Как устроен аккумулятор. Какие бывают виды аккумуляторов. Как работает аккумулятор. Где применяются аккумуляторы. Каковы преимущества и недостатки разных типов аккумуляторов.
История создания аккумуляторов
Первый аккумулятор был изобретен в 1803 году немецким физиком Иоганном Вильгельмом Риттером. Экспериментируя с вольтовым столбом, Риттер обнаружил, что его конструкция из медных кружков и влажного сукна может накапливать электрический заряд.
Важные вехи в истории аккумуляторов:
- 1859 год — Гастон Планте создает первый свинцово-кислотный аккумулятор
- 1899 год — Вальдмар Юнгнер разрабатывает никель-кадмиевый аккумулятор
- 1901 год — Томас Эдисон изобретает железо-никелевый аккумулятор
- 1970-е годы — начало массового производства свинцово-кислотных аккумуляторов
- 1990-е годы — разработка литий-ионных аккумуляторов
Принцип работы аккумулятора
Аккумулятор — это химический источник тока многоразового действия. Его работа основана на обратимых химических реакциях между электродами и электролитом.

Как работает аккумулятор?
- При разряде на электродах протекают окислительно-восстановительные реакции
- Электроны движутся от отрицательного электрода к положительному через внешнюю цепь
- При заряде реакции идут в обратном направлении под действием внешнего источника тока
- Активные вещества электродов восстанавливаются до исходного состояния
Устройство аккумулятора
Основные компоненты аккумулятора:
- Положительный электрод (катод)
- Отрицательный электрод (анод)
- Электролит
- Сепаратор
- Корпус
- Выводы
Электроды погружены в электролит и разделены пористым сепаратором. При работе аккумулятора между электродами возникает разность потенциалов — электродвижущая сила (ЭДС).
Виды аккумуляторов
Основные типы современных аккумуляторов:
Свинцово-кислотные
Преимущества:
- Низкая стоимость
- Высокая удельная мощность
- Широкий температурный диапазон
Недостатки:
- Большой вес
- Токсичность свинца
- Низкая удельная энергия
Никель-кадмиевые (NiCd)
Преимущества:
- Долгий срок службы
- Устойчивость к глубоким разрядам
- Работа при низких температурах
Недостатки:
- Токсичность кадмия
- Эффект памяти
- Саморазряд
Никель-металлгидридные (NiMH)
Преимущества:
- Высокая удельная энергия
- Экологичность
- Отсутствие эффекта памяти
Недостатки:
- Меньший срок службы, чем у NiCd
- Высокий саморазряд
- Чувствительность к перезаряду
Литий-ионные (Li-ion)
Преимущества:
- Высокая удельная энергия
- Низкий саморазряд
- Отсутствие эффекта памяти
Недостатки:
- Высокая стоимость
- Деградация при глубоких разрядах
- Пожароопасность при повреждении
Применение аккумуляторов
Аккумуляторы широко используются в различных областях:
- Автомобильный транспорт (стартерные батареи)
- Портативная электроника (смартфоны, ноутбуки)
- Электромобили и гибридные автомобили
- Возобновляемая энергетика (накопители энергии)
- Промышленность (источники бесперебойного питания)
- Медицинское оборудование
- Космическая техника
Характеристики аккумуляторов
Основные параметры аккумуляторов:
- Емкость (А·ч) — количество электричества, отдаваемое полностью заряженным аккумулятором
- Напряжение (В) — разность потенциалов между выводами аккумулятора
- Внутреннее сопротивление (Ом) — сопротивление прохождению тока внутри аккумулятора
- Саморазряд (%/мес) — потеря заряда аккумулятором без нагрузки
- Удельная энергия (Вт·ч/кг) — количество энергии на единицу массы
- Циклический ресурс — количество циклов заряд-разряд до потери емкости
Правила эксплуатации аккумуляторов
Для продления срока службы аккумуляторов следует соблюдать ряд правил:
- Не допускать глубокого разряда
- Избегать перезаряда
- Соблюдать температурный режим
- Правильно выбирать зарядное устройство
- Хранить в заряженном состоянии
- Периодически проводить обслуживание (для обслуживаемых типов)
Перспективы развития аккумуляторных технологий
Основные направления совершенствования аккумуляторов:
- Увеличение удельной энергии и мощности
- Повышение безопасности
- Снижение стоимости
- Увеличение срока службы
- Разработка новых материалов (графен, твердые электролиты)
- Создание быстрозаряжаемых аккумуляторов
Какие типы аккумуляторов могут появиться в будущем? Ученые работают над созданием литий-воздушных, натрий-ионных, алюминий-ионных и других перспективных видов аккумуляторов.
Принцип работы аккумулятора физика
Содержание
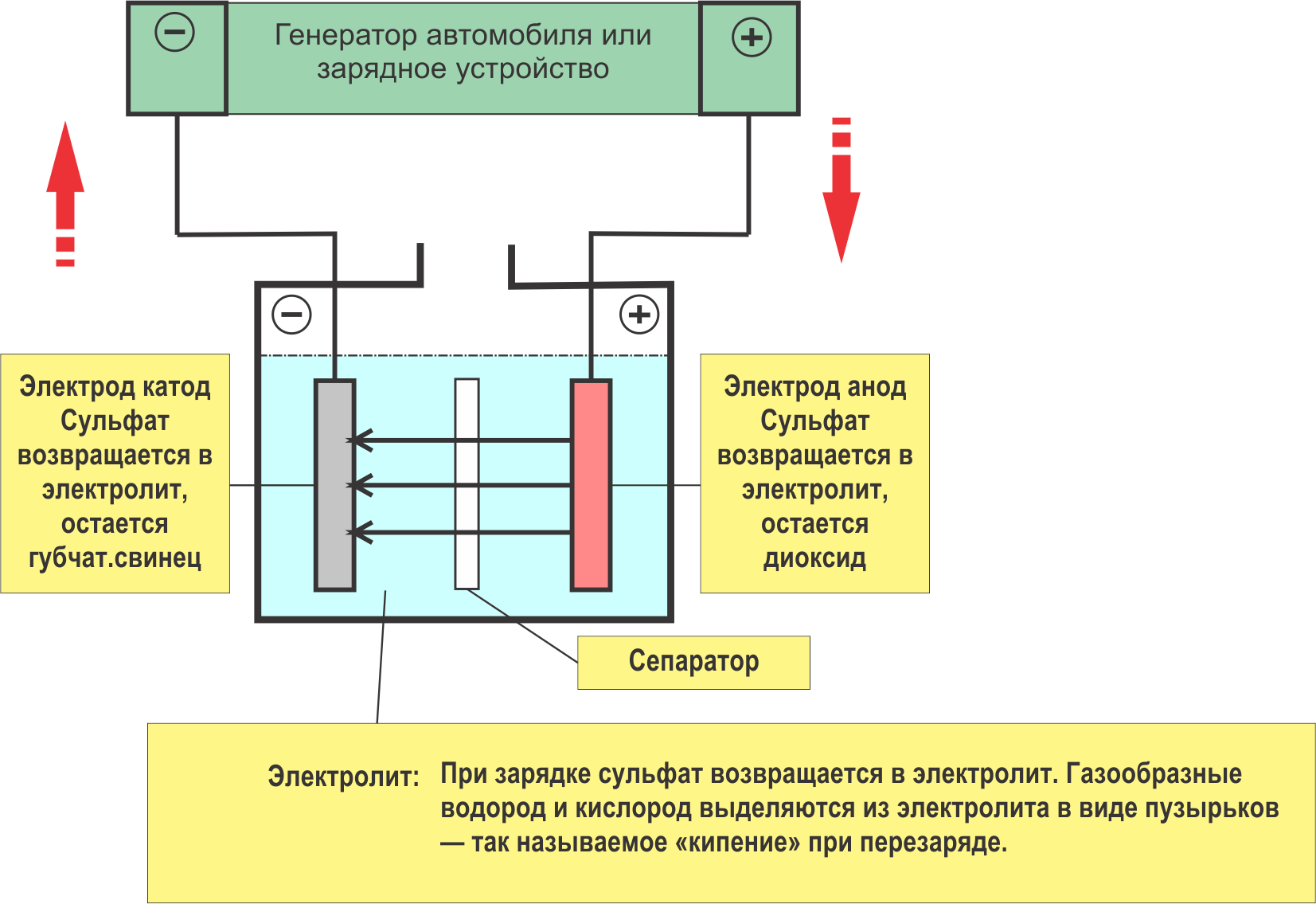
Работа аккумулятора при заряде
В широком смысле слова в технике под термином «Аккумулятор» понимается устройство, которое позволяет при одних условиях эксплуатации накапливать определенный вид энергии, а при других — расходовать ее для нужд человека.
Их применяют там, где необходимо собрать энергию за определенное время, а затем использовать ее для совершения больших трудоемких процессов. Например, гидравлические аккумуляторы, используемые в шлюзах, позволяют поднимать корабли на новый уровень русла реки.
Электрические аккумуляторы работают с электроэнергией по этому же принципу: вначале накапливают (аккумулируют) электричество от внешнего источника заряда, а затем отдают его подключенным потребителям для совершения работы. По своей природе они относятся к химическим источникам тока, способным совершать много раз периодические циклы разряда и заряда.
Во время работы постоянно происходят химические реакции между компонентами электродных пластин с заполняющим их веществом — электролитом.
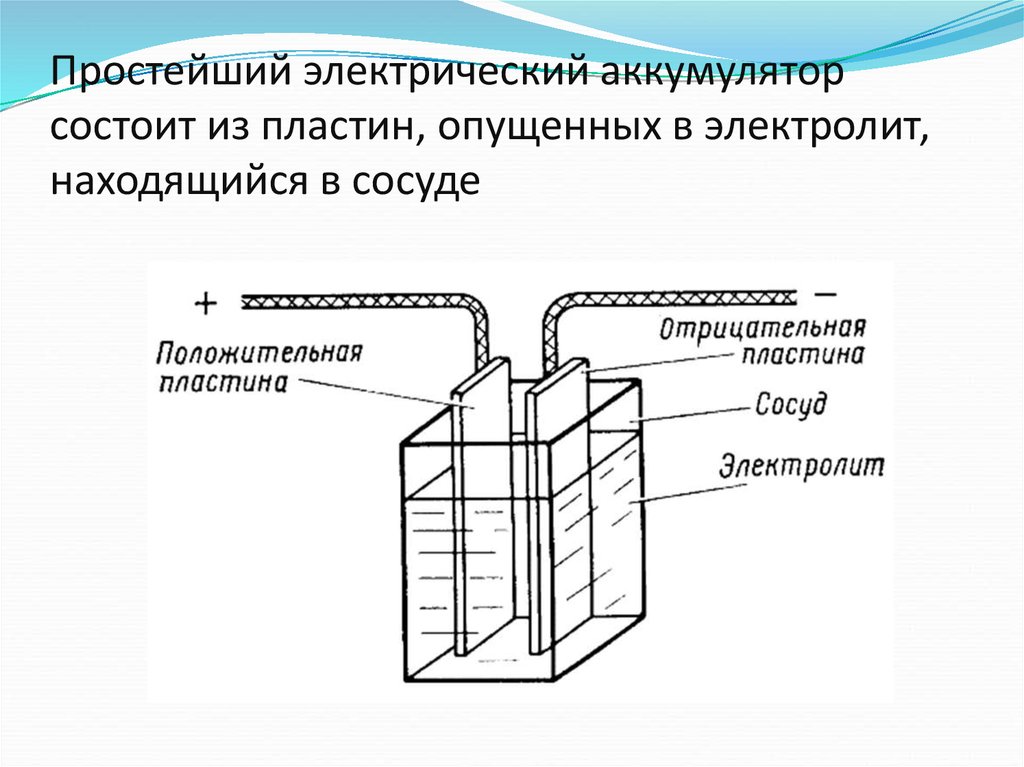
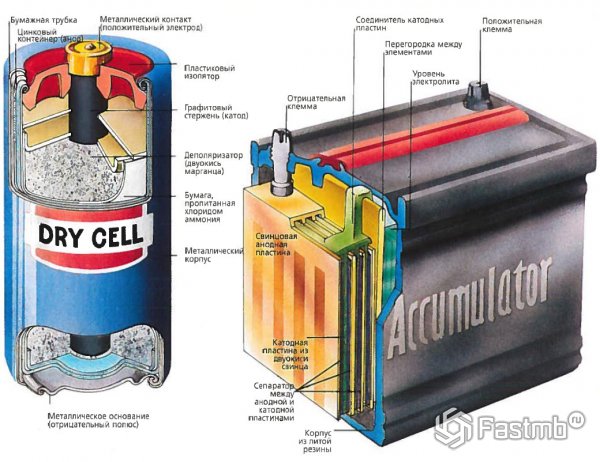
Принципиальную схему устройства аккумулятора можно представить рисунком упрощенного вида, когда в корпус сосуда вставлены две пластины из разнородных металлов с выводами для обеспечения электрических контактов. Между пластинами залит электролит.
Работа аккумулятора при разряде
Когда к электродам подключена нагрузка, например, лампочка, то создается замкнутая электрическая цепь, через которую протекает ток разряда. Он формируется движением электронов в металлических частях и анионов с катионами в электролите.
Этот процесс условно показан на схеме с никель-кадмиевой конструкцией электродов.
Здесь в качестве материала положительного электрода используют окислы никеля с добавками графита, которые повышают электрическую проводимость. Металлом отрицательного электрода работает губчатый кадмий.
Во время разряда частицы активного кислорода из окислов никеля выделяются в электролит и направляются на отрицательные пластины, где окисляют кадмий.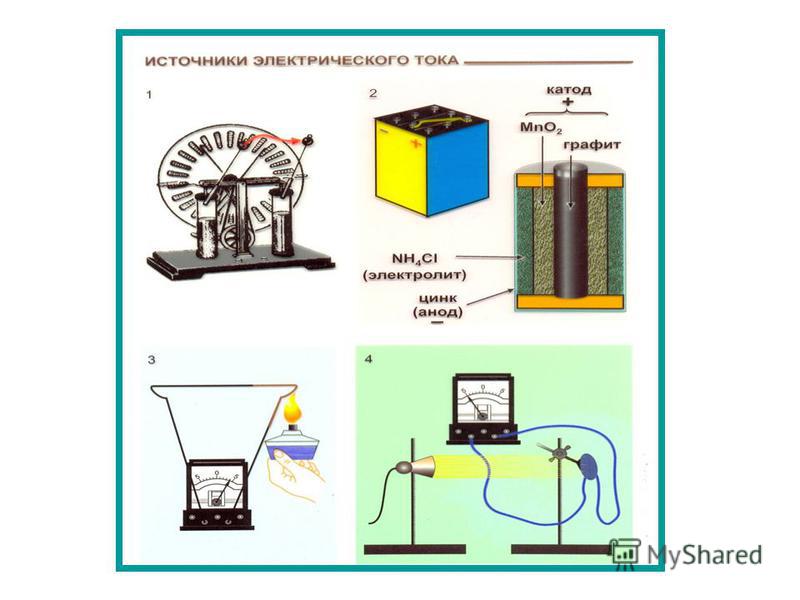
Работа аккумулятора при заряде
При отключенной нагрузке на клеммы пластин подается постоянное (в определенных ситуациях пульсирующее) напряжение большей величины, чем у заряжаемого аккумулятора с той же полярностью, когда плюсовые и минусовые клеммы источника и потребителя совпадают.
Зарядное устройство всегда обладает большей мощностью, которая «подавляет» оставшуюся в аккумуляторе энергию и создает электрический ток с направлением, противоположным разряду. В результате внутренние химические процессы между электродами и электролитом изменяются. Например, на банке с никель кадмиевыми пластинами положительный электрод обогащается кислородом, а отрицательный — восстанавливается до состояния чистого кадмия.
При разряде и заряде аккумулятора происходит изменение химического состава материала пластин (электродов), а электролита не меняется.
Способы соединения аккумуляторов
Величина тока разряда, которую может выдержать одна банка, зависит от многих факторов, но в первую очередь от конструкции, примененных материалов и их габаритов. Чем значительнее площадь пластин у электродов, тем больший ток они могут выдерживать.
Чем значительнее площадь пластин у электродов, тем больший ток они могут выдерживать.
Этот принцип используется для параллельного подключения однотипных банок у аккумуляторов при необходимости увеличения тока на нагрузку. Но для заряда такой конструкции потребуется поднимать мощность источника. Этот способ используется редко для готовых конструкций, ведь сейчас намного проще сразу приобрести необходимый аккумулятор. Но им пользуются производители кислотных АКБ, соединяя различные пластины в единые блоки.
В зависимости от применяемых материалов, между двумя электродными пластинами распространенных в быту аккумуляторов может быть выработано напряжение 1,2/1,5 или 2,0 вольта. (На самом деле этот диапазон значительно шире.) Для многих электрических приборов его явно недостаточно. Поэтому однотипные аккумуляторы подключают последовательно, причем это часто делают в едином корпусе.
Примером подобной конструкции служит широко распространенная автомобильная разработка на основе серной кислоты и свинцовых пластин-электродов.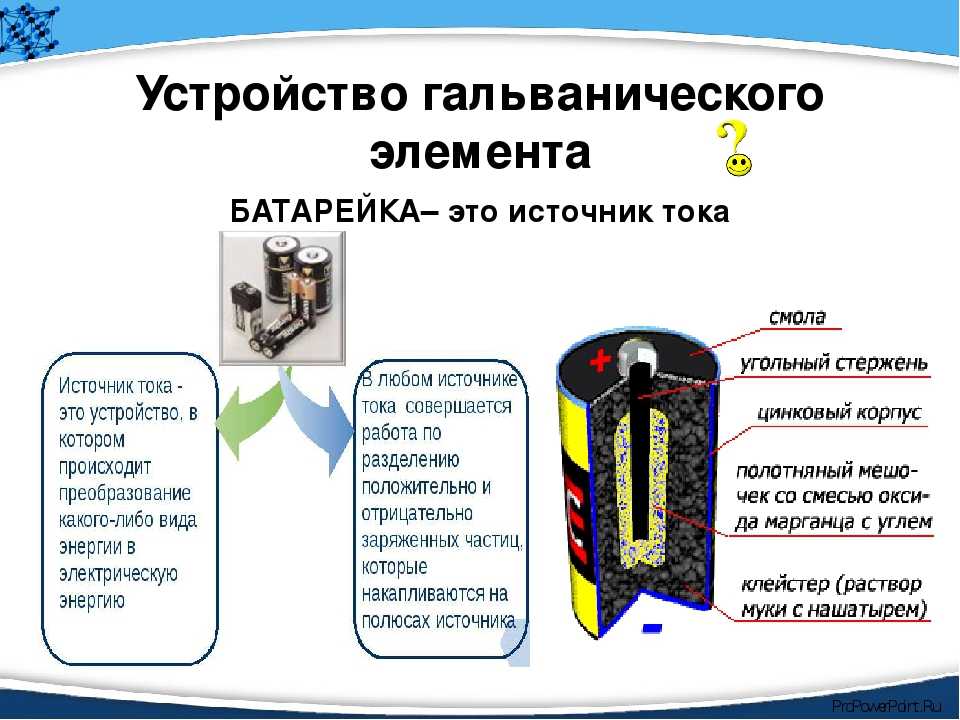
Обычно в народе, особенно среди водителей транспорта, принято называть аккумулятором любое устройство, независимо от количества его составных элементов — банок. Однако, это не совсем правильно. Собранная из нескольких последовательно подключенных банок конструкция является уже батареей, за которой закрепилось сокращенное название «АКБ» . Ее внутреннее устройство показано на рисунке.
Любая из банок состоит из двух блоков с набором пластин для положительного и отрицательного электродов. Блоки входят друг в друга без металлического контакта с возможностью надежной гальванической связи через электролит.
При этом контактные пластины имеют дополнительную решетку и отдалены между собой разделительной пластиной — сепаратором.
Соединение пластин в блоки увеличивает их рабочую площадь, снижает общее удельное сопротивление всей конструкции, позволяет повышать мощность подключаемой нагрузки.
С внешней стороны корпуса такая АКБ имеет элементы, показанные на рисунке ниже.
Из него видно, что прочный пластмассовый корпус закрыт герметично крышкой и сверху оборудован двумя клеммами (обычно конусной формы) для подключения к электрической схеме автомобиля. На их выводах выбита маркировка полярности: «+» и «-». Как правило, для блокировки ошибок при подключении диаметр положительной клеммы немного больше, чем у отрицательной.
У обслуживаемых аккумуляторных батарей сверху каждой банки размещена заливная горловина для контроля уровня электролита или доливки дистиллированной воды при эксплуатации. В нее вворачиваются пробка, которая предохраняет внутренние полости банки от попадания загрязнений и одновременно не дает выливаться электролиту при наклонах АКБ.
Поскольку при мощном заряде возможно бурное выделение газов из электролита (а этот процесс возможен при интенсивной езде), то в пробках делаются отверстия для предотвращения повышения давления внутри банки. Через них выходят кислород и водород, а также пары электролита. Подобные ситуации, связанные с чрезмерными токами заряда, желательно избегать.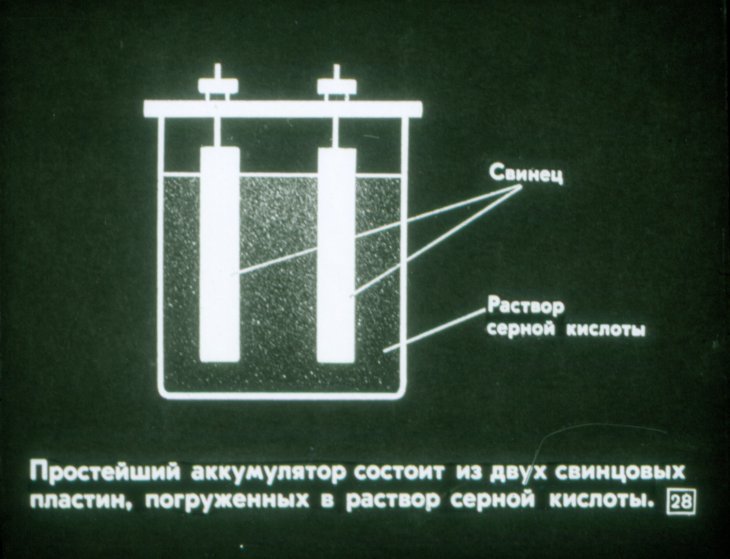
На этом же рисунке показано соединение элементов между банками и расположение пластин-электродов.
Стартерные автомобильные АКБ (свинцово-кислотные) работают по принципу двойной сульфатации. На них во время разряда/заряда происходит электрохимический процесс, сопровождающийся изменением химического состава активной массы электродов с выделением/поглощением в электролит (серную кислоту) воды.
Этим объясняется повышение удельной плотности электролита при заряде и снижение при разряде батареи. Другими словами, величина плотности позволяет оценивать электрическое состояние АКБ. Для ее замера используют специальный прибор — автомобильный ареометр.
Входящая в состав электролита кислотных батарей дистиллированная вода при отрицательной температуре переходит в твердое состояние — лед. Поэтому, чтобы автомобильные аккумуляторы не замерзали в холодное время, необходимо применять специальные меры, предусмотренные правилами эксплуатации.
Какие существуют типы аккумуляторов
Современное производство для различных целей выпускает более трех десятков разнообразных по составу электродов и электролиту изделий. Только на основе лития работает 12 известных моделей.
Только на основе лития работает 12 известных моделей.
В качестве металла электродов могут встретиться:
Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными электролит. При подключении нагрузки (электротехнических устройств) к клеммам аккумулятора в реакцию вступают электролит и активные элементы электродов. Происходит процесс перемещения электронов, который, по сути, и является электротоком.
Принцип действия аккумуляторов
Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными электролит. При подключении нагрузки (электротехнических устройств) к клеммам аккумулятора в реакцию вступают электролит и активные элементы электродов. Происходит процесс перемещения электронов, который, по сути, и является электротоком.
При разряде аккумулятора (подключении нагрузки) губчатый свинец анода выделяет положительные двухвалентные ионы свинца в электролит. Избыточные электроны перемещаются по внешней замкнутой электрической цепи к катоду, где происходит восстановление четырехвалентных ионов свинца до двухвалентных.
Избыточные электроны перемещаются по внешней замкнутой электрической цепи к катоду, где происходит восстановление четырехвалентных ионов свинца до двухвалентных.
При их соединении с отрицательными ионами серного остатка электролита, образуется сульфат свинца на обоих электродах.
Ионы кислорода от диоксида свинца катода и ионы водорода из электролита соединяются, образуя молекулы воды. Поэтому плотность электролита понижается.
При заряде происходят обратные реакции. Под воздействием внешнего напряжения ионы двухвалентного свинца положительного электрода отдают по два электрона и окисляются в четырехвалентные. Эти электроны движутся к аноду и нейтрализуют ионы двухвалентного свинца, восстанавливая губчатый свинец. На катоде, путем промежуточных реакций, снова образуется двуокись свинца.
Химические реакции в одной ячейке вырабатывают напряжение 2 В, поэтому на клеммах аккумулятора из 6 ячеек и получается 12 В.
Из видео Вы сможете более подробно узнать, как работает аккумулятор:
Аккумуляторные батареи, как и любая другая техника, имеют свое оригинальное устройство, структуру. В современных аккумуляторах используются определенные материалы, внедряются системы, основанные на физических и химических свойствах конкретных веществ и металлов. Рассмотрим принцип работы аккумуляторной батареи на примере свинцово-кислотных.
История аккумуляторов
Первый аккумулятор по официальным данным изобрел в 1798 году Алессандро Вольт – итальянский ученый, разработавший первый химический источник тока.
С 1820 ряд мировых ученых (Ампер, Фарадей, Дэниэл и другие) разрабатывал новые концепции, физические и химические законы, связанные с аккумуляторами.
1899 – Вальдмар Юнгнер разрабатывает батарею, где электродами выступали пластины из кадмия и никеля.
1901 – известный ученый Томас Эдисон изобретает бюджетную по стоимости модель железно-никелевого аккумулятора.
1947 – благодаря ученому Нойману батарея стала полностью герметичной.
1970-е – разработаны первые модели популярных свинцово-кислотных аккумуляторов.
В 1990-х начинается разработка и производство новых моделей аккумуляторов на основе металлгидрида и никеля.
Первый аккумулятор, то есть гальванический элемент многоразового использования, появился, по официальным данным, в 1803 году. Его создал немецкий физик и химик Иоганн Вильгельм Риттер. Друг Эрстеда, Риттер, не будучи ученым, изучал химическое действие света, проводил эксперименты с электролизом, ему, кстати, принадлежит открытие ультрафиолетовой части электромагнитного спектра.
Электрическим аккумулятором называют химический источник тока многоразового действия. Химические процессы внутри аккумулятора, в отличие от оных в одноразовых гальванических элементах, таких как щелочные или солевые батарейки, обратимы. Циклы заряда-разряда, накопления и отдачи электрической энергии, могут многократно повторяться.
Так, сам принцип действия аккумулятора позволяет циклически использовать его для автономного электроснабжения разнообразных устройств, портативных приборов, транспортных средств, медицинского оборудования и т. д. в совершенно различных сферах.
Произнося слово «аккумулятор», имеют ввиду или сам аккумулятор или аккумуляторную ячейку. Несколько последовательно или параллельно соединенных друг с другом аккумуляторных ячеек образуют аккумуляторную батарею, как и несколько соединенных аккумуляторов.
Первый аккумулятор, то есть гальванический элемент многоразового использования, появился, по официальным данным, в 1803 году. Его создал немецкий физик и химик Иоганн Вильгельм Риттер. Друг Эрстеда, Риттер, не будучи ученым, изучал химическое действие света, проводил эксперименты с электролизом, ему, кстати, принадлежит открытие ультрафиолетовой части электромагнитного спектра.
Однажды экспериментируя с вольтовым столбом, Риттер взял пятьдесят кружков из меди, куски влажного сукна, и составил столб из пятидесяти таких кружков и влажного сукна между ними. Пропустив через конструкцию ток от вольтова столба, Риттер обнаружил, что его столб зарядился и сам стал источником электричества. Это и был первый аккумулятор.
Пропустив через конструкцию ток от вольтова столба, Риттер обнаружил, что его столб зарядился и сам стал источником электричества. Это и был первый аккумулятор.
Обратимость химической реакции в электролите и на электродах аккумулятора позволяет восстанавливать работоспособность аккумулятора — заряжать его после разряда. Ток в процессе заряда пропускается через аккумулятор в направлении, противоположном разряду.
Так например, свинцово-кислотный аккумулятор работает благодаря электрохимическим реакциям свинца и диоксида свинца в серной кислоте. Формулы ниже отражают обратимые реакции, протекающие на аноде и на катоде: слева направо — реакция при разряде, справа налево — заряд.
Рассмотрим теперь устройство аккумулятора на примере автомобильной стартерной батареи. Ее напряжение 12 вольт. Состоит батарея из шести соединенных последовательно гальванических элементов, разделенных перегородками.
Последовательное соединение в данном случае обозначает, что отрицательный вывод одной ячейки подключен к положительному выводу следующей ячейки.
Каждый элемент включает в себя пару решетчатых электродов из свинцово-сурьмянистого сплава, погруженных в электролит, представляющий собой 38% водный раствор серной кислоты. Пористый сепаратор изолирует электроды друг от друга, предотвращая замыкания между ними, но свободно пропускает через себя электролит. То есть жидкость заполняет как ячейки свинцовых пластин, так и поры сепараторов.
Одноименные пластины соединены между собой свинцовыми перемычками, как и разделенные перегородками пакеты пластин, составляющие отдельные элементы, и выводы аккумулятора — тоже изготовлены из свинца.
Выводы автомобильного аккумулятора всегда немного отличаются в размере друг от друга — плюсовая клемма больше в диаметре чем минусовая, чтобы не ошибиться при подключении.
Корпус аккумулятора изготавливается из диэлектрического материала устойчивого к агрессивным средам, к перепадам температур и к вибрациям. Сегодня корпусы стартерных АКБ делают из полипропилена.
Корпус представляет собой герметично закрытую емкость с крышкой, оснащенную отбортовками для прочного крепления. В корпусах старых аккумуляторов всегда предусматривались пробки над каждым из гальванических элементов, составляющих батарею, чтобы можно было при необходимости доливать в них дистиллированную воду. Современные необслуживаемые аккумуляторы пробок на корпусах не имеют.
В корпусах старых аккумуляторов всегда предусматривались пробки над каждым из гальванических элементов, составляющих батарею, чтобы можно было при необходимости доливать в них дистиллированную воду. Современные необслуживаемые аккумуляторы пробок на корпусах не имеют.
Другие статьи про аккумумляторы и их использование:
1. Принцип действия
Главная > Доклад >Физика
Принцип действия и использование аккумуляторов
1. Принцип действия
2. Промышленные аккумуляторы
Итальянский ученый Луиджи Гальвани (1737–1798) открыл возможность получения электрического тока иным, чем электризация трением, способом. Однажды, когда он проводил исследование лягушек, он заметил, что при прикосновении стальным скальпелем к нерву лапка мёртвой лягушки пришла в движение. В дальнейшем Гальвани поставил несколько опытов по обнаружению причины возникновения электрического тока
Аккумулятор – прибор для накопления электрической энергии с целью её дальнейшего использования.
1. Принцип действия
Принцип действия аккумуляторов основан на явлении электролиза.
Электролиз заключается в изменение химического состава раствора при прохождении через него электрического тока, обусловленное потерей или присоединением электронов ионами. Важным свойством электролиза является его обратимость
Аналогично гальваническому элементу можно изготовить и аккумулятор. Для этого используют две свинцовые пластины, погруженные в раствор, содержащий одну часть серной кислоты и пять частей воды. Чтобы зарядить аккумулятор, его соединяют последовательно с амперметром и пропускают через цепь ток
Процесс зарядки состоит в том, что две идентичные пластины аккумулятора вследствие электролиза становятся различными; одна из них, отрицательная, по-прежнему остаётся свинцовой, а материал другой (положительной), превращается в перекись свинца
В аккумуляторе протекают следующие химические реакции (в процессе зарядки реакции идут слева направо, при разрядке – в обратном направлении):
4 + 2H 2 O PbO 2 + Pb + H 2 SO 4
2. Промышленные аккумуляторы
Промышленные аккумуляторы
Положительные пластины при производстве промышленных аккумуляторов покрывают толстым слоем перекиси свинца. Отрицательные пластины изготавливаются из пористого губчатого свинца
У обычной аккумуляторной батареи, состоящей из трех последовательно соединенных аккумуляторных элементов, напряжение составляет немногим более 6 вольт. Коэффициент полезного действия аккумуляторной батареи – примерно 75%. На аккумуляторной батарее ставят число, которое показывает количество запасенной в аккумуляторе электроэнергии, выраженной в ампер-часах
Например, 120 ампер-часов означает, что при полной разрядке аккумулятор сможет давать ток в 1 ампер в течение 120 часов, или ток в 2 ампера в течение 60 часов
Необходимо постоянно поддерживать аккумулятор в заряженном состоянии. Даже если батарея не находится в эксплуатации, ее следует регулярно подзаряжать. Необходимо содержать зажимы батареи в чистоте и предохранять от возникновения коррозии. Ни следует допускать замерзания батарей
В основном аккумуляторные батареи используются для запуска двигателей автомобилей и других машин. Возможно так же и применение в качестве временных источников электроэнергии в местах, удаленных от населенных пунктов. Необходимо помнить, что аккумуляторы следует поддерживать в заряженном состоянии, применяя для этого, к примеру, солнечную энергию
Возможно так же и применение в качестве временных источников электроэнергии в местах, удаленных от населенных пунктов. Необходимо помнить, что аккумуляторы следует поддерживать в заряженном состоянии, применяя для этого, к примеру, солнечную энергию
В будущем аккумуляторы рассчитывают применять для питания экологически чистых электромоторов
1. Кабардин О. Физика: справочные материалы. М.: Просвещение, 1991, 164 с.
2. Трофимова Т.И. Курс физики: Учебное пособие для вузов. М.: Высш. шк., 1999. 542 с.
3. Эллиот Л., Уилкокс У. Физика. М.: ГИФМЛ, 1963, 495 с.
Свинцово-кислотный аккумулятор — наиболее распространенный на сегодняшний день тип аккумуляторов, изобретен в 1859 году французским физиком Гастоном Планте. Основные области применения: стартерные батареи в автомобильном транспорте, аварийные источники электроэнергии.
Главная > Реферат >Химия
Министерство науки и образования Республики Казахстан
Актюбинский государственный университет им. К. Жубанова
К. Жубанова
По дисциплине: Физическая химия.
На тему: Аккумуляторы и принцип их работы.
Выполнил: студент Тихонов Тимур
1. Свинцово-кислотный аккумулятор
4. Физические характеристики
5. Эксплуатационные характеристики
7. Свинцово-кислотный аккумулятор при низких температурах
9. Износ свинцово-кислотных аккумуляторов
10. Электри́ческий аккумуля́тор
11. Принцип действия
12. Никель-ка́дмиевый аккумуля́тор
14. Области применения
Свинцово-кислотный аккумулятор — наиболее распространенный на сегодняшний день тип аккумуляторов, изобретен в 1859 году французским физиком Гастоном Планте. Основные области применения: стартерные батареи в автомобильном транспорте, аварийные источники электроэнергии.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в сернокислотной среде. Во время разряда происходит восстановление диоксида свинца на катоде и окисление свинца на аноде. При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода — на отрицательном.
При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода — на отрицательном.
Химическая реакция (слева-направо — разряд, справа-налево — заряд):
В новых версиях свинцовые пластины (решетки) заменяют вспененным карбоном, покрытым тонкой свинцовой пленкой, а жидкий электролит может быть желирован силикагелем до пастообразного состояния. Используя меньшее количество свинца и распределив его по большой площади, батарею удалось сделать не только компактной и легкой, но и значительно более эффективной — помимо большего КПД, она заряжается значительно быстрее традиционных аккумуляторов. [1]
Теоретическая энергоемкость: около 133 Вт·ч/кг.
Удельная энергоемкость (Вт·ч/кг): 30-60 Вт·ч/кг .
Удельная энергоплотность (Вт·ч/дм³): около 1250 Вт·ч/дм³.
ЭДС заряженного аккумулятора = 2,11 В, рабочее напряжение = 2,1 В (6 секций в итоге дают 12,7 В).
Напряжение полностью разряженного аккумулятора = 1,75 — 1,8 В (из расчета на 1 секцию). Ниже разряжать их нельзя.
Рабочая температура: от минус 40 до плюс 40
КПД: порядка 80-90%
Номинальная ёмкость , показывает количество электричества, которое может отдать данный аккумулятор. Обычно указывается в ампер-часах, и измеряется при разряде малым током (1/20 номинальной емкости, выраженной в а/ч).
Стартерный ток (для автомобильных). Характеризует способности отдавать сильные токи при низких температурах. В большинстве случаев замеряется при -18°С (0°F) в течение 30 секунд. Различные методики замера отличаются, главным образом, допускаемым конечным напряжением.
Резервная емкость (для автомобильных). Характеризует время, в течение которого аккумулятор может отдавать ток 25А. Обычно составляет порядка 100 минут.
Ареометр может быть использован для проверки удельного веса электролита каждой секции
Такие нехитрые операции вместе с проверкой автомобиля на утечку тока и периодической подзарядкой аккумулятора могут на несколько лет продлить срок эксплуатации батареи.
Свинцово-кислотный аккумулятор при низких температурах
Свинцово-кислотные аккумуляторы необходимо хранить только в заряженном состоянии. При температуре ниже −20 °C заряд аккумуляторов должен проводиться постоянным напряжением 2,275 В/секцию, 1 раз в год, в течение 48 часов. При комнатной температуре — 1 раз в 8 месяцев постоянным напряжением 2,35 В/секцию в течение 6-12 часов. Хранение аккумуляторов при температуре выше 30 °C не рекомендуется.
Слой грязи и накипи на поверхности аккумулятора создает проводник для тока от одного контакта к другому и приводит к саморазряду аккумулятора, после чего начинается преждевременная сульфатизация пластин и поэтому поверхность аккумулятора необходимо поддерживать в чистоте (то есть его надо мыть перед хранением) Хранение свинцово-кислотных аккумуляторов в разряженном состоянии приводит к быстрой потере их работоспособности.
При длительном хранении аккумуляторов и разряде их большими токами (в стартерном режиме), или при уменьшении ёмкости аккумуляторов, нужно проводить контрольно-тренировочные (лечебные) циклы, то есть разряд-заряд токами номинальной величины. [2]
[2]
Всем этим параметрам и соответствует кислотно-свинцовый аккумулятор, об устройстве которого поговорим ниже.
Обычно для автомобилей применяются кислотно-свинцовые аккумуляторы , которые имеют напряжение 12 вольт и различаются только по емкости заряда. Автомобильный аккумулятор должен обладать несколькими важными параметрами.
- Иметь малое внутренне падение напряжения
- Иметь небольшой саморазряд во время эксплуатации
- Иметь способность выдавать большие токи
- Иметь небольшие габариты и минимальное обслуживание.
Всем этим параметрам и соответствует кислотно-свинцовый аккумулятор, об устройстве которого поговорим ниже.
Элемент Даниэля-Якоби за прошедшие столетия был значительно улучшен и модернизирован. Выработка электричества стала производиться более компактными и производительными устройствами, которые к тому же теперь восстанавливают свой ресурс. Но общий принцип работы аккумулятора остался тот же и сегодня.

Общие сведения
Невозможно представить работу множества современных приборов и механизмов, без аккумулятора – компактного источника жизненной энергии для нашпигованных электроникой и автоматикой всяческих устройств.
Автомобильная стартерная аккумуляторная батарея (АКБ) – так официально называется подобное устройство в транспортных средствах. Хотя принцип работы и конструкцию аккумулятора изучают ещё в средней школе на уроках физики, но многие успевают к началу самостоятельной жизни автолюбителя изрядно забыть столь ценные знания.
Давайте немного оживим наши познания и вспомним, что за штука такая – аккумулятор, как ему удается сохранять и отдавать накопленное электричество. Основной принцип работы аккумулятора – использование эффекта возникновения разности потенциалов (напряжения) между двумя погруженными в раствор электролита металлическими пластинами. Работающий на этом эффекте элемент впервые был сделан в 1836-1838 годах. Одна из пластин в нем была медной, другая цинковой, но она быстро растворялась в электролите.
Элемент Даниэля-Якоби за прошедшие столетия был значительно улучшен и модернизирован. Выработка электричества стала производиться более компактными и производительными устройствами, которые к тому же теперь восстанавливают свой ресурс. Но общий принцип работы аккумулятора остался тот же и сегодня.
Устройство аккумуляторной батареи
Следует уточнить, что французский физик Гастон Плант в 1859 г. создал свинцово-кислотную батарею, площадь которой была всего 10 кв. м. Современный аккумулятор является копией батареи Планта, но только уменьшенной во много раз.
Все детали конструкции батареи объединены в корпусе, который можно видеть как единый элемент аккумулятора под капотом автомобиля.
Конечно, правильно было бы называть аккумулятором лишь одну, отдельно взятую ячейку. Несколько таких ячеек должны быть названы аккумуляторной батареей. Так, каждый из шести отдельных аккумуляторов («банок») в стандартной аккумуляторной батарее легкового автомобиля (12 В) вырабатывает напряжение в 2 В.
Крайне серьезные и даже жесткие требования предъявляются к корпусу батареи, который должен обладать достаточной виброустойчивостью, справляться со значительными изменениями температур, а так же выдерживать воздействие агрессивных химических реагентов. Всем этим запросам удовлетворяет современный синтетический материал – полипропилен, именно поэтому в большинстве случаев при изготовлении корпуса используется именно этот материал.
Основная глубокая емкость и закрывающая её крышка – это те части, из которых состоит корпус. Крышка может быть оснащена либо дренажной системой, которая выводит вырабатывающийся газ и стабилизирует давление внутри батареи, либо горловинами с пробками. Вид крышки зависит от типа АКБ.
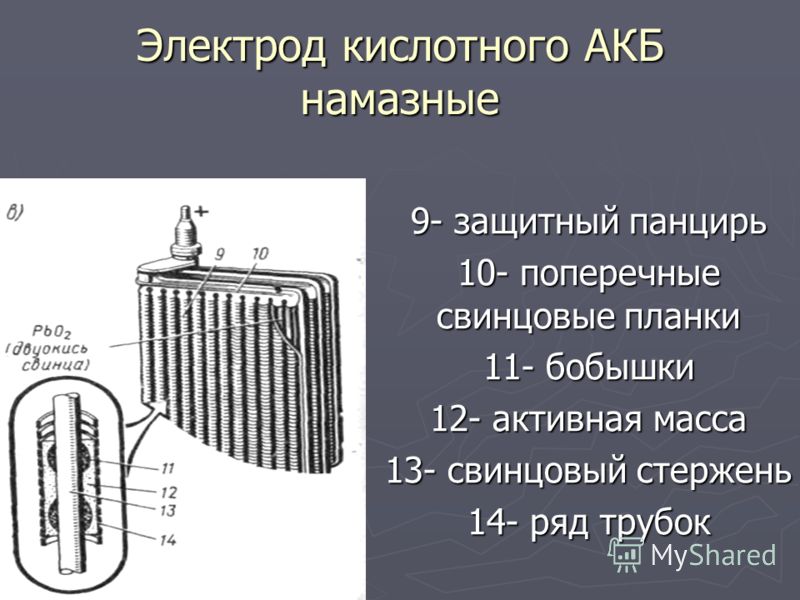
Каждая из отдельных ячеек аккумуляторной батареи оснащена одним скомбинированным пакетом, который состоит из большого количества пластин с чередованием их полярности. Пластины изготовляются из свинца. Они имеют структуру решеток, состоящих из прямоугольных сот. Именно благодаря такой конструкции можно нанести на пластины активную массу – основной рабочий реагент. Так как данную массу наносят посредством намазывания на пластины, то они так и называются – пластины намазного типа.
Именно благодаря такой конструкции можно нанести на пластины активную массу – основной рабочий реагент. Так как данную массу наносят посредством намазывания на пластины, то они так и называются – пластины намазного типа.
При изготовлении автомобильных аккумуляторов применяются только намазные пластины, хотя существуют и другие типы аккумуляторов. К примеру, в некоторых аккумуляторах устанавливаются пластины с увеличенной площадью, а также пластины из панцирной сетки.
Каждая из пластин в аккумуляторе – это электрод с противоположной полярностью. Именно поэтому может произойти короткое замыкание. Для его предотвращения между каждой парой пластин вставлен, изготовленный из пористого пластика сепаратор, который не препятствует циркуляции электролита внутри ячейки. Чтобы избежать коробления, каждая положительно заряженная пластина помещается между двумя «минусовыми» пластинами. Именно поэтому отрицательных пластин в ячейке всегда на одну больше.
Дабы предотвратить всевозможные деформации и смещения, весь собранный пакет зафиксирован специальным бандажом. При помощи токосборников, плюсовые и минусовые токовыводы пластин концентрируют свою энергию на выводных борнах аккумулятора. К данным борнам подключаются клеммы автомобиля, принимающие ток.
При помощи токосборников, плюсовые и минусовые токовыводы пластин концентрируют свою энергию на выводных борнах аккумулятора. К данным борнам подключаются клеммы автомобиля, принимающие ток.
Принцип работы
Двуокись свинца на пластине с положительным зарядом, раствор серной кислоты в воде (электролит, с плотностью 1,28 г/см3), а так же губчатый свинец на отрицательном электроде – это активные элементы, вступающие в реакцию инициирования нагрузки на клеммы аккумулятора. В результате данной реакции происходит процесс вырабатывания электротока, с последующим образованием сульфата свинца на отрицательно заряженной пластине. Так же снижается плотность электролита, так как из него выделяется вода.
К ак известно, аккумуляторы большой емкости больше и массивнее аккумуляторов малой емкости. У них больше рабочая поверхность пластин и больше пространства для диффузии электролита внутри аккумулятора. Поэтому внутреннее сопротивление аккумуляторов большой емкости меньше, чем внутреннее сопротивление аккумуляторов меньшей емкости.

П адение напряжения на свинцовом аккумуляторе не пропорционально разрядному току. При больших разрядных токах, диффузия ионов электролита происходит в свободном пространстве, а при маленьких токах разряда аккумулятора — сильно ограничивается порами активного вещества пластин аккумулятора. Поэтому внутреннее сопротивление аккумулятора при больших токах в несколько раз (для свинцового аккумулятора) меньше, чем внутреннее сопротивление того же аккумулятора при малых токах.
К ак известно, аккумуляторы большой емкости больше и массивнее аккумуляторов малой емкости. У них больше рабочая поверхность пластин и больше пространства для диффузии электролита внутри аккумулятора. Поэтому внутреннее сопротивление аккумуляторов большой емкости меньше, чем внутреннее сопротивление аккумуляторов меньшей емкости.
И змерения внутреннего сопротивления аккумуляторов на постоянном и переменном токе показывают, что внутреннее сопротивление аккумулятора сильно зависит от частоты. Ниже приводится график зависимости проводимости аккумуляторов от частоты, который взят из работы австралийских исследователей.
Ниже приводится график зависимости проводимости аккумуляторов от частоты, который взят из работы австралийских исследователей.
И з графика следует, что внутреннее сопротивление свинцового аккумулятора имеет минимум при частотах порядка сотен герц.
П ри высокой температуре скорость диффузии ионов электролита выше, чем при низкой. Эта зависимость имеет линейный характер. Она и определяет зависимость внутреннего сопротивления аккумулятора от температуры. При более высокой температуре, внутреннее сопротивление аккумулятора ниже, чем при низкой температуре.
В о время разряда аккумулятора, количество активной массы на пластинах аккумулятора уменьшается, что приводит к уменьшению активной поверхности пластин. Поэтому внутреннее сопротивление заряженного аккумулятора меньше, чем внутреннее сопротивление разряженного аккумулятора.
Отправить заявку
Аккумуляторы по новым технологиям
При всех этих конструктивных отличиях общий принцип работы и протекания электрохимических процессов внутри батарей остается прежним.
Но, к сожалению, все эти разработки крайне медленно приближаются к коммерческому уровню поскольку все они пока не вышли в массовое производство, не доказали свои практические преимущества, а пробные партии имеют несравнимо высокую цену по сравнению с традиционными, проверенными временем, выпускаемых серийно промышленных образцов аккумуляторных батарей.
- Чем больше объем двигателя, тем более емкий аккумулятор требуется;
- В дизельных моторах используются АКБ с большей емкостью, чем в бензиновых, того же объема;
- Если вы эксплуатируется автомобиль в условиях сильных морозов, нельзя покупать гелиевые АКБ.
Приобретая аккумулятор для своего автомобиля, не обязательно знать все параметры и характеристики, указываемые на батарее, а только к какой категории принадлежит ваш ДВС и какой объем двигателя у вашего автомобиля. Из особенностей которые нужно учитывать при выборе АКБ можно выделить следующее:
- Чем больше объем двигателя, тем более емкий аккумулятор требуется;
- В дизельных моторах используются АКБ с большей емкостью, чем в бензиновых, того же объема;
- Если вы эксплуатируется автомобиль в условиях сильных морозов, нельзя покупать гелиевые АКБ.

Конечно многие обращают внимание и на другие параметры, указанные на аккумуляторе, что не обязательно. Обычно на самой батарее или в ее названии указывают какого типа батарея (например стартерная), ее емкость, мощность, время заряда, масса залитой батареи, параметры согласно стандартов других стран.
Перед тем как покупать АКБ, изучите технический паспорт своего транспортного средства, либо ознакомьтесь с параметрами старой батареи – это поможет не ошибиться с выбором и правильно сделать выбор с учетом особенностей вашего автомобиля. Если самостоятельно выбрать аккумулятор не получается, можно обратиться за консультацией к специалисту, например, к продавцу в автомобильном магазине.
Источники
http://electricalschool.info/spravochnik/eltehustr/1521-kak-ustroen-i-rabotaet-akkumuljator.html
http://pue8.ru/elektricheskie-seti/805-kak-rabotaet-akkumulyator-i-iz-chego-on-sostoit.html
http://kwatt.com.ua/chto-takoe-akkumulyator-osnovnye-ponyatiya-printsip-raboty-i-nemnogo-istorii/
http://electrik. info/device/1297-ustroystvo-i-princip-raboty-akkumulyatora.html
info/device/1297-ustroystvo-i-princip-raboty-akkumulyatora.html
http://works.doklad.ru/view/1VR7KGsSkvI.html
http://works.doklad.ru/view/CDmtTwVmOa0.html
http://autoustroistvo.ru/elektrooborudovanie/akb/
http://akkumulyatorov.net/ustrojstvo-i-princip-raboty-akkumulyatora/
http://www.at-systems.ru/quest/new-quest/battery-resistance-y.shtml
http://wybor-battery.com/stati/tendencii-razvitiya-akkumulyatornyh-batarej/
http://vtorbaza.com/spravka/iz-chego-sostoit-avtomobilnyj-akkumulyator/
Применение аккумулятора — доклад сообщение по физике 8 класс
- Энциклопедия
- Физика
- Применение аккумулятора
Аккумулятор – накопитель энергии, который может впитывать энергию в себя, и при необходимости отдавать другим приборам. Правда, часть питания просто улетучиваться, но эту проблему никак не исправишь, так устроен источник. Благодаря ему энергия стала мобильной, транспортабельной.
Самый первый опыт был произведен в XIX веке, ученых звали В.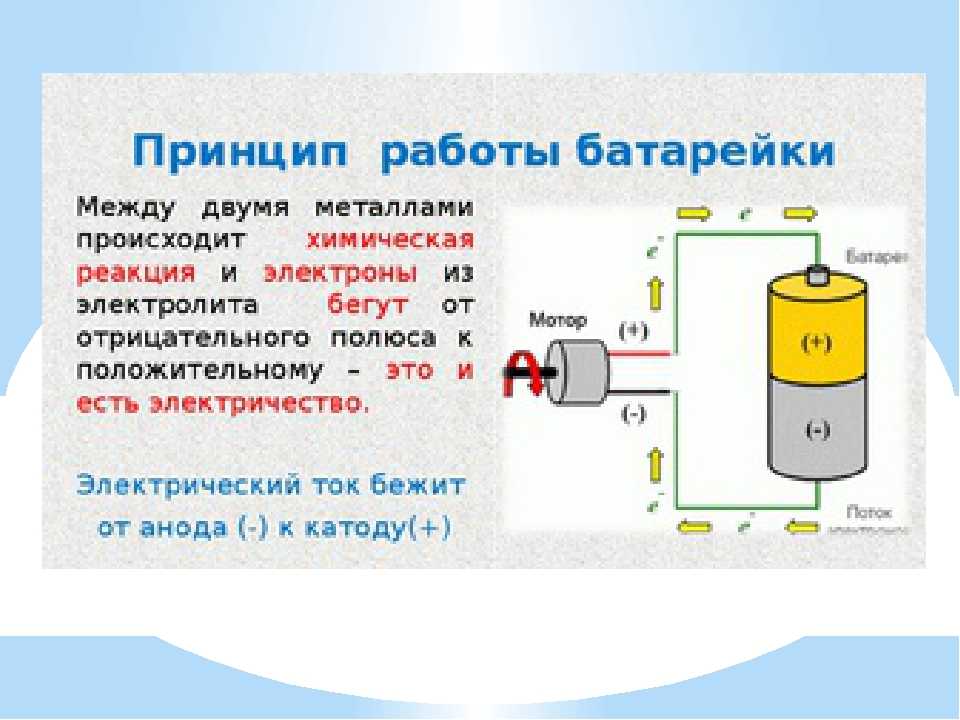 Петров и И. Риттер. Они попробовали создать накопитель и дали другим идею на то чтобы закончить их работу. В 1900 году, известный на весь мир, Эдисон изобрел самый первый аккумулятор шеллачного типа, который получил большое применение в жизни людей.
Петров и И. Риттер. Они попробовали создать накопитель и дали другим идею на то чтобы закончить их работу. В 1900 году, известный на весь мир, Эдисон изобрел самый первый аккумулятор шеллачного типа, который получил большое применение в жизни людей.
Источник энергии применяется для автомобилей и прочей электронной технике. Одни из самых популярных являются свинцовые пластины. Они повышают энергоподачу и при этом служат довольно долго, если сравнивать с другими. Также существуют аккумуляторы: пневматические, с кислотным электролитом, гидравлические. Все они широко используются людьми в машинах и различных видах техники.
В промышленности чаще всего ставят тепловые аккумуляторы. Их особенность заключается в том, что они выравнивают силовую и тепловую нагрузку на прибор. Именно с помощью их ездят современные электромашины, троллейбусы, железнодорожный транспорт.
Также они играют важную роль в старте машины, строительной техники, самолетов. У них есть необходимое питание, чтобы начать движение.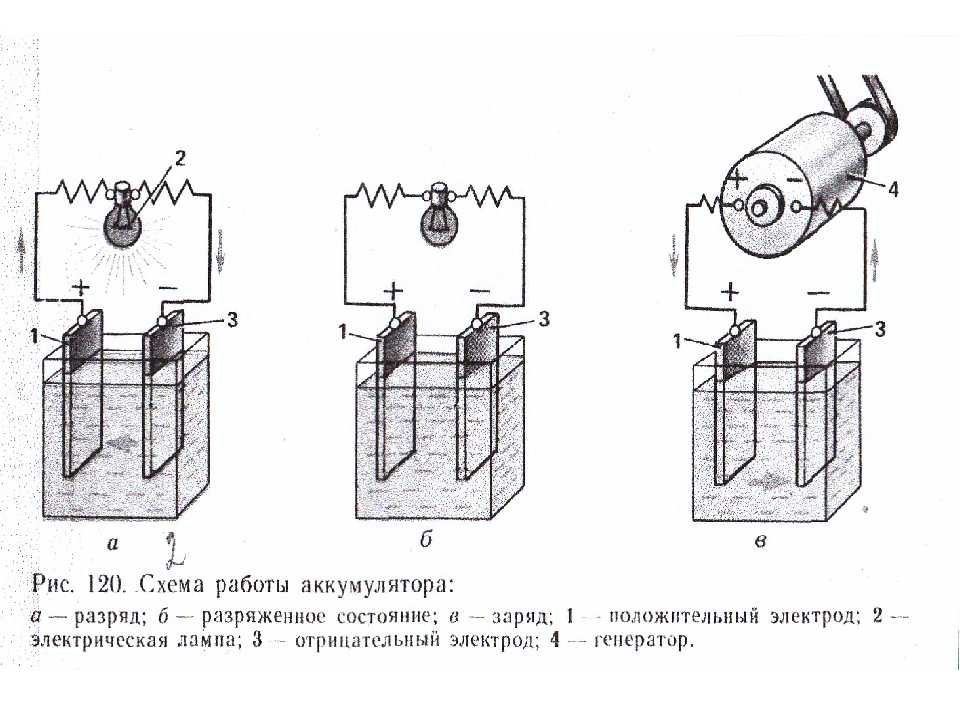 Они, можно сказать «оживляют» транспорт.
Они, можно сказать «оживляют» транспорт.
В быту накопители используются даже чаще. Почти все приборы, что нас окружают, имеют источник. Источники встроены в устройства: ноутбуки, нетбуки, смартфоны, мобильные телефоны. При этом они не занимают много места и дают достаточно энергии на несколько дней пользования.
Во всех зданиях они играют неотъемлемую роль в аварийном освещении. Если по какой-то причине выключиться свет, то аккумулятор может дать его на некоторое время. Тем самым дать работникам устранить неполадку.
Аккумуляторы играю важную роль в жизни человека. Они окружают нас повсюду: на улице, на роботе, дома. Люди настолько привыкли к ним, что уже не смогут отказаться. Ученые разрабатывают новые модели, лучше предыдущих вариантов. Они увеличивают емкость энергии, которая может поместиться внутрь, уменьшают размер, что придает больше мобильности.
Вариант 2
В настоящее время человечество использует различные приборы и машины для того, чтобы облегчить свою жизнь. Встретить подобную технику можно везде. Автомобили, стиральные машины, телевизоры и даже Интернет – все это можно отнести к данным приспособлениям, без которых жизнь уже не представляется. Аккумуляторы также являются частью нашего быта. Но из чего они состоят? И где применяются?
Встретить подобную технику можно везде. Автомобили, стиральные машины, телевизоры и даже Интернет – все это можно отнести к данным приспособлениям, без которых жизнь уже не представляется. Аккумуляторы также являются частью нашего быта. Но из чего они состоят? И где применяются?
Краткое описание и строение аккумуляторов.
Аккумулятор – это источник электрической энергии, используемый много раз. Как правило, его используют для питания электротехники. Данное создание появилось в 1803 году. Все благодаря немцу Иоганну Риттеру. Его прототип представлял собой 50 кружков, сделанных из меди и расположенных в столб. Между этими кружками находилось намоченное сукно. После каждого пропускания тока это сооружение вело себя как источник электрической энергии. Современные аккумуляторы работают на основе химии. Суть в том, что направление тока при заряде противоположно пути при разряде. Работу явления можно показать на формулах двух реакций:
1) Pb + SO42- — 2e— = PbSO4 – анод случайного прибора.
2) PbO2 + SO42- + 4H+ +2e— = PbSO4 + 2H2O – катод случайного прибора.
У аккумуляторов разные характеристики. Например, разные способы заряда. К сведению, их 4 вида: медленный и постоянный, быстрый, ускоренный и реверсивный. Еще стоит учитывать емкость самих аккумуляторов, плотность электроэнергии, температуру и, собственно, типы аккумуляторов. Их очень много, точно не сосчитать. Известны около 35 типов аккумуляторов, и все они различные.
Применение аккумуляторов и самые известные типы.
Как правило, людьми используются вот эти типы: свинцово – кислотные, никель – кадмиевые, никель – металл – гидридные, литий – ионные, литий – полимерные и никель – цинковые. Использование такое же распространение, как и сами аккумуляторы. Самое широкое применение аккумуляторов – это транспорты. Но это не все. Еще аккумуляторы используют как аварийный источник энергии и замену гальванического элемента. Естественно, нельзя было не упомянуть мобильные телефоны, причем, используют аккумуляторы и в смартфонах, и в старых кнопочных телефонах. Также аккумуляторы используют для работы некоторых строительных инструментов, работающие на электричестве. Последнее, где используют аккумуляторы – это медицина.
Также аккумуляторы используют для работы некоторых строительных инструментов, работающие на электричестве. Последнее, где используют аккумуляторы – это медицина.
← Магнитное поле Земли↑ ФизикаИстория изобретения паровых машин →
Применение аккумулятора
Несколько интересных сочинений
Презентация по физике Применение аккумуляторов доклад, проект
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация на тему Презентация по физике Применение аккумуляторов, предмет презентации: Физика. Этот материал в формате pptx (PowerPoint) содержит 12 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
Этот материал в формате pptx (PowerPoint) содержит 12 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
ПРИМЕНЕНИЕ АККУМУЛЯТОРОВ
Подготовил: обучающийся 8 класса МКОУ «Солдатская СОШ»
Потапенко Владислав
Электрический аккумулятор — химический источник тока, источник ЭДС многоразового действия, основная специфика которого заключается в обратимости внутренних химических процессов, что обеспечивает его многократное циклическое использование (через заряд-разряд) для накопления энергии и автономного электропитания различных электротехнических устройств и оборудования, а также для обеспечения резервных источников энергии в медицине, производстве, транспорте и в других сферах.
Первый прообраз аккумулятора был создан в 1803 году Иоганном Вильгельмом Риттером. Его аккумуляторная батарея представляла собой столб из пятидесяти медных кружочков, между которыми было проложено влажное сукно. После пропускания через данное устройство тока от вольтова столба, оно само стало вести себя как источник электричества
Принцип действия аккумулятора
основан на обратимости
химической реакции.
Работоспособность аккумулятора
может быть восстановлена
путём заряда, то есть
пропусканием электрического
тока в направлении, обратном
направлению тока при разряде.
Несколько аккумуляторов,
объединённых в одну электрическую
цепь, составляют
аккумуляторную батарею.
Аккумуляторная батарея является альтернативным источником энергии, рассчитанная на поддержание постоянного тока в сети в течении определенного времени, поэтому емкость аккумулятора измеряется в А. часах. Сегодня, сложно найти область, где не применяется аккумулятор. В повседневной жизни, аккумулятор встречается в сотовых телефонах, под капотом машины, но аккумуляторы используют гораздо шире. В электронике — это источники энергии для блоков бесперебойного питания, в системах охраны — аккумулятор используется как альтернатива сети.
часах. Сегодня, сложно найти область, где не применяется аккумулятор. В повседневной жизни, аккумулятор встречается в сотовых телефонах, под капотом машины, но аккумуляторы используют гораздо шире. В электронике — это источники энергии для блоков бесперебойного питания, в системах охраны — аккумулятор используется как альтернатива сети.
Внешний аккумулятор
Внешний аккумулятор (аккумуляторная батарея) — устройство для многократной подзарядки мобильного устройства (телефона, смартфона, планшетного компьютера) при отсутствии источника переменного тока (электросети).
Современные внешние аккумуляторы в большинстве случаев оснащаются универсальным разъемом — USB. Он позволяет подключать не только телефоны, смартфоны, планшеты и навигаторы. Спектр подключаемых устройств значительно шире. В том числе и благодаря изобретательным китайцам, придумавшим тысячи устройств, питающихся от USB.
Автомобильный аккумулятор
Автомобильный аккумулятор (точнее — автомобильная аккумуляторная батарея [сокр. автомобильная АКБ] ) — тип электрического аккумулятора, применяемый на автомобильном или мототранспорте. Используется в качестве вспомогательного источника электроэнергии в бортовой сети при неработающем двигателе и для запуска двигателя. На электротранспорте является не вспомогательным источником энергии, а основным.
Батарейки
Батарея (фр. batterie) — группа соединённых параллельно или последовательно электрических двухполюсников. Обычно под этим термином подразумевается соединение электрохимических источников электроэнергии/электрического тока (гальванических элементов, аккумуляторных элементов, топливных элементов).
Батареи применяют: в пультах ДУ, настенных и наручных часах, фототехнике, радио, детских музыкальных и светящихся игрушках, электробритвах, аудиоплейерах, фонариках, электронных записных книжках, слуховых аппаратах, тонометрах и т.п.
Кроме того, аккумулятор широко используют на транспорте, железнодорожные вагоны, троллейбусы, машины — гибриды, электрокары, троллейбусы и даже огромные «Белазы» — используют специальные аккумуляторы для движения. И это не привычные аккумуляторные батареи, которые стоят в наших автомобилях и требуют дополнительного сервиса по зарядке и контроль уровня электролита и его плотности. Аккумуляторы использующиеся на транспорте — это тяговые аккумуляторные батареи, разработанные специально для работы силовых агрегатов и двигателей.
Скачать презентацию
Это сайт презентаций, где можно хранить и обмениваться своими презентациями, докладами, проектами, шаблонами в формате PowerPoint с другими пользователями. Мы помогаем школьникам, студентам, учителям, преподавателям хранить и обмениваться учебными материалами.
Мы помогаем школьникам, студентам, учителям, преподавателям хранить и обмениваться учебными материалами.
Для правообладателей
Обратная связь
Email: Нажмите что бы посмотреть
батарей
батарей|
Аккумуляторы используют химическую реакцию для выполнения работы при зарядке и создания напряжения между их выходными клеммами. Основной элемент называется электрохимической ячейкой и использует реакцию окисления/восстановления. Электрохимический элемент, производящий внешний ток, называется гальваническим элементом. Напряжения, генерируемые такими ячейками, исторически назывались ЭДС (электродвижущая сила).
|
Индекс Цепи постоянного тока Как работают батареи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 Окисление на цинковом электроде (аноде) является прямым и аналогичным окислению в других элементах, таких как элемент Даниэля. В других реакциях участвуют MnO 2 , который содержится рядом с углеродным центральным стержнем, и NH 4 Cl и ZnCl 2 , которые составляют основную часть пасты между катодом и анодом.
Окисление на цинковом электроде (аноде) является прямым и аналогичным окислению в других элементах, таких как элемент Даниэля. В других реакциях участвуют MnO 2 , который содержится рядом с углеродным центральным стержнем, и NH 4 Cl и ZnCl 2 , которые составляют основную часть пасты между катодом и анодом.  ) + 2e — -> 2NH 3 (г) + H 2 (г)
) + 2e — -> 2NH 3 (г) + H 2 (г)  Хотя эти батареи имеют долгую историю полезности, их применение сокращается, поскольку некоторые из их проблем решаются в щелочных батареях.
Хотя эти батареи имеют долгую историю полезности, их применение сокращается, поскольку некоторые из их проблем решаются в щелочных батареях.  ) -> Zn(OH) 2 (s) + 2e —
) -> Zn(OH) 2 (s) + 2e —  B
B  4 Извлечение и извлечение батареи
4 Извлечение и извлечение батареи

 Если внешняя цепь закорочена, реакция
переходит к завершению, очень быстро.
Если внешняя цепь закорочена, реакция
переходит к завершению, очень быстро. 
 Немного
электроны переходят в состояния с более низкой кинетической энергией, представленные
наковальня. Это способствует ускорению реакции.
Тем временем другие электроны переходят в состояния с более высокой потенциальной энергией,
как показано синим пятном на левой стороне качелей
шататься
Немного
электроны переходят в состояния с более низкой кинетической энергией, представленные
наковальня. Это способствует ускорению реакции.
Тем временем другие электроны переходят в состояния с более высокой потенциальной энергией,
как показано синим пятном на левой стороне качелей
шататься  (Если бы все было полностью линейно,
система будет демонстрировать безудержное поведение «победитель получает все». То есть,
если бы наковальня начала опускаться, она ушла бы навсегда.)
(Если бы все было полностью линейно,
система будет демонстрировать безудержное поведение «победитель получает все». То есть,
если бы наковальня начала опускаться, она ушла бы навсегда.)

 4. Поскольку ток снаружи
аккумулятор, в идеале внутри аккумулятора ток не течет
либо. В частности, сохранение заряда (также известное как непрерывность
текущий) говорит нам, что должен быть ноль нетто ток. (Как мы будем
см., нулевой чистый ток — это не то же самое, что нулевой ток.)
4. Поскольку ток снаружи
аккумулятор, в идеале внутри аккумулятора ток не течет
либо. В частности, сохранение заряда (также известное как непрерывность
текущий) говорит нам, что должен быть ноль нетто ток. (Как мы будем
см., нулевой чистый ток — это не то же самое, что нулевой ток.)  (Обстановка у границ бардак, что
мы не собираемся беспокоиться о прямо сейчас.)
(Обстановка у границ бардак, что
мы не собираемся беспокоиться о прямо сейчас.)  Ток :: Идеальная батарея в состоянии покоя
Ток :: Идеальная батарея в состоянии покоя


 Например,
основываясь на макроскопических наблюдениях плюс закон сохранения заряда, мы знаем
что ионы должны (в среднем!) течь в направлении, изображенном на
рисунок 6. Это несколько полезно, даже
хотя это мало что говорит нам о микроскопических механизмах.
Например,
основываясь на макроскопических наблюдениях плюс закон сохранения заряда, мы знаем
что ионы должны (в среднем!) течь в направлении, изображенном на
рисунок 6. Это несколько полезно, даже
хотя это мало что говорит нам о микроскопических механизмах.  6, но некоторые из них отсутствуют.
Некоторые из них движутся вверх, против электрического поля. Это не
нарушают закон сохранения заряда, потому что для каждого иона, который перемещает
неправильном направлении, большее число ионов движется в правильном направлении. Таким образом, цифра 6 верна «в среднем», но не
обязательно поправьте в деталях.
6, но некоторые из них отсутствуют.
Некоторые из них движутся вверх, против электрического поля. Это не
нарушают закон сохранения заряда, потому что для каждого иона, который перемещает
неправильном направлении, большее число ионов движется в правильном направлении. Таким образом, цифра 6 верна «в среднем», но не
обязательно поправьте в деталях.  Это необходимо
по научным стандартам нового поколения. Единственная проблема, это
не правда. Молекулы духов явно не оседают в
низкоэнергетическое состояние. Даже не близко. Как и молекулы воздуха,
в этом отношении. Не верьте всему, что вы читали в начальной школе
научные книги. В действительности распределение молекул регулируется
больше по энтропии, чем по энергии. Иногда минимальная энергия служит
прокси для максимальной энтропии… но иногда это не так.
Это необходимо
по научным стандартам нового поколения. Единственная проблема, это
не правда. Молекулы духов явно не оседают в
низкоэнергетическое состояние. Даже не близко. Как и молекулы воздуха,
в этом отношении. Не верьте всему, что вы читали в начальной школе
научные книги. В действительности распределение молекул регулируется
больше по энтропии, чем по энергии. Иногда минимальная энергия служит
прокси для максимальной энтропии… но иногда это не так.  д.
так далее. Пожалуйста, убедитесь, что вы знакомы с идеями в
ссылку 2, прежде чем продолжить работу с этим документом.
д.
так далее. Пожалуйста, убедитесь, что вы знакомы с идеями в
ссылку 2, прежде чем продолжить работу с этим документом.  Этот процесс
будет продолжаться до тех пор, пока электрохимическое поле внутри
зазора становится константой, не зависящей от позиции, которая
является условием равновесия. может быть какая-то электрика
потенциальный градиент; Я не думаю, что есть много, но есть
может быть некоторые. И может быть некоторый градиент концентрации;
опять же, я не думаю, что их много, но они могут быть. В
в любом случае, если учесть градиент концентрации и
электрического градиента вместе, в равновесии нет
чистое движение ионов. В простейшем случае нет электричества.
поля (следовательно, нет дрейфа) и градиента концентрации (следовательно, нет суммарного
диффузия). В более общем случае дрейф из-за
градиент электрического потенциала уравновешивается диффузией по
градиент концентрации. Два градиента направлены в противоположные стороны.
направлении, и когда мы добавляем два эффекта (электрический и
концентрации) мы находим, что электрохимический потенциал
имеет нулевой градиент.
Этот процесс
будет продолжаться до тех пор, пока электрохимическое поле внутри
зазора становится константой, не зависящей от позиции, которая
является условием равновесия. может быть какая-то электрика
потенциальный градиент; Я не думаю, что есть много, но есть
может быть некоторые. И может быть некоторый градиент концентрации;
опять же, я не думаю, что их много, но они могут быть. В
в любом случае, если учесть градиент концентрации и
электрического градиента вместе, в равновесии нет
чистое движение ионов. В простейшем случае нет электричества.
поля (следовательно, нет дрейфа) и градиента концентрации (следовательно, нет суммарного
диффузия). В более общем случае дрейф из-за
градиент электрического потенциала уравновешивается диффузией по
градиент концентрации. Два градиента направлены в противоположные стороны.
направлении, и когда мы добавляем два эффекта (электрический и
концентрации) мы находим, что электрохимический потенциал
имеет нулевой градиент.  На концах каждого зазора, как правило,
накопление ионов. Это создает сложный дипольный слой (он же
двухслойный) есть. Прочность дипольного слоя зависит от
свойства электролита, а также свойства
соседний металл, как обсуждалось в разделе 2.4. Сила
дипольный слой определяет, как потенциал внутри
зазор связан с потенциалом внутри соседнего металла.
Подробнее о важности дипольных слоев см. в ссылке 3.
На концах каждого зазора, как правило,
накопление ионов. Это создает сложный дипольный слой (он же
двухслойный) есть. Прочность дипольного слоя зависит от
свойства электролита, а также свойства
соседний металл, как обсуждалось в разделе 2.4. Сила
дипольный слой определяет, как потенциал внутри
зазор связан с потенциалом внутри соседнего металла.
Подробнее о важности дипольных слоев см. в ссылке 3.
 Терминал. Естественно, клемма Ni соответствующим образом помечена знаком «+».
Терминал.
Терминал. Естественно, клемма Ni соответствующим образом помечена знаком «+».
Терминал.  3 Батарея под нагрузкой
3 Батарея под нагрузкой 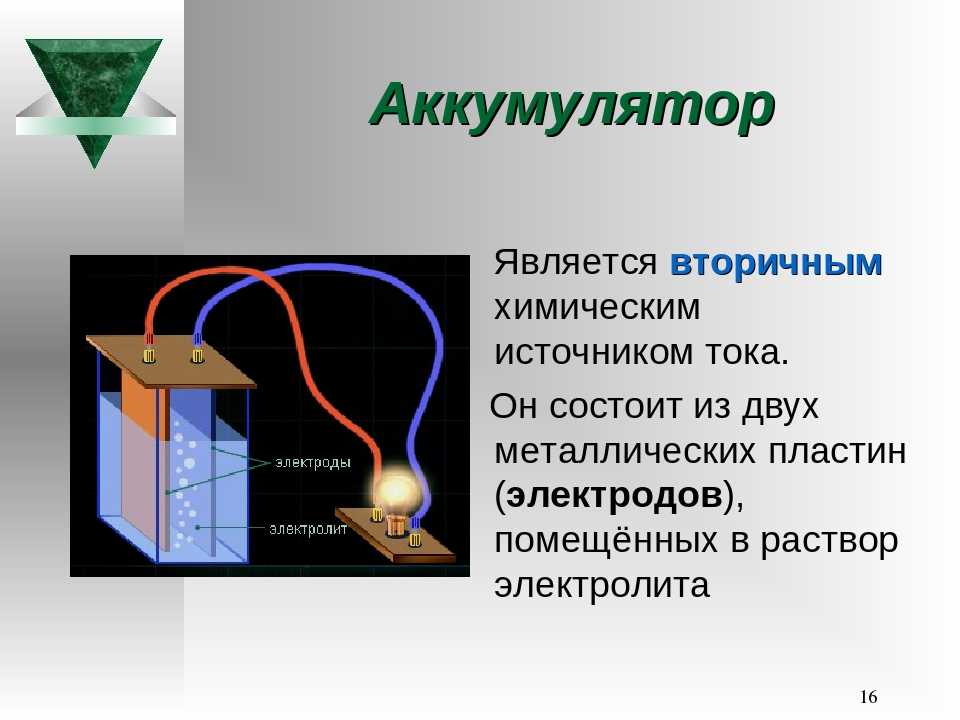

 Напряжение остается прежним
(более или менее), пока не закончатся химикаты. (Вот как единица
заряда изначально был определен: количество химического осаждения
в такой камере.)
Напряжение остается прежним
(более или менее), пока не закончатся химикаты. (Вот как единица
заряда изначально был определен: количество химического осаждения
в такой камере.)  Дрифт получит
избавиться от поля в большей части разрыва, но будет колоссальный
поле прямо возле электрода, где собираются все ионы.
( среднее поле в зазоре не будет затронуто дрейфом;
это будет просто напряжение «конденсатора», деленное на расстояние зазора.)
Дрифт получит
избавиться от поля в большей части разрыва, но будет колоссальный
поле прямо возле электрода, где собираются все ионы.
( среднее поле в зазоре не будет затронуто дрейфом;
это будет просто напряжение «конденсатора», деленное на расстояние зазора.)  Чистая энергия
на электрон освобождается в результате этой реакции, называется полуэлементом
потенциал, потенциал, φ ¢
. Обычно такие потенциалы
измеряется в вольтах. Если у вас возникнет соблазн сократить единицы измерения, будьте осторожны.
что V для вольта противоречит V для ванадия. Это может быть проблемой
при вводе уравнений реакции в компьютер, что может быть неоправданно
буквальное отношение к таким вещам.
Чистая энергия
на электрон освобождается в результате этой реакции, называется полуэлементом
потенциал, потенциал, φ ¢
. Обычно такие потенциалы
измеряется в вольтах. Если у вас возникнет соблазн сократить единицы измерения, будьте осторожны.
что V для вольта противоречит V для ванадия. Это может быть проблемой
при вводе уравнений реакции в компьютер, что может быть неоправданно
буквальное отношение к таким вещам.  Вы знаете, что обратная реакция невероятно жестока, так что
вы знаете реакцию, как написано – реакция восстановления – это
энергетически невыгодно. Эта реакция имеет отрицательное восстановление
потенциал. Это должно быть достаточным напоминанием о том, как интерпретировать
знак восстановительного потенциала.
Вы знаете, что обратная реакция невероятно жестока, так что
вы знаете реакцию, как написано – реакция восстановления – это
энергетически невыгодно. Эта реакция имеет отрицательное восстановление
потенциал. Это должно быть достаточным напоминанием о том, как интерпретировать
знак восстановительного потенциала.

 Он значительно менее информативен, чем два
уравнения полуклеточных реакций отдельно. Хотя мы показываем
величину потенциала в уравнении 3b, мы не можем
определите знак или величину этой величины, глядя на
химия только в уравнении 3a.
Он значительно менее информативен, чем два
уравнения полуклеточных реакций отдельно. Хотя мы показываем
величину потенциала в уравнении 3b, мы не можем
определите знак или величину этой величины, глядя на
химия только в уравнении 3a.  Заряд электрона равен 1,60218×10 −19 кулона.
Таким образом, заряд одного моля электронов равен 96485,3 кол.
Таким образом, вольт равен 96,4853 кДж на моль.
Заряд электрона равен 1,60218×10 −19 кулона.
Таким образом, заряд одного моля электронов равен 96485,3 кол.
Таким образом, вольт равен 96,4853 кДж на моль.  Остерегаться.
Остерегаться.  Вам просто нужно добавить 93-й закон сохранения, а именно сохранение
обвинение. Затем, чтобы написать сбалансированное электрохимическое уравнение, вы просто
необходимо сбалансировать его по отношению к атомам и по отношению к
обвинение.
Вам просто нужно добавить 93-й закон сохранения, а именно сохранение
обвинение. Затем, чтобы написать сбалансированное электрохимическое уравнение, вы просто
необходимо сбалансировать его по отношению к атомам и по отношению к
обвинение. 
 Это потому, что, в конечном счете, энергия батареи — это энергия
химические реакции.
Это потому, что, в конечном счете, энергия батареи — это энергия
химические реакции.  в этих регионах и высокие градиенты концентрации химических веществ.
Анализировать детали того, что происходит в этих регионах, непросто.
в этих регионах и высокие градиенты концентрации химических веществ.
Анализировать детали того, что происходит в этих регионах, непросто.  Соответствующие электроны
в металле действительно обладают этим свойством: они должны иметь огромное
кинетической энергии, иначе они не могли бы существовать внутри металла. Этот
энергия не зависит от того, как туда попали электроны, поэтому она не
неправильно называть это потенциалом. Он действует как потенциал. Фактически,
люди называли это потенциалом более ста лет,
задолго до того, как кто-либо смог объяснить это микроскопически, с точки зрения
кинетическая энергия и принцип запрета.
Соответствующие электроны
в металле действительно обладают этим свойством: они должны иметь огромное
кинетической энергии, иначе они не могли бы существовать внутри металла. Этот
энергия не зависит от того, как туда попали электроны, поэтому она не
неправильно называть это потенциалом. Он действует как потенциал. Фактически,
люди называли это потенциалом более ста лет,
задолго до того, как кто-либо смог объяснить это микроскопически, с точки зрения
кинетическая энергия и принцип запрета.  Мы могли бы сказать, что имеется заряд Q «на» паре
тарелки.
Мы могли бы сказать, что имеется заряд Q «на» паре
тарелки.

 Закон идеального газа PV = NRT
часто приводится в качестве примера. Но есть и другие вещи, которые кажутся
так же элементарно, но не может быть объяснено с точки зрения 19-го века
физика. Примером может служить «парадокс» Гиббса. Имеет смысл, если вы
знать, как квантовая механика имеет дело с идентичными частицами, и это
сильно парадоксально иначе.
Закон идеального газа PV = NRT
часто приводится в качестве примера. Но есть и другие вещи, которые кажутся
так же элементарно, но не может быть объяснено с точки зрения 19-го века
физика. Примером может служить «парадокс» Гиббса. Имеет смысл, если вы
знать, как квантовая механика имеет дело с идентичными частицами, и это
сильно парадоксально иначе.  Вам нужно больше квантовой механики, если вы хотите получить различные химические
элементы не ведут себя все равно. Без принципа исключения,
гелий будет вести себя точно так же, как тяжелый изотоп водорода. А также
литий будет таким же, только еще тяжелее. И кислород был бы
то же самое, только еще тяжелее.
Вам нужно больше квантовой механики, если вы хотите получить различные химические
элементы не ведут себя все равно. Без принципа исключения,
гелий будет вести себя точно так же, как тяжелый изотоп водорода. А также
литий будет таким же, только еще тяжелее. И кислород был бы
то же самое, только еще тяжелее. 

 Одним из недостатков аккумуляторов является то, что их напряжение уменьшается, когда они держат меньше заряда. Полностью заряженный литий-ионный элемент имеет напряжение 4,2 В, тогда как в почти пустом состоянии он может составлять 2,5 В. Поэтому его обычно оценивают в 3,6 В как среднее напряжение между полным и пустым аккумулятором. Обратите внимание, что конечное напряжение заряда значительно выше при расчете напряжения системы и выборе компонентов. Например, аккумуляторная батарея с номинальным напряжением 360 В может достигать 420 В в конце заряда.
Одним из недостатков аккумуляторов является то, что их напряжение уменьшается, когда они держат меньше заряда. Полностью заряженный литий-ионный элемент имеет напряжение 4,2 В, тогда как в почти пустом состоянии он может составлять 2,5 В. Поэтому его обычно оценивают в 3,6 В как среднее напряжение между полным и пустым аккумулятором. Обратите внимание, что конечное напряжение заряда значительно выше при расчете напряжения системы и выборе компонентов. Например, аккумуляторная батарея с номинальным напряжением 360 В может достигать 420 В в конце заряда.  Проверьте раздел «безопасность». Существует большое разнообразие размеров аккумуляторных ячеек. Ячейки ноутбука 18650 могут выдавать пару ампер, в то время как большие призматические ячейки могут выдавать сотни ампер. Если вы поместите батареи параллельно, вы можете увеличить силу тока (А) в вашем аккумуляторе.
Проверьте раздел «безопасность». Существует большое разнообразие размеров аккумуляторных ячеек. Ячейки ноутбука 18650 могут выдавать пару ампер, в то время как большие призматические ячейки могут выдавать сотни ампер. Если вы поместите батареи параллельно, вы можете увеличить силу тока (А) в вашем аккумуляторе.  Батареи уже использовались в конце 1800-х годов для электромобилей. Например, у Томаса Эдисона был такой. В начале 1938%(!) автомобилей в США были электрическими! Эдисон: «Электричество — это вещь. Здесь нет жужжащих и скрежещущих шестерен с их многочисленными рычагами, которые можно сбить с толку, нет опасного и зловонного бензина и нет шума».
Батареи уже использовались в конце 1800-х годов для электромобилей. Например, у Томаса Эдисона был такой. В начале 1938%(!) автомобилей в США были электрическими! Эдисон: «Электричество — это вещь. Здесь нет жужжащих и скрежещущих шестерен с их многочисленными рычагами, которые можно сбить с толку, нет опасного и зловонного бензина и нет шума».  Итак, в приведенном примере батарея может отдавать 0,5А в течение 5 часов. Если вы используете более высокий ток, выделение тепла в батарее будет составлять некоторые потери, и номинальная емкость не будет достигнута. Чем меньше этот дефицит, тем больше подходит батарея для приложений с высоким потреблением энергии. Иногда поставщики аккумуляторов сообщают вам только емкость аккумулятора. Если вы знаете напряжение, вы можете вычислить количество энергии, которое имеет батарея. Если напряжение неизвестно, например, в сборках аккумуляторных батарей, вам неизвестна основная переменная, по которой вы можете судить о количестве энергии, удерживаемой аккумуляторной батареей.
Итак, в приведенном примере батарея может отдавать 0,5А в течение 5 часов. Если вы используете более высокий ток, выделение тепла в батарее будет составлять некоторые потери, и номинальная емкость не будет достигнута. Чем меньше этот дефицит, тем больше подходит батарея для приложений с высоким потреблением энергии. Иногда поставщики аккумуляторов сообщают вам только емкость аккумулятора. Если вы знаете напряжение, вы можете вычислить количество энергии, которое имеет батарея. Если напряжение неизвестно, например, в сборках аккумуляторных батарей, вам неизвестна основная переменная, по которой вы можете судить о количестве энергии, удерживаемой аккумуляторной батареей.  Вы можете использовать этот C-rate для определения силы тока заряда (разряда) в зависимости от времени. Например, аккумулятор емкостью 2500 мАч, рассчитанный на скорость разряда 3C, может быть разряжен при токе 7,5A. Если ток в 3 раза выше, продолжительность в 3 раза меньше. Таким образом, теоретически батарея может быть разряжена током 7,5А за 20 минут (потери на сток и падение напряжения, скорее всего, сократят это время на пару минут).
Вы можете использовать этот C-rate для определения силы тока заряда (разряда) в зависимости от времени. Например, аккумулятор емкостью 2500 мАч, рассчитанный на скорость разряда 3C, может быть разряжен при токе 7,5A. Если ток в 3 раза выше, продолжительность в 3 раза меньше. Таким образом, теоретически батарея может быть разряжена током 7,5А за 20 минут (потери на сток и падение напряжения, скорее всего, сократят это время на пару минут).  Итак, проверьте мелкий шрифт и задайте вопросы: вам всегда нужно проверять, может ли аккумулятор обеспечить номинальную мощность в течение необходимого вам времени.
Итак, проверьте мелкий шрифт и задайте вопросы: вам всегда нужно проверять, может ли аккумулятор обеспечить номинальную мощность в течение необходимого вам времени.  Строго говоря, это неправильно, поскольку ни одна из этих единиц не используется для получения энергии. В частности, «емкость батареи» является сложной задачей, поскольку емкость действительно является важной частью информации, но только в сочетании с напряжением она полезна для определения способности аккумулятора накапливать энергию.
Строго говоря, это неправильно, поскольку ни одна из этих единиц не используется для получения энергии. В частности, «емкость батареи» является сложной задачей, поскольку емкость действительно является важной частью информации, но только в сочетании с напряжением она полезна для определения способности аккумулятора накапливать энергию.  Это довольно мало. Например, наш «диапазон» на 72 Вольта имеет следующие характеристики: Гравиметрическая плотность энергии составляет 190 Вт·ч/кг Объемная плотность энергии составляет 316 Вт·ч/л. наши батареи, у нас будет 494 л x 316 Втч/л = 156 104 Втч или 156 кВтч энергии. Это будет то же самое, что и 6 батарейных блоков Nissan. Обратите внимание, что мы сравниваем аккумуляторы, а не голые элементы! Вам также необходимо будет рассмотреть механический корпус и внутренние подсистемы. Голые клетки имеют лучшие показатели, но ведь их же нельзя просто кинуть в багажник, не так ли?
Это довольно мало. Например, наш «диапазон» на 72 Вольта имеет следующие характеристики: Гравиметрическая плотность энергии составляет 190 Вт·ч/кг Объемная плотность энергии составляет 316 Вт·ч/л. наши батареи, у нас будет 494 л x 316 Втч/л = 156 104 Втч или 156 кВтч энергии. Это будет то же самое, что и 6 батарейных блоков Nissan. Обратите внимание, что мы сравниваем аккумуляторы, а не голые элементы! Вам также необходимо будет рассмотреть механический корпус и внутренние подсистемы. Голые клетки имеют лучшие показатели, но ведь их же нельзя просто кинуть в багажник, не так ли?  Объемная плотность мощности составляет 110 000 / 494 л = 222 Вт/л. Это также довольно мало. Например, наш «гоночный» аккумулятор на 72 В имеет следующие характеристики: Гравиметрическая плотность мощности = 1850 Вт/кг Гравиметрическая плотность мощности = 2830 Вт/л Опять же, мы можем посчитать по-другому: если у нас будет объем 494 литра наших аккумуляторов, у нас будет 494 л x 2830 Вт/л = 1.398.020 Вт или 1398 кВт или 1,4 МВт мощности, в отличие от 110 кВт у Nissan Leaf! Это более чем в 12 раз лучше. Если вы хотите построить мегаваттный спортивный автомобиль, поговорите с нами! Кроме того, следует помнить, что мы сравниваем аккумуляторы, а не голые элементы!
Объемная плотность мощности составляет 110 000 / 494 л = 222 Вт/л. Это также довольно мало. Например, наш «гоночный» аккумулятор на 72 В имеет следующие характеристики: Гравиметрическая плотность мощности = 1850 Вт/кг Гравиметрическая плотность мощности = 2830 Вт/л Опять же, мы можем посчитать по-другому: если у нас будет объем 494 литра наших аккумуляторов, у нас будет 494 л x 2830 Вт/л = 1.398.020 Вт или 1398 кВт или 1,4 МВт мощности, в отличие от 110 кВт у Nissan Leaf! Это более чем в 12 раз лучше. Если вы хотите построить мегаваттный спортивный автомобиль, поговорите с нами! Кроме того, следует помнить, что мы сравниваем аккумуляторы, а не голые элементы!  Причина этого довольно проста: если вы хотите высосать много энергии из данной ячейки, металлические полюса в этой ячейке нагреются. Существует только такой большой ток, который может быть обработан с данным размером. Эту проблему можно решить, увеличив размер этих полюсов. Дополнительное пространство, которое потребуется для этих полюсов, не может быть использовано для реальных химикатов батареи, что приводит к потере емкости хранения энергии.
Причина этого довольно проста: если вы хотите высосать много энергии из данной ячейки, металлические полюса в этой ячейке нагреются. Существует только такой большой ток, который может быть обработан с данным размером. Эту проблему можно решить, увеличив размер этих полюсов. Дополнительное пространство, которое потребуется для этих полюсов, не может быть использовано для реальных химикатов батареи, что приводит к потере емкости хранения энергии.  Думайте об этом как о том, чтобы позволить тяжелоатлету пробежать марафон, а бегуну заняться тяжелой атлетикой. Они оба будут плохо разбираться в специализации друг друга, и бегун получит травму, пытаясь поднять слишком много, как ранец для стрельбы будет поврежден при попытке извлечь слишком много энергии. Поиск кого-то, кто мог бы делать и то и другое, возможен, как спортсмен-десятиборец. Однако он никогда не пробежит марафон так же быстро, как бегун, и не сможет заниматься тяжелой атлетикой на уровне специалиста. Наш рюкзак «производительность» сравним со спортсменом-десятиборцем. На графике вы можете увидеть, как наши решения связаны с мощностью и энергией.
Думайте об этом как о том, чтобы позволить тяжелоатлету пробежать марафон, а бегуну заняться тяжелой атлетикой. Они оба будут плохо разбираться в специализации друг друга, и бегун получит травму, пытаясь поднять слишком много, как ранец для стрельбы будет поврежден при попытке извлечь слишком много энергии. Поиск кого-то, кто мог бы делать и то и другое, возможен, как спортсмен-десятиборец. Однако он никогда не пробежит марафон так же быстро, как бегун, и не сможет заниматься тяжелой атлетикой на уровне специалиста. Наш рюкзак «производительность» сравним со спортсменом-десятиборцем. На графике вы можете увидеть, как наши решения связаны с мощностью и энергией.  Существуют различные способы его измерения, два наиболее распространенных — метод напряжения и метод интегрирования тока.
Существуют различные способы его измерения, два наиболее распространенных — метод напряжения и метод интегрирования тока.  Другим недостатком является то, что эта система со временем будет дрейфовать, поэтому вам нужно часто сбрасывать ее. Чаще всего SOC сбрасывается на 100%, когда зарядное устройство заканчивает зарядку.
Другим недостатком является то, что эта система со временем будет дрейфовать, поэтому вам нужно часто сбрасывать ее. Чаще всего SOC сбрасывается на 100%, когда зарядное устройство заканчивает зарядку. 
 Теперь вступает в действие второй этап зарядки.
Теперь вступает в действие второй этап зарядки.  Если зарядное устройство не предназначено специально для литиевых батарей и явно не работает по принципу CCCV, даже не рассматривайте его.
Если зарядное устройство не предназначено специально для литиевых батарей и явно не работает по принципу CCCV, даже не рассматривайте его. 
 Наша BMS может управлять этим процессом, чтобы обеспечить максимальный срок службы вашего аккумуляторного блока. Литиевые батареи довольно хорошо переносят низкие температуры. То есть до тех пор, пока они не используются. Зарядка ниже нуля градусов Цельсия не допускается. Это включает в себя рекуперативное торможение, поскольку оно, по сути, заряжает аккумуляторы вашей трансмиссией! BMS должна быть настроена на запрет зарядки при низкой температуре. Наша BMS имеет эту функцию, а также способна предварительно нагревать аккумуляторную батарею с жидкостным охлаждением перед зарядкой, поскольку эту систему охлаждения также можно использовать в качестве системы обогрева аккумуляторной батареи зимой. Часто BMS управляет зарядным устройством через соединение с шиной CAN: она учитывает состояние батареи, SOC и температуру и определяет правильную настройку, которую, в свою очередь, выполняет зарядное устройство. Наше зарядное устройство и BMS представляют собой идеальную комбинацию и поставляются с индивидуальными настройками для оптимальной работы в вашем приложении.
Наша BMS может управлять этим процессом, чтобы обеспечить максимальный срок службы вашего аккумуляторного блока. Литиевые батареи довольно хорошо переносят низкие температуры. То есть до тех пор, пока они не используются. Зарядка ниже нуля градусов Цельсия не допускается. Это включает в себя рекуперативное торможение, поскольку оно, по сути, заряжает аккумуляторы вашей трансмиссией! BMS должна быть настроена на запрет зарядки при низкой температуре. Наша BMS имеет эту функцию, а также способна предварительно нагревать аккумуляторную батарею с жидкостным охлаждением перед зарядкой, поскольку эту систему охлаждения также можно использовать в качестве системы обогрева аккумуляторной батареи зимой. Часто BMS управляет зарядным устройством через соединение с шиной CAN: она учитывает состояние батареи, SOC и температуру и определяет правильную настройку, которую, в свою очередь, выполняет зарядное устройство. Наше зарядное устройство и BMS представляют собой идеальную комбинацию и поставляются с индивидуальными настройками для оптимальной работы в вашем приложении.

 То же самое справедливо и для элемента с более низким напряжением, напряжение которого упадет ниже его рабочего напряжения. Если ячейки не используются в пределах их рабочего диапазона, они будут повреждены и быстро потеряют емкость. Вы должны думать о батареях, соединенных последовательно, как о звеньях цепи: прочность цепи определяется самым слабым звеном. То же самое верно и для аккумуляторных элементов: емкость самого слабого элемента определяет емкость всей батареи. По этой причине мы контролируем каждую отдельную ячейку, и BMS сообщит зарядному устройству о прекращении зарядки, если хотя бы одна ячейка окажется выше допустимого напряжения, и предупредит или даже прекратит разрядку, если хотя бы одна ячейка окажется ниже допустимого напряжения.
То же самое справедливо и для элемента с более низким напряжением, напряжение которого упадет ниже его рабочего напряжения. Если ячейки не используются в пределах их рабочего диапазона, они будут повреждены и быстро потеряют емкость. Вы должны думать о батареях, соединенных последовательно, как о звеньях цепи: прочность цепи определяется самым слабым звеном. То же самое верно и для аккумуляторных элементов: емкость самого слабого элемента определяет емкость всей батареи. По этой причине мы контролируем каждую отдельную ячейку, и BMS сообщит зарядному устройству о прекращении зарядки, если хотя бы одна ячейка окажется выше допустимого напряжения, и предупредит или даже прекратит разрядку, если хотя бы одна ячейка окажется ниже допустимого напряжения.  Когда аккумуляторная батарея правильно собрана из качественных элементов одинаковой емкости, это не проблема. Балансировка займет совсем немного времени, а вместимость вашего рюкзака останется в порядке. Однако, когда батарейный блок подвергается неправильному использованию или стареет, дисбаланс становится больше. Это займет больше времени, чтобы сбалансироваться, и пакет в целом потеряет емкость.
Когда аккумуляторная батарея правильно собрана из качественных элементов одинаковой емкости, это не проблема. Балансировка займет совсем немного времени, а вместимость вашего рюкзака останется в порядке. Однако, когда батарейный блок подвергается неправильному использованию или стареет, дисбаланс становится больше. Это займет больше времени, чтобы сбалансироваться, и пакет в целом потеряет емкость. 
