Что такое биосенсоры и как они работают. Какие бывают виды биосенсоров. Где применяются биосенсоры в медицине и других областях. Каковы преимущества и недостатки биосенсоров.
Что такое биосенсор и как он устроен
Биосенсор — это аналитический прибор, использующий биологический чувствительный элемент в сочетании с физико-химическим преобразователем для обнаружения, передачи и регистрации информации о наличии и количестве определенных химических соединений в анализируемом образце.
Основные компоненты биосенсора:
- Биорецептор (биоселективный элемент) — биологический чувствительный элемент, специфически реагирующий на определяемое вещество. Это может быть фермент, антитело, нуклеиновая кислота, клетка или ткань.
- Преобразователь (трансдьюсер) — устройство, преобразующее биохимический сигнал в измеряемый физический сигнал (электрический, оптический и др.).
- Электронный блок усиления и обработки сигнала.
- Система вывода результатов анализа.
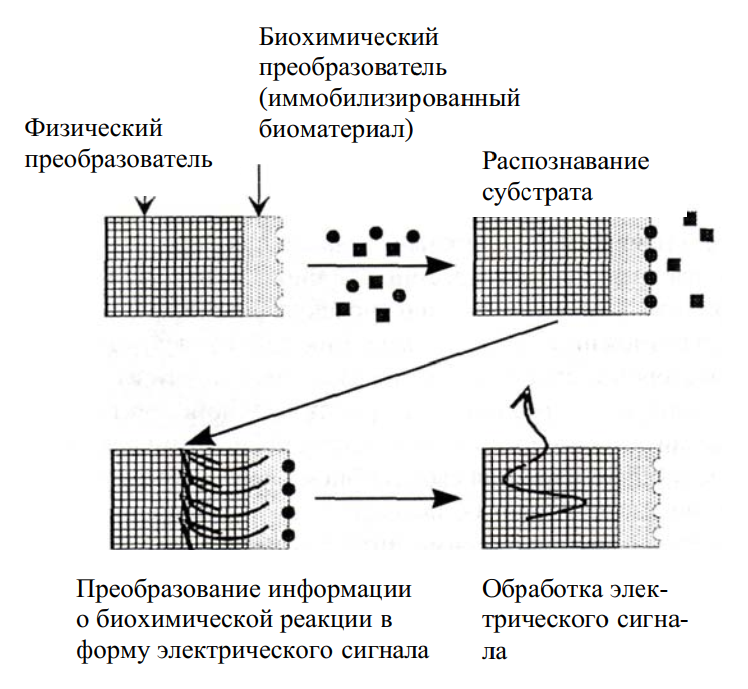
Принцип работы биосенсоров
Как работает биосенсор? Принцип действия биосенсора заключается в следующем:
/imgs/2020/06/11/09/3951674/a95aae8141622d63e9f213f450648176830eff51.jpg)
- Биорецептор специфически связывается с определяемым веществом (аналитом) в анализируемом образце.
- В результате этого взаимодействия происходят определенные биохимические реакции.
- Преобразователь регистрирует изменения, вызванные этими реакциями, и преобразует их в измеряемый сигнал.
- Сигнал усиливается и обрабатывается электронным блоком.
- Результат анализа выводится в удобном для восприятия виде.
Основные виды биосенсоров
Существует несколько основных типов биосенсоров, различающихся по принципу действия преобразователя:
Электрохимические биосенсоры
Электрохимические биосенсоры основаны на измерении электрических параметров системы, возникающих в результате биохимических реакций. Они подразделяются на:
- Потенциометрические — измеряют разность потенциалов
- Амперометрические — измеряют силу тока
- Кондуктометрические — измеряют проводимость раствора
Оптические биосенсоры
Оптические биосенсоры регистрируют изменение оптических свойств системы (поглощение, отражение, люминесценция). Наиболее распространены биосенсоры на основе:

- Поверхностного плазмонного резонанса
- Волоконно-оптических систем
- Флуоресценции
Пьезоэлектрические биосенсоры
Пьезоэлектрические биосенсоры основаны на измерении изменений массы чувствительного слоя при связывании аналита. Типичный пример — кварцевые микровесы.
Применение биосенсоров в медицине и других областях
Биосенсоры нашли широкое применение в различных сферах:
Медицина и здравоохранение
В медицине биосенсоры используются для:
- Диагностики заболеваний
- Мониторинга состояния пациентов
- Определения уровня глюкозы в крови
- Обнаружения биомаркеров различных заболеваний
- Анализа лекарственных препаратов
Экологический мониторинг
Биосенсоры применяются для:
- Определения загрязнителей в воде, воздухе и почве
- Контроля качества питьевой воды
- Мониторинга состояния окружающей среды
Пищевая промышленность
В пищевой промышленности биосенсоры используются для:
- Контроля качества и безопасности продуктов питания
- Определения содержания пестицидов, антибиотиков и других примесей
- Мониторинга процессов ферментации
Преимущества и недостатки биосенсоров
Каковы основные достоинства и ограничения применения биосенсоров?
Преимущества биосенсоров:
- Высокая специфичность и чувствительность анализа
- Быстрота получения результатов
- Возможность миниатюризации и создания портативных устройств
- Простота использования, не требующая высокой квалификации персонала
- Возможность проведения анализа в режиме реального времени
Недостатки биосенсоров:
- Ограниченный срок службы биологического компонента
- Зависимость от внешних факторов (температура, pH и др.)
- Сложность массового производства идентичных биосенсоров
- Высокая стоимость некоторых типов биосенсоров
Перспективы развития технологии биосенсоров
Каковы основные направления совершенствования биосенсоров? Перспективы развития этой технологии связаны с:
- Разработкой новых биораспознающих элементов с улучшенными характеристиками
- Созданием мультисенсорных систем типа «электронный нос» и «электронный язык»
- Интеграцией биосенсоров с микрофлюидными системами
- Разработкой имплантируемых биосенсоров для непрерывного мониторинга
- Применением наноматериалов и нанотехнологий для улучшения характеристик биосенсоров
Таким образом, технология биосенсоров активно развивается и находит все новые области применения в науке, медицине и промышленности. Дальнейшее совершенствование биосенсоров позволит создавать более чувствительные, надежные и доступные аналитические устройства.
Биосенсор — Википедия с видео // WIKI 2
Современный глюкометр для измерения уровня глюкозы в крови. Слева – игла для прокалывания кожи.
Биосе́нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях[1]. В биосенсорах биологический компонент сочетается с физико-химическим преобразователем.
Биосенсоры состоят из трёх частей:
- биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д.), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии.
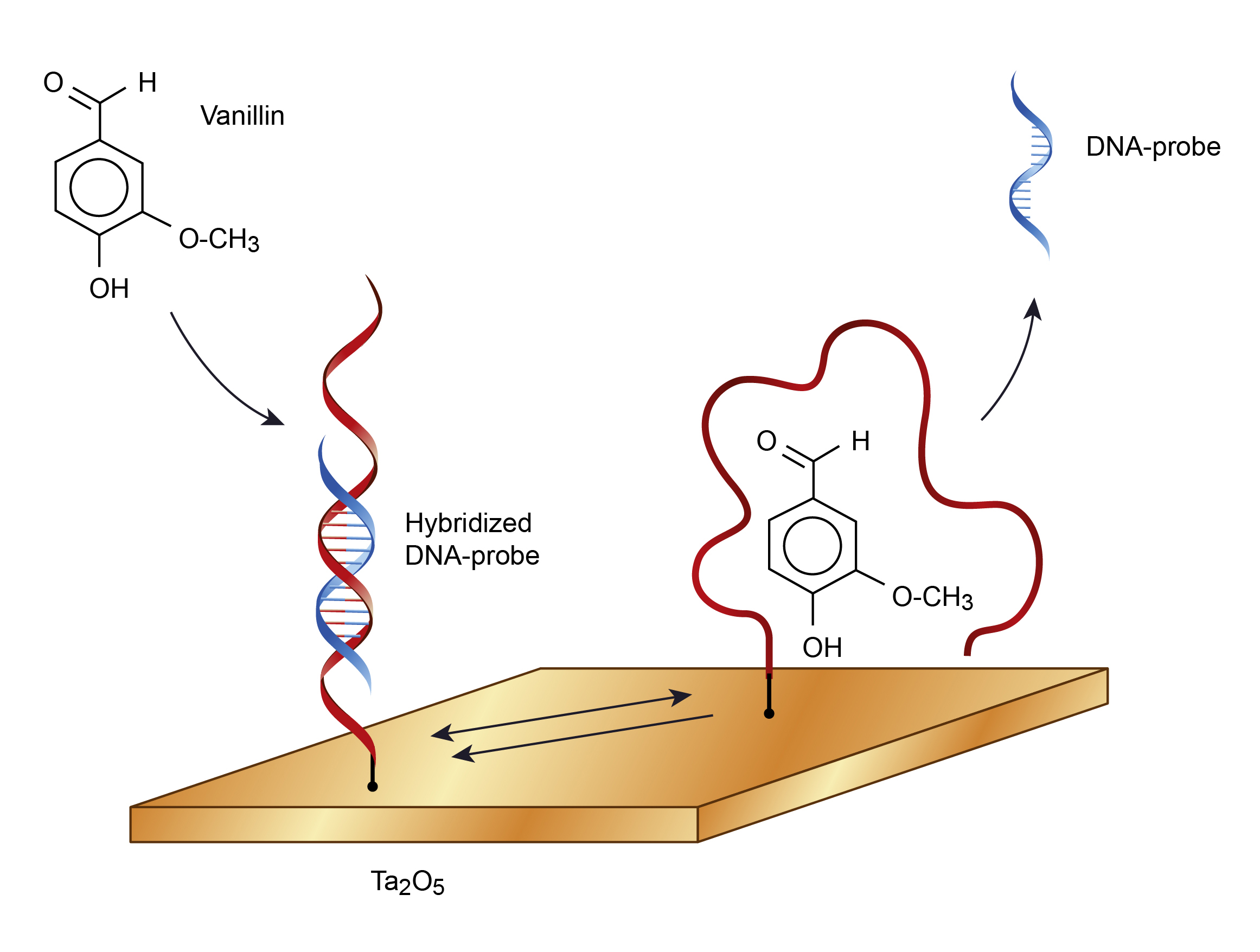
- преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д.), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить;
- связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде.[2].
Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАД·Н2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае электрод является преобразователем, а фермент — биоселективным элементом.
С недавних пор массивы из многих различных молекул детектора применяются в так называемых электронных носах, где наборы откликов от детекторов используются для определения веществ. Современные электронные носы, тем не менее, не используют биологический материал (то есть являются хемосенсорами).
Домашняя канарейка, которая применялась шахтёрами для предупреждения об утечке газа, может считаться биосенсором. Многие из современных биосенсоров работают на том же принципе, то есть используют организмы, которые реагируют на значительно меньшие концентрации токсических веществ, чем это делает человек, предупреждая таким образом о присутствии яда. Эти приборы могут использоваться для экологического мониторинга, определения незначительных примесей нефтепродуктов и на сооружениях для очистки сточных вод.
Энциклопедичный YouTube
-
1/3
Просмотров:633
2 730
710
-
✪ Передача 4. Биосенсоры. Биоэлектроника
-
✪ Биосенсоры | Трейлер к курсу
-
✪ Анализ рН — интересный опыт. pH тест- Ури-рН ООО Биосенсор АН
Содержание
История создания биосенсоров
Идея создания биосенсоров восходит опыту проведённому немецким физиологом Максом Кремером[de] в 1906 году, когда он показал, что концентрация кислоты в жидкости пропорциональна электрическому потенциалу, который возникает между частями жидкости, расположенными на противоположных сторонах стеклянной мембраны[3]. Первый биосенсор современного типа сконструировал Леланд Кларк-младший (1918–2005) в 1956 году для обнаружения кислорода, позже этот электрод стали называть «электродом Кларка»[3][4]. К 1962 году Кларк продемонстрировал первый амперометрический ферментный электрод для обнаружения глюкозы. В 1969 году Джордж Гильбо и Джозеф Монтальво-младший создали первый потенциометрический биосенсор для обнаружения мочевины. Первый коммерческий биосенсор был разработан в 1975 году компанией Yellow Spring Instruments (YSI)
Классификация биосенсоров
В зависимости от типа преобразователя, биосенсоры классифицируют на оптические, акустические, калориметрические, термические и электрохимические. Электрохимические биосенсоры, в свою очередь, делят на потенциометрические, амперометрические и кондуктометрические.[5]
Оптические биосенсоры
Принцип работы большинства оптических биосенсоров основан на явлении поверхностного плазмонного резонанса. Этот эффект может достигаться за счёт облучения поверхности стеклянной пластики с тонким покрытием металлического золота, или другого благородного металла, пучком лазерного света определённой длины волны, за счёт чего при его частичной сорбции создаются электронные волны (поверхностные плазмоны). Как правило, эффект плазмонного резонанса наступает не только при определённой длине волны лазерного излучения, но и при конкретном значении величины угла падающего света и зависит физических характеристик поверхности металлической плёнки, к которой в результате реакции произошло присоединение аналита.
Сенсоры на основе поверхностного плазмонного резонанса представляют собой чип, который состоит из пластиковой кассеты, несущей стеклянную тарелку, одна сторона которой покрыта микроскопически-тонким слоем металлического золота и обладает способностью взаимодействовать с оптической частью электронного датчика прибора. Противоположная сторона тарелки стеклянного сенсора соединяется с жидкостной проточной системой прибора, в которую поступает проба, при этом растворенные в жидкости вещества пробы непосредственно контактируют с поверхностью тарелки. Поверхность противоположной стороны стеклянной тарелки, как правило, имеет полимерное покрытие. Зачастую в качестве такого полимерного покрытия выступает слой карбоксиметилдекстрана или другого химически аналогичного вещества.
Пучок света с фиксированной длиной волны, попадая на поверхность тарелки, отражается от покрытой золотом стороны стеклянного чипа под углом полного внутреннего отражения, и детектируется электронно-аппаратной частью прибора. При этом пучок света индуцирует исчезающую волну, которая проникает сквозь стеклянную тарелку, в раствор вблизи её поверхности.
Коэффициент преломления проточной стороны сенсорного чипа прямо влияет на поведение света, отражённого от покрытой золотом стороны. Связывание веществ с поверхностью проточной стороны чипа влияет на коэффициент преломления, что можно зарегистрировать оптической аппаратурой; таким образом биологические взаимодействия могут быть измерены с высоким уровнем чувствительности.
Другие биосенсоры на основе исчезающей волны были коммерциализированы с использованием волноводов, в которых константа распространения света через волновод изменяется при абсорбции молекул на поверхность волновода. Например, в двойной поляризационной интерферометрии используются два волновода, один из которых изолирован и является эталонным, а второй волновод непосредственно контактирует с исследуемым образцом. Сравнивая константы скорости распространения света в обоих волноводах, делают заключение о концентрации аналита.
Оптические биосенсоры основаны в основном на изменении в абсорбции или флуоресценции соответствующего индикаторного компонента и не нуждаются в полном внутреннем отражении. Например, разработан полностью функционирующий прототип прибора для определения казеина в молоке. Прибор основан на обнаружении изменений в абсорбции золотого слоя.[6] Широко используемый в молекулярной биологии исследовательский инструмент, ДНК-микрочип, может также считаться оптическим биосенсором.
Электрохимические биосенсоры
Электрохимические биосенсоры обычно основаны на ферментативном катализе реакции, в которой освобождаются или поглощаются электроны (используемые ферменты принадлежат к классу оксидоредуктаз). Биосенсор обычно включает в себя три электрода: электрод сравнения, рабочий и вспомогательный. На поверхность рабочего электрода наносят биологический материал, который специфически вступает в реакцию с аналитом. Заряженные продукты реакции создают на рабочем электроде потенциал, который отнимается от потенциала на электроде сравнения для получения выходящего сигнала. Применяется также измерение силы тока (в этом случае интенсивность потока электронов пропорциональна концентрации аналита) при постоянном потенциале или потенциал можно измерять при нулевой силе тока (это даёт логарифмический отклик). Нужно отметить, что на потенциал электродов влияет заряд их окружения, что часто используется. Более того, возможно прямое электрическое определение небольших пептидов и белков по характерному для них заряду, используя биологически модифицированные ион-селективные полевые транзисторы (ИСПТ).[7]
Другие типы биосенсоров
В пьезоэлектрических сенсорах используются кристаллы, которые эластически деформируются при воздействии на них электрического потенциала. Переменный потенциал при определённой частоте вызывает стоячую волну в кристалле. Эта частота в значительной степени зависит от эластичных свойств кристалла, поэтому, если кристалл покрыт биологическим распознающим элементом, присоединение большого количества аналита к рецептору приведет к изменению резонансной частоты, что и служит сигналом о связывании.
Термические и магнитные биосенсоры практически не распространены.
См. также
Примечания
- ↑ biosensor // IUPAC Gold Book
- ↑ Cavalcanti A., Shirinzadeh B., Zhang M., Kretly L. C. Nanorobot Hardware Architecture for Medical Defense (англ.) // Sensors : journal. — 2008. — Vol. 8, no. 5. — P. 2932—2958. — doi:10.3390/s8052932.
- ↑ 1 2 3 Bhalla N., Jolly P., Formisano N., and Estrela P. Introduction to biosensors (англ.) // Essays Biochem. — 2016. — Vol. 60, no. 1. — P. 1–8. — doi:10.1042/EBC20150001.
- ↑ Heineman W.R., Jensen W.B. Leland C. Clark Jr. (1918–2005) (англ.) // Biosensors and Bioelectronics. — 2006. — Vol. 21, no. 8. — P. 1403–1404. — doi:10.1016/j.bios.2005.12.005.
- ↑ Дзядевич С.В., Солдаткін О.П. Наукові та технологічні засади створення мініатюрних електрохімічних біосенсорів. — 1-е изд. — Киев: Наукова думка, 2006. — С. 3, 6. — 256 с. — ISBN 966-00-0595-4.
- ↑ H. M. Hiep et al. «A localized surface plasmon resonance based immunosensor for the detection of casein in milk» Sci. Technol. Adv. Mater. 8 (2007) 331 free download
- ↑ S.Q. Lud, M.G. Nikolaides, I. Haase, M. Fischer and A.R. Bausch (2006).»Field Effect of Screened Charges: Electrical Detection of Peptides and Proteins by a Thin Film Resistor» ChemPhysChem 7(2), 379-384 [1]
Литература
- Баника Ф.-Г., Химические и биологические сенсоры: основы и применения. Техносфера, Москва, 2014г; Цена: 869. ISBN 978-5-94836-380-6
- Будников Г.К. Биосенсоры как новый тип аналитических устройств // Соросовский образовательный журнал, 1996, № 12, c. 26-32.
- Варфоломеев С.Д. Биосенсоры // Соросовский образовательный журнал, 1997, № 1, c. 45-49.
- Компанец О.Н. Портативные оптические биосенсоры для определения биологически активных и токсичных соединений // Успехи физических наук, 2004, т. 174, № 6, c. 684-686.
- Воронов В. К., Подоплелов А. В. Физика на переломе тысячелетий: конденсированное состояние, 2-е изд., М.: ЛКИ, 2012, 336 стр., ISBN 978-5-382-01365-7
 Эта страница в последний раз была отредактирована 13 января 2020 в 02:04.
Эта страница в последний раз была отредактирована 13 января 2020 в 02:04.
Биосенсор — Википедия
Современный глюкометр для измерения уровня глюкозы в крови. Слева – игла для прокалывания кожи.Биосе́нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях[1]. В биосенсорах биологический компонент сочетается с физико-химическим преобразователем.
Биосенсоры состоят из трёх частей:
- биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д.), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии.
- преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д.), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить;
- связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде.[2].
Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАД·Н2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае электрод является преобразователем, а фермент — биоселективным элементом.
С недавних пор массивы из многих различных молекул детектора применяются в так называемых электронных носах, где наборы откликов от детекторов используются для определения веществ. Современные электронные носы, тем не менее, не используют биологический материал (то есть являются хемосенсорами).
Домашняя канарейка, которая применялась шахтерами для предупреждения об утечке газа, может считаться биосенсором. Многие из современных биосенсоров работают на том же принципе, то есть используют организмы, которые реагируют на значительно меньшие концентрации токсических веществ, чем это делает человек, предупреждая таким образом о присутствии яда. Эти приборы могут использоваться для экологического мониторинга, определения незначительных примесей нефтепродуктов и на сооружениях для очистки сточных вод.
Классификация биосенсоров
В зависимости от типа преобразователя, биосенсоры классифицируют на оптические, акустические, калориметрические, термические и электрохимические. Электрохимические биосенсоры, в свою очередь, делят на потенциометрические, амперометрические и кондуктометрические.[3]
Оптические биосенсоры
Значительная часть оптических биосенсоров основаны на явлении поверхностного плазмонного резонанса и используют свойство золотых и других материалов, а именно то, что тонкий слой золота, нанесенный на имеющую высокий коэффициент преломления стеклянную поверхность может абсорбировать лазерный свет, создавая электронные волны (поверхностные плазмоны) на золотой поверхности. Это происходит только при определенном угле падения и длине волны падающего света и в такой степени зависит от поверхности золотого слоя, что присоединение аналита к биологическому рецептору на поверхности этого слоя генерирует заметный сигнал. Сенсоры на основе поверхностного плазмонного резонанса представляют собой сенсорный чип, который состоит из пластиковой кассеты, несущей стеклянную тарелку, одна сторона которой покрыта микроскопическим слоем золота. Эта сторона взаимодействует с оптической распознающей аппаратурой прибора. Противоположная сторона тарелки соединяется с жидкостной проточной системой. Растворенные в жидкости реагенты могут непосредственно контактировать с поверхностью тарелки. Эта сторона стеклянного сенсорного чипа может быть различными путями модифицирована, позволяя легко присоединять интересующие молекулы. Обычно она покрыта карбоксиметилдекстраном или подобным веществом.
Свет с фиксированной длиной волны отражается от покрытой золотом стороны чипа под углом полного внутреннего отражения, и детектируется внутри прибора. Этот свет индуцирует исчезающую волну, которая проникает сквозь стеклянную тарелку в раствор вблизи её поверхности.
Коэффициент преломления проточной стороны сенсорного чипа прямо влияет на поведение света, отраженного от покрытой золотом стороны. Связывание веществ с поверхностью проточной стороны чипа влияет на коэффициент преломления, что можно зарегистрировать оптической аппаратурой; таким образом биологические взаимодействия могут быть измерены с высоким уровнем чувствительности.
Другие биосенсоры на основе исчезающей волны были коммерциализированы с использованием волноводов, в которых константа распространения света через волновод изменяется при абсорбции молекул на поверхность волновода. Например, в двойной поляризационной интерферометрии используются два волновода, один из которых изолирован и является эталонным, а второй волновод непосредственно контактирует с исследуемым образцом. Сравнивая константы скорости распространения света в обоих волноводах, делают заключение о концентрации аналита.
Оптические биосенсоры основаны в основном на изменении в абсорбции или флуоресценции соответствующего индикаторного компонента и не нуждаются в полном внутреннем отражении. Например, разработан полностью функционирующий прототип прибора для определения казеина в молоке. Прибор основан на обнаружении изменений в абсорбции золотого слоя.[4] Широко используемый в молекулярной биологии исследовательский инструмент, ДНК-микрочип, может также считаться оптическим биосенсором.
Электрохимические биосенсоры
Электрохимические биосенсоры обычно основаны на ферментативном катализе реакции, в которой освобождаются или поглощаются электроны (используемые ферменты принадлежат к классу оксидоредуктаз). Биосенсор обычно включает в себя три электрода: электрод сравнения, рабочий и вспомогательный. На поверхность рабочего электрода наносят биологический материал, который специфически вступает в реакцию с аналитом. Заряженные продукты реакции создают на рабочем электроде потенциал, который отнимается от потенциала на электроде сравнения для получения выходящего сигнала. Применяется также измерение силы тока (в этом случае интенсивность потока электронов пропорциональна концентрации аналита) при постоянном потенциале или потенциал можно измерять при нулевой силе тока (это даёт логарифмический отклик). Нужно отметить, что на потенциал электродов влияет заряд их окружения, что часто используется. Более того, возможно прямое электрическое определение небольших пептидов и белков по характерному для них заряду, используя биологически модифицированные ион-селективные полевые транзисторы (ИСПТ).[5]
Другие типы биосенсоров
В пьезоэлектрических сенсорах используются кристаллы, которые эластически деформируются при воздействии на них электрического потенциала. Переменный потенциал при определённой частоте вызывает стоячую волну в кристалле. Эта частота в значительной степени зависит от эластичных свойств кристалла, поэтому, если кристалл покрыт биологическим распознающим элементом, присоединение большого количества аналита к рецептору приведет к изменению резонансной частоты, что и служит сигналом о связывании.
Термические и магнитные биосенсоры практически не распространены.
См. также
Примечания
- ↑ biosensor // IUPAC Gold Book
- ↑ Cavalcanti A, Shirinzadeh B, Zhang M, Kretly LC (2008). «Nanorobot Hardware Architecture for Medical Defense». Sensors 8 (5): 2932–2958. DOI:10.3390/s8052932.
- ↑ Дзядевич С.В., Солдаткін О.П. Наукові та технологічні засади створення мініатюрних електрохімічних біосенсорів. — 1-е изд. — Киев: Наукова думка, 2006. — С. 3, 6. — 256 с. — ISBN 966-00-0595-4.
- ↑ H. M. Hiep et al. «A localized surface plasmon resonance based immunosensor for the detection of casein in milk» Sci. Technol. Adv. Mater. 8 (2007) 331 free download
- ↑ S.Q. Lud, M.G. Nikolaides, I. Haase, M. Fischer and A.R. Bausch (2006).»Field Effect of Screened Charges: Electrical Detection of Peptides and Proteins by a Thin Film Resistor» ChemPhysChem 7(2), 379-384 [1]
Литература
- Баника Ф.-Г., Химические и биологические сенсоры: основы и применения. Техносфера, Москва, 2014г; Цена: 869. ISBN 978-5-94836-380-6
- Будников Г.К. Биосенсоры как новый тип аналитических устройств // Соросовский образовательный журнал, 1996, № 12, c. 26-32.
- Варфоломеев С.Д. Биосенсоры // Соросовский образовательный журнал, 1997, № 1, c. 45-49.
- Компанец О.Н. Портативные оптические биосенсоры для определения биологически активных и токсичных соединений // Успехи физических наук, 2004, т. 174, № 6, c. 684-686.
- Воронов В. К., Подоплелов А. В. Физика на переломе тысячелетий: конденсированное состояние, 2-е изд., М.: ЛКИ, 2012, 336 стр., ISBN 978-5-382-01365-7
Биосенсор — Википедия
Современный глюкометр для измерения уровня глюкозы в крови. Слева – игла для прокалывания кожи.Биосе́нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях[1]. В биосенсорах биологический компонент сочетается с физико-химическим преобразователем.
Биосенсоры состоят из трёх частей:
- биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д.), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии.
- преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д.), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить;
- связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде.[2].
Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАД·Н2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае электрод является преобразователем, а фермент — биоселективным элементом.
С недавних пор массивы из многих различных молекул детектора применяются в так называемых электронных носах, где наборы откликов от детекторов используются для определения веществ. Современные электронные носы, тем не менее, не используют биологический материал (то есть являются хемосенсорами).
Домашняя канарейка, которая применялась шахтерами для предупреждения об утечке газа, может считаться биосенсором. Многие из современных биосенсоров работают на том же принципе, то есть используют организмы, которые реагируют на значительно меньшие концентрации токсических веществ, чем это делает человек, предупреждая таким образом о присутствии яда. Эти приборы могут использоваться для экологического мониторинга, определения незначительных примесей нефтепродуктов и на сооружениях для очистки сточных вод.
Классификация биосенсоров
В зависимости от типа преобразователя, биосенсоры классифицируют на оптические, акустические, калориметрические, термические и электрохимические. Электрохимические биосенсоры, в свою очередь, делят на потенциометрические, амперометрические и кондуктометрические.[3]
Оптические биосенсоры
Значительная часть оптических биосенсоров основаны на явлении поверхностного плазмонного резонанса и используют свойство золотых и других материалов, а именно то, что тонкий слой золота, нанесенный на имеющую высокий коэффициент преломления стеклянную поверхность может абсорбировать лазерный свет, создавая электронные волны (поверхностные плазмоны) на золотой поверхности. Это происходит только при определенном угле падения и длине волны падающего света и в такой степени зависит от поверхности золотого слоя, что присоединение аналита к биологическому рецептору на поверхности этого слоя генерирует заметный сигнал. Сенсоры на основе поверхностного плазмонного резонанса представляют собой сенсорный чип, который состоит из пластиковой кассеты, несущей стеклянную тарелку, одна сторона которой покрыта микроскопическим слоем золота. Эта сторона взаимодействует с оптической распознающей аппаратурой прибора. Противоположная сторона тарелки соединяется с жидкостной проточной системой. Растворенные в жидкости реагенты могут непосредственно контактировать с поверхностью тарелки. Эта сторона стеклянного сенсорного чипа может быть различными путями модифицирована, позволяя легко присоединять интересующие молекулы. Обычно она покрыта карбоксиметилдекстраном или подобным веществом.
Свет с фиксированной длиной волны отражается от покрытой золотом стороны чипа под углом полного внутреннего отражения, и детектируется внутри прибора. Этот свет индуцирует исчезающую волну, которая проникает сквозь стеклянную тарелку в раствор вблизи её поверхности.
Коэффициент преломления проточной стороны сенсорного чипа прямо влияет на поведение света, отраженного от покрытой золотом стороны. Связывание веществ с поверхностью проточной стороны чипа влияет на коэффициент преломления, что можно зарегистрировать оптической аппаратурой; таким образом биологические взаимодействия могут быть измерены с высоким уровнем чувствительности.
Другие биосенсоры на основе исчезающей волны были коммерциализированы с использованием волноводов, в которых константа распространения света через волновод изменяется при абсорбции молекул на поверхность волновода. Например, в двойной поляризационной интерферометрии используются два волновода, один из которых изолирован и является эталонным, а второй волновод непосредственно контактирует с исследуемым образцом. Сравнивая константы скорости распространения света в обоих волноводах, делают заключение о концентрации аналита.
Оптические биосенсоры основаны в основном на изменении в абсорбции или флуоресценции соответствующего индикаторного компонента и не нуждаются в полном внутреннем отражении. Например, разработан полностью функционирующий прототип прибора для определения казеина в молоке. Прибор основан на обнаружении изменений в абсорбции золотого слоя.[4] Широко используемый в молекулярной биологии исследовательский инструмент, ДНК-микрочип, может также считаться оптическим биосенсором.
Электрохимические биосенсоры
Электрохимические биосенсоры обычно основаны на ферментативном катализе реакции, в которой освобождаются или поглощаются электроны (используемые ферменты принадлежат к классу оксидоредуктаз). Биосенсор обычно включает в себя три электрода: электрод сравнения, рабочий и вспомогательный. На поверхность рабочего электрода наносят биологический материал, который специфически вступает в реакцию с аналитом. Заряженные продукты реакции создают на рабочем электроде потенциал, который отнимается от потенциала на электроде сравнения для получения выходящего сигнала. Применяется также измерение силы тока (в этом случае интенсивность потока электронов пропорциональна концентрации аналита) при постоянном потенциале или потенциал можно измерять при нулевой силе тока (это даёт логарифмический отклик). Нужно отметить, что на потенциал электродов влияет заряд их окружения, что часто используется. Более того, возможно прямое электрическое определение небольших пептидов и белков по характерному для них заряду, используя биологически модифицированные ион-селективные полевые транзисторы (ИСПТ).[5]
Другие типы биосенсоров
В пьезоэлектрических сенсорах используются кристаллы, которые эластически деформируются при воздействии на них электрического потенциала. Переменный потенциал при определённой частоте вызывает стоячую волну в кристалле. Эта частота в значительной степени зависит от эластичных свойств кристалла, поэтому, если кристалл покрыт биологическим распознающим элементом, присоединение большого количества аналита к рецептору приведет к изменению резонансной частоты, что и служит сигналом о связывании.
Термические и магнитные биосенсоры практически не распространены.
См. также
Примечания
- ↑ biosensor // IUPAC Gold Book
- ↑ Cavalcanti A, Shirinzadeh B, Zhang M, Kretly LC (2008). «Nanorobot Hardware Architecture for Medical Defense». Sensors 8 (5): 2932–2958. DOI:10.3390/s8052932.
- ↑ Дзядевич С.В., Солдаткін О.П. Наукові та технологічні засади створення мініатюрних електрохімічних біосенсорів. — 1-е изд. — Киев: Наукова думка, 2006. — С. 3, 6. — 256 с. — ISBN 966-00-0595-4.
- ↑ H. M. Hiep et al. «A localized surface plasmon resonance based immunosensor for the detection of casein in milk» Sci. Technol. Adv. Mater. 8 (2007) 331 free download
- ↑ S.Q. Lud, M.G. Nikolaides, I. Haase, M. Fischer and A.R. Bausch (2006).»Field Effect of Screened Charges: Electrical Detection of Peptides and Proteins by a Thin Film Resistor» ChemPhysChem 7(2), 379-384 [1]
Литература
- Баника Ф.-Г., Химические и биологические сенсоры: основы и применения. Техносфера, Москва, 2014г; Цена: 869. ISBN 978-5-94836-380-6
- Будников Г.К. Биосенсоры как новый тип аналитических устройств // Соросовский образовательный журнал, 1996, № 12, c. 26-32.
- Варфоломеев С.Д. Биосенсоры // Соросовский образовательный журнал, 1997, № 1, c. 45-49.
- Компанец О.Н. Портативные оптические биосенсоры для определения биологически активных и токсичных соединений // Успехи физических наук, 2004, т. 174, № 6, c. 684-686.
- Воронов В. К., Подоплелов А. В. Физика на переломе тысячелетий: конденсированное состояние, 2-е изд., М.: ЛКИ, 2012, 336 стр., ISBN 978-5-382-01365-7
Применение биосенсоров приобрело огромную важность в сферах разработки лекарственных препаратов, биомедицины, стандартов продовольственной безопасности, обороны, безопасности и мониторинга качества окружающей среды. Результатом этого стала разработка точных и мощных аналитических инструментов, использующих биологический элемент в качестве биосенсора. Глюкометры, принцип действия которых основан на стратегии электрохимического выявления кислорода или пероксида водорода с помощью электродов с иммобилизованной глюкозооксидазой, положили начало разработке биосенсоров. Последние достижения в области биологических технологий и измерительных приборов, подразумевающие использование флуоресцентных меток для наноматериалов для повышения предела чувствительности биосенсоров. Применение аптамеров или нуклеотидов, аффител, пептидных панелей и полимеров с молекулярными отпечатками предоставило исследователям инструменты для разработки инновационных биосенсоров, за основу которых берутся классические методы. Интегрированные подходы предоставляют лучшие возможности для разработки специфичных и чувствительных биосенсоров с высоким регенеративным потенциалом. Различные биосенсоры, начиная с наноматериалов и полимеров и заканчивая микроорганизмами, имеют более широкую сферу перспективных направлений применения. Для этого важно интегрировать многосторонние подходы в разработку биосенсоров, потенциально пригодных для применения в различных сферах. В данной статье приведен обзор различных типов биосенсоров, начиная от электрохимических, флуоресцентных меток, наноматериалов, оксида кремния или кварца и заканчивая микроорганизмами, применяемых для биомедицинских целей и в охране окружающей среды, а также описаны будущие перспективы для отрасли биосенсорных технологий.
Введение
Термин «биосенсор» относится к мощному инновационному аналитическому устройству с биологическим чувствительным элементом, обладающему широким спектром возможных областей применения, таких как разработка препаратов, диагностика, биомедицина, продовольственная безопасность и пищевая промышленность, мониторинг состояния окружающей среды, оборона и безопасность. Первый биосенсор, изобретенный в 1962 году Кларком (Clark) и Лионсом (Lyons) для измерения уровня глюкозы в биологических образцах и использовавший стратегию электрохимического выявления кислорода или пероксида водорода с помощью электродов с иммобилизованной глюкозооксидазой. С тех пор невероятный прогресс был совершен как в технологии, так и в применении биосенсоров, использующих инновационные подходы, в том числе электрохимию, нанотехнологию и биоэлектронику. Учитывая феноменальные достижения в области биосенсоров, целью данного обзора является ознакомление читателя с различными техническим стратегиями, адаптированными для разработки биосенсоров, с целью предоставления базовых знаний и современной ситуации в области биосенсорных технологий. Особое внимание уделяется исследовательским инструментам, демонстрирующим каким образом производительность биосенсоров эволюционировала классических электрохимических методов до оптического/визуального выявления, полимеров, оксида кремния, стекла и наноматериалов, применяемых для улучшения порога обнаружения, чувствительности и избирательности. Интересен тот факт, что микроорганизмы и биолюминесценция в целом применялись в разработке биосенсоров на основе меток, тогда как не использующие меток биосенсоры подразумевают использование устройств на основе транзисторов или конденсаторов и наноматериалов. Биосенсоры предоставляют базу для понимания технологических улучшений в сфере измерительных приборов, включающих сложные аппараты с высокой пропускной способностью, применяемые в количественной биологии, и портативные количественные и полуколичественные устройства для непрофессионального применения. Помимо этого в статье освещены, современные исследовательские тенденции, будущие задачи и ограничения данной сферы. Данные обзор разделен на подразделы, описывающие две основные технические стратегии, а также различные типы биосенсоров, в том числе электрохимических и оптических/визуальных, а также использующих полимеры, оксид кремния, стекло и наноматериалы. Эти устройства разрабатывались для специфичных целей, и данный обзор предоставляет читателям исчерпывающую информацию о биосенсорных устройствах и областях их применения.
Технические стратегии
Технические стратегии, применяемые для разработки биосенсоров, основаны на выявлении биомаркеров с использованием и без использования меток. Выявление с использованием меток основано преимущественно на специфичных свойствах метящих соединений, применяемых для прицельного выявления. Биосенсоры такого типа надежны, однако часто требуют комбинации специфичных чувствительных элементов, изготавливаемых с использованием иммобилизованного белка-мишени. С другой стороны, не использующий меток метод позволяет выявлять молекулы-мишени, не пригодные для мечения. Последние междисциплинарные подходы в области биотехнологии и биоинженерии, электротехники и электроники проложили дорогу разработке не использующих метки биосенсоров для различных методов выявления с широким спектром направлений применения в области медицины и науки об окружающей среде.
Электрохимические биосенсоры
Уже ставшее классикой создание глюкометра на основе глюкозооксидазных биосенсоров является первым шагом в истории разработки электрохимических биосенсоров. Глюкозные биосенсоры очень популярны в клиниках и диагностических учреждениях, так как они необходимы для периодического мониторинга уровня глюкозы в крови пациентов с сахарным диабетом. Однако эти биосенсоры имеют недостатки в силу нестабильной активности или негомогенности фермента, обуславливающей важность дополнительной калибровки. Фактически эти потенциальные недостатки привели к разработке спектра биомолекул, обладающих различными электрохимическими свойствами, что обусловило появление более стабильно работающих биосенсоров глюкозы. В последнее время электрохимические биосенсоры, как правило, изготавливаются путем модифицирования поверхности металлических и углеродных электродов с использованием биоматериалов, таких как ферменты, антитела или ДНК. Выходной сигнал биосенсора обычно генерируется в результате специфичных реакций связывания или каталитических реакций между материалами на поверхности электрода. Необходимость разработки электрохимических сенсоров стала особенно актуальна для клинической диагностики заболеваний, в которых большое значение имеет раннее выявление или мониторинг. В данном контексте для разработки не-ферментативных биосенсоров вместо белков рассматриваются синтетические материалы. Интересен тот факт, что различные типы биомолекул обладают разной стабильностью и избирательностью, что в конечном итоге позволяет разрабатывать новые типы электрохимических биосенсоров для разных целей. В зависимости от сферы применения были разработаны разные типы электрохимических биосенсоров, а биосенсоры глюкозы претерпели стремительную эволюцию.
Еще одним современным изобретением является биохимический сенсор для оценки уровней активных форм кислорода в физиологических системах. Важным областью применения данного направления представляется выявление мочевой кислоты как наиболее важного конечного продукта метаболизма пурина в биологических жидкостях организма, которое может выступать в роли инструмента для диагностики различных клинических аномалий и заболеваний. Однако исключительно важной задачей является разработка экономически эффективного и чувствительного метода. Аналогично ситуации с количественным измерением уровня глюкозы, электрохимический подход к оценке уровня окисления мочевой кислоты выглядит идеальным претендентом. Однако сходство с точки зрения окислительных процессов мочевой кислоты с аскорбиновой кислотой серьезно затрудняет разработку высокочувствительного электрохимического биосенсора. Для преодоления этой проблемы авторы разработали биосенсор на основе амперометрического выявления (amperometric detection), позволяющего измерять как восстановительный, так и окислительный потенциалы. Учитывая стоимость и воспроизводимость данной процедуры, важным моментом является иммобилизация или нанесение ферментов на поверхность обычных электродов или электродов на основе наноматериалов, идеальных для разработки одноразовых избирательных, экономически эффективных и чувствительных биосенсоров для рутинного измерения уровней мочевой кислоты. В этом отношении очень перспективными выглядят недавние достижения в области трехмерной биопечати, целью которых является создание биосенсоров на основе живых клеток, инкапсулированных в трехмерное микроокружение. К этому же направлению относится недавно разработанный беспроводной биосенсор-капа для непрерывного определения в режиме реального времени концентрации мочевой кислоты в слюне. Эта технология может быть использована в разработке пригодных для ношения на теле устройств, для мониторинга различных параметров состояния здоровья. Электрохимические сенсоры уже успешно применялись для измерения уровня гормонов, однако перспективы применения данного подхода еще требуют детального рассмотрения. В основе еще одного потенциального направления технологических разработок в области биосенсоров лежит прицельное воздействие на нуклеиновые кислоты. Хорошо известно, что клеточная экспрессия малых интерферирующих РНК (миРНК) является идеальным биомаркером для диагностики манифестации болезни и воздействие на нее повышает эффективность генной терапии генетических заболеваний. Обычно миРНК выявляются с помощью нозерн-блоттинга, микрочипов и полимеразной цепной реакции (ПЦР). Современные технологии позволяют создавать идеальные электрохимические биосенсоры для выявления миРНК, принцип действия которых основан на безметочной идентификации реакции окисления гуанина, запускаемой формированием гибрида между миРНК и соответствующим зондом захвата на основе аналога инозина. Все эти изобретения появились благодаря современным подходам, применяемым для продвижения технологии электрохимических биосенсоров в биомедицине.
Мониторинг состояния окружающей среды является еще одним важным направлением, в котором технология биосенсоров востребована для быстрого выявления остаточных количеств пестицидов для устранения угрозы здоровью человека. Традиционные подходы, такие как высокопроизводительная жидкостная хроматография, капиллярный электрофорез и масс-спектрометрия, эффективны как методы выявления пестицидов в окружающей среде, однако они имеют ограничения, обусловленные сложностью реализации, большими временными затратами, потребностью в высокотехнологичных инструментах и эксплуатационными возможностями. Поэтому простые биосенсоры имеют огромное преимущество, но разработка унифицированного устройства для анализа различных классов пестицидов является очень сложной задачей. Для решения этой проблемы были разработаны биосенсоры на основе ферментов, а именно ингибитора ацетилхолинестеразы, позволяющие определять физиологической вклад пестицидов в окружающую среду, продовольственную безопасность и контроль качества. За последние 10-20 лет эта технология была еще более усовершенствована для быстрого проведения анализа с помощью методов иммобилизации и других стратегий изготовления. Аналогичным образом пьезоэлектрические биосенсоры были разработаны для выявления влияния на окружающую среду фосфаторганических и карбаминовокислых пестицидов. Известно, что хлорорганические пестициды оказывают неблагоприятное влияние на окружающую среду, при этом такие, как эндосульфан, могут наносить серьезный ущерб. Пестициды этого класса по-разному воздействуют на репродуктивную систему самцов и самок рыб. Учитывая этот факт, а также феномен биологического накапливания (биомагнификации), изобретение биосенсоров для анализа водных экосистем было бы очень полезно. Для того, чтобы удовлетворить эту потребность в области биосенсоров произошла революция, в рамках произошел быстрый прогресс в методах изготовления и использования наноматериалах, кварцевых кристаллов или диоксида кремния. Очень важно уделять особое внимание выбору рецепторов для разработки биосенсоров, использованию различных технологий преобразования сигнала и стратегий быстрого скрининга для применения в областях пищевой и экологической безопасности, а также мониторинга. Для достижения этого большое значение имеет изготовление биосенсоров; достижения в этой области четко описаны ниже.
Оптические/визуальные биосенсоры
Как описано выше, биомедицинские и экологические направления требуют разработки простых, быстро работающих и высокочувствительных биосенсоров. Это может быть реализовано с помощью иммобилайзеров, которые могут изготавливаться из золота, материалов на основе углерода, кварца или стекла. Фактически инкорпорирование золотых наночастиц или квантовых точек с использованием метода микротехнологии представляет собой новую технологию разработки высокочувствительных и портативных биосенсоров на основе фермента цитохрома Р450 для применения в определенных целях. Более того, оптоволоконные химические сенсоры очень актуальны для различных областей, таких как поиск новых лекарственных средств, биозондирования и биомедицины. В последнее время гидрогели, применявшиеся в качестве сенсоров на основе ДНК, приобретают популярность в качестве материалов для иммобилизации в оптоволоконной химии. По сравнению с другими материалами иммобилизация в гидрогеле происходит а трех измерениях, что обеспечивает загрузку большого количества чувствительных молекул. Гидрогели (полиакриламид) представляют собой гидрофильные полимеры с поперечными связями, которым для иммобилизации можно придавать разные формы, начиная от тонких пленок и заканчивая наночастицами. Гидрогели считаются простым субстратом для иммобилизации ДНК, обладающие рядом преимуществ, таких как возможность удержания молекул, их контролируемого высвобождения, обогащения аналитов и защиты ДНК. Эти характеристики уникальны для гидрогелей по сравнению с другими материалами, пригодными для биомолекулярной иммобилизации. Более того, хорошая оптическая прозрачность гидрогелей предоставляет возможность применения удобной стратегии визуального выявления. Методы иммобилизации ДНК-биосенсоров в монолитных полиакриламидных гелях и гелевых микрочастицах часто рассматриваются как техническое достижение в области биосенсорных технологий. Выявление единичных молекул для идентификации ДНК также стало возможным с помощью электрохимического окисления гидразина.
Биосенсоры на основе оксида кремния, кварца и стекла
Поиск новых методов разработки биосенсоров привел к использованию обладающих уникальными свойствами материалов из оксида кремния, кварца и стекла. Среди этих материалов особое место заниманию наноматериалы на основе оксида кремния, обладающие наиболее высоким потенциалом для использования в производстве биосенсоров благодаря своей биосовместимости, доступности, а также электронным, оптическим и механическим свойствам. Более того, такие материалы нетоксичны, что является очень важным условием для биомедицинских и биологических сфер применения. Материалы на основе оксида кремния могут использоваться для биовизуализации, биосенсорного анализа и в терапии рака. Помимо этого флуоресцирующие материалы на основе оксида кремния уже давно применяются в биовизуализации. Интересен тот факт, что нанопровода из оксида кремния в комбинации с золотыми наночастицами представляют собой гидридные структуры, применяемые в рамках революционных подходов к лечению рака. Ковалентное прикрепление модифицированных тиолом олигомеров ДНК к оксиду кремния или стеклу обеспечивает формирование ДНК-пленок, повышающих эффективность УФ-спектроскопии и методов гибридизации. Несмотря на множество преимуществ применения наночастиц из оксида кремния, существует целый ряд требующих решения сложностей, таких как разработка методов крупномасштабного малозатратного производства, а также биосовместимость после биомолекулярного контакта. Решение этих вопросов обеспечит возможность превращения наноматериалов на основе оксида кремния в компоненты современных биосенсоров. Не имеющие проводов и электродов биосенсоры на основе микровесов на кристалле кварца представляют собой еще одну платформу для анализа взаимодействий между биомолекулами с высокой чувствительностью. Пульсации кварцевых осцилляторов возбуждаются и регистрируются с помощью антенн через электромагнитные волны без проводных соединений. Это точное бесконтактное изменение является ключевым моментом для разработки ультравысокочувствительной идентификации белков в жидкости с помощью измерительных приборов на основе биосенсоров на кристаллах кварца. Уникальные характеристики материалов на основе оксида кремния, кварца или стекла позволили разработать несколько новых высокотехнологичных биосенсоров для усовершенствования измерительных приборов, применяемых в области биомедицинских технологий, однако их экономическая целесообразность и биологическая безопасность требуют внимания.
Биосенсоры на основе наноматериалов
Для иммобилизации биосенсоров используется широкий спектр наноматериалов, в том числе наночастицы золота, серебра, оксида кремния и меди, а также материалы на основе углерода, такие как графит, графен и углеродные нанотрубки. При разработке электрохимических и других биосенсоров материалы на основе наночастиц обеспечивают высокую чувствительность и специфичность. Среди металлических наночастиц для практического использования наиболее пригодны золотые наночастицы, устойчивые к окислению и практически нетоксичные. В то же время наночастицы из других металлов, таких как серебро, при введении в организм, например, для доставки препаратов, окисляются и оказывают токсичное действие. В целом применение наноматериалов в составе биомедицинских биосенсоров ассоциировано с потенциальными сложностями. Более того, стратегии усиления сигнала с помощью наночастиц имеют потенциальные преимущества и недостатки. Тем не менее, наноматериалы считаются важными компонентами биоаналитических устройств благодаря их способности повышать чувствительность и пороги обнаружения при детектировании единичных молекул. В данном контексте стоит упомянуть изобретение наночастиц на основе платины для электрохимической амплификации с одноуровневой реакцией для выявления низкой концентрации ДНК. Аналогичным образом полупроводниковые квантовые точки и нанокристаллы из оксида железа, обладающие как оптическими, так и магнитными свойствами, можно эффективно связывать с опухолеспецифичными лигандами, такими как моноклональные антитела, пептиды или малые молекулы, для прицельного воздействия на опухолевые антигены с высокой аффинностью и специфичностью. Технология квантовых точек может применяться в изучении опухолевого микроокружения при проведении терапии, а также для доставки нанопрепаратов.
Генетически закодированные или синтетические флуоресцентные биосенсоры
Разработка меченых биосенсоров с использованием генетически закодированной или синтетической флуоресценции предоставила возможность изучать биологические процессы, в том числе различные молекулярных пути внутри клетки. Фактически метод выявления меченых флуоресценцией антител впервые был разработан для получения изображений фиксированных клеток. Эта стратегия предоставила новые возможности разработки таких биосенсоров с использованием биологических белков и малых молекул, связывающихся с аналитами и вторичными мессенджерами. Впоследствии были разработаны флуоресцентные биосенсоры для анализа двигательных белков, использующие метод выявления единичных молекул при определенной концентрации аналита. Несмотря на эти преимущества, методология выявления и анализа метки выглядит сложной. Изобретение зеленого флуоресцирующего белка и других флуоресцирующих белков предоставило ряд преимуществ с точки зрения дизайна и эффективности оптического зонда. За последнее десятилетие генетически закодированные биосенсоры, специфичные к молекулам, вовлеченным в синтез энергии, активным формам кислорода и цАМФ, позволили лучше разобраться в физиологии митохондрий. цАМФ является важной сигнальной молекулой и терапевтической мишенью для сердечно-сосудистой системы. С учетом этого биосенсоры, функционирующие на основе метода резонансного переноса энергии флуоресценции, были разработаны для визуализации цГМФ, цАМФ и ионов кальцию внутри клетки. Некоторые из таких сенсоров эффективно применяются для in vivo визуализации в первичных культурах и живых клетках. На сегодняшний день проработано достаточно много аспектов разработки сенсоров для визуализации в условиях живого организма. Появившиеся в результате оптимизации таких подходов малоугловое рассеяние рентгеновский лучей для разработки кальциевых каналов и резонансный перенос энергии флуоресценции для выявления киназ признаны самыми лучшими биосенсорными методиками в современной физиологии. Таким образом был разработан ряд специфичных к определенным мишеням биосенсоров на основе микроорганизмов (микробов) и клеточных органелл. Как объяснялось ранее, электрохимические, электромеханические и оптические биосенсоры разрабатываются для более эффективного, по сравнению с другими молекулярными методиками, выявления миРНК. Появление in vivo визуализации с помощью биосенсоров малых молекул обеспечило возможность лучше разобраться в клеточной активности и механизмах действия многих других молекул, в том числе ДНК, РНК и миРНК. На сегодняшний день для трансформации в данной области требуется полногеномный подход, подразумевающий применение более эффективных генетических биосенсоров на основе оптики. На современном этапе считается, что оптические биосенсоры, комбинирующие технологии флуоресценции и малых молекул/наноматериалов, позволяют добиваться лучших результатом с точки зрения применимости и чувствительности.
Микробные биосенсоры, разработанные с помощью синтетической биологии и генетической/белковой инженерии
Более поздняя тенденция в области мониторинга состояния окружающей среды и биоремедиации (биологической очистки) подразумевает применение последних инновационных технологий, основанных на генетической/белковой инженерии и синтетической биологии, для программирования микроорганизмов, наделяя их специфичными выходными сигналами, чувствительность и избирательностью. Например, живые клетки, обладающие ферментативной активностью, обеспечивающей деградацию ксенобиотических соединений, будут иметь широкое применение в биоремедиации. Также были разработаны биосенсоры на микробном топливе для мониторинга биохимической потребности в кислороде и токсичности в окружающей среде. Бактерии обладают потенциалом деградировать органический субстрат и генерировать электричество для ферментации. По сути технология заключается в использовании биоэлектрохимического устройства, регулирующего силу микробного дыхания для конвертации органических субстратов непосредственно в электрическую энергию. Несмотря на эти возможности, ограничения применения микробных биосенсоров обусловлены низкой удельной мощностью с точки зрения себестоимости и эксплуатационных расходов. Специалистам удалось значительно улучшить производительность и снизить затраты с помощью новых системных подходов, что позволило создать на основе этих технологий платформу для разработки обладающих заданными свойствами микробных биосенсоров с автономным источником питания. Еще одной областью использования микробных биосенсоров является их применение для обнаружения пестицидов и тяжелых металлов, при котором эукариотические микроорганизмы имеют преимущество перед прокариотами. Это преимущественно обусловлено преимуществом разработки цельноклеточных биосенсоров для выявления токсичности пестицидов и тяжелых металлов с высокой избирательностью и чувствительностью. Помимо этого более сложные эукариотические микроорганизмы могут обладать более широким спектром чувствительности к различным токсичным молекулам и имеют большее сродство к высшим животным. Микробные биосенсоры имеют широкий спектр применения, начиная от мониторинга окружающей среды и заканчивая производством энергии. В будущем такие микробные биосенсоры будут иметь более широкое применение в мониторинге загрязнения окружающей среды тяжелыми металлами и экоэффективном производстве электроэнергии.
Технологическое сравнение биосенсоров
В предыдущих разделах статьи обсуждаются разные типы биосенсоров и их применение. В данном разделе представлено сравнение биосенсоров с точки зрения технологии, специфичности и порога обнаружения, диапазона линейности, продолжительности анализа, стоимости и портативности.
Инновации в области электрохимических сенсоров с высокой пропускной способностью, направленные на оптимизацию порога обнаружения, продолжительности анализа и портативности, обеспечили появление масштабных потребительских рынков недорогих биосенсоров, применяемых в качестве тестов на уровень глюкозы и беременность. Последний основан на использовании тест-полосок с мобилизованными антителами к хорионическому гонадотропину человека, выявляемому с помощью технологии иммунохроматографии. Иммобилизация аналитов с помощью полимеров и наноматериалов является ключом к улучшению чувствительности и порога обнаружения. С данной точки зрения, иммунохроматографический анализ на тест-полосках позволяет помещать образцы в заданное место для запуска специфичных взаимодействий, а не взаимодействий, происходящих случайным образом. Большая часть упомянутых выше биосенсоров основана на этой технологии, которая фактически проложила путь биопроизводству с использованием контактного и бесконтактного формирования. Использование для биопроизводства наноматериалов, таких как золото, серебро и оксид кремния, привело к появлению новых методов. Помимо этого нанесение полимерного покрытия на такие наноматериалы произвело революцию в сфере контактных электрохимических методов регистрации сигналов. Одним из основных преимуществ этого типа электрохимических сенсоров является чувствительность и специфичность при проведении анализа в режиме реального времени. Ограничениями в данном случае являются способность к регенерации или долгосрочное использование полимеров/других материалов, однако снижение стоимости делает такие электрохимические сенсоры более доступными. Выявление одного аналита с помощью методов контактной регистрации сигнала имеет огромные преимущества, например, возможность изменения концентрации молекул с высокой специфичностью в режиме реального времени. Для улучшения специфичности и чувствительности при выявлении единичных молекул были внедрены такие технологии, как резонансный перенос энергии флуоресценции, резонансный перенос энергии биолюменесценции, а также преобразователей на основе флуоресценции и плазмонного резонанса. При одновременном выявлении нескольких аналитов эти технологии имеют ограничения, обусловленные наложением эмиссии сигналов, однако методы, основанные на резонансном переносе энергии, часто применяют в таких ситуациях, что имеет очень большое значение для клинической диагностики из-за различий уровней биомаркеров у разных пациентов и при схожих патологиях. Применение микро- и нанокантилеверов в качестве преобразователей при биопроизводстве электрохимических сенсоров также более перспективно для одновременного выявления нескольких аналитов. Также хорошие результаты продемонстрировали неконтактные сенсоры, производимые методом трехмерной биопечати с помощью струйного или лазерного принтера. Тем не менее, необходимые затраты и адаптируемые возможности этих методов имеют серьезные ограничения. Интересно то, что большинство из этих биосенсоров с высокой пропускной способностью для выполнения специфичных целей комбинируют с методами электрохимической регистрации. Некоторые из наиболее достойных внимания портативных амперометрических электрохимических биосенсоров, работающих в режиме реального времени, были разработаны для диагностики заболеваний с использованием биологических жидкостей. В целом электрохимические биосенсоры в комбинации биопроизводством имеют низкий порог выявления для индивидуальных аналитов при проведении анализа в режиме реального времени, а также доступную цену, учитывая портативность устройства.
Оптические биосенсоры представляют собой еще одну важную технологию в области биосенсорного анализа, основывающуюся на применении оптоволоконной химии. Выявление индивидуальных молекул, например, ДНК или пептидов, наиболее эффективно при использовании перекрестно-сшитых гидрогелей, имеющих высокий коэффициент вместимости и гидрофильную природу. Были разработаны оптические биосенсоры для измерения количества ДНК, имеющие широкое применение в биомедицине и криминалистике. Комбинации биологических материалов, такие как фермент/субстрат, антитело/антиген и нуклеиновые кислоты совершили революцию в технологии оптических биосенсоров. Помимо этого в биосенсорную систему можно инкорпорировать микроорганизмы, животные или растительные клетки, а также срезы тканей. Недавние достижения в области молекулярной оптоэлектроники обусловили возможность появления оптических биометрических систем распознавания. Интегрированная оптическая технология позволяет инкорпорировать как пассивных, так и активных оптических компонентов в один и тот же субстрат для разработки минимизированных компактных регистрирующих устройств при производстве множества сенсоров на одном чипе. В данном контексте высококачественные полимеры используются для изготовления гибридных систем для оптических биосенсоров. Фактически технология оптических биосенсоров была усовершенствована с помощью современных инноваций в области анализа морфологии поверхностей с помощью высокотехнологичных электронной и атомно-силовой микроскопии. Не смотря на это, порог обнаружения оптических биосенсоров никогда не приближался к фемто-уровню из-за стоимости приборного оснащения и непортативности устройства. Современные оптические технологии с использованием наномеханических биосенсоров на основе микрокантилеверов или технологии поверхностного резонанса легли в основу инновационных ДНК-чипов, по крайней мере, для проведения специфичного и чувствительного анализа в режиме реального времени. Преимущества оптических биосенсоров главным образом заключаются в высокой скорости проведения анализа с устойчивостью сигнала к электрической или магнитной интерференции, а также потенциальном спектре предоставляемой информации. С другой стороны, основным недостатком является высокая стоимость, обусловленная определенными требованиями к оборудованию. Решение других технических проблем, таких как сложность иммобилизации, в особенности для биопроизводства, и необходимость стерильных условий, является критичным вопросом для получения максимальной пользы от оптических биосенсоров.
Биопроизводство медицинских устройств обеспечивает лучшие результаты с точки зрения массового производства биосенсоров. Электрохимические и оптические биосенсоры являются основными технологическими компонентами при разработке высококлассных биосенсоров. Серьезные достижения в области технологий микро- и нанопроизводства обеспечили возможность разработки механических устройств с движущимися деталями наноразмеров. Возможность производства таких структур с применением процедур обработки полупроводниковых материалов объединила биофизические и биоинженерные принципы в направлении прогресса микро- и наноэлектромеханических биосенсоров, пригодных для массового производства. Материалы на основе стекла, оксида кремния и кварца успешно используются после мечения флуоресцирующими агентами или золотыми наночастицами. Несмотря на то, что такие биосенсоры обладают более высокой точностью при выявлении индивидуальных молекул, их малозатратное массовое производство менее реально. Массовое производство сенсоров связано с рядом проблем, а именно со сложностью более прочного связывания агентов на наноуровне при производстве с помощью микроэлектронных технологий для высокоскоростного анализа. В этом отношении стоит упомянуть огромный потенциал применения полупроводниковых материалов и технологии квантовых точек. На сегодняшний день ни одна из существующих биосенсорных технологий не позволяет в режиме реального времени осуществлять одновременный количественный анализ больших массивов образцов, однако внедрение технологий производства кантилеверов в микро- и наномасштабах может сделать это реальностью.
Еще одним важным техническим переворотов в области биосенсоров стала возможность создания генетически закодированных или синтетических флуоресцентных биосенсоров для анализа молекулярных механизмов биологических процессов. Несмотря на то, что такие биосенсоры имеют огромные перспективы в области выявления отдельных молекул с измерением количества специфичного аналита, методология пробоподготовки и выявления очень сложна и требует высокотехнологичного оборудования. С точки зрения биоматериалов, хорошими характеристиками в плане высокой чувствительности и избирательности обладают биосенсоры, работающие микробиологических топливных элементах. Однако методы массовой продукции и генной инженерии, требующиеся для создания штамма микроорганизмов, очень сложны и затратны. В то же время, преимуществом микробных биосенсоров является возможность их использования в качестве инструмента для биоремедиации, что имеет большую значимость с точки зрения мониторинга состояния окружающей среды. Однако разработка и высвобождение в окружающую среду такого генетически модифицированного штамма микроорганизмов, помимо регулирования затрат на производство, должно подвергаться строгому контролю, соответствовать этическим требованиям, а также регулироваться законодательством.
В целом можно заявлять, что для создания высокочувствительных миниатюрных устройств требуется разработка различных микро- и нанобиосенсорных платформ с вовлечением интегрированных технологий, использующих электрохимический или оптический биоэлектронный принципы с комбинацией биомолекул или биологических материалов, полимеров и наноматериалов.
Современные исследовательские тенденции, будущие задачи и ограничения технологии биосенсоров
Интегрированные стратегии с использованием множества технологий, начиная от электрохимических, электромеханических и флюоресцентно-оптических биосенсоров и заканчивая генетически модифицированными микроорганизмами, являются современными методами разработки биосенсоров (таблица 1). Некоторые из этих биосенсоров имеют обширные перспективы применения для применения в диагностике заболеваний и медицине в целом (таблица 2). Потребности в использовании биосенсоров для быстрого экономически целесообразного анализа требуют биопроизводства, что позволит регистрировать биологическую активность на разных уровнях, начиная от клеточного из заканчивая уровнем живого организма, с высокой точностью и пределом чувствительности, стремящимся к отдельным молекулам. Помимо этого биосенсоры должны функционировать в сложных условиях. В данной ситуации требуется как двухмерное, так и трехмерное выявление с использованием сложных преобразователей для индентификации и количественной оценки исследуемых аналитов. В данном отношении было сделано несколько знаковых открытий в области контактного и бесконтактного структурирования на разных уровнях. Целью следующего уровня разработки должно быть создание более стабильных регенерирующих биосенсоров для длительного использования. Если это произойдет, появиться возможность создания новых диагностических биосенсоров, которые помогут врачам и пациентам в давнем стремлении к более интегративному пониманию механизмов развития болезней и эффектов терапии. С этой точки зрения, биосенсор на основе резонансного переноса энергии флуоресценции предоставляет возможность проведения превосходной диагностической процедуры по оценке эффективности терапии иматинибом по поводу хронической миелоидной лейкемии. Современное использование аптамеров, аффител, пептидных матриц и полимеров с молекулярными отпечатками представляет собой классические примеры проспективных исследовательских подходов в данной области. Определенные успехи также достигнуты с рядом потенциальных молекул для доставки новых лекарственных препаратов, в том числе антибиотиков. Разработки в данной сфере привелик появлению электрохимических биосенсоров, являющихся надежными аналитическими устройствами для выявления вируса-возбудителя так называемого птичьего гриппа в сложных средах. Более поздние публикации описывают потенциальное применение основанных на афинности биосенсоров в спортивной медицине и допинг-контроле. Также не так давно были подробно проанализированы возможности применения нательных электрохимических биосенсоров для неинвазивного скрининга электролитов и метаболитов в жидких средах организма в режиме реального времени для оценки состояния здоровья человека. Еще одним интересным направлением применения является оценка качества мясной и рыбной продукции с помощью гипоксантиновых биосенсоров. Разработка биосенсоров для выявления агентов биологического оружия, таких как бактерии, вирусы и токсины, производится с использованием различных технологий, в том числе электрохимической, нуклеиновых кислот, оптической и пьезоэлектрической, что позволит активно применять их не только в военной сфере и здравоохранении, но в области обороны и безопасности. В целом можно сказать, что комбинирование наноматериалов и полимеров с различными типами биосенсоров позволит разрабатывать гибридные устройства для эффективного использования в перечисленных выше отраслях. Помимо этого, научные достижения в области разработки микробных биосенсоров с использованием технологии синтетической биологии внесут большой вклад в мониторинг окружающей среды. Авторы данной статьи особенно подчеркивают важность использования микробиологических топливных элементов в разработке методов очистки и в качестве источника энергии для сенсоров, применяемых в мониторинге окружающей среды. В более широком смысле, авторы описывают различные типы биосенсоров, потенциальные возможности их применения и характеристики, такие как способность регистрировать аналит, время анализа, портативность, стоимость и адаптируемость (таблица 3).
Таблица 1. Список биосенсоров, принципов их работы и областей применения
|
№ |
Тип |
Принцип |
Области применения |
Биосенсор — это… Что такое Биосенсор?
Современный глюкометр для измерения уровня глюкозы в крови. Слева – игла для прокалывания кожи.Биосе́нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях[1]. В биосенсорах биологический компонент сочетается с физико-химическим преобразователем.
Биосенсоры состоят из трёх частей:
- биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д.), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии.
- преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д.), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить;
- связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде.[2].
Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАДН2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае, электрод является преобразователем, а фермент — биоселективным элементом.
С недавних пор, массивы из многих различных молекул детектора применяются в так называемых электронных носах, где наборы откликов от детекторов используются для определения веществ. Современные электронные носы, тем не менее, не используют биологический материал (то есть являются хемосенсорами).
Домашняя канарейка, которая применялась шахтерами для предупреждения об утечке газа, может считаться биосенсором. Многие из современных биосенсоров работают на том же принципе, то есть используют организмы, которые реагируют на значительно меньшие концентрации токсических веществ, чем это делает человек, предупреждая таким образом о присутствии яда. Эти приборы могут использоваться для экологического мониторинга, определения незначительных примесей нефтепродуктов и на сооружениях для очистки сточных вод.
Классификация биосенсоров
В зависимости от типа преобразователя, биосенсоры классифицируют на оптические, акустические, калориметрические, термические и электрохимические. Электрохимические биосенсоры, в свою очередь, делят на потенциометрические, амперометрические и кондуктометрические.[3]
Оптические биосенсоры
Значительная часть оптических биосенсоров основаны на явлении поверхностного плазмонного резонанса и используют свойство золотых и других материалов, а именно то, что тонкий слой золота, нанесенный на имеющую высокий коэффициент преломления стеклянную поверхность может абсорбировать лазерный свет, создавая электронные волны (поверхностные плазмоны) на золотой поверхности. Это происходит только при определенном угле падения и длине волны падающего света и в такой степени зависит от поверхности золотого слоя, что присоединение аналита к биологическому рецептору на поверхности этого слоя генерирует заметный сигнал. Сенсоры на основе поверхностного плазмонного резонанса представляют собой сенсорный чип, который состоит из пластиковой кассеты, несущей стеклянную тарелку, одна сторона которой покрыта микроскопическим слоем золота. Эта сторона взаимодействует с оптической распознающей аппаратурой прибора. Противоположная сторона тарелки соединяется с жидкостной проточной системой. Растворенные в жидкости реагенты могут непосредственно контактировать с поверхностью тарелки. Эта сторона стеклянного сенсорного чипа может быть различными путями модифицирована, позволяя легко присоединять интересующие молекулы. Обычно она покрыта карбоксиметилдекстраном или подобным веществом.
Свет с фиксированной длиной волны отражается от покрытой золотом стороны чипа под углом полного внутреннего отражения, и детектируется внутри прибора. Этот свет индуцирует исчезающую волну, которая проникает сквозь стеклянную тарелку в раствор вблизи её поверхности.
Коэффициент преломления проточной стороны сенсорного чипа прямо влияет на поведение света, отраженного от покрытой золотом стороны. Связывание веществ с поверхностью проточной стороны чипа влияет на коэффициент преломления, что можно зарегистрировать оптической аппаратурой; таким образом биологические взаимодействия могут быть измерены с высоким уровнем чувствительности.
Другие биосенсоры на основе исчезающей волны были коммерциализированы с использованием волноводов, в которых константа распространения света через волновод изменяется при абсорбции молекул на поверхность волновода. Например, в двойной поляризационной интерферометрии используются два волновода, один из которых изолирован и является эталонным, а второй волновод непосредственно контактирует с исследуемым образцом. Сравнивая константы скорости распространения света в обоих волноводах, делают заключение о концентрации аналита.
Другие оптические биосенсоры основаны в основном на изменении в абсорбции или флуоресценции соответствующего индикаторного компонента и не нуждаются в полном внутреннем отражении. Например, разработан полностью функционирующий прототип прибора для определения казеина в молоке. Прибор основан на обнаружении изменений в абсорбции золотого слоя.[4] Широко используемый в молекулярной биологии исследовательский инструмент, ДНК-микрочип, может также считаться оптическим биосенсором.
Электрохимические биосенсоры
Электрохимические биосенсоры обычно основаны на ферментативном катализе реакции, в которой освобождаются или поглощаются электроны (используемые ферменты принадлежат к классу оксидоредуктаз). Биосенсор обычно включает в себя три электрода: электрод сравнения, рабочий и вспомогательный. На поверхность рабочего электрода наносят биологический материал, который специфически вступает в реакцию с аналитом. Заряженные продукты реакции создают на рабочем электроде потенциал, который отнимается от потенциала на электроде сравнения для получения выходящего сигнала. Применяется также измерение силы тока (в этом случае интенсивность потока электронов пропорциональна концентрации аналита) при постоянном потенциале или потенциал можно измерять при нулевой силе тока (это даёт логарифмический отклик). Нужно отметить, что на потенциал электродов влияет заряд их окружения, что часто используется. Более того, возможно прямое электрическое определение небольших пептидов и белков по характерному для них заряду, используя биологически модифицированные ион-селективные полевые транзисторы (ИСПТ).[5]
Другие типы биосенсоров
В пьезоэлектрических сенсорах используются кристаллы, которые эластически деформируются при воздействии на них электрического потенциала. Переменный потенциал при определённой частоте вызывает стоячую волну в кристалле. Эта частота в значительной степени зависит от эластичных свойств кристалла, поэтому, если кристалл покрыт биологическим распознающим элементом, присоединение большого количества аналита к рецептору приведет к изменению резонансной частоты, что и служит сигналом о связывании.
Термические и магнитные биосенсоры практически не распространены.
Ссылки
- ↑ biosensor // IUPAC Gold Book
- ↑ Cavalcanti A, Shirinzadeh B, Zhang M, Kretly LC (2008). «Nanorobot Hardware Architecture for Medical Defense». Sensors 8 (5): 2932–2958. DOI:10.3390/s8052932.
- ↑ Дзядевич С.В., Солдаткін О.П. Наукові та технологічні засади створення мініатюрних електрохімічних біосенсорів. — 1-е изд. — Киев: Наукова думка, 2006. — С. 3, 6. — 256 с. — ISBN 966-00-0595-4
- ↑ H. M. Hiep et al. «A localized surface plasmon resonance based immunosensor for the detection of casein in milk» Sci. Technol. Adv. Mater. 8 (2007) 331 free download
- ↑ S.Q. Lud, M.G. Nikolaides, I. Haase, M. Fischer and A.R. Bausch (2006).»Field Effect of Screened Charges: Electrical Detection of Peptides and Proteins by a Thin Film Resistor» ChemPhysChem 7(2), 379-384 [1]
Биосенсор — Википедия. Что такое Биосенсор
Современный глюкометр для измерения уровня глюкозы в крови. Слева – игла для прокалывания кожи.Биосе́нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях[1]. В биосенсорах биологический компонент сочетается с физико-химическим преобразователем.
Биосенсоры состоят из трёх частей:
- биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д.), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии.
- преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д.), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить;
- связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде.[2].
Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАД·Н2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае электрод является преобразователем, а фермент — биоселективным элементом.
С недавних пор массивы из многих различных молекул детектора применяются в так называемых электронных носах, где наборы откликов от детекторов используются для определения веществ. Современные электронные носы, тем не менее, не используют биологический материал (то есть являются хемосенсорами).
Домашняя канарейка, которая применялась шахтерами для предупреждения об утечке газа, может считаться биосенсором. Многие из современных биосенсоров работают на том же принципе, то есть используют организмы, которые реагируют на значительно меньшие концентрации токсических веществ, чем это делает человек, предупреждая таким образом о присутствии яда. Эти приборы могут использоваться для экологического мониторинга, определения незначительных примесей нефтепродуктов и на сооружениях для очистки сточных вод.
Классификация биосенсоров
В зависимости от типа преобразователя, биосенсоры классифицируют на оптические, акустические, калориметрические, термические и электрохимические. Электрохимические биосенсоры, в свою очередь, делят на потенциометрические, амперометрические и кондуктометрические.[3]
Оптические биосенсоры
Значительная часть оптических биосенсоров основаны на явлении поверхностного плазмонного резонанса и используют свойство золотых и других материалов, а именно то, что тонкий слой золота, нанесенный на имеющую высокий коэффициент преломления стеклянную поверхность может абсорбировать лазерный свет, создавая электронные волны (поверхностные плазмоны) на золотой поверхности. Это происходит только при определенном угле падения и длине волны падающего света и в такой степени зависит от поверхности золотого слоя, что присоединение аналита к биологическому рецептору на поверхности этого слоя генерирует заметный сигнал. Сенсоры на основе поверхностного плазмонного резонанса представляют собой сенсорный чип, который состоит из пластиковой кассеты, несущей стеклянную тарелку, одна сторона которой покрыта микроскопическим слоем золота. Эта сторона взаимодействует с оптической распознающей аппаратурой прибора. Противоположная сторона тарелки соединяется с жидкостной проточной системой. Растворенные в жидкости реагенты могут непосредственно контактировать с поверхностью тарелки. Эта сторона стеклянного сенсорного чипа может быть различными путями модифицирована, позволяя легко присоединять интересующие молекулы. Обычно она покрыта карбоксиметилдекстраном или подобным веществом.
Свет с фиксированной длиной волны отражается от покрытой золотом стороны чипа под углом полного внутреннего отражения, и детектируется внутри прибора. Этот свет индуцирует исчезающую волну, которая проникает сквозь стеклянную тарелку в раствор вблизи её поверхности.
Коэффициент преломления проточной стороны сенсорного чипа прямо влияет на поведение света, отраженного от покрытой золотом стороны. Связывание веществ с поверхностью проточной стороны чипа влияет на коэффициент преломления, что можно зарегистрировать оптической аппаратурой; таким образом биологические взаимодействия могут быть измерены с высоким уровнем чувствительности.
Другие биосенсоры на основе исчезающей волны были коммерциализированы с использованием волноводов, в которых константа распространения света через волновод изменяется при абсорбции молекул на поверхность волновода. Например, в двойной поляризационной интерферометрии используются два волновода, один из которых изолирован и является эталонным, а второй волновод непосредственно контактирует с исследуемым образцом. Сравнивая константы скорости распространения света в обоих волноводах, делают заключение о концентрации аналита.
Оптические биосенсоры основаны в основном на изменении в абсорбции или флуоресценции соответствующего индикаторного компонента и не нуждаются в полном внутреннем отражении. Например, разработан полностью функционирующий прототип прибора для определения казеина в молоке. Прибор основан на обнаружении изменений в абсорбции золотого слоя.[4] Широко используемый в молекулярной биологии исследовательский инструмент, ДНК-микрочип, может также считаться оптическим биосенсором.
Электрохимические биосенсоры
Электрохимические биосенсоры обычно основаны на ферментативном катализе реакции, в которой освобождаются или поглощаются электроны (используемые ферменты принадлежат к классу оксидоредуктаз). Биосенсор обычно включает в себя три электрода: электрод сравнения, рабочий и вспомогательный. На поверхность рабочего электрода наносят биологический материал, который специфически вступает в реакцию с аналитом. Заряженные продукты реакции создают на рабочем электроде потенциал, который отнимается от потенциала на электроде сравнения для получения выходящего сигнала. Применяется также измерение силы тока (в этом случае интенсивность потока электронов пропорциональна концентрации аналита) при постоянном потенциале или потенциал можно измерять при нулевой силе тока (это даёт логарифмический отклик). Нужно отметить, что на потенциал электродов влияет заряд их окружения, что часто используется. Более того, возможно прямое электрическое определение небольших пептидов и белков по характерному для них заряду, используя биологически модифицированные ион-селективные полевые транзисторы (ИСПТ).[5]
Другие типы биосенсоров
В пьезоэлектрических сенсорах используются кристаллы, которые эластически деформируются при воздействии на них электрического потенциала. Переменный потенциал при определённой частоте вызывает стоячую волну в кристалле. Эта частота в значительной степени зависит от эластичных свойств кристалла, поэтому, если кристалл покрыт биологическим распознающим элементом, присоединение большого количества аналита к рецептору приведет к изменению резонансной частоты, что и служит сигналом о связывании.
Термические и магнитные биосенсоры практически не распространены.
См. также
Примечания
- ↑ biosensor // IUPAC Gold Book
- ↑ Cavalcanti A, Shirinzadeh B, Zhang M, Kretly LC (2008). «Nanorobot Hardware Architecture for Medical Defense». Sensors 8 (5): 2932–2958. DOI:10.3390/s8052932.
- ↑ Дзядевич С.В., Солдаткін О.П. Наукові та технологічні засади створення мініатюрних електрохімічних біосенсорів. — 1-е изд. — Киев: Наукова думка, 2006. — С. 3, 6. — 256 с. — ISBN 966-00-0595-4.
- ↑ H. M. Hiep et al. «A localized surface plasmon resonance based immunosensor for the detection of casein in milk» Sci. Technol. Adv. Mater. 8 (2007) 331 free download
- ↑ S.Q. Lud, M.G. Nikolaides, I. Haase, M. Fischer and A.R. Bausch (2006).»Field Effect of Screened Charges: Electrical Detection of Peptides and Proteins by a Thin Film Resistor» ChemPhysChem 7(2), 379-384 [1]
Литература
- Баника Ф.-Г., Химические и биологические сенсоры: основы и применения. Техносфера, Москва, 2014г; Цена: 869. ISBN 978-5-94836-380-6
- Будников Г.К. Биосенсоры как новый тип аналитических устройств // Соросовский образовательный журнал, 1996, № 12, c. 26-32.
- Варфоломеев С.Д. Биосенсоры // Соросовский образовательный журнал, 1997, № 1, c. 45-49.
- Компанец О.Н. Портативные оптические биосенсоры для определения биологически активных и токсичных соединений // Успехи физических наук, 2004, т. 174, № 6, c. 684-686.
- Воронов В. К., Подоплелов А. В. Физика на переломе тысячелетий: конденсированное состояние, 2-е изд., М.: ЛКИ, 2012, 336 стр., ISBN 978-5-382-01365-7
Биосенсор — Википедия. Что такое Биосенсор
Современный глюкометр для измерения уровня глюкозы в крови. Слева – игла для прокалывания кожи.Биосе́нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях[1]. В биосенсорах биологический компонент сочетается с физико-химическим преобразователем.
Биосенсоры состоят из трёх частей:
- биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д.), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии.
- преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д.), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить;
- связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде.[2].
Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАД·Н2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае электрод является преобразователем, а фермент — биоселективным элементом.
С недавних пор массивы из многих различных молекул детектора применяются в так называемых электронных носах, где наборы откликов от детекторов используются для определения веществ. Современные электронные носы, тем не менее, не используют биологический материал (то есть являются хемосенсорами).
Домашняя канарейка, которая применялась шахтерами для предупреждения об утечке газа, может считаться биосенсором. Многие из современных биосенсоров работают на том же принципе, то есть используют организмы, которые реагируют на значительно меньшие концентрации токсических веществ, чем это делает человек, предупреждая таким образом о присутствии яда. Эти приборы могут использоваться для экологического мониторинга, определения незначительных примесей нефтепродуктов и на сооружениях для очистки сточных вод.
Классификация биосенсоров
В зависимости от типа преобразователя, биосенсоры классифицируют на оптические, акустические, калориметрические, термические и электрохимические. Электрохимические биосенсоры, в свою очередь, делят на потенциометрические, амперометрические и кондуктометрические.[3]
Оптические биосенсоры
Значительная часть оптических биосенсоров основаны на явлении поверхностного плазмонного резонанса и используют свойство золотых и других материалов, а именно то, что тонкий слой золота, нанесенный на имеющую высокий коэффициент преломления стеклянную поверхность может абсорбировать лазерный свет, создавая электронные волны (поверхностные плазмоны) на золотой поверхности. Это происходит только при определенном угле падения и длине волны падающего света и в такой степени зависит от поверхности золотого слоя, что присоединение аналита к биологическому рецептору на поверхности этого слоя генерирует заметный сигнал. Сенсоры на основе поверхностного плазмонного резонанса представляют собой сенсорный чип, который состоит из пластиковой кассеты, несущей стеклянную тарелку, одна сторона которой покрыта микроскопическим слоем золота. Эта сторона взаимодействует с оптической распознающей аппаратурой прибора. Противоположная сторона тарелки соединяется с жидкостной проточной системой. Растворенные в жидкости реагенты могут непосредственно контактировать с поверхностью тарелки. Эта сторона стеклянного сенсорного чипа может быть различными путями модифицирована, позволяя легко присоединять интересующие молекулы. Обычно она покрыта карбоксиметилдекстраном или подобным веществом.
Свет с фиксированной длиной волны отражается от покрытой золотом стороны чипа под углом полного внутреннего отражения, и детектируется внутри прибора. Этот свет индуцирует исчезающую волну, которая проникает сквозь стеклянную тарелку в раствор вблизи её поверхности.
Коэффициент преломления проточной стороны сенсорного чипа прямо влияет на поведение света, отраженного от покрытой золотом стороны. Связывание веществ с поверхностью проточной стороны чипа влияет на коэффициент преломления, что можно зарегистрировать оптической аппаратурой; таким образом биологические взаимодействия могут быть измерены с высоким уровнем чувствительности.
Другие биосенсоры на основе исчезающей волны были коммерциализированы с использованием волноводов, в которых константа распространения света через волновод изменяется при абсорбции молекул на поверхность волновода. Например, в двойной поляризационной интерферометрии используются два волновода, один из которых изолирован и является эталонным, а второй волновод непосредственно контактирует с исследуемым образцом. Сравнивая константы скорости распространения света в обоих волноводах, делают заключение о концентрации аналита.
Оптические биосенсоры основаны в основном на изменении в абсорбции или флуоресценции соответствующего индикаторного компонента и не нуждаются в полном внутреннем отражении. Например, разработан полностью функционирующий прототип прибора для определения казеина в молоке. Прибор основан на обнаружении изменений в абсорбции золотого слоя.[4] Широко используемый в молекулярной биологии исследовательский инструмент, ДНК-микрочип, может также считаться оптическим биосенсором.
Электрохимические биосенсоры
Электрохимические биосенсоры обычно основаны на ферментативном катализе реакции, в которой освобождаются или поглощаются электроны (используемые ферменты принадлежат к классу оксидоредуктаз). Биосенсор обычно включает в себя три электрода: электрод сравнения, рабочий и вспомогательный. На поверхность рабочего электрода наносят биологический материал, который специфически вступает в реакцию с аналитом. Заряженные продукты реакции создают на рабочем электроде потенциал, который отнимается от потенциала на электроде сравнения для получения выходящего сигнала. Применяется также измерение силы тока (в этом случае интенсивность потока электронов пропорциональна концентрации аналита) при постоянном потенциале или потенциал можно измерять при нулевой силе тока (это даёт логарифмический отклик). Нужно отметить, что на потенциал электродов влияет заряд их окружения, что часто используется. Более того, возможно прямое электрическое определение небольших пептидов и белков по характерному для них заряду, используя биологически модифицированные ион-селективные полевые транзисторы (ИСПТ).[5]
Другие типы биосенсоров
В пьезоэлектрических сенсорах используются кристаллы, которые эластически деформируются при воздействии на них электрического потенциала. Переменный потенциал при определённой частоте вызывает стоячую волну в кристалле. Эта частота в значительной степени зависит от эластичных свойств кристалла, поэтому, если кристалл покрыт биологическим распознающим элементом, присоединение большого количества аналита к рецептору приведет к изменению резонансной частоты, что и служит сигналом о связывании.
Термические и магнитные биосенсоры практически не распространены.
См. также
Примечания
- ↑ biosensor // IUPAC Gold Book
- ↑ Cavalcanti A, Shirinzadeh B, Zhang M, Kretly LC (2008). «Nanorobot Hardware Architecture for Medical Defense». Sensors 8 (5): 2932–2958. DOI:10.3390/s8052932.
- ↑ Дзядевич С.В., Солдаткін О.П. Наукові та технологічні засади створення мініатюрних електрохімічних біосенсорів. — 1-е изд. — Киев: Наукова думка, 2006. — С. 3, 6. — 256 с. — ISBN 966-00-0595-4.
- ↑ H. M. Hiep et al. «A localized surface plasmon resonance based immunosensor for the detection of casein in milk» Sci. Technol. Adv. Mater. 8 (2007) 331 free download
- ↑ S.Q. Lud, M.G. Nikolaides, I. Haase, M. Fischer and A.R. Bausch (2006).»Field Effect of Screened Charges: Electrical Detection of Peptides and Proteins by a Thin Film Resistor» ChemPhysChem 7(2), 379-384 [1]
Литература
- Баника Ф.-Г., Химические и биологические сенсоры: основы и применения. Техносфера, Москва, 2014г; Цена: 869. ISBN 978-5-94836-380-6
- Будников Г.К. Биосенсоры как новый тип аналитических устройств // Соросовский образовательный журнал, 1996, № 12, c. 26-32.
- Варфоломеев С.Д. Биосенсоры // Соросовский образовательный журнал, 1997, № 1, c. 45-49.
- Компанец О.Н. Портативные оптические биосенсоры для определения биологически активных и токсичных соединений // Успехи физических наук, 2004, т. 174, № 6, c. 684-686.
- Воронов В. К., Подоплелов А. В. Физика на переломе тысячелетий: конденсированное состояние, 2-е изд., М.: ЛКИ, 2012, 336 стр., ISBN 978-5-382-01365-7
Первый биосенсор был изобретен в 1950 году американским биохимиком Л. Л. Кларком. Этот биосенсор используется для измерения кислорода в крови, а электрод, используемый в этом датчике, называется электродом Кларка или кислородным электродом. После этого на кислородный электрод наносили гель с ферментом, окисляющим глюкозу, для вычисления уровня сахара в крови. Соответственно, фермент уреазу использовали с электродом, который был изобретен специально для ионов Nh5 ++, для расчета мочевины в жидкостях организма, таких как моча и кровь.
На рынке доступно три поколения биосенсоров. В биосенсоре первого типа реакция продукта рассеивается на сенсор и вызывает электрическую реакцию. Во втором типе датчик включает в себя, в частности, посредники между датчиком и откликом для получения лучшего отклика. В третьем типе ответ сам вызывает реакцию, и никакой посредник не участвует напрямую. В этой статье дается обзор биосенсора, рабочих биосенсоров, различных типов и его применения.
Что такое биосенсор?
Биосенсоры можно определить как аналитические устройства, которые включают в себя комбинацию биологических детектирующих элементов, таких как сенсорная система и преобразователь. Когда мы сравниваем с любым другим существующим в настоящее время диагностическим устройством, эти датчики являются передовыми как в условиях селективности, так и чувствительности. применений этих биосенсоров в основном включает проверку контроля загрязнения окружающей среды в сельском хозяйстве, а также в пищевой промышленности.Основными особенностями биосенсоров являются стабильность, стоимость, чувствительность и воспроизводимость.
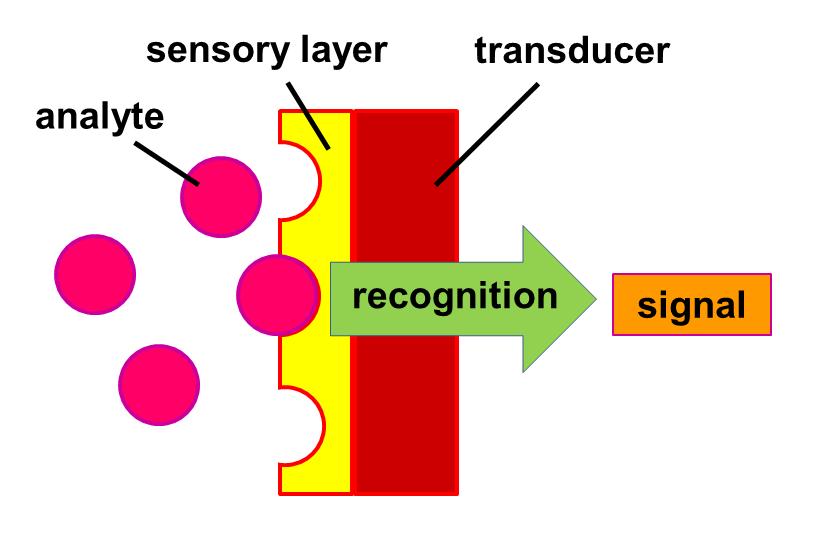
 Источник изображения
Источник изображения Основные компоненты биосенсора
Блок-схема биосенсора включает в себя три сегмента, а именно: датчик, преобразователь и связанные электроны. В первом сегменте датчик является чувствительной биологической частью, второй сегмент является частью детектора, которая изменяет результирующий сигнал от контакта с анализируемым веществом и для результатов он отображает доступным способом.Последняя секция содержит усилитель, который известен как схема формирования сигнала, блок отображения, а также процессор.
 Источник изображения
Источник изображения Принцип работы биосенсоров
Обычно определенный фермент или предпочтительный биологический материал деактивируется некоторыми из обычных методов, и деактивированный биологический материал находится в непосредственном контакте с датчиком. Аналит соединяется с биологическим объектом, чтобы сформировать чистый аналит, который в свою очередь дает электронную реакцию, которая может быть рассчитана.В некоторых примерах аналит заменяется устройством, которое может быть связано с разрядом газа, тепла, электронных ионов или ионов водорода. При этом преобразователь может изменять преобразованное устройство в электрические сигналы, которые могут быть изменены и рассчитаны.
Работа биосенсоров
Электрический сигнал преобразователя часто низкий и накладывается на довольно высокий базовый уровень. Обычно обработка сигнала включает в себя вычитание базового сигнала положения, полученного от связанного преобразователя без какого-либо покрытия биокатализатора.


Сравнительно медленный характер реакции биосенсора значительно облегчает проблему фильтрации электрического шума. На этом этапе прямой выход будет аналоговым сигналом, однако он преобразуется в цифровую форму и принимается в микропроцессорной фазе, где информация передается, зависит от предпочтительных единиц и o / p для хранилища данных.
Типы биосенсоров
Различные типы биосенсоров классифицируются на основе сенсорного устройства, а также биологического материала, который обсуждается ниже.
1. Электрохимический биосенсор
Как правило, электрохимический биосенсор основан на реакции ферментативного катализа, который потребляет или генерирует электроны. Такие типы ферментов называются окислительно-восстановительными ферментами. Подложка этого биосенсора обычно включает три электрода, такие как счетчик, эталон и рабочий тип.
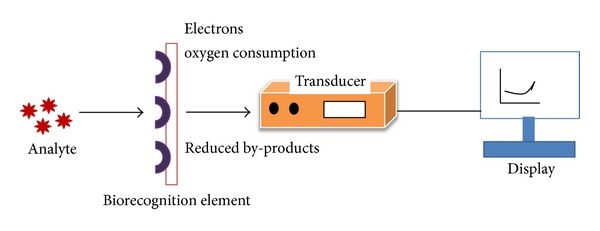
 Источник изображения
Источник изображения Анализируемый объект участвует в отклике, который происходит на поверхности активного электрода, и эта реакция может также вызывать перенос электронов через потенциал двойного слоя.Ток можно рассчитать при заданном потенциале.
Электрохимические биосенсоры подразделяются на четыре типа
- Амперометрические биосенсоры
- Потенциометрические биосенсоры
- Импедиметрические биосенсоры
- Вольтамперометрические биосенсоры
2. Амперометрический биосенсор
содержит встроенный амперометрический биосенсор количество тока, вытекающего из окисления, предлагающего точную количественную аналитическую информацию.
Как правило, эти биосенсоры имеют время реакции, энергетические диапазоны и чувствительность, сопоставимые с потенциометрическими биосенсорами. Простой амперометрический биосенсор, который часто используется, включает электрод «Clark кислород».

 Источник изображения
Источник изображения Правило этого биосенсора основано на величине потока тока между противоэлектродом и работой, которая поддерживается окислительно-восстановительной реакцией на рабочем электроде. Выбор аналитических центров важен для широкого спектра применений, включая высокопроизводительный скрининг лекарственных средств, контроль качества, поиск и устранение проблем, а также биологическую проверку.
3. Потенциометрические биосенсоры
Этот тип биосенсора обеспечивает логарифмический ответ посредством большого энергетического диапазона. Эти биосенсоры часто комплектуются монитором, производящим прототипы электродов, лежащие на синтетической подложке, покрытой работающим полимером с некоторым количеством фермента.

 Источник изображения
Источник изображения Они состоят из двух электродов, которые чрезвычайно чувствительны и прочны. Они позволяют распознавать анализируемые вещества на стадиях до того, как это будет достигнуто только с помощью ВЭЖХ, ЖХ / МС и без точной подготовки модели.
Все типы биосенсоров, как правило, занимают наименьшее количество пробоподготовки, поскольку биологический детектирующий компонент чрезвычайно разборчив в использовании для проблемного аналита. В результате изменений физического и электрохимического сигналов в слое проводящего полимера будет генерироваться сигнал из-за модификации, происходящей снаружи биосенсора.
Эти изменения могут быть отнесены к ионной силе, гидратации, pH и окислительно-восстановительным реакциям, позже как метка фермента, вращающегося над субстратом.В полевых транзисторах клемма затвора была изменена антителом или ферментом, что также может ощущать очень низкую концентрацию различных аналитов, потому что требуемый аналит к терминалу затвора вносит изменения в ток утечки к источнику.
4. Импедиметрические биосенсоры
EIS (электрохимическая импедансная спектроскопия) является чувствительным индикатором для широкого спектра физических и химических свойств. В настоящее время наблюдается тенденция к расширению импедиметрических биосенсоров.Методы Impedimetric были выполнены, чтобы дифференцировать изобретение биосенсоров, а также исследовать катализируемые реакции ферментов лектинов, нуклеиновых кислот, рецепторов, целых клеток и антител.

 Источник изображения
Источник изображения 5. Вольтамперометрический биосенсор
Это сообщение является основой нового вольтамперометрического биосенсора для обнаружения акриламида. Этот биосенсор был построен на угольном клеевом электроде, настроенном на Hb (гемоглобин), который включает четыре простатические группы рубца (Fe).Этот тип электрода показывает обратимую процедуру окисления или восстановления Hb (Fe).
Физический биосенсор
В условиях классификации физические биосенсоры являются наиболее фундаментальными, а также широко используемыми датчиками. Основные идеи, лежащие в основе этой категоризации, также возникают в результате изучения человеческого разума. Поскольку общий метод работы интеллекта слуха, зрения, осязания заключается в том, чтобы реагировать на внешние физические раздражители, поэтому любое детектирующее устройство, которое предлагает реакцию на физическое владение средой, было названо физическим биосенсором.
Физические биосенсоры подразделяются на два типа, а именно: пьезоэлектрический биосенсор и термометрический биосенсор.
Пьезоэлектрические биосенсоры
Эти датчики представляют собой набор аналитических устройств, которые работают по закону «регистрации взаимодействия аффинности». Платформа пьезоэлемента представляет собой чувствительный элемент, работающий по закону преобразования колебаний за счет скачка сбора на поверхности пьезоэлектрического кристалла. В этом анализе биосенсоры имеют свою модифицированную поверхность с антигеном или антителом, полимер с молекулярной печатью и наследственную информацию.Заявленные детали обнаружения обычно объединяются с помощью наночастиц.

 Источник изображения
Источник изображения Термометрический биосенсор
Существуют различные типы биологических реакций, которые связаны с изобретением тепла, и это составляет основу термометрических биосенсоров. Эти датчики обычно называют тепловыми биосенсорами.

 Источник изображения
Источник изображения Термометрический биосенсор используется для измерения или оценки уровня холестерина в сыворотке.Поскольку холестерин окисляется за счет фермента окисления холестерина, то будет выделяться тепло, которое можно рассчитать. Точно так же с помощью этих биосенсоров можно проводить оценку глюкозы, мочевины, мочевой кислоты и пенициллина G.
Оптический биосенсор
Оптический биосенсор — это устройство, использующее принцип оптического измерения. Они используют волоконную оптику, а также оптоэлектронные преобразователи. Термин оптрод представляет собой сжатие двух терминов: оптический и электродный.Эти датчики в основном включают антитела и ферменты, такие как трансдуцирующие элементы.

 Источник изображения
Источник изображения Оптические биосенсоры обеспечивают безопасное неэлектрическое недоступное зондирование оборудования. Дополнительным преимуществом является то, что они часто не нуждаются в эталонных датчиках, потому что сравнительный сигнал может быть получен с использованием источника света, подобного датчику выборки. Оптические биосенсоры подразделяются на два типа, а именно биосенсор прямого оптического обнаружения и маркированный биосенсор оптического обнаружения.
Носимые биосенсоры
Носимый биосенсор — это цифровое устройство, используемое для ношения на теле человека в различных носимых системах, таких как умные часы, умные рубашки, татуировки, которые позволяют определять уровень глюкозы в крови, АД, частоту сердцебиения, и т. д.

 Источник изображения
Источник изображения В настоящее время мы можем заметить, что эти датчики сигнализируют об улучшении в мире. Их лучшее использование и простота могут дать первоначальный уровень опыта в фитнес-статус пациента в режиме реального времени.Такая доступность данных обеспечит превосходный клинический выбор и повлияет на улучшение результатов в отношении здоровья и более эффективное использование систем здравоохранения.
Для людей эти датчики могут помочь в преждевременном распознавании воздействий на здоровье и предотвращении госпитализации. Возможность использования этих датчиков для уменьшения количества обращений в больницу и повторной госпитализации определенно привлечет позитивную осведомленность в будущем. Кроме того, информация о расследованиях говорит о том, что WBS определенно предоставит миру экономически эффективное носимое медицинское оборудование.
Применение биосенсоров
В последние годы эти датчики стали очень популярными, и они применимы в различных областях, которые упомянуты ниже.
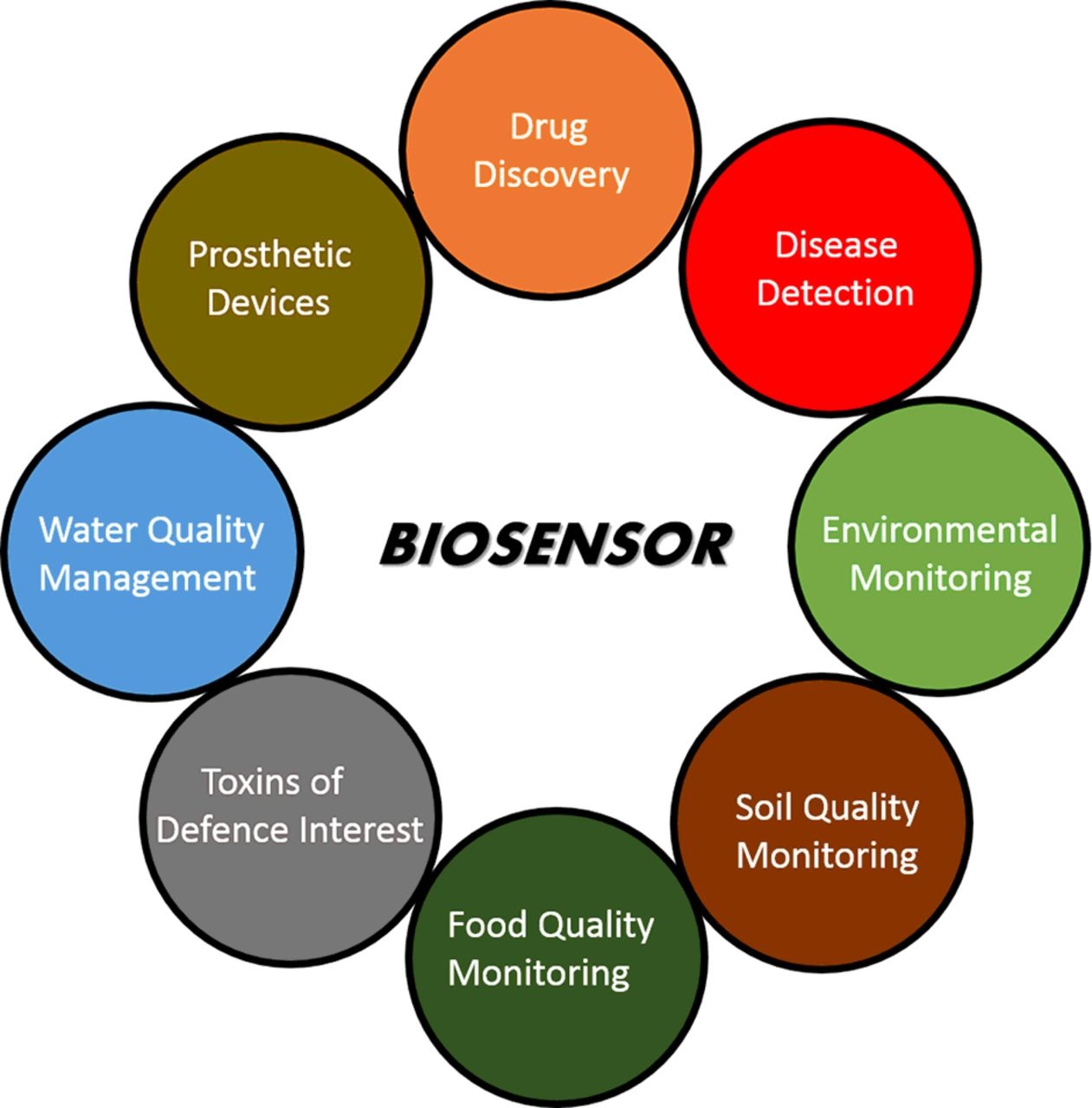
 Источник изображения
Источник изображения - Общая медицинская проверка
- Измерение метаболитов
- Скрининг на болезнь
- Лечение инсулином
- Клиническая психотерапия и диагностика заболеваний
- Военные
- Сельскохозяйственные и ветеринарные применения
- Улучшение лекарств, правонарушения обнаружение
- Обработка и мониторинг в промышленности
- Контроль загрязнения окружающей среды
Из приведенной выше статьи, наконец, можно сделать вывод, что биосенсоров и биоэлектроники были использованы во многих областях здравоохранения, исследований в области наук о жизни, окружающей среды , продукты питания и военные применения.Кроме того, эти датчики могут быть усовершенствованы как нанобиотехнологии. Лучший пример будущего использования нанобиотехнологий — электронная бумага, контактные линзы и Nokia Morph. Вот вам вопрос, что такое носимые биосенсоры?
Обзор компании | Биосенсорс Интернешнл Лтд
Более 25 лет Biosensors разрабатывает и продает катетерные системы для интенсивной терапии и связанные с ними устройства, используемые во время операций на сердце и интенсивной терапии.
В 2000 году Biosensors вышла на рынок интервенционной кардиологии и сразу стала первой кардиологической компанией , разработавшей и запатентовавшей собственный запатентованный агент для лимуса, Biolimus A9 ™ (BA9 ™), высоколипофильный антистенотический препарат 1 , разработанный специально для технологий сердечно-сосудистых стентов.
> В 2006 году мы провели первую в мире имплантацию первого в мире первого стента без полимера и носителя , покрытого Biolimus ™
> В 2008 году Биосенсоры представили результаты рандомизированного испытания без потерь качества LEADERS 2 (Limus Eluted From Durable против ERodable Stent Coating), первого испытания для всех пользователей PCI.
> В 2010 году мы представили результаты первого в мире исследования первого в мире первого стента без полимера и носителя , покрытого Biolimus A9 ™
.> В 2013 году мы представили результаты COMFORTABLE AMI 3 , первого испытания DES , чтобы показать преимущества эффективности и безопасности по сравнению с BMS у пациентов с ОИМ.
> В 2015 году мы представили результаты исследования LEADERS FREE 4 , первого испытания , предназначенного исключительно для регистрации пациентов с высоким риском кровотечения * и их рандомизации в активный стент с ультракоротким DAPT
всего в течение одного месяца.> В 2018 году в TCT в Сан-Диего был представлен результат GLOBAL LEADERS 5,6 , крупнейшего всесезонного испытания PCI. На том же заседании мы представили результаты LEADERS FREE II, первого испытания для включения населения США с высоким риском кровотечения в активный стент и всего один месяц DAPT
За последние два десятилетия Биосенсоры стали одним из крупнейших производителей и поставщиков сердечно-сосудистых стентов во всем мире.
,Биосенсоры и Биоэлектроника — Журнал
Biosensors & Bioelectronics имеет журнал зеркал с открытым доступом Biosensors & Bioelectronics: X, объединяющий те же цели и сферу деятельности, редакционную группу, систему представления и тщательный рецензирование.
Биосенсоры определяются как аналитические устройства, включающие биологический материал, биологически полученный материал …
Читать далееBiosensors & Bioelectronics имеет журнал зеркал с открытым доступом Biosensors & Bioelectronics: X, объединяющий те же цели и сферу деятельности, редакционную группу, систему представления и тщательный рецензирование.
Биосенсоры определяются как аналитические устройства, включающие биологический материал, биологически полученный материал или биомимику, тесно связанную или интегрированную с физико-химическим преобразователем или трансдуцирующей микросистемой, которая может быть оптической, электрохимической, термометрической, пьезоэлектрической, магнитной или микромеханической (Turner et al.). al., 1987; Turner, 1989). Biosensors & Bioelectronics — главный международный журнал, посвященный исследованиям, проектированию, разработке и применению биосенсоров и bioelectronics .Это междисциплинарный журнал, предназначенный для профессионалов, которые заинтересованы в использовании биологических материалов и разработок в новых диагностических и электронных устройствах, включая датчики, ДНК-чипы, электронные носы, lab-on-a-chip и µ-TAS. Биосенсоры обычно выдают цифровой электронный сигнал, который пропорционален концентрации конкретного аналита или группы аналитов. Хотя сигнал в принципе может быть непрерывным, устройства могут быть настроены на единичные измерения в соответствии с конкретными требованиями рынка.Примеры биосенсоров включают иммуносенсоры, биосенсоры на основе ферментов, биосенсоры на основе организма и целых клеток. Они были применены к широкому кругу аналитических проблем, включая применение в медицине, биомедицинских исследованиях, поиске лекарств, окружающей среде, пищевой, перерабатывающей промышленности, безопасности и обороне. Разработка и исследование молекулярных и супрамолекулярных структур с молекулярным биопознанием и биомиметическими свойствами для использования в аналитических устройствах также включены в объем журнала.Здесь основное внимание уделяется дополнительному пересечению между молекулярным распознаванием, нанотехнологиями, молекулярным импринтингом и супрамолекулярной химией для улучшения аналитических характеристик и надежности устройств.
Развивающаяся область биоэлектроники стремится использовать биологию в сочетании с электроникой в более широком контексте, включающем, например, биологические топливные элементы, бионические и биоматериалы для обработки информации, хранения информации, электронных компонентов и исполнительных механизмов.Ключевым аспектом является связь между биологическими материалами и микро- и наноэлектроникой.
Стараясь поддерживать согласованность в объеме журнала, редакторы будут принимать рецензии и документы, имеющие очевидную значимость для сообщества, которые описывают важные новые концепции, лежат в основе понимания области или дают важные сведения о практическом применении, изготовлении и коммерциализация биосенсоров и биоэлектроника.
Скрыть полные Цели и Сфера ,Biosensor — Wikipedia
Biosensoren sind Messfühler, die mit biologischen Komponenten ausgestattet sind. Diese werden in der biotechnologischen Messtechnik angewendet. Der Begriff wurde im Jahr 1977 von Karl Cammann geprägt; seit 1997 gibt es eine Definition der IUPAC dafür. [1]
 Bei Blutzuckermessstreifen handelt es sich um typische Biosensoren. Hier wird amperometrisch der Glucosegehalt des aufgetragenen Bluts bestimmt.
Bei Blutzuckermessstreifen handelt es sich um typische Biosensoren. Hier wird amperometrisch der Glucosegehalt des aufgetragenen Bluts bestimmt.
Biosensoren auf der direkten räumlichen Kopplung eines immobilisierten biologisch aktiven Systems mit einem Signalumwandler (Transduktor) и einem elektronischen Verstärker.Für die Erkennung der zu bestimmenden Substanzen nutzen Biosensoren biologische Systeme auf unterschiedlich hohem Integrationsniveau. Solche Erkennungselemente können entweder natürliche (z. B. Antikörper, Enzyme, Nukleinsäuren, Organellen oder Zellen) или синтетический (z. B. Aptamere, молекулярный полимерный полимер, Макроцилен или синтетический пептид). [2] Das immobilisierte biologische System des Biosensors tritt в Wechselwirkung mit dem Analyten. Dabei kommt es zu physikochemischen Veränderungen, wie z.B. Veränderungen der Schichtdicke, der Brechungsindizes, der Lichtabsorption oder der elektrischen Ladung. Diese Veränderungen können mittels des Transduktors, wie z. B. optoelektrischen Сенсорен, амперометришен и потенциометрич Электродэн или спецэзилен Feldeffekttransistoren (химический сенситиватор Feldeffekttransistor) bestimmt werden. [3] Nach dem Messvorgang muss der Ausgangszustand des Systems wiederhergestellt werden. Ein Problem bee der Entwicklung von Biosensoren ist die Korrosion des Biosensors в течение длительного времени содержит биологические коррозии или биологические коррозии.Beispielsweise korrodieren typische Zellkulturmedien für eukaryotische Zellkulturen Silicium mit einer Geschwindigkeit von etwa 2 nm / h. [4]
Die Messung eines Analyten mittels eines Biosensors erfolgt demnach in drei Schritten. Zunächst erfolgt die spezifische Erkennung des Analyten durch das biologische System des Biosensors. Anschließend findet die Umwandlung der physikochemischen Veränderungen, die durch die die Wechselwirkungen des Analyten mit dem Rezeptor entstehen, in ein elektrisches Signal statt.Dieses Signal wird dann verarbeitet und verstärkt. Signalumwandlung und Elektronik können kombiniert werden, z. Б. в CMOS-basierten Mikrosensorsystemen. [5] [6] Seine Selektivität und Empfindlichkeit bezieht ein Biosensor aus dem verwendeten биологическая система.
- Пьезоэлектрище Sensoren
- Die Schwingungsfrequenz eines Quarzes представляет собой пропорциональную линию сейсмической массы Masse. Ein mit Enzymen, Antikörpern oder and anderen Bindern beschichteter Quarzkristall lässt sich somit als Mikrowaage verwenden.Ein besonders empfindlicher (sensitiver) Spezialfall sind die Oberflächenwellensensoren (SAW-Sensoren, Поверхностные акустические волны). Hierbei werden auf einem пьезоэлектрический Quarz zwei Beschichtungen aufgebracht, die als Sender bzw. Экипировочные материалы и электронное оборудование для детей и подростков Oberflächenwellen aussenden. Immunreaktionen bewirken durch Bindung eines Antigens a einen Antikörper eine Änderung der Oberfläche and damit eine Änderung der Resonanzfrequenz der Welle.
- Optische Sensoren
- Mit diesen Sensoren verfolgt человек в деле Praxis vor allem den Sauerstoffgehalt в Flüssigkeiten.Als Messprinzip может быть найден Fluoreszenzlöschung zugrunde. Als Messeinrichtung dient ein Lichtwellenleiter, dessen Ende ein Indikator aufgebracht ist. Die Lumineszenzóder Absorptionseigenschaften dieses Индикаторы с химическим составом Größen, wie der Sauerstoffkonzentration abhängig. Eine andere einsetzbare Methode beruht auf der Evaneszenz, умерший за полное отражение в мировом наследничестве. Hierbei kann von einem Fluoreszenz-markierten Analyt Fluoreszenzlicht in den Lichtleiter eingekoppelt und darüber eine Aussage über die Konzentration gemacht werden.Dieses Verfahren benutzt man zur Bestimmung von Antigenen über eine Reaktion mit einem spezifischen Antikörper an der Oberfläche eines Lichtleiters. Die Methode kann man empfindlicher machen, wenn auf der Oberfläche des Lichtleiters noch einen dünnen Metallfilm anbringt. Hierbei treten in dem Metallfilm Dichteschwankungen freier Ladungsträger auf (Plasmonen). Bei einem derartigen Sensor nach dem Prinzip der Поверхностный плазмонный резонанс wird der Metallfilm zusätzlich mit Dextranen beschichtet, die Analyt-spezifische Antikörper gebunden werden können.
- Электрохимическое Детекция
- durch Амперометрия: Bei der Amperometrie wird in einer Messkammer and zwei Elektroden be konstant gehaltener Spannung der Stromfluss gemessen. Узнайте больше о Stoffwechselprodukte, умерших от недостатков или недостатков. Oftmals werden auch Mediatoren eingesetzt, das sind Redoxpaare, die bei der Oxidation des eigentlichen Субстраты индирект эйнрайфен и зум Электронентрансфер диенен. Странный з.B. ein zu bestimmendes Substrat von FAD, das Coenzym der meisten Oxidasen ist, oxidiert, wobei FAD zu FADH редуцирующий, такой странный FADH, аншлисский фон от oxidierten Form des Mediators wieder zu FAD oxidiert. Die dabei entstehende reduzierte Form des Mediators является уникальным анодом. Über Aufnahmen der Strom-Spannungs-Kurven lassen sich Aussagen zum Redoxverhalten und zur Konzentration des eigentlichen Substrats machen. Als Mediatoren werden z. B. Гидрохинон или производное ферроценса.Der Vorteil von Mediatoren ist, dass man eine viel niedrigere Spannung vorgeben kann und damit unerwünschte Nebenreaktionen vermeidet. Amperometrische Biosensoren werden z. B. eingesetzt zur Bestimmung von Glucose, Cholesterin, Fettsäuren und L-Aminosäuren mit den entsprechenden Enzymen als Oxidasen.
- durch Потенциометрия: Die Potentiometrie wird bei ionischen Reaktionsprodukten eingesetzt. Умеренный количественный Bestimmung Dieser Ionen erfolgt anhand ihres elektrischen Потенциальные возможности einer Messelektrode, die zur Bestimmung eines Substrats mit einem geeigneten Enzym belegt ist.Бей Гидролазен, з. B. Уреаз, как ни странно, — Anderung des pH-Wertes oder die — Anderung von Ammoniumionen bzw. Водородкарбонатный бестимм. Als Messelektroden werden häufig ионно-чувствительный Feldeffekttransistoren (ISFET) или Металлоксид-бесщеточный Säureelektroden (MOSFET) verwendet. Als Referenzelektrode benutzt manine Elektrode gleichen Typs, jedoch ohne Belegung mit einem Enzym. Потенциометриче ский метод Вайр Айнджетзт цур Бестиммунг фон з. B. Harnstoff, Kreatinin oder Aminosäuren.
- mit ionenselektiven Elektroden: Werden diese mit einem Enzym belegt, so arbeiten sie nach dem gleichen Prinzip wie be Potentiometrie beschrieben.
- Интерферометрище Детекция
- hierbei wechselwirken die Biomoleküle mit einer Polymerschicht deren Dickenänderung mit der reflektometrische Интерференцспектроскопия верфольга.
Das erste Messsystem, das als Biosensor entsprechend der oben angeführten Определение bezeichnet werden kann, wurde 1962 von Clark und Lyons entwickelt. [7] Es wurde ein Messsystem beschrieben, das die Bestimmung von Glucose im Blut während und nach Operationen ermöglicht.Дизерский биосенсор не имеет аналогов в мире. Заарстоффеэлектроды и др. Кларк-одер-эйнер pH-Электрод als Transduktor, vor denen zwischen zwei Membranen das Enzym Глюкозо-оксидазная война. Die Glucosekonzentration konnte als Änderung des pH-Wertes bzw. als Änderung der Sauerstoffkonzentration infolge der Oxidation der Glucose unter katalytischer Wirkung des Enzyms Глюкозо-оксидаза bestimmt werden.
Bei diesem Aufbau ist das biologische Материал zwischen zwei Membranen eingeschlossen, oder das biologische System is is aufine Membran aufgebracht und world.Die Anwendungsbereiche für Biosensoren in der Analytik vas Wasser und Abwasser lassen sich unterteilen in Biosensoren zur Bestimmung von Einzelkomponenten, Biosensoren zur Bestimmung von Toxizität und Mutagenität sousie in Bisens in the Biossen in the Biossen in the Biossen in the Biossen in the Biossen in the Biossen in the Bösen также также в Бисенсбурге, Германия
Biosensoren zur Bestimmung von Proteinen wurden mit Silizium-Feldeffekt-Sensoren (sogenannten ChemFETs) realisiert. Изучите данные по анализу Проанализируйте фоновый анализ данных in-situ -Верфарен, посвященный анализу протеинов, анализируемую белками. [8]
Der Bakteriengehalt von Badegewässern oder von Abwässern lässt sich mittels eines Биосенсоры bestimmen. Auf einer schwingenden Membran sind hierbei Antikörper gegen bestimmte Bakterienarten angebracht. Schwimmen die entsprechenden Bakterien am Messfühler vorbei, heften sie sich and antikörper und verlangsamen dadurch die Schwingungen der Membran. Unterschreiten die Schwingungen einen bestimmten Wert, Wird Alarm ausgelöst.
Die Penicillinkonzentration in einem Bioreaktor, in welchem Pilzstämme kultiviert werden, lässt sich mit einem Biosensor bestimmen.Die biologische Komponente des hierbei verwendeten Датчики stellt hierbei das Фермент Acylase dar. Dieses Penicillin spaltende Enzym wird auf eine Membran gebracht, die einer pH-Elektrode aufliegt. Nimmt nun die Penicillinkonzentration im Medium zu, spaltet das Enzym immer größere Mengen einer Säure, der Phenylessigsäure, ab. Dadurch verändert sich der pH-Wert an der Elektrode. Man kann также nun vom pH-Wert auf die Konzentration des Penicillins schließen.
Zu den Biosensoren gehört auch Oberflächenplasmonenresonanzspektroskopie.Hierbei wird die Bindung von Stoffen mittels Plasmonen-Detektion gemessen.
Eine neue Entwicklung zur Überwachung von Lebensmitteln basiert auf Nanosensoren. Die Fluoreszenz von Nanopartikeln, die sich in einem Agarose-Nährmedium befinden, ändert sich deutlich, wenn sich der pH-Wert aufgrund eines bakteriellen Stoffwechsels im Lebensmittel ändert. Hierbei sind in den Nanopartikeln zwei Fluoreszenzfarbstoffe eingebettet. Происходил в нескольких рядах от компании Fluoreszeinfarbstoff. Er leuchtet grün bei Anregung mit einer Leuchtdiode und reagiert empfindlich auf eine Änderung des pH-Wertes.Der zweite, ein Farbstoff mit pH-unabhängiger roter Fluoreszenz, dient als interne Referenz. [9]
Mit einem neuartigen pH-Sensor lassen sich pH-Wert-Änderungen in lebenden Zellen über längere Zeiträume verfolgen. Das Prinzip beruht auf einer Kombination fluoreszierender Nanokristalle mit beweglichen Oligonukleotiden, die sich in Abhängigkeit vom umgebenden pH-Wert zusammenfalten or ausstrecken. Damit wird der Abstand zwischen dem Nanokristall-Energiedonor mit einem grünen Fluoreszenzfarbstoff und einem FRET-Akzeptor, der aus einem roten Fluoreszenzfarbstoff besteht, pH-abhängig geändert.Zu einem FRET-Energietransfer and damit zum Leuchten des roten Fluoreszenzfarbstoffes kommt es dabei, Wenn der Abstand Gering ist. Beobachtet wird das Verhältnis zwischen grüner und roter Fluoreszenz mit einem Fluoreszenzmikroskop. [10]
- R. D. Schmid, U. Bilitewski: Biosensoren. In: Chemie in unserer Zeit. 26. Jahrg., Nr. 4, 1992, с. 163–173, ISSN 0009-2851
- Брайан Р. Эггинс: Химические сенсоры и биосенсоры. Аналитические методы в науках. 2. Auflage. Wiley, 2002, ISBN 0-471-89914-3.
- M. Perpeet, S. Glass, T. Gronewold, A. Kiwitz, A. Malavé, I. Stoyanov, M. Tewes, E. Quandt: SAW сенсорная система для анализа без молекулярного взаимодействия без маркеров. В: Аналитические письма. Band 39, Nr. 8, 2006, с. 1747–1757.
- Рейнхард Реннеберг, Доротея Пфайффер, Фред Лисдат, Джордж Уилсон, Улла Волленбергер, Фрэнсис Лиглер, Энтони П.Ф. Тернер: Фридера Шеллера и краткая история биосенсоров. В: Достижения в области биохимической инженерии / биотехнологии. Springer-Verlag, Berlin / Heidelberg 2008, ISBN 978-3-540-75200-4, S. 1–18 (kurzer Abriss der Geschichte der Biosensoren)
- ↑ Рейнхард Реннеберг, Доротея Пфайффер, Фред Лисдат, Джордж Уилсон, Улла Волленбергер, Фрэнсис Лиглер, Энтони П.Ф. Тернер: Фридера Шеллера и краткая история биосенсоров. В: Достижения в области биохимической инженерии / биотехнологии. Springer-Verlag, Berlin / Heidelberg 2008, ISBN 978-3-540-75200-4, S.3, имя и фамилия «Карл Камман» angegeben.
- ↑ Кан Динсер, Ричард Брух, Эстефания Коста-Рама, Мария Тереза Фернандес-Абедул, Арбен Меркочи: Одноразовые датчики в диагностике, контроле качества пищевых продуктов и окружающей среды . В: Расширенные материалы . 15. Mai 2019, ISSN 0935-9648, S. 1806739, doi: 10.1002 / adma.201806739.
- ↑ Florinel-Gabriel Bănică: Химические датчики и биосенсоры: основы и применение . John Wiley & Sons, Чичестер, Великобритания 2012, ISBN 978-1-118-35423-0.
- ↑ Грэхем Дж. Триггс, Гарет Дж. О. Эванс, Томас Ф. Краусс: Деградация кремниевых фотонных биосенсоров в средах для культивирования клеток: анализ и профилактика. В: Биомедицинская Оптика Экспресс. Band 8, Nr. 6, 2017, S. 2924, doi: 10.1364 / BOE.8.002924.
- ↑ A. Hierlemann, O. Brand, C. Hagleitner, H. Baltes: Методы микропроизводства для химических / биосенсоров. В: Труды IEEE. Band 91, Nr. 6, 2003, с. 839–863. ISSN 0018-9219.
- ↑ A. Hierlemann, H. Baltes: Химические микросенсоры на основе CMOS. В: Аналитик. Band 128, Nr. 1, 2003, с. 15–28.
- C. L. C. Clark, C. Lyons: Электродные системы для непрерывного мониторинга в сердечно-сосудистой хирургии. В: Ann. Н.Ю. акад. Sci. Band 31, Nr. 102, 1962, с. 29–45. PMID 14021529
- С. К. Луд, М. Г. Николаидес, И. Хааз, М. Фишер, А. Р. Бауш: Полевой эффект экранированных зарядов: электрическое обнаружение пептидов и белков с помощью тонкопленочного резистора. В: ХимФизХим. Band 7, Nr. 2, 2006, с. 379–384.
- ↑ Сю-донг Ванг, Роберт Дж. Майер, Отто С. Вольфбейс: Флуоресцентные рН-чувствительные наночастицы в агарозной матрице для визуализации роста бактерий и метаболизма . В: Angewandte Chemie . Группа 124, Nr. 45, 2012, doi: 10.1002 / ange.201205715.
- uan Euan R. Kay, Jungmin Lee, Daniel G. Nocera, Moungi G. Bawendi: Конформационный контроль передачи энергии: механизм для биосовместимых датчиков на основе нанокристаллов .В: Angewandte Chemie . Группа 124, Nr. 52, 2012, ISSN 1521-3757, doi: 10.1002 / ange.201207181.

