Что такое биосенсоры. Как устроены биосенсоры. Какие бывают виды биосенсоров. Где применяются биосенсоры. Какие особенности имеют биосенсоры.
Что такое биосенсор и как он устроен
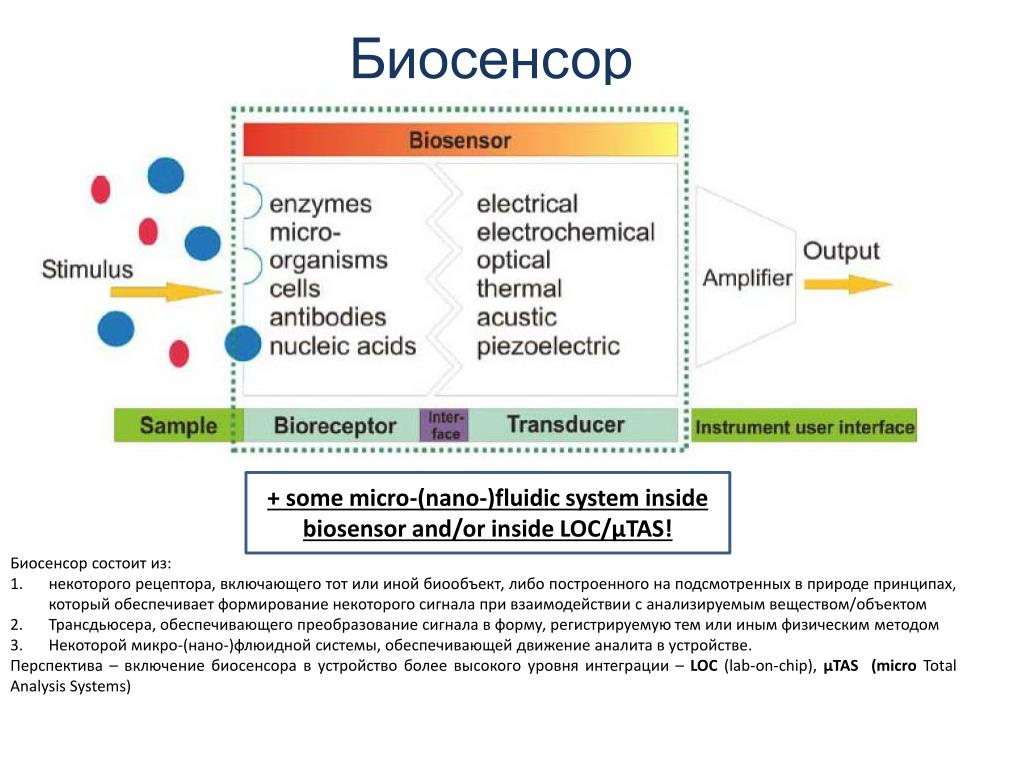
Биосенсор — это аналитический прибор, использующий биологические компоненты для определения химических соединений. Основные части биосенсора:
- Биоселективный элемент (ферменты, антитела, клетки и др.)
- Преобразователь (электрохимический, оптический и др.)
- Электроника для обработки и отображения сигнала
Биоселективный элемент специфически взаимодействует с определяемым веществом. Преобразователь конвертирует результат этого взаимодействия в измеряемый сигнал. Электроника обрабатывает сигнал и выдает результат анализа.
Основные виды и принципы работы биосенсоров
В зависимости от типа преобразователя выделяют следующие виды биосенсоров:
- Электрохимические (амперометрические, потенциометрические)
- Оптические (на основе поверхностного плазмонного резонанса)
- Пьезоэлектрические
- Термические
- Магнитные
Наиболее распространены электрохимические биосенсоры. В них биохимическая реакция сопровождается генерацией или потреблением электронов, что регистрируется как электрический сигнал.

Области применения биосенсоров
Биосенсоры нашли широкое применение в различных сферах:
- Медицинская диагностика (анализ крови, мочи и др.)
- Пищевая промышленность (контроль качества продуктов)
- Экологический мониторинг (определение загрязнителей)
- Биотехнологическое производство
- Фармацевтические исследования
- Обеспечение безопасности
Самый известный пример — глюкометр для измерения уровня сахара в крови у диабетиков. Он использует фермент глюкозооксидазу для определения концентрации глюкозы.
Преимущества биосенсоров перед традиционными методами анализа
Биосенсоры обладают рядом важных преимуществ:
- Высокая чувствительность и селективность
- Быстрота анализа (от нескольких секунд до минут)
- Простота использования
- Возможность миниатюризации
- Низкая стоимость анализа
- Возможность работы в режиме реального времени
Эти преимущества делают биосенсоры перспективными для создания портативных аналитических устройств.
Современные тенденции в разработке биосенсоров
Основные направления совершенствования биосенсоров включают:
- Использование наноматериалов для повышения чувствительности
- Разработка мультисенсорных систем («электронный нос», «электронный язык»)
- Создание имплантируемых биосенсоров для непрерывного мониторинга
- Интеграция с микрофлюидными чипами
- Беспроводные технологии передачи данных
- Применение искусственного интеллекта для обработки сигналов
Эти инновации позволяют расширить возможности и области применения биосенсоров.
Проблемы и ограничения биосенсорных технологий
При разработке и использовании биосенсоров приходится решать ряд проблем:
- Нестабильность биологических компонентов
- Неспецифические взаимодействия
- Сложность работы в биологических жидкостях
- Необходимость периодической калибровки
- Ограниченный срок хранения
Преодоление этих ограничений — важная задача для дальнейшего развития биосенсорных технологий.
Перспективы развития и будущее биосенсоров
Биосенсоры имеют большой потенциал развития. Ожидаемые достижения включают:
- Создание имплантируемых биосенсоров для постоянного мониторинга здоровья
- Разработка «умной» одежды и аксессуаров с встроенными биосенсорами
- Миниатюрные биосенсорные чипы для экспресс-диагностики
- Системы раннего обнаружения заболеваний на основе биосенсоров
- Биосенсоры для персонализированной медицины
Развитие биосенсорных технологий может произвести революцию в медицинской диагностике и мониторинге состояния здоровья.
/imgs/2020/06/11/09/3951674/a95aae8141622d63e9f213f450648176830eff51.jpg)
Заключение
Биосенсоры представляют собой перспективное направление аналитической биотехнологии. Сочетание биологических и физико-химических компонентов позволяет создавать высокочувствительные и селективные устройства для быстрого анализа. Несмотря на определенные ограничения, биосенсоры находят все более широкое применение в медицине, пищевой промышленности, экологическом мониторинге и других областях. Дальнейшее развитие этих технологий открывает новые возможности для диагностики заболеваний, контроля окружающей среды и обеспечения безопасности.
Обзор последних достижений в сфере биосенсорных технологий и возможных областей их применения
Применение биосенсоров приобрело огромную важность в сферах разработки лекарственных препаратов, биомедицины, стандартов продовольственной безопасности, обороны, безопасности и мониторинга качества окружающей среды. Результатом этого стала разработка точных и мощных аналитических инструментов, использующих биологический элемент в качестве биосенсора. Глюкометры, принцип действия которых основан на стратегии электрохимического выявления кислорода или пероксида водорода с помощью электродов с иммобилизованной глюкозооксидазой, положили начало разработке биосенсоров. Последние достижения в области биологических технологий и измерительных приборов, подразумевающие использование флуоресцентных меток для наноматериалов для повышения предела чувствительности биосенсоров. Применение аптамеров или нуклеотидов, аффител, пептидных панелей и полимеров с молекулярными отпечатками предоставило исследователям инструменты для разработки инновационных биосенсоров, за основу которых берутся классические методы. Интегрированные подходы предоставляют лучшие возможности для разработки специфичных и чувствительных биосенсоров с высоким регенеративным потенциалом. Различные биосенсоры, начиная с наноматериалов и полимеров и заканчивая микроорганизмами, имеют более широкую сферу перспективных направлений применения. Для этого важно интегрировать многосторонние подходы в разработку биосенсоров, потенциально пригодных для применения в различных сферах. В данной статье приведен обзор различных типов биосенсоров, начиная от электрохимических, флуоресцентных меток, наноматериалов, оксида кремния или кварца и заканчивая микроорганизмами, применяемых для биомедицинских целей и в охране окружающей среды, а также описаны будущие перспективы для отрасли биосенсорных технологий.
Введение
Термин «биосенсор» относится к мощному инновационному аналитическому устройству с биологическим чувствительным элементом, обладающему широким спектром возможных областей применения, таких как разработка препаратов, диагностика, биомедицина, продовольственная безопасность и пищевая промышленность, мониторинг состояния окружающей среды, оборона и безопасность. Первый биосенсор, изобретенный в 1962 году Кларком (Clark) и Лионсом (Lyons) для измерения уровня глюкозы в биологических образцах и использовавший стратегию электрохимического выявления кислорода или пероксида водорода с помощью электродов с иммобилизованной глюкозооксидазой. С тех пор невероятный прогресс был совершен как в технологии, так и в применении биосенсоров, использующих инновационные подходы, в том числе электрохимию, нанотехнологию и биоэлектронику. Учитывая феноменальные достижения в области биосенсоров, целью данного обзора является ознакомление читателя с различными техническим стратегиями, адаптированными для разработки биосенсоров, с целью предоставления базовых знаний и современной ситуации в области биосенсорных технологий. Особое внимание уделяется исследовательским инструментам, демонстрирующим каким образом производительность биосенсоров эволюционировала классических электрохимических методов до оптического/визуального выявления, полимеров, оксида кремния, стекла и наноматериалов, применяемых для улучшения порога обнаружения, чувствительности и избирательности. Интересен тот факт, что микроорганизмы и биолюминесценция в целом применялись в разработке биосенсоров на основе меток, тогда как не использующие меток биосенсоры подразумевают использование устройств на основе транзисторов или конденсаторов и наноматериалов. Биосенсоры предоставляют базу для понимания технологических улучшений в сфере измерительных приборов, включающих сложные аппараты с высокой пропускной способностью, применяемые в количественной биологии, и портативные количественные и полуколичественные устройства для непрофессионального применения. Помимо этого в статье освещены, современные исследовательские тенденции, будущие задачи и ограничения данной сферы. Данные обзор разделен на подразделы, описывающие две основные технические стратегии, а также различные типы биосенсоров, в том числе электрохимических и оптических/визуальных, а также использующих полимеры, оксид кремния, стекло и наноматериалы. Эти устройства разрабатывались для специфичных целей, и данный обзор предоставляет читателям исчерпывающую информацию о биосенсорных устройствах и областях их применения.
Технические стратегии
Технические стратегии, применяемые для разработки биосенсоров, основаны на выявлении биомаркеров с использованием и без использования меток. Выявление с использованием меток основано преимущественно на специфичных свойствах метящих соединений, применяемых для прицельного выявления. Биосенсоры такого типа надежны, однако часто требуют комбинации специфичных чувствительных элементов, изготавливаемых с использованием иммобилизованного белка-мишени. С другой стороны, не использующий меток метод позволяет выявлять молекулы-мишени, не пригодные для мечения. Последние междисциплинарные подходы в области биотехнологии и биоинженерии, электротехники и электроники проложили дорогу разработке не использующих метки биосенсоров для различных методов выявления с широким спектром направлений применения в области медицины и науки об окружающей среде.
Электрохимические биосенсоры
Уже ставшее классикой создание глюкометра на основе глюкозооксидазных биосенсоров является первым шагом в истории разработки электрохимических биосенсоров. Глюкозные биосенсоры очень популярны в клиниках и диагностических учреждениях, так как они необходимы для периодического мониторинга уровня глюкозы в крови пациентов с сахарным диабетом. Однако эти биосенсоры имеют недостатки в силу нестабильной активности или негомогенности фермента, обуславливающей важность дополнительной калибровки. Фактически эти потенциальные недостатки привели к разработке спектра биомолекул, обладающих различными электрохимическими свойствами, что обусловило появление более стабильно работающих биосенсоров глюкозы. В последнее время электрохимические биосенсоры, как правило, изготавливаются путем модифицирования поверхности металлических и углеродных электродов с использованием биоматериалов, таких как ферменты, антитела или ДНК. Выходной сигнал биосенсора обычно генерируется в результате специфичных реакций связывания или каталитических реакций между материалами на поверхности электрода. Необходимость разработки электрохимических сенсоров стала особенно актуальна для клинической диагностики заболеваний, в которых большое значение имеет раннее выявление или мониторинг. В данном контексте для разработки не-ферментативных биосенсоров вместо белков рассматриваются синтетические материалы. Интересен тот факт, что различные типы биомолекул обладают разной стабильностью и избирательностью, что в конечном итоге позволяет разрабатывать новые типы электрохимических биосенсоров для разных целей. В зависимости от сферы применения были разработаны разные типы электрохимических биосенсоров, а биосенсоры глюкозы претерпели стремительную эволюцию.
Еще одним современным изобретением является биохимический сенсор для оценки уровней активных форм кислорода в физиологических системах. Важным областью применения данного направления представляется выявление мочевой кислоты как наиболее важного конечного продукта метаболизма пурина в биологических жидкостях организма, которое может выступать в роли инструмента для диагностики различных клинических аномалий и заболеваний. Однако исключительно важной задачей является разработка экономически эффективного и чувствительного метода. Аналогично ситуации с количественным измерением уровня глюкозы, электрохимический подход к оценке уровня окисления мочевой кислоты выглядит идеальным претендентом. Однако сходство с точки зрения окислительных процессов мочевой кислоты с аскорбиновой кислотой серьезно затрудняет разработку высокочувствительного электрохимического биосенсора. Для преодоления этой проблемы авторы разработали биосенсор на основе амперометрического выявления (amperometric detection), позволяющего измерять как восстановительный, так и окислительный потенциалы. Учитывая стоимость и воспроизводимость данной процедуры, важным моментом является иммобилизация или нанесение ферментов на поверхность обычных электродов или электродов на основе наноматериалов, идеальных для разработки одноразовых избирательных, экономически эффективных и чувствительных биосенсоров для рутинного измерения уровней мочевой кислоты. В этом отношении очень перспективными выглядят недавние достижения в области трехмерной биопечати, целью которых является создание биосенсоров на основе живых клеток, инкапсулированных в трехмерное микроокружение. К этому же направлению относится недавно разработанный беспроводной биосенсор-капа для непрерывного определения в режиме реального времени концентрации мочевой кислоты в слюне. Эта технология может быть использована в разработке пригодных для ношения на теле устройств, для мониторинга различных параметров состояния здоровья. Электрохимические сенсоры уже успешно применялись для измерения уровня гормонов, однако перспективы применения данного подхода еще требуют детального рассмотрения. В основе еще одного потенциального направления технологических разработок в области биосенсоров лежит прицельное воздействие на нуклеиновые кислоты. Хорошо известно, что клеточная экспрессия малых интерферирующих РНК (миРНК) является идеальным биомаркером для диагностики манифестации болезни и воздействие на нее повышает эффективность генной терапии генетических заболеваний. Обычно миРНК выявляются с помощью нозерн-блоттинга, микрочипов и полимеразной цепной реакции (ПЦР). Современные технологии позволяют создавать идеальные электрохимические биосенсоры для выявления миРНК, принцип действия которых основан на безметочной идентификации реакции окисления гуанина, запускаемой формированием гибрида между миРНК и соответствующим зондом захвата на основе аналога инозина. Все эти изобретения появились благодаря современным подходам, применяемым для продвижения технологии электрохимических биосенсоров в биомедицине.
Мониторинг состояния окружающей среды является еще одним важным направлением, в котором технология биосенсоров востребована для быстрого выявления остаточных количеств пестицидов для устранения угрозы здоровью человека. Традиционные подходы, такие как высокопроизводительная жидкостная хроматография, капиллярный электрофорез и масс-спектрометрия, эффективны как методы выявления пестицидов в окружающей среде, однако они имеют ограничения, обусловленные сложностью реализации, большими временными затратами, потребностью в высокотехнологичных инструментах и эксплуатационными возможностями. Поэтому простые биосенсоры имеют огромное преимущество, но разработка унифицированного устройства для анализа различных классов пестицидов является очень сложной задачей. Для решения этой проблемы были разработаны биосенсоры на основе ферментов, а именно ингибитора ацетилхолинестеразы, позволяющие определять физиологической вклад пестицидов в окружающую среду, продовольственную безопасность и контроль качества. За последние 10-20 лет эта технология была еще более усовершенствована для быстрого проведения анализа с помощью методов иммобилизации и других стратегий изготовления. Аналогичным образом пьезоэлектрические биосенсоры были разработаны для выявления влияния на окружающую среду фосфаторганических и карбаминовокислых пестицидов. Известно, что хлорорганические пестициды оказывают неблагоприятное влияние на окружающую среду, при этом такие, как эндосульфан, могут наносить серьезный ущерб. Пестициды этого класса по-разному воздействуют на репродуктивную систему самцов и самок рыб. Учитывая этот факт, а также феномен биологического накапливания (биомагнификации), изобретение биосенсоров для анализа водных экосистем было бы очень полезно. Для того, чтобы удовлетворить эту потребность в области биосенсоров произошла революция, в рамках произошел быстрый прогресс в методах изготовления и использования наноматериалах, кварцевых кристаллов или диоксида кремния. Очень важно уделять особое внимание выбору рецепторов для разработки биосенсоров, использованию различных технологий преобразования сигнала и стратегий быстрого скрининга для применения в областях пищевой и экологической безопасности, а также мониторинга. Для достижения этого большое значение имеет изготовление биосенсоров; достижения в этой области четко описаны ниже.
Оптические/визуальные биосенсоры
Как описано выше, биомедицинские и экологические направления требуют разработки простых, быстро работающих и высокочувствительных биосенсоров. Это может быть реализовано с помощью иммобилайзеров, которые могут изготавливаться из золота, материалов на основе углерода, кварца или стекла. Фактически инкорпорирование золотых наночастиц или квантовых точек с использованием метода микротехнологии представляет собой новую технологию разработки высокочувствительных и портативных биосенсоров на основе фермента цитохрома Р450 для применения в определенных целях. Более того, оптоволоконные химические сенсоры очень актуальны для различных областей, таких как поиск новых лекарственных средств, биозондирования и биомедицины. В последнее время гидрогели, применявшиеся в качестве сенсоров на основе ДНК, приобретают популярность в качестве материалов для иммобилизации в оптоволоконной химии. По сравнению с другими материалами иммобилизация в гидрогеле происходит а трех измерениях, что обеспечивает загрузку большого количества чувствительных молекул. Гидрогели (полиакриламид) представляют собой гидрофильные полимеры с поперечными связями, которым для иммобилизации можно придавать разные формы, начиная от тонких пленок и заканчивая наночастицами. Гидрогели считаются простым субстратом для иммобилизации ДНК, обладающие рядом преимуществ, таких как возможность удержания молекул, их контролируемого высвобождения, обогащения аналитов и защиты ДНК. Эти характеристики уникальны для гидрогелей по сравнению с другими материалами, пригодными для биомолекулярной иммобилизации. Более того, хорошая оптическая прозрачность гидрогелей предоставляет возможность применения удобной стратегии визуального выявления. Методы иммобилизации ДНК-биосенсоров в монолитных полиакриламидных гелях и гелевых микрочастицах часто рассматриваются как техническое достижение в области биосенсорных технологий. Выявление единичных молекул для идентификации ДНК также стало возможным с помощью электрохимического окисления гидразина.
Биосенсоры на основе оксида кремния, кварца и стекла
Поиск новых методов разработки биосенсоров привел к использованию обладающих уникальными свойствами материалов из оксида кремния, кварца и стекла. Среди этих материалов особое место заниманию наноматериалы на основе оксида кремния, обладающие наиболее высоким потенциалом для использования в производстве биосенсоров благодаря своей биосовместимости, доступности, а также электронным, оптическим и механическим свойствам. Более того, такие материалы нетоксичны, что является очень важным условием для биомедицинских и биологических сфер применения. Материалы на основе оксида кремния могут использоваться для биовизуализации, биосенсорного анализа и в терапии рака. Помимо этого флуоресцирующие материалы на основе оксида кремния уже давно применяются в биовизуализации. Интересен тот факт, что нанопровода из оксида кремния в комбинации с золотыми наночастицами представляют собой гидридные структуры, применяемые в рамках революционных подходов к лечению рака. Ковалентное прикрепление модифицированных тиолом олигомеров ДНК к оксиду кремния или стеклу обеспечивает формирование ДНК-пленок, повышающих эффективность УФ-спектроскопии и методов гибридизации. Несмотря на множество преимуществ применения наночастиц из оксида кремния, существует целый ряд требующих решения сложностей, таких как разработка методов крупномасштабного малозатратного производства, а также биосовместимость после биомолекулярного контакта. Решение этих вопросов обеспечит возможность превращения наноматериалов на основе оксида кремния в компоненты современных биосенсоров. Не имеющие проводов и электродов биосенсоры на основе микровесов на кристалле кварца представляют собой еще одну платформу для анализа взаимодействий между биомолекулами с высокой чувствительностью. Пульсации кварцевых осцилляторов возбуждаются и регистрируются с помощью антенн через электромагнитные волны без проводных соединений. Это точное бесконтактное изменение является ключевым моментом для разработки ультравысокочувствительной идентификации белков в жидкости с помощью измерительных приборов на основе биосенсоров на кристаллах кварца. Уникальные характеристики материалов на основе оксида кремния, кварца или стекла позволили разработать несколько новых высокотехнологичных биосенсоров для усовершенствования измерительных приборов, применяемых в области биомедицинских технологий, однако их экономическая целесообразность и биологическая безопасность требуют внимания.
Биосенсоры на основе наноматериалов
Для иммобилизации биосенсоров используется широкий спектр наноматериалов, в том числе наночастицы золота, серебра, оксида кремния и меди, а также материалы на основе углерода, такие как графит, графен и углеродные нанотрубки. При разработке электрохимических и других биосенсоров материалы на основе наночастиц обеспечивают высокую чувствительность и специфичность. Среди металлических наночастиц для практического использования наиболее пригодны золотые наночастицы, устойчивые к окислению и практически нетоксичные. В то же время наночастицы из других металлов, таких как серебро, при введении в организм, например, для доставки препаратов, окисляются и оказывают токсичное действие. В целом применение наноматериалов в составе биомедицинских биосенсоров ассоциировано с потенциальными сложностями. Более того, стратегии усиления сигнала с помощью наночастиц имеют потенциальные преимущества и недостатки. Тем не менее, наноматериалы считаются важными компонентами биоаналитических устройств благодаря их способности повышать чувствительность и пороги обнаружения при детектировании единичных молекул. В данном контексте стоит упомянуть изобретение наночастиц на основе платины для электрохимической амплификации с одноуровневой реакцией для выявления низкой концентрации ДНК. Аналогичным образом полупроводниковые квантовые точки и нанокристаллы из оксида железа, обладающие как оптическими, так и магнитными свойствами, можно эффективно связывать с опухолеспецифичными лигандами, такими как моноклональные антитела, пептиды или малые молекулы, для прицельного воздействия на опухолевые антигены с высокой аффинностью и специфичностью. Технология квантовых точек может применяться в изучении опухолевого микроокружения при проведении терапии, а также для доставки нанопрепаратов.
Генетически закодированные или синтетические флуоресцентные биосенсоры
Разработка меченых биосенсоров с использованием генетически закодированной или синтетической флуоресценции предоставила возможность изучать биологические процессы, в том числе различные молекулярных пути внутри клетки. Фактически метод выявления меченых флуоресценцией антител впервые был разработан для получения изображений фиксированных клеток. Эта стратегия предоставила новые возможности разработки таких биосенсоров с использованием биологических белков и малых молекул, связывающихся с аналитами и вторичными мессенджерами. Впоследствии были разработаны флуоресцентные биосенсоры для анализа двигательных белков, использующие метод выявления единичных молекул при определенной концентрации аналита. Несмотря на эти преимущества, методология выявления и анализа метки выглядит сложной. Изобретение зеленого флуоресцирующего белка и других флуоресцирующих белков предоставило ряд преимуществ с точки зрения дизайна и эффективности оптического зонда. За последнее десятилетие генетически закодированные биосенсоры, специфичные к молекулам, вовлеченным в синтез энергии, активным формам кислорода и цАМФ, позволили лучше разобраться в физиологии митохондрий. цАМФ является важной сигнальной молекулой и терапевтической мишенью для сердечно-сосудистой системы. С учетом этого биосенсоры, функционирующие на основе метода резонансного переноса энергии флуоресценции, были разработаны для визуализации цГМФ, цАМФ и ионов кальцию внутри клетки. Некоторые из таких сенсоров эффективно применяются для in vivo визуализации в первичных культурах и живых клетках. На сегодняшний день проработано достаточно много аспектов разра
xn--b1aaakaba9b1aeojjo1b6af.xn--p1ai
Биосенсор — это… Что такое Биосенсор?
Современный глюкометр для измерения уровня глюкозы в крови. Слева – игла для прокалывания кожи.Биосе́нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях[1]. В биосенсорах биологический компонент сочетается с физико-химическим преобразователем.
Биосенсоры состоят из трёх частей:
- биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д.), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии.
- преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д.), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить;
- связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде.[2].
Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАДН2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае, электрод является преобразователем, а фермент — биоселективным элементом.
С недавних пор, массивы из многих различных молекул детектора применяются в так называемых электронных носах, где наборы откликов от детекторов используются для определения веществ. Современные электронные носы, тем не менее, не используют биологический материал (то есть являются хемосенсорами).
Домашняя канарейка, которая применялась шахтерами для предупреждения об утечке газа, может считаться биосенсором. Многие из современных биосенсоров работают на том же принципе, то есть используют организмы, которые реагируют на значительно меньшие концентрации токсических веществ, чем это делает человек, предупреждая таким образом о присутствии яда. Эти приборы могут использоваться для экологического мониторинга, определения незначительных примесей нефтепродуктов и на сооружениях для очистки сточных вод.
Классификация биосенсоров
В зависимости от типа преобразователя, биосенсоры классифицируют на оптические, акустические, калориметрические, термические и электрохимические. Электрохимические биосенсоры, в свою очередь, делят на потенциометрические, амперометрические и кондуктометрические.[3]
Оптические биосенсоры
Значительная часть оптических биосенсоров основаны на явлении поверхностного плазмонного резонанса и используют свойство золотых и других материалов, а именно то, что тонкий слой золота, нанесенный на имеющую высокий коэффициент преломления стеклянную поверхность может абсорбировать лазерный свет, создавая электронные волны (поверхностные плазмоны) на золотой поверхности. Это происходит только при определенном угле падения и длине волны падающего света и в такой степени зависит от поверхности золотого слоя, что присоединение аналита к биологическому рецептору на поверхности этого слоя генерирует заметный сигнал. Сенсоры на основе поверхностного плазмонного резонанса представляют собой сенсорный чип, который состоит из пластиковой кассеты, несущей стеклянную тарелку, одна сторона которой покрыта микроскопическим слоем золота. Эта сторона взаимодействует с оптической распознающей аппаратурой прибора. Противоположная сторона тарелки соединяется с жидкостной проточной системой. Растворенные в жидкости реагенты могут непосредственно контактировать с поверхностью тарелки. Эта сторона стеклянного сенсорного чипа может быть различными путями модифицирована, позволяя легко присоединять интересующие молекулы. Обычно она покрыта карбоксиметилдекстраном или подобным веществом.
Свет с фиксированной длиной волны отражается от покрытой золотом стороны чипа под углом полного внутреннего отражения, и детектируется внутри прибора. Этот свет индуцирует исчезающую волну, которая проникает сквозь стеклянную тарелку в раствор вблизи её поверхности.
Коэффициент преломления проточной стороны сенсорного чипа прямо влияет на поведение света, отраженного от покрытой золотом стороны. Связывание веществ с поверхностью проточной стороны чипа влияет на коэффициент преломления, что можно зарегистрировать оптической аппаратурой; таким образом биологические взаимодействия могут быть измерены с высоким уровнем чувствительности.
Другие биосенсоры на основе исчезающей волны были коммерциализированы с использованием волноводов, в которых константа распространения света через волновод изменяется при абсорбции молекул на поверхность волновода. Например, в двойной поляризационной интерферометрии используются два волновода, один из которых изолирован и является эталонным, а второй волновод непосредственно контактирует с исследуемым образцом. Сравнивая константы скорости распространения света в обоих волноводах, делают заключение о концентрации аналита.
Другие оптические биосенсоры основаны в основном на изменении в абсорбции или флуоресценции соответствующего индикаторного компонента и не нуждаются в полном внутреннем отражении. Например, разработан полностью функционирующий прототип прибора для определения казеина в молоке. Прибор основан на обнаружении изменений в абсорбции золотого слоя.[4] Широко используемый в молекулярной биологии исследовательский инструмент, ДНК-микрочип, может также считаться оптическим биосенсором.
Электрохимические биосенсоры
Электрохимические биосенсоры обычно основаны на ферментативном катализе реакции, в которой освобождаются или поглощаются электроны (используемые ферменты принадлежат к классу оксидоредуктаз). Биосенсор обычно включает в себя три электрода: электрод сравнения, рабочий и вспомогательный. На поверхность рабочего электрода наносят биологический материал, который специфически вступает в реакцию с аналитом. Заряженные продукты реакции создают на рабочем электроде потенциал, который отнимается от потенциала на электроде сравнения для получения выходящего сигнала. Применяется также измерение силы тока (в этом случае интенсивность потока электронов пропорциональна концентрации аналита) при постоянном потенциале или потенциал можно измерять при нулевой силе тока (это даёт логарифмический отклик). Нужно отметить, что на потенциал электродов влияет заряд их окружения, что часто используется. Более того, возможно прямое электрическое определение небольших пептидов и белков по характерному для них заряду, используя биологически модифицированные ион-селективные полевые транзисторы (ИСПТ).[5]
Другие типы биосенсоров
В пьезоэлектрических сенсорах используются кристаллы, которые эластически деформируются при воздействии на них электрического потенциала. Переменный потенциал при определённой частоте вызывает стоячую волну в кристалле. Эта частота в значительной степени зависит от эластичных свойств кристалла, поэтому, если кристалл покрыт биологическим распознающим элементом, присоединение большого количества аналита к рецептору приведет к изменению резонансной частоты, что и служит сигналом о связывании.
Термические и магнитные биосенсоры практически не распространены.
Ссылки
- ↑ biosensor // IUPAC Gold Book
- ↑ Cavalcanti A, Shirinzadeh B, Zhang M, Kretly LC (2008). «Nanorobot Hardware Architecture for Medical Defense». Sensors 8 (5): 2932–2958. DOI:10.3390/s8052932.
- ↑ Дзядевич С.В., Солдаткін О.П. Наукові та технологічні засади створення мініатюрних електрохімічних біосенсорів. — 1-е изд. — Киев: Наукова думка, 2006. — С. 3, 6. — 256 с. — ISBN 966-00-0595-4
- ↑ H. M. Hiep et al. «A localized surface plasmon resonance based immunosensor for the detection of casein in milk» Sci. Technol. Adv. Mater. 8 (2007) 331 free download
- ↑ S.Q. Lud, M.G. Nikolaides, I. Haase, M. Fischer and A.R. Bausch (2006).»Field Effect of Screened Charges: Electrical Detection of Peptides and Proteins by a Thin Film Resistor» ChemPhysChem 7(2), 379-384 [1]
dic.academic.ru
Википедия — свободная энциклопедия
Избранная статья
Первое сражение при реке Булл-Ран (англ. First Battle of Bull Run), также Первое сражение при Манассасе) — первое крупное сухопутное сражение Гражданской войны в США. Состоялось 21 июля 1861 года возле Манассаса (штат Виргиния). Федеральная армия под командованием генерала Ирвина Макдауэлла атаковала армию Конфедерации под командованием генералов Джонстона и Борегара, но была остановлена, а затем обращена в бегство. Федеральная армия ставила своей целью захват важного транспортного узла — Манассаса, а армия Борегара заняла оборону на рубеже небольшой реки Булл-Ран. 21 июля Макдауэлл отправил три дивизии в обход левого фланга противника; им удалось атаковать и отбросить несколько бригад конфедератов. Через несколько часов Макдауэлл отправил вперёд две артиллерийские батареи и несколько пехотных полков, но южане встретили их на холме Генри и отбили все атаки. Федеральная армия потеряла в этих боях 11 орудий, и, надеясь их отбить, командование посылало в бой полк за полком, пока не были израсходованы все резервы. Между тем на поле боя подошли свежие бригады армии Юга и заставили отступить последний резерв северян — бригаду Ховарда. Отступление Ховарда инициировало общий отход всей федеральной армии, который превратился в беспорядочное бегство. Южане смогли выделить для преследования всего несколько полков, поэтому им не удалось нанести противнику существенного урона.
Хорошая статья
«Хлеб» (укр. «Хліб») — одна из наиболее известных картин украинской советской художницы Татьяны Яблонской, созданная в 1949 году, за которую ей в 1950 году была присуждена Сталинская премия II степени. Картина также была награждена бронзовой медалью Всемирной выставки 1958 года в Брюсселе, она экспонировалась на многих крупных международных выставках.
В работе над полотном художница использовала наброски, сделанные летом 1948 года в одном из наиболее благополучных колхозов Советской Украины — колхозе имени В. И. Ленина Чемеровецкого района Каменец-Подольской области, в котором в то время было одиннадцать Героев Социалистического Труда. Яблонская была восхищена масштабами сельскохозяйственных работ и людьми, которые там трудились. Советские искусствоведы отмечали, что Яблонская изобразила на своей картине «новых людей», которые могут существовать только в социалистическом государстве. Это настоящие хозяева своей жизни, которые по-новому воспринимают свою жизнь и деятельность. Произведение было задумано и создано художницей как «обобщённый образ радостной, свободной творческой работы». По мнению французского искусствоведа Марка Дюпети, эта картина стала для своего времени программным произведением и образцом украинской реалистической живописи XX столетия.
Изображение дня
Рассвет в деревне Бёрнсте в окрестностях Дюл
ru.wikipedia.green
Биосенсор — Википедия
Современный глюкометр для измерения уровня глюкозы в крови. Слева – игла для прокалывания кожи.Биосе́нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях[1]. В биосенсорах биологический компонент сочетается с физико-химическим преобразователем.
Биосенсоры состоят из трёх частей:
- биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д.), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии.
- преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д.), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить;
- связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде.[2].
Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАД·Н2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае электрод является преобразователем, а фермент — биоселективным элементом.
С недавних пор массивы из многих различных молекул детектора применяются в так называемых электронных носах, где наборы откликов от детекторов используются для определения веществ. Современные электронные носы, тем не менее, не используют биологический материал (то есть являются хемосенсорами).
Домашняя канарейка, которая применялась шахтерами для предупреждения об утечке газа, может считаться биосенсором. Многие из современных биосенсоров работают на том же принципе, то есть используют организмы, которые реагируют на значительно меньшие концентрации токсических веществ, чем это делает человек, предупреждая таким образом о присутствии яда. Эти приборы могут использоваться для экологического мониторинга, определения незначительных примесей нефтепродуктов и на сооружениях для очистки сточных вод.
Классификация биосенсоров
В зависимости от типа преобразователя, биосенсоры классифицируют на оптические, акустические, калориметрические, термические и электрохимические. Электрохимические биосенсоры, в свою очередь, делят на потенциометрические, амперометрические и кондуктометрические.[3]
Оптические биосенсоры
Значительная часть оптических биосенсоров основаны на явлении поверхностного плазмонного резонанса и используют свойство золотых и других материалов, а именно то, что тонкий слой золота, нанесенный на имеющую высокий коэффициент преломления стеклянную поверхность может абсорбировать лазерный свет, создавая электронные волны (поверхностные плазмоны) на золотой поверхности. Это происходит только при определенном угле падения и длине волны падающего света и в такой степени зависит от поверхности золотого слоя, что присоединение аналита к биологическому рецептору на поверхности этого слоя генерирует заметный сигнал. Сенсоры на основе поверхностного плазмонного резонанса представляют собой сенсорный чип, который состоит из пластиковой кассеты, несущей стеклянную тарелку, одна сторона которой покрыта микроскопическим слоем золота. Эта сторона взаимодействует с оптической распознающей аппаратурой прибора. Противоположная сторона тарелки соединяется с жидкостной проточной системой. Растворенные в жидкости реагенты могут непосредственно контактировать с поверхностью тарелки. Эта сторона стеклянного сенсорного чипа может быть различными путями модифицирована, позволяя легко присоединять интересующие молекулы. Обычно она покрыта карбоксиметилдекстраном или подобным веществом.
Свет с фиксированной длиной волны отражается от покрытой золотом стороны чипа под углом полного внутреннего отражения, и детектируется внутри прибора. Этот свет индуцирует исчезающую волну, которая проникает сквозь стеклянную тарелку в раствор вблизи её поверхности.
Коэффициент преломления проточной стороны сенсорного чипа прямо влияет на поведение света, отраженного от покрытой золотом стороны. Связывание веществ с поверхностью проточной стороны чипа влияет на коэффициент преломления, что можно зарегистрировать оптической аппаратурой; таким образом биологические взаимодействия могут быть измерены с высоким уровнем чувствительности.
Другие биосенсоры на основе исчезающей волны были коммерциализированы с использованием волноводов, в которых константа распространения света через волновод изменяется при абсорбции молекул на поверхность волновода. Например, в двойной поляризационной интерферометрии используются два волновода, один из которых изолирован и является эталонным, а второй волновод непосредственно контактирует с исследуемым образцом. Сравнивая константы скорости распространения света в обоих волноводах, делают заключение о концентрации аналита.
Оптические биосенсоры основаны в основном на изменении в абсорбции или флуоресценции соответствующего индикаторного компонента и не нуждаются в полном внутреннем отражении. Например, разработан полностью функционирующий прототип прибора для определения казеина в молоке. Прибор основан на обнаружении изменений в абсорбции золотого слоя.[4] Широко используемый в молекулярной биологии исследовательский инструмент, ДНК-микрочип, может также считаться оптическим биосенсором.
Электрохимические биосенсоры
Электрохимические биосенсоры обычно основаны на ферментативном катализе реакции, в которой освобождаются или поглощаются электроны (используемые ферменты принадлежат к классу оксидоредуктаз). Биосенсор обычно включает в себя три электрода: электрод сравнения, рабочий и вспомогательный. На поверхность рабочего электрода наносят биологический материал, который специфически вступает в реакцию с аналитом. Заряженные продукты реакции создают на рабочем электроде потенциал, который отнимается от потенциала на электроде сравнения для получения выходящего сигнала. Применяется также измерение силы тока (в этом случае интенсивность потока электронов пропорциональна концентрации аналита) при постоянном потенциале или потенциал можно измерять при нулевой силе тока (это даёт логарифмический отклик). Нужно отметить, что на потенциал электродов влияет заряд их окружения, что часто используется. Более того, возможно прямое электрическое определение небольших пептидов и белков по характерному для них заряду, используя биологически модифицированные ион-селективные полевые транзисторы (ИСПТ).[5]
Другие типы биосенсоров
В пьезоэлектрических сенсорах используются кристаллы, которые эластически деформируются при воздействии на них электрического потенциала. Переменный потенциал при определённой частоте вызывает стоячую волну в кристалле. Эта частота в значительной степени зависит от эластичных свойств кристалла, поэтому, если кристалл покрыт биологическим распознающим элементом, присоединение большого количества аналита к рецептору приведет к изменению резонансной частоты, что и служит сигналом о связывании.
Термические и магнитные биосенсоры практически не распространены.
См. также
Примечания
- ↑ biosensor // IUPAC Gold Book
- ↑ Cavalcanti A, Shirinzadeh B, Zhang M, Kretly LC (2008). «Nanorobot Hardware Architecture for Medical Defense». Sensors 8 (5): 2932–2958. DOI:10.3390/s8052932.
- ↑ Дзядевич С.В., Солдаткін О.П. Наукові та технологічні засади створення мініатюрних електрохімічних біосенсорів. — 1-е изд. — Киев: Наукова думка, 2006. — С. 3, 6. — 256 с. — ISBN 966-00-0595-4.
- ↑ H. M. Hiep et al. «A localized surface plasmon resonance based immunosensor for the detection of casein in milk» Sci. Technol. Adv. Mater. 8 (2007) 331 free download
- ↑ S.Q. Lud, M.G. Nikolaides, I. Haase, M. Fischer and A.R. Bausch (2006).»Field Effect of Screened Charges: Electrical Detection of Peptides and Proteins by a Thin Film Resistor» ChemPhysChem 7(2), 379-384 [1]
Литература
- Баника Ф.-Г., Химические и биологические сенсоры: основы и применения. Техносфера, Москва, 2014г; Цена: 869. ISBN 978-5-94836-380-6
- Будников Г.К. Биосенсоры как новый тип аналитических устройств // Соросовский образовательный журнал, 1996, № 12, c. 26-32.
- Варфоломеев С.Д. Биосенсоры // Соросовский образовательный журнал, 1997, № 1, c. 45-49.
- Компанец О.Н. Портативные оптические биосенсоры для определения биологически активных и токсичных соединений // Успехи физических наук, 2004, т. 174, № 6, c. 684-686.
- Воронов В. К., Подоплелов А. В. Физика на переломе тысячелетий: конденсированное состояние, 2-е изд., М.: ЛКИ, 2012, 336 стр., ISBN 978-5-382-01365-7
wikipedia.green
Биосенсор — Википедия
Современный глюкометр для измерения уровня глюкозы в крови. Слева – игла для прокалывания кожи.Биосе́нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях[1]. В биосенсорах биологический компонент сочетается с физико-химическим преобразователем.
Биосенсоры состоят из трёх частей:
- биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д.), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии.
- преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д.), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить;
- связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде.[2].
Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАД·Н2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае электрод является преобразователем, а фермент — биоселективным элементом.
С недавних пор массивы из многих различных молекул детектора применяются в так называемых электронных носах, где наборы откликов от детекторов используются для определения веществ. Современные электронные носы, тем не менее, не используют биологический материал (то есть являются хемосенсорами).
Домашняя канарейка, которая применялась шахтерами для предупреждения об утечке газа, может считаться биосенсором. Многие из современных биосенсоров работают на том же принципе, то есть используют организмы, которые реагируют на значительно меньшие концентрации токсических веществ, чем это делает человек, предупреждая таким образом о присутствии яда. Эти приборы могут использоваться для экологического мониторинга, определения незначительных примесей нефтепродуктов и на сооружениях для очистки сточных вод.
Классификация биосенсоров
В зависимости от типа преобразователя, биосенсоры классифицируют на оптические, акустические, калориметрические, термические и электрохимические. Электрохимические биосенсоры, в свою очередь, делят на потенциометрические, амперометрические и кондуктометрические.[3]
Оптические биосенсоры
Значительная часть оптических биосенсоров основаны на явлении поверхностного плазмонного резонанса и используют свойство золотых и других материалов, а именно то, что тонкий слой золота, нанесенный на имеющую высокий коэффициент преломления стеклянную поверхность может абсорбировать лазерный свет, создавая электронные волны (поверхностные плазмоны) на золотой поверхности. Это происходит только при определенном угле падения и длине волны падающего света и в такой степени зависит от поверхности золотого слоя, что присоединение аналита к биологическому рецептору на поверхности этого слоя генерирует заметный сигнал. Сенсоры на основе поверхностного плазмонного резонанса представляют собой сенсорный чип, который состоит из пластиковой кассеты, несущей стеклянную тарелку, одна сторона которой покрыта микроскопическим слоем золота. Эта сторона взаимодействует с оптической распознающей аппаратурой прибора. Противоположная сторона тарелки соединяется с жидкостной проточной системой. Растворенные в жидкости реагенты могут непосредственно контактировать с поверхностью тарелки. Эта сторона стеклянного сенсорного чипа может быть различными путями модифицирована, позволяя легко присоединять интересующие молекулы. Обычно она покрыта карбоксиметилдекстраном или подобным веществом.
Свет с фиксированной длиной волны отражается от покрытой золотом стороны чипа под углом полного внутреннего отражения, и детектируется внутри прибора. Этот свет индуцирует исчезающую волну, которая проникает сквозь стеклянную тарелку в раствор вблизи её поверхности.
Коэффициент преломления проточной стороны сенсорного чипа прямо влияет на поведение света, отраженного от покрытой золотом стороны. Связывание веществ с поверхностью проточной стороны чипа влияет на коэффициент преломления, что можно зарегистрировать оптической аппаратурой; таким образом биологические взаимодействия могут быть измерены с высоким уровнем чувствительности.
Другие биосенсоры на основе исчезающей волны были коммерциализированы с использованием волноводов, в которых константа распространения света через волновод изменяется при абсорбции молекул на поверхность волновода. Например, в двойной поляризационной интерферометрии используются два волновода, один из которых изолирован и является эталонным, а второй волновод непосредственно контактирует с исследуемым образцом. Сравнивая константы скорости распространения света в обоих волноводах, делают заключение о концентрации аналита.
Оптические биосенсоры основаны в основном на изменении в абсорбции или флуоресценции соответствующего индикаторного компонента и не нуждаются в полном внутреннем отражении. Например, разработан полностью функционирующий прототип прибора для определения казеина в молоке. Прибор основан на обнаружении изменений в абсорбции золотого слоя.[4] Широко используемый в молекулярной биологии исследовательский инструмент, ДНК-микрочип, может также считаться оптическим биосенсором.
Электрохимические биосенсоры
Электрохимические биосенсоры обычно основаны на ферментативном катализе реакции, в которой освобождаются или поглощаются электроны (используемые ферменты принадлежат к классу оксидоредуктаз). Биосенсор обычно включает в себя три электрода: электрод сравнения, рабочий и вспомогательный. На поверхность рабочего электрода наносят биологический материал, который специфически вступает в реакцию с аналитом. Заряженные продукты реакции создают на рабочем электроде потенциал, который отнимается от потенциала на электроде сравнения для получения выходящего сигнала. Применяется также измерение силы тока (в этом случае интенсивность потока электронов пропорциональна концентрации аналита) при постоянном потенциале или потенциал можно измерять при нулевой силе тока (это даёт логарифмический отклик). Нужно отметить, что на потенциал электродов влияет заряд их окружения, что часто используется. Более того, возможно прямое электрическое определение небольших пептидов и белков по характерному для них заряду, используя биологически модифицированные ион-селективные полевые транзисторы (ИСПТ).[5]
Другие типы биосенсоров
В пьезоэлектрических сенсорах используются кристаллы, которые эластически деформируются при воздействии на них электрического потенциала. Переменный потенциал при определённой частоте вызывает стоячую волну в кристалле. Эта частота в значительной степени зависит от эластичных свойств кристалла, поэтому, если кристалл покрыт биологическим распознающим элементом, присоединение большого количества аналита к рецептору приведет к изменению резонансной частоты, что и служит сигналом о связывании.
Термические и магнитные биосенсоры практически не распространены.
Видео по теме
См. также
Примечания
- ↑ biosensor // IUPAC Gold Book
- ↑ Cavalcanti A, Shirinzadeh B, Zhang M, Kretly LC (2008). «Nanorobot Hardware Architecture for Medical Defense». Sensors 8 (5): 2932–2958. DOI:10.3390/s8052932.
- ↑ Дзядевич С.В., Солдаткін О.П. Наукові та технологічні засади створення мініатюрних електрохімічних біосенсорів. — 1-е изд. — Киев: Наукова думка, 2006. — С. 3, 6. — 256 с. — ISBN 966-00-0595-4.
- ↑ H. M. Hiep et al. «A localized surface plasmon resonance based immunosensor for the detection of casein in milk» Sci. Technol. Adv. Mater. 8 (2007) 331 free download
- ↑ S.Q. Lud, M.G. Nikolaides, I. Haase, M. Fischer and A.R. Bausch (2006).»Field Effect of Screened Charges: Electrical Detection of Peptides and Proteins by a Thin Film Resistor» ChemPhysChem 7(2), 379-384 [1]
Литература
- Баника Ф.-Г., Химические и биологические сенсоры: основы и применения. Техносфера, Москва, 2014г; Цена: 869. ISBN 978-5-94836-380-6
- Будников Г.К. Биосенсоры как новый тип аналитических устройств // Соросовский образовательный журнал, 1996, № 12, c. 26-32.
- Варфоломеев С.Д. Биосенсоры // Соросовский образовательный журнал, 1997, № 1, c. 45-49.
- Компанец О.Н. Портативные оптические биосенсоры для определения биологически активных и токсичных соединений // Успехи физических наук, 2004, т. 174, № 6, c. 684-686.
- Воронов В. К., Подоплелов А. В. Физика на переломе тысячелетий: конденсированное состояние, 2-е изд., М.: ЛКИ, 2012, 336 стр., ISBN 978-5-382-01365-7
wiki2.red
Биосенсоры Википедия
Современный глюкометр для измерения уровня глюкозы в крови. Слева – игла для прокалывания кожи.Биосе́нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях[1]. В биосенсорах биологический компонент сочетается с физико-химическим преобразователем.
Биосенсоры состоят из трёх частей:
- биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д.), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии.
- преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д.), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить;
- связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде.[2].
Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАД·Н2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае электрод является преобразователем, а фермент — биоселективным элементом.
С недавних пор массивы из многих различных молекул детектора применяются в так называемых электронных носах, где наборы откликов от детекторов используются для определения веществ. Современные электронные носы, тем не менее, не используют биологический материал (то есть являются хемосенсорами).
Домашняя канарейка, которая применялась шахтёрами для предупреждения об утечке газа, может считаться биосенсором. Многие из современных биосенсоров работают на том же принципе, то есть используют организмы, которые реагируют на значительно меньшие концентрации токсических веществ, чем это делает человек, предупреждая таким образом о присутствии яда. Эти приборы могут использоваться для экологического мониторинга, определения незначительных примесей нефтепродуктов и на сооружениях для очистки сточных вод.
История создания биосенсоров[ | ]
Идея создания биосенсоров восходит опыту проведённому немецким физиологом Максом Кремером
ru-wiki.ru
Биосенсор Википедия
Современный глюкометр для измерения уровня глюкозы в крови. Слева – игла для прокалывания кожи.Биосе́нсор — это аналитический прибор, в котором для определения химических соединений используются реакции этих соединений, катализируемые ферментами, иммунохимические реакции или реакции, проходящие в органеллах, клетках или тканях[1]. В биосенсорах биологический компонент сочетается с физико-химическим преобразователем.
Биосенсоры состоят из трёх частей:
- биоселективного элемента (биологический материал, например ткани, микроорганизмы, органеллы, клеточные рецепторы, ферменты, антитела, нуклеиновые кислоты, и т. д.), материал биологического происхождения или биомимик). Чувствительный элемент может быть создан с помощью биоинженерии.
- преобразователя (работает на физико-химических принципах; оптический, пьезоэлектрический, электрохимический, и т. д.), который преобразует сигнал, появляющийся в результате взаимодействия аналита с биоселективным элементом, в другой сигнал, который проще измерить;
- связанная электроника, которая отвечает в первую очередь за отображение результатов в удобном для пользователя виде.[2].
Самый известный пример коммерческого биосенсора — это биосенсор для измерения уровня глюкозы в крови, в котором используется фермент глюкозоксидаза для расщепления содержащейся в крови глюкозы. В процессе расщепления фермент сначала окисляет глюкозу и использует два электрона для восстановления ФАД (компонент фермента) в ФАД·Н2, который, в свою очередь, окисляется в несколько ступеней электродом. Результирующий ток пропорционален концентрации глюкозы. В этом случае электрод является преобразователем, а фермент — биоселективным элементом.
С недавних пор массивы из многих различных молекул детектора применяются в так называемых электронных носах, где наборы откликов от детекторов используются для определения веществ. Современные электронные носы, тем не менее, не используют биологический материал (то есть являются хемосенсорами).
Домашняя канарейка, которая применялась шахтёрами для предупреждения об утечке газа, может считаться биосенсором. Многие из современных биосенсоров работают на том же принципе, то есть используют организмы, которые реагируют на значительно меньшие концентрации токсических веществ, чем это делает человек, предупреждая таким образом о присутствии яда. Эти приборы могут использоваться для экологического мониторинга, определения незначительных примесей нефтепродуктов и на сооружениях для очистки сточных вод.
История создания биосенсоров[ | ]
Идея создания биосенсоров восходит опыту проведённому немецким физиологом Максом Кремером
ru-wiki.ru

