Что представляют собой галогены. Какими уникальными свойствами обладают эти элементы. Как галогены применяются в промышленности и быту. Почему галогены играют важную роль в органической и неорганической химии.
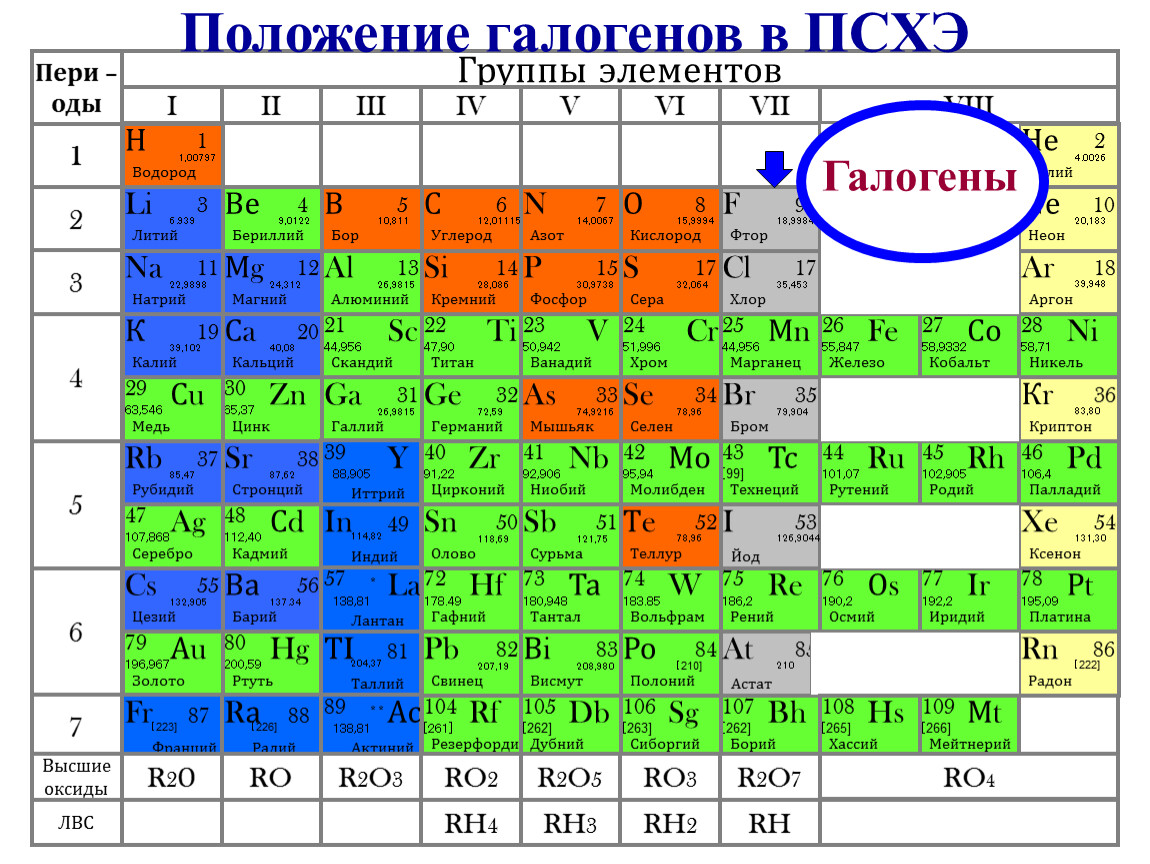
Что такое галогены и где они находятся в периодической таблице
Галогены — это группа химических элементов, расположенных в 17 группе (по старой классификации — VII группа главная подгруппа) периодической системы Д.И. Менделеева. К галогенам относятся следующие элементы:
- Фтор (F)
- Хлор (Cl)
- Бром (Br)
- Йод (I)
- Астат (At)
- Теннессин (Ts)
Два последних элемента — астат и теннессин — являются радиоактивными и не встречаются в природе в значительных количествах. Поэтому в большинстве случаев, говоря о галогенах, имеют в виду первые четыре элемента этой группы.
Особенности электронного строения и химические свойства галогенов
Атомы галогенов имеют 7 электронов на внешнем энергетическом уровне. Это определяет их высокую химическую активность и стремление присоединить еще один электрон, чтобы достроить внешний уровень до стабильного октета. Какие основные свойства характерны для галогенов?
- Высокая электроотрицательность
- Сильные окислительные способности
- Образование одновалентных отрицательных ионов (F-, Cl-, Br-, I-)
- Высокая реакционная способность
- Образование ковалентных связей с другими неметаллами
При этом химическая активность галогенов уменьшается от фтора к йоду. Фтор является самым сильным окислителем среди всех химических элементов.
Физические свойства и агрегатные состояния галогенов
В свободном виде галогены существуют в виде двухатомных молекул (F2, Cl2, Br2, I2). При нормальных условиях их агрегатные состояния различаются:
- Фтор и хлор — газы
- Бром — жидкость
- Йод — твердое кристаллическое вещество
Цвет галогенов изменяется от бледно-желтого (фтор) до фиолетового (йод). Все галогены обладают резким неприятным запахом и являются ядовитыми веществами. Температуры кипения и плавления галогенов возрастают от фтора к йоду.
Важнейшие соединения галогенов и их применение
Галогены образуют множество важных соединений, которые широко применяются в различных отраслях. Рассмотрим некоторые из них:

Галогеноводороды
HF, HCl, HBr, HI — бесцветные газы с резким запахом. Их водные растворы являются сильными кислотами (кроме HF). Соляная кислота (раствор HCl) — одна из важнейших кислот в химической промышленности.
Галогениды металлов
NaCl, KCl, CaCl2 и другие соли галогенводородных кислот широко распространены в природе и имеют большое практическое значение. Хлорид натрия (поваренная соль) — важнейшее пищевое вещество.
Оксиды галогенов
Cl2O, ClO2, Br2O и др. — нестойкие соединения. Диоксид хлора ClO2 применяется для отбеливания бумаги и дезинфекции воды.
Кислородсодержащие кислоты
Биологическая роль и применение галогенов в медицине
Галогены играют важную роль в функционировании живых организмов. Какие галогены особенно важны с биологической точки зрения?
- Хлор входит в состав желудочного сока в виде соляной кислоты
- Йод необходим для синтеза гормонов щитовидной железы
- Фтор укрепляет зубную эмаль и костную ткань
В медицине галогены и их соединения применяются как антисептики, лекарственные препараты, контрастные вещества для рентгенодиагностики. Йод используется для обработки ран, хлорсодержащие препараты — для дезинфекции.

Промышленное получение и применение галогенов
Основными промышленными способами получения галогенов являются:
- Электролиз водных растворов галогенидов (для хлора и фтора)
- Окисление бромидов и йодидов хлором
В промышленности галогены находят следующее применение:
- Хлор — производство пластмасс, дезинфекция воды
- Фтор — получение фторопластов, фреонов
- Бром — производство антипиренов, лекарств
- Йод — медицина, фотография, катализаторы
Хлор является одним из важнейших продуктов химической промышленности. Его мировое производство превышает 50 млн тонн в год.
Экологические аспекты использования галогенов и их соединений
Применение галогенов и галогенсодержащих веществ связано с определенными экологическими рисками. Каковы основные проблемы?
- Токсичность свободных галогенов для живых организмов
- Накопление хлорорганических соединений в окружающей среде
- Разрушение озонового слоя фреонами
- Образование диоксинов при сжигании хлорсодержащих отходов
Для снижения негативного воздействия на экологию разрабатываются альтернативные технологии без использования галогенов, внедряются более безопасные заменители. Ведется строгий контроль за производством и применением особо опасных галогенсодержащих веществ.

Перспективные направления исследований и разработок в области химии галогенов
Несмотря на длительную историю изучения, химия галогенов продолжает активно развиваться. Какие направления исследований наиболее актуальны сегодня?
- Синтез новых фторорганических соединений для создания современных материалов
- Разработка эффективных методов получения особо чистых галогенов
- Исследование свойств и возможностей применения астата
- Поиск экологически безопасных альтернатив галогенсодержащим веществам
- Изучение биологической роли следовых количеств галогенов
Развитие химии галогенов открывает новые перспективы для создания инновационных материалов и технологий в различных областях науки и техники.
Лампа галогенная Лисма КГ 220-1500 R7s 1500 Вт, цена
Галогенная лампа Лисма КГ представляет собой лампу накаливания, колба которой заполнена инертным газом с парами галогенов, благодаря чему уменьшается испарение вольфрамовой нити. Это увеличивает срок службы лампы и позволяет повысить температуру спирали, что обеспечивает эффективную светоотдачу галогенных ламп. Галогенная лампа Лисма КГ имеет трубчатую прозрачную колбу с цоколем R7s (линейные двухцокольные) и предназначена для использования в прожекторах и закрытых светильниках сетевого напряже…
Читать далее
- Бренд
- Лисма
-
Диаметр
?
Диаметр — фактический диаметр изделия с учетом толщины стенки.

- 12 мм
- Длина
- 254 мм
- Мощность лампы
- 1500 Вт
-
Назначение
?
Осветительные приборы имеют особенности по использованию — большинство используются под потолком, некоторые виды подходят для крепления к стене. Другие же используются например для подсветки картин, зеркал, лестниц. Также существуют приборы для освещения растений.
- Для освещения, Для прожектора
- Напряжение сети
- 220 В
- Световой поток
- 33000 лм
-
Тип цоколя
?
Цоколь — это часть лампы освещения предназначенная для ее крепления в патроне и подведения к лампе электрического тока.

Различают:
- резьбовой – Эдисона Е;
- штырьковой G;
- штифтовой B;
- цоколь, контакты в котором утоплены – R;
- фокусирующий – Р;
- софитный аналог S;
- кабельный вид К;
- телефонный – Т;
- бесцокольный – W
- R7s
-
Форма ламп
?
Форма определяет назначение лампы, возможность использования в тех или иных светильниках и т.д
Самые распространенные:
- грушевидная соответствует форме обычных ламп накаливания;
- свеча — используются в более современных люстрах и светильниках, а также для декоративного освещения;
- линейная — применяется преимущественно в потолочных и настенных светильниках, в административных, офисных и торговых помещениях;
Также есть декоративные варианты, например свеча на ветру.

- Линейная
Все характеристики
Лампы галогенные капсюльные, Лампы, www.tdmelectric.ru, заказ, дёшево
Лампы галогенные капсюльные, Лампы, www.tdmelectric.ru, заказ, дёшевоВключите в вашем браузере JavaScript!
- Главная
- Светотехника
- Лампы
- Лампы галогенные (накаливания)
Сортировка Сортировкапо возрастанию ценыпо убыванию ценысначала новыепо названию
20. 75 руб
75 руб
Лампа капсульная галогенная JC — 10Вт — 12В — G4 прозрачная TDM
20.75 руб
Лампа капсульная галогенная JC — 20Вт — 12В — G4 прозрачная TDM
20.98 руб
Лампа капсульная галогенная JC — 50 Вт — 12 В — GY6.35 прозрачная TDM
37.99 руб
Лампа капсульная галогенная JCD — 40 Вт — 230 В — G9 прозрачная TDM
37.99 руб
Лампа капсульная галогенная JCD — 60 Вт — 230 В — G9 прозрачная TDM
43 руб
Лампа капсульная галогенная JCD — 40 Вт — 230 В — G9 матовая TDM
43 руб
Лампа капсульная галогенная JCD — 60 Вт — 230 В — G9 матовая TDM
Назначение
- Для местного освещения и местной подсветки, для освещения рабочих зон, подсветки мебели и витрин.

Преимущества
- Обладают идеальной цветопередачей.
- Невосприимчивы к перепадам температур.
- Компактный размер.
- Совместимы с регуляторами яркости (диммерами) и различными датчиками.
- Поставляются в цветной индивидуальной коробке, оформленной в фирменном стиле. Маркировка и упаковка соответствуют требованиям стандартов.
- Галогенные лампы рабочего напряжения 230 В сертифицированы по стандартам ТР ТС.
- Средний срок службы ламп составляет 2 000 часов.
Быстрый заказ
Контактное лицо (ФИО):
Контактный телефон:
Email:
Согласие на обработку персональных данных
Настоящим подтверждаю, что я ознакомлен и согласен с условиями оферты и политики конфиденциальности.
Получать уведомления о заказе
С помощью уведомлений о заказе можно не только получать актуальную информацию по заказу, но и иметь быстрый канал связи с магазином
Галоген | Элементы, примеры, свойства, использование и факты
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Жан-Батист-Андре Дюма
- Похожие темы:
- галогенорганическое соединение йод фтор хлор бром
Просмотреть весь связанный контент →
Популярные вопросы
Что такое галогенные элементы?
Галогенные элементы представляют собой шесть элементов 17-й группы периодической таблицы. Группа 17 занимает вторую колонку справа в периодической таблице и содержит фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Астат и теннессин являются радиоактивными элементами с очень коротким периодом полураспада и поэтому не встречаются в природе.
Группа 17 занимает вторую колонку справа в периодической таблице и содержит фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Астат и теннессин являются радиоактивными элементами с очень коротким периодом полураспада и поэтому не встречаются в природе.
Каковы основные свойства галогенных элементов?
Галогенные элементы очень реакционноспособны. С натрием они производят соли, из которых наиболее известна поваренная соль (хлорид натрия, NaCl). Каждый атом галогена имеет семь валентных электронов на внешней электронной оболочке. Поэтому, когда атом галогена может получить электрон от атома другого элемента, два атома образуют очень стабильное соединение, потому что тогда самая внешняя электронная оболочка атома галогена заполнена.
В каких случаях используются галогеновые элементы?
Хлор используется для очистки воды. Кроме того, хлор входит в состав поваренной соли, хлорида натрия, который является одним из наиболее широко используемых химических соединений. Фтор используется во фторидах, которые добавляют в воду для предотвращения кариеса. Йод используется как антисептик.
Фтор используется во фторидах, которые добавляют в воду для предотвращения кариеса. Йод используется как антисептик.
Почему эти элементы называются галогенами?
При взаимодействии этих элементов с натрием образуются соли. Наиболее известным из них является хлорид натрия или обычная поваренная соль (также называемая галитом). Слово галоген происходит от греческих корней hal-, что означает «соль», и -gen , что означает «производить».
Сводка
Прочтите краткий обзор этой темы
галоген , любой из шести неметаллических элементов, составляющих группу 17 (группа VIIa) периодической таблицы. Галогенсодержащие элементы: фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Им дали название галоген 9.0046 , от греческих корней hal — («соль») и — gen («производить»), потому что все они производят натриевые соли со схожими свойствами, из которых лучше всего подходит хлорид натрия — поваренная соль, или галит. известный.
известный.
Свободные галогены не встречаются в природе из-за их большой реакционной способности. В комбинированной форме фтор является самым распространенным из галогенов в земной коре. Процентное содержание галогенов в изверженных породах земной коры: фтора 0,06, хлора 0,031, брома 0,00016, йода 0,00003. Астатин и теннессин не встречаются в природе, так как состоят только из короткоживущих радиоактивных изотопов.
Галогенные элементы имеют большое сходство друг с другом в их общем химическом поведении и в свойствах их соединений с другими элементами. Однако наблюдается прогрессивное изменение свойств от фтора через хлор, бром и йод к астату — разница между двумя последовательными элементами наиболее заметна для фтора и хлора. Фтор является наиболее реакционноспособным из галогенов и, фактически, из всех элементов, и у него есть некоторые другие свойства, которые отличают его от других галогенов.
Хлор является наиболее известным из галогенных элементов. Свободный элемент широко используется в качестве реагента для очистки воды и используется в ряде химических процессов. Поваренная соль, хлорид натрия, безусловно, является одним из самых привычных химических соединений. Фториды известны главным образом тем, что их добавляют в воду для предотвращения кариеса, но органические фториды также используются в качестве хладагентов и смазочных материалов. Йод наиболее известен как антисептик, а бром используется в основном для получения соединений брома, которые используются в антипиренах и в качестве пестицидов общего назначения. В прошлом дибромид этилена широко использовался в качестве присадки к этилированному бензину.
Поваренная соль, хлорид натрия, безусловно, является одним из самых привычных химических соединений. Фториды известны главным образом тем, что их добавляют в воду для предотвращения кариеса, но органические фториды также используются в качестве хладагентов и смазочных материалов. Йод наиболее известен как антисептик, а бром используется в основном для получения соединений брома, которые используются в антипиренах и в качестве пестицидов общего назначения. В прошлом дибромид этилена широко использовался в качестве присадки к этилированному бензину.
Вероятно, самое важное обобщение, которое можно сделать о галогенных элементах, состоит в том, что все они являются окислителями; то есть они повышают степень окисления или степень окисления других элементов — свойство, которое раньше приравнивалось к соединению с кислородом, но теперь интерпретируется в терминах переноса электронов от одного атома к другому. При окислении другого элемента восстанавливается сам галоген; т. е. степень окисления 0 свободного элемента снижается до -1. Галогены могут соединяться с другими элементами, образуя соединения, известные как галогениды, а именно фториды, хлориды, бромиды, йодиды и астатиды. Многие из галогенидов можно рассматривать как соли соответствующих галогеноводородов, которые при комнатной температуре и атмосферном давлении представляют собой бесцветные газы и (за исключением фтористого водорода) образуют в водном растворе сильные кислоты. Действительно, общий термин 9Соль 0045 получают из каменной или поваренной соли (хлорида натрия). Склонность галогенных элементов к образованию солеобразных (т. е. высокоионных) соединений возрастает в следующем порядке: астат < йод < бром < хлор < фтор. Фториды обычно более стабильны, чем соответствующие хлориды, бромиды или иодиды. (Часто астат опускают из общих рассуждений о галогенах, потому что о нем известно меньше, чем о других элементах.)
Галогены могут соединяться с другими элементами, образуя соединения, известные как галогениды, а именно фториды, хлориды, бромиды, йодиды и астатиды. Многие из галогенидов можно рассматривать как соли соответствующих галогеноводородов, которые при комнатной температуре и атмосферном давлении представляют собой бесцветные газы и (за исключением фтористого водорода) образуют в водном растворе сильные кислоты. Действительно, общий термин 9Соль 0045 получают из каменной или поваренной соли (хлорида натрия). Склонность галогенных элементов к образованию солеобразных (т. е. высокоионных) соединений возрастает в следующем порядке: астат < йод < бром < хлор < фтор. Фториды обычно более стабильны, чем соответствующие хлориды, бромиды или иодиды. (Часто астат опускают из общих рассуждений о галогенах, потому что о нем известно меньше, чем о других элементах.)
Окислительная сила галогенов возрастает в том же порядке, т. е. от астата к фтору. Поэтому из галогенных элементов с наибольшим трудом получается элементарный фтор, с наименьшим — йод. Галогенные элементы как класс относятся к неметаллам, но астат проявляет определенные свойства, напоминающие свойства металлов.
Галогенные элементы как класс относятся к неметаллам, но астат проявляет определенные свойства, напоминающие свойства металлов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Химическое поведение галогенных элементов удобнее всего обсуждать с точки зрения их положения в периодической таблице элементов. В периодической таблице галогены составляют группу 17 (согласно системе нумерации, принятой Международным союзом теоретической и прикладной химии), группу, непосредственно предшествующую благородным газам. Атомы галогенов несут семь валентных электронов на внешней электронной оболочке. Эти семь крайних электронов находятся на двух различных орбиталях, обозначенных как 9.0045 s (с двумя электронами) и p (с пятью). Потенциально атом галогена может содержать еще один электрон (на орбитали p ), что придаст образующемуся иону галогенида такое же расположение (конфигурацию), что и благородный газ рядом с ним в периодической таблице. Эти электронные конфигурации исключительно стабильны. Эта ярко выраженная склонность галогенов приобретать дополнительный электрон делает их сильными окислителями.
Эти электронные конфигурации исключительно стабильны. Эта ярко выраженная склонность галогенов приобретать дополнительный электрон делает их сильными окислителями.
При комнатной температуре и атмосферном давлении галогенные элементы в свободном состоянии существуют в виде двухатомных молекул. В молекулярном фторе (F 2 ) атомы удерживаются вместе связью, состоящей из объединения p орбиталей каждого атома, при этом такая связь классифицируется как сигма-связь. Следует отметить, что энергия диссоциации фтора (энергия, необходимая для разрыва связи F—F) более чем на 30 % меньше, чем у хлора, но аналогична энергии йода (I 2 ). Слабость одинарной связи F—F по сравнению с хлором можно объяснить небольшим размером фтора, что приводит к уменьшению перекрывания связывающих орбиталей и увеличению отталкивания несвязывающих орбиталей. Однако в йоде p орбитали более размыты, что означает, что связь становится слабее, чем в хлоре или броме.
Галоген | Элементы, примеры, свойства, использование и факты
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Жан-Батист-Андре Дюма
- Похожие темы:
- галогенорганическое соединение йод фтор хлор бром
Просмотреть всю связанную информацию →
Самые популярные вопросы
Что такое галогенные элементы?
Галогенные элементы представляют собой шесть элементов 17-й группы периодической таблицы. Группа 17 занимает вторую колонку справа в периодической таблице и содержит фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Астат и теннессин являются радиоактивными элементами с очень коротким периодом полураспада и поэтому не встречаются в природе.
Группа 17 занимает вторую колонку справа в периодической таблице и содержит фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Астат и теннессин являются радиоактивными элементами с очень коротким периодом полураспада и поэтому не встречаются в природе.
Каковы основные свойства галогенных элементов?
Галогенные элементы очень реакционноспособны. С натрием они производят соли, из которых наиболее известна поваренная соль (хлорид натрия, NaCl). Каждый атом галогена имеет семь валентных электронов на внешней электронной оболочке. Поэтому, когда атом галогена может получить электрон от атома другого элемента, два атома образуют очень стабильное соединение, потому что тогда самая внешняя электронная оболочка атома галогена заполнена.
В каких случаях используются галогеновые элементы?
Хлор используется для очистки воды. Кроме того, хлор входит в состав поваренной соли, хлорида натрия, который является одним из наиболее широко используемых химических соединений. Фтор используется во фторидах, которые добавляют в воду для предотвращения кариеса. Йод используется как антисептик.
Фтор используется во фторидах, которые добавляют в воду для предотвращения кариеса. Йод используется как антисептик.
Почему эти элементы называются галогенами?
При взаимодействии этих элементов с натрием образуются соли. Наиболее известным из них является хлорид натрия или обычная поваренная соль (также называемая галитом). Слово галоген происходит от греческих корней hal-, что означает «соль», и -gen , что означает «производить».
Сводка
Прочтите краткий обзор этой темы
галоген , любой из шести неметаллических элементов, составляющих группу 17 (группа VIIa) периодической таблицы. Галогенсодержащие элементы: фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Им дали название галоген 9.0046 , от греческих корней hal — («соль») и — gen («производить»), потому что все они производят натриевые соли со схожими свойствами, из которых лучше всего подходит хлорид натрия — поваренная соль, или галит. известный.
известный.
Свободные галогены не встречаются в природе из-за их большой реакционной способности. В комбинированной форме фтор является самым распространенным из галогенов в земной коре. Процентное содержание галогенов в изверженных породах земной коры: фтора 0,06, хлора 0,031, брома 0,00016, йода 0,00003. Астатин и теннессин не встречаются в природе, так как состоят только из короткоживущих радиоактивных изотопов.
Галогенные элементы имеют большое сходство друг с другом в их общем химическом поведении и в свойствах их соединений с другими элементами. Однако наблюдается прогрессивное изменение свойств от фтора через хлор, бром и йод к астату — разница между двумя последовательными элементами наиболее заметна для фтора и хлора. Фтор является наиболее реакционноспособным из галогенов и, фактически, из всех элементов, и у него есть некоторые другие свойства, которые отличают его от других галогенов.
Хлор является наиболее известным из галогенных элементов. Свободный элемент широко используется в качестве реагента для очистки воды и используется в ряде химических процессов. Поваренная соль, хлорид натрия, безусловно, является одним из самых привычных химических соединений. Фториды известны главным образом тем, что их добавляют в воду для предотвращения кариеса, но органические фториды также используются в качестве хладагентов и смазочных материалов. Йод наиболее известен как антисептик, а бром используется в основном для получения соединений брома, которые используются в антипиренах и в качестве пестицидов общего назначения. В прошлом дибромид этилена широко использовался в качестве присадки к этилированному бензину.
Поваренная соль, хлорид натрия, безусловно, является одним из самых привычных химических соединений. Фториды известны главным образом тем, что их добавляют в воду для предотвращения кариеса, но органические фториды также используются в качестве хладагентов и смазочных материалов. Йод наиболее известен как антисептик, а бром используется в основном для получения соединений брома, которые используются в антипиренах и в качестве пестицидов общего назначения. В прошлом дибромид этилена широко использовался в качестве присадки к этилированному бензину.
Вероятно, самое важное обобщение, которое можно сделать о галогенных элементах, состоит в том, что все они являются окислителями; то есть они повышают степень окисления или степень окисления других элементов — свойство, которое раньше приравнивалось к соединению с кислородом, но теперь интерпретируется в терминах переноса электронов от одного атома к другому. При окислении другого элемента восстанавливается сам галоген; т. е. степень окисления 0 свободного элемента снижается до -1. Галогены могут соединяться с другими элементами, образуя соединения, известные как галогениды, а именно фториды, хлориды, бромиды, йодиды и астатиды. Многие из галогенидов можно рассматривать как соли соответствующих галогеноводородов, которые при комнатной температуре и атмосферном давлении представляют собой бесцветные газы и (за исключением фтористого водорода) образуют в водном растворе сильные кислоты. Действительно, общий термин 9Соль 0045 получают из каменной или поваренной соли (хлорида натрия). Склонность галогенных элементов к образованию солеобразных (т. е. высокоионных) соединений возрастает в следующем порядке: астат < йод < бром < хлор < фтор. Фториды обычно более стабильны, чем соответствующие хлориды, бромиды или иодиды. (Часто астат опускают из общих рассуждений о галогенах, потому что о нем известно меньше, чем о других элементах.)
Галогены могут соединяться с другими элементами, образуя соединения, известные как галогениды, а именно фториды, хлориды, бромиды, йодиды и астатиды. Многие из галогенидов можно рассматривать как соли соответствующих галогеноводородов, которые при комнатной температуре и атмосферном давлении представляют собой бесцветные газы и (за исключением фтористого водорода) образуют в водном растворе сильные кислоты. Действительно, общий термин 9Соль 0045 получают из каменной или поваренной соли (хлорида натрия). Склонность галогенных элементов к образованию солеобразных (т. е. высокоионных) соединений возрастает в следующем порядке: астат < йод < бром < хлор < фтор. Фториды обычно более стабильны, чем соответствующие хлориды, бромиды или иодиды. (Часто астат опускают из общих рассуждений о галогенах, потому что о нем известно меньше, чем о других элементах.)
Окислительная сила галогенов возрастает в том же порядке, т. е. от астата к фтору. Поэтому из галогенных элементов с наибольшим трудом получается элементарный фтор, с наименьшим — йод. Галогенные элементы как класс относятся к неметаллам, но астат проявляет определенные свойства, напоминающие свойства металлов.
Галогенные элементы как класс относятся к неметаллам, но астат проявляет определенные свойства, напоминающие свойства металлов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Химическое поведение галогенных элементов удобнее всего обсуждать с точки зрения их положения в периодической таблице элементов. В периодической таблице галогены составляют группу 17 (согласно системе нумерации, принятой Международным союзом теоретической и прикладной химии), группу, непосредственно предшествующую благородным газам. Атомы галогенов несут семь валентных электронов на внешней электронной оболочке. Эти семь крайних электронов находятся на двух различных орбиталях, обозначенных как 9.0045 s (с двумя электронами) и p (с пятью). Потенциально атом галогена может содержать еще один электрон (на орбитали p ), что придаст образующемуся иону галогенида такое же расположение (конфигурацию), что и благородный газ рядом с ним в периодической таблице.


