Что такое гальванический элемент и как он работает. Из каких основных компонентов состоит гальванический элемент. Какие химические реакции происходят в гальваническом элементе. Где применяются гальванические элементы в современном мире.
Что такое гальванический элемент?
Гальванический элемент — это химический источник тока, в котором электрическая энергия вырабатывается в результате протекания окислительно-восстановительной реакции между электродами, погруженными в электролит. Другими словами, это устройство, преобразующее химическую энергию в электрическую.
Гальванический элемент был изобретен итальянским ученым Луиджи Гальвани в конце 18 века. Именно в честь него этот тип источников тока и получил свое название. Гальвани обнаружил, что если соединить два разных металла проводником и поместить их в электролит, то между ними возникнет электрический ток.
Принцип работы гальванического элемента
Принцип работы гальванического элемента основан на протекании окислительно-восстановительной реакции между двумя электродами, погруженными в раствор электролита. При этом:
- На отрицательном электроде (аноде) происходит реакция окисления — отдача электронов.
- На положительном электроде (катоде) идет реакция восстановления — принятие электронов.
- Электроны движутся от анода к катоду по внешней цепи, создавая электрический ток.
- Ионы в электролите замыкают внутреннюю цепь.
Таким образом, химическая энергия окислительно-восстановительной реакции преобразуется в электрическую энергию тока во внешней цепи.
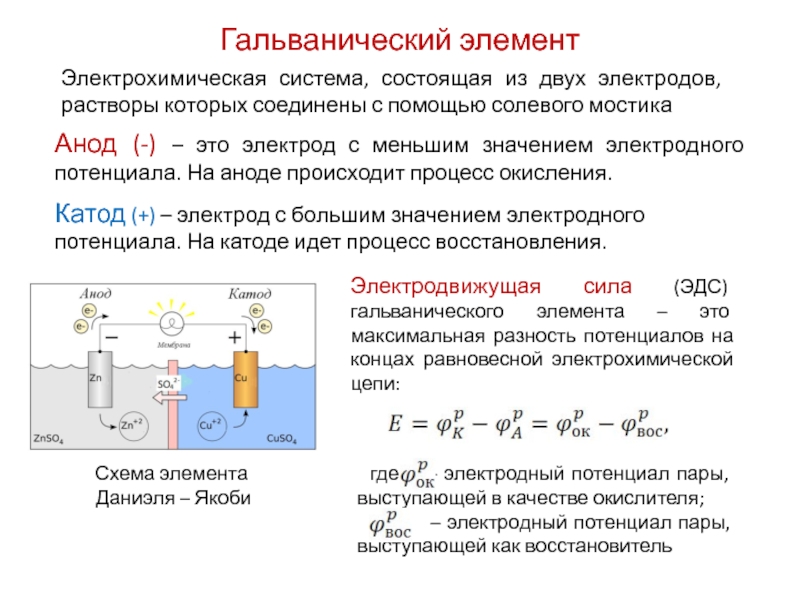
Устройство гальванического элемента
Основные компоненты гальванического элемента:
- Анод — отрицательный электрод, на котором происходит окисление.
- Катод — положительный электрод, на котором происходит восстановление.
- Электролит — проводящий раствор, в который погружены электроды.
- Диафрагма или солевой мостик — для разделения анодного и катодного пространств.
- Внешняя цепь — для протекания электронов от анода к катоду.
Анод и катод изготавливаются из разных металлов или других электропроводящих материалов. Выбор материалов электродов определяет напряжение элемента.

Химические реакции в гальваническом элементе
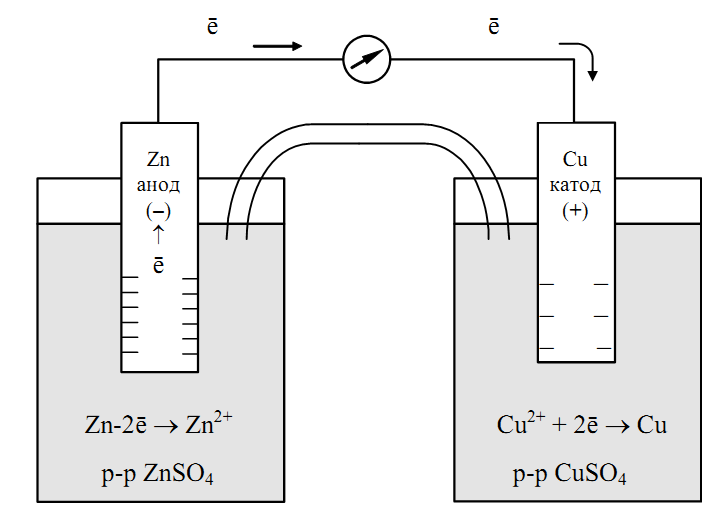
Рассмотрим для примера простейший гальванический элемент — медно-цинковый элемент Даниэля-Якоби:
- Анод — цинковая пластина, погруженная в раствор сульфата цинка.
- Катод — медная пластина, погруженная в раствор сульфата меди.
- Электроды соединены проводником и разделены пористой перегородкой.
На аноде происходит окисление цинка:
Zn → Zn²⁺ + 2e⁻
На катоде идет восстановление ионов меди:
Cu²⁺ + 2e⁻ → Cu
Суммарная реакция:
Zn + Cu²⁺ → Zn²⁺ + Cu
В результате цинковый электрод растворяется, а на медном осаждается металлическая медь. Возникает электрический ток во внешней цепи.
Виды гальванических элементов
Существует множество разновидностей гальванических элементов, различающихся материалами электродов и составом электролита. Основные типы:
- Марганцево-цинковые (солевые батарейки)
- Щелочные (алкалиновые)
- Серебряно-цинковые
- Литиевые
- Ртутно-цинковые
- Воздушно-цинковые
Каждый тип имеет свои преимущества и недостатки по емкости, напряжению, сроку службы, стоимости и другим параметрам.

Применение гальванических элементов
Гальванические элементы широко применяются как автономные источники питания во многих областях:
- Портативная электроника (смартфоны, ноутбуки, фотоаппараты)
- Бытовая техника (часы, пульты, игрушки)
- Медицинские приборы (слуховые аппараты, кардиостимуляторы)
- Автомобильная электрика
- Резервные источники питания
- Военная и космическая техника
Несмотря на развитие аккумуляторов, одноразовые гальванические элементы по-прежнему востребованы благодаря низкой стоимости, длительному сроку хранения и высокой удельной емкости.
Преимущества и недостатки гальванических элементов
Основные достоинства гальванических элементов:
- Простота конструкции
- Невысокая стоимость
- Длительный срок хранения
- Высокая удельная емкость
- Широкий диапазон рабочих температур
К недостаткам можно отнести:
- Одноразовость использования
- Постепенное снижение напряжения при разряде
- Возможность вытекания электролита
- Экологические проблемы с утилизацией
Как правильно использовать гальванические элементы?
Несколько рекомендаций по эксплуатации гальванических элементов:
- Не смешивайте элементы разных типов и производителей.
- Соблюдайте полярность при установке.
- Извлекайте элементы из устройств при длительном хранении.
- Не пытайтесь заряжать одноразовые элементы.
- Утилизируйте использованные элементы в специальных пунктах приема.
- Храните элементы в сухом прохладном месте.
При правильном использовании гальванические элементы обеспечат надежное автономное питание ваших устройств.
Гальванический элемент: схема, принцип работы, состав
Главная » Виды батареек
На чтение 5 мин Просмотров 3.1к.
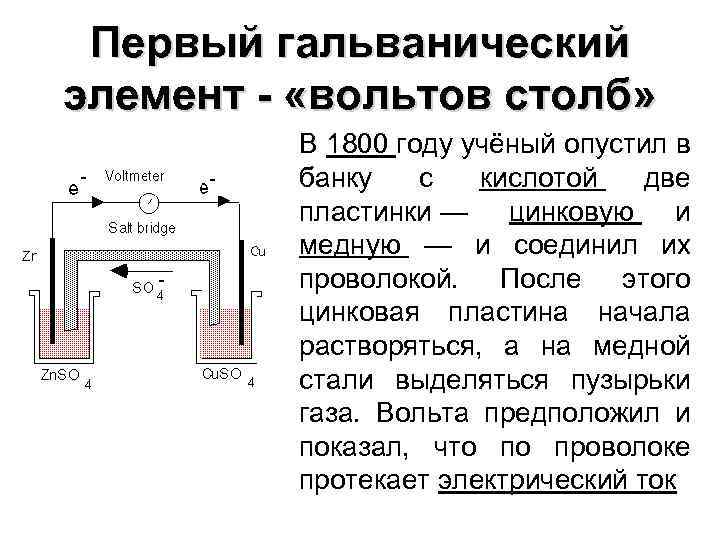
Впервые в мире гальванический элемент был разработан Луиджи Гальвани. Об его истории читайте в этой статье. По сути это временный источник электрического тока, который формируется за счет протекания химической реакции. Поток электронов формируется за счет взаимодействия между двумя разноименными металлами. В результате этого химическая энергия преобразуется в электрическую, которую уже можно использовать в повседневной жизни.
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Кроме Гальвани созданием эффективной батареи занимался Даниэль Якоби. Он немного видоизменил свой источник энергии. В его состав входит пластина, выполненная из меди, помещенная в CuSO4 и пластина из цинка погруженная в ZnSO4. Чтобы не дать им воздействовать прямо друг на друга между ними установлена пористая стенка. Ниже представлена схема гальванического элемента Даниэля Якоби.
Он немного видоизменил свой источник энергии. В его состав входит пластина, выполненная из меди, помещенная в CuSO4 и пластина из цинка погруженная в ZnSO4. Чтобы не дать им воздействовать прямо друг на друга между ними установлена пористая стенка. Ниже представлена схема гальванического элемента Даниэля Якоби.
Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Содержание
- Схема гальванического элемента
- Устройство гальванического элемента
- Принцип работы гальванического элемента
- Ответы на часто задаваемые вопросы
- Типы гальванических элементов
- Таблица гальванических элементов
- Назначение гальванического элемента
- Гальванический элемент в домашних условиях
- Процесс изготовления
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус.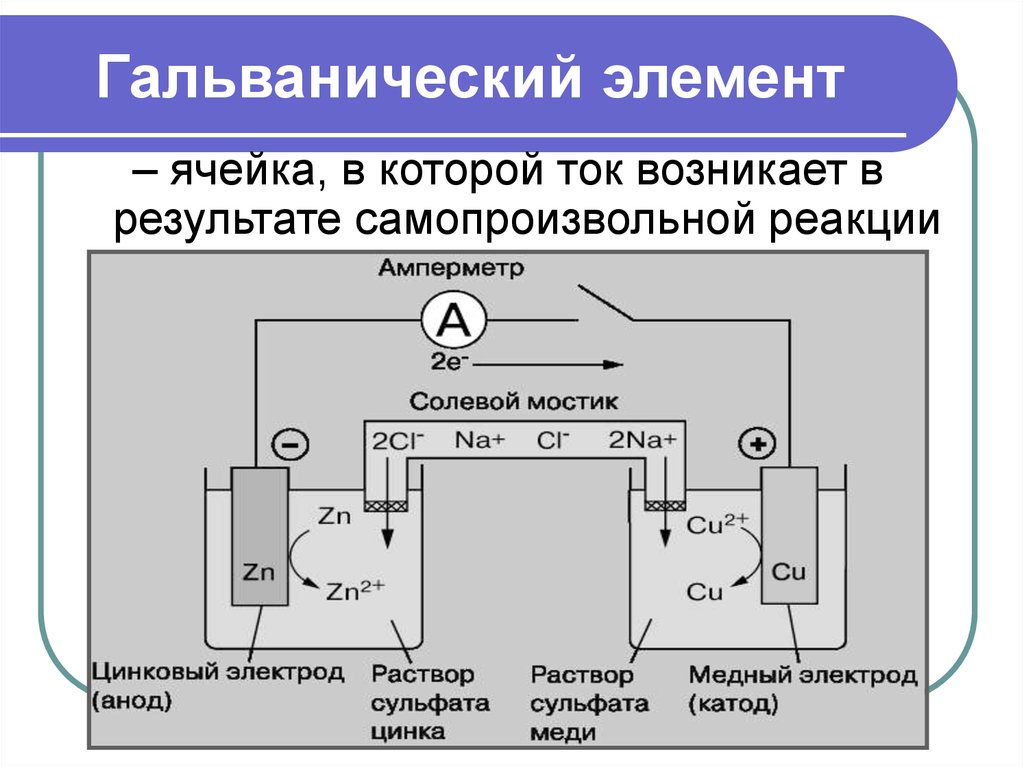 Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элементаОн предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.

- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Гальванический элемент в домашних условияхПростой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
- Пластиковый стакан.
- Электролит. В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде.
- Пластинки двух разных металлов. К примеру алюминий и медь.
- Провода
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Более детально создание батареи своими руками описано в этой статье.
Таким образом изготавливается самодельный гальванический элемент.
Batareykaa.ru
window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-196’, blockId: ‘R-A-277958-196’ })})»+»ipt>»; cachedBlocksArray[80628] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-191’, blockId: ‘R-A-277958-191’ })})»+»ipt>»; cachedBlocksArray[80625] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-69’, blockId: ‘R-A-277958-69’ })})»+»ipt>»; cachedBlocksArray[80615] = «window.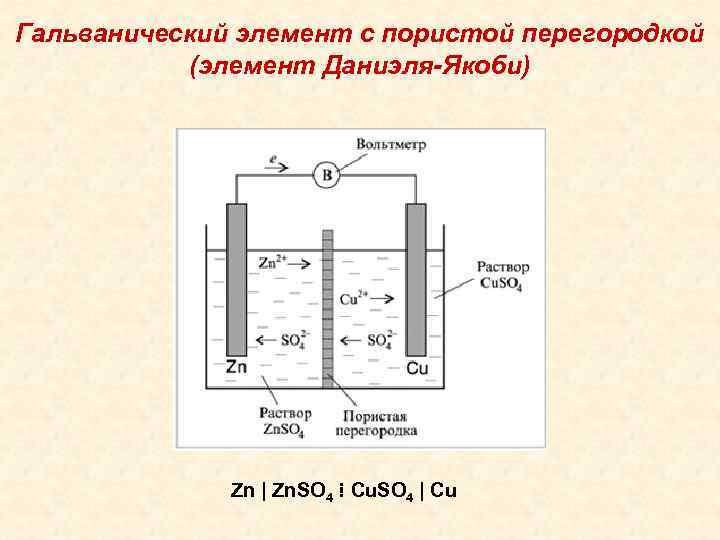 yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-48’, blockId: ‘R-A-277958-48’ })})»+»ipt>»;
cachedBlocksArray[80614] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-44’, blockId: ‘R-A-277958-44’ })})»+»ipt>»;
cachedBlocksArray[80613] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-40’, blockId: ‘R-A-277958-40’ })})»+»ipt>»;
cachedBlocksArray[80612] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-36’, blockId: ‘R-A-277958-36’ })})»+»ipt>»;
cachedBlocksArray[80611] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-35’, blockId: ‘R-A-277958-35’ })})»+»ipt>»;
cachedBlocksArray[80610] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-30’, blockId: ‘R-A-277958-30’ })})»+»ipt>»;
cachedBlocksArray[284597] = «window.
yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-48’, blockId: ‘R-A-277958-48’ })})»+»ipt>»;
cachedBlocksArray[80614] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-44’, blockId: ‘R-A-277958-44’ })})»+»ipt>»;
cachedBlocksArray[80613] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-40’, blockId: ‘R-A-277958-40’ })})»+»ipt>»;
cachedBlocksArray[80612] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-36’, blockId: ‘R-A-277958-36’ })})»+»ipt>»;
cachedBlocksArray[80611] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-35’, blockId: ‘R-A-277958-35’ })})»+»ipt>»;
cachedBlocksArray[80610] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-30’, blockId: ‘R-A-277958-30’ })})»+»ipt>»;
cachedBlocksArray[284597] = «window. yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277959-6’, blockId: ‘R-A-277959-6’ })})»+»ipt>»;
yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277959-6’, blockId: ‘R-A-277959-6’ })})»+»ipt>»;
Что такое гальванический элемент | значение термина
Физика — конспекты, новости, репетиторы » Техническая энциклопедия
Опубликовано
гальванический элемент это
химический источник тока; устройство, вырабатывающее электрическую энергию в результате прямого преобразования химической энергии окислительно-восстановительных реакций. Первые гальванические элементы созданы в 19 в. (вольтов столб, 1800 г.; элемент Даниела – Якоби, 1836 г.; элемент Лекланше, 1865 г., и др.). До 60-х гг. 19 в. гальванические элементы были единственными источниками электрического тока для питания электрических приборов и для лабораторных исследований.
Основу гальванического элемента составляют два электрода (один – содержащий окислитель, другой – восстановитель), помещаемые в электролит.
Между электродами в электролите устанавливается разность потенциалов – электродвижущая сила (ЭДС), соответствующая свободной энергии окислительно-восстановительной реакции. При замыкании внешней цепи между электродами восстановитель (напр., цинк) на отрицательном электроде окисляется, образующиеся свободные электроны переходят по внешней цепи (создавая разрядный ток) к положительному электроду (напр., меди, оксиду металла), где участвуют в реакции восстановления окислителя.
Различают гальванические элементы: одноразового использования (первичные элементы, или элементы), в которых вещества, образовавшиеся в процессе разряда, не могут быть превращены в исходные активные вещества; многоразового действия (аккумуляторы электрические), в которых такое превращение возможно; с непрерывной подачей реагентов к электродам (топливные элементы). Электродвижущая сила гальванических элементов от 1 до 1.6 В. Применяются в качестве источников электропитания незначительной мощности.
Зеркальный гальванометр
1 – осветитель; 2 – шкала; 3 – корпус гальванометра; 4 – зеркальце
Источник: Энциклопедия «Техника».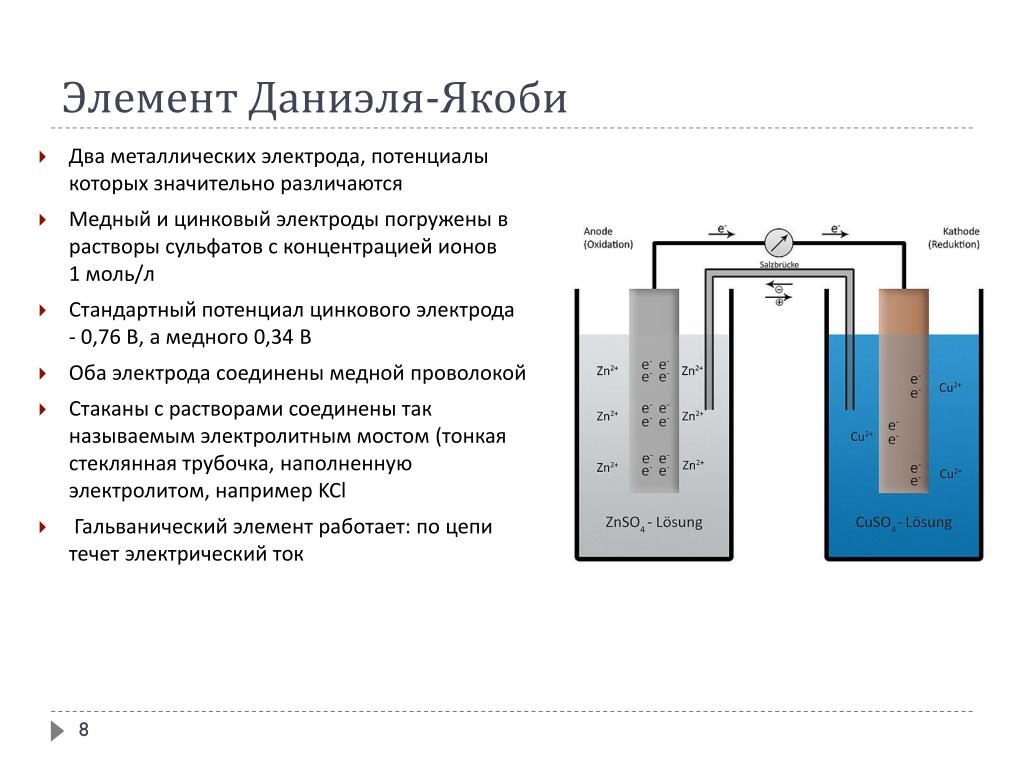 — М.: Росмэн. 2006.
— М.: Росмэн. 2006.
Гальванические элементы. 1 часть. 10 класс.
Электрохимия. Гальванический элемент Даниэля-Якоби
Гальванический элемент
Гальванический элемент
Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.
Гальванический элемент
6. Химические источники тока. Гальванический элемент
Гальванический элемент
Как работает батарейка (гальванический элемент)
🌑 ЭЛЕКТРИЧЕСТВО ИЗ ВОДЫ ВЕЧНЫЙ ФОНАРИК ГАЛЬВАНИЧЕСКИЙ ТОПЛИВНЫЙ ЭЛЕМЕНТ ИГОРЬ БЕЛЕЦКИЙ
гальванический элемент своими руками
Гальванические элементы
Продукты в ОВР. Ч.2-3. Гальванический элемент.
Алюминиевый твердотельный аккумулятор своими руками! Долгоиграющая батарея для освещенияАндреяВольта
Невероятный гальванический элемент
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Лекция гальванический элемент
Сухой гальванический элемент
Лабораторная работа «Гальванический элемент»
Галилео. Эксперимент. Лимон-батарейка
Поделиться или сохранить к себе:
17.
 2: Гальванические элементы — Химия LibreTexts
2: Гальванические элементы — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 38304
- OpenStax
- OpenStax
Цели обучения
- Используйте обозначения ячеек для описания гальванических элементов
- Описать основные компоненты гальванических элементов
Гальванические элементы, также известные как гальванические элементы, представляют собой электрохимические элементы, в которых спонтанные окислительно-восстановительные реакции производят электрическую энергию. При написании уравнений часто бывает удобно разделить реакции окисления-восстановления на полуреакции, чтобы упростить балансировку общего уравнения и подчеркнуть фактические химические превращения.
Посмотрите, что произойдет, если чистый кусок металлической меди поместить в раствор нитрата серебра (рис. \(\PageIndex{1}\)). Как только добавляется металлическая медь, начинает образовываться металлическое серебро, и ионы меди переходят в раствор. Синий цвет раствора справа указывает на присутствие ионов меди. Реакцию можно разделить на две полуреакции. Полуреакции отделяют окисление от восстановления, поэтому каждую можно рассматривать отдельно.
\[\begin{align} 92+}(aq)
\end{align} \nonumber \]
Уравнение полуреакции восстановления пришлось удвоить, чтобы число электронов, «приобретенных» в полуреакции восстановления, равнялось числу электронов, «потерянных» в полуреакции окисления.
Рисунок \(\PageIndex{1}\): Когда чистый кусок металлической меди помещают в прозрачный раствор нитрата серебра (a), происходит окислительно-восстановительная реакция, в результате которой происходит обмен Cu 2 + для ионов Ag + в растворе. По мере протекания реакции (b) раствор становится синим (c) из-за присутствия ионов меди, и металлическое серебро осаждается на медной полоске по мере удаления ионов серебра из раствора. (кредит: модификация работы Марка Отта)
По мере протекания реакции (b) раствор становится синим (c) из-за присутствия ионов меди, и металлическое серебро осаждается на медной полоске по мере удаления ионов серебра из раствора. (кредит: модификация работы Марка Отта) В гальванических или гальванических элементах происходят спонтанные электрохимические реакции, в которых полуреакции разделяются (Рисунок \(\PageIndex{2}\)) так, что ток может протекать по внешнему проводу. Стакан в левой части рисунка называется полукюветой и содержит 1 M раствора нитрата меди (II) [Cu(NO 3 ) 2 ] с частично погруженным в воду куском металлической меди. в растворе. Металлическая медь является электродом. Медь подвергается окислению; следовательно, медный электрод является анодом. Анод соединен проводом с вольтметром, а другой вывод вольтметра соединен проводом с серебряным электродом. Серебро восстанавливается; следовательно, серебряный электрод является катодом. Полуячейка в правой части рисунка состоит из серебряного электрода в 1 М раствор азотнокислого серебра (AgNO 3 ). В этот момент ток не течет, то есть не происходит значительного движения электронов по проводу, потому что цепь разомкнута. Цепь замыкается с помощью солевого мостика, передающего ток с движущимися ионами. Солевой мостик состоит из концентрированного нереакционноспособного раствора электролита, такого как раствор нитрата натрия (NaNO 3 ), используемый в этом примере. Когда электроны текут слева направо через электрод и проволоку, ионы нитрата (анионы) проходят через пористую пробку слева в раствор нитрата меди (II). Это сохраняет химический стакан слева электрически нейтральным за счет нейтрализации заряда ионов меди (II), которые образуются в растворе при окислении металлической меди. При этом ионы нитрата движутся влево, ионы натрия (катионы) – вправо, через пористую пробку, и в раствор азотнокислого серебра справа. Эти добавленные катионы «заменяют» ионы серебра, которые удаляются из раствора, поскольку они восстанавливаются до металлического серебра, сохраняя химический стакан справа электрически нейтральным.
В этот момент ток не течет, то есть не происходит значительного движения электронов по проводу, потому что цепь разомкнута. Цепь замыкается с помощью солевого мостика, передающего ток с движущимися ионами. Солевой мостик состоит из концентрированного нереакционноспособного раствора электролита, такого как раствор нитрата натрия (NaNO 3 ), используемый в этом примере. Когда электроны текут слева направо через электрод и проволоку, ионы нитрата (анионы) проходят через пористую пробку слева в раствор нитрата меди (II). Это сохраняет химический стакан слева электрически нейтральным за счет нейтрализации заряда ионов меди (II), которые образуются в растворе при окислении металлической меди. При этом ионы нитрата движутся влево, ионы натрия (катионы) – вправо, через пористую пробку, и в раствор азотнокислого серебра справа. Эти добавленные катионы «заменяют» ионы серебра, которые удаляются из раствора, поскольку они восстанавливаются до металлического серебра, сохраняя химический стакан справа электрически нейтральным. Без солевого моста отсеки не оставались бы электрически нейтральными, и не протекал бы значительный ток. Однако, если два отсека находятся в непосредственном контакте, солевой мостик не нужен. В момент замыкания цепи вольтметр показывает +0,46 В, это называется потенциалом ячейки. Потенциал клетки создается при соединении двух разнородных металлов и является мерой энергии на единицу заряда, получаемой в результате окислительно-восстановительной реакции. Вольт является производным SI единица электрического потенциала
Без солевого моста отсеки не оставались бы электрически нейтральными, и не протекал бы значительный ток. Однако, если два отсека находятся в непосредственном контакте, солевой мостик не нужен. В момент замыкания цепи вольтметр показывает +0,46 В, это называется потенциалом ячейки. Потенциал клетки создается при соединении двух разнородных металлов и является мерой энергии на единицу заряда, получаемой в результате окислительно-восстановительной реакции. Вольт является производным SI единица электрического потенциала
\[\mathrm{volt=\mathit{V}=\dfrac{J}{C}} \nonumber \]
В этом уравнении A — это ток в амперах, а C — заряд в кулонах. Обратите внимание, что вольты должны быть умножены на заряд в кулонах (Кл), чтобы получить энергию в джоулях (Дж).
Рисунок \(\PageIndex{2}\): В этом стандартном гальваническом элементе полуэлементы разделены; электроны могут течь по внешнему проводу и становятся доступными для выполнения электрической работы.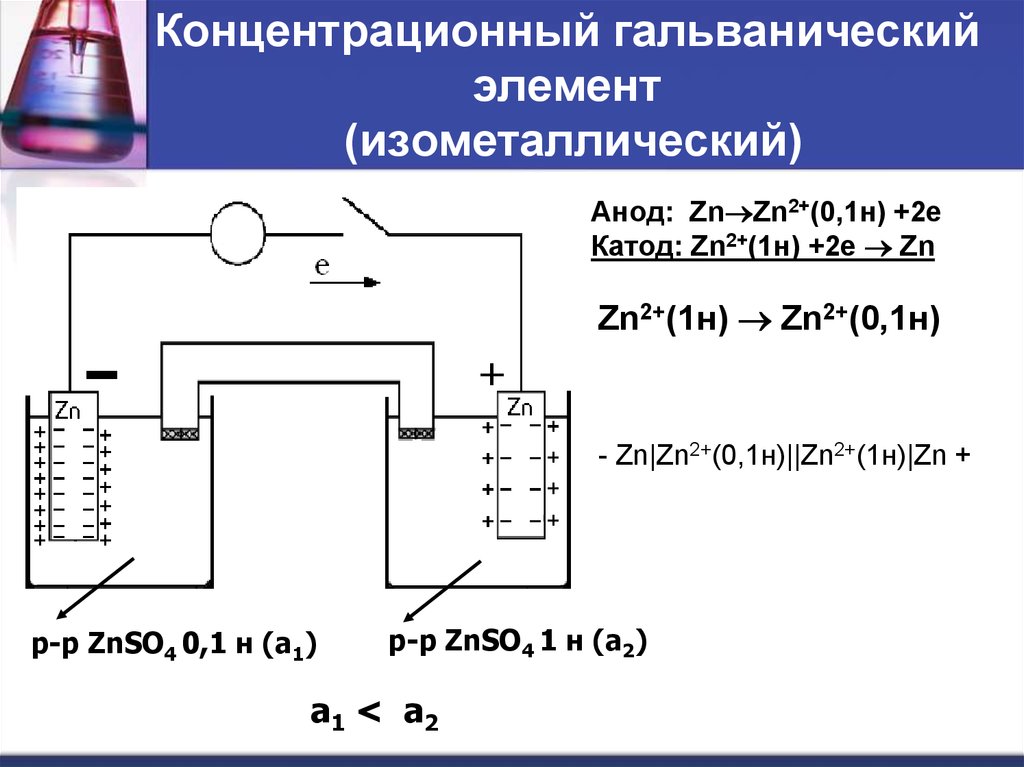
Когда электрохимическая ячейка сконструирована таким образом, положительный потенциал ячейки указывает на спонтанную реакцию и электроны текут слева направо. На рисунке \(\PageIndex{2}\) происходит много всего, поэтому полезно подвести итоги для этой системы:
- Электроны текут от анода к катоду: слева направо в стандартном гальваническом элементе на рисунке.
- Электрод в левой половине ячейки является анодом, потому что здесь происходит окисление. Название относится к потоку анионов в солевом мостике к нему.
- Электрод в правой половине ячейки является катодом, потому что здесь происходит восстановление. Название относится к потоку катионов в солевом мостике к нему.
- Окисление происходит на аноде (левая полуячейка на рисунке).
- Восстановление происходит на катоде (правая полуячейка на рисунке).
- Потенциал ячейки, +0,46 В, в данном случае является результатом врожденных различий в природе материалов, используемых для изготовления двух полуэлементов.

- Солевой мостик должен присутствовать, чтобы замкнуть (завершить) цепь, и для протекания тока должны происходить как окисление, так и восстановление.
Существует много возможных гальванических элементов, поэтому для их описания обычно используется сокращенное обозначение. Обозначение ячеек (иногда называемое диаграммой ячеек) предоставляет информацию о различных видах, участвующих в реакции. Это обозначение также работает для других типов ячеек. Вертикальная линия │ обозначает фазовую границу, а двойная линия ‖ — солевой мостик. Слева записывается информация об аноде, затем раствор анода, затем солевой мостик (если он есть), затем раствор катода и, наконец, информация о катоде справа. Тогда обозначение ячейки для гальванического элемента на рисунке \(\PageIndex{2}\) равно 9.2+}(aq,\: 1\:M)║\ce{Ag+}(aq,\: 1\:M)│\ce{Ag}(s) \nonumber \]
Обратите внимание, что ионы-спектаторы не включены и что использовалась простейшая форма каждой полуреакции. Когда известны, обычно включаются начальные концентрации различных ионов.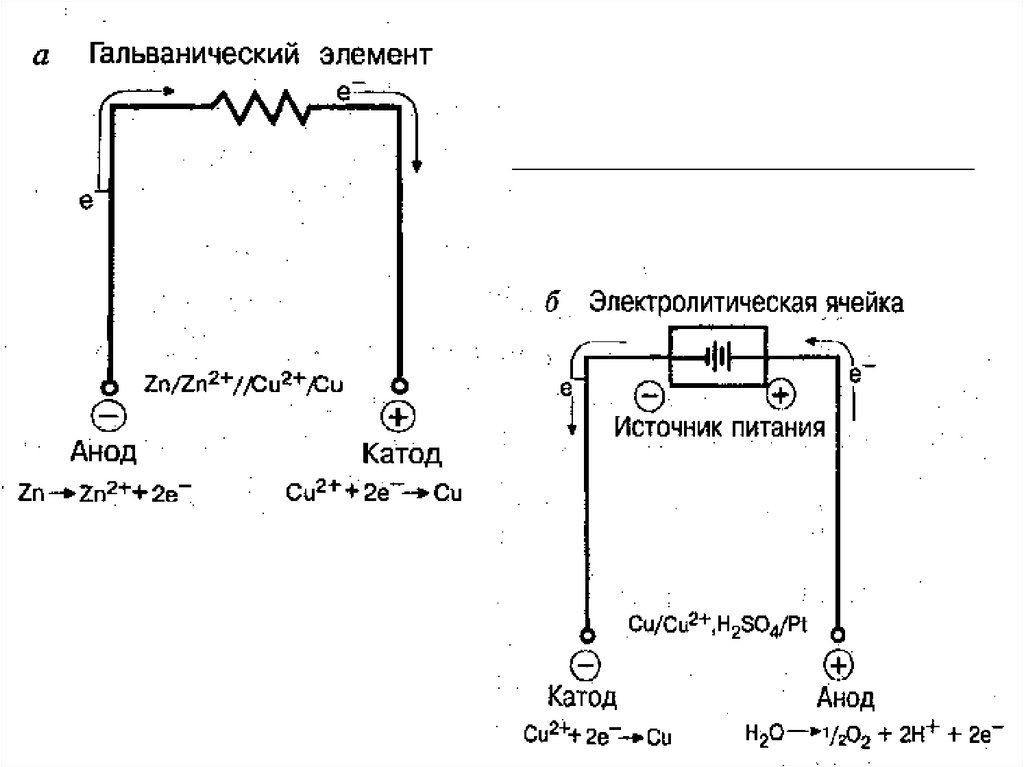
Одной из самых простых ячеек является ячейка Даниэля. Эту батарею можно построить, поместив медный электрод на дно банки и покрыв металл раствором медного купороса. Раствор сульфата цинка всплывает поверх раствора сульфата меди; затем в раствор сульфата цинка помещают цинковый электрод. Соединение медного электрода с цинковым электродом позволяет течь электрическому току. Это пример ячейки без солевого мостика, и ионы могут течь через границу между двумя растворами.
В некоторых окислительно-восстановительных реакциях участвуют соединения, плохо проводящие электричество, поэтому используется электрод, не участвующий в реакциях. Часто в качестве электрода используют платину, золото или графит, и все они инертны ко многим химическим реакциям. Одна из таких систем показана на рисунке \(\PageIndex{3}\). Магний подвергается окислению на аноде слева на рисунке, а ионы водорода восстанавливаются на катоде справа. Реакция может быть обобщена как 92+}(водн.)║\ce{H+}(водн.)│\ce{h3}(g)│\ce{Pt}(s) \nonumber \]
Магниевый электрод является активным электродом, поскольку он участвует в окислительно-восстановительной реакции. 3+}(aq)+\ce{6e-}\\ 92+}(aq)+\ce{4h3O}(l) \nonumber \]
3+}(aq)+\ce{6e-}\\ 92+}(aq)+\ce{4h3O}(l) \nonumber \]
Напишите полуреакции окисления и восстановления и запишите реакцию, используя обозначения ячеек. Какая реакция протекает на аноде? Катод?
Раствор
При проверке Fe 2 + подвергается окислению, когда один электрон теряется с образованием Fe 3 + , а MnO 4 — восстанавливается до пяти электронов, образуя Mn 2 + . Балансировка заряда дает 92+}(водн.)│\ce{Cu}(s) \nonumber. \номер\]
Резюме
Электрохимические элементы обычно состоят из двух полуэлементов. Полуэлементы отделяют полуреакцию окисления от полуреакции восстановления и позволяют току течь по внешнему проводу. Одна полуячейка, обычно изображаемая слева на рисунке, содержит анод. Окисление происходит на аноде. Анод соединен с катодом в другой полуэлементе, часто показанном на рисунке справа. Восстановление происходит на катоде. Добавление соляного моста замыкает цепь, позволяя течь току. Анионы в солевом мостике текут к аноду, а катионы в солевом мостике текут к катоду. Движение этих ионов замыкает цепь и сохраняет электрическую нейтральность каждой полуклетки. Электрохимические ячейки можно описать с помощью обозначения ячеек. В этих обозначениях информация о реакции на аноде появляется слева, а информация о реакции на катоде — справа. Соляной мост представлен двойной линией ‖. Твердая, жидкая или водная фазы внутри полуячейки разделены одной линией │. Фаза и концентрация различных видов указаны после названия вида. Электроды, участвующие в окислительно-восстановительной реакции, называются активными электродами. Электроды, которые не участвуют в окислительно-восстановительной реакции, но предназначены для протекания тока, являются инертными электродами. Инертные электроды часто изготавливают из платины или золота, которые не изменяются в результате многих химических реакций.
Добавление соляного моста замыкает цепь, позволяя течь току. Анионы в солевом мостике текут к аноду, а катионы в солевом мостике текут к катоду. Движение этих ионов замыкает цепь и сохраняет электрическую нейтральность каждой полуклетки. Электрохимические ячейки можно описать с помощью обозначения ячеек. В этих обозначениях информация о реакции на аноде появляется слева, а информация о реакции на катоде — справа. Соляной мост представлен двойной линией ‖. Твердая, жидкая или водная фазы внутри полуячейки разделены одной линией │. Фаза и концентрация различных видов указаны после названия вида. Электроды, участвующие в окислительно-восстановительной реакции, называются активными электродами. Электроды, которые не участвуют в окислительно-восстановительной реакции, но предназначены для протекания тока, являются инертными электродами. Инертные электроды часто изготавливают из платины или золота, которые не изменяются в результате многих химических реакций.
Глоссарий
- активный электрод электрод
- , участвующий в окислительно-восстановительной реакции электрохимической ячейки; масса активного электрода изменяется при окислительно-восстановительной реакции
- анод
- электрод в электрохимической ячейке, на котором происходит окисление; информация об аноде записывается слева от солевого мостика в ячейке с обозначением
- катод
- электрод в электрохимической ячейке, на котором происходит восстановление; информация о катоде записывается справа от солевого мостика в ячейке с обозначением
- обозначение ячейки
- сокращенный способ представления реакций в электрохимической ячейке
- клеточный потенциал
- разность электрических потенциалов, возникающая при соединении разнородных металлов; движущая сила потока заряда (тока) в окислительно-восстановительных реакциях
- гальванический элемент
- электрохимический элемент, включающий самопроизвольную окислительно-восстановительную реакцию; электрохимические ячейки с положительным потенциалом ячейки; также называется гальваническим элементом
- инертный электрод
- электрод, пропускающий ток, но не участвующий в окислительно-восстановительной реакции в гальваническом элементе; масса инертного электрода в ходе окислительно-восстановительной реакции не изменяется; инертные электроды часто изготавливают из платины или золота, потому что эти металлы химически неактивны.

- гальванический элемент
- другое название гальванического элемента
Эта страница под названием 17.2: Galvanic Cells распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

-
- Теги
-
- активный электрод
- анод
- Тег автора:OpenStax
- катод
- Обозначение ячейки
- потенциал ячейки
- гальванический элемент
- инертный электрод
- источник@https://openstax.org/details/books/chemistry-2e
- гальванический элемент
Гальванические элементы и гальванические элементы | Электрохимические элементы
Основные понятия
В этом учебном пособии по гальваническим элементам , также известным как гальванические элементы , вы узнаете основы окислительно-восстановительных реакций и как применить эту информацию к гальваническим элементам. Вы также узнаете, как определить, какие полуреакции происходят на каком электроде, и использовать эти стандартные потенциалы полуреакции для расчета потенциала клетки.
Вы также узнаете, как определить, какие полуреакции происходят на каком электроде, и использовать эти стандартные потенциалы полуреакции для расчета потенциала клетки.
Существует два типа электрохимических элементов: гальванический элемент, также называемый гальваническим элементом, и электролитический элемент. Гальванические элементы производят электричество, в то время как электролитические элементы используют источник энергии для ускорения реакции.
Темы, освещенные в других статьях
- Что такое электрохимия?
- Стандартные восстановительные потенциалы
- Электролизеры
- Баланс окислительно-восстановительных реакций
- Расчет числа окисления
Основы окислительно-восстановительных реакций
В электрохимическом процессе электроны перетекают от одного вещества к другому в так называемой окислительно-восстановительной (окислительно-восстановительной) реакции. Окислительно-восстановительные реакции происходят, когда вещество, называемое окислителем, окисляет другое вещество, забирая электроны и восстанавливаясь. В окислительно-восстановительной реакции простая мнемоника для запоминания направления переноса электронов — «Нефтяная вышка», что означает «окисление теряется, восстановление усиливается». Это относится к тому факту, что при окислении вид теряет электроны, а при восстановлении вид приобретает электроны.
В окислительно-восстановительной реакции простая мнемоника для запоминания направления переноса электронов — «Нефтяная вышка», что означает «окисление теряется, восстановление усиливается». Это относится к тому факту, что при окислении вид теряет электроны, а при восстановлении вид приобретает электроны.
В реакциях, не являющихся окислительно-восстановительными, например, в кислотно-щелочных реакциях, степени окисления элементов не изменяются.
Простым примером реакции окисления является реакция оксида железа (II) с монооксидом углерода по следующей схеме:
степень окисления от +2 до +4. Во всех окислительно-восстановительных реакциях один вид окисляется, а другой восстанавливается.
Некоторые элементы, такие как ванадий, могут даже проходить через несколько степеней окисления в ходе окислительно-восстановительной реакции.
Восстановительный потенциал
Потенциал, также известный как напряжение, является очень важным понятием в электрохимии. Он представляет собой энергию в джоулях, переданную одним кулоновским зарядом. Каждый химический вид, включая атомы и ионы, имеет определенную «готовность» принимать электроны. Это называется стандартным восстановительным потенциалом и измеряется в вольтах (Дж/Кл). Восстановительный потенциал отличается от электроотрицательности и сродства к электрону, но связан с обоими. Чем более положителен восстановительный потенциал, тем более предпочтительным является сокращение.
Он представляет собой энергию в джоулях, переданную одним кулоновским зарядом. Каждый химический вид, включая атомы и ионы, имеет определенную «готовность» принимать электроны. Это называется стандартным восстановительным потенциалом и измеряется в вольтах (Дж/Кл). Восстановительный потенциал отличается от электроотрицательности и сродства к электрону, но связан с обоими. Чем более положителен восстановительный потенциал, тем более предпочтительным является сокращение.
Поскольку полуреакция восстановления представляет собой процесс, посредством которого атом/ион принимает электрон, благоприятность этой полуреакции может быть представлена восстановительным потенциалом. И наоборот, полуреакция окисления показывает противоположность принятого электрона, поэтому она будет представлена отрицательным значением восстановительного потенциала. Суммирование полуреакций окисления и восстановления дает общее уравнение окислительно-восстановительной реакции. Точно так же суммирование потенциалов восстановления и окисления дает потенциал всей реакции.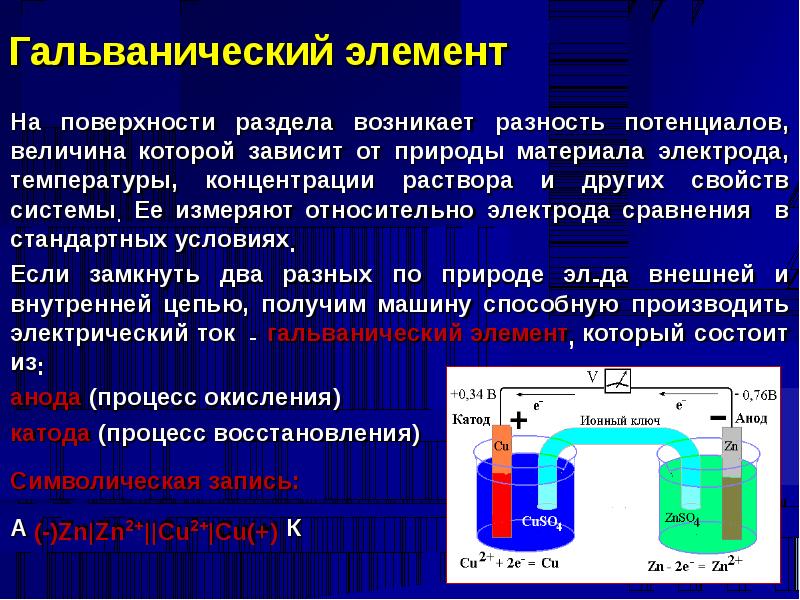 Потенциал является статическим для данной полуреакции. Поскольку значение никогда не меняется, таблицы стандартных восстановительных потенциалов — лучший друг электрохимика.
Потенциал является статическим для данной полуреакции. Поскольку значение никогда не меняется, таблицы стандартных восстановительных потенциалов — лучший друг электрохимика.
Расчет потенциала. E
0 красный обозначает восстановительный потенциал, а E 0 ox обозначает окисление. E 0 ячейка или общий потенциал реакции представляет собой просто сумму E 0 red и E 0 ox . Вот пример, объединяющий все это:Снижение полуреакции: CL 2 + 2E — → 2CL —
Из таблицы, эта полуреадка имеет потенциал +1,36 вольта → E 009.36. = 1,36 В.
Половина реакции окисления: Al → Al 3+ + 3e –
Из таблицы видно, что восстановление алюминия имеет напряжение -1,66 вольта. Однако это ОКИСЛЕНИЕ алюминия, а НЕ восстановление. Поэтому используется противоположное напряжение, поэтому E 0 бык = -E 0 красный = 1,66 В.
Однако это ОКИСЛЕНИЕ алюминия, а НЕ восстановление. Поэтому используется противоположное напряжение, поэтому E 0 бык = -E 0 красный = 1,66 В.
Чистая окислительно -восстановительная реакция: 3CL 2 + 2AL → 2ALCL 3
E 0 Cell = E 0 RED + E 0 0 RED + E 0 0 RED + E 0 0 RED + E 0 0 . = 3,02 В
Но подождите, стехиометрия…
Некоторые могут задаться вопросом: «Если полуреакция восстановления умножается на три для чистой реакции, почему потенциал не умножается на три?» Восстановительный потенциал — одно из немногих мест в химии, где стехиометрия неприменима. Причина проста: помните, что напряжение — это отношение. «Сколько энергии передается на кулон заряда?» Хотя должно быть восстановлено в три раза больше атомов хлора, чем алюминия, стабильность, придаваемая этим преобразованием («готовность»), одинакова для каждого электрона хлора. Следовательно, само количество электронов хлора не влияет на изменение энергии, наблюдаемое каждым из них.
Следовательно, само количество электронов хлора не влияет на изменение энергии, наблюдаемое каждым из них.
Электрохимические элементы
Существует два типа электрохимических элементов: гальванические и электролитические .
Гальванический элемент имеет долгую историю. Свое название он получил от итальянского физика Луиджи Гальвани (1737–1798), который наблюдал, что рассеченные мышцы лягушачьей лапки подергиваются, когда на них воздействует электрический ток. Гальванический элемент использует энергию спонтанной окислительно-восстановительной реакции для получения электрического тока. Другое распространенное название гальванических элементов — 9.0199 гальванических элементов , названных в честь другого итальянского физика Алессандро Вольта (1745 – 1827), изобретшего гальванический (гальванический) элемент.
С другой стороны, электролитическая ячейка использует электрический ток для запуска обычно неспонтанной окислительно-восстановительной реакции. Типичным примером электролитической ячейки является подача электрического тока к воде для разложения воды на газообразные водород и кислород посредством следующей реакции: анод и катод, и содержат раствор электролита. Этот раствор электролита позволяет перемещать ионы в раствор и из раствора, сохраняя при этом общий заряд элемента нейтральным.
Типичным примером электролитической ячейки является подача электрического тока к воде для разложения воды на газообразные водород и кислород посредством следующей реакции: анод и катод, и содержат раствор электролита. Этот раствор электролита позволяет перемещать ионы в раствор и из раствора, сохраняя при этом общий заряд элемента нейтральным.
Основное различие между гальваническим и электролитическим элементом заключается в направлении работы. Гальванический элемент превращает спонтанную химическую реакцию в полезную работу, тогда как электролитический элемент использует работу для запуска неспонтанной реакции.
Окисление происходит на аноде, а восстановление на катоде. Легкая мнемоника для запоминания — «Красный кот и бык», где «рыжий кот» означает восстановление — катод, а «бык» — анод — окисление.
Гальванические элементы
Гальванический элемент представляет собой установку, которая облегчает окислительно-восстановительные реакции контролируемым и особым образом, генерирующим ток (поток электронов).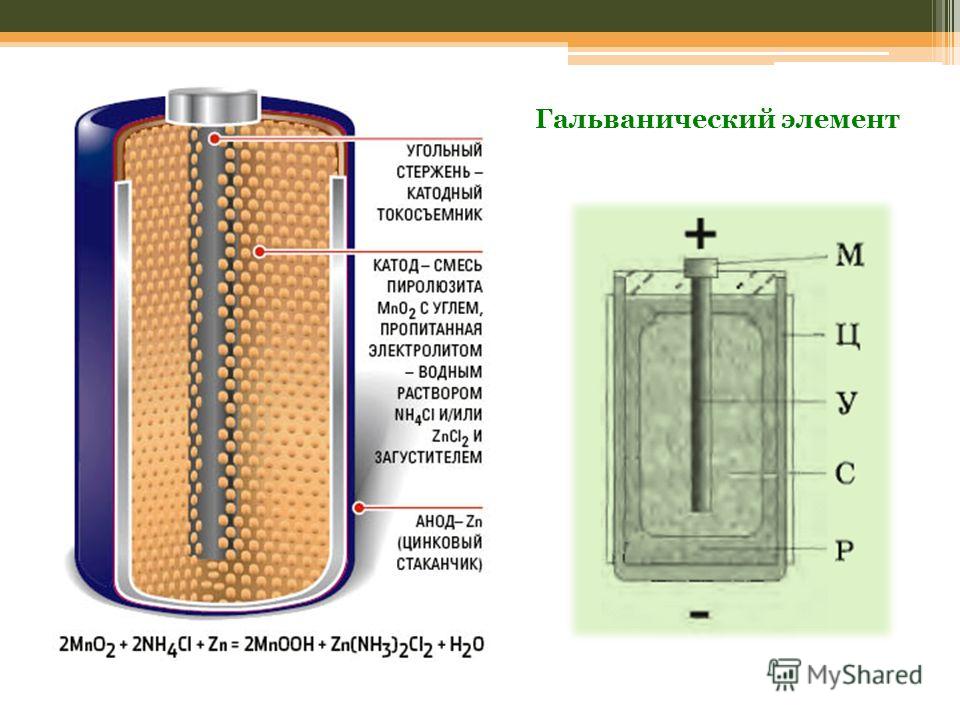 Гальванический элемент, гальванический элемент и батарея — это разные названия гальванического элемента. Ниже приведен типичный гальванический элемент, который продемонстрирует все важные функции.
Гальванический элемент, гальванический элемент и батарея — это разные названия гальванического элемента. Ниже приведен типичный гальванический элемент, который продемонстрирует все важные функции.
Каждый гальванический элемент ДОЛЖЕН содержать следующее:
- Полуэлемент окисления, где электроны будут потеряны
- Полуэлемент восстановления, где электроны будут приняты
- Провод, соединяющий два элемента, часто с вольтметром для измерения потенциала элемента
- Солевой мост или какой-либо другой способ поддержания баланса заряда
Давайте подробно рассмотрим каждую из этих функций и почему они необходимы.
Полуячейка окисления
Полуячейка окисления — место возникновения электронов. Он состоит из двух основных частей: электрода и раствора. Электрод окислительной ячейки называется 9.0058 анод . В этом примере анодом является цинк. Когда происходит реакция, электроны покидают металлический цинк на аноде, превращая его в ионы цинка.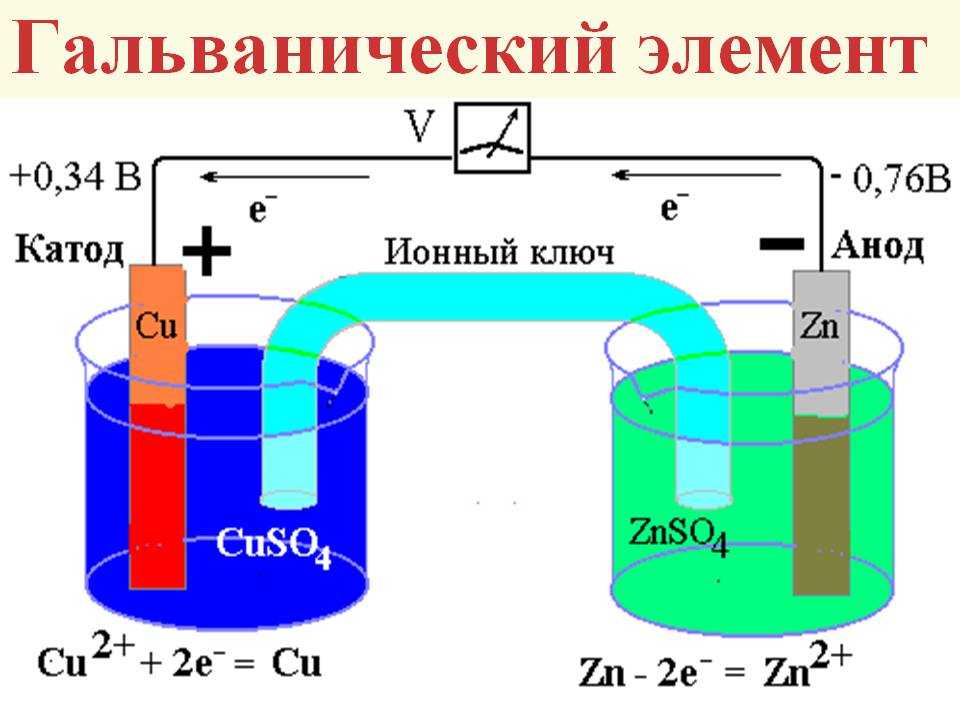 Затем эти ионы входят в раствор, в данном случае сульфат цинка. Противоион не имеет значения, если он растворим с ионом анодного металла. Однако катион раствора должен соответствовать металлу анода. В ходе реакции электроны покидают анод и перемещаются по проволоке к полуэлементу восстановления, увеличивая концентрацию ионов металла в растворе и разъедая анод.
Затем эти ионы входят в раствор, в данном случае сульфат цинка. Противоион не имеет значения, если он растворим с ионом анодного металла. Однако катион раствора должен соответствовать металлу анода. В ходе реакции электроны покидают анод и перемещаются по проволоке к полуэлементу восстановления, увеличивая концентрацию ионов металла в растворе и разъедая анод.
Провод
Это самая простая часть установки. Провод позволяет электронам перемещаться между двумя полуячейками. Часто он подключается к устройству, называемому вольтметром, который измеряет потенциал. Вольтметры полезны для наблюдения за ходом реакции, но не обязательны. Проводник не обязательно должен быть проводом, но провода являются наиболее распространенным способом соединения ячеек для таких типов установок.
Полуэлемент восстановления
Полуэлемент восстановления предназначен для электронов, высвобождаемых из анода. Металлический электрод в полуэлементе восстановления называется 9.0058 катод . Когда электроны движутся по катоду, они контактируют с ионным раствором. Затем катионы в растворе восстанавливаются до металла и осаждаются на поверхности катода. В простом гальваническом элементе катионов соответствуют катоду. В этом примере в качестве катода используется медь, поэтому катионы в растворе представляют собой медь. Опять же, противоион не имеет значения. По мере протекания реакции концентрация катиона снижается, а масса катода увеличивается.
Когда электроны движутся по катоду, они контактируют с ионным раствором. Затем катионы в растворе восстанавливаются до металла и осаждаются на поверхности катода. В простом гальваническом элементе катионов соответствуют катоду. В этом примере в качестве катода используется медь, поэтому катионы в растворе представляют собой медь. Опять же, противоион не имеет значения. По мере протекания реакции концентрация катиона снижается, а масса катода увеличивается.
Солевой мостик
По мере протекания реакции электроны покидают анод и перемещаются к катоду. Положительный заряд ионов металла в полуэлементе окисления увеличивается, а в полуэлементе катода уменьшается. Это проблема, потому что накопление заряда в большинстве случаев делает реакции неблагоприятными. Солевой мост устраняет эту проблему. Как правило, простые соли ионов-спектаторов, такие как KCl, NaNO 3 и т. д., создают хорошие солевые мостики. Солевой мостик насыщен этими соединениями и уравновешивает заряд в двух полуячейках. В показанном примере соль может содержать сульфат калия. По мере протекания реакции ионы калия будут поступать в полуэлемент восстановления, чтобы заменить потерянные ионы меди. Точно так же ионы сульфата войдут в полуячейку окисления, чтобы уравновесить ионы цинка, поступающие в раствор. Без солевого мостика, передающего заряд, гальванические элементы не работают .
В показанном примере соль может содержать сульфат калия. По мере протекания реакции ионы калия будут поступать в полуэлемент восстановления, чтобы заменить потерянные ионы меди. Точно так же ионы сульфата войдут в полуячейку окисления, чтобы уравновесить ионы цинка, поступающие в раствор. Без солевого мостика, передающего заряд, гальванические элементы не работают .
Практическая задача
Химик настраивает гальванический элемент для осуществления следующей реакции:
Cr + 3Ag + → Cr 3+ + 3Ag
Они используют положительный заряд натрия и нитратируют ионы каждый противоион. Пометьте каждую часть ячейки названием и химическим веществом, где это уместно, и укажите напряжение, связанное с реакцией в стандартных условиях.
Ответы:
A: Вольтметр
B: NANO 3 Солетный мост
C: CR ANODE
D: CR (№ 3 ) 3 Раствор
0 3 ) 3 .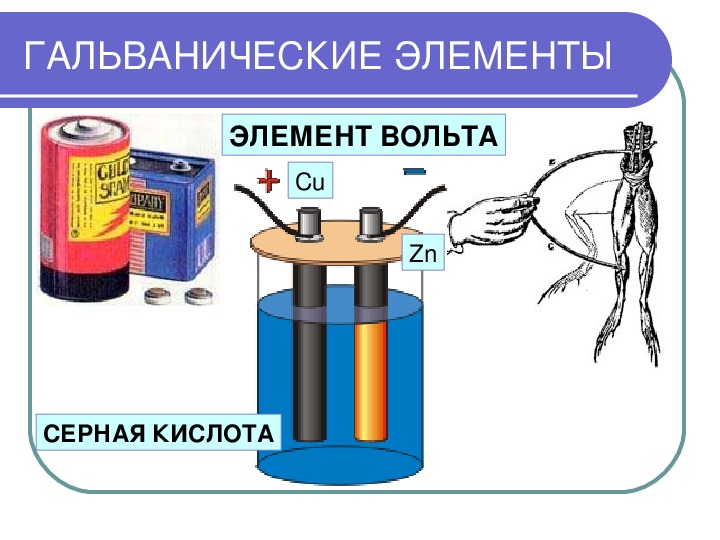 AgNO 3 раствор
AgNO 3 раствор
Напряжение: 1,54 В
Определение потенциала гальванических элементов
Рассмотрим классический Cu-Zn гальванический элемент (гальванический элемент), изображенный ниже
Как видно из изображения, есть два электрода. Один из них цинковый, а другой медный. Мы видели из предыдущего примера, что цинк является анодом, а медь — катодом. Но откуда мы знаем? Чтобы определить, какой электрод является анодом, а какой катодом, необходимо рассмотреть две полуреакции. Полуреакция — это чистая реакция, которая происходит с окислением или восстановлением частиц и показывает поток электронов. Возьмите две полуреакции в ячейке Cu-Zn:
При проведении двух подобных полуреакций обычно восстанавливаются виды с более высоким восстановительным потенциалом. Из-за этого мы видим, что в ячейке Cu-Zn медь будет восстанавливаться, а цинк окисляться. Затем мы должны перевернуть полуреакцию цинка, чтобы показать реакцию окисления:
Обратите внимание, что хотя мы перевернули химическое уравнение, стандартный восстановительный потенциал остается отрицательным.