Как устроены гальванические элементы и аккумуляторы. Какие химические процессы лежат в основе их работы. Какие виды гальванических элементов и аккумуляторов существуют. Где применяются гальванические элементы и аккумуляторы в современной технике. Каковы перспективы развития химических источников тока.
Принцип работы гальванических элементов
Гальванический элемент представляет собой устройство, в котором химическая энергия преобразуется в электрическую за счет окислительно-восстановительных реакций. Основные компоненты гальванического элемента:
- Анод — электрод, на котором происходит реакция окисления
- Катод — электрод, на котором происходит реакция восстановления
- Электролит — проводящий раствор, обеспечивающий перенос ионов между электродами
- Полупроницаемая перегородка или солевой мостик — разделяет анодное и катодное пространства, но обеспечивает электрический контакт
При работе гальванического элемента на аноде происходит окисление активного металла, а образующиеся электроны по внешней цепи переходят на катод, где восстанавливают окислитель. Движение электронов во внешней цепи создает электрический ток.
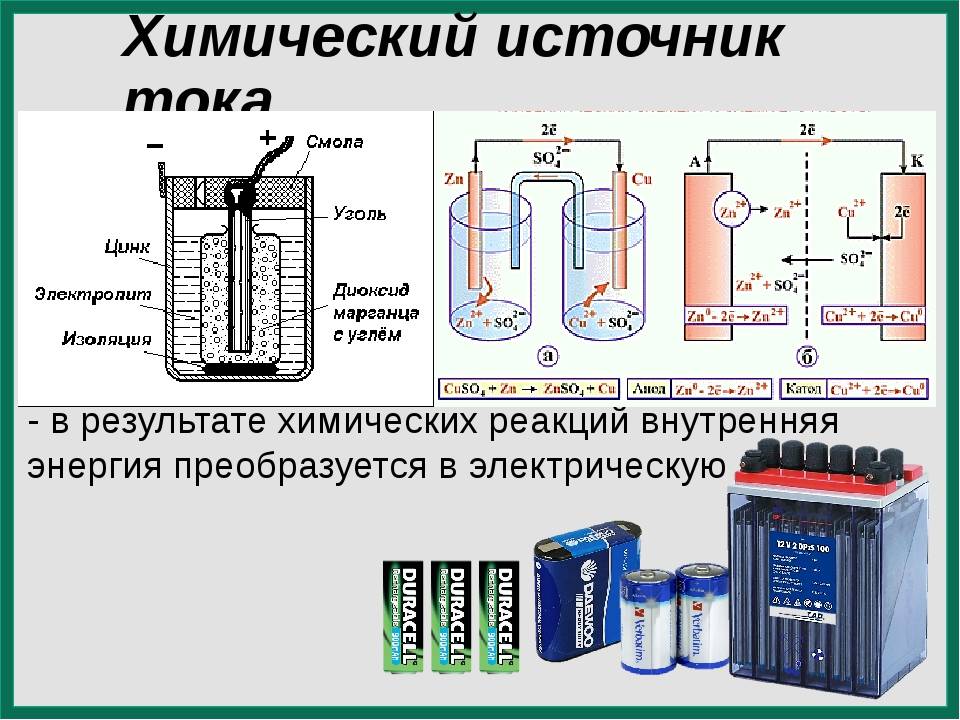
Основные типы гальванических элементов
Существует несколько основных типов гальванических элементов:
Сухие гальванические элементы
В сухих элементах электролит находится в виде пасты. Наиболее распространены марганцево-цинковые элементы:
- Анод — цинковый стаканчик
- Катод — графитовый стержень в смеси оксида марганца (IV) и графита
- Электролит — паста хлорида аммония и хлорида цинка
ЭДС такого элемента составляет около 1,5 В. Недостатки — невысокая емкость и саморазряд.
Щелочные элементы
В щелочных элементах используется щелочной электролит — гидроксид калия. Анод изготавливается из порошкообразного цинка, катод — из диоксида марганца. ЭДС около 1,5 В, но емкость и срок службы выше, чем у сухих элементов.
Литиевые элементы
Анод изготавливается из металлического лития, катод — из различных соединений (оксиды марганца, серы и др.). Электролит — неводный органический раствор. Преимущества:
- Высокое напряжение (3-4 В)
- Большая удельная емкость
- Длительный срок хранения
- Широкий температурный диапазон
Принцип работы аккумуляторов
Аккумулятор — это вторичный химический источник тока, который может быть многократно перезаряжен за счет пропускания электрического тока в обратном направлении. При этом протекают обратимые химические реакции, восстанавливающие исходные реагенты.

Основные типы аккумуляторов:
Свинцово-кислотные аккумуляторы
Наиболее распространенный тип аккумуляторов. Основные компоненты:
- Анод — свинец
- Катод — диоксид свинца
- Электролит — разбавленная серная кислота
При разряде на электродах образуется сульфат свинца. При заряде исходные вещества восстанавливаются. ЭДС одного элемента — 2,1 В.
Никель-кадмиевые аккумуляторы
Состав:
- Анод — кадмий
- Катод — гидроксид никеля
- Электролит — гидроксид калия
ЭДС элемента — 1,2 В. Преимущества — высокая удельная мощность, большой срок службы, работа при низких температурах. Недостаток — «эффект памяти».
Литий-ионные аккумуляторы
Современный тип аккумуляторов. Анод изготавливается из графита, катод — из оксидов лития и других металлов. Электролит — раствор соли лития в органическом растворителе. Преимущества:
- Высокая удельная энергоемкость
- Отсутствие эффекта памяти
- Низкий саморазряд
- Широкий температурный диапазон
Применение гальванических элементов и аккумуляторов
Основные области применения химических источников тока:
- Портативная электроника (смартфоны, ноутбуки, фотоаппараты и др.)
- Электромобили и гибридные автомобили
- Системы автономного и резервного электропитания
- Медицинская техника (кардиостимуляторы, слуховые аппараты)
- Космическая и военная техника
- Накопители энергии в системах возобновляемой энергетики
Перспективы развития химических источников тока
Основные направления совершенствования гальванических элементов и аккумуляторов:
- Повышение удельной энергоемкости
- Увеличение срока службы и числа циклов заряд-разряд
- Сокращение времени заряда
- Повышение безопасности
- Снижение стоимости
- Разработка новых электрохимических систем (литий-воздушные, натрий-ионные и др.)
Совершенствование химических источников тока имеет большое значение для развития электромобилей, портативной электроники и возобновляемой энергетики.
Гальванические элементы. Аккумуляторы | Частная школа. 8 класс
Конспект по физике для 8 класса «Гальванические элементы. Аккумуляторы». Что представляет собой гальванический элемент. Как устроен аккумулятор.
Конспекты по физике Учебник физики Тесты по физике
Для поддержания тока в проводнике необходимо электрическое поле: на концах проводника нужно постоянно создавать заряды противоположных знаков. На практике такое разделение зарядов обычно осуществляется за счёт химических реакций.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
В конце XVIII в. итальянский физик А. Вольта обнаружил, что при взаимодействии металла с кислотой происходит разделение зарядов. При этом металлическая пластинка, опущенная в раствор кислоты, электризуется отрицательно, а раствор — положительно.
Вольта построил первый химический источник тока, получивший название гальванического элемента (в честь другого итальянского учёного — Л. Гальвани).
Элемент Вольты состоит из цинковой и медной пластинок, опущенных в водный раствор серной кислоты. В результате химических реакций цинковая пластинка заряжается отрицательно, а раствор кислоты и медная пластинка — положительно. Внутри элемента образуется электрическое поле.
В результате химических реакций цинковая пластинка заряжается отрицательно, а раствор кислоты и медная пластинка — положительно. Внутри элемента образуется электрическое поле.
Если выводы пластин соединить проводником, то электроны под действием электрического поля начнут двигаться по проводнику, создавая в нём электрический ток. Выводы пластин образуют зажимы, которые называются полюсами.
Элемент Вольты как источник электричества является несовершенным — ток в цепи быстро ослабевает. Поэтому на практике большое распространение получили так называемые сухие гальванические элементы.
Элемент состоит из цинкового сосуда, в который помещён мешочек с двуокисью марганца (МnO2), смешанного с углем. В этот мешочек вставлен угольный стержень, который является положительным полюсом элемента. Отрицательным полюсом является вывод от цинкового сосуда. Вместо раствора элемент содержит густую пасту, состоящую из муки, замешанной на нашатыре.
Обычная плоская батарейка для карманного фонаря состоит из трёх гальванических элементов. При этом угольный стерженёк первого элемента соединён с цинковым сосудом второго, а угольный стерженёк второго соединён соответственно с цинковым сосудом третьего элемента.
Все три элемента помещены в картонную коробку, которая сверху залита слоем изолятора (смолой). Две полоски жести, выведенные через слой изолятора, являются полюсами батареи.
АККУМУЛЯТОРЫ
Срок службы всех гальванических элементов зависит от состояния их электродов (цинка и угля) и качества раствора. С течением времени электроды разрушаются, а качество раствора ухудшается.
Значительно более удобными источниками тока являются аккумуляторы — устройства, у которых электроды практически не разрушаются.
Простейший аккумулятор состоит из прочного сосуда (корпуса), в который залит раствор серной кислоты, и двух свинцовых пластин, опущенных в раствор.
Однако в таком состоянии аккумулятор ещё не будет являться источником тока и в нём необходимо накопить заряд. Для зарядки через аккумулятор пропускают ток от другого источника (зарядного устройства). После зарядки аккумулятор становится источником тока.
Кроме свинцовых (кислотных) аккумуляторов, широкое применение получили железно-никелевые (щелочные) аккумуляторы. Каждая из пластин в таком аккумуляторе (одна железная, а другая из окиси никеля) опущена в раствор едкой щёлочи.
В последние десятилетия наряду с традиционными источниками тока стали широко применяться источники, изготовленные на основе химического элемента лития. Эти источники устойчиво работают в широком диапазоне температур и обладают великолепным — порядка 10 лет и более — сроком службы.
ОБЛАСТИ ПРИМЕНЕНИЯ ИСТОЧНИКОВ ТОКА
Химические источники тока широко применяются в разных областях. Например, аккумуляторы служат для освещения многих транспортных средств, в частности автомобилей, для запуска различных силовых установок, для питания научной аппаратуры и средств связи, устанавливаемых на искусственных спутниках Земли и межпланетных станциях, и т. п.
Широко используемые в настоящее время аккумуляторы для мобильных телефонов — ещё один пример устройств такого типа.
Впечатляет также разнообразие габаритов источников электричества: от миниатюрных батареек для питания ручных часов, лазерных указок, электронных секундомеров и т. д. до мощных аккумуляторных батарей, устанавливаемых на подводных лодках.
Вероятно, первыми гальваническими элементами были найденные при раскопках близ Багдада керамические сосуды, закрытые смоляной пробкой, через которую внутрь сосуда пропущены железные и медные стержни. По оценкам археологов, изготовление этих устройств датируется вторым-третьим тысячелетием до нашей эры. Поразительно и то, что эти устройства «заработали» после того, как в сосуды залили морскую воду.
Поразительно и то, что эти устройства «заработали» после того, как в сосуды залили морскую воду.
Луиджи Гальвани (1737—1798) — итальянский врач, один из основателей учения об электричестве, основоположник экспериментальной электрофизиологии.
Вы смотрели Конспект по физике для 8 класса «Гальванические элементы. Аккумуляторы».
Вернуться к Списку конспектов по физике (Оглавление).
Просмотров: 7 713
Электротехника
Электротехника
ОглавлениеПРЕДИСЛОВИЕИЗ ПРЕДИСЛОВИЯ КО ВТОРОМУ ИЗДАНИЮ ГЛАВА ПЕРВАЯ. ТОК И НАПРЯЖЕНИЕ 1.2. ПРОСТЕЙШАЯ ЭЛЕКТРОТЕХНИЧЕСКАЯ УСТАНОВКА 1.3. ПАРАЛЛЕЛЬНОЕ СОЕДИНЕНИЕ 1.4. ПОСЛЕДОВАТЕЛЬНОЕ СОЕДИНЕНИЕ 1.5. ВКЛЮЧЕНИЕ АМПЕРМЕТРА И ВОЛЬТМЕТРА 1.6. МОЩНОСТЬ 1.7. СОПРОТИВЛЕНИЕ ЦЕПИ И ЗАКОН ОМА 1.  8. СОПРОТИВЛЕНИЕ ПРОВОДНИКОВ 8. СОПРОТИВЛЕНИЕ ПРОВОДНИКОВ1.9. ПОЧЕМУ ЦЕПИ, ПОДЧИНЯЮЩИЕСЯ ЗАКОНУ ОМА, НАЗЫВАЮТ ЛИНЕЙНЫМИ 1.10. НЕЛИНЕЙНЫЕ ЦЕПИ 1.11. ЗАВИСИМОСТЬ СОПРОТИВЛЕНИЯ ОТ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ 1.13. НАПРАВЛЕНИЕ ТОКА И ЕГО ХИМИЧЕСКОЕ ДЕЙСТВИЕ 1.14. НАПРАВЛЕНИЕ ТОКА И ВЫПРЯМЛЯЮЩИЕ УСТРОЙСТВА 1.15. АККУМУЛЯТОРЫ И ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ 1.16. ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ 1.17. ТОК В СЛОЖНЫХ ЦЕПЯХ 1.18. ЭЛЕКТРОДВИЖУЩАЯ СИЛА И ПОТЕРЯ НАПРЯЖЕНИЯ 1.19. ЗАЗЕМЛЕНИЕ И ПОТЕНЦИАЛ 1.20. ЗАКОНЫ КИРХГОФА ГЛАВА ВТОРАЯ. МАГНИТЫ. МАГНИТНОЕ ПОЛЕ. МАГНИТНОЕ ДЕЙСТВИЕ ТОКА 2.1. МАГНИТЫ И МАГНИТНОЕ ПОЛЕ 2.2. МАГНИТНОЕ ДЕЙСТВИЕ ТОКА 2.3. МАГНИТНОЕ ПОЛЕ ДЕЙСТВУЕТ НА ПРОВОДНИК С ТОКОМ 2.4. МАГНИТНАЯ ИНДУКЦИЯ 2.6. НАГЛЯДНОЕ ИЗОБРАЖЕНИЕ МАГНИТНЫХ ПОЛЕЙ 2.7. ВЗАИМОДЕЙСТВИЕ ТОКОВ 2.8. ИЗМЕНЕНИЕ МАГНИТНОГО ПОЛЯ СОЗДАЕТ ЭЛЕКТРОДВИЖУЩУЮ СИЛУ 2.9. ПРАВИЛО ЛЕНЦА 2.10. МАГНИТНЫЙ ПОТОК 2.11. ЗАКОН НАВЕДЕНИЯ ЭЛЕКТРОДВИЖУЩЕЙ СИЛЫ 2.  12. НАВЕДЕНИЕ ЭДС В ПРЯМОЛИНЕЙНОМ ПРОВОДНИКЕ, ДВИЖУЩЕМСЯ В ПОЛЕ 12. НАВЕДЕНИЕ ЭДС В ПРЯМОЛИНЕЙНОМ ПРОВОДНИКЕ, ДВИЖУЩЕМСЯ В ПОЛЕ2.13. ВЗАИМНАЯ ИНДУКДИЯ 2.14. САМОИНДУКЦИЯ 2.15. ВЛИЯНИЕ САМОИНДУКЦИИ НА ПЕРЕХОДНЫЕ ПРОЦЕССЫ 2.16. ЭНЕРГИЯ МАГНИТНОГО ПОЛЯ В ЭЛЕКТРИЧЕСКИХ ЦЕПЯХ ГЛАВА ТРЕТЬЯ. ЖЕЛЕЗО В МАГНИТНОМ ПОЛЕ. МАГНИТНЫЕ ЦЕПИ. ПОСТОЯННЫЕ МАГНИТЫ 3.1. ЗАКОН ПОЛНОГО ТОКА ДЛЯ МАГНИТНОЙ ИНДУКЦИИ ПРИ ОТСУТСТВИИ ЖЕЛЕЗА 3.2. НАМАГНИЧИВАНИЕ ЖЕЛЕЗНОГО КОЛЬЦА 3.3. ОТНОСИТЕЛЬНАЯ МАГНИТНАЯ ПРОНИЦАЕМОСТЬ 3.4. РАСЧЕТ ПОЛЯ В КОЛЬЦЕВОЙ КАТУШКЕ СО СПЛОШНЫМ СЕРДЕЧНИКОМ ПО МАГНИТНЫМ ХАРАКТЕРИСТИКАМ 3.5. ЗАКОН ПОЛНОГО ТОКА ДЛЯ ОДНОРОДНОГО ПОЛЯ В ФЕРРОМАГНИТНОЙ СРЕДЕ 3.6. ЗАКОН ПОЛНОГО ТОКА ДЛЯ ПОЛЯ В НЕОДНОРОДНОЙ СРЕДЕ 3.7. СТАЛЬНОЕ КОЛЬЦО С РАЗРЕЗОМ 3.8. НАПРЯЖЕННОСТЬ МАГНИТНОГО ПОЛЯ, РАСЧЕТ МАГНИТНОЙ 3.9. НАМАГНИЧЕННОСТЬ ГЛАВА ЧЕТВЕРТАЯ. ЭЛЕКТРИЧЕСКИЕ ЗАРЯДЫ И ЭЛЕКТРИЧЕСКОЕ ПОЛЕ 4.1. ЭЛЕКТРИЧЕСКИЕ ЗАРЯДЫ 4.2. ИЗОЛЯТОРЫ И ПРОВОДНИКИ 4.3. ПРОСТЕЙШИЕ ОПЫТЫ С НЕПОДВИЖНЫМИ ЭЛЕКТРИЧЕСКИМИ ЗАРЯДАМИ (ЭЛЕКТРОСТАТИКА)  4. ЭЛЕКТРИЧЕСКОЕ ПОЛЕ 4. ЭЛЕКТРИЧЕСКОЕ ПОЛЕ4.5. НАПРЯЖЕНИЕ (РАЗНОСТЬ ПОТЕНЦИАЛОВ) 4.6. ЭЛЕКТРИЧЕСКАЯ ЕМКОСТЬ. КОНДЕНСАТОРЫ 4.7. КОНДЕНСАТОР В ЭЛЕКТРИЧЕСКОЙ ЦЕПИ 4.8. ДВИЖЕНИЕ ЭЛЕКТРИЧЕСКИХ ЗАРЯДОВ В МАГНИТНОМ ПОЛЕ ГЛАВА ПЯТАЯ. ПЕРЕМЕННЫЙ ТОК 5.1. ЗАЧЕМ НУЖЕН ПЕРЕМЕННЫЙ ТОК? 5.2. ПОЛУЧЕНИЕ ПЕРЕМЕННОГО ТОКА 5.3. ГЕНЕРАТОР ПЕРЕМЕННОГО ТОКА 5.4. СИНУСОИДА 5.5. ЗАКОН ОМА ДЛЯ ЦЕПИ ПЕРЕМЕННОГО ТОКА ГЛАВА ШЕСТАЯ. ЦЕПИ ПЕРЕМЕННОГО ТОКА 6.1. КАТУШКА ИНДУКТИВНОСТИ В ЦЕПИ ПЕРЕМЕННОГО ТОКА 6.2. ФАЗОВЫЙ СДВИГ В ИНДУКТИВНОЙ ЦЕПИ 6.3. КОЭФФИЦИЕНТ МОЩНОСТИ 6.4. КОНДЕНСАТОВ В ЦЕПИ ПЕРЕМЕННОГО ТОКА 6.5. КОМПЕНСАЦИЯ СДВИГА ФАЗ 6.6. РАСЧЕТ ПРОСТЕЙШИХ ЦЕПЕЙ ПЕРЕМЕННОГО ТОКА 6.7. РЕЗОНАНС ТОКОВ 6.8. РЕЗОНАНС НАПРЯЖЕНИЙ ГЛАВА СЕДЬМАЯ. ТРЕХФАЗНЫЙ ТОК 7.1. ТРЕХФАЗНАЯ СИСТЕМА 7.2. РАЗМЕТКА КОНЦОВ ТРЕХФАЗНОЙ СИСТЕМЫ 7.3. СЛОЖЕНИЕ ФАЗНЫХ ЭДС 7.4. СОЕДИНЕНИЕ В ЗВЕЗДУ 7.5. СОЕДИНЕНИЕ ТРЕУГОЛЬНИКОМ 7.6. МОЩНОСТЬ ТРЕХФАЗНОГО ТОКА 7.7.  ПОТЕРИ МОЩНОСТИ В ТРЕХФАЗНОЙ ЛИНИИ ПОТЕРИ МОЩНОСТИ В ТРЕХФАЗНОЙ ЛИНИИГЛАВА ВОСЬМАЯ. ЭЛЕКТРОТЕХНИЧЕСКИЕ РАСЧЕТЫ НА МИКРОКАЛЬКУЛЯТОРАХ 8.1. КАК РАБОТАЕТ МИКРОКАЛЬКУЛЯТОР 8.2. ПРОСТЕЙШИЕ ЭЛЕКТРОТЕХНИЧЕСКИЕ РАСЧЕТЫ 8.3. О ТОЧНОСТИ ВЫЧИСЛЕНИЙ 8.4. ПРОГРАММИРУЕМЫЕ МИКРОКАЛЬКУЛЯТОРЫ 8.5. РАСЧЕТЫ НА ПРОГРАММИРУЕМЫХ МИКРОКАЛЬКУЛЯТОРАХ ГЛАВА ДЕВЯТАЯ. ПОЛУПРОВОДНИКОВЫЕ ПРИБОРЫ 9.1. ЭЛЕКТРИЧЕСКИЙ ТОК В ПОЛУПРОВОДНИКАХ 9.2. ПОЛУПРОВОДНИКОВЫЕ ДИОДЫ. ВЫПРЯМИТЕЛИ 9.3. ТРАНЗИСТОРЫ. УСИЛИТЕЛИ ЭЕКТРИЧЕСКИХ СИГНАЛОВ 9.4. ОБРАТНАЯ СВЯЗЬ В УСИЛИТЕЛЯХ 9.5. ГЕНЕРАТОРУ СИНУСОИДАЛЬНЫХ КОЛЕБАНИЙ 9.6. ТИРИСТОРЫ, УПРАВЛЯЕМЫЕ ВЫПРЯМИТЕЛИ 9.7. КЛЮЧИ 9.8. НЕИЗБЕЖНОСТЬ МИКРОЭЛЕКТРОНИКИ 9.9. ОПЕРАЦИОННЫЕ УСИЛИТЕЛИ ГЛАВА ДЕСЯТАЯ. МАШИНЫ ПОСТОЯННОГО ТОКА 10.1. НАЗНАЧЕНИЕ ЭЛЕКТРИЧЕСКИХ МАШИН 10.2. МАГНИТНАЯ СИСТЕМА МАШИН ПОСТОЯННОГО ТОМА 10.3. КОЛЛЕКТОР 10.4. ЯКОРНЫЕ ОБМОТКИ 10.5. РАБОЧИЙ РЕЖИМ МАШИН ПОСТОЯННОГО ТОКА 10.6. СПОСОБЫ ВОЗБУЖДЕНИЯ МАШИН 10.7. ОБРАТИМОСТЬ МАШИН ПОСТОЯННОГО ТОКА.  РАБОТА ДВИГАТЕЛЯ РАБОТА ДВИГАТЕЛЯ10.8. ДВИГАТЕЛИ С ПАРАЛЛЕЛЬНЫМ И ПОСЛЕДОВАТЕЛЬНЫМ ВОЗБУЖДЕНИЕМ ГЛАВА ОДИННАДЦАТАЯ. ТРАНСФОРМАТОРЫ 11.1. УСТРОЙСТВО И ПРИНЦИП ДЕЙСТВИЯ ТРАНСФОРМАТОРА 11.2. РАБОТА ТРАНСФОРМАТОРА 11.3. ТРАНСФОРМАТОР ТРЕХФАЗНОГО ТОКА 11.4. ПОТЕРИ В ТРАНСФОРМАТОРЕ 11.1. АВТОТРАНСФОРМАТОРЫ ГЛАВА ДВЕНАДЦАТАЯ. МАШИНЫ ПЕРЕМЕННОГО ТОКА 12.1. ГЕНЕРАТОР ПЕРЕМЕННОГО ТОКА 12.2. СИНХРОННЫЙ ДВИГАТЕЛЬ ПЕРЕМЕННОГО ТОКА 12.3. ТРЕХФАЗНЫЕ МАШИНЫ ПЕРЕМЕННОГО ТОКА 12.4. РАБОТА СИНХРОННЫХ МАШИН 12.5. ПАРАЛЛЕЛЬНАЯ РАБОТА СИНХРОННЫХ ГЕНЕРАТОРОВ 12.6. ВРАЩАЮЩЕЕСЯ МАГНИТНОЕ ПОЛЕ 12.7. АСИНХРОННЫЕ ДВИГАТЕЛИ 12.8. КПД ЭЛЕКТРИЧЕСКИХ МАШИН ГЛАВА ТРИНАДЦАТАЯ. ЭЛЕКТРИЧЕСКИЕ АППАРАТЫ 13.1. ВЫКЛЮЧАТЕЛИ, КНОПКИ И КЛАВИШИ 13.2. РАБОТА ЭЛЕКТРИЧЕСКИХ КОНТАКТОВ 13.3. ЭЛЕКТРОМАГНИТЫ 13.4. КОНТАКТОРЫ 13.5. ЭЛЕКТРОМАГНИТНЫЕ РЕЛЕ 13.6. ПРЕДОХРАНИТЕЛИ, РЕЛЕ ТОКА И ТЕПЛОВЫЕ РЕЛЕ 13.7. ПУТЕВЫЕ ВЫКЛЮЧАТЕЛИ ГЛАВА ЧЕТЫРНАДЦАТАЯ. УПРАВЛЕНИЕ ЭЛЕКТРИЧЕСКИМИ МАШИНАМИ 14.  1. КАК СОСТАВЛЯЮТСЯ ЭЛЕКТРИЧЕСКИЕ СХЕМЫ 1. КАК СОСТАВЛЯЮТСЯ ЭЛЕКТРИЧЕСКИЕ СХЕМЫ14.2. ДВА ТИПА ЭЛЕКТРИЧЕСКИХ СХЕМ 14.3. КАК ВКЛЮЧИТЬ ЭЛЕКТРИЧЕСКИЙ ДВИГАТЕЛЬ 14.4. СХЕМЫ ТОРМОЖЕНИЯ 14.5. ЗАЩИТА ЭЛЕКТРИЧЕСКИХ ЦЕПЕЙ 14.6. КАК ОПИСАТЬ ЭЛЕКТРИЧЕСКУЮ СХЕМУ ГЛАВА ПЯТНАДЦАТАЯ. ИЗМЕРЕНИЯ В ЭЛЕКТРОТЕХНИКЕ 15.1. РОЛЬ ИЗМЕРЕНИЙ В ЭЛЕКТРОТЕХНИКЕ 15.2. ПРИБОРЫ ДЛЯ ИЗМЕРЕНИЯ ПОСТОЯННОГО ТОКА 15.3. ШУНТЫ И ДОБАВОЧНЫЕ СОПРОТИВЛЕНИЯ 15.4. ИЗМЕРЕНИЕ ОЧЕНЬ МАЛЫХ ТОКОВ. ГАЛЬВАНОМЕТРЫ 15.5. ПРИБОРЫ ПЕРЕМЕННОГО ТОКА 15.6. КАК ИЗМЕРИТЬ МОЩНОСТЬ ЭЛЕКТРИЧЕСКОГО ТОКА 15.7. ЭЛЕКТРИЧЕСКИЙ СЧЕТЧИК ПЕРЕМЕННОГО ТОКА 15.8. ИЗМЕРЕНИЕ МОЩНОСТИ И ЭНЕРГИИ В ЦЕПЯХ ТРЕХФАЗНОГО ТОКА 15.9. САМОПИСЦЫ И ОСЦИЛЛОГРАФЫ 15.10. ЦИФРОВЫЕ ПРИБОРЫ 15.11. ИЗМЕРЕНИЕ СОПРОТИВЛЕНИЯ ЦЕПИ |
Гальванические элементы — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 36507
Цели обучения
- Объяснить: химию в работе батареи;
- реакции окисления и восстановления;
- техника, используемая для представления батареи;
- различные части батареи.

- Классифицировать химические реакции как окисление, восстановление или другие типы.
Химия батарей
Химия — это движущая сила магии батарей. Батарея представляет собой комплект из одного или нескольких гальванических элементов, используемых для производства и хранения электроэнергии химическим путем. А 9Гальванический элемент 0042 состоит как минимум из двух полуэлементов, элемента восстановления и элемента окисления. Химические реакции в двух полуэлементах обеспечивают энергию для работы гальванического элемента.
Каждый полуэлемент состоит из электрода и раствора электролита. Обычно раствор содержит ионы, полученные из электрода в результате реакции окисления или восстановления.
Гальванический элемент также называется гальваническим элементом . Самопроизвольные реакции в нем обеспечивают электрическую энергию или ток.
Два полуячейки могут быть соединены вместе, чтобы сформировать электролитическую ячейку , которая используется для электролиза.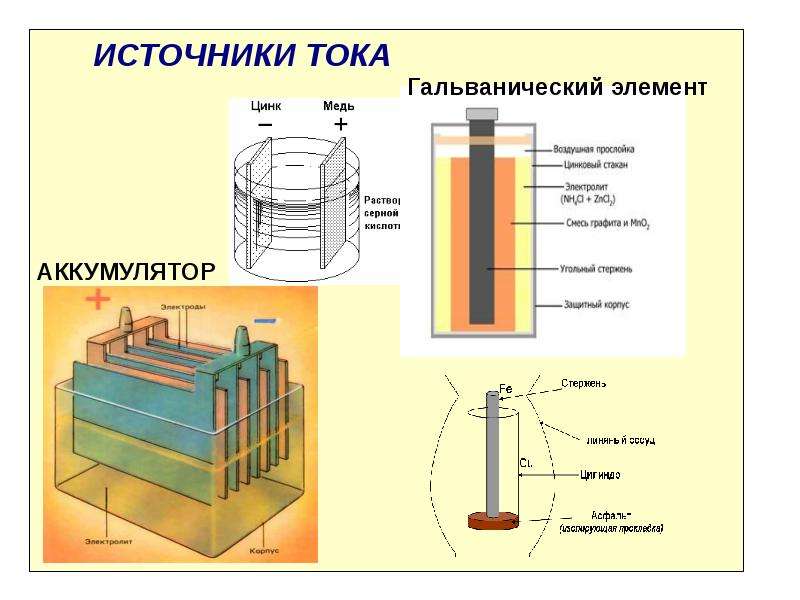 В этом случае электрическая энергия используется для форсирования несамопроизвольных химических реакций.
В этом случае электрическая энергия используется для форсирования несамопроизвольных химических реакций.
Реакции окисления-восстановления
Реакциям окисления и восстановления можно дать множество определений. С точки зрения электрохимии наиболее подходящим является следующее определение, потому что оно позволяет нам увидеть то, как электроны выполняют свои роли в химии батарей.
Примечание
Потеря электронов – это окисление (LEO), а приобретение электронов – это восстановление (GER).
Реакции окисления и восстановления не могут проводиться отдельно. Они должны появиться вместе в химической реакции. Таким образом, реакции окисления и восстановления часто называют окислительно-восстановительными реакциями . С точки зрения окислительно-восстановительных реакций восстановитель и окислитель образуют окислительно-восстановительную пару , когда они подвергаются реакции:
\(\ce{Окислитель + n\: e^- \rightarrow Восстановитель}\) 9-}\)
Окислитель является окислителем, а восстановитель является восстановителем. Восстановитель
Восстановитель
| окислитель или окислитель | восстановитель
Два члена пары представляют собой один и тот же элемент или соединение, но с разной степенью окисления.
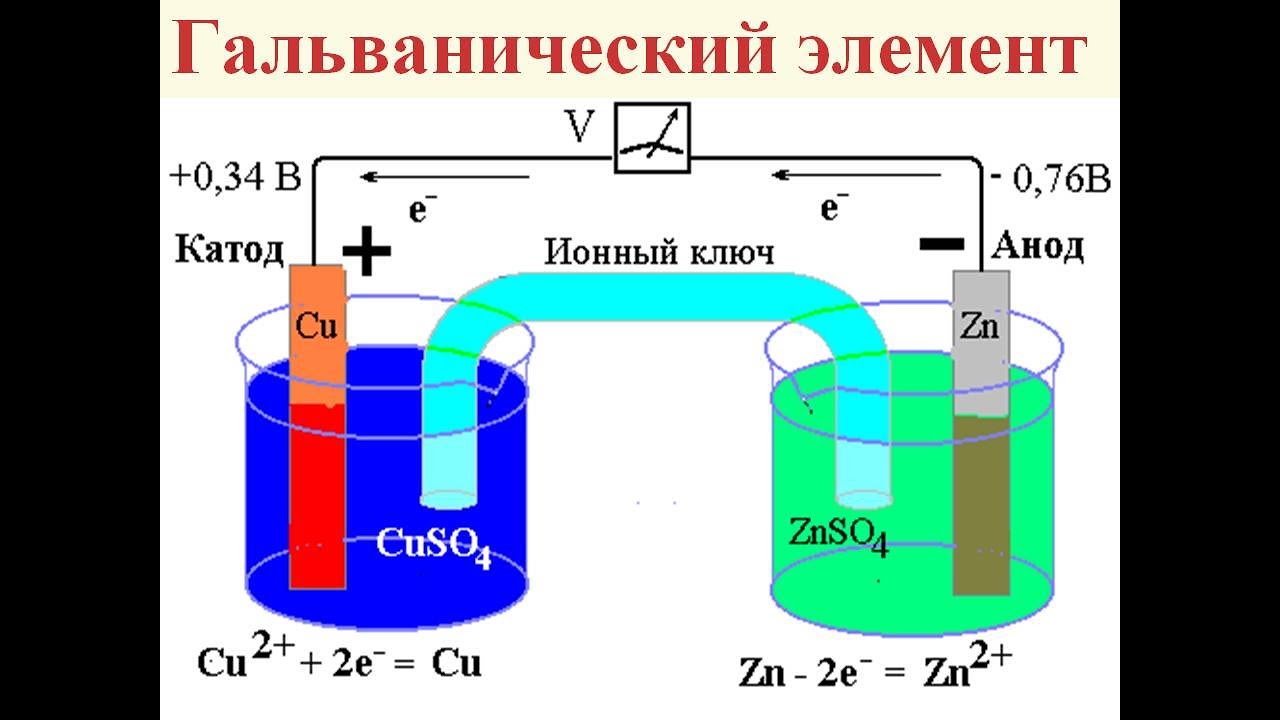
Медно-цинковые гальванические элементы
В качестве введения в электрохимию давайте рассмотрим простой гальванический элемент или гальванический элемент.
Когда палочку цинка (\(\ce{Zn}\)) помещают в раствор соли, \(\ce{Zn}\) имеет тенденцию терять электроны в соответствии с реакцией 92+]} = \textrm{1.0 M}\),
измеренное напряжение между двумя клеммами для этой батареи составляет 1,100 В.
Батарея представляет собой набор из одного или нескольких гальванических элементов, используемых для производства и хранения электроэнергии. Простейшая батарея состоит из двух полуэлементов: полуэлемента восстановления и полуэлемента окисления.
Реакции окисления и восстановления. Обзор
Общая реакция гальванического элемента:
\(\ce{Zn + Cu^2+ \rightarrow Zn^2+ + Cu}\) 92+}\) или \(\ce{Zn}\)?
Растворы
- Цинк окисляется.

Навык —
Определение и объяснение окислительно-восстановительных реакций. Потеря электронов \(\ce{Zn}\) означает, что \(\ce{Zn}\) окисляется, LEO . - Восстанавливается ион меди, а не металл.
Навык — 92+}\) уменьшается.
- Цинк имеет сильную тенденцию терять электроны.
Обсуждение —
Металл \(\ce{Zn}\) более активен, чем медь. В кислом растворе атомы \(\ce{Zn}\) отдают электроны на ионы \(\ce{H+}\), а атомы меди — нет. Тенденция измеряется с точки зрения стандартного восстановительного потенциала. - Ответственны ионы электролита в растворе.
Навык —
Объяснить проводимость раствора. Положительные и отрицательные ионы движутся в противоположных направлениях в растворе, что приводит к проводимости электричества. - Солевой мостик — это путь для движения ионов в растворе.
Следующая страница: Степени окисления
Авторы и авторство
Galvanic Cells распространяется под лицензией CC BY-NC-SA 4. 0, автором, ремиксом и/или куратором является LibreTexts.
0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
-
- Теги
-
Коммерческие гальванические элементы — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 6486
Поскольку гальванические элементы могут быть автономными и портативными, их можно использовать в качестве батарей и топливных элементов. Аккумулятор (аккумулятор) представляет собой гальванический элемент (или серию гальванических элементов), который содержит все реагенты, необходимые для производства электроэнергии. Напротив, топливный элемент представляет собой гальванический элемент, который требует постоянной внешней подачи одного или нескольких реагентов для выработки электроэнергии. В этом разделе мы описываем химический состав некоторых наиболее распространенных типов батарей и топливных элементов.
Аккумулятор (аккумулятор) представляет собой гальванический элемент (или серию гальванических элементов), который содержит все реагенты, необходимые для производства электроэнергии. Напротив, топливный элемент представляет собой гальванический элемент, который требует постоянной внешней подачи одного или нескольких реагентов для выработки электроэнергии. В этом разделе мы описываем химический состав некоторых наиболее распространенных типов батарей и топливных элементов.
Батарейки
Существует два основных типа батарей: одноразовые, или первичные, батареи, в которых электродные реакции практически необратимы и которые нельзя перезаряжать; и перезаряжаемые или вторичные батареи, которые образуют нерастворимый продукт, прилипающий к электродам. Эти батареи можно заряжать, прикладывая электрический потенциал в обратном направлении. Процесс перезарядки временно превращает перезаряжаемую батарею из гальванического элемента в электролитический элемент.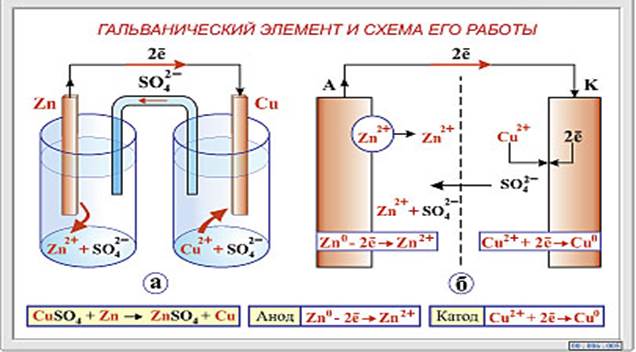
Батареи — это искусно спроектированные устройства, основанные на тех же фундаментальных законах, что и гальванические элементы. Основное различие между батареями и гальваническими элементами, которые мы описали ранее, заключается в том, что в коммерческих батареях в качестве реагентов используются твердые вещества или пасты, а не растворы, чтобы максимизировать электрическую мощность на единицу массы. Использование высококонцентрированных или твердых реагентов имеет еще один положительный эффект: концентрации реагентов и продуктов не сильно изменяются по мере разрядки батареи; следовательно, выходное напряжение остается практически постоянным во время процесса разряда. Такое поведение отличается от поведения ячейки Zn/Cu, выход которой уменьшается логарифмически по мере протекания реакции (рис. \(\PageIndex{1}\)). Когда батарея состоит более чем из одного гальванического элемента, элементы обычно соединяются последовательно, то есть с положительной (+) клеммой одной ячейки, соединенной с отрицательной (-) клеммой следующей, и так далее. Таким образом, общее напряжение батареи представляет собой сумму напряжений отдельных ячеек.
Таким образом, общее напряжение батареи представляет собой сумму напряжений отдельных ячеек.
 Анод – металлический литий, катод – твердый комплекс I 2 . Электролит представляет собой слой твердого LiI, который позволяет ионам Li + диффундировать от катода к аноду. Хотя этот тип батареи производит относительно небольшой ток, он очень надежен и долговечен.
Анод – металлический литий, катод – твердый комплекс I 2 . Электролит представляет собой слой твердого LiI, который позволяет ионам Li + диффундировать от катода к аноду. Хотя этот тип батареи производит относительно небольшой ток, он очень надежен и долговечен. Основное различие между батареями и гальваническими элементами заключается в том, что в коммерческих батареях в качестве реагентов обычно используются твердые вещества или пасты, а не растворы, чтобы максимизировать электрическую мощность на единицу массы. Очевидным исключением является стандартный автомобильный аккумулятор, в котором используется химия в растворенной фазе.
Сухой элемент Leclanché
Сухой элемент, безусловно, самый распространенный тип батареи, используется в фонариках, электронных устройствах, таких как Walkman и Game Boy, и многих других устройствах. Хотя сухой элемент был запатентован в 1866 году французским химиком Жоржем Лекланше и ежегодно продается более 5 миллиардов таких элементов, детали химии его электродов до сих пор полностью не изучены. Несмотря на свое название, 9{−}}\) ионов, присутствующих в растворе, поэтому общая реакция клетки выглядит следующим образом:
Несмотря на свое название, 9{−}}\) ионов, присутствующих в растворе, поэтому общая реакция клетки выглядит следующим образом:
- общая реакция:
\[\ce{2MnO2(тв) + 2Nh5Cl(вод) + Zn(тв) -> Mn2O3(тв) + Zn(Nh4)2Cl2(тв) + h3O(ж)} \label{Eq3} \]
Сухой элемент выдает около 1,55 В и недорог в производстве. Однако он не очень эффективен при производстве электроэнергии, потому что фактически восстанавливается только относительно небольшая часть \(\ce{MnO2}\), которая находится вблизи катода, и только небольшая часть цинкового катода фактически потребляется в качестве клетка разряжается. Кроме того, сухие элементы имеют ограниченный срок хранения, поскольку анод \(\ce{Zn}\) спонтанно реагирует с \(\ce{Nh5Cl}\) в электролите, вызывая коррозию корпуса и утечку содержимого. .
AA battery» data-cke-saved-src=»/@api/deki/files/16647/battery.jpg» src=»/@api/deki/files/16647/battery.jpg» data-quail-id= «34»> Источник: Фото предоставлено Mitchclanky2008, www.flickr. {-}(водн.)} \номер \] 9{−}} \номер \]
{-}(водн.)} \номер \] 9{−}} \номер \] - общая реакция:
\[\ce{Zn(s) + 2MnO2(s) -> ZnO(s) + Mn2O3(s)} \nonumber \]
Эта батарея также производит около 1,5 В, но имеет более длительный срок хранения и более постоянное выходное напряжение при разрядке элемента, чем у сухого элемента Лекланше. Хотя производство щелочных батарей обходится дороже, чем производство сухих элементов Лекланше, улучшенные характеристики делают эти батареи более рентабельными.
Батарейки-таблетки
Хотя некоторые маленькие батарейки-таблетки, используемые для питания часов, калькуляторов и камер, представляют собой миниатюрные щелочные элементы, большинство из них основаны на совершенно другом химическом составе. В этих «кнопочных» батареях анод представляет собой амальгаму цинка и ртути, а не чистый цинк, а катод использует в качестве окислителя либо \(\ce{HgO}\), либо \(\ce{Ag2O}\) в качестве окислителя, а не \ (\ce{MnO2}\) на рисунке \(\PageIndex{1b}\)).
Батарейки-таблетки. (Герхард Х. Вроднигг из Википедии)
(Герхард Х. Вроднигг из Википедии) Катодная, анодная и общие реакции, а также выход элемента для этих двух типов кнопочных батарей следующие (две полуреакции происходят на аноде, но показана общая полуреакция окисления): 9{−}} \номер\]
Основными преимуществами ртутных и серебряных элементов являются их надежность и высокое отношение производительности к массе. Эти факторы делают их идеальными для приложений, где малый размер имеет решающее значение, например, в камерах и слуховых аппаратах. Недостатками являются стоимость и экологические проблемы, вызванные удалением тяжелых металлов, таких как \(\ce{Hg}\) и \(\ce{Ag}\).
Литий-йодная батарея
Ни одна из описанных выше батарей не является «сухой». Все они содержат небольшое количество жидкой воды, которая значительно увеличивает массу и вызывает потенциальные проблемы с коррозией. Следовательно, значительные усилия были затрачены на разработку безводных батарей. Одним из немногих коммерчески успешных безводных аккумуляторов является литий-йодный аккумулятор . Анод — металлический литий, катод — твердый комплекс \(I_2\). Их разделяет слой твердого вещества \(LiI\), который действует как электролит, обеспечивая диффузию Li 9− \label{Eq12} \]
Следовательно, значительные усилия были затрачены на разработку безводных батарей. Одним из немногих коммерчески успешных безводных аккумуляторов является литий-йодный аккумулятор . Анод — металлический литий, катод — твердый комплекс \(I_2\). Их разделяет слой твердого вещества \(LiI\), который действует как электролит, обеспечивая диффузию Li 9− \label{Eq12} \]
- всего:
\[2Li_{(s)}+ I_{2(s)} \rightarrow 2LiI_{(s)} \label{Eq12a} \]
с \(E_{cell} = 3,5 \, V\)
Кардиостимулятор: рентгенограмма пациента, показывающая расположение и размер кардиостимулятора, работающего от литий-йодной батареи. Как показано в части (c) на рисунке \(\PageIndex{1}\), типичная литий-йодная батарея состоит из двух элементов, разделенных сеткой из металлического никеля, собирающей заряд с анода. Из-за высокого внутреннего сопротивления, вызванного твердым электролитом, может потребляться только небольшой ток. Тем не менее такие батареи зарекомендовали себя как долговечные (до 10 лет) и надежные. Поэтому они используются в приложениях, где частая замена затруднена или нежелательна, например, в кардиостимуляторах и других медицинских имплантатах, а также в компьютерах для защиты памяти. Эти батареи также используются в охранных передатчиках и пожарных извещателях. Разрабатываются и другие аккумуляторы на основе литиевых анодов и твердых электролитов с использованием \(TiS_2\), например, в качестве катода.
Поэтому они используются в приложениях, где частая замена затруднена или нежелательна, например, в кардиостимуляторах и других медицинских имплантатах, а также в компьютерах для защиты памяти. Эти батареи также используются в охранных передатчиках и пожарных извещателях. Разрабатываются и другие аккумуляторы на основе литиевых анодов и твердых электролитов с использованием \(TiS_2\), например, в качестве катода.
Сухие элементы, кнопочные батареи и литий-йодные батареи одноразового использования и не подлежат перезарядке после разрядки. Перезаряжаемые батареи, напротив, имеют значительные экономические и экологические преимущества, поскольку их можно перезаряжать и разряжать множество раз. В результате затраты на производство и утилизацию резко снижаются при заданном количестве часов использования батареи. Двумя распространенными перезаряжаемыми батареями являются никель-кадмиевая батарея и свинцово-кислотная батарея, которые мы опишем далее.
Никель-кадмиевая (NiCad) батарея
Никель-кадмиевая (NiCad) батарея используется в небольших электроприборах и устройствах, таких как дрели, портативные пылесосы и цифровые тюнеры AM/FM. -_{(aq)} \label {Eq13} \] 9- \label{Eq14} \]
-_{(aq)} \label {Eq13} \] 9- \label{Eq14} \]
- всего:
\[Cd_{(т)} + 2NiO(OH)_{(т)} + 2H_2O_{(л)} \rightarrow Cd(OH)_{2(т)} + 2Ni(OH)_{2( s)} \label{Eq15} \]
\(E_{ячейка} = 1,4 В\)
Поскольку продукты разрядных полуреакций представляют собой твердые вещества, которые прилипают к электродам [Cd(OH) 2 и 2Ni(OH) 2 ], общая реакция легко обращается вспять при перезарядке элемента. Хотя никель-кадмиевые элементы легкие, перезаряжаемые и имеют большую емкость, они имеют определенные недостатки. Например, они, как правило, быстро теряют емкость, если их не полностью разрядить перед перезарядкой, они плохо хранятся в течение длительного времени при полной зарядке и представляют собой серьезные проблемы с окружающей средой и утилизацией из-за токсичности кадмия.
Разновидностью никель-кадмиевой батареи является никель-металлгидридная батарея (NiMH), используемая в гибридных автомобилях, устройствах беспроводной связи и мобильных компьютерах. Общее химическое уравнение для этого типа батареи выглядит следующим образом:
Общее химическое уравнение для этого типа батареи выглядит следующим образом:
\[NiO(OH)_{(s)} + MH \rightarrow Ni(OH)_{2(s)} + M_{(s)} \ label{Eq16} \]
Емкость NiMH-аккумулятора на 30–40% выше, чем у NiCad-аккумулятора; он более экологичен, поэтому хранение, транспортировка и утилизация не подлежат экологическому контролю; и он не так чувствителен к подзарядке памяти. Однако у него скорость саморазряда на 50% выше, ограниченный срок службы и более высокое техническое обслуживание, и он дороже, чем никель-кадмиевый аккумулятор.
Директива 2006/66/ЕС Европейского Союза запрещает размещение на рынке портативных аккумуляторов, содержащих более 0,002% кадмия по весу. Целью этой директивы было улучшение «экологических характеристик батарей и аккумуляторов».
Свинцово-кислотная (свинцовая) батарея
Свинцово-кислотная батарея используется для обеспечения пусковой мощности практически в каждом автомобильном и судовом двигателе. в продаже. Морские и автомобильные аккумуляторы обычно состоят из нескольких элементов, соединенных последовательно. Общее напряжение, генерируемое батареей, представляет собой потенциал на ячейку (E° ячейка ), умноженная на количество ячеек.
Морские и автомобильные аккумуляторы обычно состоят из нескольких элементов, соединенных последовательно. Общее напряжение, генерируемое батареей, представляет собой потенциал на ячейку (E° ячейка ), умноженная на количество ячеек.
Как показано на рисунке \(\PageIndex{3}\), анод каждого элемента свинцовой аккумуляторной батареи представляет собой пластину или сетку из губчатого металлического свинца, а катод — аналогичную сетку, содержащую порошкообразный диоксид свинца (\(PbO_2 \)). Электролит обычно представляет собой примерно 37% раствор (по массе) серной кислоты в воде с плотностью 1,28 г/мл (около 4,5 М \(H_2SO_4\)). Поскольку окислительно-восстановительные активные частицы представляют собой твердые вещества, нет необходимости разделять электроды. Электродные реакции в каждой ячейке во время разряда следующие: 9°_{ячейка} = 2,041 \; V\)
Электролит обычно представляет собой примерно 37% раствор (по массе) серной кислоты в воде с плотностью 1,28 г/мл (около 4,5 М \(H_2SO_4\)). Поскольку окислительно-восстановительные активные частицы представляют собой твердые вещества, нет необходимости разделять электроды. Электродные реакции в каждой ячейке во время разряда следующие: 9°_{ячейка} = 2,041 \; V\)
При разрядке элемента на электродах образуется порошок \(PbSO_4\). Кроме того, расходуется серная кислота и образуется вода, что снижает плотность электролита и обеспечивает удобный способ контроля состояния батареи путем простого измерения плотности электролита. Часто это делается с помощью ареометра.
Ареометр можно использовать для проверки удельного веса каждой ячейки в качестве меры ее состояния заряда (www.youtube.com/watch?v=SRcOqfL6GqQ).
Когда к свинцово-кислотному аккумулятору прикладывается внешнее напряжение, превышающее 2,04 В на элемент, электродные реакции меняются, и \(PbSO_4\) снова превращается в металлический свинец и \(PbO_2\).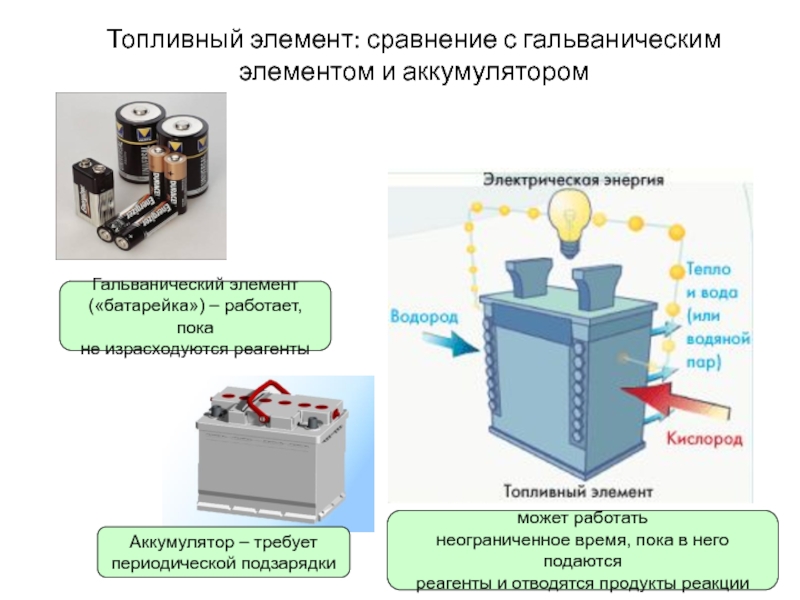 Однако, если батарея заряжается слишком энергично, может произойти электролиз воды:
Однако, если батарея заряжается слишком энергично, может произойти электролиз воды:
\[ 2H_2O_{(l)} \rightarrow 2H_{2(g)} +O_{2(g)} \label{EqX} \]
Это приводит к выделению потенциально взрывоопасного газообразного водорода. Образовавшиеся таким образом газовые пузырьки могут выбивать часть частиц \(PbSO_4\) или \(PbO_2\) из сеток, позволяя им падать на дно ячейки, где они могут скапливаться и вызывать внутреннее короткое замыкание. . Таким образом, процесс перезарядки должен тщательно контролироваться, чтобы оптимизировать срок службы батареи. Однако при надлежащем уходе свинцово-кислотный аккумулятор можно разряжать и перезаряжать тысячи раз. В автомобилях генератор переменного тока подает электрический ток, который вызывает обратную реакцию разряда.
Топливные элементы
Топливный элемент — это гальванический элемент, который требует постоянной внешней подачи реагентов, поскольку продукты реакции непрерывно удаляются. В отличие от батареи, он не хранит химическую или электрическую энергию; топливный элемент позволяет извлекать электрическую энергию непосредственно из химической реакции. В принципе, это должен быть более эффективный процесс, чем, например, сжигание топлива для приведения в действие двигателя внутреннего сгорания, который вращает генератор, который обычно имеет КПД менее 40%, а фактически КПД топливного элемента обычно от 40% до 60%. К сожалению, серьезные проблемы со стоимостью и надежностью препятствуют широкому внедрению топливных элементов. На практике их использование было ограничено приложениями, в которых масса может быть значительным фактором стоимости, например, 9+\) с образованием воды. Твердый электролит позволяет протонам диффундировать от анода к катоду. Хотя топливные элементы являются по существу экологически чистым средством получения электроэнергии, их стоимость и технологическая сложность до сих пор ограничивали их применение.
В принципе, это должен быть более эффективный процесс, чем, например, сжигание топлива для приведения в действие двигателя внутреннего сгорания, который вращает генератор, который обычно имеет КПД менее 40%, а фактически КПД топливного элемента обычно от 40% до 60%. К сожалению, серьезные проблемы со стоимостью и надежностью препятствуют широкому внедрению топливных элементов. На практике их использование было ограничено приложениями, в которых масса может быть значительным фактором стоимости, например, 9+\) с образованием воды. Твердый электролит позволяет протонам диффундировать от анода к катоду. Хотя топливные элементы являются по существу экологически чистым средством получения электроэнергии, их стоимость и технологическая сложность до сих пор ограничивали их применение.
В этих космических аппаратах используется водородно-кислородный топливный элемент, для которого требуется непрерывная подача H 2 (g) и O 2 (g), как показано на рисунке \(\PageIndex{4}\). Электродные реакции следующие: 9− \label{Eq21} \]
Электродные реакции следующие: 9− \label{Eq21} \]
- всего:
\[2H_{2(г)} + O_{2(г)} \rightarrow 2H_2O_{(г)} \label{Eq22} \]
Общая реакция представляет собой практически незагрязняющую конверсию водорода и кислорода в воду, которая затем собирается и используется в космических аппаратах. Хотя этот тип топливного элемента должен производить 1,23 В при стандартных условиях, на практике устройство достигает только около 0,9 В. Одним из основных препятствий для достижения большей эффективности является тот факт, что четырехэлектронное восстановление \(O_2(g)\ ) на катоде по своей природе довольно медленный, что ограничивает ток, который может быть достигнут. У всех основных производителей автомобилей есть крупные исследовательские программы, связанные с топливными элементами: одной из наиболее важных целей является разработка лучшего катализатора для восстановления \(O_2(g)\).
Резюме
Коммерческие батареи представляют собой гальванические элементы, в которых в качестве реагентов используются твердые или пастообразные вещества для максимизации выходной электрической мощности на единицу массы. Аккумулятор — это изолированная единица, которая производит электричество, тогда как топливный элемент — это гальванический элемент, который требует постоянного внешнего источника одного или нескольких реагентов для производства электричества. Одним из типов аккумуляторов является сухой элемент Leclanché, который содержит электролит в виде кислой пасты на водной основе. Эта батарея называется щелочной батареей, если она адаптирована для работы в щелочных условиях. Кнопочные батареи имеют высокое отношение выходной мощности к массе; литий-йодные батареи состоят из твердого электролита; никель-кадмиевый (NiCad) аккумулятор перезаряжаемый; а свинцово-кислотная батарея, которая также является перезаряжаемой, не требует, чтобы электроды находились в отдельных отсеках. Топливный элемент требует внешнего источника реагентов, так как продукты реакции постоянно удаляются. В топливном элементе энергия не хранится; электрическая энергия обеспечивается химической реакцией.
Аккумулятор — это изолированная единица, которая производит электричество, тогда как топливный элемент — это гальванический элемент, который требует постоянного внешнего источника одного или нескольких реагентов для производства электричества. Одним из типов аккумуляторов является сухой элемент Leclanché, который содержит электролит в виде кислой пасты на водной основе. Эта батарея называется щелочной батареей, если она адаптирована для работы в щелочных условиях. Кнопочные батареи имеют высокое отношение выходной мощности к массе; литий-йодные батареи состоят из твердого электролита; никель-кадмиевый (NiCad) аккумулятор перезаряжаемый; а свинцово-кислотная батарея, которая также является перезаряжаемой, не требует, чтобы электроды находились в отдельных отсеках. Топливный элемент требует внешнего источника реагентов, так как продукты реакции постоянно удаляются. В топливном элементе энергия не хранится; электрическая энергия обеспечивается химической реакцией.
Коммерческие гальванические элементы распространяются под лицензией CC BY-NC-SA 4.

 Ю. и др. Электротехника/В. Ю. Ломоносов, К. М. Поливанов, О. П. Михайлов. — М.: Энергоатомиздат, 1990. — 400 с.
Ю. и др. Электротехника/В. Ю. Ломоносов, К. М. Поливанов, О. П. Михайлов. — М.: Энергоатомиздат, 1990. — 400 с.
