Что такое гальванические токи в полости рта. Как они возникают при наличии металлических включений. Какие симптомы вызывают гальванические токи у пациентов. Как диагностировать и лечить гальванизм в стоматологии.
Что такое гальванические токи в стоматологии
Гальванические токи в стоматологии — это электрические токи, возникающие в полости рта при наличии металлических конструкций из разнородных металлов. Они образуются из-за разности электрохимических потенциалов между различными металлами в присутствии электролита — слюны.
Как возникают гальванические токи в полости рта?
- При контакте металла с электролитом (слюной) металл стремится отдать положительно заряженные ионы в раствор
- На металлической конструкции возникает электрический заряд
- Между разнородными металлами образуется разность потенциалов
- Формируется гальванический элемент, в котором протекают токи электронов и ионов
Причины возникновения гальванических токов
Основные причины появления гальванических токов в полости рта:

- Наличие металлических включений из разнородных металлов и сплавов (коронки, мосты, импланты)
- Сочетание благородных и неблагородных металлов
- Использование некачественных сплавов с примесями
- Нарушение технологии изготовления ортопедических конструкций
- Индивидуальные особенности состава слюны пациента
Какие металлы чаще всего вызывают гальванические токи?
Наиболее активно в образовании гальванических элементов участвуют: — Сплавы на основе никеля и хрома — Нержавеющая сталь — Амальгама (сплав ртути с другими металлами) — Сочетания золота с неблагородными металлами
Симптомы гальванизма в полости рта
Основные клинические проявления гальванизма в стоматологии включают:
- Изменение вкусовых ощущений (металлический, кислый, соленый, горький привкус)
- Жжение и покалывание в языке и слизистой оболочке рта
- Сухость во рту или повышенное слюноотделение
- Глоссалгия (боль в языке)
- Стомалгия (боль в полости рта)
- Нарушения общего самочувствия (головные боли, раздражительность)
Как проявляются симптомы гальванизма у пациентов?

Симптомы обычно усиливаются при приеме кислой пищи, в стрессовых ситуациях. Характерно быстрое исчезновение симптомов после удаления металлических конструкций из полости рта.
Диагностика гальванических токов
Для выявления гальванических токов в полости рта проводят следующие исследования:
- Сбор жалоб и анамнеза пациента
- Осмотр полости рта с определением наличия и состояния металлических конструкций
- Измерение разности потенциалов между металлическими включениями
- Определение силы тока в полости рта
- pH-метрия слюны
- Аллергологическое обследование для исключения аллергии на металлы
Какие показатели свидетельствуют о наличии гальванизма?
О патологическом гальванизме свидетельствуют: — Разность потенциалов между металлическими конструкциями более 80 мВ — Сила тока в полости рта более 3 мкА — pH слюны менее 6,8 или более 7,2
Методы лечения гальванизма в стоматологии
Лечение гальванизма в полости рта включает следующие мероприятия:
- Удаление металлических конструкций, вызывающих гальванические токи
- Замена разнородных металлов на однородные (например, только на золотые сплавы)
- Изоляция металлических включений с помощью керамических покрытий
- Назначение препаратов для нормализации состава слюны
- Применение антиоксидантов и витаминов для повышения защитных свойств слизистой оболочки
Как быстро проходят симптомы после лечения гальванизма?
При правильном лечении симптомы гальванизма обычно полностью исчезают в течение 1-2 недель после удаления или замены металлических конструкций.
Профилактика гальванических токов
Для предотвращения развития гальванизма в стоматологии рекомендуется:
- Использовать однородные металлы и сплавы при протезировании
- Применять современные биосовместимые материалы (керамика, цирконий)
- Проводить тщательное обследование пациентов перед протезированием
- Соблюдать технологию изготовления ортопедических конструкций
- Регулярно проходить осмотры у стоматолога
Какие материалы наиболее безопасны с точки зрения гальванизма?
Наименее вероятно вызывают гальванические токи: — Цельнокерамические конструкции — Протезы из диоксида циркония — Однородные золотые сплавы высокой пробы
Влияние гальванических токов на организм
Гальванические токи в полости рта могут оказывать следующее негативное воздействие:
- Нарушение минерального обмена в тканях полости рта
- Изменение pH слюны и нарушение ее защитных свойств
- Усиление коррозии металлических конструкций
- Повреждение слизистой оболочки полости рта
- Развитие аллергических реакций на продукты коррозии металлов
- Нарушение общего самочувствия и работоспособности
Могут ли гальванические токи вызвать серьезные заболевания?

В редких случаях длительное воздействие гальванических токов может привести к развитию хронических воспалительных и аллергических заболеваний слизистой оболочки полости рта, нарушениям иммунитета.
Заключение
Гальванические токи в стоматологии представляют собой серьезную проблему, способную значительно снизить качество жизни пациентов. Своевременная диагностика и правильное лечение гальванизма позволяют быстро устранить неприятные симптомы и предотвратить развитие осложнений. Использование современных биосовместимых материалов и соблюдение технологии протезирования являются ключевыми факторами профилактики этого состояния.
Электрический ток. Источники электрического тока по ФГОС. – конспект урока – Корпорация Российский учебник (издательство Дрофа – Вентана)
Разработки уроков (конспекты уроков)
Линия УМК А.В. Перышкина. Физика (7-9)
Физика
Внимание! Администрация сайта rosuchebnik.ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
Класс: 8
УМК: Пёрышкин А. В.
Тип урока:изучение нового материала.
Цель урока: формирование представления об электрическом токе и условиях его существования в цепи, и об источниках тока.
Планируемые результаты урока:
Предметные:
- Использование знаково-символических средств, в том числе моделей и схем для решения задач;
- формирование представлений об источниках тока;
- организация усвоения основных понятий по данной теме;
- формирование научного мировоззрения учащихся.

Метапредметные:
- Развитие умения генерировать идеи;
- выявлять причинно-следственные связи;
- работать в группе;
- пользоваться альтернативными источниками информации;
- формировать умение анализировать факты при наблюдении и объяснении явлений, при работе с текстом учебника.
Личностные:
- Формирование ценностных ориентиров и смыслов учебной деятельности на основе развития познавательных интересов, учебных мотивов;
- формирование умений управлять своей учебной деятельностью;
- формирование интереса к физике при анализе физических явлений;
- формирование мотивации постановкой познавательных задач, раскрытием связи теории и опыта, развитие внимания, памяти и творческого мышления .
Методы обучения: проблемный, репродуктивный, эвристический.
Формы организации познавательной деятельности обучающихся: коллективная, индивидуальная, групповая.
Средства обучения: ПК, проектор, экран; металлическая трубка, эбонитовая палочка, электрофорная машина, термоэлемент, спиртовка, гальванометр, фотоэлемент, лампа, гальванический элемент, батарея гальванических элементов, аккумулятор. На столах учеников лимон, картофель ,медные провода, гвозди. Карточки с заданиями.
Виды педагогических технологий, применяемые на данном уроке:
- информационная технология;
- личностно ориентированное обучение (беседа – ответы на вопросы; развитие, понимание и объяснение опытов, творчество и исследовательский поиск при решении проблемного вопроса).
Технологическая карта урока
|
Этап урока, |
Деятельность учителя |
Деятельность ученика |
Формируемые УУД |
Формы работы (индивидуальная, групповая, фронтальная) |
Средства обучения |
|
1. 1 минута. |
Приветствует учеников. |
Отвечают на приветствие учителя. |
Коммуникативные |
фронтальная |
|
|
2.Постановка целей и задач урока 2 минуты. |
Подготовка к осознанию целей и задач, создает мотивацию |
Ставят цели урока. |
Регулятивные |
фронтальная |
|
|
3. 3 минуты. |
Беседа, фронтальный опрос |
Отвечают на заданные вопросы. |
Предметные, регулятивные |
фронтальная |
|
|
4.Первичное усвоение новых знаний. 15 минут |
1.Демонстрация опыта №1. Электроскопы соединены проводником |
Следят за экспериментом, делают вывод. |
Предметные, регулятивные, коммуникативные |
индивидуальная, групповая, фронтальная |
Презентация |
|
2. Формулировка понятия эл.тока. (слайд №2) |
Пытаются самостоятельно сформулировать определение и записать его в тетрадь. |
||||
|
3.Выяснения условий длительного существования эл.тока.
|
Рисуют схему, |
||||
|
4.Демонстрация опытов с источниками эл. №2.Электрофорная машина(слайд №9) генератор(слайд №10) |
Следят за экспериментами, делают выводы и записывают их в тетрадь. |
||||
|
№3.Термоэлемент (слайд №12) |
записывают в тетрадь. |
||||
|
№4.Фотоэффект (слайд №14) |
записывают в тетрадь. |
||||
|
Эксперимент 1 |
Выполняют эксперимент. Делают выводы. |
||||
|
Рассказ про гальванический элемент. |
ЭОР |
||||
|
4. Первичная проверка понимания. 5 минут |
Рассказ про аккумуляторы ЭОР
|
Работают с учебником. Отвечают на вопросы. |
Предметные, регулятивные |
индивидуальная, фронтальная |
ЭОР |
|
Динамическая пауза. Снеговик. 2 минуты |
|
Выполняют упражнения |
Личностные |
индивидуальная, |
Презентация |
|
5. 5 минут |
Раздает карточки с задание. |
Выполняют тест. |
Предметные, регулятивные |
Индивидуальная |
Карточки с заданием |
|
6.Контроль усвоения, обсуждение допущенных ошибок и их коррекция. 3 минуты |
Корректирует ошибки. |
Взаимопроверка. Выставление оценок. |
Предметные, регулятивные |
Индивидуальная |
|
|
7. 2 минуты |
Подводить к итогам занятия, предлагает осуществить самооценку достижений. |
Участвуют в беседе по обсуждению достижений. |
Личностные, коммуникативные, регулятивные |
фронтальная |
|
|
8. Информация о домашнем задании. 2 минуты |
Информирует о домашнем задании. Раздает инструкцию по выполнению |
Записывают домашнее задание. |
Регулятивные |
фронтальная |
|
I. Организационный момент.
II. Постановка целей и задач урока (мотивация и формулировка цели урока).
Учитель: Сегодня мы начинаем изучение важнейшей для современного человека темы: «Электрический ток. Источники электрического тока». Слово «электричество», «электрический ток» прочно вошли в нашу жизнь. Мы настолько привыкли к тому, что нас окружают электроприборы и электрические явления, что порой не замечаем, какую огромную роль они играют в нашей жизни.
Представьте себе на минуту, что отключили электричество в наших домах. Что было бы? Каковы последствия этого события?
Ученики: Если отключат электричество, то погаснет свет, не сможем посмотреть телевизор, не будут работать компьютеры, холодильники, все электроприборы, останемся без воды и тепла, так как насосы, качающие воду, работают на электричестве, не смогли бы подзарядить сотовые телефоны.
Учитель: Делаем вывод: электричество играет огромную роль в нашей жизни, поэтому важно знать, что это такое. Какая цель сегодняшнего урока?
Ученики: выяснить, что такое электрический ток и какие условия необходимы для его существования, и источники тока.
III. Актуализация опорных знаний учащихся.
Фронтальный опрос.
Учитель: Но прежде всего давайте вспомним ранее изученный материал и ответим на следующие вопросы.
- Что такое электризация тел? (Электризация – разделение электрических зарядов в результате тесного контакта двух или более тел.)
- Как можно наэлектризовать тело?
- Назовите два рода зарядов. Как взаимодействуют тела, имеющие электрические заряды?
- Что такое проводники и непроводники электричества?
- Какие металлы проводят электричество?
- Под действием чего движутся свободные электроны в металлах?
- Какие заряженные частицы вы знаете?
IV.
 Первичное усвоение новых знаний.1. Электрический ток.
Первичное усвоение новых знаний.1. Электрический ток.Демонстрация №1
Два электрометра, соединенных металлическим проводником. Если поднести к одному электрометру заряженную стеклянную палочку, то стрелка второго электрометра отклонится. Что происходит при этом?
Учащиеся отвечают (вокруг заряженной палочки возникает электрическое поле, под действием которого свободные электроны перемещаются сначала к одному электрометру, а затем через проводник к другому.)
В нашем опыте электроны двигаются в одну сторону, т.е. направлено (упорядочено). В этом случае можно сказать, что по металлическому проводнику протекает электрический ток.
Кроме металлических проводников мы будем изучать и другие проводники, например, проводящие ток жидкости. В них кроме электронов есть и другие заряженные частицы – ионы. Они тоже могут перемещаться.
Сформулируем вместе, что же такое электрический ток?
- электроны и ионы – это…? (Ученики: заряженные частицы).

- что с ними происходит? (Ученики: они движутся).
- как они движутся? (Ученики: упорядочено, т.е. направлено).
- под действием чего движутся заряженные частицы? (Ученики: под действием электрического поля).
СЛАЙД 2 (запишите)
Электрический ток — это упорядоченное (направленное) движение заряженных частиц, под действием электрического поля.
2. Условие существования тока в цепи.
В нашем опыте в металлическом проводнике электрический ток возникает, но он быстро прекращается. Почему же он является кратковременным? По мере перемещения зарядов с палочки на электрометр и далее по трубке, электрическое поле вокруг палочки уменьшается, а вокруг левого электрометра растет. При равенстве зарядов их электрические поля компенсируют друг друга и движение электронов прекращается.
Значит, для того, чтобы ток в цепи существовал долго что необходимо:
- Наличие свободных электронов
- Наличие внешнего электрического поля для проводника
Источник тока.
Изобразим все в виде схемы. (Учитель рисует на доске, ученики в тетрадях схему)
3. Источники тока
Источники тока – это устройства, создающие и поддерживающие длительное время электрическое поле. Существуют различные источники тока, но в любом из них совершается работа по разделению положительно и отрицательно заряженных частиц. Разделенные заряженные частицы накапливаются на полюсах источника тока. Один полюс заряжен положительно, второй – отрицательно. Если полюсы источника соединить проводником, то в нем под действием электрического поля возникает электрический ток, т.е. свободные заряженные частицы придут в нем в движение.
4. Виды источников тока
Произвожу демонстрацию опытов по рис. 44-46 учебника. В ходе выполнения опытов задаю вопрос. Какой вид энергии превращается в электрическую в данном опыте? После обсуждения каждого опыта заполняем соответствующую строку таблицы 1.
Демонстрирую опыт №2
Действие электрофорной машины.
Вывод: Разделение зарядов происходит за счет механической энергии. При вращении дисков происходит трение щеток о диск, что приводит к разделению зарядов. В результате один электрод машины заряжается положительно, а другой отрицательно. Если приблизить электроды машины, то возникает кратковременный ток в виде электрического разряда в воздухе.
Для того, чтобы ток протекал постоянно, необходимо непрерывно вращать ручку электрофорной машины. Конечно, таким образом создавать электрический ток длительное время невозможно. На электростанциях электрический ток вырабатывают с помощью генераторов. Этот ток используется в промышленности, на транспорте, в осветительной сети.
Демонстрирую опыт №3.
Действие термоэлемента.
Вывод: Если две проволоки, изготовленные из разных металлов, спаять, затем нагреть место спая, то по цепи потечет электрический ток. Разделение зарядов происходит за счет изменения внутренней энергии веществ.
Демонстрирую опыт №4.
Действие фотоэлементаи источника света.
Вывод: Если такие вещества, как кремний, селен, оксид меди осветить, то в цепи возникает электрический ток. Это явление называется фотоэффектом. Световая энергия превращается в электрическую.
Чтобы перейти к следующему источнику тока расскажу немного об истории их создания.
Эксперимент 1
У вас на столах имеются лимон и картофель. Сейчас попробуйте получить из них источники тока используя ваши вольтметры. Понаблюдайте за отклонением стрелочки.
Какой вывод, какая энергия превратилась в электрическую.
Источники тока у которых разделение зарядов происходит за счет энергии химических процессов называют гальваническими. В них химическая энергия преобразуется в электрическую.
Обратимся к истории.(16слайд)
В 1799 году итальянский физик Алессандро Вольта, опираясь на результаты исследований Луиджи Гальвани, изготовил электрическую батарею, названную вольтовым столбом.
Батарея Вольта была составлена из чередующихся медных и цинковых кружков, которые были сложены столбиком и переложены кусочками сукна, смоченного в растворе серной кислоты
Рассказ про г.э. ЭОР
V. Первичная проверка понимания
(17 слайд)
Откройте учебники на с. 97. На рис 47 рассмотрите устройство сухого гальванического элемента и в тексте найдите ответы на вопросы.
Вопросы:
- Что такое батарея гальванических элементов? (Несколько гальванических элементов, соединенных вместе, образуют батарею гальванических элементов).
- Срок действия гальванических элементов? (Все гальванические элементы и батареи гальванических элементов имеют определенный срок действия. После этого мы их просто выбрасываем).
- Существуют ли химические источники тока многоразового действия? (Да. Это аккумуляторы, от латинского слова аккумуляторе — накоплять).

- Что представляет простейший аккумулятор? (Простейший аккумулятор – это две свинцовые пластины, помещенные в раствор серной кислоты. Чтобы аккумулятор был источником тока, надо зарядить от какого – то другого источника постоянного тока. При прохождении тока между пластинами и кислотой происходит химическая реакция. При этом один электрод становится положительно заряженным, а второй — отрицательно заряженным).
- Какие виды аккумуляторов бывают? (Аккумуляторы бывают двух видов:
- Кислотные (свинцовые) — свинцовая пластина в растворе серной кислоты:
- Щелочные (железно — никелевые) – одна пластина из спрессованного железного порошка, вторая – из пероксида никеля. Помещены в раствор щелочи.)
А с какими источниками тока вам приходилось чаще всего сталкиваться в повседневной жизни?
Ученики: Аккумуляторы.
- Рассказ про аккумуляторы ЭОР
Действительно, очень часто мы используем именно аккумуляторы. Сотовые телефоны необходимо периодически подзаряжать. Для этого мы используем зарядное устройство или так называемый сетевой адаптер, который преобразует переменный ток напряжением 220 В из осветительной сети в постоянный ток напряжением 3 В.Чаще всего там используется литиево – ионный аккумулятор или батарея, в которой применяется раствор солей лития в органическом растворителе. Ну а теперь мы полностью завершаем заполнение таблицы.
Сотовые телефоны необходимо периодически подзаряжать. Для этого мы используем зарядное устройство или так называемый сетевой адаптер, который преобразует переменный ток напряжением 220 В из осветительной сети в постоянный ток напряжением 3 В.Чаще всего там используется литиево – ионный аккумулятор или батарея, в которой применяется раствор солей лития в органическом растворителе. Ну а теперь мы полностью завершаем заполнение таблицы.
Таблица 1
|
№ |
Виды источников |
Преобразование энергии |
Название источников тока |
|
1. |
Механические |
Механическая энергия в электрическую. |
Электрофорная машина, генератор. |
|
2. |
Тепловые |
Внутренняя энергия в электрическую. |
Термоэлемент. |
|
3. |
Световые |
Световая энергия в электрическую. |
Фотоэлемент, солнечная батарея. |
|
4. |
Химические |
Химическая энергия в электрическую. |
Гальванический элемент, аккумулятор, батареи. |
Динамическая пауза. Снеговик.
VI. Первичное закрепление. Тест.
Электрический ток. Источники электрического тока.
Вариант № 1.
- Как называются приборы, создающие электрическое поле?
А.Элемент питания
Б. Источники тока
В. Электромеханический генератор
Г. Источник энергии - Какие превращения энергии происходят в термоэлементе?
А. Механическая энергия преобразуется в электрическую энергию
Б. Внутренняя энергия преобразуется в электрическую энергию
В. Энергия света преобразуется в электрическую энергию.
Г. Химическая энергия преобразуется в электрическую энергию.
- В каких источниках тока используется химическая энергия.
А.
Б.
В.
Г. - В чем отличие аккумуляторов от других гальванических источников тока?
А. Химический источник тока многоразового действия
Б. Необходимо предварительно зарядить
В. Используются для накопления энергии и автономного питания различных потребителей.
Г. Состоит из нескольких гальванических элементов, которые называются батареей. - Электрическим током называется?
А. Направленное движение атомов
Б. Направленное движение электронов по проводам.
В. Направленное движение заряженных частиц.
Г. Направленное движение нейтральных частиц.
Электрический ток. Источники электрического тока.
Вариант № 2
- Какими заряженными частицами может создаваться электрический ток?
А. Ионами
Ионами
Б. Электронами
В. Протонами
Г. Нейтронами - Какие превращения энергии происходит в электрофорной машине?
А. Механическая энергия преобразуется в электрическую энергию
Б. Внутренняя энергия преобразуется в электрическую энергию
В. Энергия света преобразуется в электрическую энергию.
Г. Химическая энергия преобразуется в электрическую энергию. - В каких источниках используется световая энергия?
А.
Б.
В.
Г. - Какие источники тока используются на электростанциях для промышленного получения тока?
А. Электрофорная машина
Б. Термоэлемент (термопара)
В. Фотоэлемент
Г. Электромеханический генератор - Для создания и поддержания электрического тока необходимо?
А. Источник тока и металлический проводник.
Б.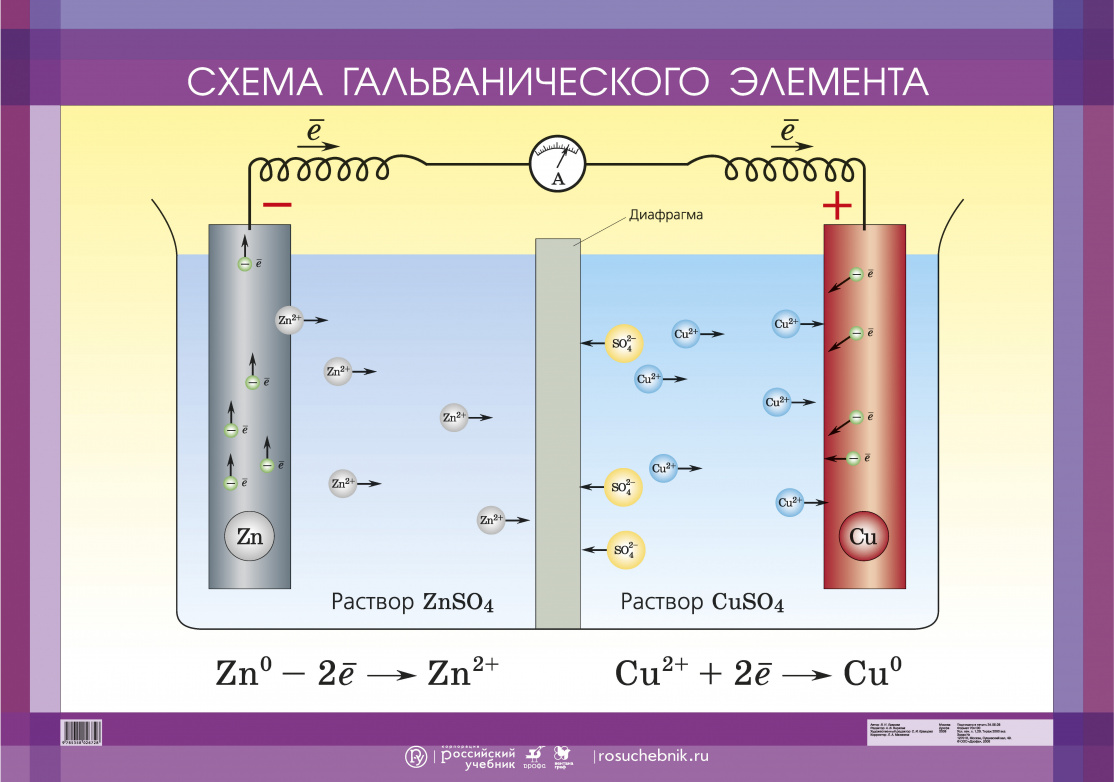 Электрофорная машина и эбонитовая палочка.
Электрофорная машина и эбонитовая палочка.
В. Свободные заряженные частицы и электрическое поле.
Г. Аккумулятор и розетка
VII. Контроль усвоения, обсуждение допущенных ошибок и их коррекция.
Взаимопроверка. Выставление оценок.
VIII. Рефлексия.
Подводит итог:
— Что было на уроке важным?
— Что было новым?
— Что было интересным?
У вас на столах лежат кружочки.
Нарисуйте на листочках, какой заряд вы получили от сегодняшнего урока.
Если всё понятно и понравилось, то рисуете положительный заряд
Если вам ничего непонятно, то рисуете отрицательный заряд.
Если вам понравился урок, но не всё понятно, рисуете два знака заряда.
IX. Информация о домашнем задании.
- Параграф 32. Вопросы 1-7.
- Домашний проект «Сделай батарейку»
Инструкция выдается каждому ученику.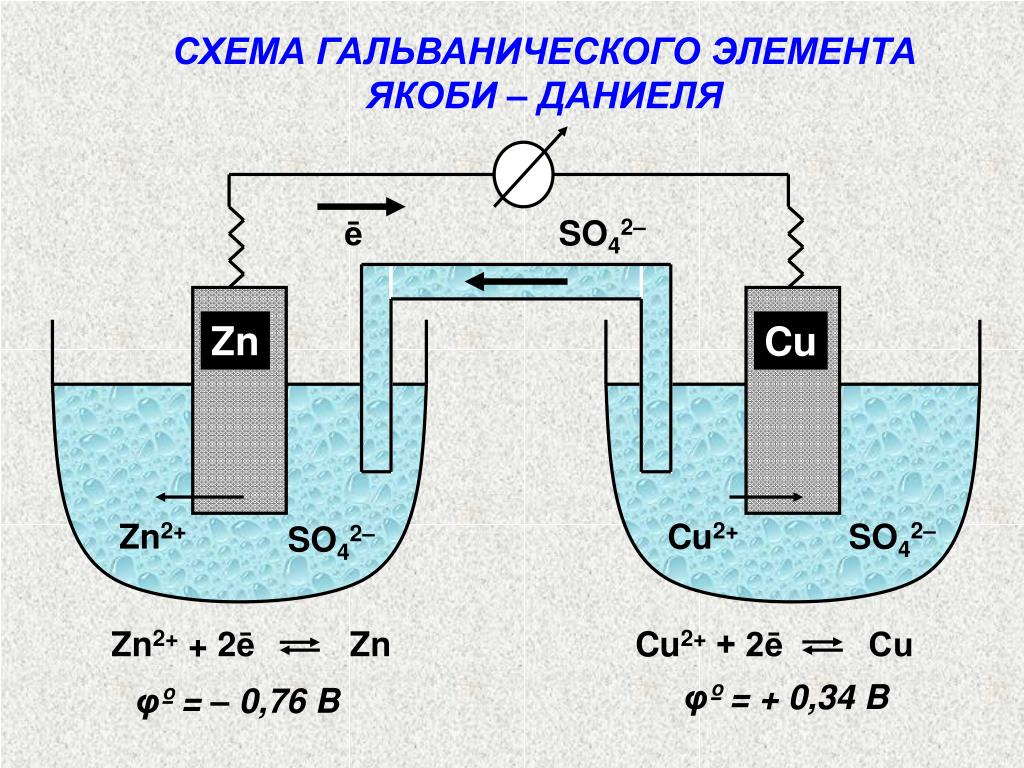
Инструкция:
- Возьмите 5 желтых монет по 10 копеек и 5 белых монет по 5 копеек. (Они примерно одинаковые по величине, а сделаны из разных сплавов).
- Расположите их столбом друг на друга поочередно, а между ними положите кусочки газетной бумаги, смоченной в крепком растворе поваренной соли.
- Возьмите столб мокрыми пальцами за концы, и вы почувствуете слабый электрический удар.
Гальванизм в стоматологии
|
В настоящее время для терапевтического и ортопедического лечения
в стоматологии применяется большое количество электропроводящих
элементов — изделий из металлов и их сплавов. Всегда при контакте
проводника с электролитом возникает электрический эффект,
который заключается в стремлении металла отдать положительно
заряженные ионы в раствор, сохранив принадлежащие ему электроны. |
Eric Davis Dental — Гальванизм
Два разнородных металла в среде слюны производят электрический ток за счет гальванического воздействия и становятся своего рода батареей. Пять металлов, часто встречающихся в большинстве составов амальгамы, создают еще более сложную батарею. Электрические токи, производимые амальгамой, намного больше по величине, чем чувствительные электрические токи, на которых работает мозг, и намного больше, чем ток, который активирует акупунктурные меридианы.
Эти аномальные электрические токи могут вызывают или способствуют большому разнообразию симптомов и заболеваний. Типичны синдром жжения во рту и красный плоский лишай. Удаление амальгамы у пациентов с состояниями, связанными с гальванической генерацией электричества, иногда дает почти немедленных улучшений.
Типичны синдром жжения во рту и красный плоский лишай. Удаление амальгамы у пациентов с состояниями, связанными с гальванической генерацией электричества, иногда дает почти немедленных улучшений.
Быстрые улучшения могут быть связаны с устранением электрических токов, производимых амальгамной батареей. Современные исследования только недавно приступили к изучению этой важной проблемной области.
Мы регулярно измеряем гальванические токи, чтобы определить порядок удаления мешающих стоматологических материалов.
Гальванизм — это состояние, при котором мягкие ткани могут быть вызваны разностью потенциалов, создаваемой разнородными металлами в ротовой полости, при этом слюна служит электролитом. Можно измерить гальванические токи, указывающие на высвобождение ионов металлов.
Существует четыре типа гальванизации:
- Классическим примером стоматологической гальванизации является серебряная амальгама, помещенная напротив или рядом с зубом, восстановленным золотом.
 Эти разнородные металлы в сочетании со слюной и биологическими жидкостями образуют электрическую ячейку. При соприкосновении цепь замыкается, поток электрического тока проходит через пульпу, и больной испытывает боль.
Эти разнородные металлы в сочетании со слюной и биологическими жидкостями образуют электрическую ячейку. При соприкосновении цепь замыкается, поток электрического тока проходит через пульпу, и больной испытывает боль. - Второй потенциальный путь для этих токов может происходить между зубами в одной дуге, но не контактирующими друг с другом.
- Третьей и наиболее широко признанной формой электролитического воздействия как источника боли и дискомфорта пациента является довольно классическая форма контакта разнородных металлов при смыкании зубов нижней и верхней челюсти.
- Четвертый тип гальванической ситуации возникает при реставрации двух соседних зубов разнородными металлами. Ток течет от металла к металлу через дентин, костную и тканевую жидкости обоих зубов.
При контакте золота и амальгамы в ротовой полости возникает гальванический ток и усиливается коррозия амальгамы с выделением ионов металла. К числу источников раздражения, которые можно рассматривать как возможные факторы возникновения предраковых и раковых поражений, можно отнести полость рта из-за эффекта электрического раздражения, создаваемого комбинацией металлов, используемых для пломбирования зубов и изготовления других зубных протезов. протез.
протез.
Мы можем обнаружить протекание тока не только между металлами двух разных потенциалов, но и между сплавами одного и того же типа, а именно: амальгама к амальгаме и золото к золоту. Для исследования пероральных токов требуется милитестер для измерения развития электрического тока в миллиамперах (мА) или разности потенциалов в милливольтах (мВ). Для клиента, измеряющего эти токи, нет никакого риска или вреда.
Пациентам с симптомами паралича Белла, шумом в ушах, нарушениями зрения, хроническими головными болями, невралгией тройничного нерва, идиопатическими нервно-мышечными патологиями головы и шеи, бруксизмом или тяжелой депрессией, синдромом жжения во рту следует провести электрическое тестирование.
ССЫЛКИ
(1) Skinner, E.W. Наука о стоматологических материалах. В.Б. Компания Saunders, глава. 19, с. 296. 289-300.
(2) Гринер, Э.Х. Материаловедение в стоматологии. Компания «Уильямс и Уилкинс» стр. 357-359
(3) Крейг Р.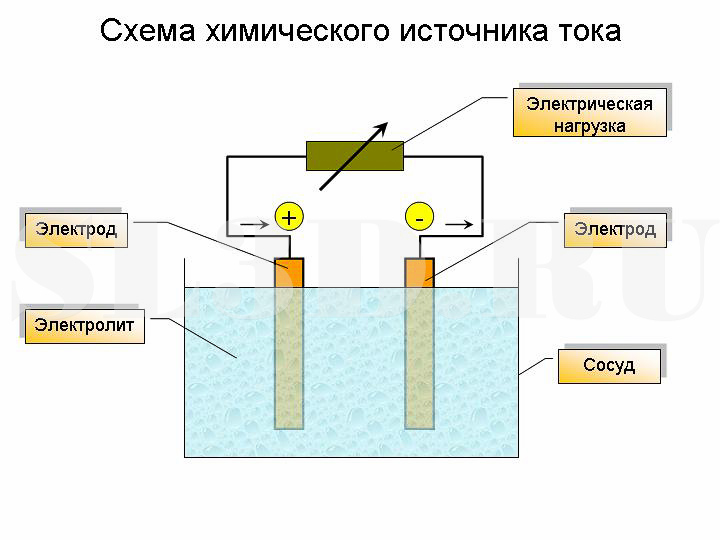 Г. Реставрационные стоматологические материалы. Резюме Mosby Co., стр. 2957, 1980.
Г. Реставрационные стоматологические материалы. Резюме Mosby Co., стр. 2957, 1980.
Синдром горящего рта-Ора…
Гальванизм-1.pdf
Гальванизм-2.pdf
Гальванизм-3-ADA-journal.pd…
Гальванизм-4.pdf
Гальванизм -5.pdf
Гальванизм-6.pdf
Гальванизм-7.pdf
JDMT29701401564600.pdf
Мейер Р.Д., Мейер Дж., Талумис Л.Дж.
J Протез Dent. 1993 г., февраль; 69(2):141-3.
Abstract
В этой статье рассмотрен стоматологический анамнез пациента с симптоматической электрохимической реакцией после изменения окклюзионного соотношения существующей цельной золотой коронки и реставрации из серебряной амальгамы. Представлен обзор литературы по оральному гальванизму с методами диагностики и вариантами лечения.
PMID: 8429505 [PubMed — проиндексировано для MEDLINE]
Gen Dent. 1996 г., июль-август; 44(4):324-6.
Certosimo AJ 1 , O’Connor RP.
«Оральное электричество», «электрогальванизм» или «гальванические токи» уже давно признано потенциальным источником боли и дискомфорта в полости рта. Это явление орального гальванизма возникает из-за разницы электрических потенциалов между разнородными восстановительными металлами, находящимися во рту. В этом отчете проанализирована литература и представлено интересное тематическое исследование. Клиническая картина пациента, а также продолжительность и постоянство оральных симптомов создают диагностические проблемы. Предложена простая, но эффективная схема лечения.
Это явление орального гальванизма возникает из-за разницы электрических потенциалов между разнородными восстановительными металлами, находящимися во рту. В этом отчете проанализирована литература и представлено интересное тематическое исследование. Клиническая картина пациента, а также продолжительность и постоянство оральных симптомов создают диагностические проблемы. Предложена простая, но эффективная схема лечения.
Клинические и гистологические исследования электрогальванически индуцированных белых поражений полости рта.
Автор: Bánóczy J, Roed-Petersen B, Pindborg JJ, Inovay J. Год: 1979 Журнал/Публикация/Источник: Oral Surg Oral Med Oral Pathol.
PubMed ID: PMID:291858
Комментарий: «Авторы данного исследования, посвященного изучению орального гальванизма, заключают: «Роль электрогальванических микротоков в развитии белых поражений слизистой оболочки полости рта подтверждается исчезновением или регрессом не менее тридцать одно из тридцати шести поражений после замены различных металлов». 0008
0008
Резюме/Выдержка: Среди 1128 пациентов с лейкоплакией полости рта и 326 пациентов с красным плоским лишаем полости рта, включенных в долгосрочные последующие исследования, у тридцати двух пациентов были обнаружены поражения слизистой оболочки полости рта, которые можно отнести к электрогальванизму. Материал состоял из двадцати женщин и двенадцати пациентов мужского пола. Клиническим диагнозом была лейкоплакия у шестнадцати пациентов и красный плоский лишай полости рта у остальных шестнадцати пациентов. Гистопатологические характеристики были проанализированы и сопоставлены с клиническими данными. В пяти случаях развилась злокачественная трансформация. Термин «электрогальванические белые поражения» предлагается в качестве общего знаменателя для этих изменений слизистой оболочки, которые, по-видимому, принимают форму красного плоского лишая так же часто, как и форму лейкоплакии.
Образец цитирования: Bánóczy J, Roed-Petersen B, Pindborg JJ, Inovay J. Клинические и гистологические исследования электрогальванически индуцированных белых поражений полости рта. Oral Surg Oral Med Oral Pathol. 1979; 48(4): 319-23.
Oral Surg Oral Med Oral Pathol. 1979; 48(4): 319-23.
Электролитическое действие во рту и его связь с болью.
Автор: Мамфорд Дж.М. Год: 1957 Журнал/Публикация/Источник: J Dent Res. Идентификатор PubMed: PMID:13449227
Комментарий: Автор этого исследования измерил токи ЭМП разнородных зубных пломбировочных материалов, погруженных в слюну, сыворотку и кровь, и исследовал, почему возникает боль в некоторых случаях орального гальванизма.
Резюме/Выдержка: «Эта тема была подробно рассмотрена Шривером и Даймондом, которые также предоставили значительную биографию. Однако, хотя хорошо известно, что боль возникает в результате электролитической активности во рту, считается, что чистый объяснение того, как возникает боль, еще не дано. «Цель этой статьи — попытаться дать такое объяснение». Образец цитирования: Мамфорд Дж. М. Электролитическое действие во рту и его связь с болью. Дж Дент Рез. 1957; 36(4):632-40.
Страна происхождения: Великобритания
Системный аллергический контактный дерматит, вызванный гальванической парой между амальгамой ртути и титановым имплантатом.

Автор: Pigatto PDM, Brambilla L, Ferrucci S, Guzzi G. Год: 2010 Журнал/Публикация/Источник: Skin Allergy Meeting
Комментарий: Это исследование показало, что зубная амальгама ртутных и титановых имплантатов может взаимодействовать и вызывать дематит.
Abstract/Excerpt:
«Abstract: Предпосылки Системный аллергический контактный дерматит был зарегистрирован у пациентов с неблагоприятными последствиями для здоровья, связанными с реставрациями из стоматологических сплавов. Здесь мы сообщаем о случае тяжелого системного аллергического контактного дерматита, вызванного аллергией на металлы, выделяемые гальваническими коррозия между ртутной зубной амальгамой и титановым зубным имплантатом.Методы.В апреле 2002 г. была обследована 36-летняя женщина, сообщившая о тяжелом системном дерматите с непреодолимым зудом. на верхней челюсти и челюсти.Обследование выявило обширный дерматит с эритемой, сухую кожу с шелушением и корками на лице, шее и в паховой области (рис. 1).У нее было 2 титановых внутрикостных имплантата (на площади 1,6 и 3,6) и 1 пломба из ртутной амальгамы. на левом первом моляре нижней челюсти (3.7).Мы заподозрили высокую скорость интраорального высвобождения ионов металлов из-за гальванической коррозии между пломбой из ртутной амальгамы на 3.7 и коронкой из золотого сплава, поддерживаемой титановым имплантатом, в области 3.6. Татуировка амальгамы присутствовала на 1,6 десневой площади. Результаты. Она прошла патч-тестирование с общей и стоматологической сериями. Мы наблюдали очень сильные положительные аллергические реакции на сульфат никеля 5% (+++) и дихромат калия 0,5% (+++), тиосульфат натрия 0,5% (++), все в петролатуме. Тест стимуляции лимфоцитов подтвердил аллергию на никель (индекс стимуляции: 6,7). Стоматологическая амальгама, а также металлокерамическая коронка на имплантате были удалены для устранения гальванической коррозии ротовой полости. Системный контактный дерматит полностью разрешился в течение 8 мес после удаления амальгамы ртути.
1).У нее было 2 титановых внутрикостных имплантата (на площади 1,6 и 3,6) и 1 пломба из ртутной амальгамы. на левом первом моляре нижней челюсти (3.7).Мы заподозрили высокую скорость интраорального высвобождения ионов металлов из-за гальванической коррозии между пломбой из ртутной амальгамы на 3.7 и коронкой из золотого сплава, поддерживаемой титановым имплантатом, в области 3.6. Татуировка амальгамы присутствовала на 1,6 десневой площади. Результаты. Она прошла патч-тестирование с общей и стоматологической сериями. Мы наблюдали очень сильные положительные аллергические реакции на сульфат никеля 5% (+++) и дихромат калия 0,5% (+++), тиосульфат натрия 0,5% (++), все в петролатуме. Тест стимуляции лимфоцитов подтвердил аллергию на никель (индекс стимуляции: 6,7). Стоматологическая амальгама, а также металлокерамическая коронка на имплантате были удалены для устранения гальванической коррозии ротовой полости. Системный контактный дерматит полностью разрешился в течение 8 мес после удаления амальгамы ртути. Имеются сообщения о кожных заболеваниях, связанных с амальгамой ртути, таких как нуммулярный дерматит, экзема, крапивница, розовая экзантема, кожный красный плоский лишай, орофациальный гранулематоз. Побочные эффекты, связанные с титановыми имплантатами, включают синдром желтого ногтя, синусит, невропатию, иммунную активацию, связанную с имплантатом, артрит и лейкопению. Выводы Клиницистам следует учитывать аллергию на ионы металлов, высвобождаемые гальванической парой между амальгамой ртути и титановым имплантатом, у пациентов с системным дерматитом».0008
Имеются сообщения о кожных заболеваниях, связанных с амальгамой ртути, таких как нуммулярный дерматит, экзема, крапивница, розовая экзантема, кожный красный плоский лишай, орофациальный гранулематоз. Побочные эффекты, связанные с титановыми имплантатами, включают синдром желтого ногтя, синусит, невропатию, иммунную активацию, связанную с имплантатом, артрит и лейкопению. Выводы Клиницистам следует учитывать аллергию на ионы металлов, высвобождаемые гальванической парой между амальгамой ртути и титановым имплантатом, у пациентов с системным дерматитом».0008
Образец цитирования: Pigatto PDM, Brambilla L, Ferrucci S, Guzzi G. Системный аллергический контактный дерматит из-за гальванической связи между амальгамой ртути и титановым имплантатом. Встреча по кожной аллергии. 2010.
Разнородные металлы во рту как возможная причина необъяснимых симптомов.
Автор: Хайамс Б.Л., Баллон Х.К. Год: 1933 Журнал/Публикация/Источник: Журнал Канадской Медицинской Ассоциации Идентификатор в PubMed: 20319291
Комментарий: Это исследование было процитировано за предположение, что разнородные металлы во рту могут способствовать электрической активности и коррозии, а у некоторых людей это может вызвать необъяснимая боль, изъязвления, воспаление и другие состояния.
Резюме/Выдержка: «Недавние исследования показали, что металлы во рту могут вызывать электрогальванические разряды. Эти разряды происходят между разнородными металлами и, согласно Соломону, Рейнхарду и Гудейлу, в некоторых редких случаях между сплавами одного и того же типа. ТЕОРИЯ: Общеизвестно, что электрическая энергия вырабатывается, когда разнородные металлы погружаются в электролит. Установлено, что металлы располагаются в ряду электродвижущей силы от положительного (наивысший потенциал) к отрицательному следующим образом: (положительный конец) алюминий, цинк, хром, железо, никель, олово, медь, ртуть, серебро, палладий, платина, золото. (отрицательный конец). Электрогальваническая активность параллельна химической активности».
Образец цитирования: Хайамс Б.Л., Баллон Х.К. Разнородные металлы во рту как возможная причина необъяснимых симптомов. Журнал Канадской медицинской ассоциации. 1933; 29(5):488.
Контактный дерматит на металлы.
Автор: Гарнер Л. А. Год: 2004 Журнал/Публикация/Источник: Dermatol Ther. Идентификатор PubMed: 15327477
А. Год: 2004 Журнал/Публикация/Источник: Dermatol Ther. Идентификатор PubMed: 15327477
Резюме/Выдержка: «Реферат: Металлы находятся в тесном контакте с кожей и слизистыми оболочками на повторяющейся, если не постоянной основе. Никель и ртуть, хорошо известные причины контактного дерматита; золото и палладий, недавно получили признание в качестве аллергенов для пластырных тестов на стандартных лотках для скрининга, а кобальт рассматривается в этой статье. Сенсибилизация к никелю, наиболее часто выявляемому аллергену при пластырных тестах, связана с прокалыванием ушей. Контакт с этим потенциальным аллергеном встречается повсеместно. Можно встретить ртуть. как органическая ртуть в тимеросале, используемом в качестве антисептика и консерванта в местных лекарствах и вакцинах, и металлическая ртуть, обнаруженная в зубной амальгаме и термометрах. Обе формы могут вызывать контактный дерматит. В некоторых случаях замешано золото, признанное частым сенсибилизатором век, пятнистый диффузный и оральный лихеноидный дерматит Аллергия на кобальт, часто встречающаяся у пациентов с аллергией на никель, также была связана с прокалыванием ушей. Чувствительность к палладию часто связана с аллергией на никель. Однако частота клинической значимости еще не установлена».
Чувствительность к палладию часто связана с аллергией на никель. Однако частота клинической значимости еще не установлена».
Образец цитирования: Гарнер Л.А. Контактный дерматит на металлы. Дерматол Тер. 2004 г.; 17(4):321-327.
Диагностика и лечение побочных эффектов металлов.
Автор: Стейскал В., Худечек Р., Стейскал Дж., Стерцл И. Год: 2006 Журнал/Публикация/Источник: Neuro Endocrinol Lett.
Идентификатор PubMed: PMID:17261999
Комментарий: Исследователи пришли к выводу: «Стоматологические материалы и имплантаты могут вызывать сенсибилизацию у генетически предрасположенных людей. Частота аллергии на металлы значительно выше у пациентов с аутоиммунными заболеваниями и СХУ, чем у здоровых людей». .Многие отчеты о клинических случаях и клинические исследования показывают, что замена амальгамы или других металлических сплавов у аллергиков может привести к значительному клиническому улучшению.Чтобы избежать побочных эффектов, важно следовать строгому рабочему протоколу, который сводит к минимуму риск воздействия металлов. для пациента».
для пациента».
Резюме/Выдержка: «Факторы окружающей среды признаны причиной увеличения частоты аллергических и аутоиммунных заболеваний. Помимо внешних загрязнителей, ионы металлов, высвобождаемые из зубных реставраций или других имплантатов тела, могут вызывать воспаление у восприимчивых субъектов. У людей , гены, управляющие воспалением, вызванным металлами, и аутоиммунитетом, еще не известны.В клинической практике у пациентов, чувствительных к металлам, проявляются различные симптомы, начиная от изменений слизистой оболочки полости рта и кожных заболеваний до чрезмерной усталости и аутоиммунных заболеваний.Поскольку генетические маркеры генетической предрасположенности у человека неизвестно, следует полагаться на фенототипические маркеры.Такими биомаркерами могут быть определенные ферменты детоксикации, а также присутствие в крови металлоспецифических клеток памяти.С ростом использования металлических имплантатов в медицине и стоматологии важно иметь правильный инструмент для диагностики аллергии на металлы у восприимчивых субъектов После никеля золото в настоящее время является вторым наиболее распространенным сенсибилизатором. Помимо патч-теста, обсуждается анализ крови in vitro, оптимизированный коммерчески доступный тест трансформации лимфоцитов (MELISA). Оба теста использовались для диагностики аллергии на металлы у выбранной группы из 15 пациентов, которые страдали клинической чувствительностью к металлам в дополнение к другим проблемам со здоровьем. Согласованность двух тестов была хорошей, но MELISA выявила больше аллергии на металлы, чем пластырный тест. Удаление несовместимого стоматологического материала (РИД) привело к длительному улучшению состояния здоровья большинства пациентов. Мы предполагаем, что in vivo ионы металлов активируют Т-клетки, инициируя системное воспаление, которое через цитокины влияет на головной мозг и ось гипоталамус-гипофиз-надпочечники. Мы предполагаем, что in vivo ионы металлов будут активировать Т-клетки, запускающие системное воспаление, которые посредством цитокинов воздействуют на головной мозг и ось гипоталамус-гипофиз-надпочечники (ГГН). Лечение и реабилитация пациентов, чувствительных к металлам, основаны на твердом понимании и признании индивидуальной восприимчивости.
Помимо патч-теста, обсуждается анализ крови in vitro, оптимизированный коммерчески доступный тест трансформации лимфоцитов (MELISA). Оба теста использовались для диагностики аллергии на металлы у выбранной группы из 15 пациентов, которые страдали клинической чувствительностью к металлам в дополнение к другим проблемам со здоровьем. Согласованность двух тестов была хорошей, но MELISA выявила больше аллергии на металлы, чем пластырный тест. Удаление несовместимого стоматологического материала (РИД) привело к длительному улучшению состояния здоровья большинства пациентов. Мы предполагаем, что in vivo ионы металлов активируют Т-клетки, инициируя системное воспаление, которое через цитокины влияет на головной мозг и ось гипоталамус-гипофиз-надпочечники. Мы предполагаем, что in vivo ионы металлов будут активировать Т-клетки, запускающие системное воспаление, которые посредством цитокинов воздействуют на головной мозг и ось гипоталамус-гипофиз-надпочечники (ГГН). Лечение и реабилитация пациентов, чувствительных к металлам, основаны на твердом понимании и признании индивидуальной восприимчивости. RID следует проводить с особой осторожностью и в соответствии со стандартным рабочим протоколом. При правильном проведении это лечение может привести к уменьшению системного воспаления и улучшению здоровья у сенсибилизированных пациентов».0008
RID следует проводить с особой осторожностью и в соответствии со стандартным рабочим протоколом. При правильном проведении это лечение может привести к уменьшению системного воспаления и улучшению здоровья у сенсибилизированных пациентов».0008
Образец цитирования: Стейскал В., Худечек Р., Стейскал Дж., Стерцль И. Диагностика и лечение побочных эффектов, вызванных металлами. Нейро Эндокринол Летт. 2006 г.; 27 Приложение 1:7-16. Обзор. Опечатка в: Neuro Endocrinol Lett. 2007 Октябрь; 28(5):iii.
Металлоспецифическая реактивность лимфоцитов снижается после замены металла в зубах.
Автор: Якоб А., Данерсунд А., Стейскал В.Д., Линдвалл А., Худечек Р., Линд У. Год: 2006 г. Журнал/публикация/Источник: Neuro Endocrinol Lett. PubMed ID: PMID:16648791
Комментарий: Авторы этого исследования о пациентах с воспалением, вызванным металлами, отмечают: «Таким образом, пациентам, которые генетически предрасположены к патологии металлов
, настоятельно рекомендуется строго избегать контакта с металлами».
Резюме/Выдержка:
«ЦЕЛИ: Это исследование было проведено для оценки результатов и клинической значимости оптимизированного теста на пролиферацию лимфоцитов, MELISA, для индуцированного металлами воспаления у пациентов с симптомами, подобными СХУ. Лечение пациентов состояло из замена несовместимых стоматологических материалов (RID) вместе с поддерживающей антиоксидантной терапией
ДИЗАЙН ИССЛЕДОВАНИЯ: 513 пациентов были протестированы MELISA в начале исследования. Из этой группы 248 пациентов были доступны для последующего наблюдения MELISA после РИД.
МЕТОДЫ: В MELISA лимфоциты выделяют из крови и культивируют с различными солями металлов в культуральной среде ткани, содержащей 10% инактивированной человеческой AB+ сыворотки или аутологичной сыворотки. Через 5 дней определяют наличие металлореактивных лимфоцитов путем мечения изотопами вновь образованной ДНК в растущих лимфобластах и оценивают путем расчета индекса стимуляции.
РЕЗУЛЬТАТЫ: Никель был наиболее распространенным сенсибилизатором, за ним следуют неорганическая ртуть, тимеросал, свинец, кадмий, палладий и золото.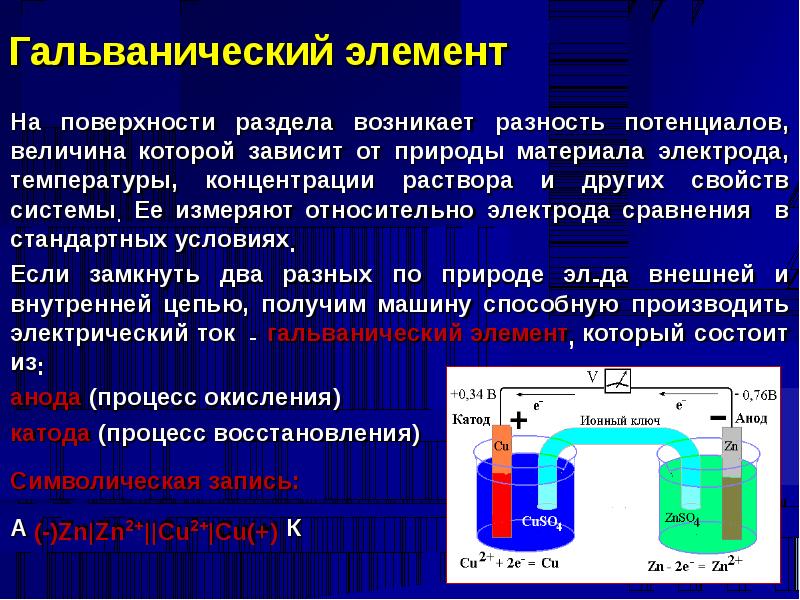 После лечения РИД можно было наблюдать снижение металлоспецифического ответа лимфоцитов у пациентов, которые реагировали на металлы в начале исследования. Культивирование лимфоцитов в аутологичной и гомологичной сыворотке существенно не повлияло на результаты. Одновременно улучшилось и состояние здоровья пациентов.
После лечения РИД можно было наблюдать снижение металлоспецифического ответа лимфоцитов у пациентов, которые реагировали на металлы в начале исследования. Культивирование лимфоцитов в аутологичной и гомологичной сыворотке существенно не повлияло на результаты. Одновременно улучшилось и состояние здоровья пациентов.
ВЫВОДЫ: Замена несовместимых стоматологических материалов привела к снижению индуцированной металлом чувствительности лимфоцитов in vitro, а также к улучшению состояния здоровья большинства пациентов с неспецифическими симптомами СХУ».
Образец цитирования: Yaqob A, Danersund A, Stejskal VD, Lindvall A, Hudecek R, Lindh U. Металлоспецифическая реактивность лимфоцитов снижается после замены металла в зубах. Нейроэндокринол Летт. 2006 г.; 27(1-2):189-97.
Роль металлов в аутоиммунитете и связь с нейроэндокринологией.
Автор: Стейскал Ю., Стейскал В.Д. Год: 1999 Журнал/Публикация/Источник: Neuro Endocrinol Lett. Идентификатор PubMed: 11458198
Комментарий: В этом документе рассматриваются риски для здоровья, потенциально связанные с чувствительностью к металлам и генетическими факторами.
Abstract/Extract: «Abstract: Имеющаяся в настоящее время литература указывает на риск аутоиммунитета, вызванного металлами, у человека. Патология металлов может быть связана с токсическими или аллергическими механизмами, где оба могут играть роль. Основными факторами, решающими для заболеваний, вызванных металлами, являются воздействие и генетика, которые определяют индивидуальную детоксикационную способность и чувствительность к металлам.В этой статье рассматриваются возможные механизмы, которые могут играть роль в аутоиммунитете, вызванном металлами, с акцентом на рассеянный склероз (РС), ревматоидный артрит (РА) и боковой амиотрофический склероз. Мы также обсуждаем роль вызванных воспалением изменений в оси гипоталамус-гипофиз-надпочечники (ГГН) как возможное объяснение утомляемости, депрессии и других психосоматических симптомов, наблюдаемых при этих заболеваниях. Расширение знаний об индивидуальной чувствительности на основе генотипа и изменчивость фенотипа вместе с использованием биомаркеров для диагностики этой индивидуальной восприимчивости, по-видимому, являются ключом к выяснению действующих механизмов. Поскольку сенсибилизация, вызванная металлами, может быть вызвана хроническим воздействием низких доз, традиционный токсикологический подход, сравнивающий концентрации металлов при вскрытии головного мозга, биопсии органов и жидкостях организма у пациентов и контрольной группы, может не дать ответов относительно связи металлов с патологией. Для решения этой проблемы лонгитудинальные исследования чувствительных к металлам пациентов предпочтительнее традиционных исследований случай-контроль».0008
Поскольку сенсибилизация, вызванная металлами, может быть вызвана хроническим воздействием низких доз, традиционный токсикологический подход, сравнивающий концентрации металлов при вскрытии головного мозга, биопсии органов и жидкостях организма у пациентов и контрольной группы, может не дать ответов относительно связи металлов с патологией. Для решения этой проблемы лонгитудинальные исследования чувствительных к металлам пациентов предпочтительнее традиционных исследований случай-контроль».0008
Образец цитирования: Стейскал Ю., Стейскал В.Д. Роль металлов в аутоиммунитете и связь с нейроэндокринологией. Нейроэндокринол Летт. 1999; 20(6):351-366.
19.3: Гальванические (или гальванические) элементы: генерация электричества в результате спонтанных химических реакций
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 84988
Цели обучения
- Понять основы гальванических элементов
- Для подключения напряжения от гальванического элемента к базовой окислительно-восстановительной химии
В любом электрохимическом процессе электроны перетекают от одного химического вещества к другому в результате окислительно-восстановительной (окислительно-восстановительной) реакции. Окислительно-восстановительная реакция происходит при переносе электронов от вещества, которое окисляется, к тому, которое восстанавливается. восстановитель – это вещество, которое теряет электроны и при этом окисляется; окислитель — это вещество, которое приобретает электроны и восстанавливается в процессе. Связанная потенциальная энергия определяется разностью потенциалов между валентными электронами в атомах разных элементов.
Окислительно-восстановительная реакция происходит при переносе электронов от вещества, которое окисляется, к тому, которое восстанавливается. восстановитель – это вещество, которое теряет электроны и при этом окисляется; окислитель — это вещество, которое приобретает электроны и восстанавливается в процессе. Связанная потенциальная энергия определяется разностью потенциалов между валентными электронами в атомах разных элементов.
Поскольку восстановление невозможно без окисления и наоборот, окислительно-восстановительную реакцию можно описать как две полуреакции , одна представляет собой процесс окисления, а другая — процесс восстановления. Для реакции цинка с бромом общая химическая реакция выглядит следующим образом: 9{−} }\nonumber \]
Каждая полуреакция записывается, чтобы показать, что на самом деле происходит в системе; \(\ce{Zn}\) является восстановителем в этой реакции (он теряет электроны), а \(\ce{Br2}\) является окислителем (он приобретает электроны). Сложение двух полуреакций дает общую химическую реакцию (уравнение \(\PageIndex{1}\)). Окислительно-восстановительная реакция уравновешивается, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Как и любое сбалансированное химическое уравнение, общий процесс электрически нейтрален; то есть чистый заряд одинаков в обеих частях уравнения.
Сложение двух полуреакций дает общую химическую реакцию (уравнение \(\PageIndex{1}\)). Окислительно-восстановительная реакция уравновешивается, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Как и любое сбалансированное химическое уравнение, общий процесс электрически нейтрален; то есть чистый заряд одинаков в обеих частях уравнения.
В любой окислительно-восстановительной реакции количество электронов, потерянных в результате реакции (реакций) окисления, равно количеству электронов, полученных в результате реакции (реакций) восстановления.
В большинстве наших обсуждений химических реакций мы предполагали, что реагенты находятся в тесном физическом контакте друг с другом. Кислотно-основные реакции, например, обычно проводят с кислотой и основанием, диспергированными в одной фазе, такой как жидкий раствор. Однако с окислительно-восстановительными реакциями можно физически разделить полуреакции окисления и восстановления в пространстве, если существует полная цепь, включая внешнее электрическое соединение, например провод, между двумя полуреакциями. По мере развития реакции электроны перетекают от восстановителя к окислителю через это электрическое соединение, создавая электрический ток, который можно использовать для совершения работы. Аппарат, который используется для выработки электричества в результате спонтанной окислительно-восстановительной реакции или, наоборот, который использует электричество для запуска несамопроизвольной окислительно-восстановительной реакции, называется электрохимическая ячейка .
По мере развития реакции электроны перетекают от восстановителя к окислителю через это электрическое соединение, создавая электрический ток, который можно использовать для совершения работы. Аппарат, который используется для выработки электричества в результате спонтанной окислительно-восстановительной реакции или, наоборот, который использует электричество для запуска несамопроизвольной окислительно-восстановительной реакции, называется электрохимическая ячейка .
Существует два типа электрохимических элементов: гальванические элементы и электролитические элементы. Гальванические клетки названы в честь итальянского физика и врача Луиджи Гальвани (1737–1798), который заметил, что рассеченные мышцы лягушачьей лапки подергиваются при приложении небольшого электрического удара, демонстрируя электрическую природу нервных импульсов. Гальванический (гальванический) элемент использует энергию, высвобождаемую во время спонтанной окислительно-восстановительной реакции (\(ΔG < 0\)) для выработки электроэнергии. Этот тип электрохимического элемента часто называют гальваническим элементом в честь его изобретателя, итальянского физика Алессандро Вольта (1745–1827). Напротив, 9Электролитическая ячейка 0034 потребляет электрическую энергию от внешнего источника, используя ее для возникновения несамопроизвольной окислительно-восстановительной реакции (\(ΔG > 0\)). Оба типа содержат два электрода из твердых металлов, подключенных к внешней цепи, обеспечивающей электрическое соединение между двумя частями системы (рис. \(\PageIndex{1}\)). Половина реакции окисления протекает на одном электроде (анод ), а полуреакция восстановления — на другом ().0034 катод ). Когда цепь замкнута, электроны текут от анода к катоду. Электроды также соединены электролитом, ионным веществом или раствором, который позволяет ионам перемещаться между отсеками электродов, тем самым поддерживая электрическую нейтральность системы. В этом разделе мы сосредоточимся на реакциях, происходящих в гальванических элементах.
Этот тип электрохимического элемента часто называют гальваническим элементом в честь его изобретателя, итальянского физика Алессандро Вольта (1745–1827). Напротив, 9Электролитическая ячейка 0034 потребляет электрическую энергию от внешнего источника, используя ее для возникновения несамопроизвольной окислительно-восстановительной реакции (\(ΔG > 0\)). Оба типа содержат два электрода из твердых металлов, подключенных к внешней цепи, обеспечивающей электрическое соединение между двумя частями системы (рис. \(\PageIndex{1}\)). Половина реакции окисления протекает на одном электроде (анод ), а полуреакция восстановления — на другом ().0034 катод ). Когда цепь замкнута, электроны текут от анода к катоду. Электроды также соединены электролитом, ионным веществом или раствором, который позволяет ионам перемещаться между отсеками электродов, тем самым поддерживая электрическую нейтральность системы. В этом разделе мы сосредоточимся на реакциях, происходящих в гальванических элементах.
 В обоих типах электрохимических элементов анодом является электрод, на котором происходит полуреакция окисления, а катодом является электрод, на котором происходит полуреакция восстановления. 9{2+} (водн.) + Cu(s)} \label{20.3.4} \]
В обоих типах электрохимических элементов анодом является электрод, на котором происходит полуреакция окисления, а катодом является электрод, на котором происходит полуреакция восстановления. 9{2+} (водн.) + Cu(s)} \label{20.3.4} \] Мы можем вызвать эту реакцию, вставив цинковый стержень в водный раствор сульфата меди(II). По мере протекания реакции цинковый стержень растворяется и образуется масса металлической меди. Эти изменения происходят спонтанно, но вся высвобождаемая энергия находится в форме тепла, а не в форме, которую можно использовать для совершения работы.
Рисунок \(\PageIndex{2}\): Реакция металлического цинка с водными ионами меди(II) в одном отсеке. Когда цинковый стержень вставляют в химический стакан, содержащий водный раствор сульфата меди (II), происходит спонтанная окислительно-восстановительная реакция: цинковый электрод растворяется с образованием \(\ce{Zn^{2+}(aq)}\) ионы, а ионы \(\ce{Cu^{2+}(aq)}\) одновременно восстанавливаются до металлической меди. Реакция происходит так быстро, что медь осаждается в виде очень мелких частиц, которые кажутся черными, а не обычным красноватым цветом меди. (youtu.be/2gPRK0HmYu4) 9{2+}}\) ионов в растворе уменьшается (рис. \(\PageIndex{3b}\)). Таким образом, мы провели ту же реакцию, что и в одном стакане, но на этот раз окислительная и восстановительная полуреакции физически отделены друг от друга. Электроны, которые высвобождаются на аноде, проходят через провод, производя электрический ток. Таким образом, гальванические элементы преобразуют химическую энергию в электрическую, которую затем можно использовать для выполнения работы. Рисунок \(\PageIndex{3}\): Реакция металлического цинка с водными ионами меди(II) в гальваническом элементе. (а) Гальванический элемент можно сконструировать, вставив медную полоску в химический стакан, содержащий 1 М водный раствор Cu 2 + ионов и полоску цинка в другой химический стакан, содержащий водный 1 М раствор ионов Zn 2 + ионов.
Реакция происходит так быстро, что медь осаждается в виде очень мелких частиц, которые кажутся черными, а не обычным красноватым цветом меди. (youtu.be/2gPRK0HmYu4) 9{2+}}\) ионов в растворе уменьшается (рис. \(\PageIndex{3b}\)). Таким образом, мы провели ту же реакцию, что и в одном стакане, но на этот раз окислительная и восстановительная полуреакции физически отделены друг от друга. Электроны, которые высвобождаются на аноде, проходят через провод, производя электрический ток. Таким образом, гальванические элементы преобразуют химическую энергию в электрическую, которую затем можно использовать для выполнения работы. Рисунок \(\PageIndex{3}\): Реакция металлического цинка с водными ионами меди(II) в гальваническом элементе. (а) Гальванический элемент можно сконструировать, вставив медную полоску в химический стакан, содержащий 1 М водный раствор Cu 2 + ионов и полоску цинка в другой химический стакан, содержащий водный 1 М раствор ионов Zn 2 + ионов. Две металлические полоски соединены проводом, по которому течет электричество, а стаканы соединены соляным мостом. Когда переключатель замкнут, чтобы замкнуть цепь, цинковый электрод (анод) самопроизвольно окисляется до ионов Zn 2 + в левом отсеке, в то время как ионы Cu 2 + одновременно восстанавливаются до металлической меди при медный электрод (катод). (b) По мере развития реакции цинковый анод теряет массу по мере растворения с образованием Zn 9.0068 2 + (водн.), в то время как катод Cu набирает массу по мере того, как ионы Cu 2 + (водн.) восстанавливаются до металлической меди, которая осаждается на катоде. (CC BY-SA-NC; анонимно)
Две металлические полоски соединены проводом, по которому течет электричество, а стаканы соединены соляным мостом. Когда переключатель замкнут, чтобы замкнуть цепь, цинковый электрод (анод) самопроизвольно окисляется до ионов Zn 2 + в левом отсеке, в то время как ионы Cu 2 + одновременно восстанавливаются до металлической меди при медный электрод (катод). (b) По мере развития реакции цинковый анод теряет массу по мере растворения с образованием Zn 9.0068 2 + (водн.), в то время как катод Cu набирает массу по мере того, как ионы Cu 2 + (водн.) восстанавливаются до металлической меди, которая осаждается на катоде. (CC BY-SA-NC; анонимно) Электролит в солевом мостике служит двум целям: он замыкает цепь, перенося электрический заряд, и поддерживает электрическую нейтральность в обоих растворах, позволяя ионам мигрировать между ними. Идентичность соли в солевом мостике не имеет значения, пока ионы компонентов не реагируют или не подвергаются окислительно-восстановительной реакции в условиях работы ячейки. {2+}}\ ) решение. В отсутствие солевого мостика или какого-либо другого подобного соединения реакция быстро прекращалась бы, поскольку нельзя было поддерживать электрическую нейтральность.
{2+}}\ ) решение. В отсутствие солевого мостика или какого-либо другого подобного соединения реакция быстро прекращалась бы, поскольку нельзя было поддерживать электрическую нейтральность.
Вольтметр можно использовать для измерения разницы электрических потенциалов между двумя отсеками. Размыкание переключателя, соединяющего провода с анодом и катодом, предотвращает протекание тока, поэтому химической реакции не происходит. Однако при замкнутом переключателе внешняя цепь замыкается, и электрический ток может течь от анода к катоду. Потенциал (\(E_{cell}\)) клетки, измеренный в вольтах, представляет собой разность электрических потенциалов между двумя полуреакциями и связан с энергией, необходимой для перемещения заряженной частицы в электрическом поле. . В описанной нами ячейке вольтметр показывает потенциал 1,10 В (рис. \(\PageIndex{3a}\)). Поскольку электроны из полуреакции окисления высвобождаются на аноде, анод в гальваническом элементе заряжен отрицательно. Катод, к которому притягиваются электроны, заряжен положительно.
Катод, к которому притягиваются электроны, заряжен положительно.
Не все электроды подвергаются химическому превращению в ходе окислительно-восстановительной реакции. Электрод может быть изготовлен из инертного металла с высокой проводимостью, такого как платина, чтобы предотвратить его реакцию во время окислительно-восстановительного процесса, когда он не участвует в общей электрохимической реакции. Это явление показано в примере \(\PageIndex{1}\).
Гальванический (гальванический) элемент преобразует энергию, выделившуюся в результате спонтанной химической реакции, в электрическую энергию. Электролитическая ячейка потребляет электрическую энергию от внешнего источника, чтобы управлять самопроизвольная химическая реакция.
Пример \(\PageIndex{1}\)
Химик сконструировал гальванический элемент, состоящий из двух стаканов. Один стакан содержит полоску олова, погруженную в водный раствор серной кислоты, а другой содержит платиновый электрод, погруженный в водный раствор азотной кислоты. Два раствора соединены солевым мостиком, а электроды соединены проводом. Начинает течь ток, и на платиновом электроде появляются пузырьки газа. Происходящая спонтанная окислительно-восстановительная реакция описывается следующим сбалансированным химическим уравнением: 9{2+} (водн.) + 2NO (г) + 4h3O (ж)} \номер \]
Два раствора соединены солевым мостиком, а электроды соединены проводом. Начинает течь ток, и на платиновом электроде появляются пузырьки газа. Происходящая спонтанная окислительно-восстановительная реакция описывается следующим сбалансированным химическим уравнением: 9{2+} (водн.) + 2NO (г) + 4h3O (ж)} \номер \]
Для этого гальванического элемента
- напишите полуреакцию, которая происходит на каждом электроде.
- указывают, какой электрод является катодом, а какой анодом.
- указывают, какой электрод является положительным электродом, а какой отрицательным.
Дано: гальванический элемент и окислительно-восстановительная реакция
Запрошено: полуреакции, идентичность анода и катода и назначение электродов как положительных или отрицательных
Стратегия:
- Определите полуреакцию окисления и полуреакцию восстановления. Затем определите анод и катод по полуреакции, которая происходит на каждом электроде.

- По направлению потока электронов назначьте каждый электрод как положительный или отрицательный.
Раствор
A В полуреакции восстановления нитрат восстанавливается до оксида азота. (Затем оксид азота будет реагировать с кислородом воздуха с образованием NO 9{−}} \nonumber \]
Таким образом, нитрат восстанавливается до NO, а оловянный электрод окисляется до Sn 2 + .
Поскольку реакция восстановления происходит на платиновом электроде, он является катодом. И наоборот, реакция окисления происходит на оловянном электроде, поэтому он является анодом.
B Электроны перетекают от оловянного электрода через проволоку к платиновому электроду, где они переходят в нитраты. Электрическая цепь замыкается солевым мостиком, который обеспечивает диффузию катионов к катоду и анионов к аноду. Поскольку электроны текут от оловянного электрода, он должен быть электрически отрицательным. Напротив, электроны текут к платиновому электроду, так что электрод должен быть электрически положительным. 9{−}} \end{align*} \nonumber \]
Напротив, электроны текут к платиновому электроду, так что электрод должен быть электрически положительным. 9{−}} \end{align*} \nonumber \]
Катодом является платиновый электрод в растворе перманганата; тот, что в растворе олова, является анодом.
Катод (электрод в стакане с раствором перманганата) положительный, а анод (электрод в стакане с раствором олова) отрицательный.
Электрохимические элементы: Электрохимические элементы (открывается в новом окне) [youtu.be]
Построение диаграмм ячеек (обозначение ячеек)
Поскольку описывать любой данный гальванический элемент словами несколько затруднительно, было разработано более удобное обозначение . В этом линейном обозначении, называемом диаграммой ячейки, идентичность электродов и химическое содержимое отсеков обозначены их химическими формулами, причем анод написан в крайнем левом углу, а катод — в крайнем правом. Границы фаз показаны одиночными вертикальными линиями, а солевой мостик, имеющий две границы фаз, двойной вертикальной линией. Таким образом, диаграмма ячейки для ячейки \(\ce{Zn/Cu}\), показанная на рисунке \(\PageIndex{3a}\), записывается следующим образом:
Границы фаз показаны одиночными вертикальными линиями, а солевой мостик, имеющий две границы фаз, двойной вертикальной линией. Таким образом, диаграмма ячейки для ячейки \(\ce{Zn/Cu}\), показанная на рисунке \(\PageIndex{3a}\), записывается следующим образом:
Гальванические элементы могут иметь расположение, отличное от примеров, которые мы видели до сих пор. Например, напряжение, возникающее в результате окислительно-восстановительной реакции, можно более точно измерить, используя два электрода, погруженных в один химический стакан, содержащий электролит, замыкающий цепь. Такое расположение уменьшает ошибки, вызванные сопротивлением потоку заряда на границе, называемой потенциал соединения . Один пример этого типа гальванического элемента выглядит следующим образом:
Такое расположение уменьшает ошибки, вызванные сопротивлением потоку заряда на границе, называемой потенциал соединения . Один пример этого типа гальванического элемента выглядит следующим образом:
\[\ce{Pt(s)\, | \, h3(g) | HCl(aq, \, 1\,M)\,|\, AgCl(s) \,Ag(s)} \nonumber \]
Эта диаграмма ячеек не включает двойную вертикальную линию, представляющую солевой мостик, поскольку нет солевого мостика, обеспечивающего соединение между двумя разнородными растворами. Кроме того, концентрации растворов не указаны, поэтому они не включены в диаграмму ячеек. Полуреакции и общая реакция для этой клетки следующие: 9{+}(aq)} \nonumber \]
Гальванический элемент с одним отсеком первоначально будет иметь то же напряжение, что и гальванический элемент, построенный с использованием отдельных отсеков, но он будет быстро разряжаться из-за прямой реакции реагента на аноде. с окисленным членом катодной окислительно-восстановительной пары. Следовательно, элементы этого типа не особенно полезны для производства электроэнергии. {-}}\)) не участвует в общей реакции , так что особо указывать не надо. Катодное отделение содержит водный раствор азотной кислоты, которая не участвует в общей реакции, вместе с продуктом реакции (\(\ce{NO}\)) и \(\ce{Pt}\) электродом. Они записываются как \(\ce{HNO3(aq)∣NO(g)∣Pt(s)}\) с одиночными вертикальными чертами, обозначающими фазовые границы. Объединив два отсека и используя двойную вертикальную черту для обозначения соляного моста, 9+(aq, \;1\, M)\,|\,Ag(s)} \nonumber \]
{-}}\)) не участвует в общей реакции , так что особо указывать не надо. Катодное отделение содержит водный раствор азотной кислоты, которая не участвует в общей реакции, вместе с продуктом реакции (\(\ce{NO}\)) и \(\ce{Pt}\) электродом. Они записываются как \(\ce{HNO3(aq)∣NO(g)∣Pt(s)}\) с одиночными вертикальными чертами, обозначающими фазовые границы. Объединив два отсека и используя двойную вертикальную черту для обозначения соляного моста, 9+(aq, \;1\, M)\,|\,Ag(s)} \nonumber \]
Схемы ячеек: Схемы ячеек(opens in new window) [youtu.be]
Резюме
Гальванический (гальванический) элемент использует энергию, высвобождаемую во время спонтанной окислительно-восстановительной реакции, для выработки электричества, тогда как электролитический элемент потребляет электричество энергию из внешнего источника, чтобы вызвать реакцию. Электрохимия – это наука о взаимосвязи между электричеством и химическими реакциями.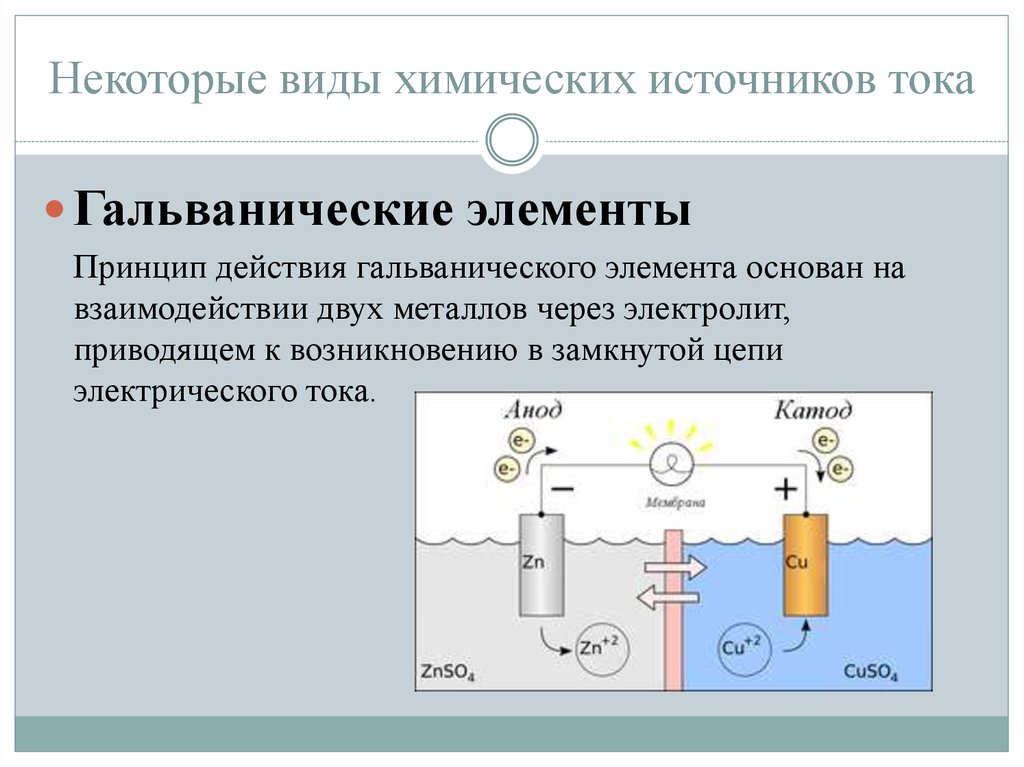 Реакция окисления-восстановления, происходящая во время электрохимического процесса, состоит из двух полуреакций, одна из которых представляет собой процесс окисления, а другая — процесс восстановления. Сумма полуреакций дает общую химическую реакцию. Общая окислительно-восстановительная реакция уравновешена, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Электрический ток создается потоком электронов от восстановителя к окислителю. Электрохимическая ячейка может либо генерировать электричество в результате спонтанной окислительно-восстановительной реакции, либо потреблять электричество для запуска несамопроизвольной реакции. В гальваническом (гальваническом) элементе энергия спонтанной реакции генерирует электричество, тогда как в электролитической ячейке электрическая энергия потребляется для запуска неспонтанной окислительно-восстановительной реакции. Оба типа ячеек используют два электрода, которые обеспечивают электрическую связь между системами, разделенными в пространстве.
Реакция окисления-восстановления, происходящая во время электрохимического процесса, состоит из двух полуреакций, одна из которых представляет собой процесс окисления, а другая — процесс восстановления. Сумма полуреакций дает общую химическую реакцию. Общая окислительно-восстановительная реакция уравновешена, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Электрический ток создается потоком электронов от восстановителя к окислителю. Электрохимическая ячейка может либо генерировать электричество в результате спонтанной окислительно-восстановительной реакции, либо потреблять электричество для запуска несамопроизвольной реакции. В гальваническом (гальваническом) элементе энергия спонтанной реакции генерирует электричество, тогда как в электролитической ячейке электрическая энергия потребляется для запуска неспонтанной окислительно-восстановительной реакции. Оба типа ячеек используют два электрода, которые обеспечивают электрическую связь между системами, разделенными в пространстве.


 Организационный момент.
Организационный момент.
 Актуализация опорных знаний учащихся.
Актуализация опорных знаний учащихся.

 тока .
тока .

 Первичное закрепление. Тест.
Первичное закрепление. Тест.
 Рефлексия.
Рефлексия.



 Вследствие этого на проводнике, погруженном в электролит (слюну),
возникает электрический заряд, а между разнородными проводниками
— разность электрохимических потенциалов, т.е. образуется
гальванический элемент. Возникающие при этом в полости рта
токи электронов и ионов приводят к серьезным заболеваниям,
которые нередко обозначаются универсальным термином «непереносимость
металлических включений в полости рта» вследствие эффекта
гальванизма.
Вследствие этого на проводнике, погруженном в электролит (слюну),
возникает электрический заряд, а между разнородными проводниками
— разность электрохимических потенциалов, т.е. образуется
гальванический элемент. Возникающие при этом в полости рта
токи электронов и ионов приводят к серьезным заболеваниям,
которые нередко обозначаются универсальным термином «непереносимость
металлических включений в полости рта» вследствие эффекта
гальванизма.



 Метод позволяет определить не только ЭДС паразитного гальванического
элемента в полости рта, но и внутреннее сопротивление участков
тканей, подверженных гальваническому воздействию в каждом
конкретном случае, то есть непосредственно в процессе проведения
протезирования. На основании получаемых при измерении данных
может делаться обоснованный вывод о наличии и степени опасности
возникновения гальванизма.
Метод позволяет определить не только ЭДС паразитного гальванического
элемента в полости рта, но и внутреннее сопротивление участков
тканей, подверженных гальваническому воздействию в каждом
конкретном случае, то есть непосредственно в процессе проведения
протезирования. На основании получаемых при измерении данных
может делаться обоснованный вывод о наличии и степени опасности
возникновения гальванизма.
