Как правильно нарисовать структуру Льюиса для иона ICl4-. Каковы основные этапы построения структуры Льюиса ICl4-. Какой атом является центральным в ионе ICl4-. Сколько валентных электронов у атомов йода и хлора в ICl4-. Как распределяются связи и неподеленные электронные пары в ICl4-.
Что такое структура Льюиса ICl4- и как ее построить
Структура Льюиса ICl4- представляет собой схематическое изображение расположения атомов и распределения электронов в ионе тетрахлоридойодата. Она позволяет наглядно показать химические связи и неподеленные электронные пары.
Основные особенности структуры Льюиса ICl4-:
- Центральным атомом является йод (I)
- Йод окружен 4 атомами хлора (Cl)
- Между I и Cl образуются одинарные ковалентные связи
- На йоде остаются 2 неподеленные электронные пары
- На каждом атоме хлора по 3 неподеленные пары
- Общий заряд иона -1
Чтобы правильно построить структуру Льюиса ICl4-, нужно пройти несколько ключевых этапов. Давайте рассмотрим их подробнее.

Определение общего числа валентных электронов в ICl4-
Первый шаг в построении структуры Льюиса — подсчет общего количества валентных электронов. Для этого нужно знать электронную конфигурацию атомов йода и хлора.
Валентные электроны атома йода (I):
- Йод находится в 17 группе периодической системы
- Валентных электронов у I — 7
Валентные электроны атома хлора (Cl):
- Хлор также в 17 группе
- Валентных электронов у Cl — 7
Общее число валентных электронов в ICl4-:
- 7 (от I) + 7 * 4 (от четырех Cl) + 1 (отрицательный заряд иона) = 36
Итого в ионе ICl4- имеется 36 валентных электронов, которые нужно распределить в структуре Льюиса.
Выбор центрального атома в ICl4-
На втором этапе определяем, какой атом будет центральным в структуре ICl4-. Для этого учитываем следующие правила:
- Центральным обычно является менее электроотрицательный атом
- Атомы водорода и галогенов (кроме йода) не бывают центральными
Сравним электроотрицательность йода и хлора:
- Электроотрицательность I — 2.66
- Электроотрицательность Cl — 3.16
Йод менее электроотрицателен, поэтому он и будет центральным атомом в структуре ICl4-. Атомы хлора расположатся вокруг него.

Соединение атомов одинарными связями в ICl4-
На следующем этапе соединяем центральный атом йода с окружающими его атомами хлора одинарными ковалентными связями. Каждая такая связь образуется за счет обобществления пары электронов.
В результате получаем:
- 4 одинарные связи I-Cl
- На образование связей расходуется 8 электронов
Это базовый скелет молекулы ICl4-, который в дальнейшем нужно дополнить оставшимися валентными электронами.
Распределение оставшихся электронов в структуре ICl4-
Теперь нужно распределить оставшиеся валентные электроны, чтобы завершить структуру Льюиса ICl4-. На предыдущих этапах мы использовали 8 электронов из 36 имеющихся.
Оставшиеся 28 электронов распределяются следующим образом:
- По 6 электронов (3 неподеленные пары) на каждый атом хлора
- 4 электрона (2 неподеленные пары) на атом йода
В итоге получаем завершенную структуру Льюиса, где все атомы имеют завершенные электронные оболочки:
- У хлора — 8 электронов (октет)
- У йода — 8 электронов (октет)
Проверка формальных зарядов атомов в ICl4-
Последний этап — проверка формальных зарядов атомов. Это позволяет убедиться в стабильности полученной структуры Льюиса.

Формальный заряд рассчитывается по формуле:
Формальный заряд = Валентные электроны — (Связывающие электроны/2) — Несвязывающие электроны
Рассчитаем для атомов в ICl4-:
Для йода (I):
- Валентные электроны: 7
- Связывающие электроны: 8
- Несвязывающие электроны: 4
- Формальный заряд I = 7 — 8/2 — 4 = -1
Для хлора (Cl):
- Валентные электроны: 7
- Связывающие электроны: 2
- Несвязывающие электроны: 6
- Формальный заряд Cl = 7 — 2/2 — 6 = 0
Полученные формальные заряды (-1 на йоде, 0 на хлоре) подтверждают стабильность структуры и соответствуют общему заряду иона -1.
Итоговая структура Льюиса ICl4-
Теперь мы можем изобразить окончательную структуру Льюиса для иона ICl4-:
- Центральный атом йода
- 4 атома хлора вокруг него
- 4 одинарные связи I-Cl
- 2 неподеленные пары на йоде
- По 3 неподеленные пары на каждом хлоре
- Общий заряд -1
Эта структура наглядно показывает распределение электронов и химические связи в ионе тетрахлоридойодата ICl4-.
Ключевые моменты в построении структуры Льюиса ICl4-
Подведем итоги основных этапов и принципов построения структуры Льюиса ICl4-:
- Подсчет общего числа валентных электронов (36)
- Выбор йода в качестве центрального атома
- Соединение атомов одинарными связями
- Распределение оставшихся электронов в виде неподеленных пар
- Проверка формальных зарядов атомов
Соблюдение этих правил позволяет правильно изобразить электронное строение сложных молекул и ионов.
Применение структуры Льюиса ICl4- в химии
Структура Льюиса ICl4- имеет важное значение в химии по нескольким причинам:
- Позволяет наглядно представить строение сложного иона
- Показывает распределение электронной плотности
- Помогает предсказать геометрию молекулы (тетраэдр)
- Объясняет химические свойства и реакционную способность
- Используется при изучении механизмов реакций
Понимание структуры Льюиса ICl4- важно для изучения неорганической и координационной химии галогенидов.
Часто задаваемые вопросы о структуре ICl4-
Вот ответы на некоторые распространенные вопросы о структуре Льюиса иона ICl4-:
Почему йод является центральным атомом в ICl4-?
Йод менее электроотрицателен, чем хлор, поэтому он становится центральным атомом.
Сколько неподеленных электронных пар у атома йода?
У йода в ICl4- остается 2 неподеленные электронные пары.
Какова геометрия молекулы ICl4-?
ICl4- имеет тетраэдрическую геометрию из-за четырех связей вокруг центрального атома.
Почему общий заряд иона равен -1?
Отрицательный заряд возникает из-за избытка одного электрона по сравнению с нейтральной молекулой.
Правильное понимание структуры Льюиса ICl4- помогает разобраться в свойствах и реакционной способности этого интересного неорганического иона.
Отзывы покупателей Invotone ICL4 на Layta.ru
Отзывы покупателей Invotone ICL4 на Layta.ruТовара нет в наличии. Предлагаем вам похожие товары
- Тромбон-СОРС-ВС кнопка со стропой 7 877 ₽ В наличии
- Тромбон-СОРС-ВС кнопка 5 500 ₽ В наличии
- МЕТА18555 Абонентское устройство (пластиковый корпус) 2 484 ₽ В наличии
- Sonar RCW-004 (ВЭД) 41 524 ₽ В наличии
- Sonar RLR-22023 6 800 ₽ В наличии
- Sonar SAB-1112A-UP 4 727 ₽ В наличии
- Текон-Автоматика Пульт АСУД-248 ПК (4) 125 580 ₽ В наличии
- ROXTON RP-8264 148 320 ₽ В наличии
- Sonar RPD-265 1 624 ₽ В наличии
- Текон-Автоматика Переговорное устройство в антивандальном исполнении (схема 14) 3 729 ₽ В наличии
- ТРОМБОН-ВП(н) (Уценка) 100 ₽ В наличии
- ТРОМБОН-ВП(н) 6 290 ₽ В наличии
- Roxton IP-A6716 40 950 ₽ В наличии
- Накладная монтажная коробка ROXTON IP-A6719 3 625 ₽ В наличии
- МЕТА ТОР-15 11 936 ₽ В наличии
- ТРОМБОН — БС-16 КК 20 726 ₽ В наличии
- Текон-Автоматика КУН-IP8 27 186 ₽ В наличии
-
Текон-Автоматика КУН-2Д.
 1
16 008 ₽
В наличии
1
16 008 ₽
В наличии
- Текон-Автоматика КУН-2Д.1П 17 112 ₽ В наличии
- Текон-Автоматика Концентратор измерителей расхода (КИР-16) 7 590 ₽ В наличии
Артикул: М0000105819
Артикул: М0000105819
Подробное описание: INVOTONE ICL4 — четырехканальный компрессор/лимитер. Устройство выполненно в однорэковом корпусе,… подробнее
Товар временно отсутствует в продаже
в закладки сравнить
Получите информацию о поступлении товара
Оставьте свои контактные данные. Как только товар будет доступен для заказа, вам придет уведомление на электронную почту.
Отзывов пока нет, вы можете стать первымНаписать отзыв
Оставьте свой отзыв о Компрессор/лимитер 4-х канальный Invotone ICL4
Авторизуйтесь, чтобы оставить отзыв о товаре Компрессор/лимитер 4-х канальный Invotone ICL4
Вход для покупателей
Адрес электронной почты:Пароль:
Забыли свой пароль?
Вход через соцсети
Символом «звездочка» (*) отмечены обязательные для заполнения поля.
Регистрация
Быстро, удобно, легко!
- Используйте введенные ранее данные
- Отслеживайте статус заказа
- Получайте персонализированные предложения
- Накапливайте и тратьте бонусные рубли
- Сохраняйте историю заказов
Зарегистрироваться
Ознакомиться с отзывами покупателей Компрессор/лимитер 4-х канальный Invotone ICL4 на Layta.ru
Качественно
Гарантия качества систем безопасности
Комплексно
Собственный логистический комплекс
Выгодно
Накапливайте и расплачивайтесь бонусами
Удобно
Тысячи товаров по лучшим ценам
Профессионально
Профессиональная техническая поддержка
Другие производители категории Аксессуары СОУЭ
- Roxton
- Inter-M
- Jedia
- Came
- DSPPA
- AMC
- ROXTONE
- JDM
- Mobotix
- Esser
- Hostcall
- ATEN
- Getcall
- QTECH
Обратная связь
Сравнение Избранное Корзина
Компрессоры Invotone ICL4 в Костроме: 500-товаров: бесплатная доставка [перейти]
Партнерская программаПомощь
Кострома
Каталог
Каталог Товаров
Одежда и обувь
Одежда и обувь
Стройматериалы
Стройматериалы
Текстиль и кожа
Текстиль и кожа
Здоровье и красота
Здоровье и красота
Детские товары
Детские товары
Продукты и напитки
Продукты и напитки
Электротехника
Электротехника
Мебель и интерьер
Мебель и интерьер
Дом и сад
Дом и сад
Сельское хозяйство
Сельское хозяйство
Торговля и склад
Торговля и склад
Все категории
ВходИзбранное
Компрессоры Invotone ICL4
11 279
Invotone ICL2PRO Тип: компрессор/лимитер, Производитель: Invotone
ПОДРОБНЕЕЕще цены и похожие товары
INVOTONE ICL4 4-канальный компрессор/лимитер
ПОДРОБНЕЕЕще цены и похожие товары
10 710
INVOTONE ICL2PRO Тип: компрессор/лимитер, Производитель: Invotone
ПОДРОБНЕЕЕще цены и похожие товары
Компрессор/лимитер Invotone ICL4 Тип: лимитер, Производитель: Invotone
ПОДРОБНЕЕЕще цены и похожие товары
11 279
Компрессор , лимитер , гейт INVOTONE ICL2PRO Тип: компрессор/лимитер, Производитель: Invotone
ПОДРОБНЕЕЕще цены и похожие товары
10 151
Invotone ICL2PRO — 2-х канальный компрессор/лимитер/зкспандер/гейт Тип: компрессор/лимитер,
ПОДРОБНЕЕЕще цены и похожие товары
INVOTONE ICL4 Тип: компрессор/лимитер, Производитель: Invotone
ПОДРОБНЕЕЕще цены и похожие товары
11 280
INVOTONE ICL2PRO — двухканальный компрессор/лимитер/зкспандер/гейт. Тип: лимитер, Производитель:
Тип: лимитер, Производитель:
ПОДРОБНЕЕЕще цены и похожие товары
INVOTONE ICL4 Производитель: Invotone, Количество каналов усиления: 4
ПОДРОБНЕЕЕще цены и похожие товары
17 740
Компрессор Fubag Air Master Kit +комплект 6 предметов 45681983 Максимальное рабочее давление: 8,
В МАГАЗИНЕще цены и похожие товары
36 510
Компрессор Fubag Auto Master Kit + комплект 11 предметов 45681953 Максимальное рабочее давление: 8,
В МАГАЗИНЕще цены и похожие товары
17 580
Компрессор Fubag DC 320/24 СМ2.5 29838182 Максимальное рабочее давление: 8, Мощность: 1.8,
В МАГАЗИНЕще цены и похожие товары
53 370
Компрессор ременной FUBAG VCF/50 СM3
ПОДРОБНЕЕЕще цены и похожие товары
48 410
Компрессор ременной FUBAG B4000B/100 СМ3
ПОДРОБНЕЕЕще цены и похожие товары
39 230
Компрессор ременной FUBAG B3600B/50 CM3
ПОДРОБНЕЕЕще цены и похожие товары
78 770
Компрессор ременной FUBAG B5200B/200 СТ4
ПОДРОБНЕЕЕще цены и похожие товары
83 720
Компрессор ременной FUBAG B6800B/100 СТ5
ПОДРОБНЕЕЕще цены и похожие товары
120 070
Компрессор ременной FUBAG B10000B/270 CT11
ПОДРОБНЕЕЕще цены и похожие товары
110 090
Компрессор ременной FUBAG B6800B/270 CT7,5
ПОДРОБНЕЕЕще цены и похожие товары
59 120
Компрессор ременной FUBAG В4800В/100 СТ4
ПОДРОБНЕЕЕще цены и похожие товары
58 400
Компрессор ременной FUBAG VCF/100 СM3
ПОДРОБНЕЕЕще цены и похожие товары
156 660
Компрессор FUBAG DCF 1300/270 CT11 двухступенчатый
ПОДРОБНЕЕЕще цены и похожие товары
122 790
Компрессор FUBAG DCF 900/270 CT7,5
ПОДРОБНЕЕЕще цены и похожие товары
189 090
Компрессор FUBAG DCF-1700/270 СТ15 двухступенчатый
ПОДРОБНЕЕЕще цены и похожие товары
46 340
Компрессор FUBAG B3600B/100 CM3
ПОДРОБНЕЕЕще цены и похожие товары
2 страница из 18
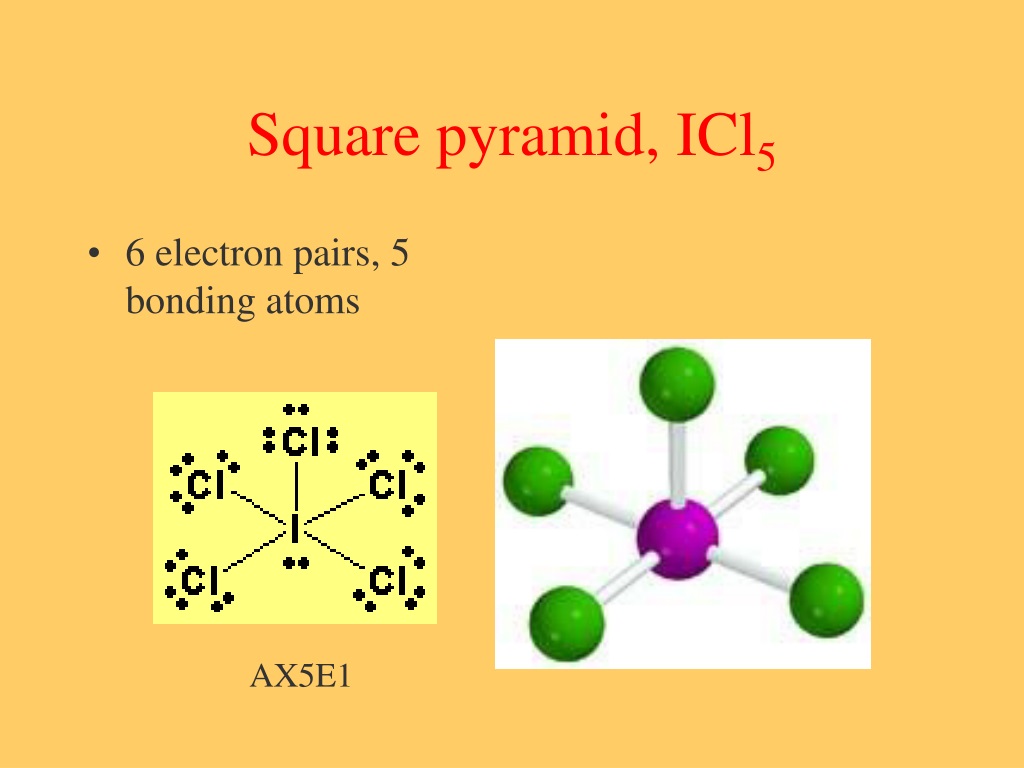
ICl4-Структура Льюиса за 5 шагов (с изображениями)
Администратор
/ 5 апреля 2022 г.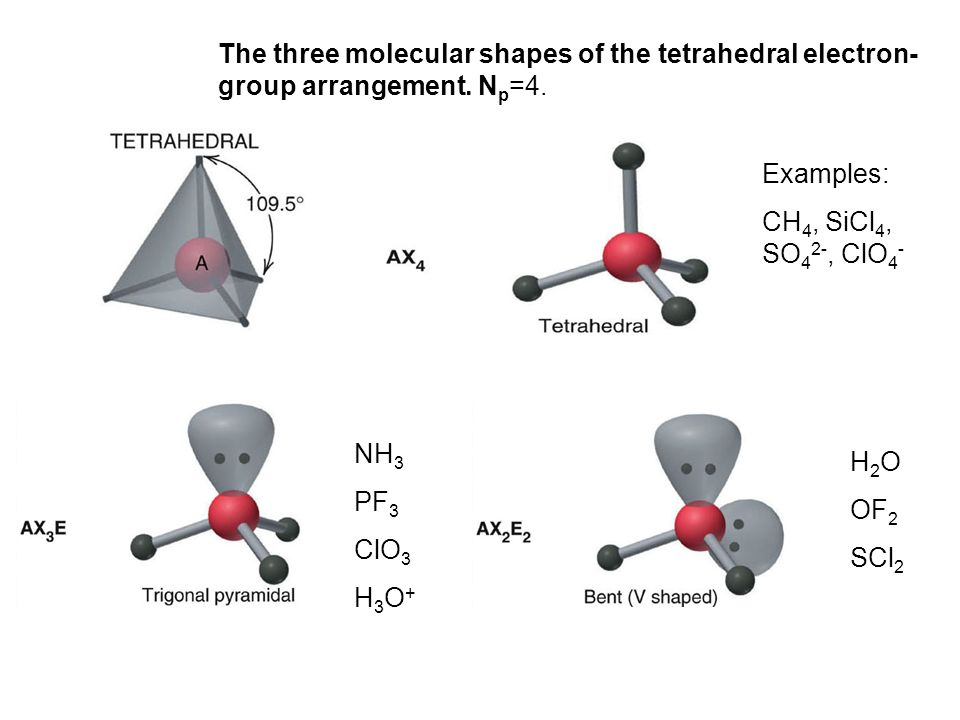
Итак, вы уже видели изображение выше, верно?
Позвольте мне вкратце объяснить приведенное выше изображение.
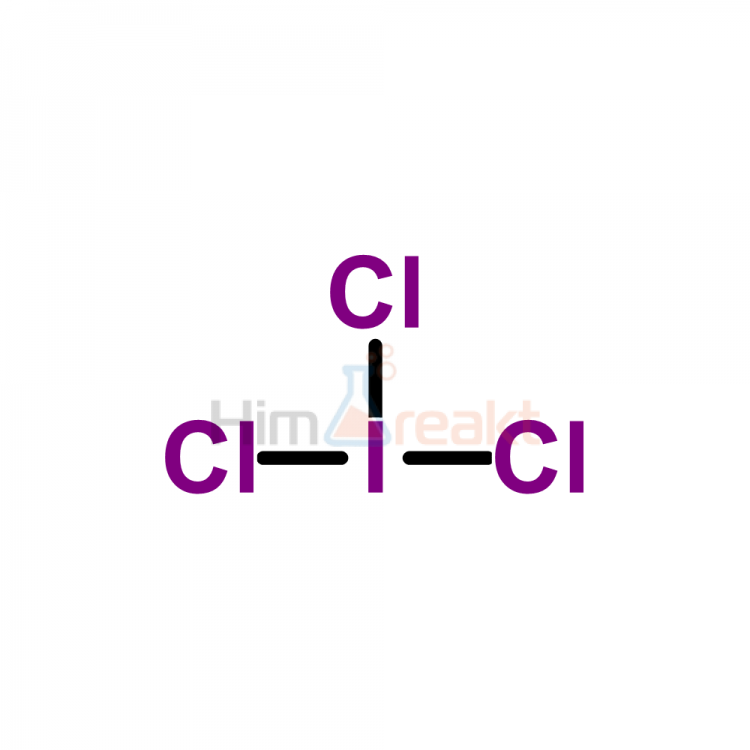
ICl4-структура Льюиса имеет атом йода (I) в центре, который окружен четырьмя атомами хлора (Cl). Между атомом йода (I) и каждым атомом хлора (Cl) имеется 4 одинарных связи. На атоме йода (I) имеется 2 неподеленные пары, а на всех четырех атомах хлора (Cl) — 3 неподеленные пары.
Если вы ничего не поняли из приведенного выше изображения структуры ICl4-льюиса, то просто оставайтесь со мной, и вы получите подробное пошаговое объяснение по рисованию структуры льюиса иона ICl4-.
Итак, давайте перейдем к этапам рисования структуры Льюиса иона ICl4-.
Шаг 1: Найдите общее количество валентных электронов в ионе ICl4-
Чтобы найти общее количество валентных электронов в ионе ICl4-, прежде всего, вы должны знать количество валентных электронов, присутствующих в атоме йода, а также в атоме хлора.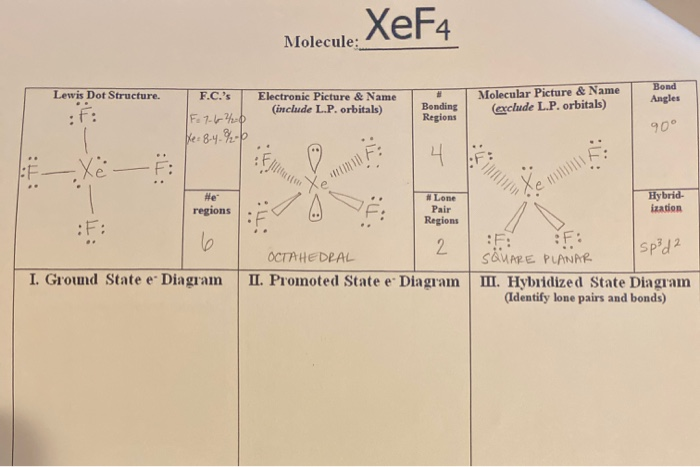
(Валентные электроны — это электроны, находящиеся на самой внешней орбите любого атома.)
Здесь я расскажу вам, как легко найти валентные электроны йода, а также хлора, используя периодическую таблицу.
Общее количество валентных электронов в ионе ICl4-
→ Валентные электроны, определяемые атомом йода:
Йод является элементом 17-й группы периодической таблицы. Следовательно, количество валентных электронов, присутствующих в йоде, составляет 7 .
Вы можете видеть 7 валентных электронов, присутствующих в атоме йода, как показано на изображении выше.
→ Валентные электроны от атома хлора:
Хлор является элементом 17 группы периодической таблицы. Следовательно, количество валентных электронов, присутствующих в хлоре, составляет 7 .
Вы можете видеть 7 валентных электронов, присутствующих в атоме хлора, как показано на изображении выше.
Следовательно,
Общее количество валентных электронов в ионе ICl4- = валентные электроны от 1 атома йода + валентные электроны от 1 атома хлора + еще 1 электрон добавляется из-за 1 отрицательного заряда = 7 + 7(4) + 1 = 36 .
Шаг 2: Выберите центральный атом
При выборе центрального атома вы должны помнить, что менее электроотрицательный атом остается в центре.
Здесь данный ион является ионом ICl4- и содержит атом йода (I) и атомы хлора (Cl).
Вы можете увидеть значения электроотрицательности атома йода (I) и атома хлора (Cl) в приведенной выше таблице Менделеева.
Если сравнить значения электроотрицательности йода (I) и хлора (Cl), то атом йода менее электроотрицательный.
Итак, здесь атом йода (I) является центральным атомом, а атомы хлора (Cl) являются внешними атомами.
Шаг 3: Соедините каждый атом, поместив между ними электронную пару
Теперь в молекуле ICl4 вы должны поместить электронные пары между атомами йода (I) и атомами хлора (Cl).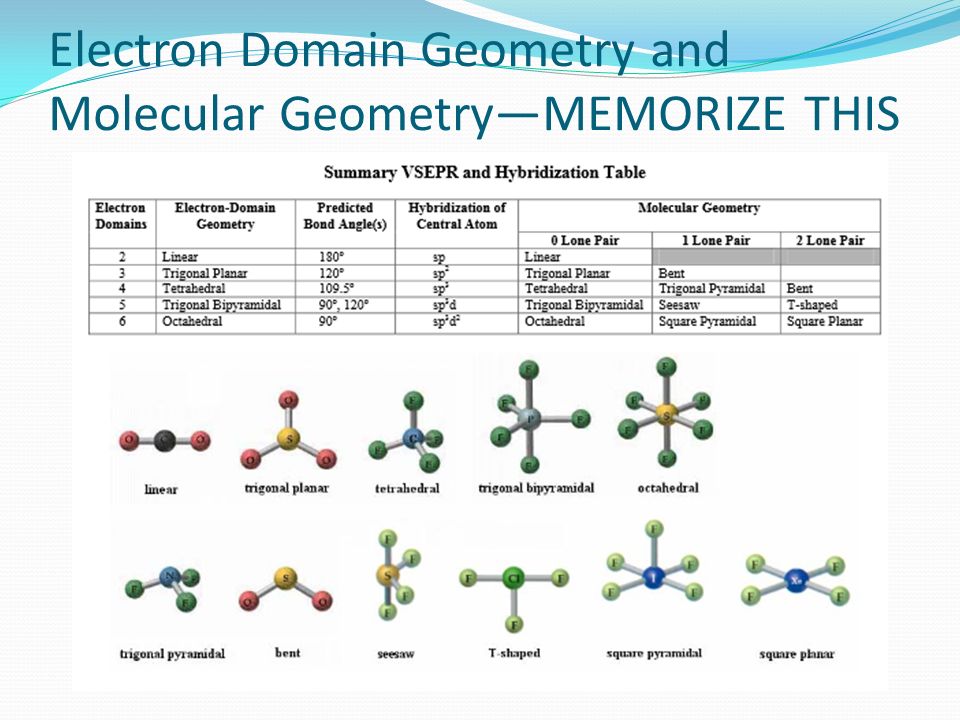
Это указывает на то, что йод (I) и хлор (Cl) химически связаны друг с другом в молекуле ICl4.
Шаг 4: Сделайте внешние атомы стабильными
На этом этапе вам нужно проверить стабильность внешних атомов.
Здесь на эскизе молекулы ICl4 видно, что внешние атомы — это атомы хлора.
Эти внешние атомы хлора образуют октет и, следовательно, они стабильны.
Кроме того, на шаге 1 мы рассчитали общее количество валентных электронов, присутствующих в ионе ICl4-.
Ион ICl4- имеет всего 36 валентных электронов и из них только 32 валентных электрона используются в приведенном выше эскизе.
Таким образом, количество оставшихся электронов = 36 – 32 = 4 .
Вы должны поместить эти 4 электронов на центральный атом йода в приведенном выше наброске молекулы ICl4.
Теперь давайте перейдем к следующему шагу.
Шаг 5: Проверка стабильности структуры Льюиса
Теперь вы подошли к последнему шагу, на котором вам нужно проверить стабильность структуры Льюиса ICl4.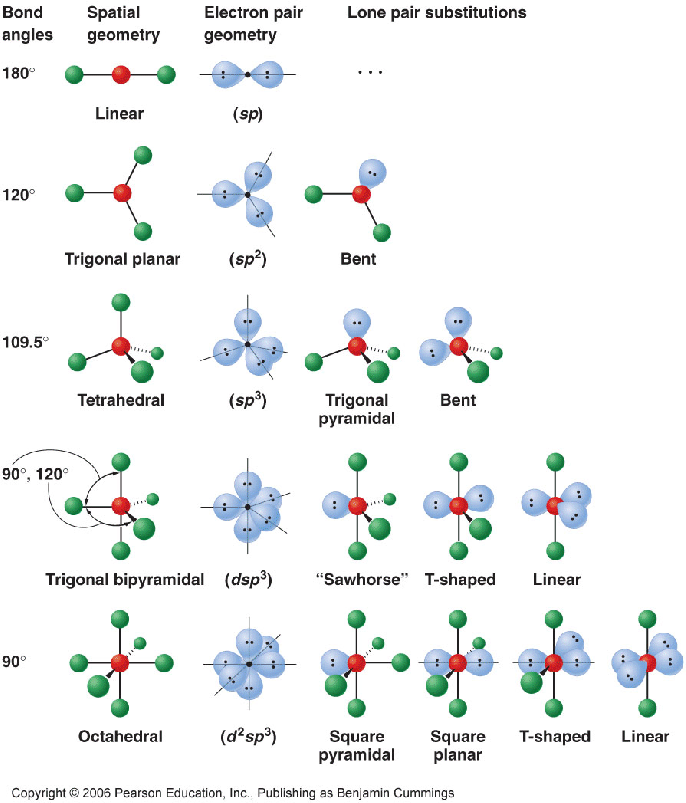
Стабильность структуры Льюиса можно проверить с помощью концепции формального заряда.
Короче говоря, теперь вам нужно найти формальный заряд атомов йода (I), а также атомов хлора (Cl), присутствующих в молекуле ICl4.
Для расчета формального сбора необходимо использовать следующую формулу;
Формальный заряд = Валентные электроны – (Связывающие электроны)/2 – Несвязывающие электроны
Вы можете увидеть количество связывающих и несвязывающих электронов для каждого атома молекулы ICl4 на изображении, приведенном ниже.
Для атома йода (I):
Валентный электрон = 7 (поскольку йод находится в группе 17)
Связывающие электроны = 8
Несвязывающие электроны = 4 electrons = 2
Nonbonding electrons = 6
| Formal charge | = | Valence electrons | – | (Bonding electrons)/2 | – | Nonbonding electrons | ||||||||||||||||||||||||||||||||||||||
| I | = | 7 | – | 8/2 | – | 4 | = | -1 | ||||||||||||||||||||||||||||||||||||
| CL | = | 7 | — | 2/2 | — | 6 | = | 9019 0 9014 902 9012. 9012. 9012. 9012. 9012. 9012. 9012. 9012. 9012. 9012. 9012. 9012 9012 9012. 9012. 9012 9012. 9012 9012 9012. 9012 9012. 9012 9012 9012. 9012. 9012. 9012. 9012. 9012. 9012. 9012. 9012. 9012. 9012 9012 9012. 9012. 9012 9012. 9012 9012 9012. 9012 9012. 9012 9012 . (I) атом имеет -1 заряд, а атом хлора имеет заряд 0 . Итак, давайте сохраним эти заряды на соответствующих атомах в молекуле ICl4. Этот общий заряд -1 молекулы ICl4 представлен на изображении, приведенном ниже. В приведенной выше структуре точек Льюиса иона ICl4- вы также можете представить каждую связывающую электронную пару (:) как одинарную связь (|). Таким образом, вы получите следующую структуру Льюиса иона ICl4-. Надеюсь, вы полностью поняли все вышеперечисленные шаги. Для большей практики и лучшего понимания вы можете попробовать другие структуры Льюиса, перечисленные ниже. Попробуйте (или хотя бы посмотрите) эти структуры Льюиса для лучшего понимания: Ch4F Структура Льюиса за 6 шагов (с изображениями)Итак, вы уже видели изображение выше, верно? Позвольте мне вкратце объяснить приведенное выше изображение. Структура Льюиса Ch4F имеет атом углерода (C) в центре, который окружен тремя атомами водорода (H) и одним атомом фтора (F). Существует одинарная связь между атомами углерода (C) и фтора (F), а также между атомами углерода (C) и водорода (H). У атома фтора (F) есть 3 неподеленные пары. Если вы ничего не поняли из приведенного выше изображения структуры Льюиса Ch4F, просто оставайтесь со мной, и вы получите подробное пошаговое объяснение по рисованию структуры Льюиса Ch4F. Итак, давайте перейдем к этапам рисования структуры Льюиса Ch4F. Шаг 1: Найдите общее количество валентных электронов в молекуле Ch4F Чтобы найти общее количество валентных электронов в молекуле Ch4F, прежде всего, вы должны знать количество валентных электронов, присутствующих в атоме углерода, атоме водорода, а также фторе. атом. Здесь я расскажу вам, как легко найти валентные электроны углерода, водорода и фтора с помощью периодической таблицы. Всего валентных электронов в молекуле Ch4F → Валентные электроны, заданные атомом углерода: Углерод является элементом 14 группы периодической таблицы. Следовательно, количество валентных электронов, присутствующих в углероде, составляет 4 . Вы можете видеть 4 валентных электрона, присутствующих в атоме углерода, как показано на изображении выше. → Валентные электроны от атома водорода: Водород является элементом 1 группы периодической таблицы. Следовательно, валентный электрон, присутствующий в водороде, равен 1 . Вы можете видеть, что в атоме водорода присутствует только 1 валентный электрон, как показано на изображении выше. → Валентные электроны от атома фтора: Фтор является элементом 17 группы периодической таблицы. Вы можете видеть 7 валентных электронов, присутствующих в атоме фтора, как показано на изображении выше. Следовательно, Всего валентных электронов в молекуле Ch4F = валентные электроны от 1 атома углерода + валентные электроны от 3 атомов водорода + валентные электроны от 1 атома фтора = 4 + 1(3) + 7 = 14 . Шаг 2: Выберите центральный атомПри выборе центрального атома вы должны помнить, что менее электроотрицательный атом остается в центре. (Помните: Если в данной молекуле присутствует водород, то всегда кладите водород снаружи.) Здесь данная молекула — Ch4F и содержит атом углерода (C), атомы водорода (H) и атом фтора ( Ф). Итак, по правилу мы должны держать водород снаружи. Теперь вы можете увидеть значения электроотрицательности атома углерода (C) и атома фтора (F) в приведенной выше периодической таблице. Если сравнить значения электроотрицательности углерода (C) и фтора (F), то атом углерода менее электроотрицательный. Итак, здесь атом углерода (C) является центральным атомом, а атом фтора (F) является внешним атомом. Шаг 3: Соедините каждый атом, поместив между ними пару электроновТеперь в молекуле Ch4F вы должны поместить пары электронов между атомами углерода (C) и фтора (F) и между атомами углерода (C ) и атомы водорода (H). Это указывает на то, что эти атомы химически связаны друг с другом в молекуле Ch4F. Шаг 4: Сделайте внешние атомы стабильнымиНа этом этапе вам нужно проверить стабильность внешних атомов. Здесь, на эскизе молекулы Ch4F, вы можете видеть, что внешними атомами являются атомы водорода и атом фтора. Эти атомы водорода и атом фтора образуют дуплет и октет соответственно и, следовательно, они стабильны. Кроме того, на шаге 1 мы рассчитали общее количество валентных электронов, присутствующих в молекуле Ch4F. Молекула Ch4F имеет всего 14 валентных электронов , и все эти валентные электроны используются в приведенном выше наброске Ch4F. Следовательно, на центральном атоме не осталось электронных пар, которые можно было бы сохранить. Итак, теперь давайте перейдем к следующему шагу. Шаг 5: Проверьте октет центрального атомаНа этом шаге вы должны проверить, стабилен ли центральный атом углерода (C). Чтобы проверить стабильность центрального атома углерода (С), мы должны проверить, образует ли он октет или нет. На изображении выше видно, что атом углерода образует октет. Это означает, что у него 8 электронов. Следовательно, центральный атом углерода стабилен. Теперь давайте перейдем к последнему шагу, чтобы проверить, устойчива ли структура Льюиса Ch4F. Шаг 6: Проверка стабильности структуры Льюиса Теперь вы подошли к последнему шагу, на котором вам нужно проверить стабильность структуры Льюиса Ch4F. Стабильность структуры Льюиса можно проверить с помощью концепции формального заряда. Короче говоря, теперь вам нужно найти формальный заряд атома углерода (C), водорода (H), а также атома фтора (F), присутствующих в молекуле Ch4F. Для расчета формального сбора необходимо использовать следующую формулу; Формальный заряд = Валентные электроны – (Связывающие электроны)/2 – Несвязывающие электроны Вы можете увидеть количество связывающих и несвязывающих электронов для каждого атома молекулы Ch4F на изображении, приведенном ниже. Для атома углерода (C): электрон = 1 (поскольку водород находится в группе 1) Для атома фтора (F):
Из приведенных выше расчетов формального заряда видно, что атом углерода (C), атом водорода (H), а также атом фтора (F) имеют «нулевой» формальный заряд. |

 1
16 008 ₽
В наличии
1
16 008 ₽
В наличии

 )
)  Следовательно, валентный электрон, присутствующий во фторе, равен 9.0009 7 .
Следовательно, валентный электрон, присутствующий во фторе, равен 9.0009 7 .