Как устроена обычная батарейка. Какие химические процессы происходят внутри гальванического элемента. Каковы основные типы и характеристики современных батареек. Как правильно выбрать и использовать батарейки в бытовых устройствах.
Принцип работы гальванического элемента
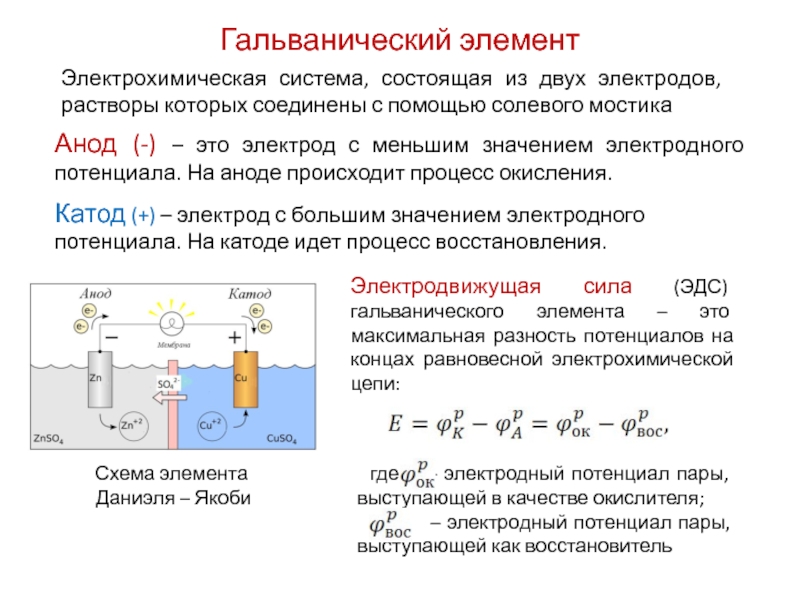
Гальванический элемент (батарейка) — это химический источник тока, преобразующий энергию окислительно-восстановительной реакции в электрическую энергию. Основные компоненты гальванического элемента:
- Анод — отрицательный электрод, на котором происходит окисление.
- Катод — положительный электрод, на котором происходит восстановление.
- Электролит — проводящая среда, обеспечивающая перемещение ионов между электродами.
- Сепаратор — разделитель электродов, предотвращающий их контакт.
При работе элемента на аноде происходит окисление активного металла (например, цинка), в результате чего образуются свободные электроны. Эти электроны по внешней цепи перемещаются к катоду, где участвуют в реакции восстановления. Движение электронов во внешней цепи и создает электрический ток.
Устройство современной щелочной батарейки
Рассмотрим конструкцию популярной щелочной (алкалиновой) батарейки:
- Стальной корпус, покрытый никелем — служит катодом.
- Катодная масса из диоксида марганца и графита.
- Сепаратор из нетканого материала.
- Электролит — концентрированный раствор гидроксида калия.
- Анод из порошкообразного цинка.
- Латунный токоотвод.
- Изолирующая прокладка.
- Стальная крышка с пластиковым уплотнением.
При разряде батарейки цинк окисляется, отдавая электроны, а диоксид марганца восстанавливается, принимая эти электроны. Щелочной электролит обеспечивает высокую проводимость и препятствует коррозии.
Основные типы современных батареек
В зависимости от химического состава и конструкции различают следующие основные типы батареек:
- Солевые (угольно-цинковые) — самые дешевые, но с низкой емкостью.
- Щелочные (алкалиновые) — высокая емкость, стабильное напряжение.
- Литиевые — высокая энергоемкость, длительный срок хранения.
- Никель-металлгидридные (Ni-MH) — перезаряжаемые, экологичные.
- Никель-кадмиевые (Ni-Cd) — перезаряжаемые, для больших токов.
- Серебряно-цинковые — высокая удельная энергия, дорогие.
Выбор типа батарейки зависит от требуемых характеристик и области применения устройства.

Характеристики гальванических элементов
Основные параметры, характеризующие работу батареек:
- Напряжение — разность потенциалов между электродами (обычно 1,2-3,7 В).
- Емкость — количество электричества, отдаваемое при разряде (мА·ч).
- Внутреннее сопротивление — влияет на максимальный ток разряда.
- Саморазряд — потеря емкости при хранении.
- Диапазон рабочих температур.
- Срок хранения.
- Число циклов заряда-разряда (для аккумуляторов).
Знание этих характеристик позволяет правильно подобрать элементы питания для конкретных устройств.
Правила использования батареек
Для эффективного и безопасного применения батареек следует соблюдать несколько простых правил:
- Использовать батарейки, соответствующие требованиям устройства.
- Не смешивать батарейки разных типов и степени разряженности.
- Соблюдать полярность при установке.
- Извлекать батарейки из устройств при длительном хранении.
- Не допускать короткого замыкания батареек.
- Хранить в сухом прохладном месте.
- Утилизировать использованные батарейки в специальных пунктах приема.
Соблюдение этих рекомендаций обеспечит максимальный срок службы батареек и безопасность их использования.

Перспективы развития химических источников тока
Развитие портативной электроники и электротранспорта стимулирует совершенствование химических источников тока. Основные направления исследований:
- Повышение удельной энергоемкости.
- Увеличение срока службы и числа циклов заряда-разряда.
- Снижение времени заряда.
- Повышение безопасности.
- Уменьшение стоимости производства.
- Разработка экологически безопасных технологий.
Перспективными считаются литий-воздушные, натрий-ионные, твердотельные аккумуляторы. Ведутся работы по созданию суперконденсаторов и топливных элементов для портативных устройств.
Заключение
Гальванические элементы, несмотря на свою кажущуюся простоту, являются сложными электрохимическими устройствами. Их разработка и производство требуют глубоких знаний в области химии, физики и материаловедения. Современные батарейки обеспечивают работу множества портативных устройств, от часов до электромобилей, и играют важную роль в нашей повседневной жизни. Дальнейшее совершенствование химических источников тока открывает новые возможности для развития мобильных технологий и альтернативной энергетики.
От Вольты до Гасснера, или Химические источники тока в XIX веке
Илья Леенсон
«Химия и жизнь» №1, 2017
Первые шаги: Гальвани и Вольта
Вплоть до конца XVIII века физики, изучавшие электрические явления, имели в своем распоряжении лишь источники статического электричества — куски янтаря, шары из плавленой серы, электрофорные машины, лейденские банки. С ними экспериментировали многие ученые, начиная с английского физика и врача Уильяма Гильберта (1544–1603). Имея в распоряжении такие источники, можно было открыть, например, закон Кулона (1785), но нельзя было открыть даже закон Ома (1826), не говоря уже о законах Фарадея (1833). Потому что накопленный статически заряд был мал и не мог обеспечить ток, длящийся хотя бы несколько секунд.
Ситуация изменилась после работ профессора медицины Болонского университета Луиджи Гальвани (1737–1798), открывшего, как он полагал, «животное электричество». Его знаменитый трактат назывался «О силах электричества при мышечном движении». В некоторых опытах Гальвани произошел первый в мире прием радиоволн. Генератором служили искры электрофорной машины, приемной антенной — скальпель в руках Гальвани, а приемником — лягушачья лапка. Помощник Гальвани проводил опыты с электрической машиной в некотором отдалении от препарированной лягушки. При этом жена Гальвани Лючия заметила, что лягушачьи лапки сокращаются в тот самый момент, когда в машине проскакивает искра, так что видна роль и случайности и наблюдательности.
Опытами Гальвани заинтересовался итальянский физик Алессандро Джузеппе Антонио Анастасио Вольта (1745–1827). Он был уже известным ученым: в 1775 году сконструировал смоляной электрофор, то есть обнаружил вещества-электреты, в 1781-м — чувствительный электроскоп, а немного позже — конденсатор, электрометр и другие приборы. В 1776 году он же обнаружил электропроводность пламени, а в 1778-м впервые получил чистый метан из собранного им в болотах газа и продемонстрировал возможность зажечь его от электрической искры. Вольта вначале был ревностным сторонником теории «животного электричества» Гальвани. Но собственноручное повторение его опытов убедило Вольту, что опыты Гальвани следует объяснять совершенно иначе: лягушачья ножка — не источник, а лишь приемник электричества. Источник же — разные металлы, которые касаются друг друга. «Металлы не только прекрасные проводники, — писал Вольта, — но и двигатели электричества».
Это было ключевое утверждение, позволившее создать гальванические элементы, батарейки, аккумуляторы, которые окружают нас со всех сторон и всю жизнь. Принцип их действия изложен в школьном учебнике, причем значительно подробнее, чем это нужно для дальнейшего. Суть проста: в проводящей среде (электролите) находятся два разных проводника (электрода), которые вступают с ней в такие реакции, что они заряжаются разноименными зарядами. Если соединить эти электроды (анод и катод) внешним проводником (нагрузкой), по ней начнет протекать ток.
Возражая Гальвани, Вольта сначала избавился от лягушки, заменив ее собственным языком. Он, например, клал на язык золотую или серебряную монету, а под язык — медную. Как только две монеты соединяли кусочком проволоки, сразу же во рту ощущался кислый вкус, знакомый каждому, кто пробовал на язык контакты батарейки для карманного фонаря. Затем Вольта и вовсе исключил из экспериментов «животное электричество», используя в опытах только приборы.
Оставался один шаг до изобретения в 1800 году первого постоянно действующего источника электрического тока. Это произошло, когда Вольта соединил последовательно пары цинковых и медных пластинок, разделенных прокладками из картона или кожи, которые были пропитаны раствором щелочи или соленой водой. Эту конструкцию назвали по имени изобретателя «вольтовым столбом». Конструкция была тяжелой, жидкость из прокладок выдавливалась, поэтому Вольта заменил ее чашечками с раствором кислоты, в которые были опущены цинковые и медные (или серебряные) полоски или кружочки. Чашки были соединены последовательно, а чтобы выводы батареи были близко, отдельные ее элементы Вольта расположил по кругу. Эту конструкцию по ее форме назвали «вольтовой короной».
После своего открытия Вольта потерял к нему интерес и отошел от научной работы, предоставив другим ученым развивать учение об электричестве. Но вклад Алессандро Вольты в учение об электричестве столь значим, что его именем названа единица напряжения. А когда Наполеон увидел в библиотеке Академии наук изображение лаврового венка с надписью «Великому Вольтеру», он стер несколько букв, так что получилось: «Великому Вольте». Вольтов столб и его разновидности дали возможность многочисленным ученым проводить эксперименты с длительно действующим источником постоянного тока. Именно с этого открытия началась эра электричества. Вероятно, самый восторженный отзыв об открытии Вольты оставил его биограф французский физик Доминик Франсуа Араго (1786–1853): «Столб, составленный из кружков медного, цинкового и влажного суконного. Чего ожидать априори от такой комбинации? Но это собрание, странное и, по-видимому, бездействующее, этот столб из разнородных металлов, разделенных небольшим количеством жидкости, составляет снаряд, чуднее которого никогда не изобретал человек, не исключая даже телескопа и паровой машины».
«Огромные наипаче батареи»
Вольта поступил очень мудро, послав в марте 1800 года письмо Джозефу Бэнксу (1743–1820), президенту Лондонского королевского общества — ведущего научного центра того времени. В письме Вольта описал различные конструкции своих источников электричества, которые в память о Гальвани назвал гальваническими. Бэнкс был ботаником, поэтому он показал письмо своим коллегам — физику и химику Уильяму Николсону (1753–1815) и врачу и химику, президенту Королевского колледжа хирургов Энтони Карлайлу (1768–1842). И уже в апреле они по описанию Вольты изготовили батарею из 17, а затем из 36 последовательно соединенных цинковых кружков и монет в полкроны, которые тогда были из серебра 925-й пробы. Между ними помещались картонные прокладки, пропитанные соленой водой.
В ходе опытов Николсон обнаружил около контакта цинка и медного проводника выделение пузырьков газа. Он определил, что это водород — причем по запаху, ибо водород, получаемый при растворении цинка в кислотах или щелочах, часто имеет запах. В цинке обычно есть примесь мышьяка, который восстанавливается до арсина, а продукты его разложения пахнут чесноком. В сентябре 1800 года немецкий физик Иоганн Риттер (1776–1810), собрав газ, выделявшийся при электролизе воды, с другого электрода батареи, показал, что это кислород. В том же году английский химик Уильям Крукшенк (1745–1800) расположил цинковые и медные пластинки в горизонтальном длинном ящике — при этом легко было заменять отработанные (полурастворившиеся и покрытые продуктами реакции) цинковые электроды. В нерабочем состоянии электролит из ящика сливали, чтобы не расходовать цинк зря. В качестве электролита Крукшенк использовал раствор хлорида аммония, а затем — разбавленную кислоту. Фарадей рекомендовал смесь слабых (1–2 %) растворов серной и азотной кислот. С таким электролитом цинк медленно растворялся с выделением маленьких пузырьков водорода. Водород выделялся и на медном аноде, а ЭДС* одного элемента батареи была всего 0,5 В.
Выделение водорода на цинке связано с поляризацией этого электрода, которая увеличивает внутреннее сопротивление и понижает потенциал элемента. Чтобы предотвратить это явление, британский физик и электротехник Уильям Стёрджен (1783–1850), создатель первого электромагнита, амальгамировал цинковые пластинки. В 1840 году английский врач Альфред Сми (1818–1877) заменил медный электрод серебряным, покрытым шероховатым слоем платины. Это ускоряло выделение из раствора пузырьков водорода и увеличивало ЭДС. Такие батареи широко использовали в гальванотехнике. Так, методом гальванопластики были изготовлены скульптуры на Исаакиевском соборе в Петербурге. Метод получения электролитическим путем копий в металле разработал петербургский академик Мориц Герман (Борис Семенович) Якоби в 1838 году, как раз во время строительства собора. Подробнее об этой технике можно прочитать на сайте «Библиотека с книгами по скульптуре».
Одну из лучших батарей своего времени собрал известный английский медик и химик Уильям Хайд Волластон (Уолластон, 1766–1828), прославившийся открытием палладия и родия, а также технологией изготовления тончайших металлических нитей, которые применялись в чувствительных приборах. В каждом элементе цинковый электрод был с трех сторон окружен медным с малым зазором, через который пузырьки водорода выделялись в воздух.
Знаменитый английский физик Гемфри Дэви (1778–1829) сначала проводил опыты с батареей, подаренной ему самим Вольтой; затем начал изготовлять все более мощные собственной конструкции — из медных и цинковых пластинок, разделенных водным раствором аммиака. Первая его батарея состояла из 60 таких элементов, но через несколько лет он собрал очень большую батарею, уже из тысячи элементов. С помощью этих батарей он впервые смог получить такие металлы, как литий, натрий, калий, кальций и барий, а в виде амальгамы — магний и стронций.
Одну из самых больших батарей создал в 1802 году физик и электротехник Василий Владимирович Петров (1761–1834). Его «огромная наипаче батарея» из 4200 медных и цинковых пластин «по полтора дюйма» размером располагалась в узких деревянных ящиках. Вся батарея была составлена из четырех рядов, каждый длиной около 3 м, соединенных последовательно медными скобками. Теоретически такая батарея может давать напряжение до 2500 В, а реально давала около 1700. Эта гигантская батарея позволила Петрову провести множество опытов: он разлагал током различные вещества, а в 1803 году впервые в мире получил электрическую дугу. С ее помощью удалось расплавлять металлы, ярко освещать большие помещения. Однако обслуживание этой батареи было исключительно трудоемким. Во время опытов пластины окислялись, и их приходилось регулярно чистить. При этом один работник мог за час почистить 40 пластин. Работая по 8 часов в день, этот работник в одиночку потратил бы не меньше двух недель, чтобы приготовить батарею к следующим опытам.
Вероятно, самый необычный гальванический элемент изготовил немецкий химик Фридрих Вёлер (1800–1882). В 1827 году, нагревая хлорид алюминия с калием, он получил металлический алюминий — в виде порошка. Ему понадобилось 18 лет, чтобы получить алюминий в виде слитка. В элементе Вёлера оба электрода были из алюминия! Причем один был погружен в азотную кислоту, другой — в раствор гидроксида натрия. Сосуды с растворами соединял солевой мостик.
Даниель, Лекланше и другие
Основу современных гальванических элементов разработал в 1836 году Джон Фредерик Даниель (1790–1845), английский физик, химик и метеоролог (он изобрел также измеритель влажности — гигрометр). Даниелю удалось преодолеть поляризацию электродов. В его первом элементе в медный сосуд с раствором сульфата меди был вставлен кусочек пищевода быка, наполненный разбавленной серной кислотой с цинковым стержнем посередине. Фарадей предложил изолировать цинк оберточной бумагой, поры которой тоже могут пропускать ионы электролита. Но Даниель в качестве диафрагмы стал использовать пористый глиняный сосуд. Заметим, что с медным и цинковым электродами, погруженными в растворы соответственно нитрата меди и сульфата цинка, еще в 1829 году экспериментировал Антуан Сезар Беккерель (1788–1878), дед более известного Антуана Анри Беккереля, открывшего радиоактивность и разделившего в 1903 году с супругами Кюри Нобелевскую премию по физике. Элемент Даниеля длительно давал стабильное напряжение 1,1 В. За это изобретение Даниель был удостоен высшей награды Королевского общества — золотой медали Копли. За прошедшие 180 лет появилось множество модификаций этого элемента; при этом их разработчики пытались разными способами избавиться от пористого сосуда.
С появлением телеграфных линий возникла потребность в более удобных и недорогих источниках тока, без пористых перегородок, с одним электролитом и с большим сроком службы. В 1872 году элемент Даниеля сменил нормальный элемент Джосайи Латимера Кларка (1822–1898): положительный электрод — ртуть, отрицательный — 10%-ная амальгама цинка, ЭДС 1,43 В. А в 1892 году ему на смену пришел ртутно-кадмиевый элемент Эдварда Вестона (1850–1936) с ЭДС 1,35 В. Его модификация под названием нормальный элемент Вестона используется до сих пор в качестве эталона напряжения — при малых нагрузках он дает высокостабильное напряжение в диапазоне 1,01850–1,01870 В, известное с точностью до пятого знака.
Один из вариантов элемента Даниеля, в котором не было пористой перегородки, разработал в 1859 году немецкий физик и изобретатель Генрих Мейдингер (1831–1905). На дне сосуда расположены медный электрод и кристаллы медного купороса (они поступают из воронки), цинковый электрод укреплен вверху. Тяжелый насыщенный раствор сульфата меди остается в нижней части: диффузии ионов меди к цинковому электроду противодействует разряд этих ионов при работе элемента, а граница между растворами выделяется очень резко. Отсюда название источников такого типа — гравитационный элемент. Элемент Мейдингера без ухода и добавления реактивов может непрерывно работать в течение нескольких месяцев. Этот элемент широко использовали в Германии с 1859 по 1916 год как источник питания для железнодорожной телеграфной сети. Аналогичные источники существовали во Франции и в США — под названием элементов Калло и Локвуда. Хорошими характеристиками обладал элемент, предложенный в 1839 году английским физиком и химиком Уильямом Робертом Грове (1811–1896). Электродами в нем служили цинк и платина, разделенные пористой перегородкой и погруженные соответственно в растворы серной и азотной кислот.
Роберт Вильгельм Бунзен (1811–1899), известный своими открытиями и изобретениями (спектральный анализ, горелка и др.), заменил дорогой платиновый электрод прессованным угольным. Угольные электроды присутствуют и в современных батарейках, однако у Бунзена они были погружены в азотную кислоту, играющую роль деполяризатора (сейчас им служит диоксид марганца). Элементы Бунзена долгое время широко использовались в лабораториях. Они могли обеспечить, хотя и недолго, большой ток. Элементы Бунзена, например, использовал молодой Чарльз Мартин Холл (1863–1914), открывший электролитический способ получения алюминия. Множество таких элементов было соединено в батарею; при этом на 1 г выделенного алюминия уходило почти 16 г цинка! Французский химик и изобретатель Эдм Ипполит Мари-Дэви (1820–1893) заменил в элементе Бунзена азотную кислоту на пасту из сульфата ртути (I) и серной кислоты; электролитом служил раствор сульфата цинка. В 1859 году было проведено сравнение батареи из 38 этих элементов (ЭДС каждой 1,4 В) с батареей из 60 элементов Даниеля. Первая проработала 23 недели, вторая — только 11. Однако высокая стоимость и ядовитость солей ртути препятствовали широкому распространению таких элементов.
Немецкий физик Иоганн Кристиан Поггендорф (1796–1877) в качестве деполяризатора использовал в своем элементе раствор дихромата калия в серной кислоте. Поггендорф известен как издатель журнала Annalen der Physik und Chemie — он занимал этот пост на протяжении 36 лет. Элемент Поггендорфа давал наибольшую ЭДС (2,1 В) и непродолжительно — большой ток. Важным преимуществом была возможность извлечь из раствора цинковый электрод, чтобы его очистить или заменить.
Уоррен де ла Рю (1815–1889), который впервые получил фотографии Луны и Солнца, в 1868 году собрал большую батарею из 14 тысяч элементов. Электродами в них служили серебро, покрытое хлоридом серебра, и амальгамированный цинк, а электролитом — раствор хлорида натрия, хлорида цинка или гидроксида калия. Цинк-хлорсеребряные элементы используются до сих пор; их хранят в сухом виде и активируют, заполняя пресной или морской водой, после чего элемент может работать до 10 месяцев. Такие элементы могут использовать потерпевшие аварию на воде. В более дешевых, но и менее мощных элементах применяется Cu/CuCl-электрод.
Один из самых известных химических источников тока — марганцево-цинковый элемент, описанный в 1868 году французским химиком Жоржем Лекланше (1839–1882) и разработанный им несколькими годами ранее. В этом элементе угольный электрод окружен деполяризатором из диоксида марганца, смешанным для лучшей электропроводности с угольным порошком. Чтобы смесь не рассыпалась при заливке электролита (раствора хлорида аммония), ее вместе с анодом помещали в пористый сосуд. Элемент Лекланше служил долго, не требовал ухода и мог давать довольно большой ток. Пытаясь сделать его более удобным, Лекланше решил загустить электролит клейстером. Это революционным образом изменило дело: элементы Лекланше перестали бояться случайного опрокидывания, их можно было использовать в любом положении. Изобретение Лекланше тут же получило коммерческий успех, а сам изобретатель, забросив свою основную профессию, открыл фабрику по производству элементов. Марганцево-цинковые элементы Лекланше были дешевыми и выпускались в больших количествах. Однако называть их «сухими» не вполне правильно: электролит в них был «полужидким», а в настоящих сухих элементах он должен быть твердым. Лекланше умер в возрасте 43 лет, не дожив до изобретения таких элементов.
С 1802 по 1812 год было сконструировано несколько сухих батарей, самая известная из которых — так называемый замбониев, или дзамбониев столб (см. «Химию и жизнь» № 6, 2007). Итальянский физик и священник Джузеппе Дзамбони (1776–1846) в 1812 году собрал столб из нескольких сотен бумажных кружков, на одной стороне которых был тонкий слой цинка, а на другой — смесь диоксида марганца и растительной камеди. Электролитом служила содержащаяся в бумаге влага. Такой столб давал высокое напряжение, но только очень малый ток. Именно столб Дзамбони позволяет уже почти два века позвякивать чашечкам в звонке, находящемся в Кларендонской лаборатории в Оксфорде. Однако для практических целей такая батарея не подходит.
Первый сухой гальванический элемент, который можно было применять на практике, запатентовал в 1886 году немецкий инженер Карл Гасснер (1855–1942). Протекающие в нем химические реакции были такими же, как и в предыдущих конструкциях: Zn + 2MnO2 + 2NH4Cl → 2MnO(OH) + [Zn(NH3)2]Cl2. При этом цинковый электрод одновременно служил и наружным контейнером. Электролитом была смесь муки и гипса, на ней был абсорбирован раствор хлоридов аммония и цинка (гипс потом заменили крахмалом). Добавление в электролит хлорида цинка значительно снижало коррозию цинкового электрода и продлевало срок хранения элемента. Положительным электродом служил угольный стержень, который окружала масса из диоксида марганца и сажи в бумажном мешочке. Сверху элемент герметизировали битумом. Емкость элементов компенсировали их размером. Солевой элемент Гасснера в общих чертах сохранился до наших дней и выпускается в количестве многих миллиардов штук в год. Но в ХХ веке конкуренцию им составили щелочные элементы, которые иногда ошибочно называют «алкалиновыми», не трудясь заглянуть в словарь при переводе с английского.
В заключение отметим, что гальванические батареи той или иной конструкции были основными источниками электричества вплоть до изобретения динамо-машины.
* Электродвижущая сила. — «Элементы».
8.2. Устройство и принцип действия гальванических элементов
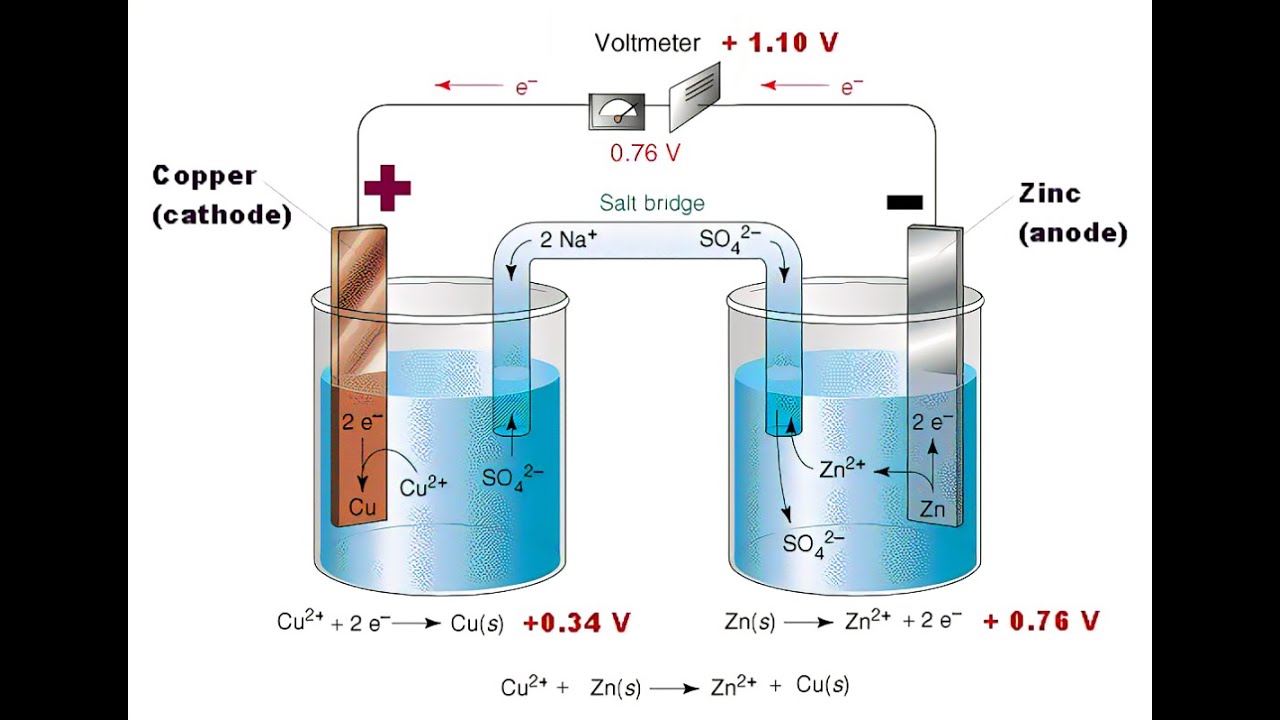
Гальванический элемент (ГЭ) — это устройство для превращения химической энергии в электрическую. ГЭ состоит из двух электродов (полуэлементов). Простейший полуэлемент состоит из металлической пластинки, опущенной в раствор своей соли. Более активный металл называется анодом. На его поверхности протекает процесс окисления. При работе ГЭ анод заряжается отрицательно. На менее активном металле, называемом катодом, протекает процесс восстановления. При работе гальванического элемента катод заряжается положительно. На рис.15 представлена схема медно-цинкового гальванического элемента Якоби-Даниеля.
Рисунок 15. — Медно-цинковый элемент Якоби-Даниеля
Медный и цинковый электроды соединены металлическим проводником, образующим внешнюю цепь гальванического элемента. Растворы солей CuSO4 и ZnSO4 соединены между собой солевым мостиком, образующим внутреннюю цепь гальванического элемента. Солевой мостик (электролитический ключ)— это стеклянная трубка, заполненная раствором электролита.
Цинковый электрод является анодом; на нем протекает процесс окисления:
Zn0 – 2e—Zn2+.
Катионы Zn2+ переходят в раствор, вследствие чего раствор приобретает положительный заряд, а электрод – отрицательный.
Электроны, отданные цинком, поступают во внешнюю цепь и мигрируют к меди.
Медный электрод является катодом; на нем протекает процесс восстановления:
Cu 2+ + 2e—Cu0.
Катионы Cu2+ принимают электроны, поступающие из внешней цепи, восстанавливаются и осаждаются на медном электроде. В результате раствор приобретает отрицательный заряд, а электрод – положительный.
Схема медно-цинкового гальванического элемента записывается следующим образом:
(-) Zn / Zn2+ // Cu2+/ Cu (+),
где / обозначает поверхность раздела металл-раствор, а также ОВ потенциал (электродный потенциал), возникающий на поверхности электрода вследствие того, что металл и раствор имеют разноименные заряды;
// обозначают границу раздела двух растворов, а так же диффузионный потенциал, возникающий из-за их разноименных зарядов.
Суммируя уравнения окислительно-восстановительных полуреакций, получаем уравнение суммарной токообразующей реакции:
Катод: Zn0 – 2e—Zn2+ 1
Анод: Cu 2+ + 2e—Cu0 1
Zn0 + Cu2+Zn2+ + Cu0
Эдс гальванического элемента рассчитывают как разность окислительно-восстановительных потенциалов катода и анода:
Е=φ(катод) – φ(анод).
Помимо окислительно-восстановительных и диффузионных потенциалов, возникновение электрического тока в гальваническом элементе происходит за счет мембранных потенциалов, возникновение которых обусловлено неравномерным распределением заряженных частиц (например, ионов) по обе стороны мембраны. Именно такое распределение ионов характерно для клеток человека (таблица 6).
Таблица 6 — Ионный состав нервной клетки
-
Ионы
Внутренняя среда
Внешняя среда
К+
400 ммоль/л
20 ммоль/л
Na+
50 ммоль/л
440 ммоль/л
Cl‾
120 ммоль/л
550 ммоль/л
Для каждого проникающего иона мембранный потенциал рассчитывается по уравнению Нернста:
где [X] внешн. среда и [x] внутр. среда — это концентрации иона во внешней и внутренней средах соответственно, моль/л;
n — заряд иона.
Мембранные потенциалы клеток называют биопотенциалами. Метод регистрации биопотенциалов используется при исследовании деятельности различных органов, например, при диагностике сердечных заболеваний (электрокардиография). Регистрация биопотенциалов мозга (электроэнцефалограмма) в ряде случаев позволяет судить о патологических нарушениях центральной нервной системы.
Классификация гальванических элементов по устройству
Различают три типа гальванических элементов: химические, концентрационные и топливные.
Химические гальванические элементы состоят из различных электродов. Примером является медно-цинковый элемент Якоби-Даниеля. Концентрационные элементы состоят из одинаковых электродов и отличаются только концентрацией электролитов них:
(–) Zn / ZnSO4 aq // ZnSO4 aq / Zn (+)
СМ(1) СМ(2)
В топливных элементах энергия, выделяющаяся при горении топлива, превращается в электрическую энергию:
С3Н8 + 5 О2 → 3 СО2 + 4 Н2О.
Классификация гальванических элементов по назначению
Различают элементы, используемые как химические источники тока, и элементы, применяемые для потенциометрических методов анализа.
Гальванический элемент. Устройство батарейки и её работа.
Тема: Как устроена и работает обычная батарейка, гальванический элемент.
В отличие от электростанций, гальванический элемент или привычней говоря — батарейка, огромную мощность не способна дать нам, но без неё невозможно обойтись в тех случаях, когда обычная сеть не доступна либо не целесообразна, так например электронные наручные часы или карманный радиоприёмник. Гальванический элемент — это источник электричества, который основан на химическом взаимодействии некоторых веществ между собой. Он был впервые придуман известным учёным Алессандро Вольта. И так давайте посмотрим, как же на самом деле всё происходит, и разберём устройство батарейки.
Представим, у нас есть стеклянный сосуд, а в него налита серная кислота и опущен цинковый стержень. Поскольку на поверхности пластины находятся положительно заряженные атомы цинка, то в растворе вокруг стержня собираются отрицательные ионы раствора, а положительные ионы раствора выталкиваются в не эту область. Притяжение раствора отрывает ионы цинка, и они становятся уже частью этого раствора. В результате цинковый стержень становится отрицательно заряженным, а раствор положительно. Вот и получили разность потенциалов. И так что получается? При соприкосновении металла и раствора на границе возникает электрическое поле. В момент образования этого поля и происходит непосредственно само превращение химической энергии в электрическую.Что даёт нам возможность её использовать.
Теперь вернёмся к понятию гальванический элемент и устройство батарейки. Мы выяснили, что для преобразования химической энергии в электрическую, необходимо наличие двух разнородных проводника с электронной проводимостью и раствор с ионной проводимостью.
Элемент Вольта состоит из двух разных пластин меди и цинка, опущенных в слабый раствор серной кислоты. Медная пластина становится плюсом, а цинковая, минусом, с разность потенциала этого элемента в 1 вольт. Нужно заметить, что это вырабатываемое в итоге ЭДС, полностью зависит только от материала и от самих химических процессов внутри.
Подсоединив гальванический элемент к обычной лампочке, мы увидим что внутри электроны с цинка начнут переходить на медь, тем самым нарушая равновесие. В итоге на медной пластине начнет, выделятся газообразный водород. Это образование газа весьма негативно влияет на дальнейшую работу элемента, не давая ионам водорода заряжаться, поскольку собой они делают барьер между границей меди и раствора. И это поляризация.
Для борьбы с этим недостатком было придумано иное устройство батарейки. Он получил название — элемент Лекланше. В сосуде с раствором нашатыря, разбавленного водой помещены цинковый стержень и графитовый, для борьбы с поляризацией, графитовый стержень вокруг себя имеет слой двуокиси марганца, назначение которого сводится как раз для поглощения нежелательного газа.
Таким образом гальванический элемент становится намного эффективнее. Именно на таком принципе и делаются большинство батареек, которыми мы с Вами пользуемся. Разница заключается в том, что в различных видах производимых батареек, отличие только в используемых веществах и материалах. Кстати именно эта разница и даёт определённые параметры и характеристики гальваническим элементам. Например, одни могут терять свой заряд постепенно и при этом ЭДС, так же будет, понижаться, а другие батарейки более равномерно отдают энергию и лишь в конце резко теряют заряд.
В настоящее время существует множество различных типов гальванических элементов, к примеру: Марганцево — цинковый, Марганцево — оловянный, Марганцево — магниевый, Свинцово — цинковый, Свинцово — кадмиевый, Свинцово — хлорный, Хром — цинковый, Окисно — ртутно-оловянный, Ртутно — цинковый, Ртутно — кадмиевый и т.д. Кроме внутреннего состава, батарейки также отличаются размерам и, следовательно, ёмкостью заряда.
Не стоит путать гальванический элемент и батарейку с аккумуляторной батареей, в ней совсем иной принцип работы, о котором мы обязательно поговорим в подходящей теме. Ну, а с этой, в общих чертах, думаю разобрались. На этом закончу тему, гальванический элемент, устройство и работа батарейки.
P.S. Сколько полезного может сделать эта карманная электростанция, под названием батарейка.
Какие есть источники постоянного тока
Постоянный ток — электрический ток, который с течением времени не изменяется по величине и направлению.
Постоянный ток — это такой ток, который почти (поскольку ничего идеального в мире нет) не изменяется во времени, ни по величине, ни по направлению. Исторически первые источники постоянного тока были исключительно химическими. Сначала они были представлены только гальваническими элементами, а позже появились и аккумуляторы.
Гальванические элементы и аккумуляторы имеют строго определенную полярность, и направление тока в них самопроизвольно не изменяется, поэтому химические источники тока — это принципиально источники постоянного тока.
Гальванический элемент
Пальчиковая батарейка АА — яркий пример современного гальванического элемента. Цилиндрическая щелочная батарейка ( которую любят называть алкалиновой, тогда как слово «alkaline» переводится как «щелочная») содержит внутри раствор гидроксида калия в качестве электролита. На положительном полюсе батарейки находится диоксид марганца, а на отрицательном — цинк в виде порошка.
Когда внешняя цепь батарейки замыкается на нагрузку, на аноде (отрицательном полюсе) происходит химическая реакция окисления цинка, одновременно с этим на катоде (положительном полюсе) идет реакция восстановления оксида марганца четырехвалентного до оксида марганца трехвалентного.
В результате с отрицательного полюса электроны бегут в сторону положительного полюса через внешнюю цепь нагрузки. Так работает источник постоянного тока — гальванический элемент.
Химический процесс в гальваническом элементе не обратим, то есть пытаться заряжать его бесполезно. Напряжение между полюсами новой пальчиковой батарейки 1,5 вольта, что обусловлено потенциалами веществ, участвующих в химической реакции внутри нее.
Аккумулятор
Литий-ионный аккумулятор, в отличие от батарейки, можно после разрядки снова заряжать, поскольку химический процесс в нем обратим. С виду аккумулятор работает как батарейка, то есть тоже дает в цепь нагрузки принципиально только постоянный ток, но емкость у аккумулятора обычно больше чем у батарейки примерно такого же размера.
В ходе разрядки литиевого аккумулятора, химическая реакция на аноде (отрицательном электроде) состоит в отделении лития от углерода и его переходе в состав соли на катоде (положительном электроде). А при зарядке ионы лития вновь переходят к углероду на аноде.
Разность потенциалов между полюсами литий-ионного аккумулятора может доходить до 4,2 вольт. Максимальный ток зависит от площади взаимодействия электродов внутри аккумулятора с электролитом и соответственно друг с другом.
Генератор
В промышленных масштабах постоянный ток получают при помощи генераторов постоянного тока. Как правило, на статоре такой машины расположены неподвижные магниты либо электромагниты, наводящие во вращающихся контурах ЭДС по закону электромагнитной индукции.
Вращающиеся контуры соединены каждый с контактными пластинами щеточно-коллекторного узла, через которые посредством неподвижных щеток и снимается в цепь нагрузки генерируемый ток. Поскольку контуры контактируют с положительной и отрицательной щетками только при прохождении мимо определенных магнитных полюсов статора, ток во внешней цепи получается выпрямленным переменным, то есть пульсирующим постоянным.
Величина тока зависит от сечения проводов, индукции магнитного поля статора и площади статора. Величина напряжения — от скорости вращения ротора генератора и от индукции магнитного поля статора.
Солнечный элемент
Солнечные батареи также дают постоянный ток. Фотоны солнечного света попадая на фотоэлемент вызывают движение положительно заряженных дырок и отрицательно заряженных электронов через p-n-переход, и во внешней цепи получается таким образом постоянный ток.
Чем больше совокупная площадь фотоэлементов — тем больше электронов и дырок участвуют в образовании тока, тем больший ток можно получить от солнечной батареи. Генерируемое напряжение солнечной батареи зависит от интенсивности солнечного света и от количества соединенных последовательно фотоэлементов, входящих в конструкцию солнечной батареи.
Трансформатор с выпрямителем
Раньше в электронной аппаратуре для получения постоянного тока, при питании от бытовой сети переменного тока, сплошь и рядом использовались блоки питания с трансформаторами на железе. Переменное сетевое напряжение понижалось при помощи трансформатора, а затем выпрямлялось при помощи лампового или диодного выпрямителя.
После выпрямителя в такой схеме всегда стоит фильтр, состоящий как минимум из конденсатора, а в лучшем случае — из конденсатора и дросселя, да еще и транзисторного стабилизатора напряжения, особенно если источник тока должен быть регулируемым.
Напряжение на выходе такого блока питания зависит от количества витков вторичной обмотки трансформатора, а максимальная величина тока — от номинальной мощности трансформатора.
Импульсный блок питания
Сегодня в радиоэлектронной аппаратуре для получения постоянного тока почти не используют блоки питания с низкочастотными трансформаторами на железе, на замену им пришли импульсные блоки питания. В них выпрямленное сетевое напряжение сначала понижается при помощи высокочастотного трансформатора и транзисторных ключей, а затем выпрямляется. Ток направляется через фильтр в конденсатор фильтра.
Конструкция импульсного блока питания получается гораздо меньше размером, чем с трансформатором на железе. Но шумов в выходном токе больше. Поэтому особое внимание при конструировании импульсных блоков питания уделяют фильтрации тока на выходе к нагрузке.
Напряжение на выходе импульсного блока питания зависит от устройства электронной схемы, а максимальный ток — от размера высокочастотного трансформатора и качества находящихся на схеме радиоэлектронных компонентов.
Конденсатор и ионистор
Источником постоянного электрического тока можно назвать в определенном смысле электрический конденсатор. Конденсатор накапливает электрическую энергию в форме постоянного электрического поля между своими обкладками, а затем может отдавать эту энергию в форме постоянного тока или импульсного разряда. И то и другое по сути — постоянный ток, отличающийся лишь длительностью проявления.
Но электролитические конденсаторы сегодня выпускаются на огромные емкости в тысячи и более микрофарад. Особая разновидность конденсатора — ионистор (суперконденсатор) — он занимает промежуточное место между аккумулятором и конденсатором.
Химические процессы в ионисторе протекают практически с такой же скоростью как в конденсаторе, но в отличие от аккумулятора, ионистор обладает меньшим внутренним сопротивлением, что позволяет получать от ионисторов большие постоянные токи на протяжении более длительного времени. Чем больше емкость конденсатора — тем больший по величине и более продолжительный ток можно получить с его помощью.
Ранее ЭлектроВести писали, что встреча глав США и СССР в 1985 году подарила миру один из самых амбициозных технологических проектов: экспериментальный термоядерный реактор ITER («путь»). В Провансе, на юге Франции, тысячи ученых и строителей готовят комплекс для научных экспериментов, способных открыть человечеству дорогу к термоядерным электростанциям будущего.
По материалам: electrik.info.
Создана первая в мире «вечная» батарейка. Она стоит дешевле литиевых аккумуляторов. Видео
, Текст: Эльяс Касми
В США созданы первые прототипы бета-гальванической батареи, способной работать 28 тыс. лет. В ее основе лежит сердечник из переработанных ядерных отходов, но для человека она безопасна за счет покрытия из специальных синтетических алмазов. В России тоже есть подобные батареи, но они работают не дольше 20 лет.
Бесконечный источник энергии
Американские ученые из компании Nano Diamond Battery разработали «вечный» источник питания, способный работать тысячи и даже десятки тысяч лет. Они создали так называемую «бета-гальваническую батарею» (betavoltaic) и, по их заверениям, даже успешно испытали их в лабораторных условиях. В отечественном институте НИТУ «МИСиС» бета-гальванические элементы питания называют бетавольтаическими.
Как сообщил ресурсу New Atlas исполнительный директор Nano Diamond Battery Нима Голшарифи (Nima Golsharifi), одна такая батарейка может работать до 28 тыс. лет. Такой элемент питания может использоваться, по мнению разработчиков, в самых разных видах техники, начиная от носимых устройств и мобильных гаджетов и заканчивая средствами передвижения – поездами, электромобилями и даже самолетами.
Как работают такие батареи
В основе работы бета-гальванических батарей лежит принцип преобразования альфа- и бета-излучений радиоактивного вещества в обычный электрический ток, питающий всю современную технику. Как заверил Нима Голшарифи, созданным компанией источникам энергии можно придавать практически любую форму, другими словами, их можно выпускать в виде привычных многим батареек различных форматов – АА, 18650, CR2032 и др.
Батарейка Nano Diamond Battery может работать тысячелетиями
Конструкция бета-гальванической батареи состоит в первую очередь из радиоактивного сердечника, который выступает в качестве источника изотопов. Нима Голшарифи подчеркнул, что сердечник изготавливается из небольшого количества переработанных ядерных отходов.
Для того чтобы сделать батареи безвредными для людей и окружающей среды, специалисты Nano Diamond Battery покрыли «фонящий» сердечник специальными нерадиоактивными синтетическими алмазами, выращенными в лабораторных условиях. Это очень дешевые в производстве аналоги обычных алмазов.
Изотопы радиоактивного элемента в процессе так называемого «неупругого рассеяния» взаимодействуют с алмазным покрытием, и в итоге энергия бета-излучения преобразуется в электрический ток.
Для чего нужна «вечная» батарея
Столь значительный период работы батарей разработчики объяснили тем, что используемое в качестве сердечника вещество может оставаться радиоактивным сотни и тысячи лет. Они отметили также, что такие батареи могут вырабатывать чрезмерно большое количество энергии, которую они предлагают хранить в дополнительной «буферной» емкости. В качестве такой емкости могут служить суперконденсаторы, а в России, как сообщал CNews, как раз научились изготавливать их из бесполезного сорного растения – борщевика.
Лабораторные испытания
Прототипы бета-гальванических батарей, разработанные в Nano Diamond Battery, были протестированы в двух лабораториях – Кавендишской лаборатории Кембриджского университета и Ливерморской национальной лаборатории им Э. Лоуренса. Результаты испытаний показали, что творение ученых компании обходили другие элементы питания на основе синтетических алмазов – если те демонстрировали 15-процентный прирост эффективности в сравнении с традиционными батареями, включая литий-ионные, то в случае разработки Nano Diamond Battery этот показатель был 40-процентным.
Форму батарее Nano Diamond Battery можно придать любую
В то же время разработчики пока не могут точно сказать, когда элементы питания, основанные на разработанной ими технологии, начнут использоваться повсеместно. Первые версии таких элементов питания, пригодные для повседневного использования, могут появиться в течение двух лет.
Как пандемия изменила подходы к организации рабочего пространства
ИнтеграцияПо их заявлению, использование таких батарей, к примеру, электромобилях намного более эффективно в сравнении с литиевыми. При тех же габаритах они смогут нести в себе большее количество энергии, а использование дешевого искусственного алмаза вместо дорогого лития позволит снизить итоговую стоимость электрокаров.
Тем временем в России
Отечественные специалисты тоже смотрят в сторону атомных портативных элементов питания. К примеру, сотрудники НИТУ «МИСиС» в августе 2020 г. продемонстрировали собственный прототип такой батареи, конструкция которой основана на запатентованной микроканальной 3D-структуре никелевого бета-гальванического элемента. Срок службы такой батарейки – 20 лет.
Особенность трехмерной структуры батарейки заключается в том, что радиоактивный элемент наносится с двух сторон так называемого планарного p-n перехода, что позволяет упростить технологию изготовления элемента, а также контролировать обратный ток, который «крадет» мощность батареи. Особая микроканальная структура обеспечивает увеличение эффективной площади преобразования бета-излучения в 14 раз, что в результате дает общее увеличение тока.
Отечественный вариант бета-гальванической батареи
За счет оригинальной 3D-структуры бета-гальванического элемента размеры батареи, по словам разработчиков, уменьшились втрое, удельная мощность повысилась в 10 раз, а себестоимость снизилась на 50%.
«Выходные электрические параметры предложенной конструкции составили: ток короткого замыкания IКЗ — 230 нА/см2 (в обычной планарной — 24 нА), итоговая мощность — 31 нВт/см2, (в планарной — 3 нВт). Конструкция позволяет на порядок повысить эффективность преобразования энергии, выделяющейся при распаде β-источника, в электроэнергию, что в перспективе снизит себестоимость источника примерно на 50% за счет рационального расходования дорогостоящего радиоизотопа, — отметил один из разработчиков Сергей Леготин, доцент кафедры полупроводниковой электроники и физики полупроводников НИТУ «МИСиС».
Батарейка может быть применена в нескольких функциональных режимах: в качестве аварийного источника питания и датчика температуры в устройствах, используемых при экстремальных температурах и в труднодоступных (или совсем не доступных) местах: в космосе, под водой, в высокогорных районах.
Гальванические элементы. Аккумуляторы | Частная школа. 8 класс
Конспект по физике для 8 класса «Гальванические элементы. Аккумуляторы». Что представляет собой гальванический элемент. Как устроен аккумулятор.
Конспекты по физике Учебник физики Тесты по физике
Гальванические элементы.
Аккумуляторы
Для поддержания тока в проводнике необходимо электрическое поле: на концах проводника нужно постоянно создавать заряды противоположных знаков. На практике такое разделение зарядов обычно осуществляется за счёт химических реакций.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
В конце XVIII в. итальянский физик А. Вольта обнаружил, что при взаимодействии металла с кислотой происходит разделение зарядов. При этом металлическая пластинка, опущенная в раствор кислоты, электризуется отрицательно, а раствор — положительно.
Вольта построил первый химический источник тока, получивший название гальванического элемента (в честь другого итальянского учёного — Л. Гальвани).
Элемент Вольты состоит из цинковой и медной пластинок, опущенных в водный раствор серной кислоты. В результате химических реакций цинковая пластинка заряжается отрицательно, а раствор кислоты и медная пластинка — положительно. Внутри элемента образуется электрическое поле.
Если выводы пластин соединить проводником, то электроны под действием электрического поля начнут двигаться по проводнику, создавая в нём электрический ток. Выводы пластин образуют зажимы, которые называются полюсами.
Элемент Вольты как источник электричества является несовершенным — ток в цепи быстро ослабевает. Поэтому на практике большое распространение получили так называемые сухие гальванические элементы.
Элемент состоит из цинкового сосуда, в который помещён мешочек с двуокисью марганца (МnO2), смешанного с углем. В этот мешочек вставлен угольный стержень, который является положительным полюсом элемента. Отрицательным полюсом является вывод от цинкового сосуда. Вместо раствора элемент содержит густую пасту, состоящую из муки, замешанной на нашатыре.
Обычная плоская батарейка для карманного фонаря состоит из трёх гальванических элементов. При этом угольный стерженёк первого элемента соединён с цинковым сосудом второго, а угольный стерженёк второго соединён соответственно с цинковым сосудом третьего элемента.
Все три элемента помещены в картонную коробку, которая сверху залита слоем изолятора (смолой). Две полоски жести, выведенные через слой изолятора, являются полюсами батареи.
АККУМУЛЯТОРЫ
Срок службы всех гальванических элементов зависит от состояния их электродов (цинка и угля) и качества раствора. С течением времени электроды разрушаются, а качество раствора ухудшается.
Значительно более удобными источниками тока являются аккумуляторы — устройства, у которых электроды практически не разрушаются.
Простейший аккумулятор состоит из прочного сосуда (корпуса), в который залит раствор серной кислоты, и двух свинцовых пластин, опущенных в раствор.
Однако в таком состоянии аккумулятор ещё не будет являться источником тока и в нём необходимо накопить заряд. Для зарядки через аккумулятор пропускают ток от другого источника (зарядного устройства). После зарядки аккумулятор становится источником тока.
Кроме свинцовых (кислотных) аккумуляторов, широкое применение получили железно-никелевые (щелочные) аккумуляторы. Каждая из пластин в таком аккумуляторе (одна железная, а другая из окиси никеля) опущена в раствор едкой щёлочи.
В последние десятилетия наряду с традиционными источниками тока стали широко применяться источники, изготовленные на основе химического элемента лития. Эти источники устойчиво работают в широком диапазоне температур и обладают великолепным — порядка 10 лет и более — сроком службы.
ОБЛАСТИ ПРИМЕНЕНИЯ ИСТОЧНИКОВ ТОКА
Химические источники тока широко применяются в разных областях. Например, аккумуляторы служат для освещения многих транспортных средств, в частности автомобилей, для запуска различных силовых установок, для питания научной аппаратуры и средств связи, устанавливаемых на искусственных спутниках Земли и межпланетных станциях, и т. п.
Широко используемые в настоящее время аккумуляторы для мобильных телефонов — ещё один пример устройств такого типа.
Впечатляет также разнообразие габаритов источников электричества: от миниатюрных батареек для питания ручных часов, лазерных указок, электронных секундомеров и т. д. до мощных аккумуляторных батарей, устанавливаемых на подводных лодках.
Вероятно, первыми гальваническими элементами были найденные при раскопках близ Багдада керамические сосуды, закрытые смоляной пробкой, через которую внутрь сосуда пропущены железные и медные стержни. По оценкам археологов, изготовление этих устройств датируется вторым-третьим тысячелетием до нашей эры. Поразительно и то, что эти устройства «заработали» после того, как в сосуды залили морскую воду.
Луиджи Гальвани (1737—1798) — итальянский врач, один из основателей учения об электричестве, основоположник экспериментальной электрофизиологии.
Вы смотрели Конспект по физике для 8 класса «Гальванические элементы. Аккумуляторы».
Вернуться к Списку конспектов по физике (Оглавление).
Просмотров: 2 081
Гальванический элемент
4. Классификация гальванических элементов
Гальванические первичные элементы — это устройства для прямого преобразования химической энергии, заключенных в них реагентов окислителя и восстановителя, в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Примером гальванического элемента является элемент Даниэля — Якоби.
Широкое распространение получили марганцево-цинковые элементы, не содержащие жидкого раствора электролита сухие элементы, батарейки. Так, в солевых элементах Лекланше: цинковый электрод служит катодом, электрод из смеси диоксида марганца с графитом служит анодом, графит служит токоотводом. Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основе гидроксида калия, обладают целым рядом преимуществ.
Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств.
Вторичные источники тока аккумуляторы — это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая — снова превращается в электрическую.
Одним из наиболее распространённых аккумуляторов является свинцовый или кислотный. Электролитом является 25 — 30 % раствор серной кислоты. Электродами кислотного аккумулятора являются свинцовые решётки, заполненные оксидом свинца, который при взаимодействии с электролитом превращается в сульфат свинца II — PbSO 4.
Также существуют щелочные аккумуляторы: наибольшее применение получили никель-кадмиевые и никель-металлгидридные аккумуляторы, в которых электролитом служит гидроксид калия K-OH.
В различных электронных устройствах, в основном, применяются литий-ионные и литий-полимерные аккумуляторы, характеризующиеся высокой ёмкостью и отсутствием эффекта памяти.
Электрохимические генераторы топливные элементы — это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента, электроды не расходуются. Восстановителем является водород H 2, метанол CH 3 OH, метан CH 4; в жидком или газообразном состоянии. Окислителем обычно является кислород — из воздуха или чистый. В кислородно-водородном топливном элементе с щелочным электролитом, происходит превращение химической энергии в электрическую. Энергоустановки применяются на космических кораблях: они обеспечивают энергией космический корабль и космонавтов.
Как работают гальванические или гальванические элементы
Гальванические или гальванические элементы
Схема электрохимической ячейки с солевым мостиком. Cmx, Лицензия на бесплатную документациюВ электрохимических ячейках протекают окислительно-восстановительные или окислительно-восстановительные реакции. Есть два типа электрохимических ячеек. Самопроизвольные реакции происходят в гальванических (гальванических) ячейках; в электролитических ячейках происходят спонтанные реакции. Оба типа ячеек содержат электроды, на которых происходят реакции окисления и восстановления.Окисление происходит на электроде , анод , а восстановление происходит на электроде , катод .
Электроды и заряд
Анод электролитической ячейки положительный (катод отрицательный), поскольку анод притягивает анионы из раствора. Однако анод гальванического элемента заряжен отрицательно, поскольку самопроизвольное окисление на аноде является источником , электронов или отрицательного заряда элемента.Катод гальванического элемента — это его положительный вывод. Как в гальванических, так и в электролитических ячейках окисление происходит на аноде, и электроны текут от анода к катоду.
Гальванические или гальванические элементы
Окислительно-восстановительная реакция в гальваническом элементе — это спонтанная реакция. По этой причине в качестве батарей обычно используются гальванические элементы. Реакции гальванических элементов поставляют энергию, которая используется для выполнения работы. Энергия используется, помещая реакции окисления и восстановления в отдельные контейнеры, соединенные устройством, которое позволяет электронам течь.Обычный гальванический элемент — это элемент Даниэля.
Ячейки электролитические
Электролитическая ячейка. Тодд ХелменстайнОкислительно-восстановительная реакция в электролитической ячейке протекает неспонтанно. Для инициирования реакции электролиза требуется электрическая энергия. Ниже показан пример электролитической ячейки, в которой расплавленный NaCl подвергается электролизу с образованием жидкого натрия и газообразного хлора. Ионы натрия мигрируют к катоду, где они восстанавливаются до металлического натрия. Точно так же ионы хлора мигрируют к аноду и окисляются с образованием газообразного хлора.Этот тип ячейки используется для производства натрия и хлора. Газообразный хлор может собираться вокруг электролизера. Металлический натрий менее плотен, чем расплав соли, и его удаляют, когда он всплывает в верхнюю часть реакционного контейнера.
2.1: Гальванические элементы — Chemistry LibreTexts
Цели обучения
- Чтобы понять основы гальванических элементов
- Для подключения напряжения от гальванического элемента к основной окислительно-восстановительной системе
В любом электрохимическом процессе электроны переходят от одного химического вещества к другому в результате окислительно-восстановительной (окислительно-восстановительной) реакции.Окислительно-восстановительная реакция происходит, когда электроны переходят от окисляемого вещества к восстанавливаемому. Восстановитель — это вещество, которое теряет электроны и окисляется в процессе; Окислитель — это вещество, которое приобретает электроны и восстанавливается в процессе. Соответствующая потенциальная энергия определяется разностью потенциалов между валентными электронами в атомах разных элементов.
Поскольку восстановление невозможно без окисления и наоборот, окислительно-восстановительная реакция может быть описана как две полуреакции , одна представляет собой процесс окисления, а другая — процесс восстановления.{-}} \ nonumber \]
Каждая полуреакция написана, чтобы показать, что на самом деле происходит в системе; \ (\ ce {Zn} \) — это восстановитель в этой реакции (он теряет электроны), а \ (\ ce {Br2} \) — окислитель (он получает электроны). Сложение двух половинных реакций дает общую химическую реакцию (Уравнение \ (\ PageIndex {1} \)). Окислительно-восстановительная реакция уравновешивается, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Как и любое сбалансированное химическое уравнение, весь процесс электрически нейтрален; то есть чистый заряд одинаков для обеих сторон уравнения.
В любой окислительно-восстановительной реакции количество электронов, потерянных в результате реакции (й) окисления, равно количеству электронов, полученному в результате реакции (й) восстановления.
В большинстве наших обсуждений химических реакций мы предполагали, что реагенты находятся в тесном физическом контакте друг с другом. Кислотно-основные реакции, например, обычно проводят с кислотой и основанием, диспергированными в одной фазе, такой как жидкий раствор. Однако с помощью окислительно-восстановительных реакций можно физически разделить полуреакции окисления и восстановления в космосе, если существует полная цепь, включая внешнее электрическое соединение, такое как провод, между двумя полуреакциями.По мере развития реакции электроны текут от восстановителя к окислителю по этому электрическому соединению, производя электрический ток, который можно использовать для выполнения работы. Устройство, которое используется для выработки электричества в результате спонтанной окислительно-восстановительной реакции или, наоборот, которое использует электричество для запуска неспонтанной окислительно-восстановительной реакции, называется электрохимической ячейкой .
Есть два типа электрохимических ячеек: гальванические ячейки и электролитические ячейки. Гальванические клетки названы в честь итальянского физика и врача Луиджи Гальвани (1737–1798), который наблюдал, как рассеченные мышцы ног лягушки подергивались при применении небольшого электрического разряда, демонстрируя электрическую природу нервных импульсов.Гальванический (гальванический) элемент использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции (\ (ΔG <0 \)), для выработки электричества. Этот тип электрохимического элемента часто называют гальваническим элементом в честь его изобретателя, итальянского физика Алессандро Вольта (1745–1827). Напротив, электролитическая ячейка потребляет электроэнергию от внешнего источника, используя ее, чтобы вызвать несамопроизвольную окислительно-восстановительную реакцию (\ (ΔG> 0 \)). Оба типа содержат два электрода , которые представляют собой твердые металлы, подключенные к внешней цепи, которая обеспечивает электрическое соединение между двумя частями системы (рисунок \ (\ PageIndex {1} \)).Полуреакция окисления происходит на одном электроде (анод ), а полуреакция восстановления происходит на другом (катод ). Когда цепь замкнута, электроны текут от анода к катоду. Электроды также соединены электролитом, ионным веществом или раствором, который позволяет ионам перемещаться между отсеками электродов, тем самым поддерживая электрическую нейтральность системы. В этом разделе мы сосредоточимся на реакциях, происходящих в гальванических элементах.
Рисунок \ (\ PageIndex {1} \): Электрохимические ячейки. Гальванический элемент (слева) преобразует энергию, выделяемую в результате спонтанной окислительно-восстановительной реакции, в электрическую энергию, которую можно использовать для выполнения работы. Окислительные и восстановительные полуреакции обычно протекают в отдельных отсеках, которые соединены внешней электрической цепью; Кроме того, второе соединение, которое позволяет ионам перемещаться между отсеками (показано здесь вертикальной пунктирной линией, обозначающей пористый барьер), необходимо для поддержания электрической нейтральности.Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток. В электролитической ячейке (справа) внешний источник электроэнергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только один отсек. В обоих типах электрохимических ячеек анод является электродом, на котором происходит полуреакция окисления, а катод является электродом, на котором происходит полуреакция восстановления.{2+} (водн.) + Cu (s)} \ label {20.3.4} \]Мы можем вызвать эту реакцию, вставив цинковый стержень в водный раствор сульфата меди (II). По мере протекания реакции цинковый стержень растворяется, и образуется масса металлической меди. Эти изменения происходят спонтанно, но вся выделяемая энергия находится в форме тепла, а не в форме, которую можно использовать для выполнения работы.
Рисунок \ (\ PageIndex {2} \): Реакция металлического цинка с водными ионами меди (II) в одном отсеке.{2 +}} \) ионов в растворе уменьшается (Рисунок \ (\ PageIndex {3b} \)). Таким образом, мы провели ту же реакцию, что и с использованием одного химического стакана, но на этот раз окислительная и восстановительная полуреакции физически отделены друг от друга. Электроны, которые высвобождаются на аноде, проходят через провод, создавая электрический ток. Таким образом, гальванические элементы преобразуют химическую энергию в электрическую, которую затем можно использовать для работы. Рисунок \ (\ PageIndex {3} \): Реакция металлического цинка с водными ионами меди (II) в гальванической ячейке.(a) Гальванический элемент можно сконструировать, поместив медную полоску в стакан, содержащий 1 М водный раствор ионов Cu 2 + , и полоску цинка в другой стакан, содержащий 1 М водный раствор Zn. 2 + ионов. Две металлические полоски соединены проводом, пропускающим электричество, а химические стаканы соединены солевым мостиком. Когда переключатель замыкается для замыкания цепи, цинковый электрод (анод) самопроизвольно окисляется до ионов Zn 2 + в левом отсеке, а ионы Cu 2 + одновременно восстанавливаются до металлической меди при медный электрод (катод).(b) По мере развития реакции анод из Zn теряет массу, растворяясь, с образованием ионов Zn 2 + (водн.), в то время как катод Cu набирает массу по мере восстановления ионов Cu 2 + (водн.). с металлической медью, которая нанесена на катод.Электролит в солевом мостике служит двум целям: он замыкает цепь, неся электрический заряд, и поддерживает электрическую нейтральность в обоих растворах, позволяя ионам перемещаться между ними. Идентичность соли в солевом мостике не имеет значения, пока составляющие ионы не вступают в реакцию или не подвергаются окислительно-восстановительной реакции в рабочих условиях ячейки.{2 +}} \) решение. В отсутствие солевого мостика или какого-либо другого подобного соединения реакция быстро прекратится, поскольку электрическая нейтральность не может быть сохранена.
Вольтметр можно использовать для измерения разницы электрических потенциалов между двумя отсеками. Открытие переключателя, который соединяет провода с анодом и катодом, предотвращает протекание тока, поэтому химическая реакция не происходит. Однако при замкнутом переключателе внешняя цепь замкнута, и электрический ток может течь от анода к катоду.Потенциал (\ (E_ {cell} \)) ячейки, измеренный в вольтах, представляет собой разность электрического потенциала между двумя половинными реакциями и связан с энергией, необходимой для перемещения заряженной частицы в электрическом поле. . В описанной нами ячейке вольтметр показывает потенциал 1,10 В (рисунок \ (\ PageIndex {3a} \)). Поскольку электроны из полуреакции окисления высвобождаются на аноде, анод в гальваническом элементе заряжается отрицательно. Катод, притягивающий электроны, заряжен положительно.
Не все электроды подвергаются химическому превращению во время окислительно-восстановительной реакции. Электрод может быть изготовлен из инертного металла с высокой проводимостью, такого как платина, чтобы предотвратить его реакцию во время окислительно-восстановительного процесса, где он не проявляется в общей электрохимической реакции. Это явление проиллюстрировано в Примере \ (\ PageIndex {1} \).
Гальванический (гальванический) элемент преобразует энергию, выделяемую в результате спонтанной химической реакции , в электрическую энергию.Электролитическая ячейка потребляет электрическую энергию от внешнего источника для запуска несамопроизвольной химической реакции .
Пример \ (\ PageIndex {1} \)
Химик построил гальванический элемент, состоящий из двух стаканов. В одном стакане находится полоска олова, погруженная в водный раствор серной кислоты, а в другом — платиновый электрод, погруженный в водный раствор азотной кислоты. Два раствора соединены солевым мостиком, а электроды соединены проволокой.{2+} (водн.) + 2НО (г) + 4х3О (л)} \ nonumber \]
Для гальванического элемента
- запишите половину реакции, которая происходит на каждом электроде.
- указывают, какой электрод является катодом, а какой — анодом.
- указывают, какой электрод является положительным электродом, а какой — отрицательным.
Дано: гальванический элемент и окислительно-восстановительная реакция
Запрошено: полуреакций, идентичность анода и катода и назначение электродов как положительное или отрицательное
Стратегия:
- Укажите полуреакцию окисления и полуреакцию восстановления.Затем определите анод и катод по полуреакции, которая происходит на каждом электроде.
- По направлению потока электронов назначьте каждый электрод положительным или отрицательным.
Решение
A В полуреакции восстановления нитрат восстанавливается до оксида азота. (Оксид азота затем реагировал бы с кислородом воздуха с образованием NO 2 с его характерным красно-коричневым цветом.) В полуреакции окисления металлическое олово окисляется.{-}} \ nonumber \]
Таким образом, нитрат восстанавливается до NO, а оловянный электрод окисляется до Sn 2 + .
Поскольку реакция восстановления происходит на платиновом электроде, это катод. И наоборот, реакция окисления происходит на оловянном электроде, поэтому это анод.
B Электроны текут от оловянного электрода через проволоку к платиновому электроду, где переходят в нитрат. Электрическая цепь замыкается солевым мостиком, который обеспечивает диффузию катионов к катоду и анионов к аноду.{-}} \ end {align *} \]
Pt электрод в растворе перманганата является катодом; в растворе олова — анод.
Катод (электрод в стакане с раствором перманганата) положительный, а анод (электрод в стакане, содержащий раствор олова) — отрицательный.
Построение диаграмм ячеек (нотация ячеек)
Поскольку описать словами любой гальванический элемент довольно сложно, были разработаны более удобные обозначения.В этой линейной нотации, называемой диаграммой ячейки, идентичность электродов и химический состав отсеков указываются их химическими формулами, причем анод написан в крайнем левом углу, а катод — в крайнем правом углу. Фазовые границы показаны одиночными вертикальными линиями, а солевой мостик, имеющий две фазовые границы, — двойной вертикальной линией. Таким образом, диаграмма ячейки для ячейки \ (\ ce {Zn / Cu} \), показанная на рисунке \ (\ PageIndex {3a} \), записывается следующим образом:
Рисунок \ (\ PageIndex {4} \): диаграмма ячеек включает концентрации раствора, если они указаны.Термин + M предназначен для обозначения подходящей концентрации вида. Если разновидностью является газ, вместо этого вы подставляете давление.Гальванические элементы могут иметь другое устройство, отличное от примеров, которые мы видели до сих пор. Например, напряжение, создаваемое окислительно-восстановительной реакцией, можно более точно измерить, используя два электрода, погруженные в один стакан, содержащий электролит, замыкающий цепь. Такое расположение уменьшает ошибки, вызванные сопротивлением потоку заряда на границе, называемым потенциалом перехода . {2 +} (aq) \, || \, HNO3 (aq) \, | \, NO (g) \, | \, Pt_ ( s)} \ nonumber \]
Концентрации раствора не указаны, поэтому они не включены в эту диаграмму ячеек.+ (aq, \; 1 \, M) \, | \, Ag (s)} \ nonumber \]
Сводка
Гальванический (гальванический) элемент использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции, для выработки электричества, тогда как электролитический элемент потребляет электрическую энергию от внешнего источника, чтобы вызвать реакцию. Электрохимия — это изучение взаимосвязи между электричеством и химическими реакциями. Реакция окисления-восстановления, которая происходит во время электрохимического процесса, состоит из двух полуреакций, одна представляет собой процесс окисления, а другая — процесс восстановления.Сумма полуреакций дает общую химическую реакцию. Общая окислительно-восстановительная реакция уравновешивается, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Электрический ток создается потоком электронов от восстановителя к окислителю. Электрохимическая ячейка может либо генерировать электричество в результате спонтанной окислительно-восстановительной реакции, либо потреблять электричество для запуска несамопроизвольной реакции. В гальваническом (гальваническом) элементе энергия спонтанной реакции генерирует электричество, тогда как в электролитическом элементе электрическая энергия расходуется для запуска неспонтанной окислительно-восстановительной реакции.Оба типа ячеек используют два электрода, которые обеспечивают электрическое соединение между системами, разделенными в пространстве. Окислительная полуреакция происходит на аноде, а восстановительная полуреакция происходит на катоде. Солевой мостик соединяет разделенные растворы, позволяя ионам перемещаться в любой раствор, обеспечивая электрическую нейтральность системы. Вольтметр — это устройство, которое измеряет поток электрического тока между двумя полуреакциями. Потенциал ячейки, измеряемый в вольтах, — это энергия, необходимая для перемещения заряженной частицы в электрическом поле.Электрохимическая ячейка может быть описана с использованием линейных обозначений, называемых диаграммой ячейки, в которой вертикальные линии указывают границы фаз и расположение солевого мостика. Сопротивление потоку заряда на границе называется потенциалом перехода.
Электролитические ячейки — Химия LibreTexts
Вольтаические элементы приводятся в действие спонтанной химической реакцией , в результате которой через внешнюю цепь образуется электрический ток. Эти элементы важны, потому что они являются основой для батарей, питающих современное общество.Но это не единственный вид электрохимической ячейки. В каждом случае обратная реакция не является спонтанной , и для ее возникновения требуется электрическая энергия.
Введение
Общий вид реакции можно записать как:
\ [\ underset {\ longleftarrow \ text {Non spontaneous}} {\ overset {\ text {Spontaneous} \ longrightarrow} {\ text {Reactants} \ rightleftharpoons \ text {Products} + \ text {Электрическая энергия}}} \ ]
Можно сконструировать ячейку, которая работает с химической системой, пропуская через систему электрический ток.Эти ячейки называются электролитическими ячейками . Электролитические элементы, как и гальванические элементы, состоят из двух полуэлементов: один — полуэлемент восстановления, другой — полуэлемент окисления. Однако направление потока электронов в электролитических ячейках может быть изменено на противоположное по сравнению с направлением спонтанного потока электронов в гальванических элементах, но определение катода и анода остается прежним, где восстановление происходит на катоде, а окисление происходит на аноде. . Поскольку направления обеих полуреакций поменялись местами, изменился знак, но не величина потенциала клетки.
Электролитические ячейки очень похожи на гальванические (гальванические) ячейки в том смысле, что оба требуют солевого моста, оба имеют катодную и анодную стороны, и оба имеют постоянный поток электронов от анода к катоду. Однако между двумя ячейками есть и разительные различия. Основные отличия указаны ниже:
Рисунок \ (\ PageIndex {1} \): Электрохимические ячейки. Гальванический элемент (слева) преобразует энергию, выделяемую в результате спонтанной окислительно-восстановительной реакции, в электрическую энергию, которую можно использовать для выполнения работы.Окислительные и восстановительные полуреакции обычно протекают в отдельных отсеках, которые соединены внешней электрической цепью; Кроме того, второе соединение, которое позволяет ионам перемещаться между отсеками (показано здесь вертикальной пунктирной линией, обозначающей пористый барьер), необходимо для поддержания электрической нейтральности. Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток.В электролитической ячейке (справа) внешний источник электроэнергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только один отсек. В обоих типах электрохимических ячеек анод является электродом, на котором происходит полуреакция окисления, а катод является электродом, на котором происходит полуреакция восстановления.
| Электрохимический элемент (гальванический элемент) | Ячейка электролитическая |
|---|---|
| Гальванический элемент преобразует химическую энергию в электрическую. | Электролитическая ячейка преобразует электрическую энергию в химическую. |
| Здесь окислительно-восстановительная реакция является спонтанной и отвечает за производство электроэнергии. | Окислительно-восстановительная реакция не является спонтанной, и для ее инициирования необходимо подавать электрическую энергию. |
| Две полуячейки размещены в разных контейнерах и соединены соляным мостиком или пористой перегородкой. | Оба электрода помещены в одну емкость в растворе расплавленного электролита. |
| Здесь анод отрицательный, а катод положительный. Реакция на аноде является окислительной, а на катоде — восстановительной. | Здесь анод положительный, а катод отрицательный. Реакция на аноде является окислительной, а на катоде — восстановительной. |
| Электроны поставляются окисляющимися частицами.Они перемещаются от анода к катоду во внешней цепи. | Внешняя батарея питает электроны. Они входят через катод и выходят через анод. |
Ячейки электролитические
Чтобы объяснить, что происходит в электролитической ячейке, давайте рассмотрим разложение расплавленного хлорида натрия на металлический натрий и газообразный хлор. Реакция написана ниже.
|
———> Несамопроизвольно (электролитическая ячейка) |
||||
|
2 Na Cl (л) |
2 Na (с) |
+ |
Класс 2 (г) |
|
|
<--------- Самопроизвольное (электрохимическая ячейка) |
||||
Если расплавленный \ (NaCl _ {(l)} \) помещается в контейнер и вставляются инертные электроды \ (C _ {(s)} \), прикрепленные к положительной и отрицательной клеммам батареи, произойдет электролитическая реакция.- \]
Прогнозирование реакции электролиза
Есть четыре основных фактора, которые определяют, будет ли проводиться электролиз, даже если внешнее напряжение превышает расчетную величину:
- Перенапряжение или превышение напряжения иногда необходимо для преодоления взаимодействий на поверхности электрода.Чаще это случается с газами. Например. H 2 (g) требует перенапряжения 1,5 В, в то время как Pt (s) требует перенапряжения 0 В
- Может иметь место более одной электродной реакции, что означает, что может быть более одной полуреакции, оставляя две или более возможностей для реакции ячейки.
- Реагенты могут находиться в нестандартных условиях, что означает, что напряжение для полуэлементов может быть меньше или больше, чем количество в стандартных условиях.Например:
- Концентрация хлорид-иона = 5,5M, а не единица активности 1M. Это означает, что уменьшение хлорида = 1,31 В, а не 1,36 В
- Стандартное условие — иметь pH 4 в анодной полуячейке, но иногда в нестандартных состояниях pH может быть выше или ниже при изменении напряжения.
- Способность инертного электрода к электролизу зависит от реагентов в растворе электролита, в то время как активный электрод может работать сам по себе для проведения полуреакции окисления или восстановления.
Если учесть все четыре фактора, мы сможем успешно предсказать полуреакции электрода и общие реакции при электролизе.
Упражнение \ (\ PageIndex {1} \)
Предскажите электродные реакции и общую реакцию, когда анод сделан из (а) меди и (б) платины.
Количественные аспекты электролиза
Майкл Фарадей в 1833 году обнаружил, что всегда существует простая взаимосвязь между количеством вещества, производимого или потребляемого на электроде во время электролиза, и количеством электрического заряда Q , который проходит через элемент.- \ rightarrow Ag \]
говорит нам, что когда 1 моль Ag + наносится на 1 моль Ag, с катода должен поступать 1 моль e —. Поскольку отрицательный заряд одного электрона, как известно, равен 1,6022 × 10 –19 Кл, мы можем умножить его на постоянную Авогадро, чтобы получить заряд на моль электронов. Эта величина называется Константа Фарадея , символ F :
.F = 1,6022 × 10 –19 C × 6,0221 × 10 23 моль –1 = 9.-} \) и \ (Q \).
Часто в экспериментах по электролизу измеряется электрический ток, а не количество электрического заряда. Поскольку кулонов определяется как количество заряда, которое проходит через фиксированную точку в электрической цепи, когда ток в один ампер течет в течение одной секунды, заряд в кулонах можно рассчитать, умножив измеренный ток (в амперах) на время (в секундах), в течение которого он течет:
\ [Q = It \]
В этом уравнении I представляет ток, а t представляет время.Если вы помните, что
кулон = 1 ампер × 1 секунда 1 C = 1 А с
можно настроить единицы времени для получения правильного результата. Теперь, когда мы можем предсказать полуреакции электрода и общие реакции при электролизе, также важно уметь рассчитывать количество потребляемых реагентов и произведенных продуктов. Для этих расчетов мы будем использовать постоянную Фарадея:
1 моль электрона = 96,485 C
заряд ( C ) = ток ( C / с ) x время (с)
( Кл / с ) = 1 кулон заряда в секунду = 1 ампер ( A )
Простое преобразование для любого типа проблемы:
- Преобразование любого заданного времени в секунды
- Возьмите заданный ток ( A ) в секундах, [1 c = (A) / (s)]
- Наконец, используйте преобразование стехиометрии: 1 моль электрона = 96 485 ° C (постоянная Фарадея)
Пример \ (\ PageIndex {1} \)
Электролиз растворенного образца брома можно использовать для определения количества брома в образце.- \]. Какую массу брома можно отложить за 3 часа при токе 1,18 А?
Решение :
3,00 часа x 60 мин / час x 60 сек / 1 мин x 1,18 C (A) /1 сек x 1 моль e — /96 485 C
= 0,132 моль —
Проблемы
1) Предскажите продукты электролиза, заполнив график:
Cl — , Br — , I — , H + , OH — , Cu 2+ , Pb 2+ , Ag +, K + , Na + ,
2) Рассчитайте количество электрического заряда, необходимого для пластины 1.386 моль Cr из кислого раствора K 2 Cr 2 O 7 согласно полууравнению
H 2 Cr 2 O 7 ( водн. ) + 12H + ( водн. ) + 12 e — → 2Cr ( s ) + 7 H 2 O ( л )
3) Пероксид водорода, H 2 O 2 , может быть получен электролизом холодной концентрированной серной кислоты. Реакция на аноде
2H 2 SO 4 → H 2 S 2 O 8 + 2H + + 2 e —
Когда полученная пероксидисерная кислота, H 2 S 2 O 8 , кипятится при пониженном давлении, она разлагается:
2H 2 O + H 2 S 2 O 8 → 2H 2 SO 4 + H 2 O 2
Рассчитайте массу перекиси водорода, образовавшейся при токе 0.893 потока за 1 час.
4) Электролиз растворенного образца холрида можно использовать для определения количества хлорида в образце. На катоде полуреакция восстановления составляет Cl 2 + (водн.) + 2 e — -> 2 Cl — . Какую массу хлорида можно отложить за 6,25 часа током 1,11 А?
5) В электролитической ячейке электрод, на котором электроны входят в раствор, называется ______; химическое изменение, которое происходит на этом электроде, называется _______.
- анод, оксидирование
- анод, редуктор
- катод, оксидирование
- катод, редукция
- не может сказать, если мы не знаем, какие виды окисляются и восстанавливаются.
6) Как долго (в часах) должен поддерживаться ток 5,0 ампер на гальванической пластине 60 г кальция из расплавленного CaCl 2 ?
- 27 часов
- 8,3 часа
- 11 часов
- 16 часов
- 5.9 часов
- 7) Сколько времени в часах потребуется для гальванического нанесения 78 г платины из раствора [PtCl 6 ] 2 — при среднем токе 10 ампер при КПД электрода 80%?
- 8,4
- 5,4
- 16,8
- 11,2
- 12,4
8) Сколько фарадеев необходимо для восстановления 1,00 г алюминия (III) до металлического алюминия?
- 1.00
- 1,50
- 3,00
- 0,111
- 0,250
9) Найдите стандартный потенциал ячейки для электрохимической ячейки с помощью следующей реакции ячейки.
Zn (тв.) + Cu 2+ (водн.) → Zn 2+ (водн.) + Cu (т.)
ответы
1) . Cl — хлор H + водород
Cl — хлор Cu 2+ медь
I — йод H + Водород
2) 12 моль e — требуется для получения 2 моль Cr, что дает нам стехиометрическое соотношение S ( e — / Cr).Затем можно использовать постоянную Фарадея для определения количества заряда.
n Cr n e — Q
Q = 1,386 моль Cr × × = 8,024 × 10 5 C
3) Произведение тока и времени дает нам количество электричества Q . Зная это, мы легко вычисляем количество электронов: n e -. Затем из первого полууравнения мы можем найти количество пероксидисерной кислоты, а второе приводит к n h3O2 и, наконец, к m h3O2 .
= 05666 × г H 2 O 2 = 0,5666 г H 2 O 2
4) 0,259 моль —
5) д
6) д
7) б
8) д
9) Напишите полуреакции для каждого процесса.
Zn (s) → Zn 2+ (водн.) + 2 e —
Cu 2+ (водн.) + 2 e — → Cu (т.)
Найдите стандартные потенциалы полуреакции восстановления.
E o восстановление Cu2 + = + 0,339 V
E o восстановление Zn2 + = — 0,762 В
Определите общий потенциал стандартной ячейки.
E o ячейка = + 1,101 V
Список литературы
- Петруччи и др. Общая химия: принципы и современные приложения. 9 изд. Река Аппер Сэдл, Нью-Джерси: Pearson / Prentice Hall, 2007.
- Кольбе, Германн. Электролиз органических соединений.Эдинбург: Э. и С. Ливингстон, 1947.
- Стюарт, A.T. «Электролиз воды». Производство водорода 13 мая 2001 г.
- Также все упомянутые «внешние ссылки».
Авторы и авторство
- Jasmine Briones, Калифорнийский университет в Дэвисе, 2012 г.,
гальванических элементов | Введение в химию
Цель обучения
- Напомним, что восстановление происходит на катоде, а окисление происходит на аноде в гальваническом элементе
Ключевые моменты
- Окисление описывает потерю электронов молекулой, атомом или ионом.
- Редукция описывает усиление электронов молекулой, атомом или ионом.
- Электроны всегда текут от анода к катоду.
- Полуячейки соединены солевым мостиком, который позволяет ионам в растворе перемещаться из одной полуячейки в другую, так что реакция может продолжаться.
Условия
- гальванический элемент Ячейка, например, в батарее, в которой в результате необратимой химической реакции вырабатывается электричество; аккумулятор, который нельзя перезарядить.
- редокс — обратимая химическая реакция, в которой одна реакция — окисление, а обратная — восстановление.
- полуэлемент Любая из двух частей электрохимического элемента, содержащего электрод и электролит.
Электрохимическая ячейка — это устройство, вырабатывающее электрический ток из энергии, выделяющейся в результате спонтанной окислительно-восстановительной реакции. Этот вид ячейки включает гальваническую или гальваническую ячейку, названную в честь Луиджи Гальвани и Алессандро Вольта. Эти ученые провели несколько экспериментов с химическими реакциями и электрическим током в конце 18 века.
Электрохимические ячейки имеют два проводящих электрода, называемых анодом и катодом. Анод определяется как электрод, на котором происходит окисление. Катод — это электрод, на котором происходит восстановление. Электроды могут быть изготовлены из любых достаточно проводящих материалов, таких как металлы, полупроводники, графит и даже проводящие полимеры. Между этими электродами находится электролит, содержащий ионы, которые могут свободно перемещаться.
В гальванической ячейке используются два разных металлических электрода, каждый в растворе электролита.Анод подвергнется окислению, а катод — восстановлению. Металл анода окислится, переходя от степени окисления 0 (в твердой форме) к положительной степени окисления, и он станет ионом. На катоде ион металла в растворе будет принимать один или несколько электронов от катода, и степень окисления иона снизится до 0. Это образует твердый металл, который откладывается на катоде. Два электрода должны быть электрически соединены друг с другом, чтобы обеспечить поток электронов, который покидает металл анода и проходит через это соединение к ионам на поверхности катода.Этот поток электронов представляет собой электрический ток, который можно использовать для работы, например, для поворота двигателя или включения света.
Пример реакции
Принцип действия гальванического элемента — это одновременная реакция окисления и восстановления, называемая окислительно-восстановительной реакцией. Эта окислительно-восстановительная реакция состоит из двух полуреакций. В типичном гальваническом элементе окислительно-восстановительная пара — это медь и цинк, представленные в следующих полуэлементных реакциях:
Цинковый электрод (анод): Zn (s) → Zn 2+ (водн.) + 2 e —
Медный электрод (катод): Cu 2+ (водн.) + 2 e — → Cu (s)
Ячейки построены в отдельных стаканах.Металлические электроды погружены в растворы электролита. Каждая полуячейка соединена солевым мостиком, который обеспечивает свободный перенос ионных частиц между двумя клетками. Когда цепь замкнута, ток течет, и ячейка «производит» электрическую энергию.
Гальваническая или гальваническая ячейка Ячейка состоит из двух полуэлементов, соединенных солевым мостиком или проницаемой мембраной. Электроды погружены в растворы электролита и подключаются через электрическую нагрузку.- \ rightarrow Cu [/ латекс]). Во время реакции будет использоваться цинковый электрод, и металл будет уменьшаться в размерах, в то время как медный электрод станет больше из-за образовавшейся осажденной меди. Солевой мостик необходим, чтобы заряд не проходил через элемент. Без солевого мостика электроны, образующиеся на аноде, будут накапливаться на катоде, и реакция прекратится.Гальванические элементы обычно используются в качестве источника электроэнергии. По своей природе они производят постоянный ток.Батарея — это набор гальванических элементов, соединенных параллельно. Например, свинцово-кислотная батарея имеет элементы с анодами из свинца и катодами из диоксида свинца.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
электрохимических ячеек | Безграничная химия
Гальванические элементы
Гальванический элемент — это устройство, которое вырабатывает электрический ток из энергии, выделяемой в результате спонтанной окислительно-восстановительной реакции в двух полуячейках.
Цели обучения
Напомним, что восстановление происходит на катоде, а окисление происходит на аноде в гальваническом элементе
Основные выводы
Ключевые моменты
- Окисление описывает потерю электронов молекулой, атомом или ионом.
- Редукция описывает усиление электронов молекулой, атомом или ионом.
- Электроны всегда текут от анода к катоду.
- Полуячейки соединены солевым мостиком, который позволяет ионам в растворе перемещаться из одной полуячейки в другую, так что реакция может продолжаться.
Ключевые термины
- редокс : обратимая химическая реакция, в которой одна реакция является окислением, а обратная — восстановлением.
- полуэлемент : любая из двух частей электрохимической ячейки, содержащая электрод и электролит.
- гальванический элемент : Элемент, например аккумулятор, в котором в результате необратимой химической реакции вырабатывается электричество; аккумулятор, который нельзя перезарядить.
Электрохимическая ячейка — это устройство, вырабатывающее электрический ток из энергии, выделяющейся в результате спонтанной окислительно-восстановительной реакции.Этот вид ячейки включает гальваническую или гальваническую ячейку, названную в честь Луиджи Гальвани и Алессандро Вольта. Эти ученые провели несколько экспериментов с химическими реакциями и электрическим током в конце 18 века.
Электрохимические ячейки имеют два проводящих электрода, называемых анодом и катодом. Анод определяется как электрод, на котором происходит окисление. Катод — это электрод, на котором происходит восстановление. Электроды могут быть изготовлены из любых достаточно проводящих материалов, таких как металлы, полупроводники, графит и даже проводящие полимеры.Между этими электродами находится электролит, содержащий ионы, которые могут свободно перемещаться.
В гальванической ячейке используются два разных металлических электрода, каждый в растворе электролита. Анод подвергнется окислению, а катод — восстановлению. Металл анода окислится, переходя от степени окисления 0 (в твердой форме) к положительной степени окисления, и он станет ионом. На катоде ион металла в растворе будет принимать один или несколько электронов от катода, и степень окисления иона снизится до 0. — [/ latex]), которые проходят через провод к медному катоду.- \ rightarrow \ text {Cu} [/ latex]). Во время реакции будет использоваться цинковый электрод, и металл будет уменьшаться в размерах, в то время как медный электрод станет больше из-за образовавшейся осажденной меди. Солевой мостик необходим, чтобы заряд не проходил через элемент. Без солевого мостика электроны, образующиеся на аноде, будут накапливаться на катоде, и реакция прекратится.
Гальванические элементы обычно используются в качестве источника электроэнергии. По своей природе они производят постоянный ток.Батарея — это набор гальванических элементов, соединенных параллельно. Например, свинцово-кислотная батарея имеет элементы с анодами из свинца и катодами из диоксида свинца.
Ячейки электролитические
Электролиз использует электрическую энергию, чтобы вызвать химическую реакцию, которая затем происходит в электролитической ячейке.
Цели обучения
Вспомните три компонента, необходимые для создания электролитической ячейки
Основные выводы
Ключевые моменты
- Электрометаллургия — это процесс восстановления металлов из металлических соединений для получения металла в чистой форме с помощью электролиза.
- Электролиз иногда можно рассматривать как работу гальванического элемента, не являющегося самопроизвольным.
- Электроды из металла, графита и полупроводников широко используются в электролизе.
- Другие системы, в которых используется электролитический процесс, используются для производства металлического натрия и калия, газообразного хлора, гидроксида натрия и хлората калия и натрия.
Ключевые термины
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
- электролитический : Относящийся к электролизу или использующий его.
В химии и производстве электролиз — это метод использования постоянного электрического тока (DC) для запуска в противном случае не спонтанной химической реакции. Электролиз является коммерчески важным этапом в процессе отделения элементов из природных источников, таких как руда.
Электролиз — это прохождение постоянного электрического тока через ионное вещество, которое либо расплавлено, либо растворено в подходящем растворителе, что приводит к химическим реакциям на электродах и разделению материалов.
Электролиз иногда можно рассматривать как запуск несамопроизвольного гальванического элемента. В зависимости от того, насколько свободно элементы отдают электроны (окисление) и насколько энергетически выгодно элементам получать электроны (восстановление), реакция может не быть спонтанной. Путем подачи извне энергии для преодоления энергетического барьера спонтанной реакции желаемая реакция «разрешается» протекать при особых обстоятельствах.
Основные компоненты, необходимые для проведения электролиза:
- Электролит: вещество, содержащее свободные ионы, переносящие электрический ток.Если ионы неподвижны, как в твердой соли, то электролиз не может происходить.
- Источник постоянного тока (DC): обеспечивает энергию, необходимую для создания или разряда ионов в электролите. Электрический ток переносится электронами во внешней цепи.
- Два электрода: электрический проводник, который обеспечивает физический интерфейс между электрической цепью, обеспечивающей энергию, и электролитом.
Типичная электролизная ячейка : Ячейка, используемая в элементарных химических экспериментах для получения газа в качестве продукта реакции и для измерения его объема.
Широко используются электроды из металла, графита и полупроводников. Выбор подходящего электрода зависит от химической активности электрода и электролита, а также от стоимости производства.
Другие системы, в которых используется электролитический процесс, используются для производства металлического натрия и калия, газообразного хлора, гидроксида натрия и хлората калия и натрия.
Обозначение электрохимической ячейки
Обозначение ячейки — это сокращение, которое выражает определенную реакцию в электрохимической ячейке.
Цели обучения
Создание соответствующей записи электрохимической ячейки для данной электрохимической реакции
Основные выводы
Ключевые моменты
- Анод ячейки и катод (полуэлементы) разделены двумя полосами или косыми чертами, которые представляют собой солевой мостик.
- Анод расположен слева, а катод — справа.
- Отдельные твердые, жидкие или водные фазы в каждой полуячейке написаны разделенными одной полосой.
- Концентрации растворенных веществ могут быть указаны в скобках после обозначения фазы (s, l, g или aq).
Ключевые термины
- полуэлемент : любая из двух частей электрохимической ячейки, содержащая электрод и электролит.
- электрод : Клемма, через которую электрический ток проходит между металлическими и неметаллическими частями электрической цепи. При электролизе электроды помещают в раствор отдельно.\ text {o} _ {\ text {окисление}} [/ latex]
Обозначения ячеек — это сокращенное описание гальванических или гальванических (спонтанных) ячеек. Условия реакции (давление, температура, концентрация и т. Д.), Анод, катод и компоненты электрода описаны в этом уникальном сокращении.
Напомним, что окисление происходит на аноде, а восстановление происходит на катоде. Когда анод и катод соединены проволокой, электроны текут от анода к катоду.
Типичный гальванический элемент : Типичное расположение полуэлементов, соединенных в гальванический элемент.- \ rightleftharpoons 2 \ text {Ag} (\ text {s}) [/ latex]
Правила обозначения ячеек
1. Сначала описывается анодный полуэлемент; следует катодная полуячейка. В пределах данной полуячейки сначала указываются реагенты, а последними — продукты. Описание реакции окисления идет первым, а реакция восстановления — последним; когда вы его читаете, ваши глаза движутся в направлении потока электронов. Ионы зрителя не включены.
2. Одна вертикальная линия (|) проведена между двумя химическими веществами, которые находятся в разных фазах, но находятся в физическом контакте друг с другом (например,г., твердый электрод | жидкость с электролитом). Двойная вертикальная линия (||) представляет собой солевой мостик или пористую мембрану, разделяющую отдельные полуячейки.
3. Фаза каждого химического вещества (s, l, g, aq) указана в скобках. Если электролиты в ячейках не соответствуют стандартным условиям, концентрациям и / или давлению, они заключаются в скобки с обозначением фазы. Если концентрация или давление не указаны, предполагается, что электролиты в ячейках находятся в стандартных условиях (1.00 М или 1,00 атм и 298 К).
Используя эти правила, мы составили обозначение ячейки:
Cd (s) | Cd 2+ (водн., 0,15 M) || Ag + (водн., 0,20 M) | Аг (ов)
Как работают гальванические элементы?
В гальваническом элементе мы используем одно химическое вещество, которое имеет тенденцию окисляться — терять электроны — и второе химическое вещество, которое сокращает — приобретает электроны.
С точки зрения физических требований нам нужно два электрода — сплошные проводники.Один, называемый анодом, позволит электронам, образовавшимся в результате окисления, покинуть ячейку, а второй, называемый катодом, позволит электронам повторно войти в ячейку, чтобы вызвать восстановление. Оба погружены в проводящий раствор электролита.
Этими электродами может служить любой из большого количества материалов. Каждый электрод вносит характерный вклад в напряжение ячейки, известный как потенциал полуячейки.
Напряжение ячейки — это разность между этими двумя потенциалами полуячейки.
На схеме ниже показана ячейка, состоящая из электродов из цинка и меди, которая обычно является первой, с которой студенты сталкиваются на уроках химии. Это типично для работы большинства клеток.
На аноде металлический цинк окисляется до ионов цинка, высвобождая два электрона. Электроны проходят путь через внешние провода, где вольтметр измеряет энергию, которой обладают заряды. Наконец, они попадают на медный катод, где покрывают внешнюю поверхность металла.- ## rarr Cu (s) #
Поскольку положительные ионы образуются в левом стакане и удаляются из правого стакана, необходимо, чтобы положительные ионы текли слева направо. В этой установке этот перенос заряда стал возможным благодаря «соляному мосту». В нем положительные ионы перемещаются слева направо, а отрицательные — справа налево.
Напряжение ячейки (при концентрации 1 M и 25 ° C) составляет 1,10 В. Это значение характерно для пар металла и ионов металла, используемых в каждом стакане или «полуячейке».Выбор разных металлов приведет к разному напряжению.
Металлацикл · Гальванические элементы
Гальванические элементы преобразуют химическую энергию в электрическую. В последующем обсуждении мы исследуем, как устроены гальванические элементы физически и как мы можем измерять и прогнозировать напряжение, создаваемое гальваническим элементом известного состава.
Теория гальванических элементов
Основным практическим аппаратом электрохимии является ячейка, устройство, которое преобразует изменение свободной энергии, связанное со спонтанной окислительно-восстановительной реакцией, в электрическую энергию.Хотя процесс преобразования энергии звучит технически, на практике идея довольно проста: мы просто разделяем «дающего» и «принимающего» электроны в пространстве, так что электроны должны течь, чтобы осуществить окислительно-восстановительную реакцию. Подумайте об энергии, генерируемой бейсбольным мячом, перемещающимся от руки питчера к перчатке кетчера на расстоянии девяноста футов. Разделение бросающего и улавливающего позволяет нам использовать энергию мяча во время его полета к своей тарелке. Точно так же, разделив процессы окисления и восстановления в космосе и соединив их проводящим проводом, мы можем использовать энергию, связанную с током, протекающим через провод, когда происходят реакции.Устройство, в котором для получения электрического тока используется спонтанная окислительно-восстановительная реакция, называется гальваническим элементом .
Любой практический гальванический элемент содержит два компонента: «восстанавливающую» систему, которая высвобождает электроны, и «окислительную» систему, которая поглощает электроны. Однако, ограничиваясь теоретическими ситуациями, мы можем представить себе половину гальванического элемента как устройство, которое либо выпускает электроны в забвение, либо забирает их из забвения. Полуреакция , связанная с такой полуячейкой , включает электроны в свое химическое уравнение: мы указываем высвобождение электронов, записывая их на стороне продуктов, и поглощение электронов, записывая их на стороне реагентов.-} \ rightarrow \ mathrm {Cu} (s) $$
Как написано, это уравнение представляет собой «окислительную» систему, которая забирает электроны из проволоки. Аппарат для этого электрода выглядит довольно утомительно. Кусок металлической меди, прикрепленный к проводящему проводу (который также может быть сделан из меди, но не обязательно), погружают в раствор ионов меди (II) и невинного противоаниона.
Концентрация ионов меди (II) в растворе связана с напряжением на ячейках, содержащих полуячейку Cu | Cu 2+ , как мы скоро увидим.Так же, как изменения свободной энергии зависят от концентраций (напомним, \ (\ Delta G = -RT \ ln K \)), напряжения элементов также зависят от концентраций. Концентрации 1,0 моль / л являются стандартом в электрохимии, поэтому мы можем представить наш стандартный медный электрод в обозначении ячейки как «Cu | Cu 2+ (1 M)». Вертикальная черта указывает на фазовую границу между твердой металлической медью и водными ионами меди (II). {2 +}} (водн.) $$
Практические аспекты: солевые мостики и электролиты
Тогда мы можем подключить медный электрод к цинковому и ожидать, что произойдет какое-то волшебство…
Объединение двух полуэлементов: будут ли электроны перетекать со стороны цинка на сторону меди?У нас есть восстановительный металл (Zn), связанный с супом окисляющих катионов (Cu 2+ ). Разве электроны не должны самопроизвольно перемещаться из одной стороны в другую? Вначале будут, но процесс очень быстро остановится. Почему? Наша нынешняя установка представляет собой разомкнутую цепь: когда электроны движутся слева направо, положительный заряд будет накапливаться слева, а отрицательный — справа.Энергия, необходимая для поддержания этого разделения зарядов, намного больше, чем энергия, которую может дать любая окислительно-восстановительная реакция. После минимального разделения зарядов электроны самопроизвольно потекут в другую сторону, чтобы каждый электрод оставался нейтральным. Ток не может течь в разомкнутой цепи!
Нам нужен механизм, возвращающий противоположные заряды в каждый стакан, когда электроны текут слева направо по проволоке. Если бы катионы и анионы в растворе могли каким-то образом прыгать между стаканами, мы могли бы гарантировать, что даже когда электроны протекают через провод, общие заряды на обоих электродах остаются близкими к нулю.Канал, называемый соляным мостиком , делает свое дело: ионы могут проходить через солевой мостик, чтобы уравновесить заряд, передаваемый при движении электронов по проводу. На практике солевой мостик может быть таким же простым, как кусок смоченной фильтровальной бумаги между двумя стаканами. Более сложные солевые мостики представляют собой U-образные трубки с пористыми пробками на обоих концах, которые позволяют ионам перемещаться между стаканами. Невинные ионы (щелочные металлы и анионы, которые универсально растворимы в воде, такие как галогениды или нитраты) добавляются к растворам в каждом химическом стакане для увеличения проводимости растворов; эти проводящие растворы называются электролитами .
При установленном солевом мостике чистый заряд в каждом стакане остается очень близким к нулю при протекании тока.В этом устройстве есть все ключевые элементы гальванического элемента: восстанавливающий электрод, который высвобождает электроны, окислительный электрод, который захватывает их, и солевой мостик, гарантирующий, что каждый электрод поддерживает нулевой общий заряд. Восстановительный электрод (Zn | Zn 2+ в нашем примере) называется анодом , а окисляющий электрод (Cu 2+ | Cu) называется катодом .Один хороший способ запомнить это — отметить, что в солевом мостике ионы cat текут в направлении катода , ode, а ионы текут в направлении an ode. Поместив электрическое устройство (например, лампочку) вдоль провода, мы можем использовать падение напряжения, связанное с окислительно-восстановительной реакцией, для питания устройства.
В работающем гальваническом элементе катионы текут к катоду, а анионы — к аноду.Теперь, когда мы увидели, как устроен типичный гальванический элемент, давайте исследуем, как определить напряжение на элементе.\ circ \)) — напряжение на ячейке. Отрицательный знак гарантирует, что отрицательная свободная энергия соответствует положительному напряжению — электрики связывают батареи и другие источники электроэнергии с положительным напряжением. В некотором смысле, приведенное выше уравнение просто отражает определение Вольт как 1 Джоуль на кулон: умноженные на кулоны вольты равны джоулям. Маленькие кружки рядом с \ (G \) и \ (E \) показывают, что это соотношение относится к стандартным условиям: концентрация всех ионов в растворе 1 моль / л, давление любых газов 1 бар и 25 ° C.
Как и энергия, напряжение наиболее полезно в качестве относительной (а не абсолютной) величины. То, что мы определяем как «ноль» напряжения, не так важно; относительные различия в напряжении («падения» напряжения или разность потенциалов) — вот что мы используем для выполнения электрических работ. Тем не менее, мы должны договориться об общей нулевой точке, чтобы напряжения, измеренные разными людьми, были сопоставимы, а нулевое напряжение для гальванических элементов определяется как напряжение на стандартном водородном электроде (SHE).
Определение SHE как эталона нулевого напряжения предполагает стандартный эксперимент по измерению напряжения других полуэлементов. Подключаем интересующую полуячейку к ШЭ и измеряем генерируемое при этом напряжение. Полуячейка может обладать достаточной окислительной способностью, чтобы вытягивать электроны из газообразного водорода, образуя протоны в SHE. В этом случае напряжение, соответствующее полуячейке, положительное (по соглашению). Электроны будут самопроизвольно течь от SHE к заказной полуячейке (что произойдет с pH раствора в SHE?).
Если полуэлемент не может окислять водород в SHE, то он должен восстанавливать протоны в SHE (если только полуэлемент сам не является SHE, и в этом случае он ничего не сделает!). Восстановление — это обратная реакция окисления, поэтому, если полуячейка не может окислять водород в SHE, то он должен самопроизвольно окисляться протонами в SHE. В этом случае напряжение на полуячейке будет отрицательным, и электроны будут течь в обратном направлении, от полуячейки к SHE.
Стандартный эксперимент по измерению напряжения был проведен на всех типах полуэлементов (и список продолжает расти по сей день). В таблицах стандартных восстановительных потенциалов перечислены напряжения, связанные с полуэлементами. Обратите внимание, что для того, чтобы действительно понять, что означают напряжения, необходимо понять схему стандартного эксперимента (и признать SHE в качестве стандартного электрода). Учтите, что использование невероятно электроположительного электрода Li | Li + в качестве эталона нулевого напряжения сделало бы напряжение почти любого другого электрода положительным — металлический литий почти всегда будет служить анодом и высвобождать электроны.Согласно соглашению, положительные напряжения соответствуют самопроизвольному восстановлению полуэлемента SHE (поэтому они называются потенциалами восстановления ), а отрицательные напряжения соответствуют самопроизвольному окислению SHE.
Напряжения в ячейках произвольной формы при стандартных условиях
Ни в одной практичной батарее не используется стандартный водородный электрод по двум причинам: (1) с газообразным водородом сложно работать и (2) в SHE используется безумно дорогой платиновый электрод.Вместо этого в практичных батареях используются металлы, соли металлов и другие твердые или жидкие вещества, с которыми проще обращаться и которые дешевле. Нас часто интересует расчет ожидаемого напряжения на батарее этого типа. Прежде чем тратить деньги на создание двух полуэлементов и их соединение друг с другом, мы хотели бы быть достаточно уверены в том, что полученная батарея будет обеспечивать напряжение, достаточное для питания наших устройств! Этот расчет представляет большой интерес для таких компаний, как Energizer и Duracell!
Стандартный эксперимент по измерению напряжения показывает нам напряжение полуэлемента относительно SHE, но как мы можем определить напряжение на двух произвольных полуэлементах? Основная идея состоит в том, чтобы использовать тот факт, что свободная энергия Гиббса \ (G \) является функцией состояния.Поскольку \ (\ Delta G \) и \ (E \) связаны линейно согласно уравнению (5), напряжение ячейки \ (E \) также является функцией состояния: его значение зависит только от идентичности и концентраций реагентов. и продукты окислительно-восстановительной реакции, питающей аккумулятор. Путь, по которому мы превращаем реагенты в продукты, не важен; \ (E \) будет тем же самым, независимо от того, как мы разделим процесс, ведущий от реагентов к продуктам.
Рассмотрим комбинацию медных и цинковых электродов, с которыми мы работали до сих пор.{2 +}} (водн.)
$Кажется, что стандартные восстановительные потенциалы меди и цинка имеют отношение к этой реакции, но как так? Представьте, что мы включили в процесс водород и протоны следующим образом. \ circ \ ll 0 \)).Это выпадает из математики, когда мы используем уравнение (7), но это также согласуется с нашими интуитивными представлениями о свободной энергии. Когда они соединены вместе, электроны с большой силой будут течь от окисленной стороны (помните, она теряет электроны) к восстановленной стороне. Точно так же сильная кислота активно реагирует с сильным основанием, сильный окислитель сильно оттягивает электроны от сильного восстановителя. И окислительно-восстановительные, и кислотно-основные реакции протекают интенсивно, потому что реагенты имеют гораздо более высокую свободную энергию Гиббса, чем продукты.В первом случае мы используем высвободившуюся свободную энергию для выполнения электрических работ в цепи. В последнем случае энергия кислотно-щелочной реакции может выделяться в виде тепла, использоваться для фазового перехода или даже преобразовываться в электрическую работу!
Стандартные восстановительные потенциалы основаны не только на SHE, но и на стандартных концентрациях, давлениях и температурах всех реагентов. Любые расчеты, в которых используются только стандартные восстановительные потенциалы, такие как «закон Бурделла», неявно предполагают, что все компоненты в ячейке находятся в стандартных условиях.Конечно, как только мы действительно подключаем ячейку к нагрузке, ее условия начинают меняться! Как рассчитать напряжение на элементе, если его компоненты находятся в нестандартных условиях?
Напряжение в нестандартных условиях
Прежде чем раскрывать количественные детали того, как рассчитать нестандартное напряжение, давайте концептуально подумаем о проблеме в контексте кислотно-щелочной химии. Рассмотрим кислотно-щелочную реакцию между гидроксидом и уксусной кислотой (связь с электрохимией станет ясной, поверьте мне).-O_2CCH_3} $$
Если мы хотим выжать из реакции (9) как можно больше энергии, с каких концентраций реагентов и продуктов нам следует начать? Реакция идет самопроизвольно в прямом направлении, поэтому ясно, что мы должны начинать только с реагентов — любые присутствующие продукты ограничивают степень реакции в соответствии с принципом Ле Шателье. Мы получаем максимальную отдачу, когда начинаем только с гидроксида и уксусной кислоты. (Именно так работает большинство химических реакций — продукт — это то, что нам нужно, , а не то, что у нас есть .)
Та же идея применима к окислительно-восстановительным реакциям: мы получаем больше всего электроэнергии от реакции в гальванической ячейке, когда мы начинаем только с тех веществ, которые реагируют спонтанно. Однако стандартные условия требуют, чтобы все виды присутствовали в концентрации 1,0 М, что фактически запрещает нам начинать только с реагентов. Например, в нашем цинк-медном элементе и цинк (II), и медь (II) должны присутствовать в ячейке в концентрации 1,0 М, чтобы применялась метка «стандартные условия»…но медь (II) — это реагент, а цинк (II) — это продукт! Ой! Урок здесь в том, что стандартное напряжение не обязательно является оптимальным.
По аналогии с кислотно-щелочной реакцией, увеличение концентрации веществ, которые реагируют спонтанно (и / или уменьшение концентрации продуктов), должно увеличивать наблюдаемое напряжение. Согласно реакции (6), увеличение [Cu 2+ ] и уменьшение [Zn 2+ ] должно увеличивать напряжение ячейки.{2 +}] _ {eq}}} $$
Концентрации в (10) отражают состояние неограниченного равновесия, когда мы позволили ячейке «работать» бесконечное количество времени (другими словами, состояние, когда батарея полностью разряжена). Мы также можем записать коэффициент реакции в той же форме, что и \ (K \), который обобщается на любое ограниченное состояние равновесия ячейки. В состоянии ограниченного равновесия соответствующее напряжение «толкает» состояние, чтобы гарантировать, что оно остается однородным и постоянным во времени.\ circ = 1 \) обязательно. Стандартное состояние связано с некоторым напряжением и соответствующим изменением свободной энергии согласно уравнению (5). В последующем обсуждении мы будем предполагать, что реакция является спонтанной в прямом направлении в стандартном состоянии. Это означает, что \ (Q \) будет самопроизвольно увеличиваться в сторону \ (K \), если ячейка закорочена и оставлена для разряда. В этом случае уменьшение \ (Q \) требует ввода энергии. Мы настроили все таким образом, потому что все гальванические элементы настроены таким образом, со спонтанной прямой реакцией.
Теперь представьте, что требуется некоторое количество свободной энергии \ (\ Delta G \), чтобы «подтолкнуть» ячейку из стандартного состояния в нестандартное состояние с меньшим коэффициентом реакции \ (Q_ \ mathrm {ns} \) и большее напряжение \ (E_ \ mathrm {ns} \). Эта энергия — всего лишь энергия заряда, необходимая для перемещения [Zn 2+ ] и [Cu 2+ ] от 1,0 M до их значений в интересующем состоянии. Чтобы вычислить энергию заряда, мы можем признать, что «толчок» на самом деле является спонтанной окислительно-восстановительной реакцией клетки, работающей в режиме в обратном направлении , из стандартного состояния в нестандартное состояние с большим количеством присутствующих реагентов.\ circ \) на большего размера \ (Q_ \ mathrm {ns} \), за исключением того, что толкать не нужно. Вместо этого энергия будет высвобождаться при переходе от стандартных к нестандартным условиям, потому что этот сдвиг теперь представляет собой (спонтанное) образование продуктов.
Почему полезен расчет этой «энергии зарядки» \ (\ Delta G \)? Мы можем использовать стандартное напряжение, рассчитанное по (7), чтобы получить 90% пути к нестандартному напряжению, а затем использовать энергию заряда для завершения работы.\ circ $$
Это говорит нам о том, что при стандартных условиях напряжение элемента является стандартным напряжением — как и должно быть! Также обратите внимание на то, что по мере уменьшения \ (Q \) напряжение ячейки имеет тенденцию повышаться. Другими словами, подача большего количества реагентов и / или меньшего количества продуктов приводит к увеличению напряжения ячейки.

