Как устроен гальванический элемент. Какие бывают виды гальванических элементов. Как работает гальванический элемент. Где применяются гальванические элементы. Можно ли сделать гальванический элемент в домашних условиях.
Что такое гальванический элемент
Гальванический элемент — это химический источник тока, в котором электрическая энергия вырабатывается в результате окислительно-восстановительных реакций между электродами и электролитом. Он преобразует химическую энергию в электрическую.
Основные компоненты гальванического элемента:
- Анод — отрицательный электрод, на котором происходит реакция окисления
- Катод — положительный электрод, на котором происходит реакция восстановления
- Электролит — проводящая среда между электродами
- Сепаратор — разделитель между электродами
История создания гальванического элемента
Первый гальванический элемент был изобретен итальянским ученым Луиджи Гальвани в 1780-х годах. Он обнаружил, что мышцы лягушачьих лапок сокращаются под действием электричества.
В 1800 году другой итальянский физик Алессандро Вольта создал первую электрическую батарею — «вольтов столб». Она состояла из чередующихся дисков цинка и меди, разделенных картоном, пропитанным солевым раствором.
Дальнейшее развитие гальванических элементов связано с именами таких ученых как:
- Джон Даниэль (элемент Даниэля, 1836 г.)
- Гастон Планте (свинцово-кислотный аккумулятор, 1859 г.)
- Жорж Лекланше (элемент Лекланше, 1866 г.)
- Вальдмар Юнгнер (никель-кадмиевый аккумулятор, 1899 г.)
Принцип работы гальванического элемента
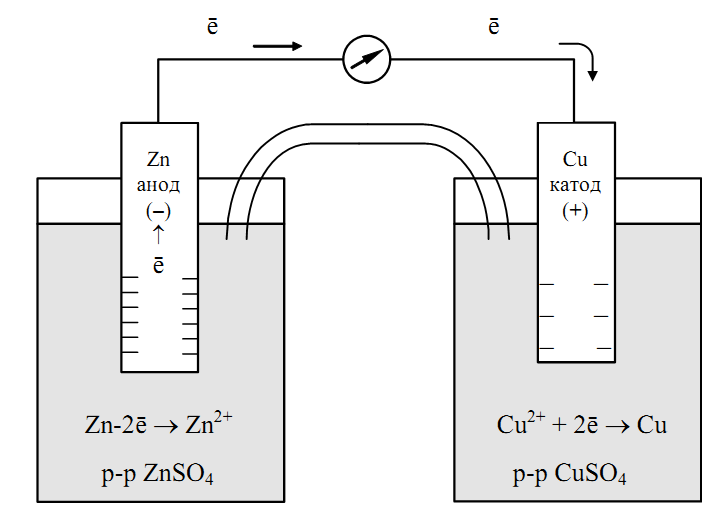
Принцип работы гальванического элемента основан на протекании окислительно-восстановительных реакций между электродами и электролитом. Рассмотрим его на примере простейшего медно-цинкового элемента:
- Цинковый электрод (анод) окисляется, отдавая электроны: Zn → Zn2+ + 2e-
- Ионы цинка переходят в раствор
- Электроны по внешней цепи перемещаются к медному электроду (катоду)
- На катоде происходит восстановление ионов меди: Cu2+ + 2e- → Cu
- Ионы SO42- в растворе обеспечивают электронейтральность
В результате возникает направленное движение электронов во внешней цепи — электрический ток. Разность потенциалов между электродами создает электродвижущую силу (ЭДС) элемента.
Виды гальванических элементов
Существует несколько основных видов гальванических элементов:
1. Марганцево-цинковые (солевые) элементы
Самые распространенные и дешевые батарейки. Состоят из цинкового анода, катода из оксида марганца и электролита на основе хлорида аммония или цинка.
Преимущества:
- Низкая стоимость
- Простота производства
Недостатки:
- Небольшая емкость
- Короткий срок хранения
2. Щелочные (алкалиновые) элементы
Усовершенствованный вариант марганцево-цинковых элементов с щелочным электролитом на основе гидроксида калия.
Преимущества:
- Высокая емкость
- Длительный срок службы
- Стабильное напряжение
Недостатки:
- Более высокая стоимость
3. Литиевые элементы
Используют литий в качестве анода. Обладают самыми высокими характеристиками.
Преимущества:
- Очень высокая емкость
- Длительный срок хранения
- Широкий температурный диапазон
Недостатки:
- Высокая стоимость
- Пожароопасность при неправильной эксплуатации
Устройство современного гальванического элемента
Рассмотрим устройство типичной цилиндрической щелочной батарейки:
- Стальной корпус (катод)
- Катодная масса (MnO2 + графит)
- Сепаратор
- Анодная масса (порошок цинка)
- Электролит (раствор KOH)
- Токосъемник
- Изолятор
- Прокладка
- Колпачок
Все компоненты помещены в герметичный стальной корпус. Между электродами находится пористый сепаратор, пропитанный электролитом. Это предотвращает прямой контакт анода и катода, но обеспечивает прохождение ионов.
Применение гальванических элементов
Гальванические элементы широко используются в качестве автономных источников питания в различных устройствах:
- Бытовая электроника (пульты, часы, фонарики)
- Портативные устройства (смартфоны, ноутбуки, фотоаппараты)
- Медицинское оборудование (слуховые аппараты, глюкометры)
- Автомобильные аккумуляторы
- Системы резервного питания
- Космические аппараты
Развитие гальванических элементов позволило создать множество портативных электронных устройств, изменивших нашу повседневную жизнь.
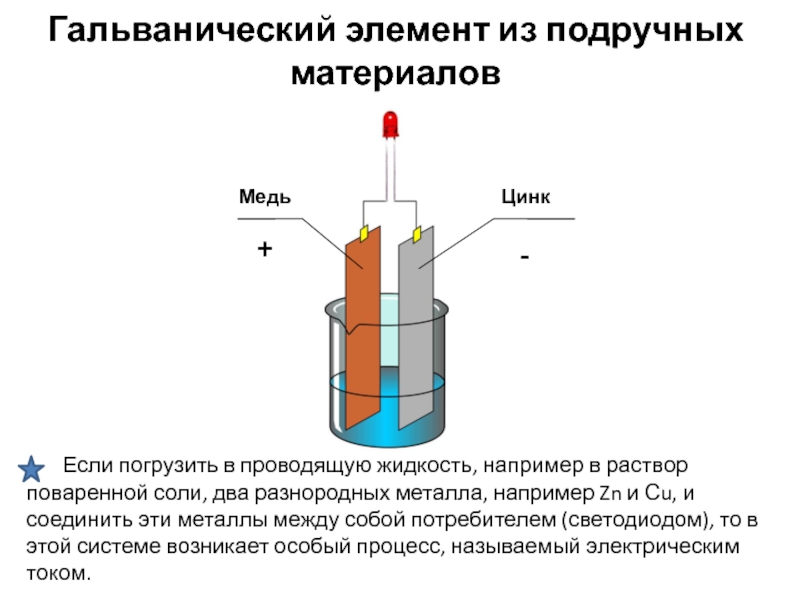
Как сделать простой гальванический элемент в домашних условиях
Простейший гальванический элемент можно изготовить своими руками. Для этого понадобится:
- Лимон или картофелина
- Медная монета или проволока
- Оцинкованный гвоздь
- Светодиод или вольтметр
Порядок действий:
- Воткните медную и цинковую пластины в лимон на расстоянии 2-3 см
- Подключите к пластинам светодиод или вольтметр
- Наблюдайте, как светодиод начинает светиться или вольтметр показывает напряжение
Такой элемент вырабатывает около 0,9 В и может работать несколько часов. Это наглядно демонстрирует принцип работы гальванического элемента.
Преимущества и недостатки гальванических элементов
Преимущества:
- Автономность и портативность
- Простота использования
- Широкий выбор типов и размеров
- Невысокая стоимость
Недостатки:
- Ограниченный ресурс работы
- Необходимость утилизации
- Саморазряд при хранении
- Снижение емкости при низких температурах
Перспективы развития гальванических элементов
Основные направления совершенствования гальванических элементов:
- Повышение удельной емкости и плотности энергии
- Увеличение срока службы и числа циклов заряда-разряда
- Улучшение экологичности и безопасности
- Снижение стоимости производства
- Разработка новых электрохимических систем (литий-воздушные, натрий-ионные и др.)
Развитие технологий гальванических элементов имеет большое значение для создания эффективных накопителей энергии, электромобилей и систем автономного энергоснабжения.
Гальванический элемент: устройство, принцип работы, виды
Люди довольно часто сталкиваются с электрохимическими элементами в повседневной жизни: от одноразовых батареек АА в пультах дистанционного управления ТВ до литий-ионных батарей в смартфонах. Существует два типа таких ячеек: гальванические и электролитические. Первые получают свою энергию от самопроизвольных окислительно-восстановительных реакций (ОВР), в то время как вторые требуют внешний источник электронов, например, блока питания переменного тока. Оба элемента состоят из анода (А) и катода (К), изготавливаемых из разнородных металлов и электролитов.
Что это такое
В любом электрохимическом процессе электроны переходят из одного вещества в другое, что обусловлено ОВР. Восстановитель представляет собой вещество, которое теряет электроны и в процессе окисляется. Связанная энергия определяется разностью потенциалов между валентными электронами в атомах различных элементов.

Принцип работы
Гальванический элемент — это устройство, которое преобразует химическую энергию в электрическую, используя электрохимию, а в быту называется батареей.
В такой ячейке есть контейнер, в котором содержится раствор концентрированного сульфата меди (CuSO4), а внутри раствора вставлен медный стержень — катод. Внутри контейнера находится пористый сосуд, заполненный концентрированной серной кислота (h3SO4), в нее вставлен цинковый стержень — анод. Таким образом, когда провод соединяет медный и цинковый стержни, по нему начинает протекать электрический ток.
Дополнительная информация. Реакции окисления и восстановления разделяются на части, называемые полуреакциями. Внешняя цепь используется для проведения потока электронов между электродами гальванического элемента. Электроды изготавливают из любых проводящих материалов, таких как металлы, полупроводники, графит и даже полимеры.
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.

Два типа ячеек
Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».

Александро Вольт
В 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник компании «Energizer», представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее.
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Виды
Гальванические элементы классифицируются, как щелочные и нещелочные. Стандартная щелочная сухая батарея имеет цинковый А и К из диоксида марганца. Электролит выполнен в виде некислотной пасты. Обычно электролитом, используемым в щелочных батарейках — есть гидроксид калия. Она выполнена в форме стальной банки, заполненной диоксидом марганца в самой внутренней области К, и заполнена цинком и электролитом в центральной области А. Электролит, окружающий А, запускает химреакцию между ними.

График окислительно-восстановительной реакции
Типичная нещелочная батарея с сухими элементами имеет цинковый А и К из углеродного стержня/ диоксида марганца. Электролит обычно представляет собой кислое пастообразное вещество из смеси хлорида аммония и хлорида цинка. Физически она имеет обратную щелочной батареи конструкцию. Цинковый контейнер служит внешним анодом, тогда как углеродный стержень/ диоксид марганца занимает внутреннюю область в качестве К. Электролит смешивается с К и обеспечивает химическую реакцию между К и А.
Общее мнение специалистов говорит о том, что химически щелочная батарея имеет преимущества по отношению к нещелочной. Хотя последние более надежные и дешевые, тем не менее, щелочные, нужны, когда требуется быстрое, сильнотоковое потребление, например, вспышка на камере с быстрой перезарядкой.
Щелочные батареи
Эта конструкция ячейки получила свое название благодаря использованию щелочных водных растворов в качестве электролитов. Химия щелочных устройств была впервые введена в начале 60-х годов. И сразу стала крупнейшим конкурентом цинк-углеродной ячейки. Эти элементы обладают многими признанными преимуществами по сравнению с цинк-углеродом, включая более высокую плотность энергии, длительный срок хранения, превосходное сопротивление утечке, лучшие характеристики, как в непрерывном, так и в прерывистых рабочих циклах, и более низкое внутреннее сопротивление, что позволяет им работать при высоких скоростях разряда.

Щелочные батареи
Цинк в порошкообразной форме увеличивает площадь поверхности анода, что обеспечивает большее взаимодействие частиц. Это снижает внутреннее сопротивление и увеличивает плотность мощности. Катод, MnO2, произведен синтетически из-за его превосходства над природным MnO2, что дает рост плотности энергии. Как и в цинковой в углеродной ячейке, графит добавляется к катоду для увеличения проводимости.
Электролит КОН, обеспечивает высокую ионную проводимость. Оксид цинка часто включают для замедления коррозии цинкового анода. Производное от целлюлозы и гелеобразующего агента делают щелочной элемент более дорогим, чем цинк-углерод, но более экономичным, особенно в ситуациях с высоким расходом, когда плотность энергии щелочного элемента намного выше.
Половинные реакции:
- Zn + 2OH — -> ZnO + h3O + 2 e —
- 2MnO2 + h3O + 2 e — -> Mn2O 3 + 2OH —
Общая реакция:
- Zn + 2MnO2 -> ZnO + Mn2O3 E = 1,5 В
Существуют и другие конструкции ячеек, которые относятся к категории щелочных, в том числе оксиды ртути, серебра и цинка. Ртуть и серебро дают еще более высокую плотность энергии, но стоят намного дороже и постепенно исключаются требованиями международных организаций из-за их высокой токсичности.
Солевые ячейки
Аккумуляторы с сухими элементами — это устройства, в которых используется электролит с очень низким содержанием влаги. Они контрастируют с батареями с мокрыми элементами, такими как свинцово-кислотные, в которых используется жидкий электролит. Электролит, используемый в большинстве устройств с сухими элементами, является пастой, которая, хотя и содержит влагу, тем не менее остается относительно сухой. Наиболее часто используемые формы сухих элементов — это батареи типа «С», «А», 9 вольт батарейки и для электронных часов.

Сухой элемент
Важно! Сухих элементы вырабатывают электроэнергию путем преобразования химической энергии в электричество. Выходные данные зависят от типа батареи с сухими элементами. Более популярными являются конструкции с использованием цинка и углерода или цинка и диоксида марганца.
Эти материалы помещаются в пасту электролита внутри батареи. Они реагируют друг с другом посредством химического процесса, в котором электролит, диоксид углерода или марганца реагирует с цинком, создавая электричество.
Литиевые аккумуляторы
Литий-ионная технология включает в себя несколько химических процессов: ионы лития хранятся в аноде или отрицательном электроде, и транспортируются во время разряда к катоду или положительному электроду в органическом электролите.
Наиболее популярными материалами являются графит для анода и оксид металла для катода на основе никеля, марганца и кобальта. Все эти материалы обладают хорошими свойствами интеркалирования лития, что позволяет хранить большое количество энергии.

Литий-ионный элемент
Выбор аккумуляторной технологии зависит от требований эксплуатации по производительности, сроку службы, безопасности и стоимости, причем каждый тип аккумулятора обеспечивает определенные функциональные возможности.
Преимущества литий-ионных аккумуляторов:
- Высокая плотность энергии. Высокая плотность энергии является одним из главных преимуществ технологии литиевых батарей, для того чтобы работать дольше.
- Саморазряд. Одной из проблем многих аккумуляторов является скорость саморазряда. Литий-ионные элементы в том, что скорость их саморазряда намного ниже, чем у Ni-Cad и NiMH. Обычно составляет около 5% в первые 4 часа после зарядки, но затем падает до 1 или 2% в месяц.
- Низкие эксплуатационные расходы, поскольку требуют технического обслуживания для обеспечения их производительности.
- Разнообразие типов: для бытовой электроники, для электроинструментов и электромобилей.
У таких батарей есть один существенный недостаток — им требуется встроенная схема защиты. Кроме того они страдают от старения и могут выдержать 500–1000 циклов зарядки-разрядки.
Устройство гальванического элемента
Гальваническая ячейка представляет собой простое устройство, с помощью которого химическая энергия преобразуется в электрическую энергию.
Строение гальванического элемента для литиевых батарей:
- Анод, при разряде отдает электроны во внешнюю цепь и окисляется во время электрохимической реакции. Большинство коммерческих элементов в настоящее время используют электрод на основе углерода/графита, однако можно использовать металл или сплав.
- Катод, на разряде принимает электроны из внешней цепи и восстанавливается во время электрохимической реакции. Обычно это переходный металлический оксид или фосфат.
- Электролит.
Обратите внимание! Строение электролита ионный проводник, при этом электронный изолятор, разделяет два электрода и обеспечивает среду для переноса заряда внутри ячейки между анодом и катодом. Электролитом обычно является неводный неорганический растворитель, содержащий растворенную соль лития, например LiPF6 в пропиленкарбонате.
Принцип работы
Литиевая батарея известна как «электронный насос» из-за носителей заряда, перемещающихся между двумя электродами во время зарядки и разрядки. Электрическое (насосное) давление или разность потенциалов между положительной и отрицательной клеммами называется напряжением или электродвижущей силой (ЭДС). Свободная энергия, связанная с переносом электронов вокруг внешней цепи и ионов лития между двумя интеркалирующими электродами, связана с разницей в химическом потенциале лития в двух электродах.
Элементы батареи накапливают энергию химически в своих электроактивных материалах. Эта химическая энергия преобразуется в электрическую энергию по требованию, посредством электрохимической реакции окисления-восстановления.

Аккумуляторная батарейка
Клетки построены в разряженном состоянии. При зарядке положительный электрод, катод, материал окисляется, ионы Li + де-интеркалируются из слоистого интеркалирующего литиевого источника, например LiCoO2, проходят через электролит.
Когда элемент разряжается, на отрицательном электроде происходит реакция окисления, ионы Li + де-интеркалируются из анода и мигрируют через электролит, чтобы быть повторно интеркалированными в материал катода. Одновременная реакция электрохимического восстановления протекает на положительном электроде и принимает электроны из внешнего контура, ионы Li + из электролита, чтобы преобразовать исходный материал. Переход от электронного тока к ионному току происходит на границе раздела электрод/электролит.
- Реакция восстановления положительного электрода (катода): Li 1 -xCoO 2 + xLi + + xe- → LiCoO2
- Реакция окисления отрицательного электрода (анода): LiC 6 → xLi + + xC6 + e-
- Общая обратимая, окислительно-восстановительная, клеточная реакция: LiC 6 + CoO 2 C6 + LiCoO 2

Применение ячеек
Область использования
Электрохимия имеет множество важных применений, особенно в промышленности. Ее процессы используются для изготовления электрических батарей. Они имеют множество применений, включая:
- Топливный элемент преобразует химическую потенциальную энергию, получаемую при окислении топлива, например, газа, водорода, углеводородов, спиртов в электрическую энергию.
- Различные виды пьезозажигалок для газа.
- Электрические приборы, такие как мобильные телефоны.
- Цифровые камеры-литиевые.
- Слуховые аппараты (оксидно-серебряные).
- Электронные часы (ртутные/оксидно-серебряные).
- Военные источники тока (тепловые).
- Батарейки A, AA, AAA, D, C и другие.
Использование химических реакций для производства электричества в настоящее время является приоритетом для многих исследователей. Возможность адекватно использовать химические реакции в качестве источника энергии в значительной степени поможет решить проблемы загрязнения окружающей среды.
rusenergetics.ru
Гальванический элемент: схема, принцип работы, состав
Впервые в мире гальванический элемент был разработан Луиджи Гальвани. Об его истории читайте в этой статье. По сути это временный источник электрического тока, который формируется за счет протекания химической реакции. Поток электронов формируется за счет взаимодействия между двумя разноименными металлами. В результате этого химическая энергия преобразуется в электрическую, которую уже можно использовать в повседневной жизни.
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Кроме Гальвани созданием эффективной батареи занимался Даниэль Якоби. Он немного видоизменил свой источник энергии. В его состав входит пластина, выполненная из меди, помещенная в CuSO4 и пластина из цинка погруженная в ZnSO4. Чтобы не дать им воздействовать прямо друг на друга между ними установлена пористая стенка. Ниже представлена схема гальванического элемента Даниэля Якоби.

Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Схема гальванического элемента
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.

Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы
| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Типы гальванических элементов
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов
| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элемента
Он предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Гальванический элемент в домашних условиях
Простой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
- Пластиковый стакан.
- Электролит. В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде.
- Пластинки двух разных металлов. К примеру алюминий и медь.
- Провода
Процесс изготовления
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Более детально создание батареи своими руками описано в этой статье.
Таким образом изготавливается самодельный гальванический элемент.
batareykaa.ru
Гальванические элементы. Виды и устройство. Работа и особенности
В первых опытах ученых в емкость с кислотой опускали две металлические пластины: медную и цинковую. Пластины соединяли проводником, после чего на медной пластине появлялись газовые пузырьки, а цинковая пластина стала растворяться. Было доказано, что по проводнику проходит электрический ток. Это исследование начинал итальянский ученый Гальвани, от него и получили название гальванические элементы.
После этого ученый Вольта разработал цилиндрическую форму этого элемента в виде вертикального столбика, включающего в себя набор колец меди, цинка и сукна, соединенных друг с другом, и пропитанных кислотой. Разработанный Вольтом вертикальный элемент полуметровой высоты вырабатывал напряжение, которое мог почувствовать человек.
Гальванические элементы — это источники электрической энергии, вырабатывающие электрический ток методом химического взаимодействия двух металлов в электролите. Химическая энергия в гальванических элементах преобразуется в электрический ток.
Виды и особенности устройства
Батарейки широко используются для питания разных электронных устройств, приборов, цифровой техники и делятся на три основных вида:
- Солевые.
- Щелочные.
- Литиевые.
Солевые гальванические элементы
Такие батарейки относятся к марганцево-цинковым элементам питания, и являются наиболее применяемыми в настоящее время.
Достоинствами солевых батареек являются:
- Приемлемые электрические параметры для многих областей использования.
- Удобство применения.
- Малая цена ввиду небольших расходов на изготовление.
- Простая технология изготовления.
- Дешевое и доступное сырье.
Длительное время этот вид батареек является наиболее популярным, благодаря соотношению качества и цены. Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси. Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония. Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция. Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.
В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите. Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3. Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Щелочные батарейки
Щелочные элементы питания появились в середине прошлого века. В них в качестве окислителя выступает диоксид марганца, а в качестве восстановителя порошковый цинк. Это дает возможность увеличить поверхность. Для предохранения от коррозии раньше применялось амальгамирование. Но после запрета на ртуть используют очищенные цинковые порошки с добавлением других металлов и ингибиторов коррозии.
Активным веществом анода щелочной (алкалиновой) батарейки стал очищенный цинк в виде порошка с добавлением алюминия, индия или свинца. Активная смесь катода включает в себя диоксид марганца, ацетиленовую сажу или графит. Электролит алкалиновых батареек состоит из едкого натра или калия с добавлением оксида цинка.
Порошковый анод позволяет значительно повысить использование активной смеси, в отличие от солевых батареек. Алкалиновые батарейки обладают значительно большей емкостью, чем солевые, при равных габаритных размерах. Они хорошо себя показали в работе на морозе.
Особенностью устройства алкалиновых элементов является порошковый цинк, поэтому вместо цинкового стакана используют стальной корпус для положительного вывода. Активная смесь положительного электрода находится возле внутренней стенки стального корпуса. В алкалиновой батарейке есть возможность разместить больше активной смеси положительного электрода, в отличие от солевой.
В активную смесь вставляется целлофановый сепаратор, смоченный электролитом. По центру батарейки проходит латунный отрицательный электрод. Остальной объем между сепаратором и отрицательным токоотводом заполняется анодной пастой в виде порошкового цинка, пропитанного густым электролитом. Обычно в качестве электролита используют щелочь, насыщенную специальными соединениями цинка. Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
По многим основным параметрам алкалиновые гальванические элементы превосходят солевые элементы. Поэтому в настоящее время увеличивается объем производства щелочных батареек.
Литиевые элементы питания
Литиевые гальванические элементы применяются в различных современных устройствах. Они выпускаются различных типоразмеров и видов.
Существуют литиевые батарейки и литиевые аккумуляторы, имеющие между собой большие отличия. Батарейки имеют в составе твердый органический электролит, в отличие от других видов элементов. Литиевые элементы используются в местах, где требуются средние и малые токи разряда, стабильное рабочее напряжение. Литиевый аккумулятор можно перезаряжать определенное количество раз, а батарейки не предназначены для этого, и используются только один раз. Их запрещается вскрывать или перезаряжать.
Основные требования к производству
- Надежная герметизация корпуса. Нельзя допускать утечки электролита и проникновения внутрь других веществ из внешней среды. Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
- Изготовление должно проходить в герметичных помещениях с аргоновой атмосферой и контролем влажности.
Форма литиевых аккумуляторов бывает цилиндрической, дисковой или призматической. Габариты практически не отличаются от других видов батареек.
Область использования
Литиевые гальванические элементы обладают более длительным сроком работы, по сравнению с другими элементами. Область применения очень широка:
- Космическая промышленность.
- Авиационное производство.
- Оборонная промышленность.
- Детские игрушки.
- Медицинская техника.
- Компьютеры.
- Фото- и видеокамеры.
Преимущества
- Широкий интервал рабочих температур.
- Компактные размеры и масса.
- Длительная эксплуатация.
- Стабильные параметры в различных условиях.
- Большая емкость.
Недостатки
- Возможность внезапного возгорания при несоблюдении правил пользования.
- Высокая цена, по сравнению с другими видами батареек.
Принцип работы
Действие гальванических элементов основано на том, что два разных металла в среде электролита взаимодействуют между собой, в результате чего во внешней цепи образуется электрический ток.
Такие химические элементы сегодня называют батарейками. Величина напряжения батарейки зависит от применяемых видов металлов и от числа элементов, находящихся в ней. Все устройство батарейки расположено в металлическом цилиндре. Электроды представляют собой металлические сетки с напылением восстановителя и окислителя.
Батарейки не могут восстанавливать утраченные свойства, так как в них осуществляется прямое преобразование химической энергии окислителя и восстановителя в электрическую. Химические реагенты при функционировании батарейки постепенно расходуются, а электрический ток уменьшается.
Отрицательный вывод батарейки выполнен из цинка или лития, он теряет электроны и является восстановителем. Другой положительный вывод играет роль окислителя, его изготавливают из оксида магния или солей металлов. Состав электролита в обычных условиях не пропускает через себя электрический ток. При замыкании электрической цепи начинается распад электролита на ионы, что обуславливает появление его электрической проводимости. Электролит состоит чаще всего из раствора кислоты или солей натрия и калия.
Похожие темы:
electrosam.ru
Устройство гальванического элемента, принцип гальваники
Принцип работы гальванических ванн, предназначение и виды конструкций
Гальванический процесс, работа которого построена на использовании электрического тока, дает возможность однотонного покрытия на поверхностях различных материалов.  Чтобы понять принцип действия работы гальванических ванн, необходимо более детально ознакомится с конструкциями и принципом работы, это даст возможность самостоятельно изготовить устройство в домашних условиях.
Чтобы понять принцип действия работы гальванических ванн, необходимо более детально ознакомится с конструкциями и принципом работы, это даст возможность самостоятельно изготовить устройство в домашних условиях.
Гальваника, что она собой представляет
Правильно используемая сила тока позволяет уменьшить растворенность катионов в металлах, этот принцип и есть основой гальваники. Использование гальваники позволяет видоизменять обрабатываемую поверхность, с учетом электрического окисления анионов по следующим параметрам:
- Улучшается внешний вид и эстетические качества.
- Увеличивается противостояние агрессивной среде, понижается скольжение.
- Удаление дефектных и поврежденных участков с учетом улучшения износостойкости.
- Процесс гальваники используют, как средство для увеличения толщены изделия в местах низкорослости, и при формировании плотности.
Использование гальванического травления именуют электроосаждением для очистки поверхностей, где предполагаемо, будет наноситься защитный слой. Принцип работы основан на применении в гальванической ванне производимой компанией plast-product.ru одного из вида электролита, который содержит одну, или несколько растворимых солей металла. Эта особенность дает возможность усиливать прохождение электрического тока и способствует накоплению ионов.
Толщина слоя зависит от времянахождения объекта в ванне, а скорость растворяемого анода зависит от катодной площади, обрабатываемого электротоком.
Отрасли, где применяется гальваника
Гальваника применяется в различных направлениях, но наиболее популярными является медицинская отрасль, декоративная металлургия и ювелирное дело. По популярности металлов, которые используют обработки поверхностей, выделяются:
- Родий.
- Золото.
- Палладий.
- Рутений.
- Серебро.
- Латунь.
В ювелирном деле и медицине технологию используют для хромирования деталей и инструмента, никелирования, оцинковки и обезжириваний.
Как организовать процесс гальваники самостоятельно в домашних мастерских
Процесс гальванизации не отличается сложностью и его вполне по силам организовать в домашних мастерских. Для этого потребуется следующее оборудование:
- Регулируемый блок питания.
- Осветитель.
- Медный купорос (вещество является ядовитым, требует корректного использования).
- Зажимы (в народе именуют «крокодилами»).
- Контейнер из стекла.
- Электроды, изготовленные из меди.
В домашних условиях сложных гальванических процессов невозможно организовать, но простейшее медное покрытие на различных покрытиях, задача выполнимая для всех желающих попробовать свои силы в подобного рода занятиях. Материал природного происхождения должен иметь слой эмали, иначе его просто испортят.
Процесс приготовления
Медный купорос растворяют в необходимом количестве воды, которая должна полностью покрывать предмет в специальном контейнере. Анод устанавливают в контейнере до полного погружения, не допуская контакта с материалом. Чем ниже напряжение, тем большее количество жидкости можно использовать.
Питание
 Блок питания имеет два выхода: (+) присоединяется к аноду, таким образом, чтобы он находился над поверхностью жидкости, (-) крепится к катоду, заранее исключая прикосновение детали к меди. После чего можно подавать питание (достаточно 1 В).
Блок питания имеет два выхода: (+) присоединяется к аноду, таким образом, чтобы он находился над поверхностью жидкости, (-) крепится к катоду, заранее исключая прикосновение детали к меди. После чего можно подавать питание (достаточно 1 В).
Время от времени нужно проверять качество и слой покрытия, если увеличивается тусклость, нужно добавить в раствор немного отбеливателя. Сам процесс занимает несколько минут.
Полоскание
По завершению нанесения слоя деталь промывают проточной водой и вытирают насухо, следя за отсутствием на поверхности частиц медного купороса. Достаточно нескольких «тренировок», чтобы овладеть технологией обработки поверхностей на приличном уровне исполнения. Данный вид обработки поверхностей позволит вернуть привлекательность многих дорогих сердцу вещиц, которые по разным причинам потеряли нужный формат.
Гальванические элементы: преимущества и недостатки
Для изготовления современных гальванических элементов используются самые различные материалы. Наиболее распространенными являются материалы на основе угольно-цинковых элементов, используемых для пальчиковых батареек.
Их основным положительным качеством считается относительно низкая стоимость. Однако, такие элементы обладают невысокой мощностью и небольшим сроком хранения. Наиболее оптимальным вариантом служит использование щелочных элементов. Здесь в качестве электролита выступает не уголь, а раствор щелочи. При разрядке не происходит выделение газа, что позволяет обеспечить полную герметичность. Щелочные элементы отличаются более высоким сроком хранения.

Общий принцип работы гальванического элемента для всех их видов совершенно одинаковый. Например, элементы на основе оксида ртути конструктивно напоминают щелочные. Они отличаются повышенной устойчивостью к высокой температуре, высокой механической прочностью и стабильным значением напряжения. Недостатком является токсичность ртути, требующая осторожного обращения с отработанными элементами.
В первых опытах ученых в емкость с кислотой опускали две металлические пластины: медную и цинковую. Пластины соединяли проводником, после чего на медной пластине появлялись газовые пузырьки, а цинковая пластина стала растворяться. Было доказано, что по проводнику проходит электрический ток. Это исследование начинал итальянский ученый Гальвани, от него и получили название гальванические элементы.
После этого ученый Вольта разработал цилиндрическую форму этого элемента в виде вертикального столбика, включающего в себя набор колец меди, цинка и сукна, соединенных друг с другом, и пропитанных кислотой. Разработанный Вольтом вертикальный элемент полуметровой высоты вырабатывал напряжение, которое мог почувствовать человек.
Гальванические элементы — это источники электрической энергии, вырабатывающие электрический ток методом химического взаимодействия двух металлов в электролите. Химическая энергия в гальванических элементах преобразуется в электрический ток.
Принцип работы
Действие гальванических элементов основано на том, что два разных металла в среде электролита взаимодействуют между собой, в результате чего во внешней цепи образуется электрический ток.
Такие химические элементы сегодня называют батарейками. Величина напряжения батарейки зависит от применяемых видов металлов и от числа элементов, находящихся в ней. Все устройство батарейки расположено в металлическом цилиндре. Электроды представляют собой металлические сетки с напылением восстановителя и окислителя.
Батарейки не могут восстанавливать утраченные свойства, так как в них осуществляется прямое преобразование химической энергии окислителя и восстановителя в электрическую. Химические реагенты при функционировании батарейки постепенно расходуются, а электрический ток уменьшается.
Отрицательный вывод батарейки выполнен из цинка или лития, он теряет электроны и является восстановителем. Другой положительный вывод играет роль окислителя, его изготавливают из оксида магния или солей металлов. Состав электролита в обычных условиях не пропускает через себя электрический ток. При замыкании электрической цепи начинается распад электролита на ионы, что обуславливает появление его электрической проводимости. Электролит состоит чаще всего из раствора кислоты или солей натрия и калия.
Виды и особенности устройства
Батарейки широко используются для питания разных электронных устройств, приборов, цифровой техники и делятся на три вида:
- Щелочные.
- Солевые.
- Литиевые.
Солевые гальванические элементы
Такие батарейки относятся к марганцево-цинковым элементам питания, и являются наиболее применяемыми в настоящее время.
Достоинствами солевых батареек являются:
- Приемлемые электрические параметры для многих областей использования.
- Удобство применения.
- Малая цена ввиду небольших расходов на изготовление.
- Простая технология изготовления.
- Дешевое и доступное сырье.
Длительное время этот вид батареек является наиболее популярным, благодаря соотношению качества и цены. Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси. Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония. Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция. Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.
В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите. Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3. Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Щелочные батарейки
Щелочные элементы питания появились в середине прошлого века. В них в качестве окислителя выступает диоксид марганца, а в качестве восстановителя порошковый цинк. Это дает возможность увеличить поверхность. Для предохранения от коррозии раньше применялось амальгамирование. Но после запрета на ртуть используют очищенные цинковые порошки с добавлением других металлов и ингибиторов коррозии.
Активным веществом анода щелочной (алкалиновой) батарейки стал очищенный цинк в виде порошка с добавлением алюминия, индия или свинца. Активная смесь катода включает в себя диоксид марганца, ацетиленовую сажу или графит. Электролит алкалиновых батареек состоит из едкого натра или калия с добавлением оксида цинка.
Порошковый анод позволяет значительно повысить использование активной смеси, в отличие от солевых батареек. Алкалиновые батарейки обладают значительно большей емкостью, чем солевые, при равных габаритных размерах. Они хорошо себя показали в работе на морозе.
Особенностью устройства алкалиновых элементов является порошковый цинк, поэтому вместо цинкового стакана используют стальной корпус для положительного вывода. Активная смесь положительного электрода находится возле внутренней стенки стального корпуса. В алкалиновой батарейке есть возможность разместить больше активной смеси положительного электрода, в отличие от солевой.
В активную смесь вставляется целлофановый сепаратор, смоченный электролитом. По центру батарейки проходит латунный отрицательный электрод. Остальной объем между сепаратором и отрицательным токоотводом заполняется анодной пастой в виде порошкового цинка, пропитанного густым электролитом. Обычно в качестве электролита используют щелочь, насыщенную специальными соединениями цинка. Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
По многим основным параметрам алкалиновые гальванические элементы превосходят солевые элементы. Поэтому в настоящее время увеличивается объем производства щелочных батареек.
Литиевые элементы питания
Литиевые гальванические элементы применяются в различных современных устройствах. Они выпускаются различных типоразмеров и видов.
Существуют литиевые батарейки и литиевые аккумуляторы, имеющие между собой большие отличия. Батарейки имеют в составе твердый органический электролит, в отличие от других видов элементов. Литиевые элементы используются в местах, где требуются средние и малые токи разряда, стабильное рабочее напряжение. Литиевый аккумулятор можно перезаряжать определенное количество раз, а батарейки не предназначены для этого, и используются только один раз. Их запрещается вскрывать или перезаряжать.
Основные требования к производству
- Надежная герметизация корпуса. Нельзя допускать утечки электролита и проникновения внутрь других веществ из внешней среды. Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
- Изготовление должно проходить в герметичных помещениях с аргоновой атмосферой и контролем влажности.
Форма литиевых аккумуляторов бывает цилиндрической, дисковой или призматической. Габариты практически не отличаются от других видов батареек.
Область использования
Литиевые гальванические элементы обладают более длительным сроком работы, по сравнению с другими элементами. Область применения очень широка:
- Космическая промышленность.
- Авиационное производство.
- Оборонная промышленность.
- Детские игрушки.
- Медицинская техника.
- Компьютеры.
- Фото- и видеокамеры.
Преимущества
- Широкий интервал рабочих температур.
- Компактные размеры и масса.
- Длительная эксплуатация.
- Стабильные параметры в различных условиях.
- Большая емкость.
Недостатки
- Возможность внезапного возгорания при несоблюдении правил пользования.
- Высокая цена, по сравнению с другими видами батареек.
Вольта элемент
Смотреть что такое «Вольта элемент» в других словарях:
-
ВОЛЬТА ЭЛЕМЕНТ — гальванический элемент, у которого положительный электрод медная пластина, отрицательный цинковая, электролит раствор поваренной соли или серной кислоты; ЭДС = 1 В. (См. .) … Большая политехническая энциклопедия
-
ВОЛЬТА ЭЛЕМЕНТ — гальванический элемент, у которого положительный электрод медная пластина, отрицательный цинковая, электролит раствор хлорида натрия или серной кислоты; электродвижущая сила 1,0 В. Предложен А. Вольтой … Большой Энциклопедический словарь
-
Вольта элемент — гальванический элемент, у которого положительный электрод медная пластина, отрицательный цинковая, электролит раствор хлорида натрия или серной кислоты; эдс 1,0 В. Предложен А. Вольтой. * * * ВОЛЬТА ЭЛЕМЕНТ ВОЛЬТА ЭЛЕМЕНТ, гальванический… … Энциклопедический словарь
-
ВОЛЬТА ЭЛЕМЕНТ — первичный элемент, у к рого положит. электрод медная пластина, отрицат. цинковая, электролит р р хлорида натрия или серной к ты. Эдс равна 1 В … Большой энциклопедический политехнический словарь
-
ВОЛЬТА ЭЛЕМЕНТ — гальванич. элемент, у к рого положит. электрод медная пластина, отрицательный цинковая, электролит р р хлорида натрия или серной кислоты; эдс 1,0 В. Предложен А. Вольтой … Естествознание. Энциклопедический словарь
-
ЭЛЕМЕНТ — элемента, м. . 1. Составная часть чего н. Разложить что н. на элементы. Классовые элементы общества. Отдельные элементы населения. Сочувствующие элементы… … Толковый словарь Ушакова
-
элемент — а, м. élément m., нем. Element <лат. elementum стихия, первоначальное вещество. 1. У древнегреческих философов материалистов одна из составных частей природы (огонь, вода, воздух, земля), лежащих в основе всех вещей, явлений; стихия. БАС 1.… … Исторический словарь галлицизмов русского языка
-
ЭЛЕМЕНТ — (лат. elementum первоначальное вещество, стихия). 1) простое или не разлагаемое тело, как напр, серебро, медь, азот и пр. 2) малые частицы, из которых состоит тело. 3) начальное вещество, стихия. Словарь иностранных слов, вошедших в состав… … Словарь иностранных слов русского языка
-
Элемент Вестона — Нормальный элемент Вестона (Weston cell). Содержание 1 Общее описание 2 Различают насыщенные и ненасыщенные НЭ … Википедия
-
элемент Вольта — Voltos elementas statusas T sritis Standartizacija ir metrologija apibrėžtis Galvaninis elementas, sudarytas iš vario ir cinko plokštelių NaCl tirpale. atitikmenys: angl. Volta pile; voltaic pile vok. Volta Element, n rus. элемент Вольта, m pranc … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Принцип работы гальванических элементов
Тема 4. Химические источники тока
Источники тока, в которых химическая энергия преобразуется в электрическую, называютсягальваническими элементами. Они просты по устройству, имеют небольшие размеры и вес.
Первичные – гальванические элементы; вторичные – аккумуляторы, т.к. для превращения в источник тока нуждается в предварительном заряде.
Растворы солей, кислот, щелочей в воде или другом растворителе называются электролитами. Являются проводниками электрического тока. В них происходит непрерывный самопроизвольный распад молекул на положительные и отрицательные ионы, что выражается обычным уравнением.
CuSO4↔ Cu+++SO4- —
В целом такой раствор электрически нейтрален.
Если в сосуд с электролитом поместить две металлические пластины (электроды), присоединенные к источнику электрической энергии постоянного тока, то вследствие разности потенциалов между электродами через электролит будет протекать ток.
Прохождение тока через электролит сопровождается химическим процессом, который называется электролиз: положительные ионы будут двигаться к катоду (-), а отрицательные — к аноду (+). Подойдя к катоду, положительный ион получает недостающие электроны и образует химически нейтральный атом. На аноде отрицательные ионы отдают свои избыточные электроны.
Это упорядоченное движение ионов представляет собой электрический ток в жидких проводниках.
Рисунок 4.1. а) заряд и б) разряд аккумулятора

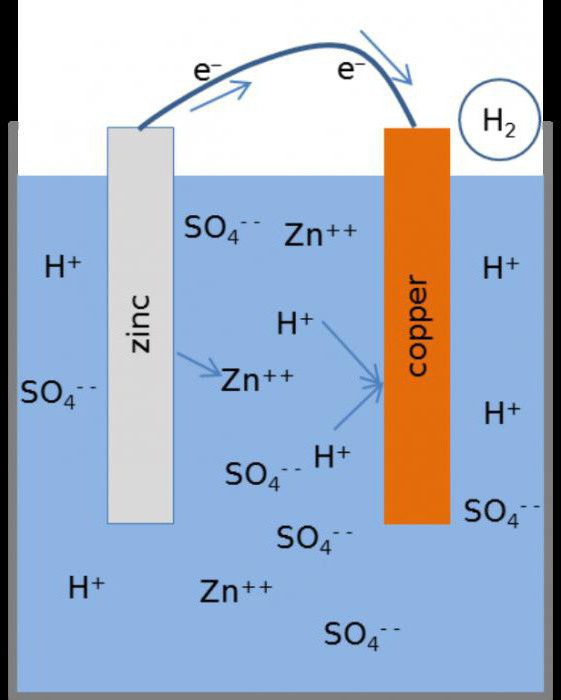
Гальванический элемент Вольта состоит из двух разнородных проводящих пластин – электродов: медного анода (+) и цинкового катода (-), помещённых в электролит (раствор серной кислоты).
Молекула серной кислоты в водном растворе распадается на два положительно заряженных иона водорода (H), в котором недостаёт по одному электрону и один отрицательно заряженный ион (SO4), в котором имеются два избыточных электрона.
Между отрицательными ионами, в состав которых входит сера и кислород, и цинковым электродом происходит химическая реакция, в результате которой образуется сернокислый цинк. При этом освобождаются два электрона, которые при расщеплении молекул серной кислоты были «захвачены» у водорода. На цинковой пластине возникает избыток свободных электронов.
При разомкнутой внешней цепи элемента дальнейшая химическая реакция прекращается, т.к. электроны, скопившиеся на цинковой пластине, отталкивают отрицательные ионы. Между медной и цинковой пластинами устанавливается определённая разность потенциалов, которая для данного элемента равна 1,1 В.
При подключении нагрузки во внешней цепи возникает электрический ток, проходящий от медной пластины к цинковой (движение электронов происходит наоборот). Внутри элемента ток течёт от цинковой пластины к медной. Положительные ионы водорода, находящиеся в электролите, соединяются на поверхности медного электрода с электронами и образуют пузырьки водорода, которые покрывают пластину тонким слоем. Происходит поляризация элемента.
При замкнутой внешней цепи элемента химическая реакция на цинковом электроде протекает непрерывно, так же непрерывно образуются и свободные электроны взамен уходящих во внешнюю цепь. В цепи устанавливается постоянный ток. Во внешней цепи происходит движение электронов в одном направлении, а во внутренней цепи движение положительных и отрицательных ионов в разных направлениях.
Так химическая энергия превращается в электрическую.
Разность потенциалов между цинковым и медным электродами определяет э.д.с. элемента. Величина э.д.с. не зависит от размеров электродов и количества электролита, она определяется только материалом электродов и химическим составом электролита.
Элемент Вольта не может долго работать. Ионы водорода на медном электроде создают как бы другой элемент с э.д.с., направленной против основной и ухудшающей электрические свойства элемента. Для нейтрализации добавляют деполяризаторы.
Сухие гальванические элементы: нашатырь смешан с древесными опилками и крахмалом, цинковый электрод – сосуд, положительный электрод — угольный, газоотводная трубка.
Контрольные вопросы
1. Как называются устройства, преобразующие химическую энергию в электрическую?
2. Что такое электролит?
3. Что такое электролиз?
4. На какие составляющие распадается молекула серной кислоты?
5. Из чего состоит гальванический элемент Вольта?
6. Как происходит поляризация элемента?
7. Какое воздействие оказывают ионы водорода на работу аккумуляторной батареи?
8. Что такое сухой гальванический элемент?
9. Как проходит электрический ток в жидких проводниках?
svyazist-izh.ru
Гальванический элемент: схема, принцип работы, применение
Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.

Химические источники тока
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора. Кроме того, схема двух гальванических элементов предполагает наличие катода и анода. Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.
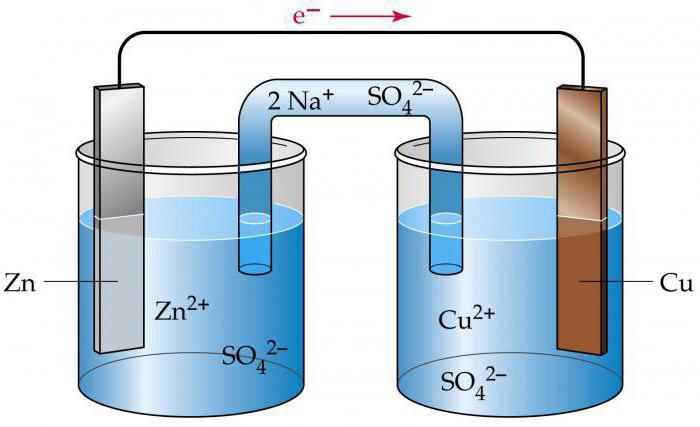
Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде – восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Пример гальванического элемента
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля. Он включает в себя медную пластинку, которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод). Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.
Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Zn = Zn2+ + 2e-
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Cu2+ + 2e- = Cu
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Заключение
Принцип работы любого гальванического элемента основывается на окислительно-восстановительных процессах, протекающих на катоде и аноде. В зависимости от используемого металла, выбранного раствора электролита, меняется срок службы элемента, а также величина номинального напряжения. В настоящее время востребованы литиевые, кадмиевые гальванические элементы, имеющие достаточно продолжительный срок своей службы.
fb.ru
8. Гальванический элемент. Выражение для эдс гальванического элемента. Работа гальванического элемента.
При любой окислительно-восстановительной реакции происходит переход электронов от восстановителя к окислителю. Так, при опускании цинковой пластинки в раствор сульфата меди происходит реакция
Zn + Cu2+ = Си + Zn2+
Здесь восстановитель — цинк — отдает электроны. Эта полуреакция выражается уравнением:
Zn = Zn2+2е—
Окислитель — ион меди — принимает электроны. Уравнение этой полуреакции имеет вид:
Си2+ + 2е— = Си
Эту реакцию можно осуществить таким способом, что окислительная и восстановительная полуреакции окажутся пространственно разделенными, а электроны будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока — по внешней цепи. Этот направленный поток электронов представляет собою электрический ток. При таком осуществлении окислительно-восстановительной реакции ее энергия будет превращена в электрическую энергию, которую можно использовать, включив во внешнюю цепь устройство, потребляющее электрическую энергию (например, электронагревательный прибор, электрическую лампу и т. п.).
Гальванические элементы – это устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую энергию.
В качестве примера на рисунке приведен медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфатом меди.

При работе элемента, т. е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла.
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
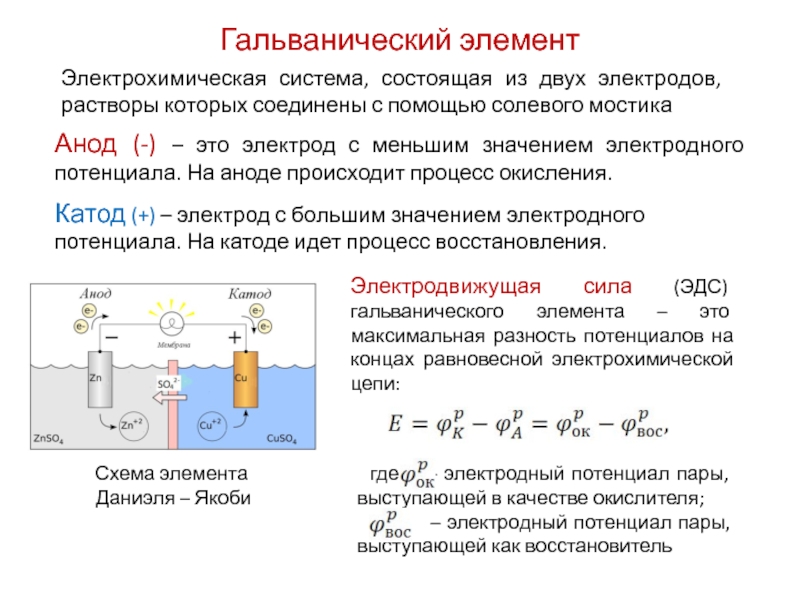
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом. В медно-цинковом элементе цинковый электрод является анодом, а медный — катодом.
Протекающая в гальваническом элементе окислительно-восстановительная реакция представляет собой сложный процесс. Она включает собственно электрохимические стадии (превращения атомов, ионов или молекул на электродах), перенос электронов, перенос ионов. Все эти стадии сопряжены между собой и протекают с одной и той же скоростью; число электронов, которые за единицу времени отдает цинк, равно числу электронов, принимаемых за это же время ионами меди. Поэтому скорость реакции, протекающей в гальваническом элементе, пропорциональна количеству электричества, перенесенного по цепи в единицу времени, т. е. силе тока в цепи.
Электрический ток, протекающий по внешней цепи гальванического элемента, может производить полезную работу. Но работа, которую можно выполнить за счет энергии химической реакции, зависит от ее скорости: она максимальна при бесконечно медленном—обратимом—проведении реакции. Следовательно, работа, которую можно произвести за счет реакции, протекающей в гальваническом элементе, зависит от величины отбираемого от него тока. Если, увеличивая сопротивление внешней цепи, уменьшать ток до бесконечно малого значения, то и скорость реакции в элементе тоже будет бесконечно малой, а работа — максимальной. Теплота, выделяемая во внутренней цепи элемента, будет при этом, наоборот, минимальна.
Работа электрического тока выражается произведением количества прошедшего по цепи электричества на напряжение. В медно-цинковом элементе при окислении одного эквивалента цинка и одновременном восстановлении одного эквивалента ионов меди по цепи пройдет один фарадей (F = 96485 кулонов) электричества, так что полезная работа А’, которую ток может совершить, будет равна
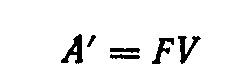
где V— напряжение между полюсами элемента.
Но поскольку эта работа зависит от силы тока, то и напряжение между полюсами элемента тоже зависит от силы тока (F — величина постоянная). В предельном случае, отвечающем обратимому протеканию реакции, напряжение будет максимальным.
ЭДС гальванического элемента – это максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции.
Для этого предельного случая полезная работа, производимая электрическим током в медно-цинковом элементе при взаимодействии одного эквивалента цинка с одним эквивалентом ионов меди, выразится уравнением
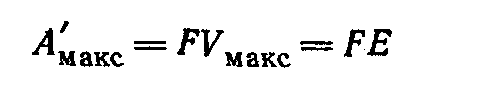
где
 —
э. д. с. элемента.
—
э. д. с. элемента.
При взаимодействии одного моля атомов цинка с одним молем ионов меди уравнение примет вид:
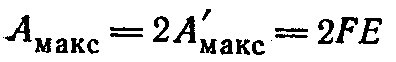
В общем случае при растворении (или выделении) одного моля вещества, ионы которого имеют заряд равный z, максимальная полезная работа связана с э. д. с. уравнением:
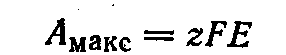
При постоянных
температуре и давлении максимальная
полезная работа реакции равна взятому
с обратным знаком изменению энергии
Гиббса
 .
Отсюда:
.
Отсюда:
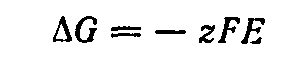
Если концентрации веществ, участвующих в реакции, равны единице, т. е. если соблюдаются стандартные условия, то э.д.с. элемента называется его стандартной электродвижущей силой и обозначается Е°. При этом последнее уравнение принимает вид:

studfile.net
Гальванические элементы
Гальваническим элементом называется электрохимическая система, производящая электрическую энергию за счет протекания в ней окислительно-восстановительной реакции. Наиболее распространенными являются гальванические элементы, состоящие из двух электродов с различными потенциалами. Рассмотрим реакцию:
Zn + CuSO4 = ZnSO4 + Cu
Сущность этой реакции вытеснения сводится к восстановлению одним металлом иона второго. Например, в ряду металлов Zn, Fe, Cu, Ag каждый предыдущий вытесняет последующий из его солей, тогда как обратное вытеснение не наблюдается.
Процесс взаимодействия цинка с ионом меди по приведенной выше схеме можно разбить на две полуреакции:
Zn – 2e = Zn2+
Cu2+ + 2e = Cu
Очевидно, что если бы удалось осуществить передачу электронов не непосредственно, а через металлический проводник, то по нему потек бы от цинка к меди поток электронов, т.е. электрический ток. На рисунке 1 показана схема гальванического элемента, т.е. установки, делающей возможной такую передачу электронов по проводу. В гальваническом элементе происходит непосредственное преобразование энергии химической реакции в электрическую энергию.
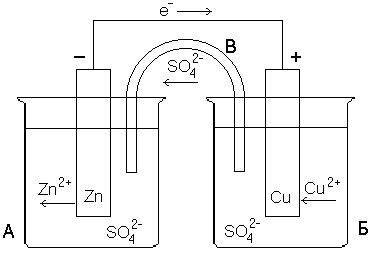
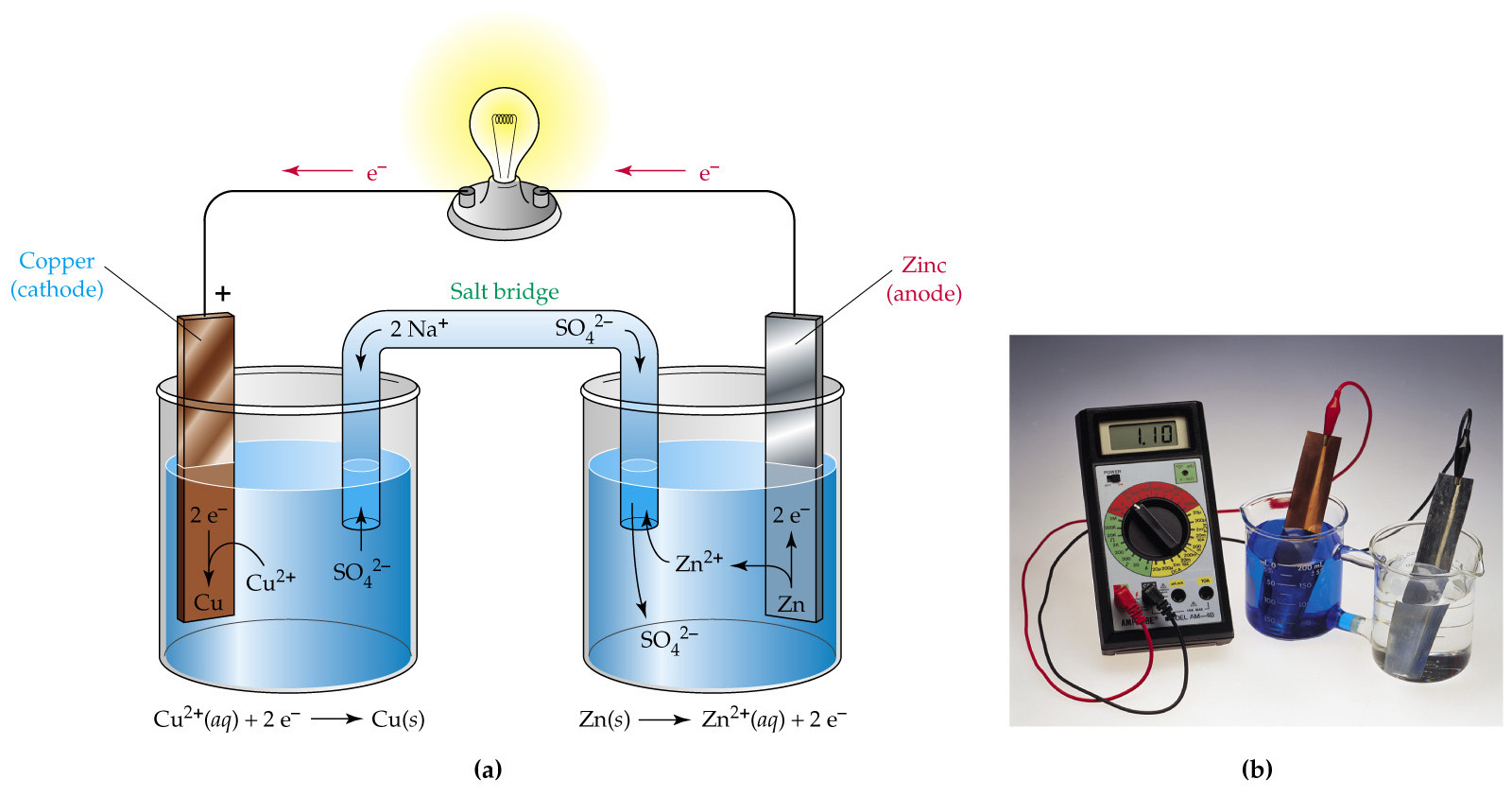
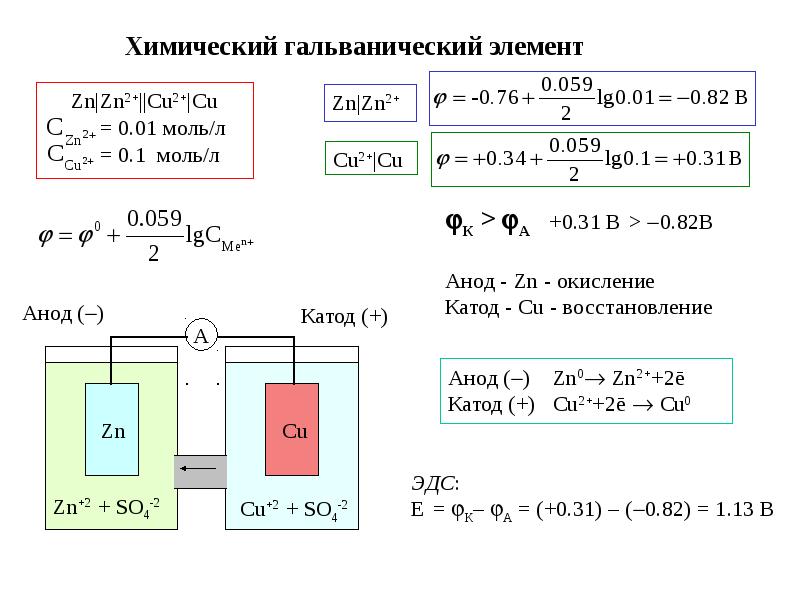
Рисунок 1 – Конструкция медно-цинкового гальванического элемента (элемент Даниэля-Якоби)
Сосуд А заполнен раствором ZnSO4, сосуд Б – раствором CuSO4. В первый из них опущена цинковая пластинка, во второй – медная. Растворы либо разделены пористой полупроницаемой перегородкой (пропускает только ионы), либо соединяются солевым мостиком B, который представляет собой стеклянную трубку, заполненную раствором сильного электролита (обычно KCl или NH4NO3). Если соединить обе пластинки проводом, то по нему в указанном стрелкой направлении начнут перемещаться электроны (потечет электрический ток). Трубка В обеспечивает замкнутость цепи, по ней перемещаются ионы SO42–. Электрод, на котором происходит процесс восстановления (на рисунке 1 – медный) называется катодом, а электрод, на котором осуществляется окисление (в рассмотренном примере – цинковый) – анодом. В электротехнике принята противоположная система обозначений электродов: катодом называют отрицательный полюс источника тока, т.е. электрод, передающий электроны во внешнюю цепь (в данном случае цинковый).
В данном случае электродные процессы являются гетерогенными, т.к. окисленная и восстановленная формы находятся в разных фазах. В более общем виде гетерогенный электродный процесс можно записать в виде:
Me
(ВФ, тв. фаза) – ne–  Men+
(aq) (ОФ, раствор)
Men+
(aq) (ОФ, раствор)
Гальванические элементы принято изображать в виде схемы, в которой указывается электрод и электролит, а вертикальные линии показывают границы раздела. Одна вертикальная черта символизирует границу раздела между металлом и электролитом, двойная вертикальная черта – границу раздела между электролитами:
Анод─ Zn|ZnSO4||CuSO4|Cu +Kатод .
В ионной форме схематическое изображение гальванического элемента: Анод─ Zn|Zn2+||Cu2+|Cu +Kатод .
На границе раздела фаз возникает двойной электрический слой, состоящий из катионов Men+ (в растворе) и электронов (в металле), что приводит к появлению потенциала E(Men+/Me). Его абсолютная величина определению не поддается, однако легко измеряется разность потенциалов катода и анода, которая называется электродвижущей силой (ЭДС) гальванического элемента ∆E=Eк–Eа.
Поскольку самопроизвольно электроны могут переходить только от электрода с большей концентрацией электронов к электроду с меньшей концентрацией, то в процессе действия рассматриваемого гальванического элемента электроны во внешней цепи движутся от цинка к меди. На цинковом электроде происходит процесс окисления, так как значение стандартного электродного потенциала Еº(Zn2+/Zn) = -0,76B меньше Еº(Cu2+/Cu) = 0,34B. ∆Eº = Eº(Cu2+/Cu) — Eº(Zn2+/Zn) = 0,34 –(-0,76) = 1,1(В).
Медь в данном процессе играет роль инертного электрода, который передает электроны, поступившие от цинка, ионам Cu2+, находящимся в растворе CuSO4.Таким образом, на медном электроде происходит восстановление катионов меди. Указанные окислительно-восстановительные процесы отображены в схеме гальванического элемента.
Во внутренней цепи ионы SO42-, оказавшиеся в избытке в катодном пространстве, переходят через пористую перегородку или через солевой мостик в анодное пространство, где компенсируют заряды образовавшихся при окислении ионов цинка.
Элемент будет работать до тех пор, пока цинковый анод полностью не растворится или не восстановится вся медь из раствора CuSO4. При описании работы гальванического элемента выделяют процессы, происходящие на электродах, и суммарную окислительно-восстановительную реакцию, указывают направление движения электронов во внешней цепи и ионов в растворе электролита. Для медно-цинкового гальванического элемента:
Zn ‑ 2ē = Zn2 + — процесс окисления на аноде;
Cu2+ + 2ē = Cu – процесс восстановления на катоде;
Zn + Cu 2+= Zn2+ + Cu – суммарная реакция в гальваническом элементе.
Направление движения электронов – от цинкового электрода к медному. Ионы SO42- перемещаются из сосуда медного электрода в сосуд цинкового.
Если гальванический элемент находится в условиях, отличных от стандартных, то для расчета ЭДС сначала необходимо найти значения потенциалов электродов в данных условиях по уравнению Нернста, а затем вычислять ЭДС элемента. Поскольку электродвижущая сила гальванического элемента всегда положительная величина, при ее определении вычитают из величины более положительного потенциала величину менее положительного:
ПРИМЕР 1. Вычислить ЭДС гальванического элемента, составленного из стандартных цинкового и оловянного электродов, опущенных в растворы сульфатов цинка и олова.
РЕШЕНИЕ. Запишем уравнения электродных равновесий, устанавливающихся на цинковом и оловянном электродах, и выпишем из таблицы значения их стандартных электродных потенциалов:
Zn2+ + 2ē = Zn; Еº = -0,76B;
Sn2+ + 2ē = Sn; Еº = -0,14B.
Электродный потенциал цинкового электрода имеет более низкое значение, следовательно, цинковый электрод будет анодом, на нем будет происходить процесс окисления. На оловянном электроде с бóльшим значением Еº будет происходить восстановление:
Zn — 2ē = Zn2+ -процесс на аноде;
Sn2+ + 2ē = Sn — процесс на катоде;
Zn + Sn2+ = Zn2+ + Sn – суммарная реакция в гальваническом элементе.
Электроны по внешней цепи переходят от цинка к олову. Ионы SO42- будут переходить по солевому мостику из катодного пространства в анодное.
ЭДС = E(Sn2+/Sn) — Е(Zn2+/Zn) = -0,14 – (-0,76) = 0,62(В).
ПРИМЕР 2. Гальванический элемент образован электродом Fe2+/Fe с концентрацией ионов Fe2+ = 0,1 моль/л и серебряным электродом Ag+/Ag с концентрацией ионов Ag+ =0,01 моль/л. Написать уравнения электродных процессов, составить схему гальванического элемента, вычислить его ЭДС.
РЕШЕНИЕ. В таблице находим значения стандартных электродных потенциалов окислительно-восстановительных систем: Eº(Fe2+/Fe) = -0,44B; Eº(Ag+/Ag) = +0,8B. По уравнению Нернста рассчитываем значения Е:
Е (Fe2+/Fe) = -0,44 + 0,059/2lg10-1 = -0,47B;
Е (Ag+/Ag) = +0,8 + 0,059/1lg10-2 = +0,682B.
Поскольку Е(Fe2+/Fe) < E(Ag+/Ag), то на железном электроде будет происходить окисление. т.е. он будет анодом, а на серебряном электроде будет происходить восстановление, т.е. этот электрод будет анодом.:
Fe — 2ē = Fe2+ -процесс на аноде;
Ag+ + ē = Ag — процесс на катоде;
Fe + Ag+ = Fe2+ + Ag — суммарная реакция в гальваническом элементе.
Схема гальванического элемента :
Анод─ Fe|FeSO4||Ag2SO4|Ag +Kатод
Или Анод─ Fe|Fe2+||Ag+|Ag +Kатод.
ЭДС = E(Ag+/Ag) — Е(Fe2+/Fe) = 0,682 – (-0,47) = 1,152(В).
Гальванический элемент может быть составлен не только из различных электродов, но и из одинаковых электродов, погруженных в раствор одного и того же электролита различной концентрации. Такой гальванический элемент называется концентрационным. Он будет действовать до тех пор, пока не произойдет выравнивание концентраций ионов у обоих электродов.
studfile.net

