Что такое гальванический элемент. Как устроен гальванический элемент. Какие бывают виды гальванических элементов. Где применяются гальванические элементы. Каковы преимущества и недостатки гальванических элементов.
Что такое гальванический элемент и как он работает
Гальванический элемент — это химический источник тока, в котором химическая энергия окислительно-восстановительной реакции преобразуется в электрическую энергию. Принцип работы гальванического элемента основан на протекании самопроизвольной окислительно-восстановительной реакции, в ходе которой электроны переходят от одного вещества (восстановителя) к другому (окислителю).
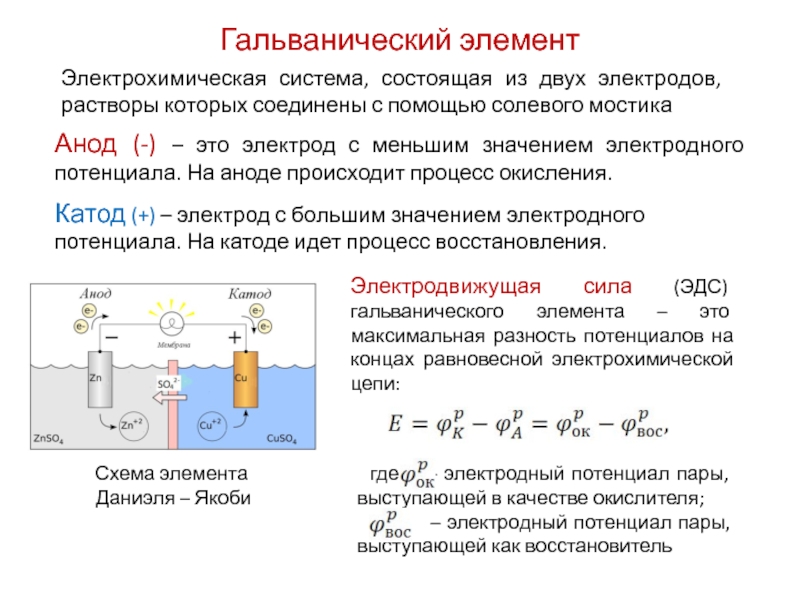
Как устроен простейший гальванический элемент? Он состоит из двух электродов, изготовленных из разных металлов и погруженных в раствор электролита. Металл, имеющий более низкий электродный потенциал, является отрицательным электродом (анодом). На нем происходит реакция окисления с отдачей электронов. Металл с более высоким потенциалом служит положительным электродом (катодом). На нем идет процесс восстановления с принятием электронов.
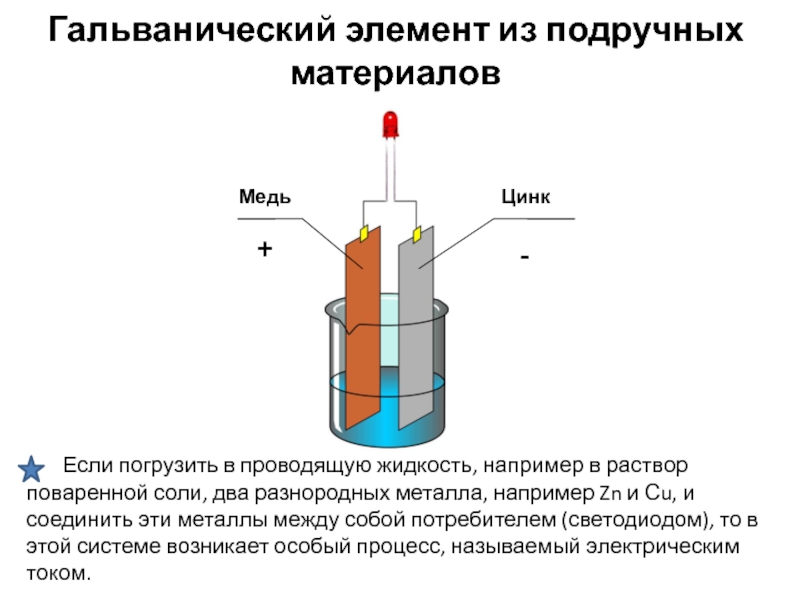
При замыкании внешней цепи электроны начинают двигаться от анода к катоду, создавая электрический ток. Внутри элемента ток обеспечивается за счет движения ионов в электролите. Таким образом, химическая реакция в гальваническом элементе пространственно разделена на два электродных процесса, что позволяет преобразовать ее энергию в электрическую.
Устройство современного гальванического элемента
Современные гальванические элементы имеют более сложное устройство по сравнению с простейшей моделью. Их основными компонентами являются:
- Анод — отрицательный электрод, на котором происходит окисление.
- Катод — положительный электрод, на котором идет восстановление.
- Электролит — проводящая среда, обеспечивающая движение ионов между электродами.
- Сепаратор — пористая перегородка, разделяющая анод и катод.
- Корпус — герметичный контейнер для компонентов элемента.
- Токоотводы — металлические контакты для подключения к внешней цепи.
В качестве активных веществ электродов и электролита используются различные материалы, подобранные для обеспечения оптимальных характеристик элемента. Конструкция также может включать дополнительные компоненты, например, коллекторы тока, газоотводные клапаны и др.
Основные виды гальванических элементов
Существует несколько основных типов гальванических элементов, отличающихся используемыми материалами и конструкцией:
Марганцево-цинковые элементы
Это наиболее распространенный тип. В них используется цинковый анод, катод из оксида марганца и электролит на основе хлорида аммония. Выпускаются в виде цилиндрических батареек разных размеров. Имеют напряжение около 1,5 В.
Щелочные элементы
Имеют цинковый анод, катод из диоксида марганца и щелочной электролит. Обладают большей емкостью и сроком службы по сравнению с солевыми. Напряжение составляет 1,5 В.
Литиевые элементы
Используют литиевый анод и различные катодные материалы (диоксид марганца, оксид серебра и др.). Имеют высокое напряжение (3 В и более), большую емкость и длительный срок хранения. Применяются в портативной электронике.
Серебряно-цинковые элементы
Анод изготовлен из цинка, катод — из оксида серебра. Обладают высокими удельными характеристиками. Из-за высокой стоимости используются в специальной аппаратуре.
Где применяются гальванические элементы
Гальванические элементы нашли широкое применение в различных областях:
- Портативная электроника (смартфоны, ноутбуки, фотоаппараты и др.)
- Бытовые приборы (часы, пульты управления, фонари)
- Медицинское оборудование (слуховые аппараты, глюкометры)
- Автомобильная электроника
- Резервные источники питания
- Военная и космическая техника
Выбор типа элемента зависит от требований к напряжению, емкости, габаритам, стоимости и другим параметрам для конкретного применения.
Преимущества и недостатки гальванических элементов
Гальванические элементы обладают рядом достоинств:
- Автономность и портативность
- Простота конструкции
- Низкая стоимость (для распространенных типов)
- Высокая удельная энергия
- Длительный срок хранения в неактивированном состоянии
К недостаткам можно отнести:
- Ограниченный ресурс (невозможность перезарядки)
- Снижение характеристик при низких температурах
- Возможность протечки электролита
- Экологические проблемы при утилизации
Несмотря на недостатки, гальванические элементы остаются востребованным источником питания для многих устройств благодаря своей доступности и удобству использования.
Перспективы развития гальванических элементов
Хотя гальванические элементы считаются «зрелой» технологией, их совершенствование продолжается. Основные направления развития включают:
- Повышение удельной энергии и мощности
- Увеличение срока службы и хранения
- Улучшение работы при экстремальных температурах
- Разработка более экологичных и безопасных материалов
- Создание гибких и тонкопленочных элементов
Одним из перспективных направлений является разработка воздушно-цинковых элементов с высокой удельной энергией. Также ведутся исследования по созданию биоразлагаемых гальванических элементов для медицинских применений.
Как правильно использовать гальванические элементы
Для обеспечения максимальной эффективности и безопасности при использовании гальванических элементов следует соблюдать ряд правил:
- Использовать элементы, соответствующие требованиям устройства
- Не смешивать элементы разных типов и степени разряженности
- Соблюдать полярность при установке
- Извлекать элементы из устройств при длительном хранении
- Не допускать короткого замыкания контактов
- Хранить в сухом прохладном месте
- Утилизировать отработавшие элементы в специальных пунктах приема
Соблюдение этих простых правил позволит продлить срок службы гальванических элементов и обеспечить их безопасное использование.
Заключение
Гальванические элементы, несмотря на свою длительную историю, продолжают играть важную роль в современной технике. Они обеспечивают автономное питание множества портативных устройств, от бытовых приборов до медицинского оборудования. Хотя в некоторых областях гальванические элементы уступают место перезаряжаемым аккумуляторам, их простота, доступность и удобство использования гарантируют сохранение спроса на эти источники тока в обозримом будущем.
Принцип работы гальванического элемента
Все о гальваническом элементе
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Схема гальванического элемента
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Устройство и принцип работы гальванического элемента
Металл, погруженный в раствор электролита, называется электродом.
Электроды — это система двух токопроводящих тел — проводников первого и второго рода.
К проводникам первого рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда — электроны.
К проводникам второго рода относятся расплавы и растворы электролитов; носители заряда — ионы.
Устройство, состоящее из двух электродов, называется гальваническим элементом.
| Рис. 2. Схема медно-цинкового гальванического элемента |
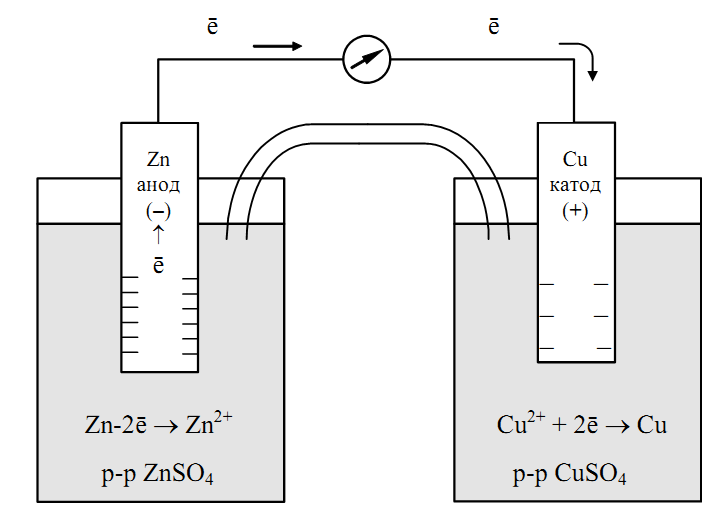
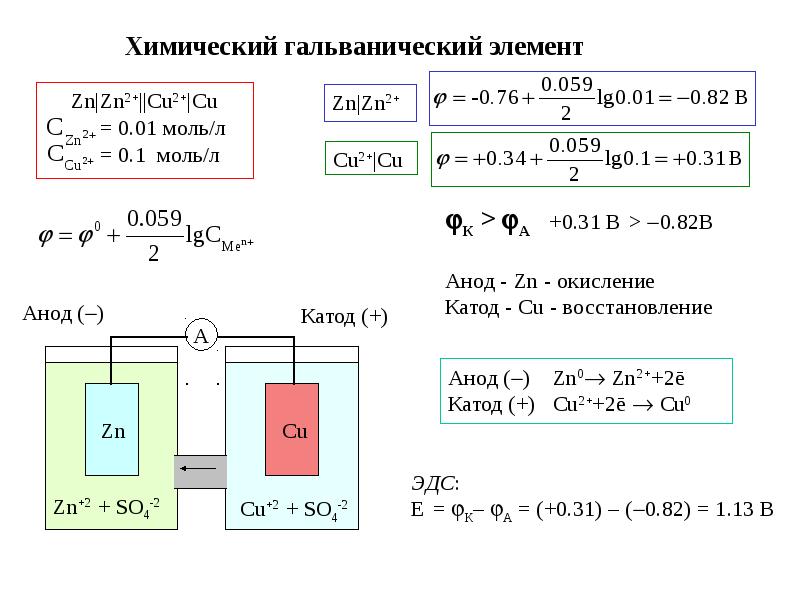
Рассмотрим гальванический элемент Якоби—Даниэля (схема приведена на рис. 2). Он состоит из цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
В гальваническом элементе электрод, сделанный из более активного металла, т.е. металла, расположенного левее в ряду напряжений, называют анодом, а электрод, сделанный из менее активного металла — катодом.
На поверхности цинкового электрода (анода) возникает двойной электрический слой и устанавливается равновесие:
Zn0 – 2ē ←→ Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медного электрода (катода) также возникает двойной электрический слой и устанавливается равновесие:
Cu2+ + 2ē ←→
Cu0.В результате возникает электродный потенциал меди.
Так как потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, то при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате этого процесса равновесие на цинковом электроде смещается вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы или не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе гальванического элемента Якоби—Даниэля протекают следующие процессы:
1. Анодный процесс, процесс окисления:
Zn0 – 2ē → Zn2+.
2. Катодный процесс, процесс восстановления:
Cu2+ + 2ē → Cu0.
3. Движение электронов во внешней цепи.
4. Движение ионов в растворе: анионов SO42– к аноду, катионов Cu2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получим:
Zn + Cu2+ = Zn2+ + Cu.
В результате протекании данной реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. Поэтому суммарную химическую реакцию, протекающую в гальваническом элементе, называют токообразующей реакцией.
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделенными: на отрицательном электроде (аноде) происходит процесс окисления, на положительном электроде (катоде) — процесс восстановления.
Необходимым условием работы гальванического элемента является разность потенциалов электродов. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности между потенциалом катода и потенциалом анода элемента:
ЭДС = Eк – Ea . (1)
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определенный порядок в записи схемы элемента: записанный слева электрод должен быть отрицательным. Например, схема элемента Якоби—Даниэля записывается в виде:
Zn │ ZnSO4 ║ CuSO4 │ Cu .
Гальванический элемент: схема, принцип работы, применение
Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.
Химические источники тока
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора. Кроме того, схема двух гальванических элементов предполагает наличие катода и анода. Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.
Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде – восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Пример гальванического элемента
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля. Он включает в себя медную пластинку, которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод). Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.
Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Zn = Zn2+ + 2e-
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Cu2+ + 2e- = Cu
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Понравилась статья? Расскажите друзьям: Оцените статью, для нас это очень важно:Проголосовавших: 1 чел.
Средний рейтинг: 5 из 5.
Гальванические элементы — Знаешь как
 Химические источники тока (ХИТ) или питания, в которых происходят необратимые процессы преобразования химической энергии в электрическую, называются гальваническими или первичными элементами.
Химические источники тока (ХИТ) или питания, в которых происходят необратимые процессы преобразования химической энергии в электрическую, называются гальваническими или первичными элементами.
Простейший гальванический элемент Вольта (рис. 2-2) состоит из двух электродов — цинкового и медного, погруженных в водный раствор серной кислоты. Часть молекул этой кислоты в присутствии воды распадается на положительные (2Н) и отрицательные (SО4) ионы. Цинковый электрод под действием химических сил растворяется в электролите.
Положительные ионы цинка переходят в раствор, соединяясь с отрицательными ионами (SО4), образуют нейтральные молекулы цинкового купороса (ZnSO4). Положительные ионы водорода заряжают электролит положительно. Цинковый электрод заряжается отрицательно. В результате в пограничном слое цинк — электролит создается разность потенциалов, возникает электрическое поле, направленное от электролита к цинковому электроду. Силы поля противодействуют переходу положительных ионов цинка в электролит. По достижении равновесия между силами электрического поля и химическими растворение цинка в электролите прекращается. Часть положительных ионов (2Н) нейтрализуется за счет свободных электронов медного электрода, который почти не растворяется в электролите. Вследствие этого медный электрод будет иметь положительный потенциал, мало отличающийся от потенциала электролита.
Рис. 2-2. Элемент Вольта и схема его включения
Электродвижущая сила элемента (э. д. с.) равна разности потенциалов между медным и цинковым электродами — напряжению между электродами, если к элементу не присоединена внешняя цепь. Электродвижущая сила элемента Вольта равна около 1,1 в. Электродвижущая сила в элементе направлена от отрицательного электрода (зажима) к положительному и совпадает с направлением тока в нем.
Присоединим к зажимам элемента внешнюю цепь, замкнув рубильник Р (рис. 2-2). Под действием э. д. с. в цепи возникнет ток, при этом во внешнем участке цепи электроны будут двигаться от отрицательного зажима к положительному.

Ток вызывает уменьшение зарядов на электродах, а следовательно, уменьшение электрического поля и нарушение равновесия электрических и химических сил. Под действием последних в электролит переходят новые ионы цинка, а ионы водорода, приближаясь к медному электроду, соединяются с его свободными электронами, становясь нейтральными молекулами водорода. Медный электрод покрывается плохо проводящим слоем пузырьков водорода, отделяющим его от электролита. Это явление называется поляризацией элемента. Она приводит к уменьшению э. д. с. и увеличению внутреннего сопротивления элемента. Для устранения поляризации применяют деполяризаторы — вещества, легко отдающие кислород, например перекись марганца. Кислород деполяризатора, соединяясь с водородом, образует воду, освобождая электрод от плохо проводящего слоя водорода.
В настоящее время из большого числа различных первичных элементов, изготовляемых заводами электротехнической промышленности, наибольшее распространение получили марганцово-цинковые элементы (МЦЭ).
Они изготовляются сухими и наливными.
Последние заливаются электролитом и приводятся в действие непосредственно перед их использованием. Они называются еще резервными, так как могут длительно храниться до заливки их электролитом. Марганцово-цинковые элементы изготовляются стаканчиковой и галетной конструкции.
В марганцово-цинковом элементе стаканчиковой конструкции (рис 2-3) отрицательный цинковый электрод одновременно является сосудом, имеющим форму цилиндрического или прямоугольного стакана.
Положительным электродом служит угольный стержень, расположенный в центре стакана. Вокруг угольного электрода запрессован деполяризатор (смесь двуокиси марганца, графита и сажи). Пространство между деполяризатором и цинковым стаканом заполняется электролитом, представляющим водный раствор хлористого аммония (нашатыря) с добавлением некоторых солей и загустителя — муки.
Рис. 2-3. Марганцово-цинковый элемент (МЦЭ) стаканчикового типа.
Электродвижущая сила МЦЭ составляет около 1,5 в. Наибольший ток, который допускается при использовании элемента, называется номинальным разрядным током элемента. Количество электричества, которое можно получить от элемента за время его работы, называется емкостью элемента. Емкость измеряется в ампер-часах:
1 а•ч = 3 600 а •сек = 3 600 к.
Марганцово-цинковые элементы выпускаются весом от нескольких грамм до 1 кг и более. Из отдельных элементов собираются батареи с напряжением до 160 в. Они применяются для карманных фонарей, слуховых аппаратов, в радиотехнике, аппаратуре связи и т. д.
Статья на тему Гальванические элементы
Гальванический элемент — Студопедия
Гальванический элемент – это химический источник тока, в котором энергия, выделяющаяся при протекании на электродах окислительно-восстановительной реакции, непосредственно преобразуется в электрическую энергию.
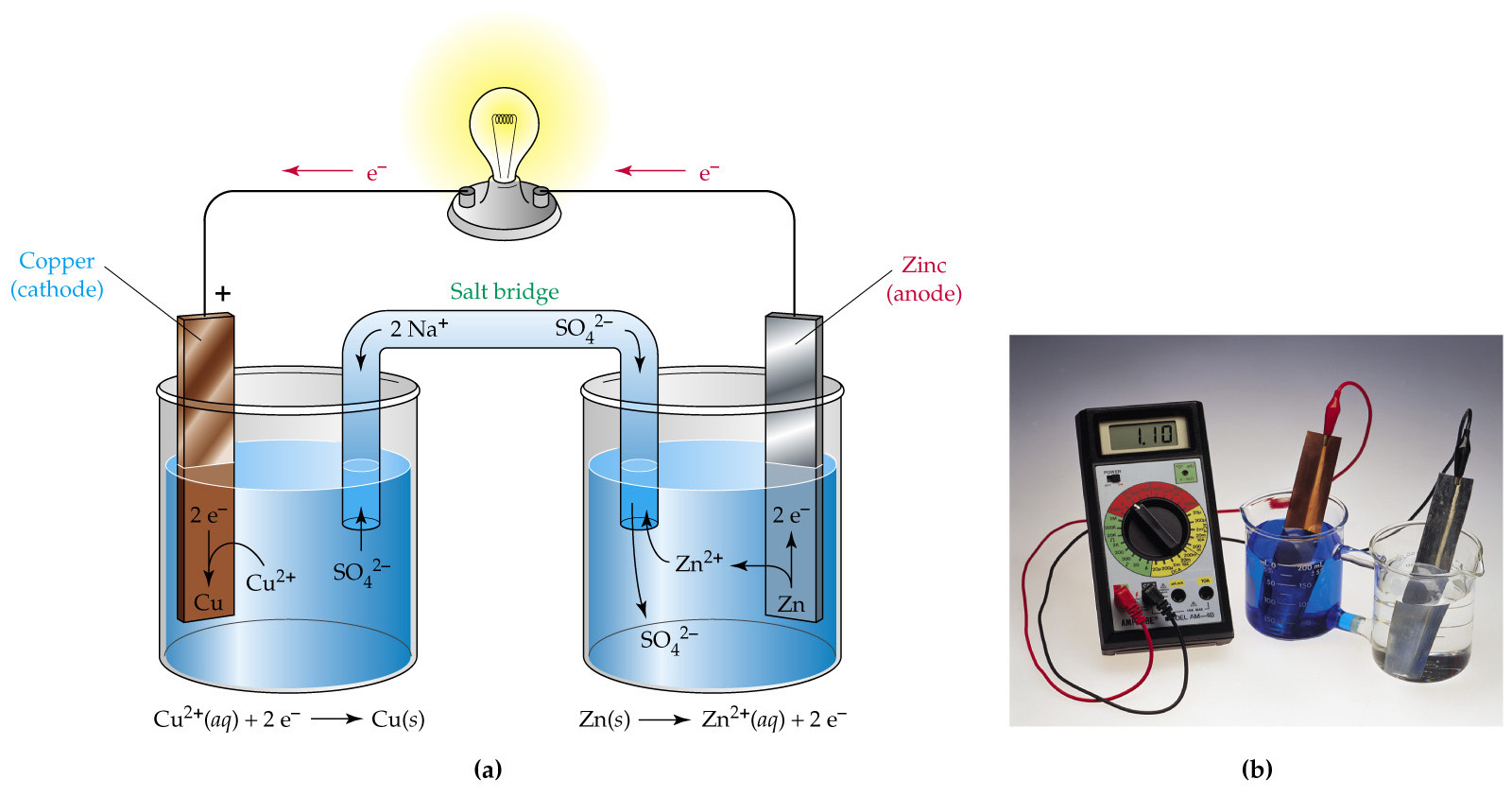
Принцип работы гальванического элемента можно рассмотреть на примере элемента Даниэля – Якоби (рис 9.2).

Рис. 9.2. Схема гальванического элемента Даниэля – Якоби
Здесь I – стакан, содержащий раствор ZnSO4 в воде с погруженной в него цинковой пластинкой; II – стакан, содержащий раствор CuSO4 в воде с погруженной в него медной пластинкой; III – солевой мостик (электролитический ключ), который обеспечивает перемещение катионов и анионов между растворами; IV – вольтметр (нужен для измерения ЭДС, но в состав гальванического элемента не входит).
Стандартный электродный потенциал цинкового электрода  . Стандартный электродный потенциал медного электрода
. Стандартный электродный потенциал медного электрода 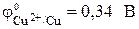 . Так как
. Так как 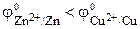 , то атомы цинка будут окисляться:
, то атомы цинка будут окисляться:
| Zn – 2? = Zn2+. | (а) |
Электрод, на котором идет реакция окисления или который посылает катионы в электролит, называется анодом. У рассматриваемого гальванического элемента в роли анода выступает цинковый электрод. Так как стандартный электродный потенциал цинка ниже, чем у меди, цинковому электроду приписывается условный заряд «–», а медному – «+».
Электроны, освободившиеся в результате окисления, по внешней цепи переходят на медь (возникает электрический ток).
На медном электроде происходит процесс восстановления катионов электролита Cu2+:
Электрод, на котором идет реакция восстановления или которыйпринимает катионы из электролита, называется катодом.
Через электролитический ключ происходит движение ионов в растворе: анионов SO42– к аноду, катионов Zn2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Реакции (а) и (б) называются электродными реакциями.
Складывая уравнения процессов, протекающих на электродах, получаем суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе:
| Zn + Cu2+ = Zn2+ + Cu | (в) |
или, с учетом анионов раствора:
| Zn + CuSO4= ZnSO4+ Cu. | (г) |
В общем случае, суммарное уравнение окислительно-восстановительной реакции, протекающей в произвольном гальваническом элементе, можно представить в виде:
| MeА + MeКn+ Á MeАn+ + MeК, | (д) |
где индексы А и К относятся к металлам анода и катода соответственно.
Реакции (в) – (д) называются токообразующими реакциями.
Символическая запись (схема) гальванического элемента имеет вид: 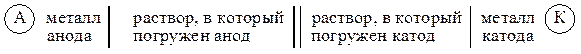
Часто вместо растворов обозначают только катионы, содержащиеся в растворе:
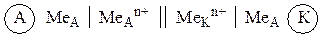 |
(9.3) |
Схема гальванического элемента Даниэля – Якоби имеет вид:
Zn | ZnSO4 || CuSO4 | Cu
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента Е. Она вычисляется по формуле;
| Е= φк – φа, | (9.4) |
где φк и φа – электродные потенциалы катода и анода соответственно.
Величина ЭДС элемента Даниэля – Якоби при стандартных условиях равна:
Е = +0,34 – (–0,76) = 1,10 В.
Электродвижущая сила Е характеризует способность гальванического элемента совершать электрическую работу во внешней цепи.
Электрическая работа определяется максимальной полезной работой, совершаемой химической реакцией, которая равна изменению изобарно-изотермического потенциала ?G процесса. Связь между величиной ?G и ЭДС описывается уравнением:
где n – число электронов в элементарном окислительно-восстановительном акте, F – число Фарадея.
Величина изменения изобарно-изотермического потенциала токообразующей реакции при стандартных условиях ?G0 связана с константой равновесия этой реакции Кравн соотношением
 |
(9.6) |
Гальванические элементы являются первичными (однократно используемыми) химическими источниками тока (ХИТ). Вторичными (многократно используемыми) ХИТ являются аккумуляторы. Процессы, протекающие при разряде и заряде аккумуляторов, взаимнообратны.
Гальванические элементы, у которых электроды выполнены из одного и того же металла и опущены в растворы своих солей разной концентрации, называются концентрационными. Функцию анода в таких элементах выполняет металл, опущенный в раствор соли с меньшей концентрацией, например:
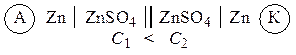
Пример 1. Составьте схему гальванического элемента, в основе которого лежит реакция: Mg + ZnSO4 = MgSO4 + Zn. Что является катодом и анодом в этом элементе? Напишите уравнения процессов, протекающих на этих электродах. Рассчитайте ЭДС элемента при стандартных условиях. Вычислите константу равновесия для токообразующей реакции.
Если отсутствует электрическая сеть, то для питания электроприборов применяют гальванические элементы и аккумуляторы, называемые иначе химическими источниками тока. Рассмотрим принцип их работы на примере первого простейшего элемента – элемента Вольта (рис. 1). Он состоит из медной (Сu) и цинковой (Zn) пластинок, опущенных в раствор серной кислоты (h3SO4). Вследствие химической реакции, происходящей между цинком и серной кислотой, на цинке образуется излишек электронов. Цинк заряжается отрицательно и является отрицательным полюсом. Раствор и медная пластинка, в него погруженная, заряжаются положительно. В результате возбуждается ЭДС, равная примерно одному вольту, которая сохраняется все время, пока цепь не замкнута.
Если замкнуть цепь, пойдет ток и внутри элемента усиленно начнет выделяться водород, покрывающий поверхность пластинок слоем пузырьков. Этот слой уменьшает напряжение на полюсах элемента. Такое явление носит название поляризации. Чем больше ток, тем сильнее поляризация и тем быстрее уменьшается напряжение элемента.
Рис.1. Простейший гальванический элемент Вольта.
Для устранения поляризации в элемент вводят вещества, способные поглощать водород и называемые деполяризаторами. Чтобы напряжение на полюсах оставалось постоянным, деполяризатор должен быстро поглощать водород, образующийся при работе элемента. Поглощая водород, деполяризатор постепенно приходит в негодность. Но обычно раньше этого портится электролит и под действием электролита разъедается цинк. Вообще электрическая энергия получается в элементе за счёт расхода цинка, электролита и деполяризатора; поэтому каждый элемент обладает определенным запасом энергии и может работать лишь ограниченное время.
Работа гальванических элементов объясняется с помощью теории электролитической диссоциации, согласно которой молекулы вещества, растворенного в воде распадаются (диссоциируют) на, ионы. Такое явление характерно для всех электролитов, представляющих собой растворы кислот, щелочей и солей. В элементе Вольта молекула серной кислоты (h3SO4) в водном растворе распадаются на отрицательный ион кислотного остатка (SO4) и положительный ион водорода (h3), что показано на рис. 2.
Химическая реакция между цинком и серной кислотой состоит в том, что положительные ионы цинка переходят в раствор, притягиваясь к отрицательным ионам электролита. При этом цинковый электрод сам заряжается отрицательно. Между ним и электролитом возникает разность потенциалов, а следовательно, и электрическое поле, которое препятствует дальнейшему переходу положительных ионов цинка в раствор. Поэтому создается некоторое равновесие с определенной разностью потенциалов между цинком и раствором. Для других металлов и растворов значение разности потенциалов будет иное.
Чтобы использовать возникшую разность потенциалов, в электролит помещают второй электрод, выполненный из другого металла. Если второй электрод – цинковый, то между ним и растворов получится такая же разность потенциалов, как у первого электрода но она будет действовать навстречу, и результирующая разность потенциалов между электродами будет равна нулю. У элементов отрицательный электрод, как правило, цинковый, а положительный электрод обычно медный или угольный.
Если соединить электроды элемента проводником, т. е. создать замкнутую цепь, то под действием разности потенциалов по внешней цепи от цинка будут двигаться электроны. Так как они уходят с цинкового электрода, то его отрицательный потенциал начинает уменьшаться и электрическое поле между ним и раствором ослабевает. Но тогда новые положительные ионы цинка переходят в раствор. Тем самым поддерживается определенный отрицательный потенциал цинкового электрода.
Рис.2. Ионы в электролите элемента Вольта.
При работе элемента непрерывно происходит растворение цинка в электролите, который постепенно превращается в раствор сернокислого цинка (ZnSO4). Положительные ионы цинка, переходящие все время в электролит, притягивают к себе отрицательные ионы кислотного остатка. Эти ионы в электролите данжутся в направлении от медной пластинки к цинковой. Зато положительные ионы водорода отталкиваются положительными ионами цинка и движутся в обратном направлении, то есть от цинка к меди. Таким об разом, если во внешней цепи ток представляет собой движение электронов (как и всегда в металлических проводниках), то в электролите ток является перемещением положительных и отрицательных ионов в противоположных направлениях. Ионы водорода подходят к медной пластинке и отнимают от нее электроны, превращаясь в нейтральные атомы. Вследствие этого на медной пластинке поддерживается определенный положительный потенциал, несмотря на то, что к ней из внешней цепи прибывают электроны. Однако медная пластинка постепенно покрывается слоем водорода. Между этим слоем и электролитом возникает разность потенциалов, действующая навстречу основной разности потенциалов, имеющейся между электродами. Возникновение такой противоэлетродвижущей силы и называется поляризацией элемента. Вследствие поляризации результирующая разность потенциалов уменьшается и действие элемента ухудшается.
Гальванические элементы характеризуются разными параметрами и прежде всего электродвижущей силой, внутренним сопротивлением, максимальным допустимым разрядным током и емкостью.
Электродвижущая сила обусловливается типом элемента, то есть материалом его электродов, веществом электролита и деполяризатора. Она совершенно не зависит от размеров элемента (размеров его электродов), количества электролита и количества деполяризатора.
Внутреннее сопротивление элемента зависит не только от его типа, но и от его размеров, а также от того, как долго работал элемент. Чем больше размеры элемента, тем меньше его внутреннее сопротивление. По мере работы элемента внутреннее сопротивление растет. Оно особенно резко возрастает у истощившихся элементов. Внутреннее сопротивление у элементов в начале их работы обычно бывает от единиц ом до десятых долей ома. Когда элемент присоединен к замкнутой цепи, напряжение на его зажимах всегда несколько меньше ЭДС и снижается при увеличении тока, так как возрастает потеря части ЭДС на внутреннем сопротивлении элемента. Иногда для элементов указывают напряжение при максимальном разрядном токе в начале работы элемента (начальное напряжение).
Каждый элемент можно разряжать током до определённого значения. Чрезмерно большой ток вызовет ускоренную поляризацию и напряжение быстро станет недопустимо низким. Подобное же явление, но в ещё большей степени происходит при коротком замыкании элемента. У большинства элементов максимальный допустимый разрядный ток составляет доли ампера. Чем больше размеры элемента, тем больше этот ток. Превышение тока приводит и быстрому истощению элемента.
Емкостью элемента называют количество электричества, которое он способен отдать при разряде током не свыше максимального допустимого. Обычно емкость элементов измеряют в ампер-часах (а-ч), то есть произведением разрядного тока в амперах и числа часов работы элемента. Элемент считают разряженным, если его напряжение уменьшилось примерно на 50 % по сравнению с первоначальным значением.
Время работы элемента можно определить, разделив емкость в ампер-часах на разрядный ток в амперах. При этом ток не должен превышать максимального допустимого значения.
Емкость элемента зависит от количества цинка, электролита и деполяризатора. Чем больше размеры элемента, тем больше количество входящих в его состав веществ и тем больше емкость. Кроме того, емкость зависит от разрядного тока, а также от перерывов во время разряда и их длительности. Нормальная емкость элемента соответствует максимальному допустимому разрядному току при непрерывном разряде. Если ток меньше максимального и если разряд происходит с перерывами то емкость увеличивается, а при токе свыше максимального ёмкость снижается, так как часть деполяризатора не участвует в реакциях. Емкость также уменьшается с понижением температуры. Поэтому расчет времени работы элемента по его номинальной емкости и разрядному току является приближенным.
2. МАРГАНЦОВО – ЦИНКОВЫЕ
И ОКСИДНО – РТУТНЫЕ ЭЛЕМЕНТЫ.
Широкое распространение получили марганцово – цинковые (МЦ) сухие элементы с деполяризатором из диоксида марганца.
Сухой элемент стаканчикового типа (рис. 3) имеет цинковый сосуд прямоугольной или цилиндрической формы, являющийся отрицательным электродом. Внутри него помещён положительный электрод в виде угольной
палочки или пластинки, которая находится в мешке, наполненном смесью диоксида марганца с порошком угля или графита. Уголь или графит добавляют для уменьшения сопротивления. Угольный стержень и мешок с деполяризующей массой называют агломератом. В качестве электролита используется паста, составленная из нашатыря (Nh5Cl), крахмала и некоторых других веществ. У стаканчиковых элементов центральный вывод является положительным полюсом.
Рабочее напряжение сухого элемента несколько ниже, чем его ЭДС, равная 1,5 В, и составляет примерно 1,3 или 1,4 В. При длительном разряде напряжение по степенно уменьшается, так как деполяризатор не успевает поглощать весь выделяемый водород, и к концу раз ряда оно достигает 0,7 В.
Рис.3. Устройство сухого элемента.
Другая конструкция сухого элемента, так называемого галетного типа, показана на рис. 4. В нем положительным электродом является деполяризующая масса (угольного электрода нет). Галетные элементы имеют значительно лучшие характеристики, нежели стаканчиковые.
Рис. 4. Устройство сухого галетного элемента.
1 – деполяризатор – положительный электрод; 2 – цинк – отрицательный электрод; 3 – бумага;
4 – картон, пропитанный электролитом; 5 – полихлорвиниловая плёнка.
В каждом элементе, имеющем электролит, даже при разомкнутой внешней цепи происходит так называемый саморазряд, в результате которого разъедается цинковый электрод, а также истощаются электролит и деполяризатор. Поэтому сухой элемент при хранении постепенно проходит в негодность и электролит у него высыхает.
Когда сухие элементы полностью разрядятся, их агломераты ещё работоспособны и могут быть использованы для устройства самодельных наливных элементов. Такие элементы имеют агломерат и электрод из листового цинка в растворе нашатыря, находящемся в стеклянном или керамическом или пластмассовом стаканчике. При отсутствии нашатыря можно с несколько худшими результатами применить раствор обычной поваренной соли с небольшой добавкой сахара. Помимо сухих элементов типа МЦ, широко применяются элементы с марганцово – воздушной деполяризацией (МВЦ). Они устроены аналогично элементам МЦ, но у них положительный электрод сделан так, что к диоксиду марганца по особым каналам поступает наружный атмосферный воздух. Кислород воздуха возмещает потерю кислорода диоксидом марганца при деполяризации. Поэтому деполяризация может происходить значительно дольше и емкость элемента увеличивается.
Физико-химические процессы в элементах с диоксидом марганца происходят следующим образом. Нашатырь, то есть хлористый аммоний (Nh5Cl), в водном растворе образует положительные ионы аммония (Nh5) и отрицательные ионы хлора (Cl). Положительные ионы цинка переходят в раствор и цинк приобретает отрицательный потенциал. При замыкании цепи, когда во внешней цепи электроны движутся в направлении от цинка к углю всё время происходит растворение цинка. Его ионы переходят в электролит, за счёт чего поддерживается отрицательный потенциал цинка. Ионы цинка соединяются с ионами хлора, образуя раствор хлористого цинка (ZnCl2). В то же время ионы Nh5 движутся к угольному электроду, отнимают от него электроны и распадаются на аммиак (Nh4) и водород. Это происходит по уравнению
2Nh5 = 2Nh4 + h3.
Выделяющийся водород вступает в соединение с деполяризатором, то есть диоксидом марганца, образуя оксид марганца и воду:
h3 + MnО2 = MnО2 + Н2О.
В последние годы выпускаются еще сухие герметичные МЦ-элементы со щелочным электролитом (КОН). Они бывают цилиндрические, дисковые и галетные, ёмкостъ у них в три – пять раз больше, чем у элементов с электролитом из нашатыря. Кроме того, они допускают несколько циклов подзаряда током с отдачей 10% емкости. У таких элементов центральный электрод цинковый и является минусом, то есть полярность выводов противоположна полярности выводов обычных МЦ-элементов. Элементы со щелочным электролитом применяются для длительной работы, например, в электронных часах. В обозначениях таких элементов впереди ставится буква А.
У всех элементов начальное напряжение составляет примерно 1,3 – 1,5 В, а конечное напряжение равно 0,7 – 1 В. Хранение сухих элементов или батарей в бездействующем состоянии перед их использованием не должно продолжаться более срока, указанного на них; в противном случае сохранение работоспособности не гарантируется. Однако при хранении в течение указанного срока происходит некоторое снижение емкости, но не больше, чем на одну треть.
В последнее время выпускаются ещё малогабаритные оксидно – ртутные (ртутно – цинковые) герметичные элементы, имеющие более высокие качества, нежели элементы типа МЦ. Устройство оксидно – ртутных элементов показано на рис. 5. Элемент имеет стальной корпус состоящий из двух половин, отделенных друг от друга герметизирующей изоляционной прокладкой из резины.
В одну половину корпуса впрессована активная масса из оксида ртути (HgO) с графитом, являющаяся положительным электродом. Отрицательным электродом служит цинковый порошок, впрессованный в другую половину корпуса. Щелочной электролит (КОН) пропитывает пористую прокладку, разделяющую электроды. Эти элементы выпускаются разных размеров и разной емкости (от десятых долей ампер-часа до нескольких ампер-
часов). ЭДС у них составляет примерно 1,35 В. Срок хранения этих элементов 2,5 года. Саморазряд не превышает 1 % в год. По сравнению с МЦ-элементами ртут-
Рис. 5. Устройство герметичного оксиднво-ртутного элемента;
1 – стальной корпус с положительным электродом; 2 – пористая прокладка; 3 – резиновая уплотняющая прокладка; 4 – крышка корпуса с отрицательным электродом.
но – цинковые элементы имеют большую емкость, меньшее внутреннее сопротивление, но более высокую стоимость. Они широко применяются в электронных часах, кардиостимуляторах, фотоэкспонометрах, измерительных приборах. У самых малогабаритных элементов размеры составляют всего лишь несколько миллиметров, а масса – десятые доли грамма.
Важной особенностью оксидно-ртутных элементов является стабильность напряжения при разряде. Только в самом конце разряда напряжение резко падает до нуля.
3. СОЕДИНЕНИЕ ЭЛЕМЕНТОВ В БАТАРЕИ.
Выше говорилось, что ЭДС обычного химического элемента приблизительно равна 1,5 В. Для увеличения ЭДС применяют батарею с последовательным соединением элементов. В этом случае “+” одного элемента соединяют с “–” другого и т. д. “Минус” первого и “плюс” последнего являются полюсами всей батареи (рис. 6.).
При последовательном соединении элементов ЭДС возрастает во столько раз, сколько соединено элементов.
Рис.6. Последовательное и параллельное соединение элементов в батарею.
Реже встречается параллельное соединение элементов, при котором положительные полюсы всех элементов соединяются вместе, образуя положительный полюс батареи, а отрицательный полюс батареи получается путем соединения отрицательных полюсов элементов (рис. 6). При параллельном соединении элементов ЭДС батареи не увеличивается, но возрастают емкость и максимальный разрядный ток. Поэтому параллельное соединение применяют, когда нужно получить больший разрядный ток и большую емкость, чем у одного элемента.
Значительно чаще прибегают к смешанному соединению, при котором увеличиваются и ЭДС, и емкость, и максимальный разрядный ток. В этом случае обычно соединяют параллельно несколько групп элементов, а в каждой группе соединяют последовательно столько элементов сколько нужно для получения необходимой ЭДС.
Рис. 7. Смешанное соединение элементов в батарею.
Число параллельных групп определяется необходимой величиной максимального разрядного тока (рис. 7). Вообще желательно составлять батареи из последовательно соединённых элементов с достаточным разрядным током. И только в случае, когда необходимо получить больший ток или увеличенную емкость, прибегают к смешанному соединению. Включение дополнительных элементов по принципу смешанного соединения применяется также для повышения напряжения, если элементы сильно разрядились.
Во время бездействия батареи параллельные группы элементов надо отсоединять друг от друга, так как за счет даже незначительной разницы в ЭДС одна группа может разряжаться на другую.
В первых опытах ученых в емкость с кислотой опускали две металлические пластины: медную и цинковую. Пластины соединяли проводником, после чего на медной пластине появлялись газовые пузырьки, а цинковая пластина стала растворяться. Было доказано, что по проводнику проходит электрический ток. Это исследование начинал итальянский ученый Гальвани, от него и получили название гальванические элементы.
После этого ученый Вольта разработал цилиндрическую форму этого элемента в виде вертикального столбика, включающего в себя набор колец меди, цинка и сукна, соединенных друг с другом, и пропитанных кислотой. Разработанный Вольтом вертикальный элемент полуметровой высоты вырабатывал напряжение, которое мог почувствовать человек.
Гальванические элементы — это источники электрической энергии, вырабатывающие электрический ток методом химического взаимодействия двух металлов в электролите. Химическая энергия в гальванических элементах преобразуется в электрический ток.
Виды и особенности устройства
Батарейки широко используются для питания разных электронных устройств, приборов, цифровой техники и делятся на три основных вида:
- Солевые.
- Щелочные.
- Литиевые.
Солевые гальванические элементы
Такие батарейки относятся к марганцево-цинковым элементам питания, и являются наиболее применяемыми в настоящее время.
Достоинствами солевых батареек являются:
- Приемлемые электрические параметры для многих областей использования.
- Удобство применения.
- Малая цена ввиду небольших расходов на изготовление.
- Простая технология изготовления.
- Дешевое и доступное сырье.
Длительное время этот вид батареек является наиболее популярным, благодаря соотношению качества и цены. Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси. Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония. Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция. Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.

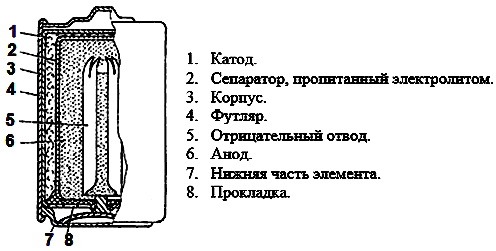
В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите. Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3. Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Щелочные батарейки
Щелочные элементы питания появились в середине прошлого века. В них в качестве окислителя выступает диоксид марганца, а в качестве восстановителя порошковый цинк. Это дает возможность увеличить поверхность. Для предохранения от коррозии раньше применялось амальгамирование. Но после запрета на ртуть используют очищенные цинковые порошки с добавлением других металлов и ингибиторов коррозии.
Активным веществом анода щелочной (алкалиновой) батарейки стал очищенный цинк в виде порошка с добавлением алюминия, индия или свинца. Активная смесь катода включает в себя диоксид марганца, ацетиленовую сажу или графит. Электролит алкалиновых батареек состоит из едкого натра или калия с добавлением оксида цинка.
Порошковый анод позволяет значительно повысить использование активной смеси, в отличие от солевых батареек. Алкалиновые батарейки обладают значительно большей емкостью, чем солевые, при равных габаритных размерах. Они хорошо себя показали в работе на морозе.
Особенностью устройства алкалиновых элементов является порошковый цинк, поэтому вместо цинкового стакана используют стальной корпус для положительного вывода. Активная смесь положительного электрода находится возле внутренней стенки стального корпуса. В алкалиновой батарейке есть возможность разместить больше активной смеси положительного электрода, в отличие от солевой.
В активную смесь вставляется целлофановый сепаратор, смоченный электролитом. По центру батарейки проходит латунный отрицательный электрод. Остальной объем между сепаратором и отрицательным токоотводом заполняется анодной пастой в виде порошкового цинка, пропитанного густым электролитом. Обычно в качестве электролита используют щелочь, насыщенную специальными соединениями цинка. Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
По многим основным параметрам алкалиновые гальванические элементы превосходят солевые элементы. Поэтому в настоящее время увеличивается объем производства щелочных батареек.
Литиевые элементы питания
Литиевые гальванические элементы применяются в различных современных устройствах. Они выпускаются различных типоразмеров и видов.

Существуют литиевые батарейки и , имеющие между собой большие отличия. Батарейки имеют в составе твердый органический электролит, в отличие от других видов элементов. Литиевые элементы используются в местах, где требуются средние и малые токи разряда, стабильное рабочее напряжение. Литиевый аккумулятор можно перезаряжать определенное количество раз, а батарейки не предназначены для этого, и используются только один раз. Их запрещается вскрывать или перезаряжать.
Основные требования к производству
- Надежная герметизация корпуса. Нельзя допускать утечки электролита и проникновения внутрь других веществ из внешней среды. Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
- Изготовление должно проходить в герметичных помещениях с аргоновой атмосферой и контролем влажности.
Форма литиевых аккумуляторов бывает цилиндрической, дисковой или призматической. Габариты практически не отличаются от других видов батареек.
Область использования
Литиевые гальванические элементы обладают более длительным сроком работы, по сравнению с другими элементами. Область применения очень широка:
- Космическая промышленность.
- Авиационное производство.
- Оборонная промышленность.
- Детские игрушки.
- Медицинская техника.
- Компьютеры.
- Фото- и видеокамеры.
Преимущества
- Широкий интервал рабочих температур.
- Компактные размеры и масса.
- Длительная эксплуатация.
- Стабильные параметры в различных условиях.
- Большая емкость.
Недостатки
Два металла, погруженные в растворы своих солей, соединенные проводником, образуют гальванический элемент. Первый гальванический элемент был изобретен Александром Вольтом в 1800 г. Элемент состоял из медных и цинковых пластинок, разделенных сукном, смоченным раствором серной кислоты. При последовательном соединении большого числа пластинок элемент Вольта обладает значительной электродвижущей силой (э.д.с.).
Возникновение электрического тока в гальваническом элементе обусловлено разностью электродных потенциалов взятых металлов и сопровождается химическими превращениями, протекающими на электродах. Рассмотрим работу гальванического элемента на примере медно-цинкового элемента (Дж. Даниэля – Б.С. Якоби).
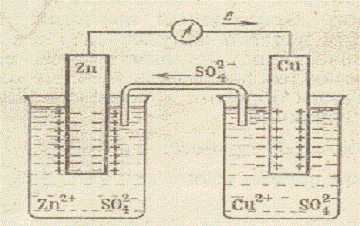
Схема медно-цинкового гальванического элемента Даниэля-Якоби
|
На цинковом электроде, опущенном в раствор сульфата цинка (с = 1 моль/дм3), происходит окисление цинка (растворение цинка) Znо — 2e = Zn2+. Электроны поступают во внешнюю цепь. Zn – источник электронов. Источник электронов принято считать отрицательным электродом – анодом. На электроде из меди, погруженном в раствор сульфата меди (с = 1 моль/дм3) происходит восстановление ионов металла. Атомы меди осаждаются на электроде Cu2+ + 2e = Cuо. Медный электрод положительный. Он является катодом. Одновременно часть ионов SO42- переходят через солевой мостик в сосуд с раствором ZnSO4. Сложив уравнения процессов, протекающих на аноде и катоде, получим суммарное уравнение
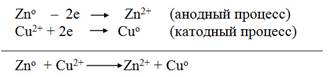
или в молекулярной форме

Это обычная окислительно — восстановительная реакция, протекающая на границе металл-раствор. Электрическая энергия гальванического элемента получается за счёт химической реакции. Рассмотренный гальванический элемент можно записать в виде краткой электрохимической схемы
(-) Zn/Zn2+//Cu2+/Cu (+).
Необходимым условием работы гальванического элемента является разность потенциалов, она называется электродвижущей силой гальванического элемента (э.д.с.). Э.д.с. всякого работающего гальванического элемента величина положительная. Для вычисления э.д.с. гальванического элемента надо из величины более положительного потенциала отнять величину менее положительного потенциала. Так э.д.с. медно–цинкового гальванического элемента при стандартных условиях (t = 25 оС, с = 1 моль/дм3, Р = 1 атм ) равна разности между стандартными электродными потенциалами меди (катода) и цинка (анода), то есть
э.д.с. = ЕоСu2+/Cu — ЕoZn2+/Zn= +0,34 В – (-0,76 В) = +1,10 В.
В паре с цинком ион Cu2+ восстанавливается.
Необходимую для работы разность электродных потенциалов можно создать, используя один и тот же раствор разной концентрации и одинаковые электроды. Такой гальванический элемент называется концентрационным, а работает он за счет выравнивания концентраций раствора. Примером может служить элемент, составленный из двух водородных электродов
Pt, H2 / H2SO4 (с`) // H2SO4 (с«) /H2, Pt,
где с` = [H+]`; с« = [H+]«.
Если р = 101 кПа, с` < с«, то его э.д.с. при 25 оС определяется уравнением
Е = 0,059lg(с«/с`).
При с` = 1 моль-ион/дм3 э.д.с. элемента определяется концентрацией водородных ионов во втором растворе, то есть Е = 0,059lgс« = -0,059 pH.
Определение концентрации ионов водорода и, следовательно, рН среды измерением э.д.с. соответствующего гальванического элемента называется потенциометрией.
Явления поляризации электродов наблюдаются как в гальванических элементах, так и в электролизерах, т. е. при прохождении через электроды постоянного электрического тока независимо от его происхождения (генерации тока в результате работы гальванического элемента или его подвода от внещнего источника к электролизеру). [c.193]
Г.1. ЛАБОРАТОРНАЯ РАБОТА. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ [c.526]
При работе гальванического элемента [c.245]
Реакция, которая протекает при работе гальванического элемента, отвечает уравнению [c.425]
Обратимые и необратимые цепи. Общие термодинамические условия обратимости применительно к работе гальванических элементов могут быть сформулированы следующим образом. Гальванический элемент работает обратимо при соблюдении двух условий 1) если его э. д. с. лишь на бесконечно малую величину превышает приложенную к нему извне и противоположно направленную э. д. с. (обратимость условий работы) и 2) если реакция в элементе может быть полностью обращена в противоположном направлении при приложении к нему извне противоположно направленной э. д. с., которая лишь на бесконечно малую величину превышает э. д. с. данного элемента (обратимость самой цепи, т. е. химических реакций, происходящих на электродах). [c.421]
Согласно уравнению (ХП1,4) при замене Л ах на—АО при работе гальванического элемента в условиях обратимости получим [c.288]
При работе гальванического элемента электрохи-мическая система с более высоким значением электродного потенциала выступает в качестве окислителя, а с более низким — в качестве восстановителя. [c.185]
Гальваническими элементами называются устройства, с помощью которых химическая энергия окислительно-восстановитель-ных процессов может быть преобразована в электрическую. В основе работы гальванических элементов лежат явления, происходящие на границе между металлом и раствором электролита и сопровождающиеся возникновением на ней разности, или скачка, потенциалов. [c.159]
Электрическая работа гальванического элемента равна его э. д. с. ( ), умноженной на переносимый заряд Если во время реакции произойдет восстановление и окисление 2 моль однозарядных ионов, то по закону Фарадея будет перенесено гр Кл Р число Фарадея). [c.131]
Электрохимия изучает некоторые особенности свойств растворов электролитов, электропроводность растворов, процессы электролиза, работу гальванических элементов и электрохимическую коррозию металлов. [c.23]
Электрохимия. Рассматривает важнейшие процессы взаимного превращения электрической и химической форм движения материи, а также свойства и строение растворов электролитов, процессы электролиза, работу гальванических элементов, электрохимическую коррозию металлов, электросинтез веществ и др. В настоящее время электрохимические методы исследования и анализа приобретают все большее значение в практике заводских, агрохимических, почвенных и других лабораторий. [c.6]
Э. д. с. гальванической цепи, записанной для обратного направления этой реакции, приписывается отрицательный знак. Он показывает, что элемент может работать, лишь когда данная реакция осуществляется в направлении, противоположном указанному в записи цепи. При этом он будет обладать той же величиной э. д. с., но знаки заряда электродов будут обратными. Течение же реакции в направлении, указываемом записью цепи, в этом случае не только не может служить источником работы гальванического элемента, но, наоборот, требует затраты работы извне, т. е. требует приложения э. д. с. извне и может осуществляться путем электролиза. [c.420]
Электрохимическая коррозия протекает в результате электрохимического взаимодействия различных составных частей данного металла или металлического изделия это взаимодействие происходит главным образом вследствие возникновения и работы гальванических элементов. Подобная форма коррозии наблюдается как при соприкосновении металла с водой, раствором электролита или другой жидкой средой (жидкостная коррозия), так и при соприкосновении его с влажным воздухом или другим влажным газом (атмосферная коррозия), т. е. в условиях, когда на поверхности металла может образоваться хотя бы тонкая пленка влаги. [c.454]
Получаемая в процессе работы гальванического элемента энергия электрического тока равна произведению количества электричества, прошедшего от анода к катоду, на напряжение, т. е. разность между потенциалами катода н анода. Максимальное значение этого напряжения называется электродвижущей силой гальванического элемента. [c.204]
Риа. 5. Схема работы гальванического элемента [c.36]
Очистка цементацией [1, 2] основана на принципе, сходном с работой гальванических элементов и электрохимической коррозией металлов. При этом в общей химической реакции окисление (анодный процесс) и восстановление (катодный процесс) протекают на разных участках, энергетически для этого более выгодных, что возможно из-за наличия проводящей среды. Поэтому скорость реакции вытеснения типа [c.241]
При работе гальванического элемента, образовавшегося при коррозии алюминия, находящегося в контакте с железом в среде влажного воздуха, за 1 час работы на железном катоде восстановился кислород объемом 0,025 л. Определите, насколько уменьшилась при этом масса алюминиевого электрода и чему равна сила тока, прошедшего во внешней цепи гальванического элемента. [c.154]
Если во время работы гальванического элемента на его электродах в единичном акте реакции окисляется или восстанавливается 2 эквивалентов вещества, то по металлическому проводнику, замыкающему электроды этого элемента, переносится Q = = гР кулонов электричества, где Р 96 500 Кл/экв — электрический заряд 1 экв вещества. Отсюда имеем Ш = гРи, где V — разность электростатических потенциалов электродов работающего гальванического элемента 11 = фси — Ф2п- [c.242]
Таким образом, под действием напряжения и к > Е на электродах гальванической пары протекают процессы, противоположные процессам
Настройка гальванических элементов
Гальванические элементы используют электрическую энергию, доступную от перенос электрона в окислительно-восстановительная реакция на выполнение полезных электромонтажных работ. Ключ к собирая поток электронов должен разделять окисление и восстановление полуреакции, соединяя их проводом, так что электроны должны течь через это провод. Этот электрон поток, называемый током, может быть отправлен через цепь, которая может быть часть любого числа электрических устройств, таких как радио, телевизоры, часы и т. д.
На рисунке ниже показаны две типичные установки для гальванических элементов. левая клетка Диаграмма показывает и окисление и восстановительную половинную реакцию, объединенную как провод и пористый диск, в то время как правая ячейка диаграммы показывает ту же ячейку заменяя солевой мостик для пористого диска.
 Рисунок%: диаграмма гальванического элемента
Рисунок%: диаграмма гальванического элемента
Солевой мостик или пористый диск необходим для поддержания заряда нейтральность каждой полуэлемента, позволяя потоку ионов с минимальным перемешиванием полуэлемента решения.Так как электроны переносятся из окислительной полуэлемента к восстановлению полуэлемент, отрицательный заряд строится в восстановительной полуэлементе и положительный заряд в полуклетка окисления. Который Накопление заряда будет противостоять току от анода к cathode— эффективно останавливая поток электронов — если в клетке не было пути для ионов течь между два решения.
Приведенный рисунок указывает на то, что электрод при окислении полуклетка называется анодом, а электрод в восстановительной полуэлементе называется катод.Хороший мнемоника, чтобы помочь вспомнить, что означает « Рыжий кот съел вола » сокращение происходит на катоде и окисление происходит на аноде.
Анод, как источник отрицательно заряженных электронов, обычно отмечен знак минус (-) и катод отмечен знаком плюс (+). Физикам определить направление потока тока как поток положительного заряда на основе 18-го века понимание электричества. Как мы теперь знаем, отрицательно заряженные электроны течь в провод.Поэтому химики указывают направление электронного потока на клетку диаграммы и не направление тока. Чтобы прояснить этот момент, направление поток электронов указан со стрелкой и символом для электрона, e —
 %: Диаграмма гальванического элемента, показывающая направление потока электронов
%: Диаграмма гальванического элемента, показывающая направление потока электронов
Линейная нотация для гальванических элементов
Вместо того, чтобы рисовать клеточную диаграмму, например, или химики разработали сокращенный способ полностью описание клетки названная линия обозначения.Эта схема обозначений размещает составляющие катод на справа и анодные компоненты слева. Фазы всех реактивных виды перечислены и их концентрации или давления приведены, если эти виды не находятся в их стандарт состояния (то есть 1 атм. для газов и 1М для растворов). Вся фаза интерфейсы отмечены с одна линия (|) и несколько видов в одной фазе разделены запятые. Для Например, полуэлемент, содержащий 1М растворы CuO и HCl и Pt электрод для сокращение Cu 2+ будет записано как:
,Гальванические элементы — это устройство, которое преобразует химическую энергию в электрическую. Это общее применение электрохимии, которая также называется батареей. Он был изобретен Луиджи Гальвани и Алессандро Вольта, который способен производить напряжение. Он имеет два проводящих электрода, называемых анодом и катодом. Анод является электродом, где происходит окисление. Катод — это электрод, на котором происходит восстановление.
Гальванические элементы — это устройство, которое преобразует химическую энергию в электрическую.Это общее применение электрохимии , которая также называется батареей. Он был изобретен Луиджи Гальвани и Алессандро Вольта , который способен генерировать напряжение.
В этой камере находится контейнер, в котором содержится раствор концентрированного сульфата меди (CuSO 4 ), а внутри раствора CuSO 4 вставлен медный стержень, который действует как катод. Внутри этого контейнера находится пористый контейнер , в котором заполнена концентрированная серная кислота (H 2 SO 4 ), в которую вставлен цинковый стержень, который действует как анод.Таким образом, когда провод соединен через медный стержень и цинковый стержень, электрический ток начинает течь.
Важные компоненты гальванических элементов
- Анод — это электрод, где происходит окисление.
- Катод — это электрод, на котором происходит восстановление.
- Солевой мостик — это камера электролитов, необходимая для замыкания цепи в гальваническом элементе.
- Реакции окисления и восстановления разделены на части, называемые полуклетками.
- Внешняя цепь используется для проведения потока электронов между электродами гальванического элемента и обычно включает в себя нагрузку.
- Нагрузка — это часть цепи, которая использует поток электронов для выполнения некоторой функции.
Как работают гальванические элементы?
Гальванические элементы имеют два проводящих электрода, называемых анодом и катодом. Анод является электродом, где происходит окисление. Катод — это электрод, на котором происходит восстановление.Электроды могут быть изготовлены из любых достаточно проводящих материалов, таких как металлы, полупроводники, графит и даже проводящие полимеры. Между этими электродами находится электролит, который содержит ионы, которые могут свободно двигаться.
Ячейка использует два разных металлических электрода, каждый в растворе электролита. Анод будет подвергаться окислению, а катод — восстановлению. Металл анода будет окисляться, переходя из степени окисления 0 (в твердой форме) в положительную степень окисления, и он станет ионом.На катоде ион металла в растворе будет принимать один или несколько электронов от катода, и степень окисления иона уменьшится до 0. Это образует твердый металл, который осаждается на катоде. Два электрода должны быть электрически соединены друг с другом, чтобы обеспечить поток электронов, которые покидают металл анода и протекают через это соединение к ионам на поверхности катода. Этот поток электронов является электрическим током, который можно использовать для выполнения работы, например, для вращения двигателя или включения света.
,Электролитические и гальванические (например, гальванические) элементы — это два метода производства энергии. Обе клетки используют окислительно-восстановительную реакцию; электролитические элементы используют окислительно-восстановительные реакции для преобразования электрической энергии в химическую энергию, в то время как гальванические элементы используют окислительно-восстановительные реакции для преобразования химической энергии в электрическую энергию.
В окислительно-восстановительной реакции один компонент в реакции окисляется (теряет электроны), а один компонент восстанавливается (приобретает электроны).Например, когда 2Ag + (aq) реагирует с Cu (s), он создает Cu2 + (aq) и 2Ag (s). Серебро (Ag) выходит из степени окисления от +1 до 0, что означает, что он получил электрон и был восстановлен. Медь (Cu) выходит из состояния окисления от 0 до 2+, то есть теряет два электрона и окисляется. Разница между гальванической и электролитической ячейками заключается в том, что гальваническая ячейка позволяет окислительно-восстановительной реакции происходить самопроизвольно и преобразует энергию в электричество, в то время как электролитической ячейке требуется ввод энергии для запуска окислительно-восстановительной реакции в обратном направлении.
В гальваническом элементе электрод, изготовленный из металла любого типа, помещают в раствор ионов металла того же типа металла (например, электрод Cu в растворе ионов Cu2 +). Так как медь окисляется, это потому что анод. Анод (отрицательный, источник электронов) соединен проводом с другим металлическим электродом в другом растворе иона (скажем, Ag в растворе Ag +). Поскольку Ag + уменьшается в этой реакции, электрод Ag является катодом (положительный, приемник электронов). Поток электронов пойдет от анода к катоду.Растворы связаны солевым мостиком, сделанным из какой-то ионной соли (скажем, KCl). Этот солевой мостик имеет решающее значение, поскольку он нейтрализует два решения, позволяя потоку электронов продолжаться. Если бы солевой мост отсутствовал, реакция прекратилась бы сама, и поток электричества прекратился бы. Реакция гальванического элемента — тип реакции, найденной в батарее.
Электролизер устанавливается таким же образом, за исключением того, что в систему вводится электричество для запуска окислительно-восстановительной реакции в обратном направлении.Анод теперь положительный, потому что он принимает электроны, а катод отрицательный, потому что он является источником электронов. Электролитические ячейки могут быть использованы для изготовления определенных элементов (производство алюминия) или для изготовления ювелирных изделий или монет, или для применения в научных исследованиях (камеры ПЦР).
Флорида Атлантический университет 2015 — Биология
5«Во время обучения в аспирантуре Университета Флориды в Атлантике я преподавал микробиологию, генетику, биотехнологию и анатомию…»
Гальванический элемент / батарея преобразует химическую энергию в электрическую, тогда как электролитический элемент работает в обратном порядке. (электрическая к химической энергии)
Анкита С. Электролитические и гальванические элементыCase Western Reserve University 2018 — Биология
—«Я всегда интересовался репетиторством с юных лет.Дома я помогала двум моим младшим братьям и сестрам делать домашнее задание и … »
Гальванические элементы — это устройства, в которых две половинные реакции окислительно-восстановительной реакции происходят в разных камерах, и электроны текут из одной камеры в другую по проводам. Гальванические элементы эксергонны, с отрицательным изменением свободной энергии; реакция «хочет» произойти. Аккумуляторы представляют собой гальванические элементы.Электролитические ячейки — это то же самое, за исключением того, что они имеют положительное изменение свободной энергии. Они используют электрическую энергию для управления химией. Обычно они используются для восстановления ионов металла до металла, на который мы хотим нанести новый металл.
Университет штата Айова 1983 — биохимия
1«Я преподавал биохимию и смежную химию в Университете Болл в течение одного года, а также химию и биохимию в…»
Гальванические элементы — это электрохимические элементы, которые содержат спонтанную реакцию и всегда имеют положительное напряжение. Электрическая энергия, выделяемая во время реакции, может быть использована для работы. Полуэлемент, в котором происходит окисление, называется анодом. Другая полуэлемент, где происходит восстановление, называется катодом. Электроны в гальванических элементах протекают от отрицательного электрода к положительному электроду, который течет от анода к катоду.
Электролитические ячейки — это электрохимические ячейки, которые используют реакции, которые не являются спонтанными и которые протекают с применением электрического тока.
Арлин Б. Электролитические и гальванические элементыФилиппинский университет Дилиман 2008 — Химия
2.2K«Я преподаю курсы Бакалавриата по химии уже почти 10 лет (с июня 2008 года по настоящее время). Я преподаю общее …»
Электролиз = Электро (электрическая энергия электронов) и Лизис (ломающийся): электролитическая ячейка — это ячейка, в которой вы расщепляете молекулы путем подачи электрической энергии.Другими словами, это ячейка, где реакция восстановления и окисления происходят одновременно, когда вы поставляете электричество.
Гальваническая ячейка является противоположностью электролитической ячейке. К сожалению, имя носит имя Луиджи Гальвани и не очень интуитивно понятно. В гальваническом элементе происходит спонтанная химическая реакция (без подачи электрической энергии) для производства электроэнергии. Следовательно, электролитические и гальванические элементы достигают противоположной цели.
Индийский технологический институт, Бомбей 2008 — Химия
—«Я доктор философиии иметь опыт преподавания курсов химии, в частности, на уровне выпускников. Я тоже наставник … »
Это два основных типа «электрохимических» ячеек. В электролитической ячейке энергия подается в ячейку путем подачи напряжения для управления химической реакцией, тогда как в гальванической ячейке протекает спонтанная химическая реакция, которая вырабатывает электрическую энергию.Гальванические элементы — это «батареи».
Амир Б. Электролитические и гальванические элементыУниверситет Торонто 2017 — Химия
10«В настоящее время ассистент преподавателя кафедры Университета Торонто.химии. — Был учителем в старшей школе … »
Гальванические элементы, также известные как Вольтовые элементы, построены из спонтанных процессов, которые генерируют напряжение, или ЭДС. Гальванические элементы обычно включают в себя две полуэлемента, соединенные солевым мостиком, где окисление происходит в одной ячейке, а восстановление в другой. Каждая ячейка будет включать электрод и жидкую фазу, и электроды обычно соединяются проводом с вольтметром, который измеряет напряжение.Ячейка OXidation содержит ANode (AN OX), а ячейка REDuction содержит CAThode (RED CAT). Солевой мостик позволяет балансировать заряды для продолжения процесса. Вещество с более высоким (более положительным) восстановительным потенциалом восстанавливается, а другое окисляется. Потенциал ячейки определяется путем вычитания потенциала на окислительной ячейке (анод) из потенциала на восстановительной ячейке (катод). Электроны текут от анода (отрицательный) к катоду (положительный).
Электролитические ячейки, с другой стороны, являются спонтанными процессами, которые требуют внешнего источника энергии.Примером может быть наведение противоположной реакции в гальваническом элементе путем возбуждения реакции в несамостоятельном направлении через батарею.
Джерри Л. Электролитические и гальванические элементыКорнельский университет 2016 — Химия
—«Я обучал учеников-сверстников по химии в средней школе и по всем уровням математики до математического анализа.Как колледж химии специальности … »
Электролитические и гальванические элементы, изученные во вводной химии и за ее пределами, могут дать общее представление о том, как работают аккумуляторы, одно из самых повседневных применений электрохимии. Эти клетки также изучаются в аналитической химии как предметы вольтамперометрии и кулонометрии.С точки зрения карьеры, это очень полезно для инженеров многих дисциплин.
Университет Фордхэм 2017 — Психология, Незначительное в женских исследованиях, пр …
3«В старших классах я обучал студентов (через соответствующие общества чести) математике, французскому языку и фундаментальным наукам.Я…»
Основное различие между электролитическими и гальваническими элементами состоит в том, что электролитический двигатель вызывает спонтанные реакции, в то время как гальванические элементы вызывают спонтанные реакции.
Университет Джона Хопкинса 2014 — Биология и Восточноазиатские исследования
7«В старших классах я учил новичков играть на 21-струнной китайской цитре под названием« Ян И Гучжэн »…»
Эта тема поможет вам понять энергетические исследования. Изучение того, как различные виды элементов будут предоставлять знания о топливных элементах и как производятся различные типы элементов питания. Это постоянная тема исследований, поскольку ученые стремятся найти дешевые альтернативные источники энергии.
Электрохимия также является важным аспектом аналитической химии.Например, можно использовать электролитические и гальванические элементы, чтобы найти продукт растворимости (Ksp) определенного нерастворимого вещества путем мониторинга химических концентраций и напряжений. Это было бы гораздо более практичным, чем пытаться найти такие маленькие значения, которые почти невозможно найти иначе.
Корнельский университет 2016 — Химия
—«Я обучал учеников-сверстников по химии в средней школе и по всем уровням математики до математического анализа.Как колледж химии специальности … »
,Автор: Редакция | Обновлено: 18 ноября 2017 г.
Вольтовые или гальванические элементы и электролизеры являются электрохимическими элементами. Электрохимические элементы — это устройства, которые преобразуют химическую и электрическую энергию. Существует множество применений, связанных с электрохимическими ячейками. Вольтовые или гальванические элементы и электролитические элементы — это слова, которые мы не слышим каждый день, но мы постоянно используем их. В этой статье мы определим их и опишем, как они отличаются.
Сводная таблица
| Гальванические или гальванические элементы | Электролизеры |
| Преобразует химическую энергию в электрическую энергию | Преобразует электрическую энергию в химическую энергию |
| Производит электричество из химической реакции | Вызывает химическую реакцию от электрической энергии |
| Окислительно-восстановительная реакция является спонтанной | Окислительно-восстановительная реакция индуцируется от внешнего источника электрической энергии |
| Анод является отрицательным электродом | Анод является положительным электродом |
| Катод является положительный электрод | Катод является отрицательным электродом |
Описание
 Гальваническая или гальваническая ячейка
Гальваническая или гальваническая ячейка Гальваническая ячейка представляет собой электрохимическое устройство, которое вырабатывает электрическую энергию в результате реакции самопроизвольного восстановления-окисления, Так называемая окислительно-восстановительная реакция.Окислительно-восстановительная реакция представляет собой химическую реакцию, в которой один реагент теряет электроны (реакция окисления), а другой реагент — электроны (реакция восстановления).
Вольтовая ячейка обычно состоит из двух разных металлов; каждый погружен отдельно в ионные растворы соответствующего металла и соединен вместе солевым мостиком. Металлы называются электродами. Один электрод называется анодом и является местом, где происходит процесс окисления. Поскольку реагент на этом электроде высвобождает электроны, во время реакции будет накапливаться отрицательный заряд.
На гальваническом элементе анод также называется отрицательным электродом. Другой электрод называется катодом, и именно здесь происходит реакция восстановления. На этом электроде реагент потребляет электроны, оставляя чистый положительный заряд. Катод тогда называют положительным электродом для гальванических элементов. Из-за этого накопления зарядов на каждом электроде соединение электродов с проводником завершает цепь и инициирует протекание тока через цепь.
Вольтаическая ячейка получила свое название от итальянского ученого Алессандро Вольта.Volta разработала первую батарею, которая состояла из стопки медных и цинковых дисков, разделенных картоном, смоченным в соленой воде. Строго говоря, батарея определяется как группа из нескольких отдельных гальванических элементов, электрически соединенных последовательно. Каждая единица медь-картон-цинк представляет собой одну ячейку, а вольтовая батарея — это батарея.
Применения включают щелочные сухие батареи, в которых в качестве катода используется диоксид марганца (MnO2), а в качестве анода — цинк (Zn). В мобильных телефонах обычно используются литий-ионные аккумуляторы, в которых в качестве анода используется литий.Другим примером гальванического элемента является свинцово-кислотный аккумулятор, чаще всего используемый в качестве автомобильных аккумуляторов. Они используют свинец (Pb) в качестве анода и диоксид свинца (PbO2) в качестве катода с серной кислотой (h3SO4) в качестве электролитического раствора.
Гальванический элемент — это просто другое название гальванического элемента и может использоваться взаимозаменяемо. Он получил свое имя от другого итальянского ученого, Луиджи Гальвани. Он был первым, кто обнаружил, что когда два разных металла, соединенных друг с другом, одновременно касаются разных точек на нерве ноги лягушки, это может привести к сокращению мышц ноги.Это позволило Вольте исследовать и разработать вольтовую кучу, упомянутую ранее.
 Электролизер
Электролизер Электролизер — это устройство, которое вызывает окислительно-восстановительные реакции путем подачи электрической энергии. Электролизер обычно состоит из двух электродов и водного раствора растворенных ионов, также называемого электролитом. В электролизере напряжение, приложенное к электродам, вызывает окислительно-восстановительную реакцию, когда ионы в электролите притягиваются к электроду противоположного заряда.В электролизерах катод несет отрицательный заряд, а анод — положительный заряд. Это потому, что реакция восстановления происходит, когда электроны нагнетаются в систему внешним электрическим источником, заставляя ионы приобретать электроны. По определению, катод является электродом, где происходит процесс восстановления. Противоположное верно для другого электрода, анода, где происходит реакция окисления. Внешний источник напряжения всегда требуется для инициирования и поддержания окислительно-восстановительной реакции в электролизере.
Типичным применением электролизеров является электролиз, примером которого является разделение воды на кислород и водород. В процессе электролиза на аноде образуются пузырьки кислорода, а на катоде образуется водород. Другое практическое применение — гальваника. Металл, который наносится, помещается на катод, а металл, используемый для нанесения покрытия, помещается на анод. Растворенные ионы плакирующего металла осаждаются на целевом металле на катоде. Аккумуляторы при разряде действуют как гальванические элементы, но при перезарядке они действуют как электролитические элементы.
Вольтовые или гальванические элементы против электролитических ячеек
В чем разница между вольтовыми или гальваническими элементами и электролизерами? Вольтовые или гальванические элементы преобразуют химическую энергию в электрическую и производят электричество в результате химической реакции. Электролитические ячейки, с другой стороны, преобразуют электрическую энергию в химическую энергию, вызывая химическую реакцию от электрической энергии. Окислительно-восстановительная реакция в гальванических или гальванических элементах является самопроизвольной, в то время как окислительно-восстановительная реакция в электролизерах индуцируется от внешнего источника электрической энергии.В гальванических или гальванических элементах анод является отрицательным электродом, а катод — положительным электродом. И наоборот, в электролизерах анод является положительным электродом, а катод — отрицательным электродом.

