Что такое катод и анод. Где у них плюс, а где минус. Как определить полярность катода и анода. Применение в электрохимии, гальванотехнике и электронике. Принцип работы в различных устройствах.
Основные понятия: катод и анод
Катод и анод — это электроды, используемые в различных электротехнических и электрохимических устройствах. Их основные характеристики:
- Катод — электрод, на котором происходит процесс восстановления (присоединения электронов)
- Анод — электрод, на котором происходит процесс окисления (отдачи электронов)
При этом полярность катода и анода может меняться в зависимости от типа устройства и протекающих процессов. Разберемся подробнее, где у них плюс, а где минус.
Полярность катода и анода в разных устройствах
Полярность катода и анода не является постоянной и зависит от конкретного применения:
- В гальванических элементах и аккумуляторах при разрядке:
- Катод — положительный электрод (+)
- Анод — отрицательный электрод (-)
- При электролизе и зарядке аккумуляторов:
- Катод — отрицательный электрод (-)
- Анод — положительный электрод (+)
- В электронных приборах (диодах, электронных лампах):
- Катод — отрицательный электрод (-)
- Анод — положительный электрод (+)
Как видим, полярность может меняться на противоположную в зависимости от протекающих процессов.

Как определить катод и анод
Существует несколько способов определить, где катод, а где анод:
- По маркировке на корпусе устройства — обычно анод обозначается знаком «+» или красным цветом
- В диодах катод обозначается полоской на корпусе
- В электролитических конденсаторах длинный вывод — это анод (+)
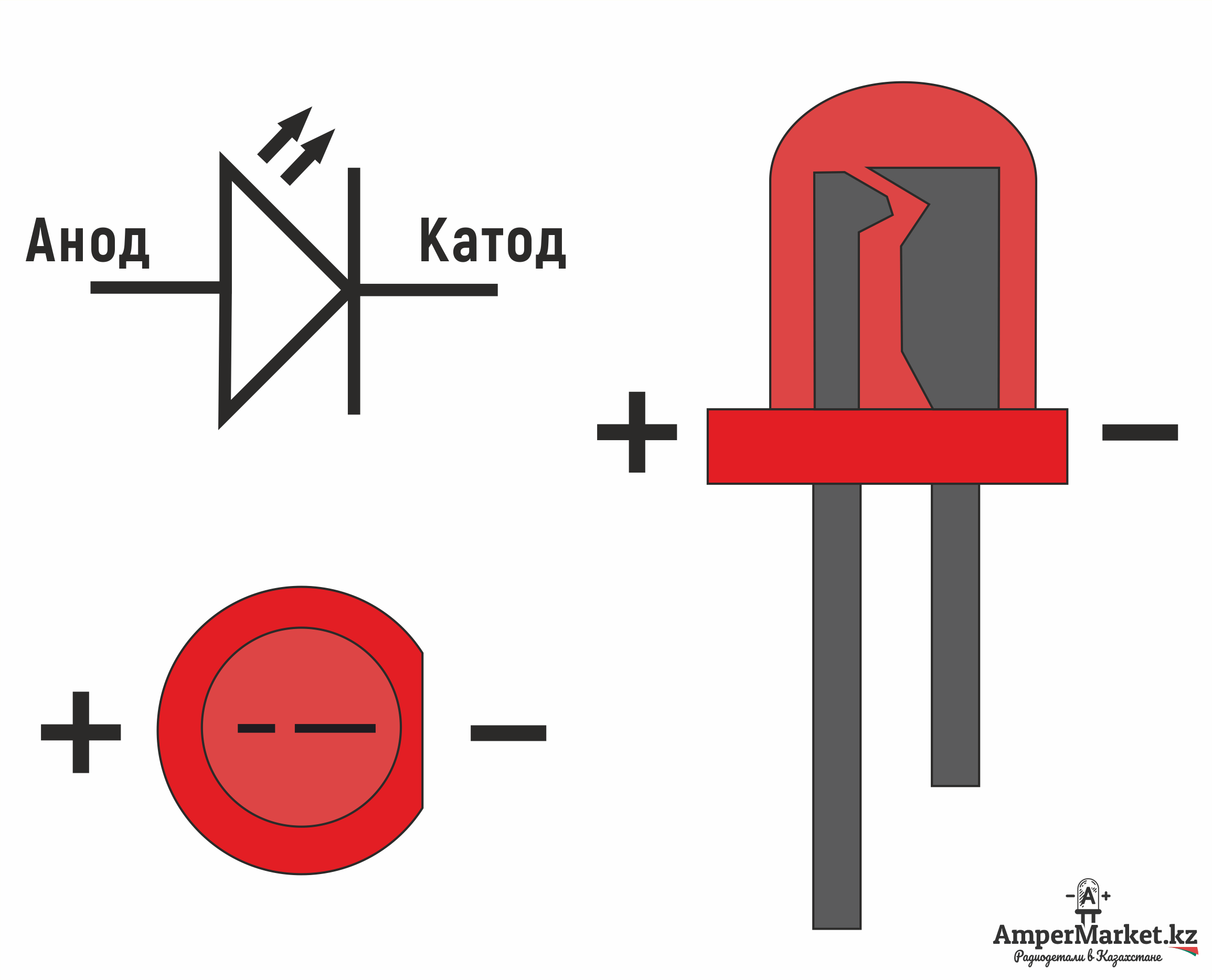
- В светодиодах длинный вывод — анод, короткий — катод
- По схеме включения — катод подключается к отрицательному полюсу источника питания
При работе с электронными компонентами важно правильно определять полярность для их корректного подключения.
Применение катода и анода в электрохимии
В электрохимии катод и анод играют ключевую роль в протекании окислительно-восстановительных реакций:
- Гальванические элементы и аккумуляторы — преобразование химической энергии в электрическую
- Электролиз — разложение веществ под действием электрического тока
- Гальваническое покрытие металлов
- Электрорафинирование металлов
- Электролитическое получение веществ
В этих процессах катод и анод участвуют в переносе электронов между веществами, обеспечивая протекание химических реакций.

Катод и анод в электронных приборах
В электронике катод и анод являются основными электродами многих устройств:
- Диоды — пропускают ток только в одном направлении (от анода к катоду)
- Электронные лампы — катод эмитирует электроны, которые движутся к аноду
- Электронно-лучевые трубки — катод испускает пучок электронов, управляемый анодами
- Фотоэлементы — катод эмитирует электроны под действием света
- Газоразрядные приборы — между катодом и анодом происходит ионизация газа
Правильное подключение катода и анода обеспечивает корректную работу этих электронных компонентов.
Принцип работы катода и анода
Основные процессы, происходящие на катоде и аноде:
- Катод:
- Восстановление веществ (присоединение электронов)
- Эмиссия электронов в вакуумных приборах
- Выделение водорода при электролизе водных растворов
- Анод:
- Окисление веществ (отдача электронов)
- Сбор электронов в вакуумных приборах
- Выделение кислорода при электролизе водных растворов
Эти процессы лежат в основе работы различных электрохимических и электронных устройств.
Диодный мост — практическое применение катодов и анодов
Диодный мост представляет собой схему из четырех диодов, которая используется для выпрямления переменного тока. Принцип его работы основан на свойствах катодов и анодов диодов:
- Диоды пропускают ток только от анода к катоду
- В каждый полупериод работают только два диода из четырех
- Обеспечивается преобразование обеих полуволн переменного напряжения
- На выходе получается пульсирующее, но однонаправленное напряжение
Диодные мосты широко применяются в блоках питания различных электронных устройств для получения постоянного тока из переменного напряжения сети.
Часто задаваемые вопросы о катоде и аноде
Куда течет электрический ток — от катода к аноду или наоборот?
Электрический ток (движение положительных зарядов) условно течет от анода к катоду. Однако реальное движение электронов происходит в обратном направлении — от катода к аноду.
Почему в разных устройствах полярность катода и анода может быть разной?
Это связано с тем, что в разных процессах (электролиз, работа гальванического элемента) окислительно-восстановительные реакции идут в противоположных направлениях. Соответственно, меняются и функции электродов.
Как запомнить, где у диода катод, а где анод?
Можно использовать мнемоническое правило: в словах «катод» и «минус» одинаковое количество букв, как и в словах «анод» и «плюс». Также на корпусе диода катод обычно отмечен полоской.
Заключение
Катод и анод — фундаментальные понятия в электротехнике и электрохимии. Понимание их свойств и принципов работы необходимо для эффективного использования и проектирования различных электронных и электрохимических устройств. При этом важно учитывать, что их полярность может меняться в зависимости от конкретного применения.
что это такое, плюс или минус, определяем полярность
Часто возникает проблема определения, какой из электродов является катодом, а какой — анодом. Для начала нужно разобраться с терминами.
Понятие катода и анода — простое объяснение
В сложных веществах электроны между атомами в соединениях распределены неодинаково. В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной. Потеря электронов называется окислением, элемент, отдающий электроны — восстановителем.
Присоединение электронов носит название восстановление, принимающий элемент в этом процессе — окислитель. Переход электронов от восстановителя к окислителю может протекать по внешней цепи, и тогда его можно использовать в качестве источника электрической энергии. Устройства, в которых энергия химической реакции превращается в электрическую энергию, называются гальваническими элементами.
Простейший классический пример гальванического элемента — две пластины, изготовленные из различного металла и погруженные в раствор электролита. В такой системе окисление происходит на одном металле, а восстановление — на другом.
ВАЖНО! Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление — катодом.
Из школьных учебников химии известен пример медно-цинкового гальванического элемента, работающего за счет энергии реакции между цинком и сульфатом меди. В устройстве Якоби — Даниэля пластина из меди помещена в раствор сульфата меди (медный электрод), цинковая пластина погружена в раствор сульфата цинка (цинковый электрод). Цинковый электрод отдает катионы в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
Замыкание внешней цепи заставляет электроны перетекать от цинкового электрода к медному. Равновесные отношения на границах фаз прерываются. Идёт окислительно-восстановительная реакция.
Энергия самопроизвольно протекающей химической реакции превращается в электрическую.
Если химическую реакцию провоцирует внешняя энергия электрического тока, идёт процесс, называемый электролизом. Процессы, протекающие при электролизе, обратны процессам, протекающим при работе гальванического элемента.
ВНИМАНИЕ! Электрод, на котором происходит восстановление, также называется катодом, но при электролизе он заряжен отрицательно, а анод — положительно.
Применение в электрохимии
Аноды и катоды принимают участие во многих химических реакциях:
- Электролиз;
- Электроэкстракция;
- Гальваностегия;
- Гальванопластика.
Электролизом расплавленных соединений и водных растворов получают металлы, производят очистку металлов от примесей и извлечение ценных компонентов (электролитическое рафинирование). Из металла, подлежащего очистке, отливают пластины. Они помещаются в качестве анодов в электролизер. Под воздействием электрического тока металл подвергается растворению. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в первоначальной неочищенной металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролите, откуда удаляются. Электролитическому рафинированию подвергают медь, никель, свинец, золото, серебро, олово.
Электроэкстракция — процесс выделения металла из раствора в ходе электролиза. Для того чтобы металл перешёл в раствор, его обрабатывают специальными реагентами. В ходе процесса на катоде происходит выделение металла, характеризующегося высокой чистотой. Так получают цинк, медь, кадмий.
Чтобы избежать коррозии, придать прочность, украсить изделие поверхность одного металла покрывают слоем другого. Этот процесс называется гальваностегией.
Гальванопластика — процесс получения металлических копий с объёмных предметов электроосаждением металла.
Применение в вакуумных электронных приборах
Принцип действия катода и анода в вакуумном приборе может продемонстрировать электронная лампа. Она выглядит как герметически запаянный сосуд с металлическими деталями внутри. Прибор используется для выпрямления, генерирования и преобразования электрических сигналов. По числу электродов выделяют:
- диоды;
- триоды;
- тетроды;
- пентоды и т.д.
Диод — вакуумный прибор с двумя электродами, катодом и анодом. Катод подключен к отрицательному полюсу источника питания, анод — к положительному. Предназначение катода — испускать электроны под действием нагрева электрическим током до определенной температуры. Посредством испущенных электронов создается пространственный заряд между катодом и анодом. Самые быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер объемного заряда. Анод принимает эти частицы. Создается анодный ток во внешней цепи. Электронным потоком управляют с помощью дополнительных электродов, подавая на них электрический потенциал. Посредством диодов переменный ток преобразуется в постоянный.
Применение в электронике
Сегодня используется полупроводниковые типы диодов.
В электронике широко используется свойство диодов пропускать ток в прямом направлении и не пропускать в обратном.
Работа светодиода основана на свойстве кристаллов полупроводников светиться при пропускании через p-n переход тока в прямом направлении.
Гальванические источники постоянного тока — аккумуляторы
Химические источники электрического тока, в которых протекают обратимые реакции, называются аккумуляторами: их перезаряжают и используют многократно.
При работе свинцового аккумулятора происходит окислительно-восстановительная реакция. Металлический свинец окисляется, отдает свои электроны, восстанавливая диоксид свинца, принимающего электроны. Металлический свинец в аккумуляторе — анод, он заряжен отрицательно. Диоксид свинца — катод и заряжен положительно.
По мере разряда аккумулятора расходуются вещества катода и анода и их электролита, серной кислоты. Чтобы зарядить аккумулятор, его подключают к источнику тока (плюсом к плюсу, минусом к минусу). Направление тока теперь обратное тому, какое было при разряде аккумулятора. Электрохимические процессы на электродах «обращаются». Теперь свинцовый электрод становится катодом, на нем проходит процесс восстановления, а диоксид свинца — анодом, с протекающей процедурой окисления. В аккумуляторе вновь создаются вещества, необходимые для его работы.
Почему существует путаница?
Проблема возникает из-за того, что определенный знак заряда не может быть прочно закреплен за анодом или катодом. Часто катодом является положительно заряженный электрод, а анодом — отрицательный. Часто, но не всегда. Все зависит от процесса, протекающего на электроде.
ВНИМАНИЕ! Деталь, которую поместили в электролит, может быть и анодом и катодом. Все зависит от цели процесса: нужно нанести на нее другой слой металла или снять его.
Как определить анод и катод
В электрохимии анод — это электрод, на котором идут процессы окисления, катод — это электрод, где происходит восстановление.
У диода отводы называются анод и катод. Ток будет идти через диод, если отвод анод подключить к «плюсу», отвод «катод» — к «минусу».
У нового светодиода с необрезанными контактами анод и катод определяются визуально по длине. Катод короче.
Если контакты обрезаны, поможет батарейка, приложенная к ним. Свет появится, когда полярности совпадут.
Знак анода и катода
В электрохимии речь правильнее вести не о знаках зарядов электродов, а о процессах, на них идущих. На катоде проходит реакция восстановления, на аноде — окисления.
В электротехнике для протекания тока катод подключают к отрицательному полюсу источника тока, анод — к положительному.
Катод — определение и практическое применение
Это специфическое обозначение часто применяют в описаниях радиотехнических приборов, производственных процессов. Ошибочное понимание терминологии провоцирует аварийные ситуации, увеличивает затраты в ходе монтажных и ремонтных работ. В этой публикации рассказано о том, что такое катод. Примеры с пояснениями помогут правильно решать типовые практические задачи.
Катод и анод – это плюс или минус
Что такое катодЭтим термином обозначают контакт, подключаемый к отрицательной клемме аккумуляторной батареи либо другого источника постоянного тока. На картинке выше – фотографии диода и конденсатора. Эти элементы используют в сетях с переменными электрическими параметрами. Однако и в подобных ситуациях катодным называют подсоединение с учетом соответствующей полярности.
Соответствующие физические (химические) реакции применяют:
- для создания автономных источников питания;
- при воспроизведении технологических процессов.
В первом случае речь идет об аккумуляторных батареях. Классическая гальваническая пара состоит из двух элементов:
- анода (-), разрушающегося в ходе реакции окисления;
- катода (+), «принимающего» электроны.
Подключение нагрузки к гальваническому элементу питания
Представленная на рисунке схема поясняет принцип разрушения (восстановления) анода (катода), соответственно. Отмеченный процесс выполняет полезные функции в гальванотехнике. С помощью соответствующих технологий извлекают из растворов ионы металлов и других веществ, создают качественные декоративные и защитные покрытия на изделиях сложной формы.
Зарядка АКБ и электролиз
Как показано на первой схеме, при подключении сильного источника тока в процессе зарядки АКБ катоды и аноды обозначают разные полярности. На второй части рисунка показано, как происходит процесс нанесения медного слоя на деталь. Анод в этой схеме – это электрод, который подключен к «плюсу» батарейки. Он разрушается в процессе электролиза. Ионы меди равномерно накапливаются на катоде, подсоединенном к «минусу». Покрывать благородными и дорогими металлами можно недорогие заготовки из проводящих материалов.
К сведению. Аналогичные методики применяют в химии, чтобы разделить вещества в растворенном состоянии на составные компоненты (ионы).
Катод в вакуумных приборахИзделия этой категории выполняют свои функции следующим образом. Катод – это генерирующий элемент, который отличается относительно малой работой для выхода электронов. Повышают эффективность данного компонента с помощью нагрева.
Ток через центральную часть проходит при соответствующей полярности подключения
Эта схема демонстрирует прямую зависимость применяемых терминов от движения электронов. В некоторых вакуумных приборах между анодом и катодом устанавливают сетчатую перегородку, которой регулируют силу тока и соответствующий коэффициент усиления.
Модифицированный вариант – электронно-лучевая трубка (ЭЛТ)
В типичной конструкции применяют несколько анодов, которые разгоняют электроны и обеспечивают фокусировку луча. Изменением напряжения на горизонтальных (вертикальных) пластинах перемещают поток в нужном направлении. Экран изнутри покрыт слоем люминофора, который светится в видимом диапазоне спектра при попадании заряженных частиц.
Для нагрева применяют прямые и косвенные методики. Катод накрывают модулятором. Это изделие создают в форме стакана с отверстием в центральной части дна. Сюда подают отрицательный потенциал, который оказывает существенное влияние на энергетические параметры пучка и силу свечения.
К сведению. При повышении мощности электронной пушки сфокусированный поток можно использовать для локального нагрева, сварки. Такие технологии обеспечивают высокое качество соединений. В соответствующем исполнении они пригодны для создания оружия. Катод у полупроводниковых приборовИзделия этой категории отличаются большим электрическим сопротивлением, по сравнению с проводниками, но меньшим – чем в диэлектриках. Специально подобранная комбинация материалов типового диода (p-n переход) не создает больших препятствий прохождению тока только в одном направлении.
Схема подключения и внешний вид диодов
На верхней части рисунка показаны обозначения источника питания постоянного тока и полупроводникового прибора. По стандартным рисункам на плате и утолщенным линиям несложно определить соответствующий вывод. Прозрачный корпус миниатюрных моделей не препятствует визуальной идентификации. Правильные выводы можно сделать при внимательном изучении светодиодов. Более крупная часть в том и другом примере – это катод.
Тиристор создан по аналогии с ламповыми аналогами. С помощью третьего электрода управляют работой электронного ключа.
Знак катодаОшибки в применении понятий возникают по причине разных подходов. Химики рассматривают процессы окисления и восстановления (анод – это «плюс», а катод – «минус»). Соответствующее подключение внешнего источника питания активизирует движение ионов и отдельные химические реакции.
В гальванических элементах наблюдаются обратные процессы. Избыточное количество электронов на одном из функциональных компонентов обеспечивает окисление цинкового или другого электрода. В этом примере при подключении нагрузки восстанавливается второй элемент (катод) – это контакт батареи, обозначенный знаком «плюс».
Как показано выше, ситуация изменяется при подключении внешнего более сильного источника питания. От направления движения тока меняются соответствующие обозначения ламповых приборов.
Как определить анод – это плюс или минус
Представленное на последнем рисунке правило действительно при рассмотрении электротехнических схем, полупроводниковых приборов. Для уточнения полярности достаточно проверить соответствие количества букв.
Видеочто это такое, где плюс и где минус на диоде
На чтение 6 мин Просмотров 569 Опубликовано Обновлено
Классические термины из физики и химии часто встречаются в инструкциях к использованию современных приборов. Необходимо точно знать, что такое определение под собой подразумевает и как его применять к тем или иным конструкциям и явлениям.
Что такое анод и катод
Потребитель сталкивается с понятиями анод и катод при зарядке и разрядке аккумулятора, зарядке и обслуживании батареи.
Понять разницу между катодом, анодом, положительным и отрицательным зарядом проще всего, вспомнив некоторые положения из электрохимии.
- Гальванические элементы – электрический ток производится благодаря текущей химической реакции. Именно на этом принципе работают батарейки и аккумуляторы. Поэтому их называют химическими источниками тока.
- Электролиз – химическая реакция, которая протекает за счет включения в систему источника электроэнергии.
В обоих случаях один из электродов несет более высокий потенциал. Этот электрод считается положительным. Электрод с более низким потенциалом и необязательно отрицательным, будет носить название отрицательный. Ток, соответственно, течет от носителя более высокого потенциала к носителю более низкого потенциала.
Очень редко
21.74%
Не припоминаю
21.74%
Проголосовало: 23
Анод
По определению анодом выступает электрод, на котором протекает окислительная реакция. Это означает, что электрод служит источником электронов. В химии его же нередко именуют восстановителем.
Катод
Под катодом подразумевают электрод, на котором протекает реакция восстановления. Здесь электрод забирает электроны и называется окислителем.
Принимая, что ток является движением положительно заряженных частиц, а не отрицательных, получается, что ток в растворе идет от катода к аноду. В цепи, соединяющей элементы гальванической пары, электроны идут от минуса к плюсу и с этой точки зрения катод является плюсом, а анод – минусом.
Противоречие кажущееся, ведь направление тока определяется движением положительных частиц, хотя фактически в металлической цепи его обеспечивает движение электронов.
Как определить анод и катод
Если с батарейкой все довольно просто (полюс и минус не меняются местами), то с зарядкой аккумулятора дело обстоит сложнее.
Во время зарядки разность между большим и меньшим потенциалом увеличивается, то есть потенциал положительного электрода становится выше, чем его же потенциал в покое – накапливается заряд, а потенциал отрицательного электрода становится меньше, чем он же в состоянии покоя. Отсюда вытекает, что положительный электрод выступает анодом, а отрицательный – катодом.
При использовании устройства потенциал положительного электрода (анода) всегда остается больше, чем потенциал отрицательного (катода). Но во время цикла разрядки/зарядки роль электрода меняется: при разрядке положительным становится катод, отрицательным – анод. Во время зарядки положительным выступает анод, отрицательным – катод.
Если речь идет о растворах и электрофизических реакциях в них, проще запомнить, что катионы – всегда частицы с положительным зарядом, а значит двигаются к минусу. Анионы – частицы всегда с отрицательным зарядом и двигаются к плюсу.
Валера
Голос строительного гуру
Задать вопрос
Чтобы запомнить, где плюс, где минус, используют мнемоническое правило. В словах «катод» и «минус», а также в словах «анод» и «плюс» одинаковое количество букв. В нормальном режиме работы любого электрического прибора ток вытекает из катода и втекает в анод. Даже если речь о металлической жиле, поскольку здесь направление тока определяют не смещении электронов, а смещение дырок.
Сфера применения
В промышленности используют не только собственно гальванические элементы (для получения электрического тока), но и электрохимические реакции, которые протекают под действием тока. Самый известный – получение тонкопослойного защитного покрытия стали – из цинка, алюминия, цинкового-алюминиевых сплавов.
Электрохимия
Электролиз по своему значению противоположен работе гальванического элемента: реакция проходит под действием тока. При этом плюс источника питания все же именуется катодом, а минус анодом, что как бы противоречит вышесказанному. Происходит это потому, что ток от плюсового вывода источника питания уходит на плюсовой вывод аккумулятора и в этом случае последний уже никак не может быть катодом. В результате электроды аккумулятора при зарядке меняются местами, потому что реакция идет в обратном направлении.
Гальванотехника
Посеребрение, золочение, хромирование, оцинковка – наиболее известные способы использования процесса осаждения вещества. Принцип действия таких установок одинаков: изделие погружают в электролитическую ванную, в которой оно выступает катодом. На его поверхности осаждаются ионы металла – катионы. Чтобы изделие стало катодом, к нему подключают плюсовой вывод источника питания.
Вакуумные и полупроводниковые электроприборы
Понятие катода и анода, а точнее плюса и минуса в вакуумных и полупроводниковых приборах связано с возможностью протекания тока только в одном направлении или в двух. Полупроводник допускает только прямое течение тока, а при наложении напряжения обратного типа ток здесь течет, но крайне незначительно. Для резистора же вопрос не принципиален: он пропускает ток в обоих направлениях.
Катодом и анодом называют выводы диода – ножки. К плюсу батареи подключается анод. Называется он так, потому что у диода в ток любом случае втекает в анод. Светодиод и даже вакуумный подключается точно так же: анод к плюсу, а катод к минусу.
У пассивных потребителей катод и анод (плюс и минус) не меняются. У активных, способных пропускать ток в обоих направлениях, разряжаться и заряжаться – плюсы и минус могут меняться. В аккумуляторе катод положительный во время разрядки и отрицательный при зарядке. Для правильного использования приборов и элементов важно помнить одно: у всех потребителей энергии – электронных деталей, электролизеров, гальванических батарей − вывод, подключаемый к плюсу, называется анодом.
Катод и Анод : Помогите решить / разобраться (Ф)
Э не-е-е-е, ГОСТами пользоваться надо когда они не противоречат учебникам и словарям — вот честно, доверия физической энциклопедии в разы больше чем левому ГОСТу, который к тому же утратил силу в РФ, правда в действующем ГОСТ Р МЭК 60050-482-2011 ничего и не поменялось.Ну а БСЭ тоже не верите?
Большая советская энциклопедия. — М.: Советская энциклопедия 1969—1978 писал(а):
Анод (от греч. ánodos — подъём, восхождение, от aná — вверх и hodós — путь, движение)
1) положительный электрод источника электрического тока, например положительного полюс гальванического элемента или электрического аккумулятора (см. Химические источники тока).
2) Электрод электронного прибора (См. Электронные приборы) (ионного прибора (См. Ионные приборы)), соединяемый с положительным полюсом источника электрического тока.
3) Положительный полюс электролитной ванны (см. Электролиз).
4) Положительный электрод электрический дуги (см. Дуговой разряд).
Материалом А. в зависимости от назначения служат металлы (тантал, молибден, никель, медь, железо, вольфрам и др.) и графит.
Энциклопедия «Техника». — М.: Росмэн 2006 писал(а):
ано́д
положительный электрод источника электрического тока, напр. положительный полюс гальванического элемента или электрического аккумулятора; электрод электронного прибора (ионного прибора), соединяемый с положительным полюсом источника электрического тока; положительный полюс электролитической ванны; положительный электрод электрической дуги. В электролитической ванне и электронных приборах анод соединяется с положительным полюсом источника электрического тока.
Предлагаю для источников тока (батареи, аккумуляторы в режиме разряда, блоки питания) не заморачиваться с терминами анод/катод, а пользоваться обозначениями плюс и минус. Раз уж такой разброд и шатание.
— 16.03.2017, 00:28 —
Также где катод и анод у светодиода и какие знаки имеют?
У светодиода на анод надо подавать плюс внешнего напряжения, на катод — минус внешнего напряжения. Тут никаких разногласий нет. Знаков они не имеют.Куда течет ток или где же этот чертов катод? / Хабр
Есть вещи, которые хочется, что называется «развидеть» — термин вполне устоявшийся и понятный.
— Евгений Гришковец, рассказывает про железнодорожников. (с) Спектакль
«Одновременно»А есть вещи которые, ну никак не получается запомнить. Это возникает от того, что новое понятие не может однозначно зацепиться за уже известные факты в сознании, никак не получается построить новую связь в семантической сети фактов.
Все знают, что у диода есть катод и анод. Все знают, как диод обозначается на электрической схеме. Но далеко не все могут правильно сказать, где же на схеме что.
Под спойлером картинка, посмотрев на которую, вы навсегда запомните, где у диода анод, а где катод. Должен предупредить, развидеть это не получится, так что тот, кто не уверен в себе, пусть не открывает.
Да, вот так все просто. Буква К — это катод, буква А — это анод. Извините, теперь и вы это никогда не забудете.
Продолжим, и разберемся куда течет ток. Если приглядеться, обозначение диода представляет собой стрелку. Вот, не поверите — ток течет именно туда, куда показывает стрелка! Что логично, не правда ли? Дальше больше — ток течет «Аткуда» (от Анода) и «Куда» (к Катоду). В обозначениях транзисторов тоже есть стрелки, и они так же обозначают направление тока.
Ток — направленное движение заряженных частиц — это мы все знаем из школьной физики. Каких частиц? Да, любых заряженных! Это могут быть и электроны несущие отрицательный заряд и обделенные электронами частицы — атомы или молекулы, в растворах и плазме — ионы, в полупроводниках — «свободные электроны» или вообще «дырки», что бы это не значило. Так вот, во всем этом зоопарке проще всего разобраться так: ток течет от плюса к минусу, и все. Запомнить это очень просто: «плюс» — интуитивно — это там где чего-то «больше», больше в данном случае зарядов (еще раз — не важно каких!) и текут они в сторону «минуса», где их мало и ждут. Все остальные подробности, непринципиальны.
Ну, и последнее — батарейка. Обозначение тоже всем известно, две палочки подлинней потоньше и покороче потолще. Так вот покороче и потолще символизирует собой минус — эдакий «жирный минус» — как в школе, помните: «ставлю тебе четыре с жирным минусом». Я только так и запомнил, возможно, кто-то предложит вариант лучше.
Теперь, вы без труда ответите на вопрос, загорится ли лампочка в этой схеме:
Всех с 1 апреля! Улыбайтесь, господа. Улыбайтесь!
Диодный мост: схема, принцип работы
Диодный мост? Это совсем не то, что Крымский. Это такой маленький диодный мостик, схема которого строится из небольших совсем электронных устройств — диодов. Их мы собираем даже своими руками. Да, соберите своими руками и увидите, что это легко и быстро, надо только знать, из чего и для чего. Он состоит из диодов.
Что такое диоды
Диоды — это электронные устройства с двумя электродами («ди» — два). Анод и катод.
ДиодРаньше, в эпоху стеклянных электронных вакуумных ламп, это была самая простая из ламп. В ней непосредственно около катода располагалась нить накаливания, как в лампочке. Катод от этого разогревался, и из него начинали выпрыгивать электроны все быстрее и быстрее. А кроме напряжения накала к электродам было приложено рабочее напряжение. И если на катод подать минус, а на анод плюс, то электроны от катода начинают отталкиваться, а к аноду притягиваться. Так как этому процессу в вакууме ничто не мешает, через вакуум и побежит ток, пропорциональный приложенному напряжению. А если поменять полюса — подать на анод минус, а на катод плюс, ток остановится. Потому что анод холодный, а к катоду теперь приложен положительный потенциал, который возвращает выброшенные накалом катода электроны обратно. Вот так и получился самый первый и самый простой нелинейный электрический элемент. В одну сторону ток он пропускает, а в другую — нет.
Почти такая же картина и в полупроводниковых диодах. Только там нет вакуума, а твердая пластинка полупроводника имеет свойство не препятствовать движению электронов в одну сторону и запрещать их движение в противоположную.
Весь секрет в N-P-переходе полупроводника.
Полупроводниковый диод представляет собой пластинку, похожую на плоский кружочек (или квадратик) металла. Но это не металл, а две его стороны имеют чуть разные свойства. Металлы характеризуется тем, что электроны в их кристаллической решетке почти не держатся, вылетают и болтаются между атомами кристалла по любому поводу, самая небольшая температура, заставляющая ядра атомов на своих местах слегка вибрировать, вышибает электроны напрочь и массово. А на этом месте что образуется? Знамо дело, дырка. Так называется атом, потерявший электрон. И получается, что электроны хаотично мечутся по межатомному пространству металла, а дырки тоже мечутся — только уже по самой кристаллической решетке. Потому что если соседний атом «заметит» дырку, он очень просто легким толчком закинет в нее свой электрон. И это можно понять в обратном смысле: получилось, это дырка перескочила из того атома в этот. И так дырки начинают жить тоже своей самостоятельной жизнью и блуждать как им взбредется. А встретится им электрон — может произойти рекомбинация, когда электрон запрыгнет в эту самую дырку. Ну и все, нашел свою судьбу. Только свободных электронов в металле видимо-невидимо, и поэтому стоит приложить к проводнику напряжение — как тут же начнется уже более-менее упорядоченное движение электронов от минуса к плюсу, то есть электрический ток. Соответственно, и дырки побегут, наоборот, от плюса к минусу, то есть как раз так, как люди определили когда-то НАСТОЯЩИМ направлением тока. Определили, еще ничего не зная ни о свободных электронах, ни о дырках.
В полупроводниках картина очень тонкая. Он сам плохой проводник и никудышный изолятор. Потому они так и названы — полупроводники. В них тоже есть свободные электроны и дырки. Только их не так много, как в металлах, а равновесие электронов и дырок нарушают примеси в полупроводнике. Атомы примесей становятся дополнительными источниками в одних случаях свободных электронов, в других — «свободных» дырок. Есть такие атомы, которые в одном случае прихватывают себе лишний электрон и не отпускают его (акцепторная примесь). А на его месте в атоме полупроводника получается дырка и начинает бродить неприкаянно по кристаллической решетке.
А в другом случае атом примеси имеет свойство отдавать свой электрон (донорная примесь), ничего не прося взамен. И пойдет электрон лишний куда глаза глядят.
Первая проводимость названа дырочной — P (positive, положительная), вторая электронной — N (negative, отрицательная).
Но самое интересное, что два типа проводимости могут существовать в одном куске полупроводника. Вот той самой тонкой пластинки, похожей на металл. С одной стороны в нее внедряют донорную примесь, а с другой — акцепторную.
Очень просто: можно на основу из полупроводника — германия или кремния — с одной стороны нанести материал-акцептор, фосфор, мышьяк или сурьму. Температура плавления сурьмы чуть выше 980 ⁰С, а у полупроводников еще выше, около 1200–1400 ⁰С. Атомы акцептора (чаще всего сурьмы, более остальных практичной в обращении) внедряются в кристаллическую решетку полупроводника, делая его полупроводником типа P. Другую сторону обрабатывают алюминием или индием — легкими и плавкими металлами. Достаточно поместить капельку индия, просто капнуть с одной стороны при температуре плавления 430 ⁰С.
Вот и получился у нас знаменитый N-P переход, который ток пропускает в одну и другую стороны по-разному.
И правда, если представить ток как движение заряженных частиц, то в полупроводнике N-типа движутся электроны (их подавляюще больше). А в P-типа — дырки. Причем направление их движений противоположное. Только если в металле они движутся одновременно и независимо — одни туда, другие сюда, то в полупроводнике все не так. В полупроводнике N-типа движутся, в основном, электроны, по полупроводнику P-типа ток создает движение дырок. А вот в N-P переходе эти два вида токов встречаются.
На границе этих двух типов (границе между полупроводником с примесями одного типа и проводником с примесями другого) электроны вместо дальнейшего движения будут «находить свою судьбу», то есть встречаться с дырками и с ними производить рекомбинацию. Такую зону счастливых электронных пар мы называем «зоной запрета», потому что при рекомбинации атомы примесей становятся ионами (в N-зоне положительные, а в P-зоне отрицательные), и они создают электрическую разность потенциалов, всегда направленную от N проводимости к P проводимости. И вот теперь, если прикладывать напряжение к внешним контактам диода, и если полярность его совпадает с направлением этой разности потенциалов, то ток потечет через диод, а если противоположно ей, то нет. Первое направление (когда к P приложен плюс, а к N минус) называется прямым, второе (когда на P подан минус, а на N плюс) — обратным.
СхемаПрямое направление диода делает его по работе похожим на обычное сопротивление, работающим по закону Ома.
А обратное дает нечто вроде разрыва в цепи, хотя при этом всегда сохраняется некоторый обратный ток, зависящий от других вещей — температуры, радиации.
Вот на таких приборах и строятся выпрямительные мосты.
Выпрямительные мосты
Если подавать на диод переменное электрическое напряжение, которое непрерывно изменяется от некоторого напряжения U+ > 0 до напряжения U–< 0, то наш диод начнет «срезать» все напряжения, которые для него будут «обратными».
Работа диодаВ случае обычного для наших сетей синусоидального сигнала в результате работы диода получается «полусинусоида» тока (или напряжения в нагрузке).
Синусоидальный сигналВесь ток и напряжение в сети нагрузки будет иметь положительное направление, но половина электроэнергии не будет «доходить» до адресата.
Чтобы использовать и вторую половину синусоиды, нужно, чтобы она не срезалась, а меняла знак на противоположный. Вот и получилась схема диодного моста.
Диодный мост: принцип работыУже лучше, но мост не является выпрямителем в полном смысле. Напряжение в нагрузку он дает не постоянное, а пульсирующее с двойной частотой.
Если нагрузкой сделаем лампу накаливания, то никаких пульсаций света можем и не заметить.
Лампа накаливания является прибором инерционным, в плане преобразования электричества в тепло и свет. То есть за 1/50 (при переменном напряжении) или за 1/100 (при пульсирующим напряжении от диодного моста) доли секунды ее нить накала не успевает остыть, как уже приходит очередной импульс. В этом случае диодный мостик такой схемы вполне подойдет.
СхемаВ результате этого температура спирали во времени представляет собой кривую, сглаживающую кривую напряжения, выходящего из диодного моста. И чем спираль массивнее, тем более сглажена кривая ее температуры. В выпрямительных мостах сглаживание делается конденсатором, которые способны, подобно спирали лампы, накапливать энергию, а потом медленно ее отдавать.
Выпрямительный мостВыпрямительный мост — это настолько отработанная, привычная и полезная схема, что для нее имеется общепринятое сокращенное графическое обозначение. А как сделать диодный мост — тут вообще все просто. Следует только разобраться с концами диодов — какие плюс и какие минус. На входные два узелка подается переменное напряжение, поэтому к ним подходят как плюс диодов, так и минус: VD1 плюс, VD2 минус —на верхний, VD3 + и VD4 — на нижний. А выходные клеммы от моста получают уже знакопостоянное напряжение, поэтому их плюсы и минусы совпадают с +/- диодов. VD2, VD4 припаяем плюсами на плюсовой выход, VD1, VD3 — минусами на минусовой. Вот и получился выпрямительный диодный мост.
Диодный мостТакие диодные мосты присоединяют часто к обычному трансформатору от блоков питания, понижающему к 12 вольтам. Диоды в этом случае подойдут любые, лишь бы рабочий диапазон напряжений был немного больше, чем на 12 вольт. Скажем, вольт на 20–35. Особых требований нет, соединения низковольтные, для подключения достаточно обычной спайки.
СхемаТрехфазный диодный мост
Однако делают диодные мосты и высоковольтные. Там все то же самое, только все элементы схемы рассчитываются на те номиналы напряжений, с которыми будет иметь дело диодный мост — с запасом, разумеется. Кроме того, можно сделать его и для трехфазного напряжения. И он оказывается сложнее однофазного не в три раза, а только в полтора.
Подключить диодный мост к трансформатору здесь нужно в трех точках, по одной на каждую фазу. Принципиальной разницы между спайкой диодного моста на три фазы и собранного под одну фазу нет. Разобраться с концами здесь почти так же просто. Здесь плюсы одних трех диодов и минусы других подключаются к выходам, после этого попарно спаиваются плюсы с минусами верхней и нижней тройки диодов, и в эти же три точки подаются фазы. Все, вы его собрали.
Похожие статьи:Где у светодиода плюс, а где минус? Способы определения полярности. | У дяди Васи
Скоро Новый год. Все уже активно начали украшать дома, квартиры, улицы городов, офисы, магазины… А одним из самых главных украшений являются светодиодные гирлянды. В вечернее время именно они освещают улицы, делают окна квартир особенными. Одна гирлянда может быть сделана из 20 светодиодов, а может быть и несколько тысяч. Тут уже все зависит от вашего кошелька.
Новогодняя елкаНовогодняя елка
Но в нашей жизни никто не застрахован от таких ситуаций, когда купил за несколько тысяч светодиодную гирлянду, а она порадовала несколько дней и все. Например, не вышла полностью из строя, а из нескольких цветов перестал светиться только один. Это означает что из последовательно соединенной цепи мог выйти из строя всегда один элемент. И тут обязательно в доме появляется мужик, которому по плечу починить гирлянду самостоятельно, или женщина, которая не видит сложности в решении проблемы. Но самостоятельный ремонт иногда заканчивается плачевно сразу же после первого тестирования. Светодиодная гирлянда окончательно выходит из строя и больше ремонту не подлежит. Почему это происходит?
Потому что люди подвергают себя опасности из-за незнания основ физики и радиоэлектроники. Ремонт светодиодной гирлянды заключается не только в соединении нескольких проводков и замены неисправного светодиода. Нужно еще знать полярность светодиода.
Если на замену сгоревшего светодиода вы берете новый, то обратите внимание, что выводы (ножки) светодиода разной длины. Длинный вывод — это анод (положительный или плюс), а короткий — это катод (отрицательный или минус).
Длинный вывод — это анод (положительный или плюс), а короткий — это катод (отрицательный или минус).Длинный вывод — это анод (положительный или плюс), а короткий — это катод (отрицательный или минус).
Но если вы берете бывший в употреблении светодиод, то ножки скорее всего будут одинакового размера. Иногда минус еще разработчики отмечают точкой или небольшим надрезом на корпусе. А если заглянуть во внутрь светодиода, то можно увидеть как плюс выделен контактом меньшего размера (по сравнению с минусом).
Можно определить анод и катод с помощью севшей батарейки типа CR2032. Просто прикладываем попеременно выводы светодиода к сторонам батарейки. На батарейке плюс и минус обычно подписаны, а при правильном приложении ножек светодиод будет светиться. Но при этом повторюсь, что ток батарейки не должен превышает 30 мА. В противном случае светодиод просто выйдет из строя.
Если под рукой севшей батарейки у вас нет, то можно взять и обычную с напряжением не более 6 В. Но тогда вам дополнительно понадобится еще и резистор с сопротивлением 300–470 Ом. Перед тем как прикоснуться ножками светодиода к контактам батарейки нужно припаять резистор к любой из них.
Ну и последние способы определения полярности и работоспособности светодиода связаны с мультиметром. Это второй по значимости инструмент после паяльника. Он выручает во многих ситуациях.
Подробно о мультиметре и способах его применения в быту вы можете почитать в статье «Мультиметр — волшебная палочка любого электронщика!»
А в нашем случае есть несколько способ определения полярности:
- Переключатель прибора нужно установить в положение «прозвонка, проверка диода». Затем нужно снова попеременно коснуться щупами выводов светодиода. Если красный щуп коснется анода, а черный — катода, то светодиод слегка засветится.
Проверка светодиода на режиме «прозвонка»
- Если в приборе имеется отсек для проверки PNP транзисторов. Для определения полярности в отсеке достаточно катод светодиода вставить в отверстие с надписью «С», а анод — с надписью «Е». Если все правильно сделано, то светодиод засветится.
Определение полярности светодиода с помощью мультиметра
- Если в приборе имеется отсек для проверки NPN транзисторов. Для определения полярности в отсеке достаточно катод светодиода вставить в отверстие с надписью «E», а анод — с надписью «С». Если все правильно сделано, то светодиод засветится.
Определение полярности светодиода с помощью мультиметра
Спасибо за внимание! Понравилась статья? Тогда жмите «Палец вверх» и делитесь ей с друзьями в социальных сетях.
Анод, катод, положительный и отрицательный: основные элементы батареи
Обновлено: 26 августа 2021 г.Значительные разработки были сделаны в области аккумуляторных батарей (иногда называемых вторичными элементами), и большая часть этой работы может быть отнесена к разработке электромобилей. Эта работа привела к присуждению Нобелевской премии по химии 2019 года за разработку литий-ионных аккумуляторов.Следовательно, термины «анод», «катод», «положительный» и «отрицательный» стали все более заметными.
В статьях о новых электродах батареи часто используются названия анод и катод без указания того, разряжается батарея или заряжается. Термины анод, катод, положительный и отрицательный не являются синонимами, иногда их можно путать, что может привести к ошибкам.
Целью данной статьи является прояснение и четкое определение этих различных терминов.
Реакции окисления и восстановления
- Реакция окисления — это электрохимическая реакция, при которой образуются электроны.- \ to LiCoO_2} $
— реакция восстановления. Уменьшение — это выигрыш электронов.
Анод, катод
- Анод — это электрод, на котором протекает реакция окисления. Потенциал анода, через который протекает ток, превышает его равновесный потенциал: $ E_ \ text a (I)> E_ {I = 0} $ (рис. 1).
- Катод — это электрод, на котором протекает реакция восстановления. Потенциал катода, по которому протекает ток, ниже его равновесного потенциала: $ E_ \ text c (I)
Рисунок 1: $ (E_ {I \ neq 0} -E_ {I = 0}) \; I> 0 $
Положительный и отрицательный электроды
Два электрода батареи или аккумулятора имеют разные потенциалы. Электрод с более высоким потенциалом называется положительным, электрод с более низким потенциалом — отрицательным. Электродвижущая сила, ЭДС в В, батареи — это разность потенциалов положительного и отрицательного электродов, когда батарея не работает. + $ → положительный электрод является анодом.- $ → отрицательный электрод является катодом.
Рисунок 3: Разряд / заряд вторичной батареи, представленной в виде электрохимической ячейки, с электронами и направлением тока.
Заключение
При нормальном использовании аккумуляторной батареи потенциал положительного электрода как при разряде, так и при перезарядке остается больше, чем потенциал отрицательного электрода.С другой стороны, роль каждого электрода переключается во время цикла разряд / заряд.
- Во время разряда положительный полюс является катодом, отрицательный — анодом.
- Во время зарядки положительный полюс является анодом, отрицательный — катодом.
Тексты, описывающие аноды или катоды батарей, безусловно, косвенно рассматривают случай разряда. Давайте, не колеблясь, напишем, перефразируя Резерфорда, неявное — не что иное, как плохое явное.
Узнать больше о потенциостатах
Чтобы узнать больше о потенциостатах BioLogic, которые используются при исследовании аккумуляторов и тестировании аккумуляторов среди других областей исследования, пожалуйста, щелкните нашу страницу обзора потенциостатов и страницу обзора тестирования аккумуляторов / циклического режима аккумуляторов.
Узнайте больше о кривых цикла заряда аккумулятора
Может быть интересна следующая статья «Как считывать кривые срабатывания батареи»
аккумулятор анод катод положительный отрицательный электрод
Что такое катодный ток? (с изображением)
Есть два типа электронных или электрических устройств: те, которые обеспечивают питание, и те, которые используют энергию.В устройстве, которое подает питание, катод является положительным выводом, а анод — отрицательным выводом. Для устройств, которые используют питание, катод является отрицательной клеммой, а анод — положительной клеммой. Положительный катодный ток — это ток, который течет от катода, а отрицательный катодный ток течет в катод.
Электроны имеют отрицательный заряд и притягиваются к положительным зарядам.Это поток электронов через проводящий материал, который создает электрический ток, и электроны всегда текут от отрицательного к положительному. Следовательно, электроны имеют тенденцию течь из катода, который является отрицательной клеммой, в анод, который является положительной клеммой. Это несколько усложняет понимание катодного тока некоторых устройств, таких как диоды и батареи.
Батареи маркируются положительными и отрицательными клеммами, часто с использованием знака «плюс» (+) или «минус» (-).Эти ярлыки могут вводить в заблуждение. Ток, протекающий от батареи, представляет собой положительный ток, то есть прямой ток, который покидает положительную клемму батареи, проходит через цепь и возвращается к отрицательной клемме батареи. Положительный полюс батареи фактически имеет отрицательный заряд и является катодом устройства. Катодный ток течет от положительной клеммы аккумулятора.
Электронные устройства, называемые диодами, имеют поляризованные выводы.Катод диода изготовлен из отрицательного материала, что означает, что в нем больше электронов, чем протонов. Он сопротивляется потоку электронов через него, потому что в материале уже есть избыток электронов. Анод противоположный, и в нем отсутствуют электроны, что облегчает попадание электронов в него. Когда количество электронов в положительном материале анода достигает определенного уровня, они преодолевают сопротивление отрицательного материала, и прямой или положительный катодный ток вытекает из катодного вывода диода.
Диод начнет проводить в обратном направлении, если напряжение станет достаточно высоким.В стандартном диоде этот обратный ток быстро вызывает необратимое повреждение диода. Специальные диоды, такие как стабилитроны и туннельные диоды, предназначены для проведения после того, как обратное напряжение достигнет определенного порога. Обратный или отрицательный катодный ток течет в диод через катод и выходит из анода.
Вакуумные лампы несколько отличаются по принципу действия.Электроны попадают в катод устройства и собираются на электроде в вакууме трубки. По мере роста отрицательного заряда на электроде электроны покидают электрод и перетекают к более положительно заряженному аноду. Это вызывает положительный ток, протекающий от анодного вывода трубки. В этом случае катодный ток является отрицательным и течет в устройство, а не из него.
17.2: Электролиз — Химия LibreTexts
Типичная электролитическая ячейка может быть изготовлена, как показано на рисунке \ (\ PageIndex {1} \). Два электрических проводника (электроды , ) погружены в жидкость, подлежащую электролизу. Эти электроды часто изготавливаются из инертного материала, такого как нержавеющая сталь, платина или графит. Жидкость, подлежащая электролизу, должна быть способна проводить электричество, поэтому обычно это водный раствор электролита или расплавленное ионное соединение. Электроды подключены проводами к батарее или другому источнику постоянного тока.Этот источник тока можно рассматривать как «электронный насос», который забирает электроны с одного электрода и выталкивает их на другой электрод. Электрод, с которого удаляются электроны, становится положительно заряженным, в то время как электрод, к которому они подводятся, имеет избыток электронов и отрицательный заряд.
Рисунок \ (\ PageIndex {1} \): электролитическая ячейка. Батарея откачивает электроны от анода (делая его положительным) в катод (делая его отрицательным). Положительный анод притягивает к себе анионы, а отрицательный катод притягивает к себе катионы.Электрический ток переносится электронами в проводе и электродах, но он переносится анионами и катионами, движущимися в противоположных направлениях в самой ячейке. Поскольку анод может принимать электроны, на этом электроде происходит окисление. Катод является донором электронов и может вызвать восстановление. из Википедии (кредит XXX).Отрицательно заряженный электрод притягивает к себе положительные ионы (катионы) из раствора. Он может отдавать часть своих избыточных электронов таким катионам или другим частицам в жидкости, подвергаемой электролизу.Следовательно, этот электрод фактически является восстановителем. В любом электрохимическом элементе (электролитическом или гальваническом) электрод, на котором происходит восстановление , называется катодом .
Положительный электрод, с другой стороны, притягивает к себе отрицательные ионы (анионы). Этот электрод может принимать электроны от этих отрицательных ионов или других частиц в растворе и, следовательно, ведет себя как окислитель. В любой электрохимической ячейке анод является электродом, на котором происходит окисление .Простой способ запомнить, какой электрод — это то, что анод и окисление начинаются с гласных, в то время как катод и восстановление начинаются с согласных.
На следующем видео показан этот процесс в нейтральном водном растворе с некоторыми присутствующими электролитами.
В качестве примера того, как электролиз может вызвать химическую реакцию, предположим, что мы пропускаем постоянный электрический ток через 1 M HCl. Ионы H 3 O + в этом растворе будут притягиваться к катоду, а ионы Cl — будут мигрировать к аноду.{-} (aq) \ rightarrow \ text {H} _2 (g) + \ text {Cl} _2 (g) + \ text {2H} _2 \ text {O} (l) \]
Чистая реакция [Уравнение \ (\ ref {3} \)] — это , обратная спонтанной комбинации H 2 ( г, ) с Cl 2 ( г ) с образованием HCl ( водн ). Такой результат справедлив для электролиза в целом: электрический ток , подаваемый извне системы, вызывает несамопроизвольную химическую реакцию.
Хотя электролиз всегда обращает вспять спонтанную окислительно-восстановительную реакцию, результат данного электролиза не всегда может быть той реакцией, которую мы хотим. {-} \]
Однако Li + — очень плохой акцептор электронов, и поэтому очень трудно заставить выполняться уравнение \ (\ ref {5} \).{-} \ label {8} \]
Общее уравнение можно получить, умножив уравнение \ (\ ref {7 } \ ) на 2, добавив его к уравнению \ (\ ref {8} \) и сложив H + с OH — для получения H 2 O:
\ [\ text {2H} _2 \ text {O} (l) \ rightarrow \ text {2H} _2 (g) + \ text {O} _2 (g) \]
На следующем видео показан процесс электролиза воды с использованием серной кислоты в качестве моста для передачи заряда. После завершения электролиза идентичность образующихся газов проверяется с помощью тестов на горючие шины.
Таким образом, этот электролиз обращает спонтанную комбинацию H 2 и O 2 с образованием H 2 O. При обсуждении окислительно-восстановительных реакций мы упоминаем несколько окислителей, которые, например, достаточно сильны, чтобы окислять H 2 O. В то же время мы описываем восстановители, которые достаточно сильны для восстановления H 2 O, такие как щелочные металлы и более тяжелые щелочноземельные металлы. Как правило, такие вещества не могут быть получены электролизом водных растворов, потому что вместо этого H 2 O окисляется или восстанавливается.Вещества, которые подвергаются спонтанной окислительно-восстановительной реакции с H 2 O, обычно получают электролизом расплавов солей или в каком-либо другом растворителе. Однако из этого правила есть некоторые исключения, поскольку некоторые электродные реакции протекают медленнее, чем другие. Например, используя таблицу 11.5, мы можем предсказать, что H 2 O является лучшим восстановителем, чем Cl —.
Следовательно, мы ожидаем, что O 2 , а не Cl 2 , будет получен путем электролиза 1 M HCl, что противоречит уравнению \ (\ ref {1} \).Оказывается, что O 2 образуется больше , медленно , чем Cl 2 , и последний пузырится из раствора до того, как H 2 O может быть окислен. По этой причине Таблицу 1 из раздела Редокс-пары не всегда можно использовать для прогнозирования того, что произойдет при электролизе.
Как определить анод и катод
Вот посмотрите на разницу между анодом и катодом элемента или батареи и как вы можете запомнить, что есть что.
Держать их прямыми
Помните, что cat hode притягивает ионы cat или ca t hode притягивает заряд + . Ода n притягивает исходный заряд n .
Поток тока
Анод и катод определяются течением тока. В общем смысле ток относится к любому движению электрического заряда. Тем не менее, вы должны иметь в виду соглашение о том, что направление тока соответствует тому, куда будет двигаться положительный заряд , а не отрицательный заряд.Итак, если электроны действительно совершают , перемещая в ячейке, тогда ток течет в противоположном направлении. Почему это так определяется? Кто знает, но это стандарт. Ток течет в том же направлении, что и носители положительного заряда, например, когда положительные ионы или протоны несут заряд. Ток течет в противоположном направлении от отрицательных носителей заряда, таких как электроны в металлах.
Катод
- Катод — отрицательно заряженный электрод.
- Катод притягивает катионы или положительный заряд.
- Катод является источником электронов или донором электронов. Он может принимать положительный заряд.
- Поскольку катод может генерировать электроны, которые обычно представляют собой электрические компоненты, совершающие фактическое движение, можно сказать, что катоды генерируют заряд или что ток движется от катода к аноду. Это может сбивать с толку, потому что направление тока будет определяться тем, как будет двигаться положительный заряд. Просто помните, любое движение заряженных частиц — это ток.
Анод
- Анод — это положительно заряженный электрод.
- Анод притягивает электроны или анионы.
- Анод может быть источником положительного заряда или акцептором электронов.
Катод и анод
Помните, что заряд может течь как от положительного к отрицательному, так и от отрицательного к положительному! Из-за этого анод может быть заряжен положительно или отрицательно, в зависимости от ситуации. То же самое и с катодом.
Источники
- Durst, R .; Baumner, A .; Мюррей, Р .; Buck, R .; Андрие, К. (1997) «Химически модифицированные электроды: Рекомендуемая терминология и определения». ИЮПАК. pp 1317–1323.
- Росс, С. (1961). «Фарадей консультирует ученых: происхождение терминов электрохимии». Примечания и записи Лондонского королевского общества n. 16: 187–220. DOI: 10.1098 / RSNR.1961.0038
красный, черный положительный, отрицательный, анод и катод? — IontoCentre
Как видно из названия этого поста, будет справедливо сказать, что существует некоторая путаница, связанная с положительным и отрицательным кабелями, и где они должны быть по отношению к вашему аппарату для ионтофореза, и как это влияет на ваше лечение гипергидроза.Не помогает то, что каждую сторону можно назвать красной или черной, положительной или отрицательной, анодом и катодом!
Чтобы помочь прояснить это, следующее объясняет, что есть что:
Анод или Красный = Положительный (+)
Катод или Черный = Отрицательный (-)
Предыдущие модели для ионофореза Hidrex (PSP100 и GS400)
Также не помогает то, что предыдущие модели Hidrex, такие как Hidrex PSP1000 и Hidrex GS400, поставлялись с кабелями с цветовой кодировкой.
На задней панели панелей управления этого аппарата для ионтофореза кабельные порты также имеют цветовую маркировку. В дополнение к этому, электродные пластины, поставляемые с этими моделями, также имели цветовую кодировку, поэтому неудивительно, что люди считали, что это важная часть их лечения ионтофорезом.
Эта цветовая кодировка позволяла подключить соответствующие кабели и визуально узнать, какая сторона корпуса обрабатывалась с положительной и отрицательной сторон. Знание этой информации было важным в то время, так как считалось, что немного лучше (в большинстве случаев незаметно) на положительной (красный +) стороне.Это связано с тем, что на положительном аноде немного больше ионной активности, поэтому теоретически, если вы когда-либо обрабатывали только одну сторону тела положительной стороной, вы можете обнаружить, что эта сторона быстрее добьется лучших результатов.
В этих случаях и для этих машин было рекомендовано поменять местами стороны, чтобы вы могли выровнять ответы, и общий совет заключался в том, чтобы чередовать, какая сторона обрабатывалась положительной красной или отрицательной черной стороной. В то время этому переключающему действию не уделялось слишком много внимания, поскольку этот эффект не был клинически доказан — доказательства были чисто анекдотичными.
Текущие версии аппаратов для ионофореза Hidrex не содержат кабелей, портов или электродов с цветовой кодировкой.
Hidrex ClassicION
Однако недавние фактические исследования показали, что красная положительная сторона анода будет реагировать лучше, чем отрицательная катодная на современных машинах.
Текущие версии аппаратов для ионофореза Hidrex не содержат кабелей, портов или электродов с цветовой кодировкой. Это связано с тем, что более совершенное устройство для ионофореза Hidrex ClassicION содержит функцию автоматического переключения полярности, которая автоматически переключает направление тока в середине процедуры.Важно отметить, что в целом направление тока очень мало влияет на лечение, кроме случаев, когда вы лечите только с одной стороны.
Hidrex ClassicION не имеет автоматического переключения полярности. Чтобы изменить, какая сторона тела обрабатывается положительным анодом (+), просто поменяйте местами, какая рука, ступня или подмышка будет на этой стороне при следующем сеансе лечения. Например, если на следующий день лечения вы положили левую ногу на лотки стороной (+), поменяйте местами, чтобы поставить (+) сторону правой ступни.
На изображении ниже показана задняя часть панели управления ClassicION:
Порты обозначены A и B.
Порт A — положительный анод (+)
, а порт B — отрицательный катод (-)
Дополнительную информацию об этом можно найти на стр. 6 руководства по эксплуатации
Диаграмму, показывающую порты, можно найти на стр. 9
Hidrex ConnectION
ConnectION имеет автоматическое переключение полярности.
Hidrex ConnectION имеет новую настройку, которая может автоматически менять полярность во время лечения. Изменение тока просто изменяет направление, в котором ток проходит через тело.
Вы можете включить или выключить эту функцию, нажав обе кнопки управления и удерживая их в течение нескольких секунд. Это переведет машины в режим настройки полярности, и вы сможете выбрать автоматическую полярность ON (отображается на экране как poLI) или автоматическую полярность OFF (отображается на экране как poLO — см. Изображения).
Когда эта функция включена, аппарат автоматически выключится на полпути процедуры, изменит полярность, а затем вернется к установленному вами уровню мощности. Во время этого действия пациенты должны оставаться в лотках / подключенных к аппарату для ионтофореза. Лечение возобновится в обычном режиме с этой промежуточной точки лечения.
Подробнее об автоматическом переключении полярности можно прочитать здесь.
Катодные и анодные реакции полуэлементов — стенограмма видео и урока
Расчет потенциала напряжения элемента
Электрохимические элементы, о которых вы узнали, являются гальваническими элементами.Гальванический элемент — это элемент, в котором спонтанная окислительно-восстановительная реакция производит электричество. В гальванической ячейке, как вы знаете, реакция окисления на аноде заставляет электроны проходить через провод, соединяющий катод с анодом. Он называется электрическим потенциалом и измеряется в вольтах (В). Более конкретно, потенциал электрода — это разность потенциалов между электродом и его раствором или величина притяжения электронов. Это количество энергии, необходимое для перемещения электрического заряда по ячейке.
Каждая из двух полуэлементов батареи имеет потенциал — потенциал либо отдавать электроны, либо принимать электроны. Разница между ними — это электродный потенциал всей ячейки или напряжение. К счастью, потенциал электрода — это не то, что вам нужно запоминать. Ученые определили стандартные электродные потенциалы для многих различных типов электродов.
Чтобы определить напряжение любой ячейки, посмотрите таблицу электродных потенциалов. Вычтите электродный потенциал анода из потенциала катода, и вы получите электродный потенциал ячейки или напряжение: ячейка Eo = катод Eo — анод Eo.
Это число легко вычислить. Например, рассчитайте напряжение ячейки для реакции жидкого ртутного электрода в растворе нитрата ртути (I) и металлического кадмиевого электрода в растворе нитрата кадмия. Если Eo вам не предоставлено, вы можете обратиться к диаграмме для определения значения.
| Электрод | Реакционный электрод | Eo Вольт |
|---|---|---|
| Cd2 + | Кд2 + |
Формула полуреакций:
- Hg22 + + 2e- = 2Hg (l), что имеет Eo = 0.850 В
- Cd2 + (aq) + 2e- = Cd (s), который имеет Eo = -0,403V
- Ячейка Eo = катод Eo — анод Eo
Ячейка Eo = 0,850 В — (-0,403 В). Помните, что два негатива дают положительный результат. Ячейка Eo = 1,253 В.
Попробуйте другой.
- Zn2 + (водн.) + 2e- = Zn (s), который имеет Eo = -0,762V
- 2h3 O (l) + 2e- = h3 (g) + 2OH- (водн.), Который имеет Eo = -0,828V
Ячейка Eo = (-0,762 В) — (-0,828 В). Итак, ячейка Eo = 0,066 В.
Коррозия
Как вы знаете, трубопровод Аляски представляет собой длинную стальную трубу, по которой нефть доставляется с Аляски в 48 нижних штатов. Что бы произошло, если бы он заржавел? Не разольется ли нефть в окружающей среде? Как защитить металл от коррозии?
Коррозия — это постепенное разрушение металла в результате химических реакций. Поскольку это химическая реакция, мы можем предотвратить ее с помощью химических реакций, а именно окислительно-восстановительных реакций. Одним из металлов, наиболее подверженных коррозии, является железо.Когда железо подвергается коррозии, ржавчина образуется в реакции 4Fe (s) + 3O2 (g) + h3 = 2Fe2O3h3O (s).
Количество образующейся ржавчины зависит от количества воды, с которой железо может реагировать. Две электрохимические полуреакции:
- Fe (s) = Fe2 + (водн.) + 2e-. Это анод.
- O2 (г) + 2h3 O (l) + 4e- = 4OH- (водн.). Это катод.
Анод и катод находятся на одной и той же железке, но в разных ее частях. Вы знаете, что для того, чтобы эта реакция сработала, электронам нужен какой-то провод или какой-то способ проведения электронного потока.В этом случае проволокой выступает сам утюг.
Итак, когда кусок железа подвергается воздействию кислорода и воды, участок на железе окисляется и теряет электроны. Эти электроны проходят через железо к другому участку, где они восстанавливаются. Здесь они образуют твердое вещество, называемое гидратированным оксидом железа, 2Fe2sub) 3sub) 2. Слой воды на поверхности железа действует как барьер или солевой мостик, необходимый для работы электрохимической ячейки или реакции.
Чтобы предотвратить коррозию, используйте другой металл, который окисляется легче, чем металл, который вы хотите защитить. Цинк окисляется легче, чем железо, поэтому, если вы покроете железо цинком, цинк будет коррозировать раньше, чем железо. Это защищает утюг. Это называется катодной защитой, потому что вы добавляете к металлу защитный катод. Гвозди являются примером. Железные гвозди часто покрывают цинком в процессе, называемом гальванизацией, чтобы защитить их от ржавчины.
Трубопровод на Аляске — еще один прекрасный пример такого типа защиты. Вместо того, чтобы покрывать все цинком, трубопровод подключается к цинковой проволоке. Цинк будет корродировать раньше, чем сталь, и если корродированный цинк будет периодически заменяться, сама труба не подвергнется коррозии. Это отличная вещь.
Краткое содержание урока
Электрохимические реакции в ячейке состоят из двух полуреакций: на анодном электроде и на катодном электроде. Две полуреакции можно сложить вместе, чтобы получить полноценную клеточную реакцию.Потенциал электродной ячейки измеряется в вольтах. Достаточно легко определить напряжение любой электрохимической ячейки, если у вас есть таблица, в которой указано напряжение для каждого типа электрода. Чтобы определить напряжение любой ячейки, вычтите потенциал электрода анода из потенциала катода, и вы получите электродный потенциал ячейки или напряжение. Ячейка Eo = катод Eo — анод Eo .
Коррозия — это постепенное разрушение металла в результате химических реакций, и это реальная проблема в нашей повседневной жизни.Поскольку коррозия — это химическая реакция, мы можем предотвратить ее с помощью химических реакций, а именно окислительно-восстановительных реакций. Чтобы предотвратить коррозию, используйте другой металл, который окисляется легче, чем металл, который вы хотите защитить. Как и в большинстве случаев в жизни, химические реакции протекают по пути наименьшего сопротивления и наименьшей энергии, поэтому металл, который легче окисляется, подвергнется коррозии, а другой металл будет защищен.
Результаты обучения
По окончании этого урока вы сможете:
- Описывать две половинные ячейки в электрохимической ячейке
- Объясните, как можно сложить две полуреакции, чтобы получить полную реакцию клетки.
- Обобщите, как определить напряжение ячейки
- Дайте определение коррозии и объясните, как ее предотвратить
Какую полярность электродов следует использовать при ручной дуговой сварке металлическим электродом?
Часто задаваемые вопросы
Первый важный момент заключается в том, что не все электроды MMA можно использовать с любой полярностью.Информация и спецификации производителя электродов, такие как BS EN ISO 2560: 2009 и AWS A5.1-2012, определяют полярность, с которой могут использоваться электроды с различными покрытиями. Выбор полярности также зависит от типа материала, положения сварки и конструкции соединения. В процедуре сварки должна быть указана полярность для каждого сварочного шва.
Щелкните здесь, чтобы увидеть наши последние подкасты по технической инженерии на YouTube .
Необходимо определить термины, чтобы указать полярность сварочного процесса.Положительная часть сварочной цепи (притягивающая электроны в дугу) — это анод. Отрицательная часть сварочной цепи (генерирующая электроны в дуге) — это катод. Полезной мнемоникой для этого является PANiC (положительный анод, отрицательный катод).
Когда процесс сварки выполняется в режиме постоянного тока, электрод (электрод MMA, MIG / MAG / флюсовая или порошковая проволока или вольфрамовый электрод) может быть положительным или отрицательным. В результате получается либо положительный электрод постоянного тока (DCEP), либо отрицательный электрод постоянного тока (DCEN).DCEP также исторически был известен как обратная полярность постоянного тока (DCRP) или просто «обратная полярность», тогда как DCEN также была известна как прямая полярность постоянного тока (DCSP) или просто «прямая».
При сварке TIG разделение тепла между анодом и катодом является значительным. Приблизительно 2/3 тепла генерируется на положительном аноде из-за столкновения высокоскоростных электронов с высокой энергией. Отрицательный катод не испытывает этого эффекта и даже может охлаждаться термоэлектронной эмиссией в зависимости от материала.Например, вольфрамовый электрод является термоэмиссионным, поэтому он испытывает охлаждающий эффект. По этой причине полярность DCEN является наиболее распространенным выбором для сварки TIG, когда очищающее действие процесса DCEP не требуется. Использование DCEP для сварки TIG требует вольфрамовых электродов большего диаметра и водяного охлаждения, и чаще всего используется как только часть цикла при сварке на переменном токе.
Однако процесс MMA с его расходуемым электродом не вызывает этих проблем. Распределение тепла между электродом и заготовкой также отличается и не так сильно зависит от полярности.В частности, перемещение материала непосредственно от расходуемого электрода к заготовке приводит к значительному уравновешиванию тепла между двумя точками.
Более важным, чем распределение тепла, является влияние полярности на проплавление при сварке MMA. В общем, работа на DCEP приводит к большему проплавлению, а DCEN приводит к уменьшению проплавления и уменьшению разбавления металла сварного шва подложкой. Это важно для электродов, которые можно использовать при обеих полярностях постоянного (и переменного) тока.Режим DCEN часто используется на открытых корневых проходах, чтобы снизить риск прожога, тогда как DCEP используется для снижения риска отсутствия дефектов сварки. DCEN также может использоваться для наплавки, чтобы минимизировать проплавление, и для сварки тонких листов. Переменный ток также используется как метод снижения вероятности возникновения дуги. Однако решающим фактором остается флюсовое покрытие электрода, которое присуще сварочному электроду и приводит к ограничениям полярности, указанным производителем.
Для полноты информации здесь представлена информация о процессе сварки MIG / MAG и дуге под флюсом, а также о влиянии полярности.
Для сварки MIG / MAG DCEN и AC обычно не используются, потому что трудно достичь стабильных условий распыления, в основном работающих с глобулярным переносом, что не обязательно приводит к приемлемому сварному шву. Однако производители оборудования все чаще ищут источники питания, которые могут использовать эти условия. Условие DCEP также способствует плавлению провода из-за столкновения электронов.Это тепло снова передается сварочной ванне через проход расплавленных капель, помогая уравновесить анод и катод.
Дуговая сварка под флюсом аналогична MIG / MAG, причем наиболее часто используемой полярностью является DCEP, но DCEN встречается чаще в этом процессе, особенно при наплавке, где предпочтительны меньшее проплавление и разбавление субстратом. Переменный ток используется при выполнении многопроволочной сварки, обычно с ведущим проводом постоянного тока и переменным током для всех ведомых проводов, чтобы уменьшить проблемы с дугой.
Список литературы
Справочник по сварке AWS — Американское сварочное общество
Энциклопедия сварки Джефферсона, 18-е издание — Американское общество сварки
Принципы сварки — Роберт В. Месслер, младший
Руководство по дуговой сварке — Lincoln Electric
Сварка металлургии, 2-е издание — Синдо Коу
ANSI / AWS A5.1-2012 Технические условия на электроды из углеродистой стали для дуговой сварки в среде защитного металла
BS EN ISO 2560: 2009 Сварочные материалы.Покрытые электроды для ручной дуговой сварки нелегированных и мелкозернистых сталей. Классификация
Для получения дополнительной информации свяжитесь с нами.
.
