Что такое катод и анод. Как различаются катод и анод в электрохимии и электронике. Где применяются катод и анод. Какие процессы происходят на катоде и аноде. Как определить, где катод, а где анод.
Что такое катод и анод: основные определения
Катод и анод — это электроды, через которые электрический ток входит в электрохимическую систему или устройство и выходит из него. Их определения зависят от контекста:
- В электрохимии:
- Катод — электрод, на котором происходит процесс восстановления
- Анод — электрод, на котором происходит процесс окисления
- В электронных устройствах:
- Катод — отрицательный электрод
- Анод — положительный электрод
Различия между катодом и анодом в электрохимии
В электрохимических процессах катод и анод различаются следующим образом:
- На катоде происходит реакция восстановления — принятие электронов
- На аноде происходит реакция окисления — отдача электронов
- Катод имеет более отрицательный потенциал, чем анод
- К катоду движутся положительно заряженные ионы (катионы)
- К аноду движутся отрицательно заряженные ионы (анионы)
Применение катода и анода в различных устройствах
Катод и анод используются во многих электрохимических и электронных устройствах:
- Гальванические элементы и аккумуляторы
- Электролизеры
- Электронные лампы
- Полупроводниковые приборы (диоды, транзисторы)
- Электронно-лучевые трубки
Как определить катод и анод в электрохимической ячейке?
Чтобы определить катод и анод в электрохимической ячейке, нужно учитывать следующее:
- Катод — это электрод с более отрицательным потенциалом
- На катоде происходит восстановление — прием электронов
- К катоду движутся положительные ионы (катионы)
- Анод — это электрод с более положительным потенциалом
- На аноде происходит окисление — отдача электронов
- К аноду движутся отрицательные ионы (анионы)
Процессы на катоде и аноде при электролизе
При электролизе на катоде и аноде происходят следующие процессы:
Процессы на катоде:
- Восстановление катионов металлов
- Выделение водорода
- Восстановление анионов
Процессы на аноде:
- Окисление анионов
- Выделение кислорода
- Растворение металла анода
Катод и анод в гальванических элементах и аккумуляторах
В гальванических элементах и аккумуляторах катод и анод меняют свои роли при разряде и зарядке:
- При разряде:
- Катод — положительный электрод
- Анод — отрицательный электрод
- При зарядке:
- Катод — отрицательный электрод
- Анод — положительный электрод
Особенности катода и анода в электронных лампах
В электронных лампах катод и анод имеют следующие особенности:
- Катод:
- Нагревается и испускает электроны (термоэлектронная эмиссия)
- Изготавливается из материалов с низкой работой выхода электронов
- Может быть прямого или косвенного накала
- Анод:
- Собирает электроны, испускаемые катодом
- Имеет положительный потенциал относительно катода
- Обычно изготавливается из металла с хорошим теплоотводом
Катод и анод в полупроводниковых приборах
В полупроводниковых приборах, таких как диоды и транзисторы, катод и анод определяются следующим образом:
- Катод:
- Область полупроводника n-типа
- Электрод, от которого идет основной ток носителей заряда
- Анод:
- Область полупроводника p-типа
- Электрод, к которому идет основной ток носителей заряда
Как правильно подключать катод и анод в электронных схемах?
При подключении катода и анода в электронных схемах следует учитывать следующее:
- В диодах катод обозначается полоской на корпусе
- В светодиодах длинный вывод — анод, короткий — катод
- В электролитических конденсаторах длинный вывод — анод
- В транзисторах эмиттер обычно является катодом
- В электронных лампах катод обычно подключается к «земле»
Влияние материала катода и анода на электрохимические процессы
Материал катода и анода оказывает значительное влияние на электрохимические процессы:
- Материал катода влияет на:
- Перенапряжение выделения водорода
- Эффективность восстановления ионов металлов
- Селективность катодных процессов
- Материал анода влияет на:
- Скорость растворения анода
- Выход по току при электролизе
- Образование побочных продуктов
Заключение: ключевые отличия катода и анода
Подведем итоги основных отличий катода и анода:
- Катод — электрод, на котором происходит восстановление, анод — окисление
- В электрохимии катод имеет более отрицательный потенциал, чем анод
- В электронных устройствах катод обычно отрицательный, анод — положительный
- К катоду движутся катионы, к аноду — анионы
- Роли катода и анода могут меняться в зависимости от процесса (например, при зарядке и разрядке аккумулятора)
Понимание различий между катодом и анодом крайне важно для правильного проектирования и эксплуатации электрохимических и электронных устройств.

Катод — определение и практическое применение
Это специфическое обозначение часто применяют в описаниях радиотехнических приборов, производственных процессов. Ошибочное понимание терминологии провоцирует аварийные ситуации, увеличивает затраты в ходе монтажных и ремонтных работ. В этой публикации рассказано о том, что такое катод. Примеры с пояснениями помогут правильно решать типовые практические задачи.
Катод и анод – это плюс или минус
Что такое катодЭтим термином обозначают контакт, подключаемый к отрицательной клемме аккумуляторной батареи либо другого источника постоянного тока. На картинке выше – фотографии диода и конденсатора. Эти элементы используют в сетях с переменными электрическими параметрами. Однако и в подобных ситуациях катодным называют подсоединение с учетом соответствующей полярности.
Катод и анод в электрохимииСоответствующие физические (химические) реакции применяют:
- для создания автономных источников питания;
- при воспроизведении технологических процессов.
В первом случае речь идет об аккумуляторных батареях. Классическая гальваническая пара состоит из двух элементов:
- анода (-), разрушающегося в ходе реакции окисления;
- катода (+), «принимающего» электроны.
Подключение нагрузки к гальваническому элементу питания
Представленная на рисунке схема поясняет принцип разрушения (восстановления) анода (катода), соответственно. Отмеченный процесс выполняет полезные функции в гальванотехнике. С помощью соответствующих технологий извлекают из растворов ионы металлов и других веществ, создают качественные декоративные и защитные покрытия на изделиях сложной формы.
Зарядка АКБ и электролиз
Как показано на первой схеме, при подключении сильного источника тока в процессе зарядки АКБ катоды и аноды обозначают разные полярности. На второй части рисунка показано, как происходит процесс нанесения медного слоя на деталь. Анод в этой схеме – это электрод, который подключен к «плюсу» батарейки. Он разрушается в процессе электролиза. Ионы меди равномерно накапливаются на катоде, подсоединенном к «минусу». Покрывать благородными и дорогими металлами можно недорогие заготовки из проводящих материалов.
К сведению. Аналогичные методики применяют в химии, чтобы разделить вещества в растворенном состоянии на составные компоненты (ионы).
Катод в вакуумных приборахИзделия этой категории выполняют свои функции следующим образом. Катод – это генерирующий элемент, который отличается относительно малой работой для выхода электронов. Повышают эффективность данного компонента с помощью нагрева.
Ток через центральную часть проходит при соответствующей полярности подключения
Эта схема демонстрирует прямую зависимость применяемых терминов от движения электронов. В некоторых вакуумных приборах между анодом и катодом устанавливают сетчатую перегородку, которой регулируют силу тока и соответствующий коэффициент усиления.
Модифицированный вариант – электронно-лучевая трубка (ЭЛТ)
В типичной конструкции применяют несколько анодов, которые разгоняют электроны и обеспечивают фокусировку луча. Изменением напряжения на горизонтальных (вертикальных) пластинах перемещают поток в нужном направлении. Экран изнутри покрыт слоем люминофора, который светится в видимом диапазоне спектра при попадании заряженных частиц.
Для нагрева применяют прямые и косвенные методики. Катод накрывают модулятором. Это изделие создают в форме стакана с отверстием в центральной части дна. Сюда подают отрицательный потенциал, который оказывает существенное влияние на энергетические параметры пучка и силу свечения.
К сведению. При повышении мощности электронной пушки сфокусированный поток можно использовать для локального нагрева, сварки. Такие технологии обеспечивают высокое качество соединений. В соответствующем исполнении они пригодны для создания оружия.
Катод у полупроводниковых приборовИзделия этой категории отличаются большим электрическим сопротивлением, по сравнению с проводниками, но меньшим – чем в диэлектриках. Специально подобранная комбинация материалов типового диода (p-n переход) не создает больших препятствий прохождению тока только в одном направлении.
Схема подключения и внешний вид диодов
На верхней части рисунка показаны обозначения источника питания постоянного тока и полупроводникового прибора. По стандартным рисункам на плате и утолщенным линиям несложно определить соответствующий вывод. Прозрачный корпус миниатюрных моделей не препятствует визуальной идентификации. Правильные выводы можно сделать при внимательном изучении светодиодов. Более крупная часть в том и другом примере – это катод.
Тиристор создан по аналогии с ламповыми аналогами. С помощью третьего электрода управляют работой электронного ключа.
Знак катодаОшибки в применении понятий возникают по причине разных подходов. Химики рассматривают процессы окисления и восстановления (анод – это «плюс», а катод – «минус»). Соответствующее подключение внешнего источника питания активизирует движение ионов и отдельные химические реакции.
В гальванических элементах наблюдаются обратные процессы. Избыточное количество электронов на одном из функциональных компонентов обеспечивает окисление цинкового или другого электрода. В этом примере при подключении нагрузки восстанавливается второй элемент (катод) – это контакт батареи, обозначенный знаком «плюс».
Как показано выше, ситуация изменяется при подключении внешнего более сильного источника питания. От направления движения тока меняются соответствующие обозначения ламповых приборов.
Как определить анод – это плюс или минус
Представленное на последнем рисунке правило действительно при рассмотрении электротехнических схем, полупроводниковых приборов. Для уточнения полярности достаточно проверить соответствие количества букв.
ВидеоКак выглядит катод. Анод и катод
Любой электровакуумный прибор имеет электрод, предназначенный для испускания (эмиссии) электронов. Этот электрод называется катодом. Электрод, предназначенный для приема эмиттированных катодом электронов, называется анодом.
На анод подают более высокий и положительный относительно катода потенциал.
Катод должен отдавать с единицы поверхности большой ток эмиссии при возможно низкой температуре нагрева и обладать большим сроком службы. Нагрев катода в электровакуумном приборе производится протекающим по нему током.
Такие термоэлектронные катоды разделяются на две основные группы:
- катоды прямого накала,
- катоды косвенного накала (подогревные).
Катоды прямого накала представляют собой металлическую нить, которая непосредственно разогревается током накала и служит для излучения электронов (рис. 6, а ).
Поверхность излучения катодов прямого накала невелика, поэтому от них нельзя получить большой ток эмиссии. Малая теплоемкость нити не позволяет использовать для нагрева переменный ток. Кроме того, при нагреве переменным током температура катода не постоянна во времени, а следовательно, меняется во времени и ток эмиссии.
Положительным свойством катода прямого накала является его экономичность, которая достигается благодаря малому количеству тепла, излучаемого в окружающую среду вследствие малой поверхности катода.
Катоды прямого накала изготовляются из вольфрамовой и никелевой проволоки. Однако большая работа выхода (W 0 = 4,2÷4,5 в) определяет высокую рабочую температуру катода, вследствие чего катод становится неэкономичным. Для повышения экономичности катода вольфрамовую или никелевую проволоку (керн) «активируют» — покрывают пленкой другого элемента. Такие катоды называются активированными.
Если на поверхность керна нанесена электроположительная пленка (пленка из цезия, тория или бария, имеющих меньшую работу выхода, чем материал керна), то происходит поляризация пленки: валентные электроны переходят в керн, и между положительно заряженной пленкой и керном возникает разность потенциалов, ускоряющая движение электрона при выходе его из керна. Работа выхода катода с такой мономолекулярной электроположительной пленкой оказывается меньше работы выхода электрона как из основного металла, так и из металла пленки. При покрытии керна электроотрицательной пленкой, например кислородом, работа выхода катода увеличивается.
Подогревные катоды выполняются в виде никелевых гильз, поверхность которых покрывается активным слоем металла, имеющим малую работу выхода (рис. 6, б ). Внутри катода помещается подогреватель — вольфрамовая нить или спираль, подогрев которой может осуществляться как постоянным, так и переменным током.
Для изоляции подогревателя от гильзы внутренность последней покрывается алундом (Аl 2 O 3).
Подогревные катоды, благодаря их большой тепловой инерции, обычно питают переменным током, значительная поверхность гильзы обеспечивает большой эмиссионный ток. Подогревные катоды, однако, менее экономичны и разогреваются значительно дольше, чем катоды прямого накала.
Параметры и характеристики катодов
Катоды характеризуются следующими основными параметрами:
1. Удельной эмиссией , определяемой величиной тока с одного квадратного сантиметра эмиттирующей поверхности катода при нормальной рабочей температуре.
В электронных лампах с активированными катодами вместо удельной эмиссии часто пользуются параметром,называемым допустимой плотностью катодного тока. Этот параметр характеризуется током, который можно получить с одного квадратного сантиметра поверхности катода при нормальном (рабочем) напряжении накала. Работа при токах с катода, равных току эмиссии в этих лампах, приводит к разрушению поверхности слоя катода.
2. Эффективностью , равной величине тока эмиссии катода, приходящейся на одни ватт затраченной на накал мощности:
Н=I э /P н (12)
где I э — ток эмиссии катода, ма; P н — мощность, затраченная в цепи накала, вт.
3. Сроком службы катода, измеряемым в часах и характеризующим время, в течение которого катод сохраняет необходимые эксплуатационные свойства. Для простых катодов считается, что уменьшение диаметра катода на 10% приводит к его гибели. Соответственно оценивается и срок их службы.
Срок службы активированных катодов определяется уменьшением площади покрытия катода активной пленкой (а следовательно, ухудшением основных параметров лампы) на 20%.
Для выбора оптимального режима работы катода необходимо знать зависимость тока эмиссии катода от его температуры. Непосредственное измерение температуры накаленного катода затруднительно, поэтому пользуются так называемой накальной или эмиссионной характеристикой катода — графически выраженными зависимостями тока накала или тока эмиссии от напряжения или тока накала (рис. 7, а ).
В схеме имеются две цепи: анодная и накальная. Контроль за напряжением накала производится вольтметром V1, непосредственно подключенным в катодную цепь; если необходимо знать ток накала, то в нее включают амперметр. При этом амперметр следует подсоединять к тому зажиму катода, через который проходят накальный и анодный токи в одном направлении: данный конец нити накала нагревается сильнее и работает в наиболее тяжелых тепловых условиях.
Величина тока накала определяется разностью показания амперметра и показания миллиамперметра, но уменьшенного вдвое (так как по этой части цепи проходит примерно половина анодного тока).
Поддерживая постоянным напряжение на аноде, снимают зависимость тока эмиссии от напряжения (или тока) накала. Эмиссионный ток появляется начиная с напряжения на катоде 1-1,5 в и резко возрастает при напряжениях накала, близких к нормальным (рабочим) значениям.
Характеристику I н = ƒ(U н) (см. рис. 7, а ) следует снимать при разомкнутой анодной цепи. Накальная характеристика нелинейна, так как с повышением температуры катода его сопротивление увеличивается. При этом ток накала возрастает меньше, чем увеличивается напряжение накала.
Про анод и катод источника питания необходимо знать тем, кто занимается практической электроникой. Что и как называют? Почему именно так? Будет углублённое рассмотрение темы с точки зрения не только радиолюбительства, но и химии. Наиболее популярное объяснение звучит следующим образом: анод — это положительный электрод, а катод — отрицательный. Увы, это не всегда верно и неполно. Чтобы уметь определить анод и катод, необходимо иметь теоретическую базу и знать, что да как. Давайте рассмотрим это в рамках статьи.
Анод
Обратимся к ГОСТ 15596-82, который занимается химическими Нас интересует информация, размещённая на третьей странице. Согласно ГОСТу, отрицательным электродом является именно анод. Вот так да! А почему именно так? Дело в том, что именно через него электрический ток входит из внешней цепи в сам источник. Как видите, не всё так легко, как кажется на первый взгляд. Можно посоветовать внимательно рассматривать представленные в статье картинки, если содержимое кажется слишком сложным — они помогут понять, что же автор хочет вам донести.
Катод
Обращаемся всё к тому же ГОСТ 15596-82. Положительным электродом химического источника тока является тот, при разряде из которого он выходит во внешнюю цепь. Как видите, данные, содержащиеся в ГОСТ 15596-82, рассматривают ситуацию с другой позиции. Поэтому при консультировании с другими людьми насчет определённых конструкций необходимо быть очень осторожным.
Возникновение терминов
Их ввёл ещё Фарадей в январе 1834 года, чтобы избежать неясности и добиться большей точности. Он предлагал и свой вариант запоминания на примере с Солнцем. Так, у него анод — это восход. Солнце движется вверх (ток входит). Катод — это заход. Солнце движется вниз (ток выходит).
Пример радиолампы и диода
Продолжаем разбираться, что для обозначения чего используется. Допустим, один из данных потребителей энергии у нас имеется в открытом состоянии (в прямом включении). Так, из внешней цепи диода в элемент по аноду входит электрический ток. Но не путайтесь благодаря такому объяснению с направлением электронов. Через катод во внешнюю цепь из используемого элемента выходит электрический ток. Та ситуация, что сложилась сейчас, напоминает случаи, когда люди смотрят на перевёрнутую картину. Если данные обозначения сложные — помните, что разбираться в них таким образом обязательно исключительно химикам. А сейчас давайте сделаем обратное включение. Можно заметить, что полупроводниковые диоды практически не будут проводить ток. Единственное возможное здесь исключение — обратный пробой элементов. А электровакуумные диоды (кенотроны, радиолампы) вообще не будут проводить обратный ток. Поэтому и считается (условно), что он через них не идёт. Поэтому формально выводы анод и катод у диода не выполняют свои функции.
Почему существует путаница?
Специально, чтобы облегчить обучение и практическое применение, было решено, что диодные элементы названия выводов не будут менять зависимо от своей схемы включения, и они будут «прикреплены» к физическим выводам. Но это не относится к аккумуляторам. Так, у полупроводниковых диодов всё зависит от типа проводимости кристалла. В электронных лампах этот вопрос привязан к электроду, который эмитирует электроны в месте расположения нити накала. Конечно, тут есть определённые нюансы: так, через такие как супрессор и стабилитрон, может немного протекать обратный ток, но здесь существует специфика, явно выходящая за рамки статьи.
Разбираемся с электрическим аккумулятором
Это по-настоящему классический пример химического источника электрического тока, что является возобновляемым. Аккумулятор пребывает в одном из двух режимов: заряд/разряд. В обоих этих случаях будет разное направление электрического тока. Но обратите внимание, что полярность электродов при этом меняться не будет. И они могут выступать в разных ролях:
- Во время зарядки положительный электрод принимает электрический ток и является анодом, а отрицательный его отпускает и именуется катодом.
- При отсутствии движения о них разговор вести нет смысла.
- Во время разряда положительный электрод отпускает электрический ток и является катодом, а отрицательный принимает и именуется анодом.
Об электрохимии замолвим слово
Здесь используют немного другие определения. Так, анод рассматривается как электрод, где протекают окислительные процессы. И вспоминая школьный курс химии, можете ответить, что происходит в другой части? Электрод, на котором протекают восстановительные процессы, называется катодом. Но здесь нет привязки к электронным приборам. Давайте рассмотрим ценность окислительно-восстановительных реакций для нас:
- Окисление. Происходит процесс отдачи частицей электрона. Нейтральная превращается в положительный ион, а отрицательная нейтрализуется.
- Восстановление. Происходит процесс получения частицей электрона. Положительная превращается в нейтральный ион, а потом в отрицательный при повторении.
- Оба процесса являются взаимосвязанными (так, количество электронов, что отданы, равняется присоединённому их числу).
Также Фарадеем для обозначения были введены названия для элементов, что принимают участие в химических реакциях:
- Катионы. Так называются положительно заряженные ионы, что двигаются в в сторону отрицательного полюса (катода).
- Анионы. Так называются отрицательно заряженные ионы, что двигаются в растворе электролита в сторону положительного полюса (анода).
Как происходят химические реакции?
Окислительная и восстановительная полуреакции являются разделёнными в пространстве. Переход электронов между катодом и анодом осуществляется не непосредственно, а благодаря проводнику внешней цепи, на котором создаётся электрический ток. Здесь можно наблюдать взаимное превращение электрической и химической форм энергии. Поэтому для образования внешней цепи системы из проводников разного рода (коими являются электроды в электролите) и необходимо пользоваться металлом. Видите ли, напряжение между анодом и катодом существует, как и один нюанс. И если бы не было элемента, что мешает им напрямую произвести необходимый процесс, то ценность источников химического тока была бы весьма низка. А так, благодаря тому, что заряду необходимо пройтись по той схеме, была собрана и работает техника.
Что есть что: шаг 1
Теперь давайте будем определять, что есть что. Возьмём гальванический элемент Якоби-Даниэля. С одной стороны он состоит из цинкового электрода, который опущен в раствор сульфата цинка. Затем идёт пористая перегородка. И с другой стороны имеется медный электрод, который расположен в растворе Они соприкасаются между собой, но химические особенности и перегородка не дают смешаться.
Шаг 2: Процесс
Происходит окисление цинка, и электроны по внешней цепи двигаются к меди. Так получается, что гальванический элемент имеет анод, заряженный отрицательно, и катод — положительный. Причем данный процесс может протекать только в тех случаях, когда электронам есть куда «идти». Дело в том, что попасть напрямую от электрода к другому мешает наличие «изоляции».
Шаг 3: Электролиз
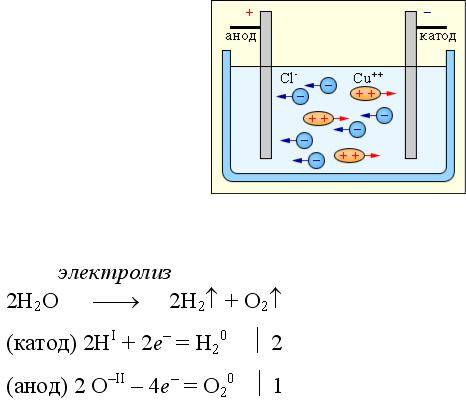
Давайте рассмотрим процесс электролиза. Установка для его прохождения является сосудом, в котором имеется раствор или расплав электролита. В него опущено два электрода. Они подключены к источнику постоянного тока. Анод в этом случае — это электрод, который подключен к положительному полюсу. Здесь происходит окисление. Отрицательно заряженный электрод — это катод. Здесь протекает реакция восстановления.
Шаг 4: Напоследок
Поэтому при оперировании данными понятиями всегда необходимо учитывать, что анод не в 100% случаев используется для обозначения отрицательного электрода. Также катод периодически может лишаться своего положительного заряда. Всё зависит от того, какой процесс на электроде протекает: восстановительный или окислительный.
Заключение
Вот таким всё и является — не очень сложно, но не скажешь, что и просто. Мы рассмотрели гальванический элемент, анод и катод с точки зрения схемы, и сейчас проблем с соединением источников питания с наработками у вас быть не должно. И напоследок нужно оставить ещё немного ценной для вас информации. Всегда приходится учитывать разницу, которую имеет анода. Дело в том, что первый всегда будет немного большим. Это из-за того, что коэффициент полезного действия не работает с показателем в 100 % и часть зарядов рассеивается. Именно из-за этого можно увидеть, что аккумуляторы имеют ограничение на количество раз заряда и разряда.
Изучение таких отраслей, как электрохимия и цветная металлургия, невозможно без понимания в полной мере терминов катод и анод. В то же время эти термины являются неотъемлемой частью вакуумных и полупроводниковых электронных приборов.
Катод и анод в электрохимии
Под электрохимией следует понимать раздел физической химии, изучающий химические процессы, вызываемые воздействием электрического тока, а также электрические явления, вызываемые химическими процессами. Существует два основных вида электрохимических операций:
В электрохимии под терминами анод и катод понимают следующее:
- Электрод, на котором проходит окислительная реакция, называется анодом;
- Электрод, на котором осуществляется процедура восстановления, называется катодом.
Под процессами окисления стоит понимать процедуру, при которой частица отдает электроны. Восстановительный процесс подразумевает процедуру принятия электронов частицей. Соответственно, частицы, которые отдают электроны, именуются «восстановителями», и они подвержены окислению. Частицы, которые принимают электроны, именуются «окислителями», они восстанавливаются.
Цветная металлургия широко использует процесс электролиза для выделения металлов из добытых руд и дальнейшей очистки. В процедуре электролиза применяются растворимые и нерастворимые аноды, а сами процессы называются электрорафинированием и электроэкстракцией, соответственно.
Катод в вакуумных приборах
Одной из разновидностей электровакуумных приборов является электронная лампа. Предназначение электроламп – регулирование потока электронов, дрейфующих в вакууме между другими электродами. Конструктивно электролампа выглядит как герметичный сосуд-баллон, с помещенными в середине мелкими металлическими выводами. Численность выводов зависит от вида радиолампы.
В составе любой радиолампы такие элементы:
- Катод;
- Анод;
- Сетка.
Катодом электролампы подразумевается разогретый электрод, подключенный к «минусу» блока питания и испускающий электроны, будучи накаленным. Эти электроны движутся к аноду, подключенному к «плюсу». Процесс испускания электронов разогретым катодом называется термоэмиссией, а возникший при этом ток именуется током термоэмиссии. Метод нагрева обуславливает разновидности катодов:
- Катод прямого разогрева;
- Катод непрямого разогрева.
Катодом непосредственного накала является прочный вольфрамовый проводник большого сопротивления. Прогревание катода проходит путем подвода к нему напряжения.
Важно! К особенностям электронных ламп непосредственного нагрева относятся быстрый запуск лампы в работу при меньшем потреблении мощности, хотя за счет срока службы. Поскольку питающий ток таких ламп является постоянным, то ограничено их применение в среде переменного тока.
Электролампы, у которых внутри катода, выполненного в виде цилиндра, размещена нагревающая нить, называются радиолампами косвенного нагрева.
Конструктивно анод выглядит в виде пластины либо коробочки, размещенной вокруг катода с сеткой и имеющей потенциал, обратный катоду. Дополнительные электроды, размещенные между анодом и катодом, называются сеткой и применяются для регулировки потока электронов.
Катод у полупроводниковых приборов
К полупроводниковым приборам относятся устройства, состоящие из вещества, удельное электрическое сопротивление которого больше сопротивления проводника, но меньше сопротивления диэлектрика. К особенностям таких приборов относится большая зависимость электропроводимости от концентрации добавок и влияния электрическим током. Свойства p-n перехода определяют принципы работы большей части полупроводниковых компонентов.
Наиболее простым представителем полупроводниковых компонентов является диод. Это элемент, имеющий два вывода и один p-n переход, отличительной особенностью которого выступает протекание тока в одном направлении.
Химические реакции, сопровождающиеся переносом электронов () делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав .
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
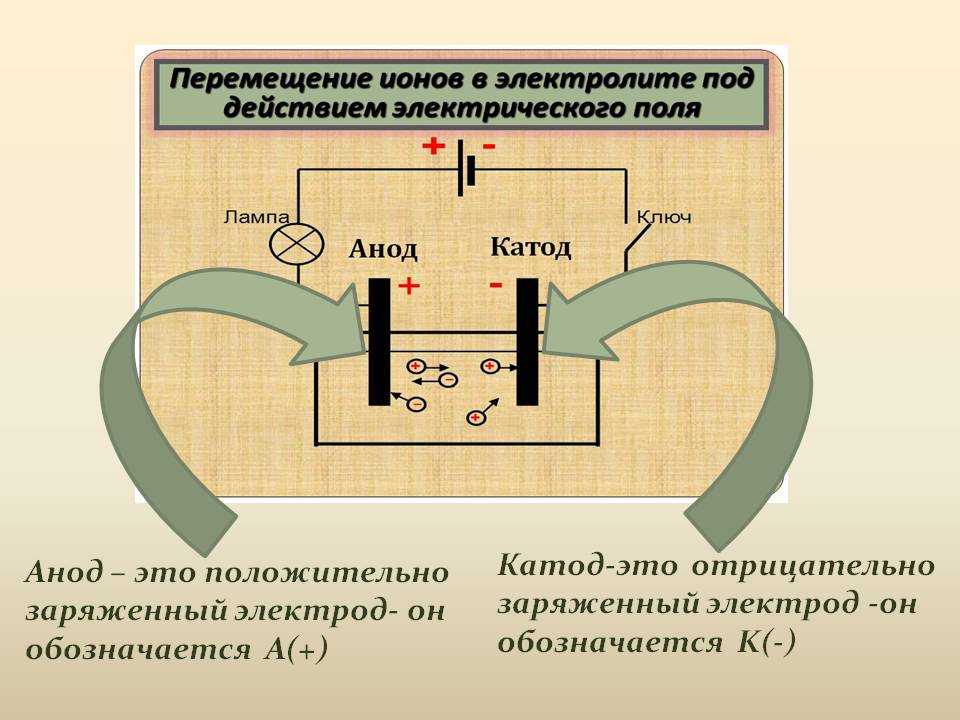
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита , и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод (анод ) притягивает отрицательно заряженные частицы (анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворовРазличают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода , которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессыВ растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей . Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н 2 О . В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный (до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H 2 O +2ē → H 2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н +) , то на катоде восстанавливается (разряжается ) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться ) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2H + 2 O +2ē → H 2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H 2 0
Анодные процессыПоложительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl 2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются . А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H 2 O -2 – 4ē → O 2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H 2 O -2 – 4ē → O 2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O 2 0 + 2H 2 O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2CH 3 C +3 OO – – 2ē → 2C +4 O 2 + CH 3 -CH 3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди . На катоде восстанавли-ваются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды :
Анод (+): 2H 2 O -2 – 4ē → O 2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом урав-нении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO 4 + 2H 2 O -2 → 2Cu 0 + 2H 2 SO 4 + O 2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород :
Катод (–):
На аноде окисляются хлорид-ионы :
Анод (+): 2Cl – – 2ē → Cl 2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хло-рида натрия :
2H + 2 O +2NaCl – → H 2 0 + 2NaOH + Cl 2 0
Следующий пример карбоната калия.
На катоде восстанавливается водород из воды :
Катод (–): 2H + 2 O +2ē → H 2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода :
Анод (+): 2H 2 O -2 – 4ē → O 2 0 + 4H +
Таким образом, при
2H 2 + O -2 → 2H 2 0 + O 2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь :
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора :
Анод (+): 2Cl – – 2ē → Cl 2 0
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
Cu 2+ Cl 2 – → Cu 0 + Cl 2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды :
Катод (–): 2H + 2 O +2ē → H 2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода :
Анод (+): 4 O -2 H – – 4ē → O 2 0 + 2H 2 O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2H 2 + O -2 → 2H 2 0 + O 2 0
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия . На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора :
Анод (+): 2Cl – – 2ē → Cl 2 0
расплава хлорида натрия :
2Na + Cl – → 2Na 0 + Cl 2 0
Еще один пример: электролиз расплава гидроксида натрия . На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы :
Анод (+): 4OH – – 4ē → O 2 0 + 2H 2 O
Сумарное уравнение электролиза расплава гидроксида натрия :
4Na + OH – → 4Na 0 + O 2 0 + 2H 2 O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na 3 плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
Al 2 O 3 = Al 3+ + AlO 3 3-
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы :
Анод (+): 4AlO 3 3 – – 12ē → 2Al 2 O 3 + 3O 2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2Al 2 О 3 = 4Al 0 + 3О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О 2 0 = C +4 O 2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Среди терминов в электрике встречаются такие понятия как анод и катод. Это касается источников питания, гальваники, химии и физики. Термин встречается также в вакуумной и полупроводниковой электронике. Им обозначают выводы или контакты устройств и каким электрическим знаком они обладают. В этой статье мы расскажем, что это такое анод и катод, а также как определить где они находятся в электролизере, диоде и у батарейки, что из них плюс, а что минус.
Электрохимия и гальваника
В электрохимии есть два основных раздела:
- Гальванические элементы – производство электричества за счет химической реакции. К таким элементам относятся батарейки и аккумуляторы. Их часто называют химическими источниками тока.
- Электролиз – воздействие на химическую реакцию электроэнергией, простыми словами – с помощью источника питания запускается какая-то реакция.
Рассмотрим окислительно-восстановительную реакцию в гальваническом элементе, тогда какие процессы протекают на его электродах?
- Анод – электрод на котором наблюдается окислительная реакция , то есть он отдаёт электроны . Электрод, на котором происходит окислительная реакция – называется восстановителем .
- Катод – электрод на котором протекает восстановительная реакция , то есть он принимает электроны . Электрод, на котором происходит восстановительная реакция – называется окислителем .
Отсюда возникает вопрос – где плюс, а где минус у батарейки? Исходя из определения, у гальванического элемента анод отдаёт электроны .
Важно! В ГОСТ 15596-82 дано официальное определение названий выводов химических источников тока, если кратко, то плюс на катоде, а минус на аноде.
В данном случае рассматривается протекание электрического тока по проводнику внешней цепи от окислителя (катода) к восстановителю (аноду) . Так как электроны в цепи текут от минуса к плюсу, а электрический ток наоборот, тогда катод – это плюс, а анод – это минус.
Внимание: ток всегда втекает в анод!
Или то же самое на схеме:
Процесс электролиза или зарядки аккумулятора
Эти процессы похожи и обратны гальваническому элементу, поскольку здесь не энергия поступает за счет химической реакции, а наоборот – химическая реакция происходит за счет внешнего источника электричества.
В этом случае плюс источника питания всё также называется катодом, а минус анодом. Зато контакты заряжаемого гальванического элемента или электроды электролизера уже будут носить противоположные названия, давайте разберемся почему!
Важно! При разряде гальванического элемента анод – минус, катод – плюс, при зарядке наоборот.
Так как ток от плюсового вывода источника питания поступает на плюсовой вывод аккумулятора – последний уже не может быть катодом. Ссылаясь на вышесказанное можно сделать вывод, что в этом случае электроды аккумулятора при зарядке условно меняются местами.
Тогда через электрод заряжаемого гальванического элемента, в который втекает электрический ток, называют анодом. Получается, что при зарядке у аккумулятора плюс становится анодом, а минус катодом.
Процессы осаждения металлов в результате химической реакции под воздействием электрического тока (при электролизе) называют гальванотехникой. Таким образом мир получил посеребренные, золоченные, хромированные или покрытые другими металлами украшения и детали. Этот процесс используют как в декоративных, так и в прикладных целях – для улучшения стойкости к коррозии различных узлов и агрегатов механизмов.
Принцип действия установок для нанесения гальванического покрытия лежит в использовании растворов солей элементов, которыми будут покрывать деталь, в качестве электролита.
В гальванике анод также является электродом, к которому подключаются плюсовой вывод источника питания, соответственно катод в этом случае – это минус. При этом металл осаждается (восстанавливается) на минусовом электроде (реакция восстановления). То есть если вы хотите сделать позолоченное кольцо своими руками – подключите к нему минусовой вывод блока питания и поместите в ёмкость с соответствующим раствором.
В электронике
Электроды или ножки полупроводниковых и вакуумных электронных приборов тоже часто называют анодом и катодом. Рассмотрим условное графическое обозначение полупроводникового диода на схеме:
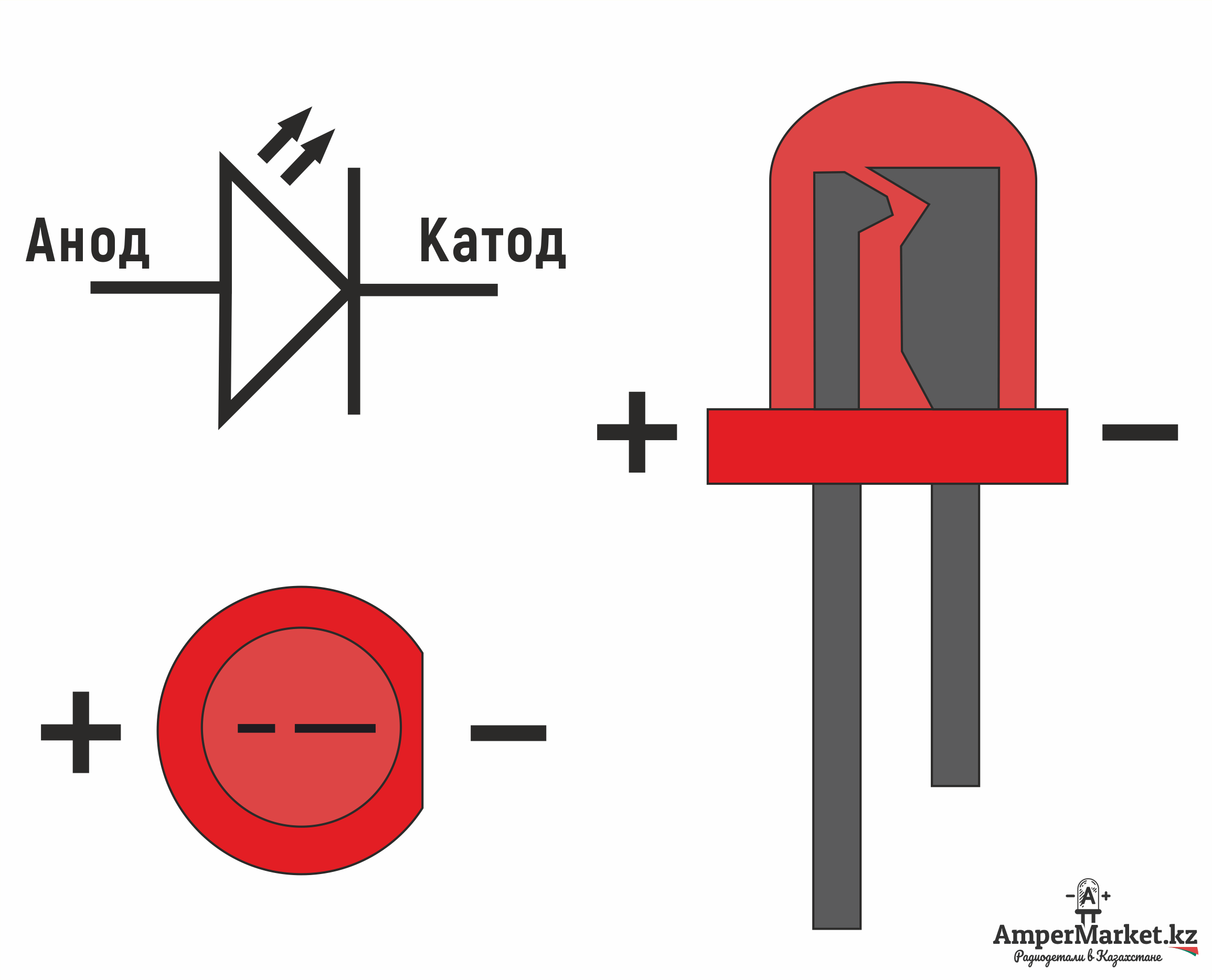
Как мы видим, анод у диода подключается к плюсу батареи. Он так называется по той же причине – в этот вывод у диода в любом случае втекает ток. На реальном элементе на катоде есть маркировка в виде полосы или точки.
У светодиода аналогично. На 5 мм светодиодах внутренности видны через колбу. Та половина, что больше — это катод.
Также обстоит ситуация и с тиристором, назначение выводов и «однополярное» применение этих трёхногих компонентов делают его управляемым диодом:
У вакуумного диода анод тоже подключается к плюсу, а катод к минусу, что изображено на схеме ниже. Хотя при приложении обратного напряжения – названия этих элементов не изменятся, несмотря на протекание электрического тока в обратном направлении, пусть и незначительного.
С пассивными элементами, такими как конденсаторы и резисторы дело обстоит иначе. У резистора не выделяют отдельно катод и анод, ток в нём может протекать в любом направлении. Вы можете дать любые названия его выводам, в зависимости от ситуации и рассматриваемой схемы. У обычных неполярных конденсаторов также. Реже такое разделение по названиям контактов наблюдается в электролитических конденсаторах.
Заключение
Итак, подведем итоги, ответив на вопрос: как запомнить где плюс, где минус у катода с анодом? Есть удобное мнемоническое правило для электролиза, заряда аккумуляторов, гальваники и полупроводниковых приборов. У этих слов с аналогичными названиями одинаковое количество букв, что проиллюстрировано ниже:
Во всех перечисленных случаях ток вытекает из катода, а втекает в анод.
Пусть вас не собьёт с толку путаница: «почему у аккумулятора катод положительный, а когда его заряжают – он становится отрицательным?». Помните у всех элементов электроники, а также электролизеров и в гальванике – в общем у всех потребителей энергии анодом называют вывод, подключаемый к плюсу. На этом отличия заканчиваются, теперь вам проще разобраться что плюс, что минус между выводами элементов и устройств.
Теперь вы знаете, что такое анод и катод, а также как запомнить их достаточно быстро. Надеемся, предоставленная информация была для вас полезной и интересной!
Материалы
Электронные схемы, как научится их читать
Электронная схема — изделие, сочетание отдельных электронных компонентов, таких как резисторы, конденсаторы, индуктивности, диоды, транзисторы и интегральные микросхемы, соединённых между собой, для выполнения каких либо задач или схема (рисунок) с условными знаками.
Для начинающих электронщиков важно понимать, как работают детали, как их рисуют на схеме и как разобраться в схеме электрической принципиальной. Для этого нужно сперва ознакомиться с принципом работы элементов, а как читать схемы электроники я расскажу в этой статье на примерах популярных устройств для начинающих.
Схема настольной лампы и фонарика на светодиоде
Схема – это рисунок на которых с помощью определенных символов изображаются детали схемы, линиями – их соединения. При этом, если линии пересекаются – то контакта между этими проводниками нет, а если в месте пересечения присутствует точка – это узел соединения нескольких проводников.
Кроме значков и линий на схеме изображены буквенные обозначения. Все обозначения стандартизированы, в каждой стране свои стандарты, например в России придерживаются стандарта ГОСТ 2.710-81.
Начнем изучение с простейшего – схемы настольной лампы.
Схемы не всегда читают слева направо и сверху вниз, лучше идти от источника питания. Что мы можем узнать из схемы, посмотрите в правую её часть. ~ — значит питание переменным током.
Рядом написано «220» — напряжением в 220 В. X1 и X2 – предполагается подключение в розетку с помощью вилки. SW1 – так изображается ключ, тумблер или кнопка в разомкнутом состоянии. L – условное изображение лампочки накаливания.
Краткие выводы:
На схеме изображено устройство, которое подключается к сети 220 В переменного тока с помощью вилки в розетку или других разъёмных соединений. Есть возможность отключения с помощью переключателя или кнопки. Нужно для питания лампы накаливания.
С первого взгляда кажется очевидным, но специалист должен уметь сделать такие выводы глядя на схему без пояснений, это умение даст возможность выносить диагноз неисправности и устранять её или же собирать устройства с нуля.
Перейдем к следующей схеме. Это фонарик с питанием от батарейки, в качестве излучателя в нём установлен светодиод.
Взгляните на схему, возможно, вы увидите новые для себя изображения. Справа изображен источник питания, так выглядит батарейка или аккумулятор, длинный вывод это плюс другое название – Катод, короткий – минус или Анод. У светодиода к аноду (треугольная часть обозначения) подключается плюс, а к катоду (на УГО выглядит как полоска) – минус.
Это нужно запомнить, что у источников питания и потребителей названия электродов наоборот. Две исходящие от светодиода стрелки дают вам понять, что этот прибор ИЗЛУЧАЕТ свет, если бы стрелки наоборот указывали на него – это был бы фотоприемник. Диоды имеют буквенное обозначение VDx, где х- порядковый номер.
Важно:
Нумерация деталей на схемах идет столбцами сверху вниз, слева направо.
Резистор – это сопротивление. Преобразует электрический ток в тепло, препятствую его движению, выглядит как прямоугольник, обычно на схемах имеет буквенное обозначение «R».
Как читать электронные схемы: увеличиваем уровень сложности
Когда вы уже разобрались с базовым набором элементов, пора ознакомится с более сложными схемами, давайте рассмотрим схему трансформаторного блока питания.
Главным средством преобразователя на схеме является трансформатор TV1, это новый для вас элемент. Предлагаю рассмотреть ряд подобных изделий.
Трансформаторы используются повсеместно, либо в сетевом (50 гц), либо в импульсном (десятки кГц) исполнении. Катушки индуктивности используются в генераторах, радиопередающих устройствах, фильтрах частот, сглаживающих и стабилизирующих приборах. Она выглядит следующим образом.
Второй незнакомый элемент на схеме – это конденсатор, здесь используется для сглаживания пульсаций выпрямленного напряжения. Вообще основная его функция – это накапливать энергию в качестве заряда на его обкладках. Изображается следующим образом.
В центре схеме изображен мостовой диодный выпрямитель.
Если к схеме добавить узел стабилизации, построенный по схеме параметрического стабилизатора, напряжение блока питания будет стабилизировано. При этом только от повышения питающего напряжения, при просадках ниже, чем Uстабилизации напряжение будет пульсирующем в такт с просадками. VD1 – это стабилитрон, они включаются в обратном смещении (катодом к точке с положительным потенциалом). Различаются по величине тока стабилизации (Iстаб) и напряжения стабилизации (Uстаб).
Краткие итоги:
Что мы можем понять из этой схемы? То, что блок питания состоит из трансформатора, выпрямителя и сглаживающего фильтра на конденсаторе. Подключается первичной стороной (входом) к сети переменного тока с напряжением 220 Вольт. На его выходе имеет два разъёмных соединения – «+» и «-» и напряжение 12 В, нестабилизорванное.
Давайте перейдем еще более сложным схемам и познакомимся с другими элементами электрических цепей.
Как читать схемы с транзисторами?
Транзисторы – это управляемые ключи, вы можете закрыть их и открыть, а если нужно открыть не полностью. Данные свойства позволяют их применять, как в ключевом, так и линейном режимах, что позволяет их использовать в огромном спектре схемных решений.
Давайте рассмотрим популярную среди новичков схему – симметричный мультивибратор. Это по сути генератор, который на своих выходах выдаёт симметричные импульсы. Может применяться, как основа для простых мигалок, в качестве источника частоты для пищалки, в качестве генератора для импульсного преобразователя и во многих других цепях.
Пройдемся по знакомым деталям сверху вниз. Вверху мы видим 4 резистора, средние два – времязадающие, а крайние – задают ток резистора, также влияют на характер выходных импульсов.
Далее HL – это светодиоды, а ниже два электролита – это полярные конденсаторы, когда будете их монтировать оставайтесь внимательны – неправильное подключение электролитического конденсатора чревато выходом его из строя вплоть до взрыва с выделением тепла.
Интересно:
На графическом обозначении электролитического конденсатора всегда помечается «положительная» обкладка конденсатора, а на настоящих элементах – чаще всего есть пометка отрицательной ножки, не перепутайте!
VT1-VT2 – это новые для вас элементы, таким образом обознаются биполярные транзисторы обратной проводимости (NPN), ниже указана модель транзистора – «КТ315». У них обычно 3 ножки:
1. База.
2. Эмиттер.
3. Коллектор.
При этом на корпусе их назначение не указывается. Чтобы определить назначение выводов, нужно воспользоваться одним из поисковых запросов:
1. «Название элемента» — цоколевка.
2. «Название элемента» — распиновка.
3. «Название элемента» datsheet.
Это справедливо, как для радиоламп, так и для современных микросхем. Запросы имеют почти одинаковый смысл. Вот таким образом я нашел цоколевку транзистора КТ315.
На изображении с распиновкой должно быть четко видно: с какой стороны считать ножки, где находится ключ, срез или метка, чтобы вы правильно определили необходимый вывод.
Интересно:
У биполярных транзисторов стрелка на эмиттере обозначается направление протекания тока (от плюса к минусу), если стрелка ОТ базы – это транзистор обратной проводимости (NPN), а если К базе то прямой проводимости (PNP), часто вы можете заменить все NPN транзисторы на PNP, как в схеме мультивибратора, тогда нужно будет и поменять полярность источника питания (плюс и минус местами) ведь, повторюсь, стрелка на эмиттере указывает направление протекания тока.
На приведенной схеме положительный контакт источника питания подключен к верхней части схемы, а отрицательный к нижней. Так и на транзисторе стрелка указывает сверх-вниз – по направлению протекания тока!
В элементах с большим количеством ног имеет значение куда подключать, так же, как и в диодах и светодиодах, если вы перепутаете ножки – в лучшем случае схема не заработает, а в худшем – убьете детали.
Что мы смогли узнать, прочитав схему мультивибратора:
В этой схеме используются транзисторы и электролитические конденсаторы, питается она напряжением в 9 В (хотя может и больше, и меньше, например 12 В не повредят схеме, как и 5 В).
Стало ясно о способе соединения деталей и включения транзисторов. А также о том, что схема представляет собой прибор, работающий на принципе автогенератора основанного на процессе перезаряда транзисторов, которое вызвано попеременным открытием и закрытием транзисторов каждого по очереди, когда первый открыт, второй закрыт.
Проследив пути протекания тока (от плюса к минусу) и использовав знания о том, как работает биполярный транзистор мы делаем выводы о характере работы.
Тиристоры – полууправляемые ключи, учимся читать схемы
Давайте рассмотрим схему с не менее важным и распространенным элементом – тиристором. Я выбрал слово «полууправляемый» потому что, в отличие от транзистора, вы можете только открыть его, ток в нем прервется либо при прерывании питания, либо при смене полярности приложенного к нему напряжения. Открывается с помощью подачи на управляющий электрод напряжения.
Симисторы – содержат два тиристора соединённых встречно-параллельно. Таким образом, одним компонентом можно коммутировать переменный ток, при прохождении верхней части (положительной) полуволны синусоиды, при условии наличия сигнала на управляющем, электроде откроется один из внутренних тиристоров. Когда полуволна сменит свой знак на отрицательный – он закроется и в работу вступит второй тиристор.
Динисторы – разновидность тиристора, без управляющего электрода, а открываются они, подобно стабилитронам, по преодолению определенного уровня напряжения. Часто используются в импульсных блоках питания, как пороговый элемент для запуска автогенераторов и в устройствах для регулировки напряжения.
Вот так, собственно это выглядит на схеме.
Внимательно смотрим на подключение. Схема предназначена для подключения к сети переменного тока, например 220 В, в разрыв одного из питающих проводов, например фазного (L). Симистор VS1 – основной силовой элемент цепи, справа внизу дана его распиновка из даташита, 3 вывод – управляющий. На него через двунаправленный динистор VD1 модели DB3 рассчитанный на напряжение включения порядка 30 вольт, подаётся управляющий сигнал.
Так как все полупроводниковые приборы в этой конкретной схеме двунаправленные, регулировка осуществляется по обеим полуволнам синусоиды. Динистор открывается, когда на конденсаторе C1 появляется необходимой величины потенциал (напряжение), а скорость его заряда, следовательно, момент открытия ключей, задаётся RC цепью, состоящей из R1, переменного резистора (потенциометра) R2 и С1.
Эта простая схем имеет огромное значение и прикладное применение.
Выводы
Благодаря умению читать схемы электрические принципиальные, вы можете определить:
1. Что делает это устройство, для чего оно предназначено.
2. При ремонте – номинал вышедшей из строя детали.
3. Чем питать это устройство, каким напряжением и родом тока.
4. Примерную мощность электронного устройства, исходя из номиналов компонентов силовых цепей.
Важно не только знать условные графические обозначения элементов, но и принцип их работы. Дело в том, то не всегда те или иные детали могут использоваться в привычной роли. Но в пределах сегодняшней статьи рассмотреть все распространенные элементы довольно сложно, так как это займет очень большой объем.
Ранее ЭлектроВести писали, что Министерство развития экономики, торговли и сельского хозяйства передало госпредприятие, мощного производителя электрогенерирующего оборудования, завод «Электротяжмаш» на приватизацию в Фонд государственного имущества Украины.
По материалам: electrik.info.
Как запомнить полярность диода в символе? (Самообеспечение ответил)
Две мнемонические техники я упомяну. Обе техники я выучил у кого-то еще много лет назад.
- Мы можем легко вспомнить, что анод сокращенно обозначен как А, а катод — как К. Это стандартно и легко запомнить.
Теперь напишите K
Теперь просто заполните пробелы, чтобы сделать его диодным.
Теперь сторона диода, на которой нарисован K , — это катод (K).
По умолчанию противоположной стороной является анод (A).
Теперь, если однажды мы научимся распознавать K , если диод будет ориентироваться в другом направлении на диаграмме, мы можем легко идентифицировать анод и катод.
————————————————— —————
- Треугольник внутри диода, делает знак стрелки . Это говорит о направлении разрешенного направления тока.
Из второго метода мы легко запоминаем направление тока.
И вл. Выбранный участок схемы (интересующий участок) (здесь диодный) катод — это электрод, из которого вырывается положительный заряд;
и анод интересующей части схемы (здесь диод) является электродом, который всасывает положительный заряд.
Таблица выше: анод-катод против плюс-минус
Это применимо не только для диодов. Это применимо для любых компонентов, таких как электрохимическая (батарея) -элемент, электролитическая ячейка, катодно-лучевая трубка ( ЭЛТ ) и т. Д.
Анод, представляющий интерес для цепи (здесь диод), должен быть присоединен с катодом цепи (здесь батарея).
И катод, представляющий интерес для схемы (здесь диод), который должен быть присоединен к аноду аналога цепи (здесь аккумулятор).
В интересующей части схемы (здесь это диод) ток течет в направлении от анода к катоду.
В аналоге этой выбранной части или внешней части пути ток течет от анода (выбранной части, здесь диода) к катоду (выбранной части, здесь диода).
Как определить плюс или минус
Известно, что светодиод в рабочем состоянии пропускает ток только в одном направлении. Если его подключить инверсионно, то постоянный ток через цепь не пройдет, и прибор не засветится. Происходит это потому, что по своей сущности прибор является диодом, просто не каждый диод способен светиться. Получается, что существует полярность светодиода, то есть он чувствует направление движения тока и работает только при определенном его направлении.
Определить полярность прибора по схеме не составит труда. Светодиод обозначают треугольником в кружке. Треугольник упирается всегда в катод (знак «−», поперечная черточка, минус), положительный анод находится с противоположной стороны.
Но как определить полярность, если вы держите в руках сам прибор? Вот перед вами маленькая лампочка с двумя выводами-проводками. К какому проводку подключать плюс источника, а к какому минус, чтобы схема заработала? Как правильно установить сопротивление где плюс?
Первый способ – визуальный. Предположим, вам необходимо определить полярность абсолютно нового светодиода с двумя выводами. Посмотрите на его ножки, то есть выводы. Один из них будет короче другого. Это и есть катод. Запомнить, что это катод можно по слову «короткий», поскольку оба слова начинаются на буквы «к». Плюс будет соответствовать тому выводу, который длиннее. Иногда, правда, на глаз определить полярность сложновато, особенно когда ножки согнуты или поменяли свои размеры в результате предыдущего монтажа.
Глядя в прозрачный корпус, можно увидеть сам кристаллик. Он расположен как будто в маленькой чашечке на подставке. Вывод этой подставки и будет катодом. Со стороны катода также можно увидеть небольшую засечку, как бы срез.
Но не всегда эти особенности заметны у светодиода, поскольку некоторые производители отходят от стандартов. К тому же есть много моделей, изготовленных по другому принципу. На сложных конструкциях сегодня производитель ставит значки «+» и «−», делают отметку катода точкой или зеленой линией, чтобы все было предельно понятно. Но если таких отметок нет по каким-то причинам, то на помощь приходит электрическое тестирование.
Применяем источник питания
Более эффективный способ определить полярность – подключить светодиод к источнику питания. Внимание! Выбирать надо источник, напряжение которого не превышает допустимое напряжение светодиода. Можно соорудить самодельный тестер, используя обычную батарейку и резистор. Это требование связано с тем, что при обратном подключении светодиод может перегореть или ухудшить свои световые характеристики.
Некоторые говорят, что подключали светодиод и так и сяк, и он от этого не портился. Но все дело в предельном значении обратного напряжения. К тому же, лампочка может сразу и не погаснуть, но срок ее работы уменьшится, и тогда ваш светодиод проработает не 30-50 тысяч часов, как указано в его характеристиках, а в несколько раз меньше.
Если мощности элемента питания для светодиода не хватает, и прибор не светится, как вы его ни подключаете, то можно соединить несколько элементов в батарею. Напоминаем, что элементы соединяются последовательно плюс к минусу, а минус к плюсу.
Существуют прибор, который называется мультиметром. Его с успехом можно использовать, чтобы узнать, куда подключать плюс, а куда минус. На это уходит ровным счетом одна минута. В мультиметре выбирают режим измерения сопротивления и прикасаются щупами к контактам светодиода. Красный провод указывает на подключение к плюсу, а черный – к минусу. Желательно, чтобы касание было кратковременным. При обратном включении прибор ничего не покажет, а при прямом включении (плюс к плюсу, а минус к минусу) прибор покажет значение в районе 1,7 кОм.
Можно также включать мультиметр на режим проверки диода. В этом случае при прямом включении светодиодная лампочка будет светиться.
Данный способ самый эффективный для лампочек, излучающих красный и зеленый свет. Светодиод, дающий синий или белый свет рассчитан на напряжение, большее 3 вольт, поэтому не всегда при подключении к мультиметру он будет светиться даже при правильной полярности. Из этой ситуации можно легко выйти, если использовать режим определения характеристик транзисторов. На современных моделях, таких как DT830 или 831, он присутствует.
Диод вставляют в пазы специальной колодки для транзисторов, которая обычно расположена в нижней части прибора. Используется часть PNP (как для транзисторов соответствующей структуры). Одну ножку светодиода засовывают в разъем С, который соответствует коллектору, вторую ножку – в разъем Е, соответствующий эмиттеру. Лампочка засветится, если катод (минус), будет подключен к коллектору. Таким образом, полярность определена.
Точное знание полярности электроприбора крайне важно. Ведь если подключить электрическую аппаратуру с нарушением полярности, она может либо не работать, либо полностью выйти из строя. В большинстве случаев «плюс» и «минус» проводов и контактов в подобных устройствах обозначаются буквенным, символьным или цветовым способом (на корпусе возле контактов есть маркер «+» и «-», а провода имеют черный цвет для минуса и красный для плюса).
Но иногда случается, что визуально определить полюса нет возможности. Для этого можно воспользоваться как обыкновенным тестером полярности, так и подручными средствами.
Определение полярности мультиметром
Иногда случается, что в новом электрическом аппарате, который необходимо подключить, отсутствует маркировка полярности или необходимо перепаять проводку поврежденного устройства, а все провода одного цвета. В такой ситуации важно правильно определить полюса проводов или контактов.
Но при наличии необходимых приборов возникает закономерный вопрос: как мультиметром определить плюс и минус электроприбора?
Для определения полярности мультиметр необходимо включить в режим замера постоянного напряжения до 20 В. Провод черного щупа подключается в гнездо с маркировкой СОМ (он соответствует отрицательному полюсу), а красный подключается в гнездо с маркером VΩmA (он, соответственно, является плюсом).
После этого щупы подсоединяются к проводам или контактам и прибор, полярность которого необходимо узнать, включается.
Если на дисплее мультиметра отображается значение без дополнительных знаков, то полюса определены правильно, контакт к которому подключен красный щуп – это плюс, а к которому подключен черный щуп будет соответствовать минусу.
В том случае если мультиметр показал значение напряжения со знаком минус – это будет означать, что щупы подключены к устройству неверно и красный щуп будет минусом, а черный – плюсом.
Если мультиметр, которым производится замер, аналоговый (со стрелкой и табло с градациями значений), при правильном подключении полюсов стрелка покажет действительное значение напряжения, а сели полюса перепутаны то стрелка будет отклоняться в противоположную сторону относительно нуля, то есть показывает отрицательное значение напряжения тока.
Определение полярности альтернативными методами
Если случилось так, что мультиметра под рукой нет, а полярность необходимо найти, можно использовать альтернативные и «народные» средства.
К примеру, заряды проводки динамиков проверяются при помощи батарейки на 3 вольта. Для этого необходимо на короткий промежуток времени прикоснуться проводами, присоединенными к батарейке, к выводам динамика.
Если диффузор в динамике начинает двигаться наружу, это будет значить, что положительная клемма динамика присоединена к плюсу батарейки, а отрицательная к минусу. Если же диффузор движется внутрь – полярность перепутана: положительная клемма замкнута на минусе, а отрицательная на плюсе.
Если необходимо подключить блок питания постоянного напряжения или аккумулятор, но на них нет маркировки полярности, а под рукой нет мультиметра, плюс и минус можно определить «народными» методами при помощи подручных материалов.
Самый простой способ определения полярности, которым можно воспользоваться дома – это использовать картофель. Для этого необходимо взять один клубень сырого картофеля и разрезать пополам. После этого два провода (желательно разного цвета или с любым другим отличительным знаком) оголенными концами втыкаются в срез картофеля на расстоянии 1-2 сантиметра друг от друга.
Другие концы проводов подключаются к проверяемому источнику постоянно тока, и прибор включается в сеть (если это аккумулятор, то после подсоединения проводов больше ничего делать не нужно) на 15-20 минут. По истечении этого времени на срезе картофеля, вокруг одного из проводов образуется светло-зеленое пятно, которое будет признаком плюсового заряда провода.
Второй способ также не требует, каких либо, особых устройств или инструментов. Для определения полярности проводов источника постоянного тока понадобится емкость с теплой водой, в которую опускаются два подключенных к источнику питания провода.
После включения прибора в сеть вокруг одного из проводов начнут появляться пузыри газа (водород) – это процесс электролиза воды. Эти пузырьки образуются вокруг источника отрицательного заряда.
Следующий способ подойдет в том случае, если есть не используемый, рабочий компьютерный кулер. Способ определения полярности данным методом заключается в том, что кулер необходимо запитать от проверяемого источника бесперебойного питания. Но зачастую в кулерах присутствует три провода:
- черный, отвечает за отрицательный заряд;
- красный, отвечает за положительный заряд;
- желтый, является датчиком оборотов.
В данном случае желтый провод игнорируется и никуда не подключается. Если после подключения кулера к источнику постоянного напряжения, кулер начал работать, то полярность определена правильно, плюс подключен к красному проводу, а минус – к черному. А если кулер не срабатывает – это будет означать что полярность неправильная.
Также, если мультиметр отсутствует, положительный и отрицательный контакты аккумулятора можно определить при помощи индикаторной отвертки.
Для этого необходимо дотронутся индикатором до одного из выводов аккумулятора, прижать палец к обратной стороне индикатора (к контакту на рукоятке), а ко второму выводу аккумулятора дотронуться рукой.
Если индикатор начал светиться, то заряд проверенного вывода, с которым он контактирует, имеет положительное значение, а если индикатор не засветился – вывод отрицательный. Но у этого способа определения полярности есть один недостаток.
Если аккумулятор разрядился или поврежден (пробит), индикатор будет загораться при контакте с обеими клеммами, из-за чего определить значения полюсов аккумуляторной батареи будет невозможно.
Как определить полярность неизвестного вам источника питания? Давайте предположим, что вам в руки попался какой-то блок питания постоянного напряжения, батарейка или аккумулятор. Но… на нем не обозначено, где плюс, а где минус. Да, дело быстро решается мультиметром, но что делать, если у вас его нет под рукой? Спокойно. Есть три проверенных рабочих способа.
С помощью воды
Думаю, это самый простой способ определения полярности. Первым делом наливаем водичку в какую-нибудь емкость. Желательно не металлическую. От источника питания с неизвестными клеммами отводим два провода, отпускаем их в нашу водичку и смотрим внимательно на контакты. На минусовом выводе начнут выделяться пузырьки водорода. Начинается электролиз воды.
С помощью сырого картофеля
Берем сырую картофелину и разрезаем ее пополам.
Втыкаем в нее два наших провода от неизвестного источника постоянного тока и ждем 5-10 мин.
Около плюсового вывода на картошке образуется светло-зеленый цвет.
С помощью вентилятора от ПК
Берем вентилятор от компьютера. Он имеет два вывода, а иногда даже три. Третий может быть желтый провод – датчик оборотов. Но его мы все равно использовать не будем. Нас волнуют только два провода – это красный и черный. Если на красном проводе будет плюс, а на черном – минус, то вентилятор у нас будет вращаться
Если же не угадали, то лопасти будут стоять на месте.
Вентилятор используем, если известно, что напряжение источника питания от 3 и до 20 Вольт. Подавать на вентилятор напряжение более 20 Вольт чревато для него летальным исходом.
Заключение
В заключении хотелось бы сказать, что с переменным током эти фишки не прокатывают. А как вы знаете, переменный однофазный ток состоит из двух проводов – фазы и ноля, кто не помнит, как их можно определить, прошу заглянуть вот сюда. Хочется также пожелать вам, чтобы вы никогда не путали полюсовку, потому что “защиты от дурака” (защиты от переполюсовки) ставят не во всех электронных приборах.
Катод и Анод : Помогите решить / разобраться (Ф)
Э не-е-е-е, ГОСТами пользоваться надо когда они не противоречат учебникам и словарям — вот честно, доверия физической энциклопедии в разы больше чем левому ГОСТу, который к тому же утратил силу в РФ, правда в действующем ГОСТ Р МЭК 60050-482-2011 ничего и не поменялось.Ну а БСЭ тоже не верите?
Большая советская энциклопедия. — М.: Советская энциклопедия 1969—1978 писал(а):
Анод (от греч. ánodos — подъём, восхождение, от aná — вверх и hodós — путь, движение)
1) положительный электрод источника электрического тока, например положительного полюс гальванического элемента или электрического аккумулятора (см. Химические источники тока).
2) Электрод электронного прибора (См. Электронные приборы) (ионного прибора (См. Ионные приборы)), соединяемый с положительным полюсом источника электрического тока.
3) Положительный полюс электролитной ванны (см. Электролиз).
4) Положительный электрод электрический дуги (см. Дуговой разряд).
Материалом А. в зависимости от назначения служат металлы (тантал, молибден, никель, медь, железо, вольфрам и др.) и графит.
Энциклопедия «Техника». — М.: Росмэн 2006 писал(а):
ано́д
положительный электрод источника электрического тока, напр. положительный полюс гальванического элемента или электрического аккумулятора; электрод электронного прибора (ионного прибора), соединяемый с положительным полюсом источника электрического тока; положительный полюс электролитической ванны; положительный электрод электрической дуги. В электролитической ванне и электронных приборах анод соединяется с положительным полюсом источника электрического тока.
Предлагаю для источников тока (батареи, аккумуляторы в режиме разряда, блоки питания) не заморачиваться с терминами анод/катод, а пользоваться обозначениями плюс и минус. Раз уж такой разброд и шатание.
— 16.03.2017, 00:28 —
Также где катод и анод у светодиода и какие знаки имеют?
У светодиода на анод надо подавать плюс внешнего напряжения, на катод — минус внешнего напряжения. Тут никаких разногласий нет. Знаков они не имеют.Разработан стабильный катод без кобальта для литий-ионной батареи
Георгий ГоловановКобальт играет важную роль в производительности современных литиевых батарей, хотя добыча этого элемента сопряжена с опасностью для здоровья и зачастую губительно сказывается на окружающей среде. Специалисты из Министерства энергетики США разработали альтернативную архитектуру катода на основе никеля, которая сохраняет высокую стабильность после 200 циклов.
4512
Наряду с никелем и алюминием кобальт используется для производства катодов в современных литиевых батареях, но этот материал настолько редкий, что увеличивает себестоимость аккумулятора примерно вполовину. Эти соображения, а также защита природы и прав человека в странах, добывающих кобальт, толкают ученых к разработке альтернативных видов батарей.
Команда специалистов из Ок-Риджской национальной лаборатории создала новый класс никель-железо-алюминиевых катодов, пишет New Atlas. Для их разработки они использовали производные никелата лития, которые ученые считают подходящей заменой кобальтовым катодам, но до сих пор не подобрали правильного рецепта, поскольку этот материал обладает структурной и электрохимической нестабильностью.
«В своем исследовании мы заменили часть никеля на железо и алюминий, чтобы повысить стабильность катода, — пояснил Ильяс Беларуак, руководитель научной группы. — Железо и алюминий дешевые, доступные и экологичные материалы».
Испытания нового катода показали его высокую емкость и способность сохранять 88% емкости после 100 циклов. Также ученые изготовили батарею с катодом NFA и обнаружили, что несмотря на некоторое снижение стабильность ее емкость все еще остается на уровне 72% после 200 циклов.
Хотя исследователи называют эти результаты предварительными, они убеждены, что предложенная ими конструкция хорошо подходит для создания батарей без дорогого и редкого сырья. Кроме того, ее можно легко интегрировать в существующие процессы серийного производства катодов.
О прорыве в создании бескобальтовых батарей сообщили летом ученые США. Они создали катоды нового класса, которые на 89% состоят из никеля, а остальное — это алюминий и марганец.
Facebook45Вконтакте12WhatsAppTelegram
физическая химия — положительный или отрицательный анод / катод в электролитической / гальванической ячейке
Анод — это электрод, в котором протекает реакция окисления
\ begin {align} \ ce {Красный -> Ox + e-} \ end {align}
происходит, в то время как катод является электродом, где протекает реакция восстановления
\ begin {align} \ ce {Ox + e- -> Красный} \ end {align}
имеет место. Так определяются катод и анод.
Гальванический элемент
Теперь в гальваническом элементе реакция протекает без помощи внешнего потенциала.Поскольку на аноде происходит реакция окисления, в результате которой образуются электроны, в ходе реакции накапливается отрицательный заряд, пока не будет достигнуто электрохимическое равновесие. Таким образом, анод отрицательный.
На катоде, с другой стороны, происходит реакция восстановления, которая потребляет электроны (оставляя положительные (металлические) ионы на электроде) и, таким образом, приводит к накоплению положительного заряда в ходе реакции до электрохимического равновесия. достигается.Таким образом, катод положительный.
Ячейка электролитическая
В электролитической ячейке вы прикладываете внешний потенциал, чтобы заставить реакцию идти в противоположном направлении. Теперь рассуждение обратное. На отрицательном электроде, где вы создали высокий электронный потенциал через внешний источник напряжения, электроны «выталкиваются» из электрода, тем самым уменьшая окисленные частицы $ \ ce {Ox} $, потому что уровень энергии электронов внутри электрода (Ферми Level) выше, чем уровень энергии НСМО $ \ ce {Ox} $, и электроны могут снизить свою энергию, занимая эту орбиталь — у вас, так сказать, очень реактивные электроны.Таким образом, отрицательный электрод будет тем, где будет происходить реакция восстановления, и, следовательно, это будет катод.
На положительном электроде, где вы создали низкий потенциал электронов через внешний источник напряжения, электроны «засасываются» в электрод, оставляя после себя восстановленные частицы $ \ ce {Red} $, потому что уровень энергии электронов внутри электрода (уровень Ферми ) ниже уровня энергии ВЗМО $ \ ce {Red} $. Таким образом, положительный электрод будет тем, где будет происходить реакция окисления, и, следовательно, это будет анод.
Сказка об электронах и водопадах
Поскольку существует некоторая путаница в отношении принципов, на которых работает электролиз, я попробую использовать метафору, чтобы объяснить это. Электроны текут из области с высоким потенциалом в область с низким потенциалом, подобно тому, как вода падает с водопада или стекает по наклонной плоскости. Причина та же: таким образом вода и электроны могут понижать свою энергию. Теперь внешний источник напряжения действует как две большие реки, соединенные с водопадами: одна на большой высоте, которая ведет к водопаду — это будет минусовой полюс — и одна на низкой высоте, которая ведет от водопада — это будет плюс. столб.Электроды будут похожи на точки реки незадолго до или после водопадов на этой картинке: катод похож на край водопада, где вода падает, а анод похож на точку, в которую падает вода.
Хорошо, что происходит при реакции электролиза? На катоде у вас высотная ситуация. Так электроны устремляются к «краю своего водопада». Они хотят «упасть», потому что за ними река подталкивается к краю, оказывая какое-то «давление».Но куда они могут упасть? Другой электрод отделен от них раствором и обычно диафрагмой. Но есть молекулы $ \ ce {Ox} $, которые имеют пустые состояния, расположенные энергетически ниже состояния электрода. Эти пустые состояния похожи на небольшие пруды, лежащие на более низкой высоте, куда может упасть немного воды из реки. Таким образом, каждый раз, когда такая молекула $ \ ce {Ox} $ приближается к электроду, электрон использует возможность прыгнуть на нее и уменьшить ее до $ \ ce {Red} $. Но это не означает, что в электроде внезапно отсутствует электрон, потому что река немедленно заменяет «вытолкнутый» электрон.А источник напряжения (источник реки) не может исчерпать электроны, потому что он получает электроны из розетки.
Теперь анод: у анода у вас ситуация на малой высоте. Так что здесь река ниже всего. Теперь вы можете представить себе ВЗМО-состояния молекул $ \ ce {Red} $ в виде небольших барьерных озер, лежащих на большей высоте, чем наша река. Когда молекула $ \ ce {Red} $ приближается к электроду, это как будто кто-то открывает шлюзы плотины барьерного озера.Электроны перетекают из ВЗМО в электрод, образуя молекулу $ \ ce {Ox} $. Но электроны не остаются в электроде, так сказать, они уносятся рекой. А поскольку река такая огромная (много воды) и обычно впадает в океан, то небольшое количество «воды», которое добавляется к ней, не сильно меняет реку. Он остается неизменным, так что каждый раз, когда открывается наводнение, вода из барьерного озера будет падать на одно и то же расстояние.
Как определить анод и катод
Вот посмотрите на разницу между анодом и катодом элемента или батареи и как вы можете запомнить, что есть что.
Держать их прямыми
Помните, что cat hode притягивает ионы cat или ca t hode притягивает заряд + . Ода n притягивает исходный заряд n .
Поток тока
Анод и катод определяются течением тока. В общем смысле ток относится к любому движению электрического заряда. Тем не менее, вы должны иметь в виду соглашение о том, что направление тока соответствует тому, куда будет двигаться положительный заряд , а не отрицательный заряд.Итак, если электроны действительно совершают , перемещая в ячейке, тогда ток течет в противоположном направлении. Почему это так определяется? Кто знает, но это стандарт. Ток течет в том же направлении, что и носители положительного заряда, например, когда положительные ионы или протоны несут заряд. Ток течет в противоположном направлении от отрицательных носителей заряда, таких как электроны в металлах.
Катод
- Катод — отрицательно заряженный электрод.
- Катод притягивает катионы или положительный заряд.
- Катод является источником электронов или донором электронов. Он может принимать положительный заряд.
- Поскольку катод может генерировать электроны, которые обычно представляют собой электрические компоненты, совершающие фактическое движение, можно сказать, что катоды генерируют заряд или что ток движется от катода к аноду. Это может сбивать с толку, потому что направление тока будет определяться тем, как будет двигаться положительный заряд. Просто помните, любое движение заряженных частиц — это ток.
Анод
- Анод — это положительно заряженный электрод.
- Анод притягивает электроны или анионы.
- Анод может быть источником положительного заряда или акцептором электронов.
Катод и анод
Помните, что заряд может течь как от положительного к отрицательному, так и от отрицательного к положительному! Из-за этого анод может быть заряжен положительно или отрицательно, в зависимости от ситуации. То же самое и с катодом.
Источники
- Durst, R .; Baumner, A .; Murray, R .; Buck, R .; Андрие, К. (1997) «Химически модифицированные электроды: Рекомендуемая терминология и определения». ИЮПАК. pp 1317–1323.
- Росс, С. (1961). «Фарадей консультирует ученых: происхождение терминов электрохимии». Примечания и записи Лондонского королевского общества n. 16: 187–220. DOI: 10.1098 / RSNR.1961.0038
Анод, катод, положительный и отрицательный: основы батареи
Обновлено: 12 февраля 2020 г.Значительные разработки были сделаны в области аккумуляторных батарей (иногда называемых вторичными элементами), и большая часть этой работы может быть отнесена к разработке электромобилей.Эта работа привела к присуждению Нобелевской премии по химии 2019 года за разработку литий-ионных аккумуляторов. Следовательно, термины «анод», «катод», «положительный» и «отрицательный» стали все более заметными.
В статьях о новых электродах батареи часто используются названия анод и катод без указания того, разряжается батарея или заряжается. Термины анод, катод, положительный и отрицательный не являются синонимами, иногда их можно путать, что может привести к ошибкам.
Целью данной статьи является прояснение и четкое определение этих различных терминов.- \ to LiCoO_2}
$
— реакция восстановления. Уменьшение — это выигрыш электронов.
Анод, катод
- Анод — это электрод, на котором протекает реакция окисления. Потенциал анода, через который протекает ток, превышает его равновесный потенциал: $ E_ \ text a (I)> E_ {I = 0} $ (рис. 1).
- Катод — это электрод, на котором протекает реакция восстановления. Потенциал катода, по которому протекает ток, ниже его равновесного потенциала: $ E_ \ text c (I)
Рисунок 1: $ (E_ {I \ neq 0} -E_ {I = 0}) \; I> 0 $
Положительный и отрицательный электроды
Два электрода батареи или аккумулятора имеют разные потенциалы. Электрод с более высоким потенциалом называется положительным, электрод с более низким потенциалом называется отрицательным. Электродвижущая сила, ЭДС в В, батареи — это разность потенциалов положительного и отрицательного электродов, когда батарея не работает.- $ → отрицательный электрод является анодом.
Рисунок 2: Разрядка и заряд батареи: слева, изменение потенциала положительного и отрицательного электродов; справа, изменение напряжения АКБ
Зарядная батарея
Во время заряда напряжение элемента U, , разница между положительным и отрицательным, увеличивается (рис. + $ → положительный электрод является анодом.- $ → отрицательный электрод является катодом.
Рисунок 3: Разряд / заряд вторичной батареи, представленной в виде электрохимической ячейки, с электронами и направлением тока.
Заключение
При нормальном использовании аккумуляторной батареи потенциал положительного электрода как при разряде, так и при перезарядке остается больше, чем потенциал отрицательного электрода. С другой стороны, роль каждого электрода переключается во время цикла разряд / заряд.
- Во время разряда положительный полюс является катодом, отрицательный — анодом.
- Во время заряда положительный полюс является анодом, отрицательный — катодом.
Тексты, описывающие аноды или катоды батарей, безусловно, косвенно рассматривают случай разряда. Давайте, не колеблясь, напишем, перефразируя Резерфорда, неявное — не что иное, как плохое явное.
аккумулятор анод катод положительный отрицательный электрод
Катодные и анодные реакции полуэлементов — научный класс [Видео 2021]
Узнайте, как записать электродные полуреакции для катодов и анодов.Узнайте, как рассчитать потенциал напряжения ячейки, имея таблицу стандартных электродных потенциалов. Узнайте, как предотвратить коррозию, используя концепции окислительно-восстановительного потенциала, и как защитить металл с помощью катодной защиты.
Electrode Half-Reactions
Батарейки — полезные штуки. Будь то пульт от телевизора или фонарик, при отключении питания от них воняет. В этом уроке вы узнаете, как работают батареи и почему они умирают.
Ранее вы узнали, что электрохимическая ячейка состоит из двух полуэлементов: анода и катода.Анод — это электрод, на котором происходит окисление и потеря электронов. Катод — это место, где происходит восстановление и приобретаются электроны. Эти реакции не происходят по отдельности; они должны работать вместе в реакции окисления и восстановления.
В следующем разделе предположим, что электроды сделаны из цинка и меди. Есть и другие металлы, которые могут выступать в качестве электродов, но давайте будем простыми и будем придерживаться этих двух.Половина реакции на аноде, где происходит окисление, равна Zn (s) = Zn2 + (aq) + (2e-). Цинк теряет два электрона с образованием Zn2 +. Половина реакции на катоде, где происходит восстановление, равна Cu2 + (водн.) + 2e- = Cu (s). Здесь ионы меди приобретают электроны и становятся твердой медью.
Всю реакцию можно записать, объединив обе полуреакции: Zn (s) + Cu2 + (aq) = Zn2 + (aq) + Cu (s). Это уравнение для электрохимической ячейки также может быть представлено как: анодный электрод — анодный раствор — катодный раствор — катодный электрод, что в таком случае будет выглядеть так: Zn (s) — Zn2 + (aq) — Cu2 + (aq) — Cu (s).
Итак, хотя обе реакции происходят одновременно, они разделены барьером. Итак, единственное место для движения электронов — это провод, соединяющий анод и катод. Так вы улавливаете производимое электричество.
Другой тип электрохимических элементов — это углеродно-цинковые сухие элементы. Это ваши батарейки размера C и D. Эти батареи имеют цинковый контейнер, который представляет собой анод, заполненный пастой из MnO2, графита и Nh5 Cl. У них есть углеродный стержень, идущий по середине, который является катодом.Когда цепь замкнута, например, когда она в фонарике и фонарик включен, полуреакция на аноде будет: Zn (s) = Zn2 + (aq) + 2e-. Половина реакции восстановления на катоде равна: 2MnO2 (s) + h3 O (l) + 2e- = Mn2 O3 (s) + 2OH- (водн.).
Расчет потенциала напряжения элемента
Электрохимические элементы, о которых вы узнали, являются гальваническими элементами.Гальванический элемент — это элемент, в котором спонтанная окислительно-восстановительная реакция производит электричество. В гальванической ячейке, как вы знаете, реакция окисления на аноде заставляет электроны проходить через провод, соединяющий катод с анодом. Он называется электрическим потенциалом и измеряется в вольтах (В). Более конкретно, , потенциал электрода — это разность потенциалов между электродом и его раствором или величина притяжения электронов. Это количество энергии, необходимое для перемещения электрического заряда по ячейке.
Каждая из двух полуэлементов батареи имеет потенциал — потенциал либо отдавать электроны, либо принимать электроны. Разница между ними — это электродный потенциал всей ячейки или напряжение. К счастью, потенциал электрода — это не то, что вам нужно запоминать. Ученые определили стандартные электродные потенциалы для многих различных типов электродов.
Чтобы определить напряжение любой ячейки, посмотрите таблицу электродных потенциалов. Вычтите электродный потенциал анода из потенциала катода, и вы получите электродный потенциал ячейки или напряжение: ячейка Eo = катод Eo — анод Eo.
Это число легко вычислить. Например, рассчитайте напряжение ячейки для реакции жидкого ртутного электрода в растворе нитрата ртути (I) и металлического кадмиевого электрода в растворе нитрата кадмия. Если Eo вам не предоставлено, вы можете обратиться к диаграмме для определения значения.
| Электрод | Реакция электродов | Eo Вольт |
|---|---|---|
| Cd2 + | Кд2 + |
Формула полуреакций:
- Hg22 + + 2e- = 2Hg (l), что имеет Eo = 0.850 В
- Cd2 + (aq) + 2e- = Cd (s), который имеет Eo = -0,403V
- Ячейка Eo = катод Eo — анод Eo
Ячейка Eo = 0,850 В — (-0,403 В). Помните, что два негатива дают положительный результат. Ячейка Eo = 1,253 В.
Попробуйте другой.
- Zn2 + (водн.) + 2e- = Zn (s), который имеет Eo = -0,762V
- 2h3 O (l) + 2e- = h3 (g) + 2OH- (водн.), Который имеет Eo = -0,828V
Ячейка Eo = (-0,762 В) — (-0,828 В). Итак, ячейка Eo = 0,066 В.
Коррозия
Как вы знаете, трубопровод Аляски представляет собой длинную стальную трубу, по которой нефть доставляется с Аляски в 48 нижних штатов.Что бы произошло, если бы он заржавел? Не разольется ли нефть в окружающей среде? Как защитить металл от коррозии?
Коррозия — это постепенное разрушение металла в результате химических реакций. Поскольку это химическая реакция, мы можем предотвратить ее с помощью химических реакций, а именно окислительно-восстановительных реакций. Одним из металлов, наиболее подверженных коррозии, является железо. Когда железо подвергается коррозии, ржавчина образуется в реакции 4Fe (s) + 3O2 (g) + h3 = 2Fe2O3h3O (s).
Количество образующейся ржавчины зависит от количества воды, с которой железо может реагировать.Две электрохимические полуреакции:
- Fe (s) = Fe2 + (водн.) + 2e-. Это анод.
- O2 (г) + 2h3 O (l) + 4e- = 4OH- (водн.). Это катод.
Анод и катод находятся на одном железе, но в разных его частях. Вы знаете, что для того, чтобы эта реакция сработала, электронам нужен какой-то провод или какой-то способ проведения электронного потока. В этом случае проволокой выступает сам утюг.
Итак, когда кусок железа подвергается воздействию кислорода и воды, участок на железе окисляется и теряет электроны.Эти электроны проходят через железо к другому участку, где они восстанавливаются. Здесь они образуют твердое вещество, называемое гидратированным оксидом железа, 2Fe2sub) 3sub) 2. Слой воды на поверхности железа действует как барьер или солевой мостик, необходимый для работы электрохимической ячейки или реакции.
Чтобы предотвратить коррозию, используйте другой металл, который окисляется легче, чем металл, который вы хотите защитить.Цинк окисляется легче, чем железо, поэтому, если вы покроете железо цинком, цинк будет коррозировать раньше, чем железо. Это защищает утюг. Это называется катодной защитой, потому что вы добавляете к металлу защитный катод. Гвозди являются примером. Железные гвозди часто покрывают цинком в процессе, называемом гальванизацией, чтобы защитить их от ржавчины.
Трубопровод на Аляске — еще один прекрасный пример такого типа защиты. Вместо того, чтобы покрывать все цинком, трубопровод подключается к цинковой проволоке.Цинк будет корродировать раньше, чем сталь, и если корродированный цинк будет периодически заменяться, сама труба не подвергнется коррозии. Это отличная вещь.
Краткое содержание урока
Электрохимические реакции в ячейке состоят из двух полуреакций: на анодном электроде и на катодном электроде. Две полуреакции можно сложить вместе, чтобы получить полноценную клеточную реакцию. Потенциал электродной ячейки измеряется в вольтах. Достаточно легко определить напряжение любой электрохимической ячейки, если у вас есть таблица, в которой указано напряжение для каждого типа электрода.Чтобы определить напряжение любой ячейки, вычтите потенциал электрода анода из потенциала катода, и вы получите электродный потенциал ячейки или напряжение. Ячейка Eo = катод Eo — анод Eo .
Коррозия — это постепенное разрушение металла в результате химических реакций, и это реальная проблема в нашей повседневной жизни. Поскольку коррозия — это химическая реакция, мы можем предотвратить ее с помощью химических реакций, а именно окислительно-восстановительных реакций. Чтобы предотвратить коррозию, используйте другой металл, который окисляется легче, чем металл, который вы хотите защитить.Как и в большинстве случаев в жизни, химические реакции протекают по пути наименьшего сопротивления и наименьшей энергии, поэтому металл, который легче окисляется, подвергнется коррозии, а другой металл будет защищен.
Результаты обучения
По окончании этого урока вы сможете:
- Описывать две половинные ячейки в электрохимической ячейке
- Объясните, как можно сложить две полуреакции, чтобы получить полноценную клеточную реакцию.
- Обобщите, как определить напряжение ячейки
- Дайте определение коррозии и объясните, как ее предотвратить
российских химиков разработали полимерные катоды для сверхбыстрых аккумуляторов
Ученые ищут альтернативы литиевой технологии перед лицом растущего спроса на литий-ионные батареи и ограниченных запасов лития.Российские исследователи из Сколтеха, Университета Д. Менделеева и Института проблем химической физики РАН синтезировали и испытали новые катодные материалы на полимерной основе для литиевых двухионных аккумуляторов. Испытания показали, что новые катоды выдерживают до 25 000 рабочих циклов и заряжаются за считанные секунды, превосходя литий-ионные аккумуляторы. Катоды также можно использовать для производства менее дорогих двухионно-калиевых батарей. Исследование было опубликовано в журнале Energy Technology .
Количество потребляемой электроэнергии во всем мире растет с каждым годом, как и спрос на решения для хранения энергии, поскольку многие устройства часто работают в автономном режиме. Литий-ионные батареи могут генерировать огромную мощность, демонстрируя при этом довольно высокую скорость разряда и заряда, а также накопительную емкость на единицу массы, что делает их популярным устройством хранения в электронике, электротранспорте и глобальных электрических сетях. Например, Австралия запускает серию крупномасштабных проектов по хранению литий-ионных аккумуляторов для управления избыточной солнечной и ветровой энергией.
Если литий-ионные батареи будут продолжать производиться в больших количествах, мир рано или поздно может исчерпать запасы лития. Поскольку Конго производит 60% кобальта для катодов литий-ионных батарей, цены на кобальт могут резко возрасти. То же самое и с литием, поскольку потребление воды при добыче лития представляет собой серьезную проблему для окружающей среды. Поэтому исследователи ищут новые устройства хранения энергии, основанные на более доступных материалах и использующие тот же принцип работы, что и литий-ионные батареи.
Команда использовала многообещающую постлитиевую двухионную технологию, основанную на электрохимических процессах с участием анионов и катионов электролита, для многократного увеличения скорости зарядки литий-ионных аккумуляторов. Еще один плюс в том, что прототипы катодов были изготовлены из полимерных ароматических аминов, синтезированных из различных органических соединений.
«Наше предыдущее исследование касалось полимерных катодов для сверхбыстрых аккумуляторов большой емкости, которые можно заряжать и разряжать за несколько секунд, но мы хотели большего», — говорит Филипп А.Обрезков, к.э.н. Сколтеха. студент и первый автор статьи. «Мы использовали различные альтернативы, в том числе линейные полимеры, в которых каждое мономерное звено связывается только с двумя соседями. В этом исследовании мы продолжили изучение новых разветвленных полимеров, где каждое звено связывается по крайней мере с тремя другими звеньями. Вместе они образуют большие сетчатые структуры. которые обеспечивают более быструю кинетику электродных процессов. Электроды из этих материалов демонстрируют еще более высокую скорость заряда и разряда ».
Стандартный литий-ионный элемент заполнен литийсодержащим электролитом и разделен на анод и катод сепаратором.В заряженной батарее большинство атомов лития включены в кристаллическую структуру анода. Когда батарея разряжается, атомы лития перемещаются от анода к катоду через сепаратор. Российская группа исследовала двухионный аккумулятор, в котором в электрохимических процессах участвовали катионы электролита (то есть катионы лития) и анионы, которые входят и выходят из структур материала анода и катода соответственно.
Еще одна новинка заключается в том, что в некоторых экспериментах ученые использовали калиевые электролиты вместо дорогостоящих литиевых для получения двухионных калиевых батарей.
Команда синтезировала два новых сополимера дигидрофеназина с дифениламином (PDPAPZ) и фенотиазином (PPTZPZ), которые они использовали для производства катодов. В качестве анодов использовали металлические литий и калий. Поскольку катод управляет ключевыми элементами этих прототипов батарей, называемыми полуэлементами, ученые собирают их, чтобы быстро оценить возможности новых катодных материалов.
В то время как полуэлементы PPTZPZ показали среднюю производительность, PDPAPZ оказался более эффективным: литиевые полуэлементы с PDPAPZ довольно быстро заряжались и разряжались, демонстрируя хорошую стабильность и сохраняя до трети своей емкости даже после 25000 рабочих циклов.Если бы обычный телефонный аккумулятор был таким же стабильным, его можно было бы заряжать и разряжать ежедневно в течение 70 лет. Полуэлементы калия PDPAPZ показали высокую плотность энергии 398 Вт · ч / кг. Для сравнения, значение для обычных литиевых элементов составляет 200-250 Втч / кг, включая массу анода и электролита. Таким образом, российская группа продемонстрировала, что полимерные катодные материалы могут создавать эффективные литиевые и калиевые двухионные батареи.
###
Сколтех — частный международный университет, расположенный в России.Сколтех, основанный в 2011 году в сотрудничестве с Массачусетским технологическим институтом (MIT), воспитывает новое поколение лидеров в области науки, технологий и бизнеса, исследует прорывные области и продвигает технологические инновации, направленные на решение критических проблем, которые лицом к России и миру. Сколтех фокусируется на шести приоритетных областях: наука о данных и искусственный интеллект, науки о жизни, передовые материалы и современные методы проектирования, энергоэффективность, фотоника и квантовые технологии, а также передовые исследования.
Интернет: https: /
Российский химико-технологический университет им. Д. Менделеева, опорный университет российской химической промышленности, стремится генерировать и внедрять новые знания в отрасли. Работа выполнена научными сотрудниками Сколковского института науки и технологий (Сколтех) и Института проблем химической физики РАН, а также студентами Института химии и проблем устойчивого развития им. Д. Менделеева с финансовой поддержкой. при поддержке Миннауки и высшего образования России и Российского фонда фундаментальных исследований (РФФИ).
Заявление об отказе от ответственности: AAAS и EurekAlert! не несут ответственности за точность выпусков новостей, размещенных на EurekAlert! участвующими учреждениями или для использования любой информации через систему EurekAlert.
Что происходит с анодом и катодом в tDCS? — tDCS.com
tDCS всегда имеет анодный электрод и катодный электрод, и что?
Что ж, одна из первых вещей, которые вы узнаете о транскраниальной стимуляции постоянным током (tDCS), это то, что вы помещаете анодный электрод на ту часть мозга, которую хотите возбудить, а катодный электрод на ту часть мозга, которую вы хотите подавить. .Эта идея кажется такой же старой, как оригинальная современная статья о tDCS, написанная немецкими учеными доктором Ницше и доктором Паулюсом. Но новые статьи из тех же лабораторий, кажется, предполагают, что все не так просто. Например, увеличение тока на катоде может сделать его возбуждающим, в то время как увеличение длительности на аноде может сделать его тормозящим. К тому же, действительно неясно, когда вы имеете дело с более сложными функциями мозга, такими как изучение языка или игра в видеоигры, можно ли думать, что мозг просто действует как ручка, которую вы вращаете вверх и вниз.Важно понимать, что у вас всегда должны быть вместе анодный и катодный электроды — если вы наденете только один электрод на головку, tDCS вообще не будет работать, ведя себя так же, как при замыкании цепи. чтобы на самом деле зажечь лампочку.
Итак, что бы вы могли сделать, если бы вам нужен был эффект только одного электрода, а не другого? Например, вы можете захотеть, чтобы анод усилил определенную область или функцию вашего мозга, но, возможно, не захотите иметь дело с другим электродом — скажем, вы не хотите никакого возможного катодного торможения.
-
Один из подходов состоит в том, чтобы предположить, что оба электрода действуют как эффективные ускорители мозга — это может быть идеей устройства Halo TDCS, поскольку вы хотите усилить обе стороны тела.
-
Другой подход — придерживаться проверенных фотомонтажей, которые уже доказали свою эффективность в отношении той функции мозга, которую вы хотите усилить. Ознакомьтесь с нашим руководством по монтажу.
-
Если у вас есть ресурсы, tDCS высокого разрешения позволяет вам выбрать только анод или катод.
-
Наконец, вы можете использовать тот факт, что у вас действительно есть анодное и катодное влияние, и попробовать подход, при котором вы усиливаете одну область и одновременно подавляете другую область, который пытались исследователи.
Общие сведения об анодной и катодной стимуляции
Практикуете ли вы нейрофизиологию в хирургии, в лаборатории или в клинике, вы, вероятно, ежедневно используете электрическую стимуляцию для активации нервной системы.Как вы, вероятно, знаете, стимуляция катодная лучше всего работает в некоторых приложениях, тогда как стимуляция анодная лучше всего работает в других приложениях.
Вооружившись этими знаниями, вы точно знаете, где разместить электроды на теле и куда подключить эти электроды — черный на катоде (-) и красный на аноде (+). Но какая разница? Что такое анодная или катодная стимуляция и почему в некоторых приложениях одна из них работает лучше, чем другая?
Сегодня я надеюсь ответить для вас на некоторые из этих вопросов, потому что считаю, что понимание полярности стимулов важно, и это сделает вас лучшим нейрофизиологом.
Прежде чем мы поговорим о том, как работают стимуляторы , важно иметь общее представление о том, как работает батарея , , , .
Как работает аккумулятор
Правильный термин для того, что мы часто называем «батареей», — это «элемент», но я собираюсь использовать слово «батарея» для простоты. Итак, аккумулятор , , , , является устройством разделения заряда. Он накапливает электрическую энергию, разделяя катионы , и анионы , на два отдельных отсека или терминала (Рисунок 1).
- Катионы — положительно заряженные ионы (+).
- Анионы — отрицательно заряженные ионы (-).
Если вы обратитесь к иллюстрации на Рисунке 1, вы увидите, что одна клемма батареи содержит избыток катионов (+), и это положительная клемма (+) . Поскольку он содержит катионов (+), положительный (+) вывод батареи называется катодом (+).Другая клемма батареи содержит избыток анионов (-), и это отрицательная клемма (-). Поскольку он содержит анионов (-), отрицательная (-) клемма батареи называется анодом (-).
Когда батарея подключена к нагрузке , , , , в данном случае лампочка, устройство питается от протекающего тока. Обычный ток предполагает, что ток течет от положительной клеммы, через цепь к отрицательной клемме.Это была конвенция , выбранная во время открытия электричества, , но они ошибались! Скорее, Электрический ток — это то, что на самом деле происходит, когда электроны (-) выходят из отрицательной клеммы (анода) через цепь и попадают в положительную клемму (катод).
Вывод: в батарее ток течет от анода к катоду. Чтобы узнать больше об аккумуляторах, перейдите сюда.
Как работает электростимулятор
В электрическом стимуляторе поток анионов (-) и катионов (+) контролируется механикой схемы внутри стимулятора.Стимулятор уникален тем, что катод является отрицательным полюсом (-), потому что он разряжает анионы (-), а анод является положительным полюсом (+), потому что он разряжает катионы (+). В конце концов, это фундаментальное различие между батареей и стимулятором.
В зависимости от того, как мы настроим полярность , стимулятор будет выбрасывать катионы или анионы в стимулируемую часть тела.
В катодной стимуляции анионы (-) разряжаются в тело, когда ток течет от катода (-) через ткань и обратно к аноду (+).
В анодной стимуляции катионы (+) разряжаются в тело, когда ток течет от анода (+) через ткань и обратно к катоду (-).
Теперь представим, что мы помещаем электрический стимулятор на поверхность кожи, а под ним проходит нервный пучок (рис. 2).Внутри нервного пучка находится одно нервное волокно (аксон), на котором мы сосредоточимся.
В состоянии покоя внутренняя часть ячейки более отрицательна, чем внешняя часть ячейки. Это происходит потому, что количество отрицательных зарядов немного больше, чем положительных зарядов внутри клетки (внутриклеточное пространство), и немного большее количество положительных зарядов, чем отрицательных зарядов вне клетки (внеклеточное пространство). Из-за электрической разницы ячейка называется поляризованной — как и у магнита, одна сторона более положительная, а другая — отрицательная.Если бы электрический градиент был внезапно обратным, клетка была бы деполяризованной , и мы могли бы увидеть потенциал действия .
Катодная стимуляция периферических нервов
Когда мы используем термин катодная стимуляция , мы имеем в виду, что отрицательно заряженные анионы (-) текут от катода в ткань и обратно к аноду (рис. 3). Когда электрический ток течет от катода к аноду, отрицательные заряды (анионы) имеют тенденцию накапливаться на внешней поверхности нервной мембраны, поскольку они будут отталкиваться отрицательно заряженным катодом.Это делает внешнюю часть мембраны более негативной. Следовательно, внутренняя часть мембраны становится более положительной из-за накопления положительных ионов внутри. Это приведет к деполяризации , которая, если ее величина будет достаточной, приведет к потенциалу действия (нервный импульс или активация мышц).
Рисунок 3 иллюстрирует активацию аксона под катодом. В результате стимуляции потенциал действия передается в обоих направлениях по длине нерва, начиная с катода.Но что-то интересное происходит под анодом! Весь отрицательный заряд из внеклеточного пространства притягивается к аноду, в результате чего внешняя часть ячейки становится чрезмерно электрически положительной по сравнению с внутренней частью ячейки. Таким образом, ячейка является гиперполяризованной под анодом, что означает, что ее очень и очень трудно активировать.
Если применить приведенную выше информацию к SSEP срединного нерва (рис. 4), то можно понять, почему анод всегда дистально , а катод всегда проксимально .
Что произойдет, если вы случайно перевернете электроды стимуляции при выполнении теста SSEP? Сложность, с которой вы можете столкнуться при попытке получить SSEP, объясняется явлением анодной блокировки (Рисунок 3). Таким образом, когда концы биполярных электродов имеют ту же ориентацию, что и волокно, волокно будет деполяризовано под катодом и гиперполяризовано под анодом. Если гиперполяризация достаточно велика, потенциал действия, инициированный под катодом, может не распространяться через область гиперполяризации.В этом случае потенциал действия будет распространяться только в одном направлении. Хотя мы часто говорим о феномене анодной блокировки, вы не увидите этого в клиническом сценарии, если используете соответствующие параметры стимуляции. Для интраоперационного мониторинга ССВП следует использовать супрамаксимальную стимуляцию . Стимул высокой интенсивности преодолеет любые проблемы, которые могут возникнуть в результате анодной блокировки.
Анодная стимуляция периферических нервов
Когда мы используем термин анодная стимуляция , мы имеем в виду, что катионы (+) текут от анода в ткань и обратно к катоду (рис. 5).При воздействии на поверхность нерва анодный ток увеличивает концентрацию катионов (+) во внеклеточном пространстве под анодом. Это приведет к гиперполяризации , , что, как я только что упомянул, переводит клетку в состояние повышенного покоя. Итак, на рисунке 5 мы видим, что аксон нерва деактивируется (гиперполяризуется) под анодом.
Важность ориентации клеток
Во всех примерах, описанных до сих пор, ориентация ячейки под стимулятором была горизонтальной относительно ориентации анода и катода (рисунки 2-5).Обычно это происходит при стимуляции нервов в руках и ногах.
Что происходит, если ориентация ячейки вертикальная по отношению к ориентации анода и катода? Ответ заключается в том, что обычно все работает точно напротив тому, что мы только что обсудили относительно горизонтально ориентированных ячеек.
Это становится особенно важным в головном мозге, где пирамидные клетки коры головного мозга ориентированы вертикально по отношению к поверхности, которую мы стимулируем.
Анодная стимуляция коры головного мозга
Электростимуляция коры головного мозга используется по многим причинам, но сегодня я собираюсь сосредоточиться на моторных вызванных потенциалах (МВП). Если вы используете электричество (в отличие от магнита), чтобы вызвать MEP в своей клинической практике, надеюсь, вы знаете следующий принцип:
Независимо от того, стимулируете ли вы кожу головы над моторной корой головного мозга или напрямую стимулируете кортикальную поверхность, MEP всегда легче всего выявить и охарактеризовать, когда вы используете анодную, монополярную стимуляцию с последовательностью импульсов. С подкорковой стимуляцией все немного меняется, но это тема для другого дня.
Начиная с Фрича и Хитцига (1870), многие исследователи показали, что монополярная стимуляция моторной коры более эффективна с анодом, чем с катодом. Кроме того, монополярная анодная стимуляция, по-видимому, напрямую активирует пирамидные клетки.
Один из предложенных механизмов заключается в том, что анодный ток входит (и гиперполяризует) дендриты на поверхности мозга, затем уходит и деполяризует аксон или тело клетки.Один из способов подумать об этом показан на рисунке 7.
Анодная стимуляция — это просто инъекция положительно заряженных ионов под электрод. Поскольку противоположности притягиваются, отрицательно заряженные ионы мигрируют к самой поверхности коры под анодом. Вы можете думать об этом как о приемнике тока , и следствием этого является гиперполяризация апикальных дендритов пирамидной клетки. Чтобы компенсировать этот сток тока, источник тока , , , генерируется дистально, так что положительно заряженные ионы собираются вокруг другого конца пирамидальной ячейки.Это приводит к деполяризации (активации) тела клетки, бугорка аксона и начального сегмента аксона, образующего кортикоспинальный тракт.
Конечно, не все так просто! Компьютерное моделирование рисует более сложную картину. Как показано на рисунке 8, нервный ответ на стимуляцию, вероятно, представляет собой сложный паттерн деполяризации и гиперполяризации по всей нейронной геометрии клетки, которая зависит от параметров стимуляции и положения нейронов относительно электрода.Ясно, что когда длинная ось клетки ориентирована вертикально относительно ориентации анодного стимулирующего электрода, компьютерное моделирование поддерживает гиперполяризацию апикальных дендритов и деполяризацию вокруг бугорка аксона.
Все сводится к ориентации клетки!
Подумайте об этом … когда вы помещаете монополярный стимулирующий электрод над моторной корой и проводите анодную стимуляцию, ваши самые низкие пороговые значения CMAP исходят от вертикально ориентированных клеток чуть ниже вашего электрода.Если вы делаете транскраниальную МВП, ваш электрод, вероятно, C3 или C4, верно? И электрод — прямо над изображением моторного гомункула. Вам действительно нужно увеличивать интенсивность, чтобы получить MEP от ног, верно? Это связано с тем, что эти клетки «ноги» находятся глубоко в межполушарной щели и , клетки ориентированы горизонтально по отношению к анодному стимулирующему электроду. НО, если вы поменяете полярность и проведете катодную стимуляцию с одного и того же электрода, MEP от ног иногда будет легче вызвать, а руки станут более сложными.Этот феномен лучше всего работает, когда вы стимулируете интенсивность около пороговой. Вы можете использовать это для устранения неполадок ваших MEP. Если вы начинаете стимуляцию и получаете МВП от ног / ступней с меньшей интенсивностью, чем руки / кисти, то ваша полярность, вероятно, обратная.
Список литературы
- Fritsch GT, Hitzig E. 1870. Über die elektrische Erregbarkeit des Grosshirns. Arch Anat Physiol Med Wiss 300–32. Перевод в фон Бонине Г. 1960. Некоторые статьи о коре головного мозга.Спрингфилд (Иллинойс): Чарльз Томас.
- Merrill DR, Bikson M, Jefferys JGR. Электрическая стимуляция возбудимой ткани: разработка эффективных и безопасных протоколов. J Neurosci Methods. 2005 15 февраля; 141 (2): 171-198.
- Наир Д.Р., Берджесс Р., Макинтайр С.К., Людерс Х. Хронические субдуральные электроды в лечении эпилепсии. Clin Neurophysiol. 2008 Янв; 119 (1): 11-28. Epub 2007 26 ноября. Обзор.
- Ranck JB Jr. Какие элементы возбуждаются при электростимуляции центральной нервной системы млекопитающих: обзор.

