Каковы основные параметры и особенности транзистора КТ608. Где применяется этот транзистор. Как КТ608 сравнивается с зарубежными аналогами. Какие существуют модификации КТ608.
Основные характеристики транзистора КТ608
Транзистор КТ608 представляет собой кремниевый эпитаксиально-планарный n-p-n транзистор, предназначенный для работы в импульсных и высокочастотных схемах. Рассмотрим его ключевые параметры:
- Структура: n-p-n
- Материал: кремний
- Технология: эпитаксиально-планарная
- Корпус: металлостеклянный с гибкими выводами
- Масса: не более 2 г
- Максимальная рассеиваемая мощность коллектора: 500 мВт
- Максимальное напряжение коллектор-эмиттер: 60 В
- Максимальный ток коллектора: 400 мА
- Граничная частота коэффициента передачи тока: не менее 200 МГц
Какие особенности выделяют КТ608 среди других транзисторов? Высокая граничная частота и малое время рассасывания (не более 120 нс) позволяют использовать его в быстродействующих импульсных схемах. Небольшие размеры и масса делают транзистор удобным для применения в компактной аппаратуре.

Области применения транзистора КТ608
Благодаря своим характеристикам, транзистор КТ608 нашел широкое применение в различных электронных устройствах:
- Высокочастотные усилители
- Импульсные схемы
- Генераторы
- Преобразователи напряжения
- Ключевые схемы
- Схемы управления
В каких конкретных устройствах можно встретить КТ608? Этот транзистор часто используется в радиоприемниках, передатчиках, измерительных приборах, системах автоматики и телемеханики. Его высокая надежность позволяет применять КТ608 даже в ответственной аппаратуре специального назначения.
Модификации транзистора КТ608
Транзистор КТ608 выпускается в нескольких модификациях, различающихся своими параметрами:
- КТ608А — базовая модель
- КТ608Б — улучшенная версия с более высоким коэффициентом усиления
- 2Т608А — аналог КТ608А для специального применения
- 2Т608Б — аналог КТ608Б для специального применения
Чем отличаются эти модификации? Основное различие — в коэффициенте усиления по току. У КТ608Б и 2Т608Б он выше, что позволяет использовать их в схемах, требующих большего усиления. Модели 2Т608А и 2Т608Б имеют расширенный диапазон рабочих температур от -60°C до +125°C.

Сравнение КТ608 с зарубежными аналогами
Как КТ608 соотносится с транзисторами иностранного производства? Рассмотрим несколько популярных аналогов:
- 2SC456 (Япония) — близкий аналог по основным параметрам
- BCR521 (Европа) — схожие характеристики, но меньшая мощность
- 2SD602A (Япония) — более мощный аналог
- 2SD46 (Япония) — функциональная замена в аналогичном корпусе
В чем преимущества КТ608 перед зарубежными аналогами? Главное достоинство — высокая надежность и стабильность параметров в широком диапазоне температур, что особенно важно для промышленного и специального применения. При этом по основным электрическим характеристикам КТ608 не уступает импортным транзисторам.
Особенности применения транзистора КТ608
При использовании КТ608 в электронных схемах следует учитывать некоторые его особенности:
- Чувствительность к статическому электричеству
- Необходимость теплоотвода при работе на максимальной мощности
- Зависимость параметров от температуры
- Разброс характеристик у разных экземпляров
Как обеспечить надежную работу КТ608? Рекомендуется использовать антистатические меры предосторожности при монтаже, обеспечивать хороший теплоотвод, учитывать температурную зависимость параметров при проектировании схемы. Для ответственных применений желательно проводить входной контроль и отбор транзисторов по ключевым параметрам.

Перспективы применения КТ608 в современной электронике
Несмотря на то, что КТ608 был разработан несколько десятилетий назад, он до сих пор находит применение в различных областях:
- Ремонт и обслуживание устаревшего оборудования
- Бюджетные решения для любительской электроники
- Образовательные цели при изучении основ схемотехники
- Специальное применение, где важна проверенная временем надежность
Каковы перспективы дальнейшего использования КТ608? Хотя в новых разработках этот транзистор применяется все реже, он остается востребованным для поддержания работоспособности существующей аппаратуры. В некоторых нишевых применениях, где не требуются предельные характеристики, КТ608 может использоваться еще долгое время благодаря своей надежности и доступности.
Альтернативы транзистору КТ608 в современных схемах
Для новых разработок вместо КТ608 часто используются более современные компоненты:
- Полевые транзисторы (MOSFET) — лучшие характеристики на высоких частотах
- Биполярные транзисторы с изолированным затвором (IGBT) — для мощных применений
- Интегральные схемы — объединяют функции нескольких дискретных транзисторов
- SiC и GaN транзисторы — для экстремальных режимов работы
Какие преимущества дают современные альтернативы? Они обеспечивают лучшие частотные характеристики, более высокую эффективность, меньшие размеры и часто более низкую стоимость в массовом производстве. Однако в некоторых специфических применениях классические биполярные транзисторы, подобные КТ608, все еще могут быть оптимальным выбором.
Транзистор КТ608: КТ608А, КТ608Б, 2Т608А, 2Т608Б
ОТ КАТОДА ДО АНОДА
|
Поиск по сайту Новости Галогенным лампам снова нашли замену |
ГЛАВНАЯ » ТРАНЗИСТОРЫ » КТ608 Транзистор КТ608 — переключательный, эпитаксиально-планарный, структуры n-p-n, кремниевый. Основное применение — высокочастотные и быстродействующие импульсные устройства. Имеет гибкие выводы и металлостеклянный корпус. На боковой поверхности корпуса указывается тип прибора. Его масса не более 2 г. Цоколевка транзисторов КТ608Электрические параметры транзистора КТ608
Предельные эксплуатационные характеристики транзисторов КТ608
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Транзистор КТ608 — DataSheet
Перейти к содержимому
Цоколевка транзистора КТ608
| Параметр | Обозначение | Маркировка | Условия | Значение | Ед. изм. |
| Аналог | КТ608А | 2SC456 *3, BCR521 *3 | |||
| КТ608Б | CD637 *1, PA6034 *3, 2SD602A *1, 2SD46 *2, SG107 *3 | ||||
| Структура | — | n-p-n | |||
| Максимально допустимая постоянная рассеиваемая мощность коллектора | PK max,P*K, τ max,P**K, и max | КТ608А | — | 0. 5 5 |
Вт |
| КТ608Б | — | 0.5 | |||
| Граничная частота коэффициента передачи тока транзистора для схемы с общим эмиттером | fгр, f*h31б, f**h31э, f***max | КТ608А | — | ≥200 | МГц |
| КТ608Б | — | ≥200 | |||
| Пробивное напряжение коллектор-база при заданном обратном токе коллектора и разомкнутой цепи эмиттера | UКБО проб., U*КЭR проб., U**КЭО проб. | КТ608А | — | 60 | В |
| КТ608Б | — | 60 | |||
| Пробивное напряжение эмиттер-база при заданном обратном токе эмиттера и разомкнутой цепи коллектора | UЭБО проб.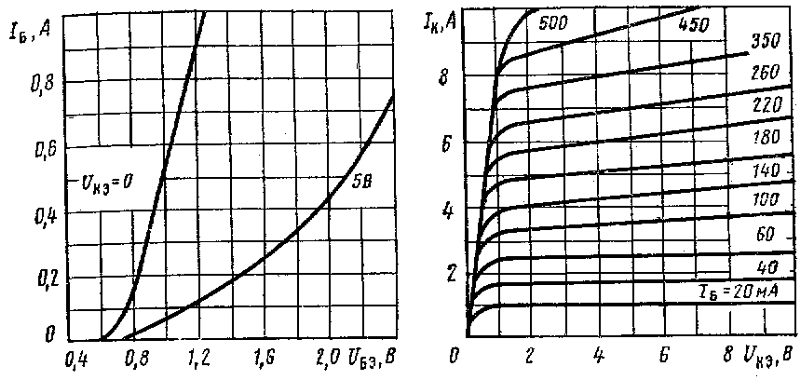 , , |
КТ608А | — | 4 | В |
| КТ608Б | — | 4 | |||
| Максимально допустимый постоянный ток коллектора | IK max, I*К , и max | КТ608А | — | 400(800*) | мА |
| КТ608Б | — | 400(800*) | |||
| Обратный ток коллектора — ток через коллекторный переход при заданном обратном напряжении коллектор-база и разомкнутом выводе эмиттера | IКБО, I*КЭR, I**КЭO | КТ608А | 60 В | ≤10 | мкА |
| КТ608Б | 60 В | ≤10 | |||
| Статический коэффициент передачи тока транзистора в режиме малого сигнала для схем с общим эмиттером | h21э, h*21Э | КТ608А | 5 В; 0. 2 мА 2 мА |
20…80* | |
| КТ608Б | 5 В; 0.2 мА | 40…160* | |||
| Емкость коллекторного перехода | cк, с*12э | КТ608А | 10 В | ≤15 |
пФ |
| КТ608Б | 10 В | ≤15 | |||
| Сопротивление насыщения между коллектором и эмиттером | rКЭ нас, r*БЭ нас, К**у.р. | КТ608А | — | ≤2.5 | Ом, дБ |
| КТ608Б | — | ≤2.5 | |||
| Коэффициент шума транзистора | Кш, r*b, P**вых | КТ608А | — | — | Дб, Ом, Вт |
| КТ608Б | — | — | |||
| Постоянная времени цепи обратной связи на высокой частоте | τк, t*рас, t**выкл, t***пк(нс) | КТ608А | — | ≤120* | пс |
| КТ608Б | — | ≤120* |
Описание значений со звездочками(*,**,***) смотрите в таблице параметров биполярных транзисторов.
*1 — аналог по электрическим параметрам, тип корпуса отличается.
*2 — функциональная замена, тип корпуса аналогичен.
*3 — функциональная замена, тип корпуса отличается.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Изменение метаболизма между штаммами Microcystis aeruginosa с помощью нецелевой масс-спектрометрии
1. Михалак А.М., Андерсон Э.Дж., Белецкий Д., Боланд С., Бош Н.С., Бриджмен Т.Б., Чаффин Дж.Д., Чо К., Конфесор Р., Далоглу И. , и другие. Рекордное цветение водорослей в озере Эри, вызванное сельскохозяйственными и метеорологическими тенденциями, соответствует ожидаемым будущим условиям. проц. Натл. акад. науч. США. 2013; 110:6448–6452. doi: 10.1073/pnas.1216006110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Сокольник И.Р. Цианобактериальные токсины источников питьевой воды: цилиндроспермопсины и микроцистины. КПР Пресс; Нью-Йорк, штат Нью-Йорк, США: 2004. [Google Scholar]
[Google Scholar]
3. Даунинг Дж. А., Уотсон С. Б., Макколи Э. Прогнозирование доминирования цианобактерий в озерах. Может. Дж. Фиш. Аква. науч. 2001; 58: 1905–1908. doi: 10.1139/f01-143. [CrossRef] [Google Scholar]
4. Beaulieu M., Pick F.R., Gregory-Eaves I. Питательные вещества и температура воды являются важными предикторами биомассы цианобактерий в наборе данных 1147 озер. Лимнол. океаногр. 2013;58:1736–1746. дои: 10.4319/lo.2013.58.5.1736. [CrossRef] [Google Scholar]
5. Харрис Т. Д., Смит В. Х. Стимулируют ли стойкие органические загрязнители цветение цианобактерий? Внутренние воды. 2016; 6: 124–130. doi: 10.5268/IW-6.2.887. [CrossRef] [Google Scholar]
6. Выберите Ф.Р. Цветущие водоросли: взгляд Канады на распространение токсичных цианобактерий. Может. Дж. Фиш. Аква. науч. 2016;73:1149–1158. doi: 10.1139/cjfas-2015-0470. [CrossRef] [Google Scholar]
7. Paerl H.W., Huisman J. Изменение климата: катализатор глобального распространения вредоносного цветения цианобактерий. Окружающая среда. микробиол. Представитель 2009 г.;1:27–37. doi: 10.1111/j.1758-2229.2008.00004.x. [PubMed] [CrossRef] [Google Scholar]
Окружающая среда. микробиол. Представитель 2009 г.;1:27–37. doi: 10.1111/j.1758-2229.2008.00004.x. [PubMed] [CrossRef] [Google Scholar]
8. Брукс Б.В., Лазорчак Дж.М., Ховард М.Д.А., Джонсон М.В.В., Мортон С.Л., Перкинс Д.А.К., Риви Э.Д., Скотт Г.И., Смит С.А., Стивенс Дж.А. Становится ли вредоносное цветение водорослей самой серьезной угрозой качеству внутренних вод для здоровья населения и водных экосистем? Окружающая среда. Токсикол. хим. 2016;35:6–13. doi: 10.1002/и т. д. 3220. [PubMed] [CrossRef] [Google Scholar]
9. Хор И., Бартрам Дж. Токсичные цианобактерии в воде: руководство по их последствиям для общественного здравоохранения, мониторингу и управлению. Всемирная организация здравоохранения, E&FN Spon; Лондон, Великобритания: 1999. [Google Scholar]
10. Bouaïcha N., Miles C.O., Beach D.G., Labidi Z., Djabri A. Структурное разнообразие, характеристика и токсикология микроцистинов. Токсины. 2019;11:714. doi: 10.3390/toxins11120714. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Pouria S., De Andrade A., Barbosa J., Cavalcanti R.L., Barreto V.T.S., Ward C.J., Preiser W., Poon G.K., Neild G.H. , Кодд Г.А. Смертельная интоксикация микроцистином в отделении гемодиализа в Каруару, Бразилия. Ланцет. 1998;352:21–26. doi: 10.1016/S0140-6736(97)12285-1. [PubMed] [CrossRef] [Google Scholar]
Pouria S., De Andrade A., Barbosa J., Cavalcanti R.L., Barreto V.T.S., Ward C.J., Preiser W., Poon G.K., Neild G.H. , Кодд Г.А. Смертельная интоксикация микроцистином в отделении гемодиализа в Каруару, Бразилия. Ланцет. 1998;352:21–26. doi: 10.1016/S0140-6736(97)12285-1. [PubMed] [CrossRef] [Google Scholar]
12. Вуд Р. Острые отравления животных и человека в результате воздействия цианотоксинов — обзор литературы. Окружающая среда. Междунар. 2016;91:276–282. doi: 10.1016/j.envint.2016.02.026. [PubMed] [CrossRef] [Google Scholar]
13. Krienitz L., Ballot A., Kotut K., Wiegand C., Pütz S., Metcalf J.S., Codd G.A., Pflugmacher S. Вклад цианобактерий горячих источников в загадочная гибель малых фламинго на озере Богория, Кения. ФЭМС микробиол. Экол. 2003; 43: 141–148. дои: 10.1111/j.1574-6941.2003.tb01053.х. [PubMed] [CrossRef] [Google Scholar]
14. Миллер М.А., Кудела Р.М., Мекебри А., Крейн Д., Оутс С.С., Тинкер М.Т., Стедлер М., Миллер В.А., Той-Чутка С., Доминик С. , и другие. Доказательства нового вредоносного цветения морских водорослей: перенос цианотоксина (микроцистина) с суши к морским выдрам. ПЛОС ОДИН. 2010;5:e12576. doi: 10.1371/journal.pone.0012576. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, и другие. Доказательства нового вредоносного цветения морских водорослей: перенос цианотоксина (микроцистина) с суши к морским выдрам. ПЛОС ОДИН. 2010;5:e12576. doi: 10.1371/journal.pone.0012576. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Cook P.F., Reichmuth C., Rouse A.A., Libby L.A., Dennison S.E., Carmichael O.T., Kruse-Elliott K.T., Bloom J., Singh B. , Фравель В.А., и др. Токсин водорослей ухудшает память морских львов и связь гиппокампа, что может привести к выбросу на берег. Наука. 2015; 350:1445–1447. doi: 10.1126/science.aac5675. [PubMed] [CrossRef] [Академия Google]
16. Сивонен К., Джонс Г. Цианобактериальные токсины. В: Chorus I., Bartram J., редакторы. Токсичные цианобактерии в воде: руководство по их последствиям для общественного здравоохранения, мониторингу и управлению. Всемирная организация здравоохранения, E&FN Spon; Лондон, Великобритания: 1999. [Google Scholar]
17. ВОЗ . Руководство по безопасной рекреационной водной среде. Всемирная организация здравоохранения; Женева, Швейцария: 2003. [Google Scholar]
Всемирная организация здравоохранения; Женева, Швейцария: 2003. [Google Scholar]
18. Du X., Liu H., Yuan L., Wang Y., Ma Y., Wang R., Chen X., Losiewicz M.D., Guo H., Zhang H. Разнообразие цианобактериальных токсинов по структурной характеристике, распределению и идентификации: систематический обзор. Токсины. 2019;11:530. doi: 10.3390/toxins11090530. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Доусон Р.М. Токсикология микроцистинов. Токсикон. 1998; 36: 953–962. doi: 10.1016/S0041-0101(97)00102-5. [PubMed] [CrossRef] [Google Scholar]
20. Гупта Н., Пант С.С., Виджаярагхаван Р., Рао П.В.Л. Сравнительная оценка токсичности вариантов микроцистина циклического пептидного токсина цианобактерий (LR, RR, YR) у мышей. Токсикология. 2003; 188: 285–296. doi: 10.1016/S0300-483X(03)00112-4. [PubMed] [CrossRef] [Академия Google]
21. Мерел С., Уокер Д., Чикана Р., Снайдер С., Баурес Э., Томас О. Уровень знаний и опасения по поводу цветения цианобактерий и цианотоксинов. Окружающая среда. Междунар. 2013;59:303–327. doi: 10.1016/j.envint.2013.06.013. [PubMed] [CrossRef] [Google Scholar]
Окружающая среда. Междунар. 2013;59:303–327. doi: 10.1016/j.envint.2013.06.013. [PubMed] [CrossRef] [Google Scholar]
22. Hollister JW, Kreakie BJ Ассоциации между хлорофиллом a и различными концентрациями микроцистина-LR, рекомендуемыми для здоровья. F1000Исследование. 2016;5:151. doi: 10.12688/f1000research.7955.1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Спуф Л., Кэтрин А. Справочник по цианобактериальному мониторингу и анализу цианотоксинов. Уайли; Чичестер, Великобритания: 2017 г. Приложение 3: Таблицы микроцистинов и нодуляринов; стр. 526–537. [Google Scholar]
24. Лазар С., Эгоз И., Брандейс Р., Чепмен С., Блох-Шилдерман Э., Грауэр Э. Распространение повреждений мозга крыс после воздействия зарина: дифференциальное развитие ранних процессов. Токсикол. заявл. Фармакол. 2016; 310:87–97. doi: 10.1016/j.taap.2016.09.008. [PubMed] [CrossRef] [Академия Google]
25. Zurawell R.W., Chen H., Burke J.M., Prepas E.E. Гепатотоксичные цианобактерии: обзор биологического значения микроцистинов в пресноводной среде. Дж. Токсикол. Окружающая среда. Лечить. Часть B Крит. 2005 г.; 8:1–37. doi: 10.1080/10937400590889412. [PubMed] [CrossRef] [Google Scholar]
Дж. Токсикол. Окружающая среда. Лечить. Часть B Крит. 2005 г.; 8:1–37. doi: 10.1080/10937400590889412. [PubMed] [CrossRef] [Google Scholar]
26. Guyot M., Doré J.C., Devilles J. Типология вторичных метаболитов цианобактерий на основе анализа минимального связующего дерева. SAR QSAR Окружающая среда. Рез. 2004; 15:101–114. doi: 10.1080/10629360410001665866. [PubMed] [CrossRef] [Академия Google]
27. Rouhiainen L., Vakkilainen T., Siemer B.L., Buikema W., Haselkorn R., Sivonen K. Гены, кодирующие гепатотоксические гептапептиды (микроцистины) в штамме Cyanobacterium Anabaena 90. Appl. Окружающая среда. микробиол. 2004; 70: 686–692. doi: 10.1128/AEM.70.2.686-692.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Welker M., Von Döhren H. Цианобактериальные пептиды — природный комбинаторный биосинтез. ФЭМС микробиол. 2006 г.; 30:530–563. doi: 10.1111/j.1574-6976.2006.00022.x. [PubMed] [CrossRef] [Академия Google]
29. Растоги Р.П., Синха Р. П. Биотехнологическое и промышленное значение вторичных метаболитов цианобактерий. Биотехнолог. Доп. 2009; 27: 521–539. doi: 10.1016/j.biotechadv.2009.04.009. [PubMed] [CrossRef] [Google Scholar]
П. Биотехнологическое и промышленное значение вторичных метаболитов цианобактерий. Биотехнолог. Доп. 2009; 27: 521–539. doi: 10.1016/j.biotechadv.2009.04.009. [PubMed] [CrossRef] [Google Scholar]
30. Классен А., Фаччио А.Т., Кануто Г.А.Б., да Круз П.Л.Р., Рибейро Х.К., Таварес М.Ф.М., Суссулини А. Метаболомика: от основ к клиническому применению. Спрингер; Базель, Швейцария: 2017. Метаболомика: определения и значение в системной биологии. [Академия Google]
31. Беверсдорф Л.Дж., Вейрих К.А., Бартлетт С.Л., Миллер Т.Р. Различные профили токсинов и метаболитов цианобактерий в шести эвтрофных озерах с различными физико-химическими характеристиками. Токсины. 2017;9:62. doi: 10.3390/toxins62. [CrossRef] [Google Scholar]
32. Файад П.Б., Рой-Лашапель А., Дуй С.В., Прево М., Сове С. Он-лайн твердофазная экстракция в сочетании с жидкостной хроматографией, тандемная масс-спектрометрия для анализа цианотоксинов в цветут водоросли. Токсикон. 2015; 108: 167–175. doi: 10. 1016/j.toxicon.2015.10.010. [PubMed] [CrossRef] [Академия Google]
1016/j.toxicon.2015.10.010. [PubMed] [CrossRef] [Академия Google]
33. Рой-Лашапель А., Файад П.Б., Синотт М., Деблуа С., Сове С. Общий анализ микроцистинов в воде с использованием лазерной диодной термодесорбции, химической ионизации при атмосферном давлении и тандемной масс-спектрометрии. Анальный. Чим. Акта. 2014; 820:76–83. doi: 10.1016/j.aca.2014.02.021. [PubMed] [CrossRef] [Google Scholar]
34. Sanz M., Andreote A.P.D., Fiore M.F., Dörr F.A., Pinto E. Структурная характеристика новых вариантов пептидов, продуцируемых цианобактериями из бразильских атлантических прибрежных лесов, с использованием жидкостной хроматографии в сочетании с квадрупольная времяпролетная тандемная масс-спектрометрия. Мар. Наркотики. 2015;13:3892–3919. doi: 10.3390/md13063892. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Леон К., Пеньюэла Г.А. Обнаружены цианотоксины методом УВЭЖХ-МС/МС в тропических водоемах северо-востока Колумбии. Токсикон. 2019;167:38–48. doi: 10. 1016/j.toxicon.2019.06.010. [PubMed] [CrossRef] [Google Scholar]
1016/j.toxicon.2019.06.010. [PubMed] [CrossRef] [Google Scholar]
36. Хаддад С.П., Боббитт Дж.М., Тейлор Р.Б., Ловин Л.М., Конкл Дж.Л., Чамблисс С.К., Брукс Б.В. Определение микроцистинов, нодуларина, анатоксина-а, цилиндроспермопсина и сакситоксина в воде и тканях рыб с помощью жидкостной хроматографии с изотопным разбавлением и тандемной масс-спектрометрии. Ж. Хроматогр. А. 2019 г.;1599:66–74. doi: 10.1016/j.chroma.2019.03.066. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Леон С., Бойкс С., Бельтран Э., Пеньюэла Г., Лопес Ф., Санчо Дж. В., Эрнандес Ф. Изучение деградации цианотоксинов и оценка продуктов их превращения в поверхностных водах методом квадрупольно-времяпролетной ВЭЖХ-МС. Хемосфера. 2019; 229: 538–548. doi: 10.1016/j.chemosphere.2019.04.219. [PubMed] [CrossRef] [Google Scholar]
38. Ortiz X., Korenkova E., Jobst K.J., MacPherson K.A., Reiner E.J. Высокопроизводительный целевой и нецелевой метод анализа микроцистинов и анатоксина-А с использованием твердофазной экстракции в режиме реального времени в сочетании с жидкостной хроматографией-квадрупольной времяпролетной масс-спектрометрией высокого разрешения. Анальный. Биоанал. хим. 2017;409: 4959–4969. doi: 10.1007/s00216-017-0437-0. [PubMed] [CrossRef] [Google Scholar]
Анальный. Биоанал. хим. 2017;409: 4959–4969. doi: 10.1007/s00216-017-0437-0. [PubMed] [CrossRef] [Google Scholar]
39. Стюарт А.К., Равиндра Р., Ван Вагонер Р.М., Райт Дж.Л.К. Открытие микрогининовых пептидов из культур цианобактерий Microcystis aeruginosa с помощью метаболомики. Дж. Нат. Произв. 2018; 81: 349–355. doi: 10.1021/acs.jnatprod.7b00829. [PubMed] [CrossRef] [Google Scholar]
40. Yilmaz M., Foss A.J., Miles C.O., Özen M., Demir N., Balcı M., Beach D.G. Всеобъемлющий мульти-методический подход выявляет большое разнообразие микроцистинов в полевых коллекциях и связанный с ними изолят Microcystis aeruginosa из турецкого озера. Токсикон. 2019;167:87–100. doi: 10.1016/j.toxicon.2019.06.006. [PubMed] [CrossRef] [Google Scholar]
41. Исида К., Окита Ю., Мацуда Х., Окино Т., Мураками М. Аэрогинозины, ингибиторы протеазы из цианобактерий Microcystis aeruginosa. Тетраэдр. 1999;55:10971–10988. doi: 10.1016/S0040-4020(99)00621-3. [CrossRef] [Google Scholar]
42. Исида К., Велкер М., Кристиансен Г., Кадел-Сикс С., Бушье К., Диттманн Э., Хертвек К., Де Марсак Н.Т. Пластичность и эволюция биосинтеза аэругинозина у цианобактерий. заявл. Окружающая среда. микробиол. 2009 г.;75:2017–2026. doi: 10.1128/AEM.02258-08. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Исида К., Велкер М., Кристиансен Г., Кадел-Сикс С., Бушье К., Диттманн Э., Хертвек К., Де Марсак Н.Т. Пластичность и эволюция биосинтеза аэругинозина у цианобактерий. заявл. Окружающая среда. микробиол. 2009 г.;75:2017–2026. doi: 10.1128/AEM.02258-08. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Roy-Lachapelle A., Solliec M., Sauvé S. Определение BMAA и трех алкалоидных цианотоксинов в озерной воде с использованием дериватизации дансилхлорида и высокого разрешения масс-спектрометрии. Анальный. Биоанал. хим. 2015; 407:5487–5501. doi: 10.1007/s00216-015-8722-2. [PubMed] [CrossRef] [Google Scholar]
44. Лейкоски Н., Фьюэр Д.П., Сивонен К. Широкое распространение и латеральный перенос кластера генов биосинтеза цианобактина у цианобактерий. заявл. Окружающая среда. микробиол. 2009 г.;75:853–857. doi: 10.1128/AEM.02134-08. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Briand E., Bormans M., Gugger M., Dorrestein P.C., Gerwick W. H. Изменения вторичных метаболических профилей штаммов Microcystis aeruginosa в ответ на внутривидовые взаимодействия. Окружающая среда. микробиол. 2016;18:384–400. дои: 10.1111/1462-2920.12904. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
H. Изменения вторичных метаболических профилей штаммов Microcystis aeruginosa в ответ на внутривидовые взаимодействия. Окружающая среда. микробиол. 2016;18:384–400. дои: 10.1111/1462-2920.12904. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
46. Welker M., Maršálek B., Šejnohová L., von Döhren H. Обнаружение и идентификация олигопептидов в колониях Microcystis (цианобактерий): на пути к пониманию метаболического разнообразия. Пептиды. 2006;27:2090–2103. doi: 10.1016/j.peptides.2006.03.014. [PubMed] [CrossRef] [Google Scholar]
47. Kultschar B., Dudley E., Wilson S., Llewellyn C.A. Внутриклеточные и внеклеточные метаболиты цианобактерий chlorogloeopsis fritschii, pcc 6912, в течение 48 часов воздействия УФ-В. Метаболиты. 2019;9:74. doi: 10.3390/metabo9040074. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
48. Park H., Namikoshi M., Brittain S.M., Carmichael W.W., Murphy T. [D-Leu1] microcystin-LR, новый микроцистин, выделенный из водяной цветок в канадском прерийном озере. Токсикон. 2001;39: 855–862. doi: 10.1016/S0041-0101(00)00224-5. [PubMed] [CrossRef] [Google Scholar]
Токсикон. 2001;39: 855–862. doi: 10.1016/S0041-0101(00)00224-5. [PubMed] [CrossRef] [Google Scholar]
49. Пинто Р.К. Метаболомика: от основ к клиническому применению. Спрингер; Базель, Швейцария: 2017. Хемометрические методы и стратегии в метаболомике; стр. 163–190. [Google Scholar]
50. Тугизимана Ф., Стенкамп П.А., Пиатер Л.А., Дюбери И.А. Разговор о стратегиях интеллектуального анализа данных в нецелевой метаболомике ЖХ-МС: этапы предварительной обработки и предварительной обработки. Метаболиты. 2016;6:40. дои: 10.3390/метабо6040040. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Schrimpe-Rutledge A.C., Codreanu S.G., Sherrod S.D., McLean J.A. Стратегии нецелевой метаболомики — вызовы и новые направления. Варенье. соц. Масс-спектр. 2016; 27:1897–1905. doi: 10.1007/s13361-016-1469-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
52. Sivonen K., Leikoski N., Fewer DP, Jokela J. Цианобактины — рибосомальные циклические пептиды, продуцируемые цианобактериями. заявл. микробиол. Биотехнолог. 2010;86:1213–1225. doi: 10.1007/s00253-010-2482-x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
заявл. микробиол. Биотехнолог. 2010;86:1213–1225. doi: 10.1007/s00253-010-2482-x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Martin C., Oberer L., Ino T., König W.A., Buschdtt M., Weckesser J. Цианопептолины, новые депсипептиды из цианобактерий Microcystins sp. PCC 7806. J. Antibiot. (Токио) 1993; 46:1550–1556. doi: 10.7164/антибиотики.46.1550. [PubMed] [CrossRef] [Google Scholar]
54. Leblanc Renaud S. Ph.D. Тезис. Университет Оттавы; Оттава, Онтарио, Канада: 2009. Производство микроцистина и доминирование токсигенных штаммов цианобактерий в исследованиях озер и культур. [Академия Google]
55. Zhang H., Liu Y., Nie X., Liu L., Hua Q., Zhao G.P., Yang C. Цианобактериальный орнитин-аммиачный цикл включает аргининдигидролазную статью. Нац. хим. биол. 2018;14:575. doi: 10.1038/s41589-018-0038-z. [PubMed] [CrossRef] [Google Scholar]
56. Portmann C., Blom JF, Gademann K., Jüttner F. Аэроцикламиды A и B: выделение и синтез токсичных рибосомных гетероциклических пептидов из цианобактерии Microcystis aeruginosa PCC7806. Дж. Нат. Произв. 2008; 71: 1193–119.5. doi: 10.1021/np800118g. [PubMed] [CrossRef] [Google Scholar]
Дж. Нат. Произв. 2008; 71: 1193–119.5. doi: 10.1021/np800118g. [PubMed] [CrossRef] [Google Scholar]
57. Faltermann S., Zucchi S., Kohler E., Blom J.F., Pernthaler J., Fent K. Молекулярные эффекты цианобактериального токсина цианопептолина (CP1020), встречающегося в цветении водорослей : Анализ глобального транскриптома у эмбрионов рыбок данио. Аква. Токсикол. 2014; 149:33–39. doi: 10.1016/j.aquatox.2014.01.018. [PubMed] [CrossRef] [Google Scholar]
58. Перейра Д.А., Джани А. Производство олигопептидов в зависимости от плотности клеток в штаммах цианобактерий. ФЭМС микробиол. Экол. 2014; 88: 175–183. дои: 10.1111/1574-6941.12281. [PubMed] [CrossRef] [Google Scholar]
59. Jüttner F., Watson S.B., von Elert E., Köster O. β-Cyclocitral, сигнал защиты Grazer, уникальный для Cyanobacterium Microcystis. Дж. Хим. Экол. 2010;36:1387–1397. doi: 10.1007/s10886-010-9877-0. [PubMed] [CrossRef] [Google Scholar]
60. Cox P.A., Banack S.A., Murch S.J., Rasmussen U., Tien G. , Bidigare R.R., Metcalf J.S., Morrison L.F., Codd G.A., Bergman B. Разнообразные таксоны цианобактерий производят β-N-метиламино-L-аланин, нейротоксичную аминокислоту. проц. Натл. акад. науч. США. 2005; 102: 5074–5078. doi: 10.1073/pnas.0501526102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Bidigare R.R., Metcalf J.S., Morrison L.F., Codd G.A., Bergman B. Разнообразные таксоны цианобактерий производят β-N-метиламино-L-аланин, нейротоксичную аминокислоту. проц. Натл. акад. науч. США. 2005; 102: 5074–5078. doi: 10.1073/pnas.0501526102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
61. Morán X.A.G., Gasol J.M., Arin L., Estrada M. Сравнение стекловолоконных и мембранных фильтров для оценки производства POC и DOC в фитопланктоне. Мар. Экол. прог. сер. 1999; 187:31–41. doi: 10.3354/meps187031. [CrossRef] [Google Scholar]
62. Коэн С.А. Аналитические методы обнаружения α-амино-β-метиламинопропионовой кислоты. Аналитик. 2012; 137:1991–2005. doi: 10.1039/c2an16250d. [PubMed] [CrossRef] [Google Scholar]
63. Рорлак Т., Эдвардсен Б., Скулберг Р., Хальстведт С.Б., Уткилен Х.С., Птачник Р., Скулберг О.М. Олигопептидные хемотипы токсичной пресноводной цианобактерии Planktothrix могут образовывать субпопуляции с несходными экологическими признаками. Лимнол. океаногр. 2008;53:1279–1293. doi: 10.4319/lo.2008.53.4.1279. [CrossRef] [Google Scholar]
Лимнол. океаногр. 2008;53:1279–1293. doi: 10.4319/lo.2008.53.4.1279. [CrossRef] [Google Scholar]
64. Андерсон Р.А. Методы культивирования водорослей. 1-е изд. Академическая пресса Эльзевира; Нью-Йорк, штат Нью-Йорк, США: 2005. [Google Scholar]
65. Аранда-Родригес Р., Тиллманнс А., Бенуа Ф.М., Пик Ф.Р., Харви Дж., Соленаиа Л. Жидкостная экстракция токсинов из клеток цианобактерий под давлением. Окружающая среда. Токсикол. 2005; 20: 390–396. doi: 10.1002/tox.20116. [PubMed] [CrossRef] [Google Scholar]
66. Ortelli D., Edder P., Cognard E., Jan P. Быстрый скрининг и количественный анализ микроцистинов в пищевых добавках с микроводорослями и воде с помощью жидкостной хроматографии в сочетании с временем полета масс-спектрометрии. Анальный. Чим. Акта. 2008; 617: 230–237. doi: 10.1016/j.aca.2008.03.033. [PubMed] [CrossRef] [Академия Google]
Geekvape Aegis Hero Pod Mod Kit – VapoRider
Geekvape Aegis Hero Pod Mod Kit – Вапорайдер ПРЕДУПРЕЖДЕНИЕ. Этот продукт содержит никотин. Никотин — химическое вещество, вызывающее привыкание.
Этот продукт содержит никотин. Никотин — химическое вещество, вызывающее привыкание.
Цвет Серебро — 29,99 долларов США. Синий — 29,99 долларов США. Красный — 29,99 долларов. Металлическая бронза — 29,99 долларов США. Черный — $29,99 Радуга — 29,99 долларов США.
Артикул КТ608
Количество
Geekvape Aegis Hero Pod Mod Kit — это набор модов для субомных капсул, который лучше всего подходит для вейперов среднего и продвинутого уровня. Geekvape Aegis Hero Pod Kit может выдавать максимальную мощность 45 Вт от встроенного аккумулятора емкостью 1200 мАч. А устройство Geekvape Aegis Hero обладает водонепроницаемостью и ударопрочностью IP67, что делает его удобным и долговечным. Кроме того, комплект Aegis Hero имеет 0,42-дюймовый OLED-экран для отображения основных данных о парении и режимов вывода. Вы можете управлять переменной мощностью и режимом байпаса с помощью рабочих кнопок. Более того, Geekvape Aegis Hero оснащен капсулой Aegis Hero объемом 4 мл, которая лучше всего совместима с серией G Coil Boost. Комплект модов Geekvape Aegis Hero с практичным дизайном с верхней заправкой и гладким регулируемым воздушным потоком подарит отличные впечатления от вейпинга.
Вы можете управлять переменной мощностью и режимом байпаса с помощью рабочих кнопок. Более того, Geekvape Aegis Hero оснащен капсулой Aegis Hero объемом 4 мл, которая лучше всего совместима с серией G Coil Boost. Комплект модов Geekvape Aegis Hero с практичным дизайном с верхней заправкой и гладким регулируемым воздушным потоком подарит отличные впечатления от вейпинга.
Быстрые ссылки:
Geekvape Aegis Boost Coil
Geekvape Aegis Hero Замена картриджа
Параметры
Dimensions: 48.15.15. Сопротивление катушки: 0,4 Ом, 0,6 Ом.0163 Аккумулятор емкостью 1200 мАч с максимальной выходной мощностью 45 Вт
0,42-дюймовый OLED-экран
Совместимость с серией G Coil Boost
Регулируемый поток воздуха и легкая заправка сверху
Несколько защит для безопасного парения
Комплект включает
- Herois Pod 9 9×187 1
- 1 сетка Geekvape Aegis G Coil Boost 0,4 Ом
- 1 сетка Geekvape Aegis G Coil Boost 0,6 Ом
- 1 x Руководство пользователя
- 1 кабель для зарядки Micro USB
- Подробности
- Политика доставки
Geekvape Aegis Hero Pod Mod Kit – это набор модов для субомных капсул, который лучше всего подходит для вейперов среднего и продвинутого уровня. Geekvape Aegis Hero Pod Kit может выдавать максимальную мощность 45 Вт от встроенного аккумулятора емкостью 1200 мАч. А устройство Geekvape Aegis Hero обладает водонепроницаемостью и ударопрочностью IP67, что делает его удобным и долговечным. Кроме того, комплект Aegis Hero имеет 0,42-дюймовый OLED-экран для отображения основных данных о парении и режимов вывода. Вы можете управлять переменной мощностью и режимом байпаса с помощью рабочих кнопок. Более того, Geekvape Aegis Hero оснащен капсулой Aegis Hero объемом 4 мл, которая лучше всего совместима с серией G Coil Boost. Комплект модов Geekvape Aegis Hero с практичным дизайном с верхней заправкой и гладким регулируемым воздушным потоком подарит отличные впечатления от вейпинга.
Geekvape Aegis Hero Pod Kit может выдавать максимальную мощность 45 Вт от встроенного аккумулятора емкостью 1200 мАч. А устройство Geekvape Aegis Hero обладает водонепроницаемостью и ударопрочностью IP67, что делает его удобным и долговечным. Кроме того, комплект Aegis Hero имеет 0,42-дюймовый OLED-экран для отображения основных данных о парении и режимов вывода. Вы можете управлять переменной мощностью и режимом байпаса с помощью рабочих кнопок. Более того, Geekvape Aegis Hero оснащен капсулой Aegis Hero объемом 4 мл, которая лучше всего совместима с серией G Coil Boost. Комплект модов Geekvape Aegis Hero с практичным дизайном с верхней заправкой и гладким регулируемым воздушным потоком подарит отличные впечатления от вейпинга.
Быстрые ссылки:
Geekvape Aegis Boost Coil
Geekvape Aegis Hero Замена картриджа
Параметры
Dimensions: 48.15.15. Сопротивление катушки: 0,4 Ом, 0,6 Ом. 0163 Аккумулятор емкостью 1200 мАч с максимальной выходной мощностью 45 Вт
0163 Аккумулятор емкостью 1200 мАч с максимальной выходной мощностью 45 Вт
0,42-дюймовый OLED-экран
Совместимость с серией G Coil Boost
Регулируемый поток воздуха и легкая заправка сверху
Несколько защит для безопасного парения
Комплект включает
- Herois Pod 9 9×187 1
- 1 сетка Geekvape Aegis G Coil Boost 0,4 Ом
- 1 сетка Geekvape Aegis G Coil Boost 0,6 Ом
- 1 x Руководство пользователя
- 1 кабель для зарядки Micro USB
В соответствии с PACT ACT , со всех посылок взимается плата в размере 6,95 долларов США за подпись взрослого (21+) при доставке с удостоверением личности. проверять. Убедительно просим вас доставлять заказы до места работы, чтобы легче было получить посылку в течение дня.
Подписавшийся не обязательно должен быть получателем посылки, а может быть только взрослым, который живет или работает по адресу доставки. Заказ, размещенный до 12:00 CST в будний день, будет отправлен в тот же день, в противном случае заказ будет отправлен на следующий рабочий день. Политика доставки
Политика доставки
Обычно время обработки составляет 24 часа. Для заказов на сумму более 79 долларов будет предложена бесплатная стандартная доставка! Все заказы, размещенные с понедельника по пятницу до 13:00 CST, будут отправлены в тот же день. Заказы, размещенные в выходные или праздничные дни, будут отправлены на следующий рабочий день. Мы не несем ответственности за задержку доставки, вызванную перевозчиком.
Политика возврата
Вы можете вернуть большинство новых, невскрытых товаров в течение 30 дней с момента доставки для полного возврата средств. Мы также оплатим стоимость обратной доставки, если возврат является результатом нашей ошибки (вы получили неправильный или дефектный товар и т. д.).
В целях гигиены и безопасности мы не принимаем к возврату следующие предметы, открытые или бывшие в употреблении и, следовательно, НЕ ПОДЛЕЖАЩИЕ ВОЗВРАТУ: жидкости для электронных сигарет, одноразовые расходные материалы, открытые картриджи, сменные катушки, капельные наконечники, сменные стаканы, распылители/резервуары и аккумуляторы.

 5
5 ..+100°C
..+100°C ..+100°C
..+100°C ..+50°C
..+50°C ..+85°C
..+85°C