Что представляет собой варикап КВ109. Каковы основные технические характеристики варикапа КВ109. Где применяется варикап КВ109 в радиоэлектронных схемах. Какие особенности имеет варикап КВ109 по сравнению с другими моделями. Как правильно использовать варикап КВ109 в радиотехнических устройствах.
Что такое варикап КВ109 и его основные характеристики
Варикап КВ109 представляет собой полупроводниковый диод, емкость которого зависит от приложенного обратного напряжения. Это позволяет использовать его в качестве электрически управляемого конденсатора переменной емкости.
Основные технические характеристики варикапа КВ109:
- Емкость при обратном напряжении 3 В: 8-17 пФ (в зависимости от модификации)
- Емкость при обратном напряжении 25 В: 1.8-2.8 пФ
- Коэффициент перекрытия по емкости: 4.0-6.5
- Добротность: 160-450 (в зависимости от модификации)
- Максимальное обратное напряжение: 28 В
- Максимальный обратный ток: 0.5 мкА
Варикап КВ109 выпускается в нескольких модификациях (А, Б, В, Г, Е, Ж), которые отличаются диапазоном емкостей и некоторыми другими параметрами.
Принцип работы варикапа КВ109
Принцип работы варикапа КВ109 основан на зависимости барьерной емкости p-n перехода от приложенного к нему обратного напряжения. При увеличении обратного напряжения ширина обедненной зоны p-n перехода увеличивается, что приводит к уменьшению емкости варикапа.
Как это работает на практике?
- При подаче небольшого обратного напряжения (около 3 В) емкость варикапа КВ109 максимальна и составляет 8-17 пФ
- При увеличении обратного напряжения до 25 В емкость уменьшается до 1.8-2.8 пФ
- Таким образом, изменяя напряжение от 3 до 25 В, можно плавно регулировать емкость варикапа в довольно широком диапазоне
Этот принцип позволяет использовать варикап КВ109 для электронной перестройки частоты в различных радиоэлектронных устройствах.
Области применения варикапа КВ109
Благодаря своим характеристикам, варикап КВ109 находит широкое применение в различных радиотехнических устройствах:
- Системы автоматической подстройки частоты (АПЧ) в радиоприемниках
- Генераторы, управляемые напряжением (ГУН)
- Схемы частотной модуляции
- Перестраиваемые колебательные контуры
- Параметрические усилители
- Умножители частоты
- Управляемые фазовращатели
- Схемы электронной настройки в телевизорах
Рассмотрим некоторые из этих применений подробнее.
Использование КВ109 в системах АПЧ
В системах автоматической подстройки частоты варикап КВ109 используется для точной подстройки частоты гетеродина приемника. Как это работает?
- Варикап включается в колебательный контур гетеродина
- При отклонении частоты от заданной формируется управляющее напряжение
- Это напряжение подается на варикап, изменяя его емкость
- Изменение емкости варикапа приводит к изменению частоты контура
- Таким образом частота автоматически подстраивается до нужного значения
Применение КВ109 в ГУН
В генераторах, управляемых напряжением, варикап КВ109 позволяет изменять частоту генерации в зависимости от приложенного управляющего напряжения. Принцип работы:
- Варикап включается в колебательный контур генератора
- Изменение управляющего напряжения меняет емкость варикапа
- Это приводит к изменению резонансной частоты контура
- В результате меняется частота генерируемых колебаний
Такие ГУН широко используются в системах фазовой автоподстройки частоты, синтезаторах частот и других устройствах.
Особенности и преимущества варикапа КВ109
Варикап КВ109 обладает рядом особенностей, которые определяют его преимущества по сравнению с другими моделями:
- Широкий диапазон изменения емкости (коэффициент перекрытия до 6.5)
- Высокая добротность (до 450 на частоте 50 МГц)
- Низкий обратный ток (не более 0.5 мкА)
- Стабильность характеристик в широком диапазоне температур
- Малые габариты и вес (не более 0.06 г)
Какие преимущества это дает при практическом применении?
- Широкий диапазон перестройки частоты в ГУН и других устройствах
- Высокая добротность обеспечивает малые потери и хорошую избирательность контуров
- Низкий обратный ток снижает уровень шумов
- Температурная стабильность позволяет использовать варикап в широком диапазоне условий
- Малые размеры удобны для применения в миниатюрной аппаратуре
Как правильно использовать варикап КВ109 в схемах
Для эффективного использования варикапа КВ109 в радиоэлектронных устройствах следует учитывать некоторые особенности его применения:
- Варикап всегда включается в схему в обратном направлении
- Необходимо обеспечить подачу управляющего напряжения через развязывающий резистор
- Для улучшения линейности характеристики используют последовательное включение нескольких варикапов
- Следует учитывать паразитную индуктивность выводов (до 4 нГн)
- При работе на высоких частотах важно минимизировать длину выводов
Рассмотрим типовую схему включения варикапа КВ109 в колебательный контур:

- Варикап включается параллельно катушке индуктивности
- Управляющее напряжение подается через резистор 100-200 кОм
- Для развязки по высокой частоте используется конденсатор 1000-10000 пФ
- При необходимости для расширения диапазона перестройки несколько варикапов включают последовательно
Такая схема позволяет эффективно управлять частотой колебательного контура, изменяя напряжение на варикапе.
Сравнение варикапа КВ109 с аналогами
Чтобы лучше понять особенности варикапа КВ109, полезно сравнить его характеристики с некоторыми аналогами:
| Параметр | КВ109 | КВ102 | BB149 |
|---|---|---|---|
| Емкость при 3В, пФ | 8-17 | 14-40 | 11-17 |
| Коэффициент перекрытия | 4.0-6.5 | 2.5-3.5 | 3.5-5.5 |
| Добротность | 160-450 | 40-100 | >100 |
| Макс. обратное напряжение, В | 28 | 45 | 30 |
Какие выводы можно сделать из этого сравнения?
- КВ109 имеет больший коэффициент перекрытия по емкости, что обеспечивает более широкий диапазон перестройки
- Добротность КВ109 существенно выше, особенно у некоторых модификаций
- По максимальному обратному напряжению КВ109 уступает КВ102, но превосходит BB149
- В целом КВ109 обладает более высокими характеристиками по сравнению с аналогами
Маркировка и внешний вид варикапа КВ109
Для правильной идентификации и использования варикапа КВ109 важно знать особенности его маркировки и внешнего вида:
- Варикап КВ109 выпускается в пластмассовом корпусе с гибкими ленточными выводами
- Масса варикапа не превышает 0.06 грамма
- Маркировка осуществляется цветной точкой у положительного вывода
- КВ109А маркируется белой точкой
- КВ109Б — красной точкой
- КВ109В — зеленой точкой
- КВ109Г не имеет цветной маркировки
Что нужно учитывать при работе с варикапом КВ109?
- Важно правильно определять полярность выводов по маркировке
- Следует аккуратно обращаться с выводами из-за их гибкости
- При пайке нужно соблюдать температурный режим во избежание повреждения
- Рекомендуется использовать антистатические меры предосторожности
Знание особенностей маркировки и внешнего вида поможет избежать ошибок при монтаже и эксплуатации варикапа КВ109.
Варикапы типа: КВ109А, КВ109Б, КВ109В, КВ109Г
Варикапы кремниевые эпитаксиально-планарные: КВ109А, КВ109Б, КВ109В, КВ109Г. Выпускаются в пластмассовом корпусе с гибкими ленточными выводами. Варикапы маркируются цветной точкой у положительного вывода:
| КВ109А | белой |
| КВ109Б | красной |
| КВ109В | зелёной |
| КВ109Г | не имеет маркировки |
Масса варикапа не более 0,06 грамма.
Чертёж варикапа КВ109А, КВ109Б, КВ109В, КВ109ГЭлектрические параметры.
| Ёмкость при ƒ=1÷10 МГц | |
| при Uобр=3 В | |
| КВ109В | От 8 до 16 пФ |
| КВ109Г | От 8 до 17 пФ |
| КВ109А | От 2,3 до 2,8 пФ |
| КВ109Б | От 2,0 до 2,3 пФ |
| КВ109В | От 1,9 до 3,1 пФ |
| Коэффициент перекрытия по ёмкости | |
| КВ109А | От 4 до 5,5 |
| КВ109Б | От 4,5 до 6,5 |
| КВ109В | От 4 до 6 |
| КВ109Г, не менее | 4 |
| Температурный коэффициент ёмкости | (500±300)•10-6 1/К |
| Добротность при Uобр=3 В и частоте ƒ= 50 МГц, не менее | |
| КВ109А, КВ109Б | 300 |
| КВ109В, КВ109Г | 160 |
| ƒ=470 МГц для КВ109А, КВ109Б | 30 |
| Постоянный обратный ток при U обр=25 В, не более | 0,5 мкА |
| Индуктивность выводов диода на расстоянии от корпуса до 1,5 мм, не более | 4 нГн |
Предельные эксплуатационные данные.
| Постоянное обратное напряжение | 25 В |
| Рассеиваемая мощность при температуре до 49,85°С | 5 мВт |
| Температура окружающей среды | От -40,15 до 84,85°С |
Примечание. В интервале температур от 49,85 до 84,85°С рассеиваемая мощность снижается линейно на 0,05 мВт/К.
Зависимость ёмкости от напряжения и зависимость обратного тока от напряженияЗависимость ёмкости от напряжения и зависимость обратного тока от напряжения.
Варикап КВ109
Справочник количества содержания ценных металлов в варикапе КВ109 согласно паспорта на изделие и информационной литературы. Указано точное значение драгоценных металлов в граммах (Золото, серебро, платина, палладий и другие) на единицу изделия.
Содержание драгоценных металлов в варикапе КВ109
Золото: 3,84E-04 грамм.
Серебро: 0 грамм.
Платина: 0 грамм.
Палладий: 0 грамм.
Источник информации: .
Фото варикапа КВ109:
Варикап радиодеталь
Варикап — «переменный», и cap(acity) — «ёмкость») — полупроводниковый диод, работа которого основана на зависимости барьерной ёмкости p-n перехода от обратного напряжения. Варикапы применяются в качестве элементов с электрически управляемой ёмкостью в схемах перестройки частоты колебательного контура, деления и умножения частоты, частотной модуляции, управляемых фазовращателей и др.
О варикапе КВ109
Основные характеристики Варикапа
Общая ёмкость — ёмкость, измеренная между выводами варикапа при заданном обратном напряжении.
Коэффициент перекрытия по ёмкости — отношение ёмкостей при двух заданных значениях обратного напряжения на варикапе.
Добротность — отношение реактивного сопротивления варикапа на заданной частоте к сопротивлению потерь при заданном значении ёмкости или обратного напряжения.
Постоянный обратный ток — постоянный ток, протекающий через варикап при заданном обратном напряжении.
Максимально допустимое постоянное обратное напряжение.
Максимально допустимая рассеиваемая мощность.
Температурные коэффициенты емкости и добротности — отношение относительного изменения емкости (добротности) варикапа к вызвавшему его абсолютному изменению температуры. В общем случае сами эти коэффициенты зависят от значения обратного напряжения, приложенного к варикапу.
Предельная частота варикапа — значение частоты, на которой реактивная составляющая проводимости варикапа становится равной активной составляющей. Измерение предельной частоты производится при конкретных заданных обратном напряжении и температуре, которые в свою очередь зависят от типа варикапа.
Как работает диод – видео.
Как видим, его изображение очень напоминает условное изображение полупроводникового диода. И это не случайно. Дело в том, что p-n переход любого диода обладает так называемой барьерной ёмкостью. Сама по себе барьерная ёмкость перехода для диода нежелательна. Но и этот недостаток смогли использовать. В результате был разработан варикап – некий гибрид диода и переменного конденсатора, ёмкость которого можно менять с помощью напряжения.
Сама по себе барьерная ёмкость перехода для диода нежелательна. Но и этот недостаток смогли использовать. В результате был разработан варикап – некий гибрид диода и переменного конденсатора, ёмкость которого можно менять с помощью напряжения.
Как известно, при подаче обратного напряжения на диод, он закрыт и не пропускает электрический ток. В таком случае p-n переход выполняет роль своеобразного изолятора, толщина которого зависит от величины обратного напряжения (Uобр). Меняя величину обратного напряжения (Uобр), мы меняем толщину перехода – этого самого изолятора. А поскольку электрическая ёмкость C зависит от площади обкладок, в данном случае площади p-n перехода, и расстояния между обкладками – толщины перехода, то появляется возможность менять ёмкость p-n перехода с помощью напряжения. Это ещё называют электронной настройкой.
На варикап прикладывают обратное напряжение, что изменяет величину ёмкости барьера p-n перехода.
Отметим, что барьерная ёмкость есть у всех полупроводниковых диодов, и она уменьшается по мере увеличения обратного напряжения на диоде. Но вот у варикапов эта ёмкость может меняться в достаточно широких пределах, в 3 – 5 раз и более.
Но вот у варикапов эта ёмкость может меняться в достаточно широких пределах, в 3 – 5 раз и более.
Характеристики диодов КВ109:
Купить или продать а также цены на Варикап КВ109:
Оставьте отзыв о КВ109:
Схема FM радиоприемника — Меандр — занимательная электроника
Данную схему fm радиоприемника легко можно увеличить нажав на нее.Данный несложный радиоприемник ловит частоты в диапазоне FM в котором щас в основном и вещают радиостанции..
В статье будут приведены внешний вид деталей, и печатная плата для данного радиоприемника.
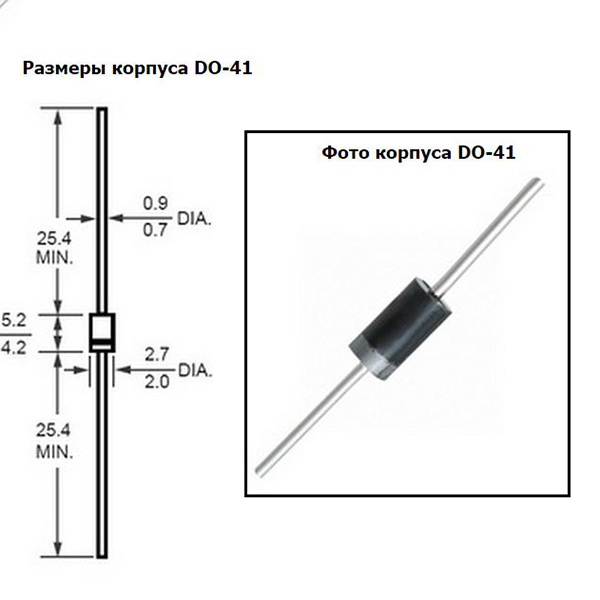
Начинающие могут смутить мало-распространенные элементы, подписанные на схеме как КВ109 и 10,7 МГц. В первом случае под КВ109 понимается элемент варикап, который изменяет свою емкость при изменении напряжения на его выводах. Ниже фотография варикапа и габаритные размеры.
В зависимости от буквенного индекса, варикапы КВ109 маркируются соответствующей цветной точкой. Например, КВ109А маркирован белой точкой. В нашей схеме можно использовать варикапы с любым буквенным индексом. Ножка со стороны маркировки является анодом, а ножка со стороны выпуклой метки – катодом.
Например, КВ109А маркирован белой точкой. В нашей схеме можно использовать варикапы с любым буквенным индексом. Ножка со стороны маркировки является анодом, а ножка со стороны выпуклой метки – катодом.
Если внимательно посмотреть схему – элементы с маркировкой 10,7 МГц отличаются между собой по количеству выводов. С двумя выводами элемент справедливо можно назвать кварцевым резонатором, но его правильнее называть фильтром дискриминатора.
У некоторых мог возникнуть вопрос о многооборотном переменном резисторе. Это переменное сопротивление, движок которого перемещается медленно и плавно, что позволяет производить точную настройку. Такие переменные многооборотные сопротивления вы могли видеть в старых телевизорах, в блоках настройки каналов. Наибольшее распространение получило сопротивление типа СП3-36. Ниже его фотография.
С торца сопротивления имеется удобная ручка-крутилка. Положение движка легко контролировать визуально по ползунку на валу. Сопротивление можно вклеить в корпус, а через прорезь в корпусе настраивать крутилкой.
Теперь поговорим о катушках. Катушки очень просты в изготовлении. Раньше для детекторного приемника требовался тонкий обмоточный провод, ферритовый стержень и терпение, чтобы намотать 100-120 витков контурной катушки. Фраза в рисунке схемы у катушки «11 витков / 0,5 / 2,5» говорит о том, что нам потребуется намотать 11 витков проводом диаметром 0,5 мм на оправке 2,5 мм. Обмоточный медный провод диаметром 0,5 мм в лаковой изоляции (ПЭЛ) можно найти в мастерских по ремонту электродвигателей и бытовой техники, либо в других местах. Оправка – это сверло диаметром 2,5 мм. Предварительно выравниваем провод методом вытягивания. Мотаем на оправку плотно, виток к витку. Перед началом намотки зачищаем конец провода на 2-3 мм и сразу облуживаем припоем. После намотки обрезаем провод, оставив вывод 2-3 мм; его также зачищаем и облуживаем. Аналогично делаем вторую катушку на 10 витков. У вас должно получиться нечто подобное.
Маркировка конденсаторов:
1000 пф – маркировка 102
10 пф – маркировка 100
Маркировка резисторов (ориентировочно):
47 кОм – желтый, фиолетовый, оранжевый
4,7 кОм – желтый, фиолетовый, красный
Как правило, приемник начинающего радиолюбителя выполняется «воздушным монтажом», т.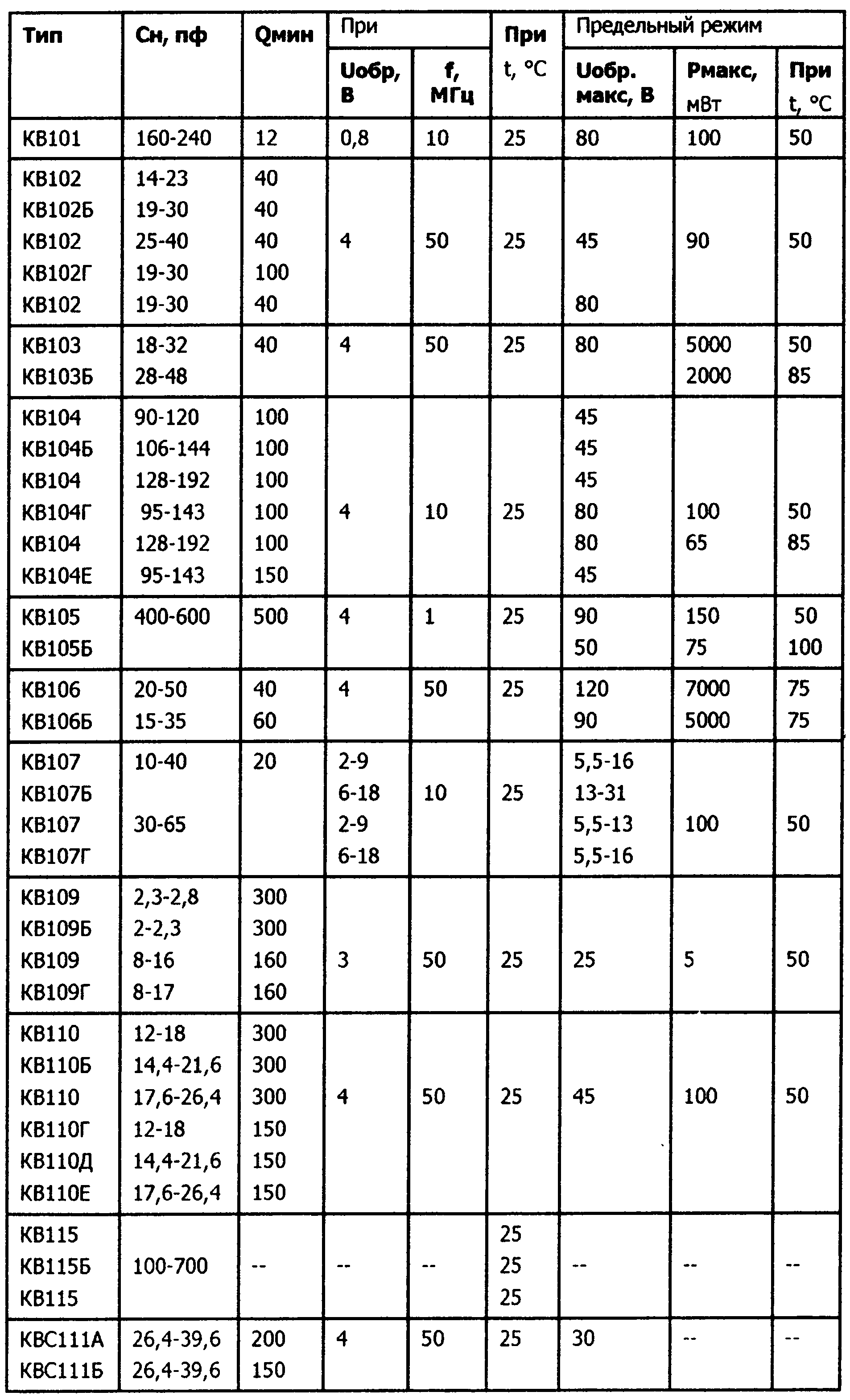 к. нет достаточного навыка изготовления печатных плат. По крайней мере, мой первый приемник именно такой и был как и множество других конструкций. Для тех, кто темой печатных плат владеет, предлагаю рисунок печатной платы. Этим рисунком рекомендую руководствоваться при сборке приемника на монтажных платах.
к. нет достаточного навыка изготовления печатных плат. По крайней мере, мой первый приемник именно такой и был как и множество других конструкций. Для тех, кто темой печатных плат владеет, предлагаю рисунок печатной платы. Этим рисунком рекомендую руководствоваться при сборке приемника на монтажных платах.
Покупаем на выгодных условиях: платы, радиодетали, микросхемы, АТС, приборы, лом электроники, катализаторы
Мы гарантируем Вам честные цены! Серьезный подход и добропорядочность — наше главное кредо.
Компания ООО «РадиоСкупка» (скупка радиодеталей) закупает и продает радиодетали , а также любое радиотехническое оборудование и приборы. У нас Вы сможете найти не только наиболее востребованные радиодетали, но и редкие производства СССР и стран СЭВ. Мы являемся партнером «ФГУП НИИ Радиотехники» и накопили огромный опыт за наши годы работы. Также многих радиолюбителей заинтересует наш уникальный справочник по содержанию драгметаллов в радиодеталях. В левом нижнем углу нашего сайта Вы сможете узнать актуальные цены на драгметаллы такие, как золото, серебро, платина, палладий (цены указаны в $ за унцию) а также текущие курсы основных валют. Работаем со всеми городами России и география нашей работы простирается от Пскова и до Владивостока. Наш квалифицированный персонал произведет грамотную и выгодную для Вас оценку вашего оборудования, даст профессиональную консультацию любым удобным Вам способом – по почте или телефону. Наш клиент всегда доволен!
В левом нижнем углу нашего сайта Вы сможете узнать актуальные цены на драгметаллы такие, как золото, серебро, платина, палладий (цены указаны в $ за унцию) а также текущие курсы основных валют. Работаем со всеми городами России и география нашей работы простирается от Пскова и до Владивостока. Наш квалифицированный персонал произведет грамотную и выгодную для Вас оценку вашего оборудования, даст профессиональную консультацию любым удобным Вам способом – по почте или телефону. Наш клиент всегда доволен!
Покупаем платы, радиодетали, приборы, АТС, катализаторы. Заинтересованы в выкупе складов с неликвидными остатками радиодеталей а также цехов под ликвидацию с оборудованием КИПиА.
Приобретаем:
- платы от приборов, компьютеров
- платы от телевизионной и бытовой техники
- микросхемы любые
- транзисторы
- конденсаторы
- разъёмы
- реле
- переключатели
- катализаторы автомобильные и промышленные
- приборы (самописцы, осциллографы, генераторы, измерители и др.
 )
)
Купим Ваши радиодетали и приборы в любом состоянии, а не только новые. Цены на сайте указаны на новые детали. Расчет стоимости б/у деталей осуществляется индивидуально в зависимости от года выпуска, состоянии, а также текущих цен Лондонской биржи металлов. Работаем почтой России, а также транспортными компаниями. Наша курьерская служба встретит и заберет Ваш груз с попутного автобуса или поезда.
Честные цены, наличный и безналичный расчет, порядочность и клиентоориентированность наше главное преимущество!
Остались вопросы – звоните 8-961-629-5257, наши менеджеры с удовольствием ответят на все Ваши вопросы. Для вопросов по посылкам: 8-900-491-6775. Почта [email protected]
С уважением, директор Александр Михайлов.
Диод КВ109 | Радиодетали в приборах
Диод КВ109
Справочник содержания драгоценных металлов в радиодеталях основан на справочных данных различных организаций, занимающихся переработкой лома радиодеталей, паспортах устройств, формулярах и других открытых источников.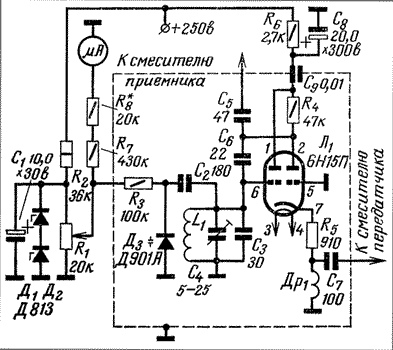 Стоит отметить, что реальное содержание может отличатся на 20-30% в меньшую сторону.
Стоит отметить, что реальное содержание может отличатся на 20-30% в меньшую сторону.
Диоды могут содержать золото, серебро, платину и МПГ (Металлы платиновой группы, Платиновая группа, Платиновые металлы, Платиноиды, ЭПГ)
Содержание драгоценных металлов в диоде (стабилитроне):
КВ109Золото: 0.0054
Серебро: 0
Платина: 0
МПГ: 0
По данным: Справочник по драгоценным металлам ПРИКАЗ №70
Принцип действия диода
Диод – это полупроводниковый прибор, с односторонней проводимостью электрического тока: он хорошо пропускает через себя ток в одном направлении и очень плохо — в другом. Это основное свойство диода используется, в частности, для преобразования переменного тока в постоянный ток.
Типы диодов
Выпрямительные диоды. Выпрямительные диоды – самые распространенные полупроводниковые диоды, применяемые в выпрямителях – устройствах, преобразующих переменный ток промышленной частоты в постоянный. В выпрямительных диодах используются переходы с большой площадью для пропускания больших токов.
Стабилитроны. Предназначены для использования в схемах, обеспечивающих стабилизацию напряжений.
Варикапы. Зависимость емкости n-p -перехода от обратного напряжения используется в полупроводниковых диодах, называемых варикапами. Для варикапов характерна малая инерционность процесса изменения емкости.
Высокочастотные диоды.
Переключающие диоды. В ряде электронных схем полупроводниковый диод должен работать в режиме переключения, т.е. в одни периоды времени он оказывается смещенным в прямом направлении, а в другие — в обратном.
Диоды Шотки. В диодах этого типа используется контакт Шотки (контакт металл – полупроводник). Инжекция неосновных носителей в базу отсутствует, так как прямой ток образуется электронами, движущимися из кремния в металл. Накопление заряда в базе диода не происходит, и поэтому время переключения диода может быть существенно уменьшено (до значений порядка 100 пс).
Фотодиод (ФД) представляет собой диод с открытым p-n-переходом. Световой поток, падающий на открытый p-n-переход приводит к появлению в одной из областей дополнительных не основных носителей зарядов, в результате чего увеличивается обратный ток.
Световой поток, падающий на открытый p-n-переход приводит к появлению в одной из областей дополнительных не основных носителей зарядов, в результате чего увеличивается обратный ток.
Светоизлучающие диоды (СИД) преобразуют электрическую энергию в световое излучение за счет рекомбинации электронов и дырок. В обычных диодах рекомбинация (объединение) электронов и дырок происходит с выделением тепла, т. е. без светового излучения.
Поделиться ссылкой:
Понравилось это:
Нравится Загрузка…
Похожее| Диод | Cв /Uоб пФ / В |
Kс(U1-U2) (В) |
ТКЕ* 1000 (U) |
Q( U/F ) ( В/МГц) [пФ/МГц] |
Iо/Uо мкА/В |
Uоб В |
Кор- пус |
| КВ101А | 160-240/0. 8 8 |
1.2- | 12(0.8/10) | 1/4 | 4 | 68 | |
| КВ102А КВ102Б КВ102В КВ102Г КВ102Д 2В102Е 2В102Ж |
14-23 /4 19-30 /4 25-40 /4 19-30 /4 19-30 /4 25-37 /4 19-28 /4 |
2.5- 2.5- 2.5- 2.5- 3.5- 2.1- 2.1- |
40( 4/50) 40( 4/50) 40( 4/50) 100( 4/50) 40( 4/50) 100( 4/50) 50( 4/50) |
1/45 1/45 1/45 1/45 1/80 1/45 1/80 |
45 45 45 45 80 45 80 |
58 58 58 58 58 58 58 |
|
| КВ103А КВ103Б |
18-32 /4 28-48 /4 |
50( 4/50) 40( 4/50) |
10/80 10/80 |
80 80 |
8 8 |
||
| КВ104А КВ104Б КВ104В КВ104Г КВ104Д КВ104Е |
90-120/4 106-144/4 128-192/4 95-143/4 128-192/4 95-143/4 |
2. 5- 5- 2.5- 2.5- 3.5- 3.5- 2.5- |
100( 4/10) 100( 4/10) 100( 4/10) 100( 4/10) 100( 4/10) 150( 4/10) |
5/45 5/45 5/45 5/80 5/80 5/45 |
45 45 45 80 80 45 |
58 58 58 58 58 58 |
|
| КВ105А КВ105Б |
400-600/4 400-600/4 |
3.8- (4-90) 3.0- (4-50) |
0.5/4 0.5/4 |
500( 4/1 ) 500( 4/1 ) |
30/90 30/50 |
90 50 |
5 5 |
| КВ106А КВ106Б |
20-50 /4 15-35 /4 |
— — |
40( 4/50) 60( 4/50) |
20/120 20/90 |
120 90 |
8 8 |
|
| КВ107А КВ107Б КВ107В КВ107Г |
10-40 / 10-40 / 30-65 / 30-65 / |
1. 5- 5- 1.5- 1.5- 1.5- |
20( /10) 20( /10) 20( /10) 20( /10) |
100/ 100/ 100/ 100/ |
6-16 -31 6-16 -31 |
83 83 83 83 |
|
| КВ109А КВ109Б КВ109В КВ109Г КВ109Е КВ109Ж |
2.3-2.8/25 2.0-2.3/25 8.0-16 /3 8.0-17 /3 2.0-2.3/25 1.8-2.8/25 |
4.0-5.5(3-25) 4.5-6.5(3-25) 4.0-6.0(3-25) 4.0- (3-25) 4.5-6.0(3-25) 4.0-6.0(3-25) |
300( 3/50) 300( 3/50) 160( 3/50) 160( 3/50) 450( 3/50) 300( 3/50) |
0.5/25 0.5/25 0.5/25 0.5/25 0.02/25 0.5/25 |
28 28 28 28 28 28 |
30 30 30 30 30 30 |
|
| 2В110А 2В110Б 2В110В 2В110Г 2В110Д 2В110Е 2В110Ж |
12. 0-28.0/4 0-28.0/4 14.4-21.6/4 17.6-26.4/4 12.0-28.0/4 14.4-21.6/4 17.6-26.4/4 32.0-30.0/4 |
2.5- 2.5- 2.5- 2.5- 2.5- 2.5- 2.5-3.0 |
300( 4/50) 300( 4/50) 300( 4/50) 150( 4/50) 150( 4/50) 150( 4/50) 300( 4/50) |
1/45 1/45 1/45 1/45 1/45 1/45 1/45 |
45 45 45 45 45 45 45 |
1 1 1 1 1 1 1 |
|
| КВС111А КВС111Б |
19.7-36.3/4 19.7-36.3/4 |
2.1- (4-30) 2.1- (4-30) |
0.5/ 0.5/ |
200( 4/50) 150( 4/50) |
1/30 1/30 |
30 30 |
27 27 |
| КВ112А КВ112Б 2В112Б9 |
9. 6-14.4/4 6-14.4/4 12.0-18.0/4 12.0-18.0/4 |
1.8- (4-25) 1.8- (4-25) 1.8- (4-25) |
0.5/4 0.5/4 — |
200( 4/50) 200( 4/50) 200( 4/50) |
1/25 1/25 1/25 |
25 25 25 |
70 70 55 |
| КВ113А КВ113Б |
54.4-81.6/4 54.4-81.6/4 |
4.4- 4.4- |
0.5/4 0.5/4 |
300( 4/10) 300( 4/10) |
10/135 10/100 |
150 115 |
67 67 |
| КВ114А1 КВ114А1 |
54.4-81.6/4 54.4-81.6/4 |
4.4- (4-135) 3.9- (4-100) |
0.5/4 0.5/4 |
300( 4/10) 300( 4/10) |
10/135 10/100 |
150 115 |
70 70 |
| КВ115А КВ115Б КВ115В |
100-700/0 100-700/0 100-700/0 |
— — — |
0.1/ 0.05/ 0.01/ |
0.1 0.1 0.1 |
42 42 42 |
||
| КВ116А1 2В116Б1 2В116В1 |
168-252/1 168-210/1 195-252/1 |
18- (1-10) 18- (1-10) 18- (1-10) |
2.0/4 2.0/4 2.0/4 |
100( 1/1 ) 200( 1/1 ) 200( 1/1 ) |
1/10 1/12 1/12 |
10 12 12 |
71 71 71 |
| КВ117А КВ117Б |
26.4-39.6/3 26.4-39.6/3 |
5-7 (3-25) 4-7 (3-25) |
0.6/3 0.6/3 |
180( 3/50) 150( 3/50) |
1/25 1/25 |
25 25 |
1 1 |
| 2ВС118А 2ВС118Б |
54.4-81.6/4 54.4-81.6/4 |
3.6-4.4(4-Uом) 2.7-3.3(4-Uом) |
200[55/10] 250[55/10] |
1/100 1/50 |
115 60 |
66 66 |
|
| КВ119А | 168-252/1 | 18- (1-10) | 2.0/4 | 100( 1/1 ) | 1/10 | 12 | 1 |
| КВС120А КВС120Б КВС120А1 |
230-320/1 230-320/1 230-320/1 |
20- (1-30) 20- (1-30) 20- (1-30) |
100( 1/1 ) 100( 1/1 ) 100( 1/1 ) |
0.5/30 0.5/30 0.5/30 |
32 32 32 |
69 69 |
|
| КВ121А КВ121Б |
4.3-6.0/25 4.3-6.0/25 |
7.6- (1.5-25) 7.6- (1.5-25) |
— 0.8/4 |
200[27/50] 150[27/50] |
0.5/28 0.5/28 |
30 30 |
30 30 |
| КВ122А КВ122Б КВ122В |
2.3-2.8/25 2.0-2.3/25 1.9-3.1/25 |
4.0-5.5 (3-25) 4.5-6.5 (3-25) 4.0-6.0 (3-25) |
0.8/3 0.8/3 0.8/3 |
450[ 9/50] 450[ 9/50] 300[ 9/50] |
0.2/28 0.2/28 0.2/28 |
30 30 30 |
30 30 30 |
| КВ122А9 КВ122АГ9 КВ122АТ9 КВ122Б9 КВ122БГ9 КВ122БТ9 КВ122В9 КВ122ВГ9 КВ122ВТ9 КВ122Г9 |
2.3-2.8/25 2.3-2.8/25 2.3-2.8/25 2.0-2.3/25 2.0-2.3/25 2.0-2.3/25 1.9-3.1/25 1.9-3.1/25 1.9-3.1/25 2.3-2.8/25 |
4.0-5.5 (3-25) 4.0-5.5 4.0-5.5 4.5-6.5 (3-25) 4.5-6.5 4.5-6.5 4.0-6.0 (3-25) 4.0-6.0 4.0-6.0 4.0-5.5 (3-25) |
0.8/3 — — 0.8/3 — — 0.8/3 — — — |
450[ 9/50] 450[ 9/50] 450[ 9/50] 450[ 9/50] 450[ 9/50] 450[ 9/50] 300[ 9/50] 300[ 9/50] 300[ 9/50] 450[ /50] |
0.05/28 0.05 0.05 0.02/28 0.02/28 0.02/28 0.05/28 0.05 0.05 0.05/28 |
30 30 30 30 30 30 30 30 30 30 |
55 55 55 55 55 55 55 55 55 55 |
| КВ123А КВ123АГ |
2.6-3.8/25 2.6-3.8/25 |
6.8- (3-25) 6.8- |
0.8/3 | 250[12/50] 250[12/50] |
0.05/28 0.05/25 |
28 28 |
30 30 |
| 2В124А 2В124Б 2В124А9 |
24.3-29.7/3 9.0-11.0/3 24.3-29.7/3 |
4.7-6.7 (3-25) 4 -6.5 (3-25) 4.7-6.7 (3-25) |
— — 0.5/4 |
200[25/50] 250[25/50] 200[25/50] |
0.5/25 0.5/25 0.5/25 |
28 30 28 |
30 30 55 |
| 2В125А | 24-36 /1 2.9-4.3/12 |
5.6-12. (1-12) | 150[10/50] | 0.5/12 | 14 | 30 | |
| КВ126А5 | 2.6-3.8/25 | 6.8- (3-25) | 0.8/4 | 200[12/50] | 0.5/25 | 28 | |
| КВ127А КВ127Б КВ127В КВ127Г |
230-280/1 260-320/1 230-260/1 230-320/1 |
20- (1-30) 20- (1-30) 20- (1-30) 20- (1-30) |
140( 1/1 ) 140( 1/1 ) 140( 1/1 ) 100( 1/1 ) |
0.5/30 0.5/30 0.05/32 0.5/30 |
30 30 32 30 |
30 30 30 30 |
|
| КВ128А КВ128АК |
22-28 /1 22-28 /1 |
1.9- (1-9 ) 1.9- (1-9 ) |
0.8/4 — |
300[20/50] 300[20/50] |
0.05/10 0.05/10 |
12 12 |
33 33 |
| КВ129А | 7.2-11 /3 | 4- 5.5 | 0.8/ | 50[ 9/50] | 0.5/8 | 28 | 33 |
| КВ130А КВ130А9 КВ130АГ9 КВ130АТ9 |
3.7-4.5/28 3.7-4.5/28 3.7-4.5/28 3.7-4.5/28 |
12 — (1-28) 12 -18 (1-28) 12 -18 (1-28) 12 -18 (1-28) |
— 0.8/3 — — |
300( /50) 300[12/50] 300[12/50] 300[12/50] |
0.05/ 0.05/ 0.05/ 0.05/ |
28 28 28 28 |
30 55 55 55 |
| КВ131А | 440-530/1 | 18 — (1-8.5) | 2.0/1 | 130( 1/1 ) | 0.05/10 | 14 | 71 |
| КВ132А КВ132АГ КВ132АР КВ132АТ |
26.4-39.6/2 26.4-39.6/2 26.4-39.6/2 26.4-39.6/2 |
3.5-4.4 (2-5 ) 3.5- (2-5 ) 3.5- (2-5 ) 3.5- (2-5 ) |
2.0/2 2.0/2 — — |
300(4/500) 300(4/50 ) 300(4/50 ) 300(4/50 ) |
0.05/5 0.05/5 0.05/5 0.05/5 |
12 12 12 12 |
30 30 30 30 |
| 2В133А | 120-180 /4 | 8- (4-27) | 100[120/10 | 1/27 | 32 | 30 | |
| КВ134А | 18-22 /1 | 3 — (1-10) | 400(4/500) | 0.05/10 | 23 | 30 | |
| КВ134А9 | 18-22 /1 -6 /10 |
3 -3.9 (1-10) | 400(4/500) | 0.05/10 | 25 | 55 | |
| КВ134АТ9 | 18-22 /1 -6 /10 |
3 — (1-10) | 400(4/500) | 0.05/10 | 25 | 55 | |
| КВ135А | 486-594/1 -30/10 |
16.2- (1-10) | 150( 1/1 ) | 0.5/10 | 13 | 73 | |
| КВ136А КВ136Б |
17-19/4 20-24/4 |
2.6-3.1 (2-30) 2.6-3.2 (2-30) |
0.4/4 0.4/4 |
500( 4/50) 500( 4/50) |
0.02/25 0.02/25 |
30 30 |
1 1 |
| КВ138А КВ138Б |
14-18/2 17-21/2 |
3.5-4.8 (2-5 ) 3.5-4.8 (2-5 ) |
0.8/2 0.8/2 |
200( 3/50) 200( 3/50) |
0.05/5 0.05/5 |
12 12 |
30 30 |
| КВ139А КВ139АГ КВ139АР КВ139АТ |
500-620/1 500-620/1 500-620/1 500-620/1 |
18-25 (1-5 ) 18-25 (1-5 ) 18-25 (1-5 ) 18-25 (1-5 ) |
0.8/1 — — — |
160[500/1] 160[500/1] 160[500/1] 160[500/1] |
0.5/12 0.5/ 0.5/ 0.5/ |
16 16 16 16 |
39 39 39 39 |
| КВ140А1 КВ140Б1 |
170-210/1 195-240/1 |
18- (1-10) 18- (1-10) |
0.8/1 0.8/1 |
200( 1/1 ) 200( 1/1 ) |
0.5/10 0.5/10 |
15 15 |
71 71 |
| 2В141А6 | 5.4-6.6/8 | 3- (1-8 ) | 0.8/ | 0.2/14 | 16 | ||
| КВ142А КВ142АГ КВ142АР КВ142АТ КВ142Б КВ142БГ КВ142БР КВ142БТ |
230-260/1 230-260/1 230-260/1 230-260/1 250-320/1 250-320/1 250-320/1 250-320/1 |
19-25 (1-30) 19-25 (1-30) 19-25 (1-30) 19-25 (1-30) 19-25 (1-30) 19-25 (1-30) 19-25 (1-30) 19-25 (1-30) |
0.4/1 — — — 0.4/1 — — — |
300[200/1] 300[200/1] 300[200/1] 300[200/1] 300[200/1] 300[200/1] 300[200/1] 300[200/1] |
0.05/32 0.05/ 0.05/ 0.05/ 0.05/32 0.05/ 0.05/ 0.05/ |
32 32 32 32 32 32 32 32 |
30 30 30 30 30 30 30 30 |
| 2В143А 2В143Б 2В143В |
24.3-29.7/3 24.3-29.7/3 24.3-29.7/3 |
3.2-4.1 (3-15) 3.8-4.8 (3-15) 4.9-6.5 (3-25) |
400( /50) 400( /50) 350( /50) |
0.05/15 0.05/15 0.05/25 |
18 18 28 |
33 33 33 |
|
| КВ144А | 2.6-3.0/25 31.0- /1 |
12-15 (1-28) | 110[30/50] | 0.01 | 32 | — | |
| КВ144А1 | 2.6-3.0/25 31.0- /1 |
12-15 (1-28) | 100[30/50] | 0.02 | 32 | 30 | |
| КВ144АГ | 2.6-3.0/25 31.0- /1 |
12-15 (1-28) | 110[30/50] | 0.01 | 32 | 95 | |
| КВ144АТ | 2.6-3.0/25 31.0- /1 |
12-15 (1-28) | 110[30/50] | 0.01 | 32 | 95 | |
| КВ144Б | 2.8-3.2/25 33.5- /1 |
12-15 (1-28) | 110[30/50] | 0.01 | 32 | 95 | |
| КВ144Б1 | 2.8-3.2/25 33.5- /1 |
12-15 (1-28) | 100[30/50] | 0.02 | 32 | 30 | |
| КВ144БГ | 2.6-3.0/25 31.0- /1 |
12-15 (1-28) | 110[30/50] | 0.01 | 32 | 95 | |
| КВ144БТ | 2.6-3.0/25 31.0- /1 |
12-15 (1-28) | 110[30/50] | 0.01 | 32 | 95 | |
| КВ144В | -3.0/25 31.0- /1 |
12-15 (1-28) | 90[30/50] | 0.01 | 32 | 95 | |
| КВ144В1 | -3.0/25 31.0- /1 |
12-15 (1-28) | 90[30/50] | 0.01 | 32 | 30 | |
| КВ144Г | -3.2/25 33.0- /1 |
12-15 (1-28) | 90[30/50] | 0.01 | 32 | 95 | |
| КВ144Г1 | -3.2/25 33.0- /1 |
12-15 (1-28) | 90[30/50] | 0.01 | 32 | 30 | |
| КВ146А | 10- 16/10 | 2.4- (0-10) | 100( 4/50) | 0.05 | 32 | 77 | |
| КВ147А КВ147Б |
85-105/4 95-115/4 |
2.8-3.5 (4- ) 2.8-3.5 (4- ) |
65( 4/50) 65( 4/50) |
5 5 |
50 50 |
||
| КВ149А1 КВ149Б1 КВ149В1 |
1.9-2.4/28 1.8-2.4/28 2.2-2.7/28 |
7.7-9.4 (1- ) 7.5-9.5 (1- ) 7.0-9.0 (1- ) |
450( /50) 350( /50) 450( /50) |
0.02 0.02 0.02 |
30 30 30 |
30 30 30 |
|
| АВ151А5 | 0.75+-10%/ /25 |
8- (1.5-25) | 50(/1000) 1000( /50) |
27 | |||
2В110, КВ117, КВ119, КВ136 |
КВ105 |
КВ103, КВ106 |
|||||
КВС111 |
КВ109, КВ121, КВ122, КВ123, КВ124А,Б, 2В125, КВ127, КВ130А, КВ132, 2В133, КВ134, КВ138, КВ142, КВ144А1, КВ144Б1, КВ144В1, КВ144Г1, КВ149 |
КВ128, КВ129, 2В143 |
|||||
КВ139 |
КВ115 |
КВ122, 2В124А9, КВ130А9, АГ9, КВ130АТ9, КВ134А9, АТ9 |
|||||
КВ102, КВ104 |
2ВС118 |
КВ113 |
|||||
КВ101 |
КВС120 |
КВ112А,Б, КВ114 |
|||||
КВ116, КВ131, КВ140 |
КВ135 |
КВ146 |
|||||
КВ107 |
КВ144АГ,АТ, КВ144Б,БГ,БТ, КВ144В,Г, КВ144Г |
||||||
| Варикап | Цветовая маркировка | ||||||
| КВ101А | полярность обозначается точкой со стороны анода | ||||||
| 2В102
КВ102 |
полярность обозначается желтой точкой со
стороны анода
полярность обозначается белой точкой со стороны анода |
||||||
| 2В104
КВ104А |
полярность обозначается белой точкой со
стороны анода
полярность обозначается оранжевой точкой со стороны анода |
||||||
| КВ109А
109Б 109В |
полярность обозначается белой точкой со
стороны анода
полярность обозначается красной точкой со стороны анода полярность обозначается зеленой точкой со стороны анода |
||||||
| КВС111А
111Б |
маркируется белой точкой
маркируется оранжевой точкой |
||||||
| 2В112Б9 | полярность обозначается белой точкой со стороны анода | ||||||
| 2В113А
113Б КВ113А 113Б |
полярность обозначается белой точкой со
стороны анода
полярность обозначается оранжевой точкой со стороны анода полярность обозначается желтой точкой со стороны анода полярность обозначается зеленой точкой со стороны анода |
||||||
| КВ121А
121Б |
тип обозначается синей точкой или полосой,
полярность обозначается выпуклой точкой со стороны катода
тип обозначается желтой точкой или полосой, полярность обозначается выпуклой точкой со стороны катода |
||||||
| КВ122А
122Б 122В КВ122А9 |
маркируется оранжевой точкой, полярность
обозначается выпуклой точкой со стороны катода
маркируется фиолетовой точкой, полярность обозначается выпуклой точкой со стороны катода маркируется коричневой точкой, полярность обозначается выпуклой точкой со стороны катода тип и полярность обозначаются оранжевой точкой со стороны анода |
||||||
| КВ123А | маркируется белой полосой со стороны анода, полярность обозначается выпуклой точкой со стороны катода | ||||||
| 2В124А
124Б 2В124А9 |
полярность обозначается выпуклой точкой
со стороны катода, тип обозначается зеленой точкой со стороны анода
тип обозначается зеленой точкой со стороны катода тип обозначается зеленой точкой со стороны анода |
||||||
| 2В125А | полярность обозначается выпуклой точкой со стороны катода, тип обозначается белой точкой со стороны анода | ||||||
| КВ127А
127Б 127В 127Г |
тип обозначается белой краской со стороны
катода
полярность обозначается выпуклой точкой со стороны катода тип обозначается красной краской со стороны катода полярность обозначается выпуклой точкой со стороны катода тип обозначается желтой краской со стороны катода полярность обозначается выпуклой точкой со стороны катода тип обозначается зеленой краской со стороны катода полярность обозначается выпуклой точкой со стороны катода |
||||||
| КВ128А | тип и полярность обозначаются красной точкой со стороны анода | ||||||
| КВ129А | тип и полярность обозначаются черной точкой со стороны анода | ||||||
| КВ130А
КВ130А9 |
маркируются красной точкой со стороны катода
тип и полярность обозначаются оранжевой точкой со стороны анода |
||||||
| КВ131А | тип и полярность обозначаются красной точкой со стороны анода | ||||||
| КВ132А | тип обозначается белой точкой со стороны катода | ||||||
| 2В133А | полярность обозначается выпуклой точкой со стороны катода, тип обозначается красной точкой со стороны катода | ||||||
| КВ134А
КВ134А9 |
тип обозначается белой (желтой?) точкой
со стороны катода
полярность обозначается выпуклой точкой со стороны катода тип и полярность обозначаются желтой точкой со стороны анода |
||||||
| КВ135А | тип и полярность обозначаются белой точкой со стороны анода | ||||||
| КВ138А
138Б |
две белые точки
две красные точки |
||||||
| КВ142А
142Б |
полярность обозначается выпуклой точкой
со стороны катода тип обозначается белой точкой со стороны анода
полярность обозначается выпуклой точкой со стороны катода тип обозначается красной точкой со стороны анода |
||||||
| 2В143А
143Б 143В |
маркируется белой точкой со стороны катода
маркируется красной точкой со стороны катода маркируется желтой точкой со стороны катода |
||||||
| КВ146А | тип и полярность обозначаются желтым кольцом со стороны катода | ||||||
| КВ149А | тип и полярность обозначаются оранжевым кольцом со стороны катода | ||||||
| КВ149Б | тип и полярность обозначаются двумя оранжевыми кольцами со стороны катода | ||||||
| КВ149В | тип и полярность обозначаются двумя белыми кольцами со стороны катода |
1-комнатная квартира Горизонт 17 кв 109 в Ольгинке, г. Туапсе, с. Ольгинка, мкр. Горизонт, 17, кв. 109 — цены, отзывы, фото — забронировать
Фото 1 из 12
Фото 1 из 12
Фото 2 из 12
Фото 3 из 12
Фото 4 из 12
Фото 5 из 12
Фото 6 из 12
Фото 7 из 12
Фото 8 из 12
Фото 9 из 12
Фото 10 из 12
Фото 11 из 12
Фото 12 из 12
Площадь: 35 м2
Число гостей: до 4
Доп. места: бесплатно
Удобства:
шкаф, комод, стулья, диван-кровать, обеденный стол, кухонный стол, туалетный столик, вешалка, посуда
Техника:
телевизор, спутниковое ТВ, холодильник, СВЧ, электрочайник, кондиционер, фен
- санузел и душ в квартире (совмещены)
Рабочая группа по новым противотуберкулезным препаратам
SQ109 — это новый низкомолекулярный препарат на основе 1,2-этилендиамина с 3 уникальными механизмами действия, которые отличаются от других антибиотиков, используемых для лечения туберкулеза (ТБ).
Исследование фазы 2b завершено и опубликовано в России: Борисов С.Е., Богородская Е.М., Волченков Г.В., Кульчавеня Е.В., Марьяндышев А.О., Скорняков С.Н., Талибов О.Б., Тихонов А.М., Васильева И.А. ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ РЕЖИМА ХИМИОТЕРАПИИ С SQ109 ПРИ НЕСКОЛЬКИХ ЛЕКАРСТВЕННО-УСТОЙЧИВЫХ ТУБЕРКУЛЕЗАХ.Туберкулез и болезни легких. 2018; 96 (3): 6-18. https://doi.org/10.21292/2075-1230-2018-96-3-6-18.
Из аннотации: Цель исследования: оценить эффективность и безопасность SQ109, используемого в стандартных схемах лечения туберкулеза с множественной лекарственной устойчивостью (МЛУ ТБ). Предметы и методы. Многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование проводилось в двух параллельных группах с 21 сентября 2012 г. по 30 сентября 2016 г. в 6 исследовательских центрах, расположенных в 5 городах Российской Федерации.Основные результаты. 1. Прекращение бактериовыделения, подтвержденное посевами на жидких средах, к концу 6-го месяца интенсивной фазы химиотерапии у пациентов с МЛУ-ТБ легких, получавших SQ109, наблюдалось достоверно чаще по сравнению с режимами лечения, содержащими только существующие противотуберкулезные препараты: как для ITT-популяция (61,0% против 42,9%, p = 0,0412) и PP-популяция (79,7% против 61,4%, p = 0,0486). 2. Не было статистически значимых различий в достижении конверсии мокроты между группами, но к концу 8-й недели мокрота преобразовалась у 52% пациентов в группе, получавшей SQ109, по сравнению с 38% в группе, принимавшей плацебо. .Среднее время прекращения бактериальной экскреции, подтвержденное посевом на жидких средах, в группе SQ109 составило 56 дней, а в группе плацебо — 84 дня. 3. Применение SQ109 вместе с базовой химиотерапией при легочном МЛУ-ТБ не привело к увеличению частоты нежелательных явлений, ухудшению их степени тяжести, развитию новых вариантов нежелательных явлений по сравнению с базовым противотуберкулезным лечением этой группы пациентов в комбинация с плацебо. 4. Результаты исследования позволяют сделать вывод о том, что SQ109 — эффективный препарат, удовлетворительно переносимый (совместимый с переносимостью плацебо), входящий в состав комплексной этиотропной химиотерапии больных легочным МЛУ-ТБ.
В предыдущих лабораторных исследованиях SQ109 продемонстрировал отличную активность против лекарственно-чувствительных и мультирезистентных M. tuberculosis, включая штаммы ТБ с широкой лекарственной устойчивостью. SQ109 также увеличивал активность противотуберкулезных препаратов изониазида, рифампицина и бедаквилина и сокращал более чем на 30% время, необходимое для лечения мышей от экспериментального ТБ. SQ109 может заменить одно или несколько текущих противотуберкулезных препаратов, упростить терапию и сократить время лечения. Компания Infectex, Ltd предоставила права на разработку и коммерциализацию SQ109 в Российской Федерации и Содружестве Независимых Государств компании Sequella, Inc., 2011г.
SQ109 в настоящее время находится под контролем компании Sequella в США IND и завершил три исследования фазы 1 в США и два исследования фазы 2 у пациентов с лекарственно-чувствительным туберкулезом в Африке в дополнение к исследованию фазы 2b-3 в России.
SQ109 нацелен на MmpL3, мембранный переносчик мономиколята трегалозы, участвующий в донорстве миколовой кислоты в ядро клеточной стенки Mycobacterium tuberculosis
РЕЗЮМЕ
SQ109, 1,2-диамин, связанный с этамбутолом, в настоящее время проходит клинические испытания для лечения туберкулез, но механизм его действия остается неясным.Здесь мы демонстрируем, что SQ109 нарушает сборку клеточной стенки, о чем свидетельствуют анализы включения макромолекул и ультраструктурные анализы. SQ109 препятствует сборке миколиновых кислот в ядре клеточной стенки Mycobacterium tuberculosis, поскольку бациллы, подвергшиеся воздействию SQ109, демонстрируют немедленное ингибирование продукции димиколата трегалозы (TDM) и не могут прикрепить миколаты к арабиногалактану клеточной стенки. Эти эффекты не были связаны с ингибированием синтеза миколата, поскольку общие уровни миколата не были затронуты, а вместо этого приводили к накоплению мономиколата трегалозы (TMM), предшественника TDM и миколатов клеточной стенки. Анализы in vitro с использованием очищенных ферментов показали, что это не связано с ингибированием секретируемых миколилтрансфераз Ag85. Нам не удалось добиться спонтанного образования устойчивых к SQ109 мутантов; однако аналоги этого соединения, которые приводили к аналогичному прекращению синтеза TDM с сопутствующим накоплением TMM, были использованы для спонтанного образования устойчивых мутантов, которые также были перекрестно устойчивы к SQ109. Полногеномное секвенирование этих мутантов показало, что все они имели мутации в основном гене mmpL3 , который кодирует трансмембранный транспортер.Наши результаты предполагают, что MmpL3 является мишенью для SQ109 и что MmpL3 является переносчиком микобактериального TMM.
ВВЕДЕНИЕ
Туберкулез (ТБ) остается убийцей номер один людей, инфицированных одним инфекционным агентом во всем мире, и, по оценкам, треть населения мира латентно инфицирована Mycobacterium tuberculosis, этиологическим агентом ТБ (70) . Текущий короткий курс химиотерапии требует минимум 6 месяцев лечения, состоящего из 2-месячной интенсивной фазы лечения препаратами изониазид (INH), рифампицином, пиразинамидом и этамбутолом (EMB) с последующим 4-месячным продолжением терапии с Только изониазид и рифампицин (72).Этот режим лечения может обеспечить 95% излечение в условиях клинических испытаний, где обеспечивается оптимальная помощь пациентам, но глобальные показатели излечения намного ниже. Движущим фактором низких показателей излечения является отказ пациентов от химиотерапии из-за увеличенной продолжительности лечения, когда раннее прекращение химиотерапии увеличивает риск развития лекарственной устойчивости. По оценкам, почти 4% всех случаев туберкулеза в мире имеют множественную лекарственную устойчивость (71), причем число случаев лекарственной устойчивости ежегодно увеличивается.Таким образом, срочно необходимы новые препараты для сокращения продолжительности химиотерапии туберкулеза, а также для борьбы с лекарственно-устойчивым туберкулезом (4).
Биосинтез клеточной стенки микобактерий исторически был особенно уязвимой мишенью для химиотерапевтических вмешательств, так как многие препараты, используемые в клинической практике для лечения туберкулеза, нацелены на синтез миколиновой кислоты (INH, этионамид и тиацетазон) или арабинановых (EMB) компонентов клетки. конверт (3, 6, 34, 39). Стенка микобактериальной клетки состоит из ковалентно связанного комплекса трех гетерополимеров, пептидогликана, арабиногалактана и миколовой кислоты, часто называемого комплексом миколила-арабиногалактан-пептидогликан (12, 13).Эта сложная сборка образует асимметричный нефлюидный монослой, украшенный на своей поверхности нековалентно связанными «капсульными» липидами, такими как мономиколат трегалозы (TMM), димиколат трегалозы (TDM), сульфолипиды, фенольные гликолипиды и димикозерозаты фтиоцерина (PDIM). в виде сложных полисахаридов и небольшого количества белка (рис.1) (17, 22, 35). Несмотря на наше понимание химических структур, участвующих в комплексе клеточной стенки, наши знания о механистических деталях их сборки остаются неполными, и наше понимание их точной организации все еще развивается (27, 57, 74).
Рис. 1Схематическое изображение микобактериальной клеточной стенки и предполагаемый путь, участвующий в процессинге и экспорте миколиновой кислоты (12, 63) (адаптировано с разрешения ссылки 16a). На рисунке показаны некоторые компоненты клеточной стенки, при этом основное внимание уделяется мономиколату трегалозы (TMM) и димиколату трегалозы (TDM). Гипотетические или предлагаемые шаги обозначены серыми стрелками, а вопросительные знаки в скобках представляют собой еще не идентифицированные гипотетические белки / ферменты. Легенда на вставке представляет формы, используемые для изображения показанных компонентов.Обратите внимание, что диаграмма не в масштабе и не включает подробные структуры или все компоненты клеточной стенки микобактерий.
Миколиновые кислоты представляют собой длинноцепочечные (от C 70 до C 90 ) α-алкил, β-гидроксижирные кислоты, обнаруженные непосредственно с концевыми арабинозными звеньями основного комплекса, а также в большом количестве сложных эфиров дисахарида трегалозы. как TMM и TDM (5, 50). Эти длинноцепочечные липиды являются основными медиаторами гидрофобного характера клеточной оболочки и образуют плотно упакованный непроницаемый монослой (12, 44, 45, 51, 67).Агент первой линии INH ингибирует биосинтез миколиновой кислоты комплексом синтазы жирных кислот II микобактерий посредством нескольких механизмов (66), что приводит к потере TMM и TDM и миколатов, прикрепленных к арабинану клеточной стенки. EMB, с другой стороны, подавляет биосинтез арабиногалактанового компонента клеточной стенки микобактерий (62). Точный механизм действия EMB неясен, хотя известно, что он нацелен на интегральные мембранные арабинозилтрансферазы, участвующие в переносе арабинана на галактановый компонент клеточной стенки, при этом мутации устойчивости преимущественно отображаются на арабинозилтрансферазу, кодируемую embB (68). .Обработка EMB приводит к накоплению как TDM, так и TMM из-за потери арабинановых акцепторных сайтов для миколатов в клеточной стенке (49).
EMB был выбран из аналогов молекулы свинца N , N ‘-диизопропилэтилендиамина, которые, как было установлено, обладают активностью против M. tuberculosis in vitro и in vivo (59). EMB был включен в стандартные схемы химиотерапии, когда было обнаружено, что он лучше переносится, чем пара -аминосалициловая кислота, и позволил сократить общую продолжительность химиотерапии с 24 до 18 месяцев в клинических испытаниях (21, 41).Этамбутол обладает умеренной эффективностью против M. tuberculosis in vitro (МИК, 10 мкМ) и из-за токсичности для глаз может вводиться людям только в дозах, которые дают пиковые концентрации в сыворотке менее чем в 2 раза выше МИК, что приводит к субоптимальное воздействие из-за его быстрого выведения (период полувыведения из сыворотки 4 ч) (73). Однако благоприятные физико-химические свойства этамбутола в сочетании с его низкой цитотоксичностью стимулировали поиск улучшенных аналогов этилендиамина с улучшенной активностью против M.туберкулез in vitro . Используя комбинаторный подход твердофазного синтеза, было протестировано более 63000 аналогов и почти 3000 прошли повторный скрининг на ингибирование роста M. tuberculosis (40). Из 69 наиболее эффективных аналогов, которые были повторно синтезированы в миллиграммах, два соединения имели субмикромолярные значения МИК, а одно, SQ109, { N ‘- (2-адамантил) — N — [(2E) -3,7-диметилокта. -2,6-диенил] этан-1,2-диамин}, обладал низкой цитотоксичностью, а также улучшал эффективность in vivo и против M.туберкулез (55). Было показано, что SQ109 превосходит EMB in vitro , а также in vivo (33), обладает благоприятными фармакокинетическими свойствами и, что важно, было показано, что он накапливается в легких, месте заражения M. tuberculosis (32). . Накопление в очаге инфекции может быть критическим параметром, определяющим эффективность препарата (54), что еще раз подчеркивает потенциальную полезность SQ109 для химиотерапии туберкулеза. Замена EMB на SQ109 в схемах сочетания лекарств приводит к улучшенному клиренсу бактерий из инфицированных тканей животных, что побудило клиническую оценку этого соединения в фазе I клинических испытаний для определения безопасности (53).SQ109 сейчас входит в испытания для оценки ранней бактерицидной активности у пациентов с легочным туберкулезом (Michael Hoelscher, Clinicaltrials.gov ID NCT01218217, Национальные институты здравоохранения, 2011 г .; http://clinicaltrials.gov/).
Несмотря на прогресс SQ109 в клинической разработке, механизм действия SQ109 остается неуловимым. Его синтез был основан на общем ядре N , N ‘-изопропилэтилендиамина, что привело к открытию EMB. Первоначальный скрининг, который идентифицировал SQ109, был основан на активации промотора оперона iniBAC (40), при этом влияние SQ109 на экспрессию белков, кодируемых iniBAC , было впоследствии подтверждено протеомными исследованиями (31).Оперон iniBAC кодирует набор генов с неизвестной функцией, хотя они, по-видимому, необходимы для работы неидентифицированного насоса, который обеспечивает низкий уровень лекарственной устойчивости у Mycobacterium bovis и M. tuberculosis (15). Эти гены сильно активируются многими ингибиторами синтеза клеточной стенки (1, 11). Однако было обнаружено, что механизм действия SQ109 отличается от механизма действия EMB и N , N ‘-изопропилэтилендиамина, поскольку он сохраняет полную активность против EMB-устойчивых изолятов M.tuberculosis (55), в результате профили транскрипции M. tuberculosis отличались от результатов для EMB и N , N ‘-изопропилэтилендиамина (11) и не вызывали быстрого истощения связанных с клеточной стенкой сахаров арабинозы. связанные с лечением EMB (11).
В текущем исследовании мы провели биохимический анализ для определения пути, нарушенного SQ109. SQ109 ингибирует включение de novo -синтезированных миколиновых кислот в M.клеточная оболочка туберкулеза сильнее, чем EMB, не влияя на общий уровень миколата. Анализ клеточных миколатных пулов показал, что SQ109 вызывает истощение пулов TDM с сопутствующей активацией уровней TMM, и было показано, что этот эффект не связан с активностью миколилтрансфераз антигена 85 (Ag85), которые, как известно, участвуют в превращении TMM в TDM (рис. 1) (7) и перенос миколатов на клеточную стенку (18, 29, 56). Наша гипотеза заключалась в том, что SQ109 ингибирует активность системы оттока TMM, и это было дополнительно подтверждено открытием, что мутации в основном гене mmpL3 , кодирующем трансмембранный переносчик неизвестной функции, придают устойчивость к SQ109 и родственным аналогам этилендиамина, но не EMB.Это открытие дополнительно подтверждает представление о том, что донором миколата для связанных с арабиногалактаном миколатов является TMM.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы, среды и условия роста М. tuberculosis h47Rv поддерживали в фазе логарифмического роста в жидкой культуре с использованием среды Миддлбрука 7H9 (Becton Dickinson, NJ), содержащей 0,05% (об. / об.) Твин 80 с добавлением ADC (альбумин-декстроза-каталаза), а твердые культуры поддерживали на агаре 7h21. (Becton Dickinson, NJ) с добавлением OADC (ADC, содержащего олеиновую кислоту).Все антибиотики были приобретены у Sigma-Aldrich (Сент-Луис, Миссури), и все радиохимические препараты были приобретены у PerkinElmer, Inc. ADT (6-азидо-6-дезокси-α, α’-трегалоза) для анализов ингибирования Ag85 был любезно предоставлен К.М. Бэкуса (2). M. tuberculosis выращивали при 37 ° C, а жидкие культуры размножали с использованием роликовых бутылей. Escherichia coli BL21 (DE3) был приобретен у Invitrogen (Life Technologies), и культуры были выращены в среде LB для получения белков Ag85, как указано в Контракте на материалы для тестирования и исследования противотуберкулезной вакцины в Университете штата Колорадо (TBVTRM-CSU) (http: / / www.cvmbs.colostate.edu/mip/tb/).
Определение МИКи ранние анализы аэробного уничтожения. МИК определяли с использованием метода 2-кратного разбавления бульона с МИК, представленной как концентрация лекарственного средства, которая полностью подавляет весь видимый рост после 1 недели роста (69). Анализы аэробного уничтожения проводили с использованием 10-кратных концентраций МИК соответствующих соединений. Жидкие культуры, выращенные до оптической плотности при 650 нм (OD 650 ) ∼0,3, разбавляли в 100 раз перед добавлением соответствующих соединений.Образцы объемом в сто микролитров отбирали в дни 0, 1, 2, 3, 4, 6, 8, 11, 14 и 21 и последовательно разводили в трех экземплярах, и разведения помещали в планшеты в двух экземплярах и инкубировали в течение 4-6 недель перед оценка роста M. tuberculosis путем подсчета количества КОЕ.
Анализы включения макромолекул. Пяти миллилитровые культуры M. tuberculosis выращивали до OD 650 ∼0,3 перед добавлением радиоактивно меченных предшественников. Использовали десять микрокюри на миллилитр [4,5- 3 H] 1-лейцина (60 Ки / ммоль) и [1- 3 H] N -ацетил-d-глюкозамин (5 Ки / ммоль). для мониторинга биосинтеза белка и пептидогликана соответственно.Десять микрокюри на миллилитр [5,6- 3 H] урацила (40 Ки / ммоль) использовали для мечения общих нуклеиновых кислот (TNA) на основании отчетов, описывающих его эффективное включение как в РНК, так и в ДНК у микобактерий (61). Конкретные значения активности и воздействия были получены из аналогичных исследований на M. tuberculosis, где было показано, что поглощение было линейным в течение этого времени (38, 47). Культуры инкубировали в течение 1 ч с последующим добавлением SQ109 в концентрациях от 0 до 10-кратных значений MIC. После 10 ч воздействия SQ109 культуры центрифугировали, осадок клеток ресуспендировали в 500 мкл фосфатно-солевого буфера (PBS) и разрушали путем взбивания шариков с использованием инструмента MagNA Lyser (Roche) и шариков из диоксида циркония.Макромолекулы осаждали добавлением равного объема 20% ледяной трихлоруксусной кислоты (TCA) с последующей инкубацией на льду в течение 30 минут. Осадок собирали на фильтрах Whatman GF / C и тщательно промывали ледяной 10% TCA, и включенную радиоактивность измеряли с помощью жидкостного сцинтилляционного счета.
Анализы электронной микроскопии. M. tuberculosis в средней логарифмической фазе (OD 650 = 0,2) обрабатывали 10-кратным МИК SQ109 (20 мкМ), EMB (62,5 мкМ) или INH (2 мкМ) в течение 48 ч перед сбором клеток и двукратной промывкой PBS, содержащим 0.05% Твина 80 (об. / Об.) (PBST). Для сканирующей электронной микроскопии (SEM) осадки клеток ресуспендировали в 1/10 объема PBST и 50 мкл суспензии наносили на Si-чипы (Ted Pella, Inc.). Клеткам давали возможность прикрепиться к чипу в течение 15-20 минут, после чего следовали две промывки PBST. Затем чипы фиксировали 2,5% глутаральдегидом в 0,1 М буфере какодилата натрия. Вся последующая обработка проводилась в лабораторной микроволновой системе Pelco Biowave (Ted Pella, Inc.) при 250 Вт и 20 дюйм.Вакуум ртутного столба. Затем чипсы фиксировали смесью 1% тетроксида осмия и 0,8% феррицианида калия в 0,1 М какодилате натрия с последующей промывкой водой и дегидратацией в серии градиентных этанолов. Образец сушили до критической точки в сушилке Bal-Tec CPD 030 (Bal-Tec AG) и покрывали 80 Å иридием с использованием ионно-лучевого распылителя IBS (South Bay Technology, Inc.). Образцы SEM получали с помощью SEM Hitachi SU8000 (Hitachi High Technologies). Для просвечивающей электронной микроскопии гранулы клеток фиксировали в 2.5% глутаральдегид в 0,1 М буфере какодилата натрия (pH 6,5). Гранулы постфиксировали в микроволновой печи с использованием 1% тетроксида осмия — 0,8% феррицианида калия в 0,1 М какодилате натрия, затем 1% дубильной кислоты в дистиллированной воде и окрашивали en bloc 1% водным раствором уранилацетата. Затем их промывали дистиллированной водой и дегидратировали в серии градиентных этанолов. Затем гранулы пропитывали и заливали смолой Spurr, которая полимеризовалась в течение ночи в печи при 68 ° C. Тонкие срезы (90 нм) вырезали с помощью ультрамикротома UC6 (Leica Microsystems) и окрашивали 4% водным раствором уранилацетата и цитратом свинца Рейнольдса перед просмотром на Hitachi H-7500 (Hitachi High Technologies) при 80 кВ.Цифровые изображения были получены с помощью цифровой камеры Hammamatsu XR-100 (AMT).
Мечение липидов, экстракция и анализ. Радиоактивное мечение липидов M. tuberculosis 14 C-ацетатом проводили путем добавления натриевой соли [1,2- 14 C] уксусной кислоты (PerkinElmer Inc.) при конечная концентрация 2 мкКи / мл (1 Ки / ммоль) культуры с OD 650 ∼0,3. Было обнаружено, что включение радиоактивной метки было линейным до 18 часов в этих условиях (теперь показаны результаты).Аликвоты культур объемом пять миллилитров отбирали в указанное время и центрифугировали, а осадок клеток использовали непосредственно для анализа общих клеточных липидов с использованием протокола метилэтерификации для получения метиловых эфиров миколовой кислоты (MAME) и метиловых эфиров жирных кислот (FAME), как описано ранее. (60). Для анализа экстрагируемых полярных липидов осадок клеток экстрагировали 5 мл CHCl 3 -CH 3 OH (2: 1) при 50 ° C в течение ночи, а затем пробирки повторно центрифугировали. Осадок содержал фракцию липидов, ковалентно связанных с клеточной стенкой, тогда как экстракт растворителя содержал экстрагируемую фракцию нековалентно связанных полярных липидов (включая TMM и TDM).Осадок клеток обрабатывали для выделения MAME и FAME для анализа, как описано выше, тогда как экстрагированные липиды сушили и повторно растворяли в CHCl 3 -CH 3 OH (2: 1) для последующего анализа.
Тонкослойная хроматография (ТСХ) для анализа экстрагируемых липидов проводилась с использованием пластин силикагеля 60 размером 20 на 20 см (EMD Chemicals, Inc.), и для разделения использовались различные системы растворителей на основе липидных видов и требуемое разрешение. Для визуализации MAME и FAME материал, содержащий 10000 имп / мин, был разбавлен равным объемом ацетона и нанесен на планшеты для ТСХ, которые были трижды проявлены с использованием петролейного эфира-диэтилового эфира (85:15) (60).Для одномерного анализа экстрагируемых полярных липидов в планшеты для ТСХ загружали образцы, как описано выше (за исключением того, что экстрагируемые липиды растворяли в CHCl 3 -CH 3 OH, 2: 1), и планшеты проявляли в любом CHCl 3 -CH 3 OH-NH 4 OH (80: 20: 2) (7) или CHCl 3 -CH 3 OH-H 2 O (62: 25: 4) (49). Двумерный ТСХ-анализ экстрагируемых полярных липидов проводили с использованием следующей системы растворителей: первое измерение, CHCl 3 -CH 3 OH-H 2 O (62: 25: 4), затем CHCl 3 -CH 3 COOH-CH 3 OH-H 2 O (50: 60: 2.5: 3) для разделения во втором измерении. Пластины для ТСХ сушили на воздухе и визуализировали с помощью фосфорного сканера (Typhoon Trio), а денситометрию проводили с использованием прилагаемого программного обеспечения ImageQuant (GE Healthcare).
Очистка и анализ активности белкаAg85. Рекомбинантные белки Ag85A, -B и -C были экспрессированы и очищены с использованием плазмидных систем pMRLB41 (для Ag85A), pMRLB47 (для Ag85B) и pMRLB16 (для Ag85C) и протоколов, как указано Автор: TBVTRM-CSU (http: //www.cvmbs.colostate.edu/mip/tb/). Нативные Ag85A, -B и -C были также получены из TBVTRM-CSU для анализа активности. Ферментативные анализы Ag85 проводили с использованием ранее описанного протокола (36).
Синтез SQ109 и его аналогов. SQ109 синтезировали, как описано ранее (40). Подробная методология и схемы, использованные в химическом синтезе аналогов SQ109, используемых в данном исследовании, включены в дополнительный материал. Соединения DA5 и DA8 были приобретены в ChemBridge Corporation (Сан-Диего).
Выделение и генетическая характеристика мутантов, перекрестно устойчивых к SQ109. Соединения DA5 (SRI 356596) и DA8 (SRI 391844) были первоначально идентифицированы в ходе скрининга на ингибирование роста M. tuberculosis, который проводился в Южном научно-исследовательском институте как часть исследования. Программа MLPCN и часть программы по приобретению и координации противомикробных препаратов для лечения туберкулеза заключают контракты N01-AI-95364 и NO1-AI-15449 (24). Мутанты M. tuberculosis, устойчивые к DA5 и DA8, выделяли путем высева 10-кратных серийных разведений жидких культур, выращенных до OD 600 ~ 1.5 на планшеты, содержащие 40 мкМ DA5 и 21,1 или 42,2 мкМ DA8 соответственно. Чашки инкубировали в течение 4 недель, после чего наблюдали рост. Колонии были собраны, выращены в жидкой среде и подвергнуты тестированию MIC с использованием DA5, DA8 и SQ109. Один изолят, устойчивый к DA5, и по одной колонии от каждого из двух изолятов, устойчивых к DA8, были отправлены на секвенирование хромосомной ДНК и анализ однонуклеотидного полиморфизма (SNP). Библиотеки полногеномных фрагментов получали с использованием набора для подготовки образцов с парными концами Illumina.Образцы ДНК были гибридизованы в проточной кювете с использованием набора для создания кластеров с парными концами, версия 2 (Illumina, San Diego, CA), и перенесены в анализатор генома IIx, и было выполнено 50 циклов секвенирования с использованием 36-циклового секвенирования. комплект, версия 3 (Illumina, Сан-Диего, Калифорния). Sequencing Control Studio версии 2.5 использовалась с интегрированной версией анализа в реальном времени 1.5.35.0 на анализаторе генома IIx, а для анализа использовалась версия 1.5.0 конвейера. Полученные от 8 до 11 миллионов считываний были сопоставлены с геномом h47Rv с использованием bwa, версия 0.5.9 (42) и преобразован в файл .sam, а затем в файл .bam с помощью программы samtools версии 1.17 (43). Файл .bam был отсортирован, дубликаты удалены, SNP были вызваны с помощью SAMtools mpileup (были задействованы расширенные вычисления BAQ). Сообщалось только о гомозиготных SNP высокого качества (> 200). Онлайн-программы TMHMM (http://www.cbs.dtu.dk/services/TMHMM-2.0/) и TMpred (http://www.ch.embnet.org/software/TMPRED_form.html) использовались для прогнозирования топология предполагаемого белка MmpL3.
РЕЗУЛЬТАТЫ
In vitro кинетика уничтожения SQ109.Чтобы определить, проявляет ли SQ109 бактериостатическую или бактерицидную активность против M. tuberculosis, были выполнены анализы выживания in vitro и . Аэробные периодические культуры подвергали воздействию EMB, INH, аналога SQ109 NIH59 (40, 55) и SQ109, и выживание клеток отслеживали в течение 21 дня (рис. 2). SQ109 и его аналог NIH59 снижают жизнеспособность клеток в ранней культуре и проявляют активность, аналогичную INH, известному бактерицидному агенту M. tuberculosis (26). Кроме того, EMB и SQ109 снижали выживаемость микобактерий примерно на 5 log к 21 дню (рис.2).
Рис. 2In vitro активность SQ109. Выживаемость M. tuberculosis после воздействия 10 × MIC EMB, INH, NIH59 и SQ109 в аэробных условиях. Пакетные культуры размножали в присутствии указанных лекарств, и образцы отбирали для определения количества КОЕ путем посева в указанные дни. Увеличение количества КОЕ при лечении изониазидом связано с возникновением спонтанной резистентности, как сообщалось ранее (8).
Наблюдалось увеличение количества бацилл в периодической культуре, подвергшейся воздействию INH после 4 дней воздействия, что можно объяснить высокой скоростью появления устойчивости к INH, наблюдаемой в условиях in vitro и (8).Мы также не смогли выделить спонтанные мутанты SQ109, когда M. tuberculosis высевали на агаре, содержащем 5- или 10-кратную МИК SQ109, или при попытках создания устойчивых мутантов в серийной жидкой культуре при различных концентрациях SQ109, тогда как мутанты INH были выделены при заявленные частоты (данные не показаны). Эти результаты свидетельствуют о том, что SQ109 ингибирует важную мишень, где мутации в остатках, критических для связывания SQ109, не допускаются, или возможно, что это соединение ингибирует несколько мишеней.
SQ109 влияет на ковалентное прикрепление липидов к клеточной оболочке. Исследования транскрипционного профилирования показали, что SQ109 имеет механизм действия, отличный от EMB (11). Чтобы подтвердить, что основной эффект SQ109 по-прежнему направлен на клеточную оболочку, мы провели анализы включения макромолекул для количественной оценки белков, нуклеиновых кислот и биосинтеза клеточной стенки с использованием радиоактивно меченных предшественников. Эти результаты продемонстрировали, что SQ109 не ингибировал включение урацила, 1-лейцина или N -ацетил-d-глюкозамина в качестве маркеров синтеза нуклеиновой кислоты, белка и пептидогликана, соответственно, при концентрациях ниже МИК, хотя ингибирование было очевидно, особенно для биосинтеза пептидогликана, при концентрациях выше его МПК (рис.3А). Напротив, обработка клеток SQ109 с последующей радиоактивной меткой 14 C-ацетатом показала быстрое и резкое снижение липидов, ковалентно связанных с клеточной стенкой, после обработки SQ109. EMB, напротив, приводил к более постепенному снижению ковалентно связанных липидов (рис. 3B). Это быстрое ингибирование ковалентно связанных липидов не отражалось в общем количестве свободных липидов ни с SQ109, ни с EMB (фиг. 3C). Таким образом, SQ109, по-видимому, специфически влияет на прикрепление, а не на биосинтез липидов к клеточной стенке микобактерий во время сборки.
Рис. 3Анализы включения макромолекул показывают, что SQ109 ингибирует включение предшественников во время биосинтеза клеточной стенки. (A) Культуры были помечены [4,5- 3 H] 1-лейцином, [1- 3 H] N -ацетил-d-глюкозамином и [5,6- 3 H] урацила в течение 1 ч для мониторинга биосинтеза белка, пептидогликана и общего количества нуклеиновых кислот, соответственно, при воздействии различных концентраций SQ109 на основе его MIC. (B и C) SQ109 ингибирует включение предшественника в липиды клеточной стенки.Пакетные культуры подвергали воздействию концентраций EMB и SQ109 10 × МИК в течение указанного времени с последующим мечением 14 C-ацетатом в течение 1 часа. Клетки собирали и экстрагировали CHCl 3 -CH 3 OH (2: 1), и экстракт растворителя содержал полярные экстрагируемые липиды, тогда как липиды, ковалентно связанные с клеточной стенкой, оставались в нерастворимом материале. (B) Радиоактивность, извлеченная из осадка, экстрагированного растворителем после омыления (представляющая ковалентно связанные липиды клеточной стенки), демонстрирующая быстрое уменьшение включения 14 C в липиды, связанные с клеточной стенкой, при обработке SQ109.(C) Радиоактивность, извлеченная в экстракте растворителя перед омылением (представляет собой экстрагируемые полярные липиды).
Влияние SQ109 на ультраструктуру клеточной стенки. Затем мы проанализировали ультраструктурные изменения, которые произошли в M. tuberculosis после обработки SQ109 и другими известными ингибиторами сборки клеточной стенки, с помощью сканирующей и просвечивающей электронной микроскопии (рис. 4). Сканирующая электронная микроскопия показала, что клетки M. tuberculosis демонстрируют значительную неровность поверхности после обработки SQ109 (рис.4Ai). Подобно клеткам, обработанным INH (фиг. 4Aii) и обработанным EMB (фиг. 4Aiii), клетки, обработанные SQ109, были немного короче, чем необработанные клетки (фиг. 4Aiv). Количественная оценка длины клеток от 150 бацилл для каждой обработки показала, что все три ингибитора клеточной стенки уменьшали длину клеток примерно на 30% (см. Фиг. S1 и таблицу S1 в дополнительном материале). Обработка всеми тремя ингибиторами клеточной стенки аналогичным образом приводила к клеткам с большим поперечным диаметром, а необработанные клетки имели ширину 0.36 ± 0,03 мкм (среднее ± стандартное отклонение) и обработанных SQ109 клеток, имеющих ширину 0,43 ± 0,04 мкм (см. Таблицу S1). Просвечивающая электронная микроскопия срезов, вырезанных из идентично обработанных фиксированных клеток, показала, что обработка SQ109 привела к накоплению электронно-непрозрачного материала в области, отделяющей плазматическую мембрану от электронно-просветного каркаса клеточной стенки (рис. 4Bi и ii). Эта плотная зона была больше похожа на внешний вид клеток, обработанных INH (фиг. 4Biii и iv), но выглядела более выраженной.Клетки, обработанные SQ109, очень сильно отличались от необработанных (фиг. 4Bvii и viii) и обработанных EMB (фиг. 4Bv и vi) клеток, что согласуется с отдельным механизмом ингибирования клеточной стенки.
Рис. 4Ультраструктурные изменения, связанные с лечением SQ109, параллельны изменениям, наблюдаемым при лечении INH и EMB. (A) Сканирующие электронные микрофотографии M. tuberculosis, обработанных 10 × MIC SQ109 (i), EMB (ii) или INH (iii) в течение 48 часов, в отличие от необработанных клеток (iv), показывают сокращение клеток на лекарственном препарате. экспозиция.Масштабная линейка: 1 мкм. (B) Электронные микрофотографии M. tuberculosis, обработанных 10 × MIC SQ109 (i, ii), INH (iii, iv) или EMB (v, vi), в отличие от необработанных клеток (vii, viii), показывающие продольные (i, iii, v, vii) и поперечные (ii, iv, vi, viii) сечения репрезентативных клеток соответственно. Шкала шкалы: 100 нм. Обработанные клетки показывают утолщение слоя клеточной стенки всеми тремя агентами.
SQ109 ингибирует прикрепление миколатов к клеточной стенке и TDM, что приводит к накоплению TMM.Анализы включения макромолекул и ультраструктурные анализы показали, что мишень SQ109 была связана со сборкой клеточной стенки, что согласуется с активацией оперона iniBAC и ранее сообщенным увеличением содержания арабинозы в клеточной стенке при воздействии SQ109 (11). Чтобы еще больше сузить цель, мы исследовали влияние SQ109 на прикрепление миколиновых кислот к скелету клеточной стенки. После экстракции периферически связанных липидов омыление ковалентно связанных липидов клеточной стенки показало, что все три класса заякоренных арабиногалактаном миколатов быстро истощаются (рис.5А). Недавно синтезированные миколаты, прикрепленные к клеточной стенке, не были обнаружены в течение 75 минут после обработки SQ109. Напротив, EMB приводил к постепенному уменьшению количества миколатов, прикрепленных к клеточной стенке, которые все еще определялись после 5 часов лечения лекарственными средствами (фиг. 5A). Обработка клеток SQ109 не влияла на общий пул жирных кислот и миколатов (фиг. 6A и B) в период времени, в течение которого этот препарат отменял прикрепление миколатов к клеточной стенке (фиг. 5).
Рис. 5Миколатные липидные профили M. tuberculosis при воздействии лекарств.Бактерии в периодических культурах подвергали воздействию концентраций EMB и SQ109 10 × МИК в течение 1 ч, а затем метили 14 С-ацетатом. Клетки собирали в указанные моменты времени, и осадки экстрагировали CHCl 3 -CH 3 OH (2: 1). (A) Анализ ТСХ MAME и FAME, выделенных из гранул после удаления свободных липидов с помощью экстракции CHCl 3 -CH 3 OH. Система растворителей: петролейный эфир-диэтиловый эфир (85:15). Фигура демонстрирует потерю включения миколиновых кислот, синтезированных de novo , в клеточную стенку при воздействии SQ109, в отличие от результатов для контроля EMB.(B) Профили экстрагируемых липидов (экстракт осадка CHCl 3 -CH 3 OH), показывающие накопление TDM при воздействии EMB, как сообщалось ранее (49), и потерю продукции TDM при обработке SQ109. Система растворителей: CHCl 3 -CH 3 OH-NH 4 OH (80: 20: 2).
Рис. 6Общие профили миколиновой кислоты и жирных кислот (внутриклеточные и связанные с клеточной стенкой) из клеток M. tuberculosis при обработке SQ109. Клетки обрабатывали, как описано для фиг. 5, без предварительной экстракции хлороформ-метанол для удаления свободных липидов, демонстрируя, что SQ109 не снижает биосинтез миколиновой кислоты.(A) ТСХ-анализ общего количества выделенных MAME и FAME. (B) Радиоактивность, выделенная из осадка клеток после этерификации, для определения общего содержания 14 ° C, включенного в миколиновые кислоты и жирные кислоты.
Уровни TDM в экстрагируемой липидной фракции постепенно повышаются после обработки EMB (рис. 5B), как сообщалось ранее (49), предположительно в результате накопления миколатов в TDM в результате исчезновения концевых сайтов присоединения гексарабинофуранозида для миколаты.В отличие от этого, обработка SQ109 привела к немедленной потере детектируемого TDM даже в самые короткие проанализированные моменты времени (рис. 5B). Несмотря на быструю потерю миколиновых кислот как в скелете клеточной стенки, так и в TDM, анализ общего количества жирных кислот путем омыления целых клеток показал, что чистые уровни миколиновой кислоты в значительной степени не изменились даже после 3 часов лечения препаратом.
Влияние SQ109 на продукцию TDM побудило нас взглянуть на уровни TMM выше по течению, поскольку эта молекула является вероятным предшественником TDM и миколатов клеточной стенки (65).Анализ ТСХ с использованием ранее описанной системы растворителей (49) привел к лучшему разделению и разделению этих липидов (фиг. 7A). Как и ожидалось, пятна, соответствующие TMM и TDM, отсутствовали в культуре, обработанной INH, из-за полного ингибирования биосинтеза миколиновой кислоты, тогда как накопление TDM наблюдалось в образце, обработанном EMB (фиг. 7A). Продукция TDM была отменена при обработке SQ109, но наблюдалось соответствующее увеличение интенсивности пятна, соответствующего TMM, по сравнению с необработанным контролем (рис.7А). Денситометрический анализ изображения дополнительно подтвердил, что обработанные SQ109 клетки M. tuberculosis утратили способность продуцировать TDM с сопутствующим накоплением TMM (фиг. 7B). Чтобы исключить любую двусмысленность из-за сопредельных видов липидов, была проведена 2-мерная ТСХ с использованием тех же образцов, которые четко продемонстрировали накопление TMM в обработанных SQ109 культурах по сравнению с его уровнями при обработке INH или EMB (рис. 7C). Ингибирование продукции TDM происходило дозозависимым образом (см.рис.S2 в дополнительном материале).
Рис. 7Обработка SQ109 приводит к потере биосинтеза TDM и накоплению TMM. (A) ТСХ-анализ экстрагируемых полярных липидов после обработки EMB, INH и SQ109 (показаны точки, соответствующие TDM и TMM). Система растворителей: CHCl 3 -CH 3 OH-H 2 O (62: 25: 4). (B) Денситометрический анализ пятен, соответствующих TDM и TMM из панели A, при воздействии соответствующих лекарств, показывающий относительные уровни двух гликолипидов.(C) Двумерный анализ ТСХ и разделение экстрагируемых липидов, показывающий миграцию TDM и TMM и накопление TMM при обработке SQ109. Система растворителей: первое измерение (ось y ), CHCl 3 -CH 3 OH-H 2 O (62: 25: 4), и второе измерение (ось x ), CHCl 3 -CH 3 COOH-CH 3 OH-H 2 O (50: 60: 2,5: 3). CONT, контроль.
SQ109 не подавляет переэтерификацию, опосредованную антигеном 85.Белки Ag85 представляют собой миколилтрансферазы, способные катализировать переэтерификацию миколиновых кислот между рядом акцепторов (2). Перенос миколиновой кислоты между двумя молекулами TMM приводит к образованию одного TDM и свободной трегалозы (7). Поскольку SQ109 ингибирует продукцию TDM и приводит к накоплению TMM в M. tuberculosis, белки Ag85 оценивали на их чувствительность к ингибированию SQ109. Нативные и рекомбинантные белки Ag85A, -B и -C очищали и анализировали в реакциях миколилтрансферазы, как описано ранее, с использованием известного ингибитора Ag85 6-азидо-6-дезокси-α, α’-трегалозы (ADT) в качестве положительного контроля ( 7).EMB и NIH59 (см. Рис. 9A) также были включены в этот анализ (рис. 8). При добавлении в конечной концентрации 200 мкМ ADT ингибировал миколилтрансферазную активность нативного белка Ag85C на 69%, как сообщалось ранее (7), тогда как EMB, NIH59 и SQ109 в аналогичных концентрациях не ингибировали фермент в этих условиях (рис. 8). ). Вместо этого наблюдалось небольшое усиление активности фермента, возможно, из-за улучшенной солюбилизации субстратов и продуктов (таблица 1). Этот эффект наблюдался для всех трех изоформ Ag85 (таблица 1).Эти результаты демонстрируют, что потеря in vivo и переноса миколата арабиногалактана на клеточную стенку и накопление TMM SQ109 не были следствием прямого ингибирования миколилтрансфераз Ag85.
Рис. 8SQ109 не является ингибитором миколилтрансферазы Ag85. Показаны анализы ингибирования с использованием нативного Ag85C из M. tuberculosis (36). Известный ингибитор Ag85 6-азидо-6-дезокси-α, α’-трегалоза (ADT) использовали в качестве положительного контроля, а EMB и NIH59 использовали в качестве отрицательного контроля.Обозначены точки, соответствующие TDM и TMM. Система растворителей для анализа ТСХ: CHCl 3 -CH 3 OH-NH 4 OH (80: 20: 2).
Таблица 1Влияние SQ109 и ADT a на активность миколилтрансфераз Ag85A, Ag85B и Ag85C
Мутации в MmpL3 придают устойчивость к SQ109 и его аналогам. Несмотря на неоднократные попытки как на твердой, так и на жидкой среде, мы не смогли выбрать для спонтанных мутантов, устойчивых к SQ109. Поэтому мы исследовали родственные соединения в надежде, что они хотя бы частично будут иметь один и тот же сайт связывания и, возможно, позволят выработать устойчивость.NIH59 продуцировал профили транскрипции в обработанных клетках M. tuberculosis, которые были очень похожи на профили транскрипционных профилей клеток, обработанных SQ109, что позволяет предположить, что это соединение влияет на аналогичную мишень (11). Чтобы убедиться, что другие аналоги SQ109 имеют механизм действия, аналогичный SQ109, мы наблюдали за характерным исчезновением TDM и накоплением TMM в клетках при воздействии соединений. Тестирование MIC показало, что полное восстановление геранильной группы SQ109 (DBK7) или замена ее другой адамантильной группой (DBK13) приводило лишь к небольшому снижению активности по сравнению с таковой у SQ109 (рис.9А). Замена адамантильной и геранильной групп другими объемными группами также незначительно снижает активность, как это видно в случае NIH59. Обработка клеток до 10-кратной их соответствующих концентраций МИК с последующим мечением 14 С-ацетатом и липидным анализом показала, что все эти аналоги SQ109 (DBK7, DBK13 и NIH59) аналогичным образом подавляли синтез TDM одновременно с накоплением TMM (рис. 9). Кроме того, мы проанализировали два родственных соединения (DA5 и DA8), которые были идентифицированы в ходе высокопроизводительного химического скрининга на M.tuberculosis, которые также значительно активировали оперон iniBAC (D. A. Alland, неопубликованные результаты). Эти соединения также содержат характерную аминоадамантильную (или амидоадамантильную) группу SQ109 и аналогичным образом ингибируют синтез TDM одновременно с накоплением TMM (рис. 9).
Рис. 9Идентификация адамантилдиаминов и родственных соединений, которые сохраняют способность ингибировать продукцию TDM в M. tuberculosis. (A) Идентификация аналогов SQ109 и адамантиламинов / амидов, которые ингибируют рост M.туберкулез. Показаны структуры соединений, синтезированных в текущем исследовании (серия DBK) и идентифицированных при скрининге на ингибирование роста M. tuberculosis (серия DA), а их МИК указаны в скобках. (B) Способность соединений ингибировать продукцию TDM у M. tuberculosis.
DA5 и DA8 имели значительно более высокие значения MIC, чем SQ109, что позволяет предположить, что они обладают пониженным сродством к мишени и, следовательно, могут более легко допускать мутацию мишени, которая может привести к устойчивости.Посев клеток M. tuberculosis на среду, содержащую DA5 или DA8, приводил к появлению устойчивых мутантов с умеренной частотой примерно 1 из 10 7 клеток. Были выделены два резистентных к DA5 (5_1 и 5_2) и три резистентных к DA8 (8_1, 8_2 и 8_3) мутанта, и было обнаружено, что все пять мутантов обладают перекрестной устойчивостью к SQ109 (таблица 2). Чтобы идентифицировать мутации, связанные с устойчивостью к DA5, DA8 и SQ109, были секвенированы геномы трех мутантов, 5_1, 8_2 и 8_3 соответственно.Все три мутанта имели однонуклеотидные переходные мутации, приводящие к полиморфизму замены в гене, кодирующем мембранный транспортный белок MmpL3 ( Rv0206c ), который является консервативным для всех микобактерий, для которых доступны последовательности генома. Мутант 5_1 имел переход G2098A, приводящий к замене аминокислоты A700T, тогда как мутанты 8_2 и 8_3 имели переход A119G, приводящий к изменению Q40R в предсказанной аминокислотной последовательности MmpL3. Мутант 5_1 независимо секвенировали второй раз, получая точно такой же результат.Помимо мутации mmpL3 , мутанты 8_2 и 8_3 имели мутацию перехода T → C в положении 2055375 в геноме M. tuberculosis h47Rv, который находится в межгенной области между открытыми рамками считывания Rv1812c и Rv1813c . , кодирующие предполагаемую дегидрогеназу и небольшой консервативный гипотетический белок, соответственно, оба из которых, как предполагается, секретируются и являются несущественными для M. tuberculosis (37, 58). Дальнейшее секвенирование mmpL3 мутанта, устойчивого к DA5 и DA8, дополнительно подтвердило, что однонуклеотидные полиморфизмы в этом гене были связаны с устойчивостью, причем один из них (8_1) несет новую мутацию, приводящую к замене аминокислоты L567P (Таблица 2 ).Эти результаты убедительно подтверждают, что мишенью SQ109 и родственных аналогов является важный трансмембранный переносчик, кодируемый mmpL3 . Обработка устойчивых мутантов SQ109 или аналогами показала, что продукция TDM подавлялась при концентрациях, превышающих их соответствующие концентрации MIC (см. Фиг. S3 и S4 в дополнительном материале). Роль MmpL3 в транспорте TMM к клеточной стенке д. Предполагать, что накопленный TMM будет потребляться внеклеточными миколилтрансферазами после удаления SQ109.Чтобы убедиться в этом, мы обрабатывали клетки 10-кратным МИК SQ109 с последующим радиоактивным мечением липидов. Затем клетки промывали для удаления радиоактивной метки и лекарства с последующим отрастанием. Последующий анализ экстрагируемых липидов методом ТСХ продемонстрировал, что накопленный TMM исчез, при этом радиоактивная метка появлялась в TDM в зависимости от времени (см. Фиг. S2 в дополнительном материале), причем большая часть радиоактивных меток, как ожидается, превратится в арабинановые миколаты.
Таблица 2Профили устойчивости и однонуклеотидного полиморфизма мутантов с перекрестной устойчивостью SQ109
ОБСУЖДЕНИЕ
Хотя SQ109 был разработан как аналог EMB, известного ингибитора биосинтеза арабиногалактана клеточной стенки, биохимические и транскрипционные данные ранее предполагали, что мишень SQ109 отличается от EMB.Здесь мы показали, используя анализы включения макромолекул для исследования эффектов на биосинтез белков, нуклеиновых кислот, пептидогликанов и липидов, что SQ109 быстро ингибирует прикрепление липидов к клеточной стенке. Это подтверждает наше более раннее предположение (11, 40) о том, что активация оперона iniBAC указывает на ингибирование биосинтеза клеточной стенки. Недавняя работа предполагает, что этот оперон кодирует не охарактеризованную помпу, обеспечивающую толерантность к нескольким лекарствам (15). Ультраструктурный анализ клеток, обработанных SQ109, подтвердил, что это привело к укорачиванию и расширению клеток, аналогичному тому, которое наблюдается с EMB и INH, которые влияют на сборку арабинанового и миколатного компонентов комплекса миколил-арабиногалактан-пептидогликан клеточной стенки соответственно ( Инжир.4).
Современные модели ядра клеточной стенки согласуются с внутренним листком, состоящим из монослоя параллельных цепей миколиновой кислоты, связанных с арабинаном, пересеченных наружным листком, состоящим из TDM и TMM (и других амфифилов), в результате чего получается плотно упакованный бислой. . Предлагается несколько теоретических моделей, объясняющих неожиданно тонкий и симметричный характер ядра (27, 74). Ингибирование прикрепления миколата либо непосредственно путем ингибирования его синтеза INH, либо путем ингибирования образования арабинана клеточной стенки, к которому миколиновые кислоты присоединяются посредством EMB, может поставить под угрозу проницаемость ядра клеточной стенки для окрашивающих реагентов или увеличить ассоциацию этого слоя. материалом с повышенными окрашивающими характеристиками (48).SQ109 приводит к быстрому уменьшению присоединения миколиновых кислот к арабиногалактановому комплексу клеточной стенки, а также к TDM (рис. 5) и связан с падением жизнеспособности клеток (рис. 2). Потеря миколатов клеточной стенки не была связана с ингибированием их биосинтеза, поскольку общие миколатные пулы не были затронуты (рис. 6). Одновременно с потерей переноса миколата на клеточную стенку или TDM, TMM накапливался в клетках, обработанных SQ109 (фиг. 7). Эта серия метаболических эффектов отличается от эффектов любых известных ингибиторов M.сборка клеточной стенки туберкулеза, включая EMB и INH.
Биосинтез миколиновых кислот комплексом Fas-II и комплексом ацил-кофермент А карбоксилаза (AccA3 / AccD4) / ацил-AMP лигаза (FadD32) / поликетидсинтаза 13 (Pks13) подробно описан (см. Ссылки 5 и 50), но этапы их транспорта через клеточную мембрану и прикрепления к клеточной стенке не ясны (63). Текущая модель предполагает, что редуктаза, кодируемая геном Rv2509 , катализирует заключительную реакцию во время биосинтеза миколиновой кислоты, превращая β-кетогруппу, оставшуюся от конденсации α-ветви с предшественником меромиколата, в β-гидроксильную группу (10). , скорее всего пока они еще прикреплены к Pks13.За этим следуют последовательные стадии, катализируемые гипотетическими миколилтрансферазами I и II, которые опосредуют перенос миколиновых кислот от Pks13 к носителю манноза-P-гептапренол (9) и трегалозе, соответственно, что в конечном итоге приводит к образованию TMM внутри ячейку (рис.1) (63). Затем TMM экспортируется из клетки неопознанным переносчиком, который, как предполагается, является переносчиком семейства АТФ-связывающих кассет (ABC) (63). Оказавшись вне клетки, белки антигена 85 (Ag85A, -B и -C) опосредуют перенос миколата от одной молекулы TMM к другой, давая TDM, а также от TMM к арабиногалактану клеточной стенки (рис.1) (7). Также было продемонстрировано, что очищенные миколилтрансферазы Ag85 могут преобразовывать TMM в TDM in vitro (7) и что делеция гена Ag85C значительно снижает содержание миколиновой кислоты в клеточной стенке M. tuberculosis (29). События между восстановлением β-кетогруппы миколатов и их прикреплением к клеточной стенке или отложением в TDM неизвестны (рис. 1).
Влияние SQ109 на уровни TDM и TMM имитирует фенотип мутантов миколилтрансферазы Corynebacterium.Индивидуальное нарушение любого из пяти Ag85-подобных генов снижает перенос миколатов на клеточную стенку, что приводит к истощению TDM и накоплению TMM (18, 56). Демонстрация того, что ингибирование переноса миколатов с образованием TDM и арабиногалактана клеточной стенки не связано с ингибированием секретируемых миколилтрансфераз Ag85 (рис. 8 и таблица 1), единственных известных белков, способных выполнять два описанных процесса (7), предполагает, что SQ109 и другие активные соединения, указанные на рис.9 должен ингибировать стадию, предшествующую стадии, катализируемой белками Ag85, тем самым предотвращая доступ миколилтрансфераз к TMM. Согласно принятой в настоящее время модели (рис. 1), есть три ключевых гипотетических белка, которые еще предстоит идентифицировать. К ним относятся две дополнительные миколилтрансферазы (I и II), участвующие в образовании TMM, и мембранный транспортер, который выкачивает TMM из клетки (63). Поскольку TMM все еще продуцируется в присутствии SQ109, гипотетические миколилтрансферазы I и II, по-видимому, не подвержены влиянию этого соединения, в результате чего транспортер TMM остается главным кандидатом для ингибирования SQ109.
Нам не удалось создать спонтанные устойчивые к SQ109 мутанты, чтобы подтвердить эту гипотезу, предполагая, что соединение ингибирует важную мишень, где аминокислотные остатки, критические для связывания SQ109, одинаково важны для функции мишени или что связывающие взаимодействия были достаточно сильные, чтобы единичные мутации не могли вызвать резистентность. Учитывая относительно большую и высокогидрофобную природу SQ109, большая поверхность связывания не является маловероятной, что затрудняет развитие резистентности за счет замены одной аминокислоты.Тем не менее, нельзя исключить возможность того, что это соединение влияет на другие вторичные мишени в клетках. Используя аналоги SQ109, которые, как мы биохимически продемонстрировали, имеют тот же механизм действия, но демонстрируют более слабую активность, мы смогли создать устойчивые мутанты, которые показали 2-8-кратную перекрестную устойчивость к SQ109 (Таблица 2). Большинство этих аналогов имеют общую структуру ядра этилендиамина и приводят к потере образования TDM с сопутствующим накоплением TMM (рис. 9). Тот факт, что эти соединения позволили генерировать спонтанно устойчивые мутанты, предполагает, что аминокислотные остатки, важные для связывания этих соединений, не были теми же остатками, которые управляют связыванием SQ109.Умеренная перекрестная устойчивость этих мутантов к SQ109 (таблица 2) подтверждает это мнение. Пересеквенирование всего генома трех из этих мутантов выявило мутации в основном гене mmpL3 (19). Мутации в mmpL3 были также идентифицированы еще у двух устойчивых мутантов (таблица 2). MmpL3 был очень привлекательным кандидатом в качестве насоса TMM, поскольку это единственный белок этого семейства, выполняющий важную функцию.
Белки MmpL принадлежат к семейству мембранных белков устойчивости, нодуляции и деления клетки (RND), которые участвуют в транспорте различных лигандов из клетки под действием энергии протонной движущей силы (52).Эти белки обычно содержат 12 трансмембранных спиралей с большими петлями между трансмембранными сегментами 1 и 2, а также 7 и 8, которые являются внецитоплазматическими и участвуют в распознавании субстрата (23). Используя алгоритмы прогнозирования топологии, мутация в штамме 5_1 (A700T) была сопоставлена с основанием последней трансмембранной спирали (номер 12) и, по прогнозам, будет расположена на внешней стороне клеточной мембраны. Мутации Q40R в штаммах 8_2 и 8_3 картированы в первой экстрацитоплазматической петле между трансмембранными спиралями 1 и 2, которая, как известно, важна для распознавания субстрата в других родственных белках.Поскольку обе мутации изменили аминокислоты, предположительно расположенные за пределами трансмембранных спиралей, возможно, что эти мутации уменьшают / изменяют способность SQ109 и других родственных соединений связываться и ингибировать функцию мутантных белков MmpL3, что приводит к устойчивости. В исследовании, в котором изучалась роль всех 13 генов mmpL M. tuberculosis , было продемонстрировано, что ген mmpL3 был единственным важным членом этого семейства, поскольку попытки удалить этот ген были безуспешными (19).Таким образом, наши результаты предполагают, что белок MmpL3 является наиболее вероятной клеточной мишенью для SQ109 и родственных соединений (фиг. 9A) и что MmpL3, таким образом, является вероятным переносчиком TMM. Другие белки MmpL также кодируют переносчики цитоплазматически синтезируемых липидов, и их несущественность объясняется тем фактом, что ни один из этих липидов не является существенным для роста in vitro . Например, было показано, что белок MmpL7 участвует в транспорте открытого на поверхность липида фтиоцерола димикоцерозата (PDIM) через клеточную мембрану (14).Кроме того, было показано, что белок MmpL8 участвует в транспорте предшественника сульфолипида SL-1 через клеточную мембрану (16, 20). Интересно, что заключительные стадии биосинтеза и транспорта связаны как для MmpL7, так и для MmpL8. В обеих системах фермент терминальной поликетидсинтазы прикреплен к транспортируемому липидному субстрату, а в случае MmpL7 было показано, что он физически взаимодействует с PpsE, последней поликетидсинтазой, участвующей в биосинтезе PDIM (30).В случае MmpL8 этерификация гидроксифтиоцерановых кислот до диацилтрегалозо-сульфата напрямую связана с экспортом сульфолипида-1 (16, 20). Сравнение известных механизмов экспорта PDIM и SL-1 с конечными стадиями биосинтеза миколиновой кислоты предполагает дополнительное сходство между этими тремя процессами. Предшественники миколиновых кислот остаются связанными с ацильным доменом-носителем Pks13 до поздней, еще не определенной стадии (63). Следовательно, возможно, что Pks13 и MmpL3 функционируют аналогично тому, как это делают белки PksE-MmpL7 и Pks2-MmpL8, которые участвуют в экспорте PDIM и SL-1, соответственно.Трансфераза, которая этерифицирует миколиновую кислоту до трегалозы, не зависит от функции MmpL3, поскольку накопление TMM происходит, когда функция MmpL3 ингибируется, в отличие от MmpL8, делеция которого отменяет перенос гидроксифтиоцерановых кислот (16, 20).
В заключение, наши результаты предполагают, что MmpL3 является переносчиком TMM и что образование TDM и закрепление миколиновых кислот на клеточной оболочке требует экспорта TMM. Это открытие хорошо согласуется с предлагаемой в настоящее время моделью процессинга и экспорта миколиновой кислоты, поскольку участие белков MmpL в транспорте липидов, по-видимому, является общей темой для микобактерий.Первоначальное увеличение биосинтеза пептидогликана, наблюдаемое в настоящем исследовании, с последующим его ингибированием, а также ранее сообщаемое увеличение содержания арабинозы в клеточных стенках M. tuberculosis, обработанных SQ109 (11), хорошо согласуется с этой моделью, поскольку правильная сборка миколил Комплекс арабиногалактан-пептидогликан требует скоординированного биосинтеза всех трех компонентов (25). Следовательно, ингибирование биосинтеза одного из его компонентов может привести к краткосрочным компенсаторным эффектам и увеличению продукции других компонентов до полного прекращения и гибели клеток.Ингибирование биосинтеза миколиновой кислоты такими лекарствами, как INH (64), биосинтез пептидогликана бета-лактамами (28), разветвление синтеза арабинана клеточной стенки с помощью EMB (49, 62) и ингибирование эпимеризации остатков рибозы, необходимых для арабинана. Синтез бензотиазинонов (46) подчеркивает крайнюю уязвимость механизма сборки комплекса миколила-арабиногалактан-пептидогликан клеточной стенки у M. tuberculosis и предполагает, что могут быть другие, еще не использованные мишени для лечения ТБ.
БЛАГОДАРНОСТИ
В этой работе использовалась сеть центров производства молекулярных библиотек NIH (MLPCN; www.mli.nih.gov).
Это исследование финансировалось (частично) Программой внутренних исследований NIAID, NIH (для C.E.B.), а частично — стипендией UNCF / Merck для научных исследований (для R.W.).
Мы с благодарностью благодарим W. R. Jacobs, Jr. (Медицинский колледж Альберта Эйнштейна) за помощь в работе по секвенированию.
- Авторские права © 2012, Американское общество микробиологии.Все права защищены.
Оценка SQ109, высоких доз рифампицина и моксифлоксацина у взрослых с легочным туберкулезом с положительным мазком мазка в дизайне MAMS — полный текст
Эта фаза II, многопрофильная, многоэтапная, открытая, проспективно рандомизированная В контролируемом клиническом исследовании будет сравниваться эффективность и безопасность четырех экспериментальных схем с контрольной стандартной схемой лечения у пациентов с туберкулезом легких (ТБ) с положительным мазком мокроты. Всего будет четыре экспериментальных режима.Участники будут случайным образом распределены по контролю или одному из четырех экспериментальных режимов интенсивной фазы в соотношении 2: 1: 1: 1: 1. Контрольная и 4 экспериментальных схемы:
Контроль: изониазид HRZE, стандарт рифампицина, пиразинамид, этамбутол Группа 1: изониазид HRZQlow, стандарт рифампицина, пиразинамид, SQ109 150 мг Группа 2: изониазид HRZQhigh, стандарт рифампицина, пиразигинамид, SQ10920 300 мг кг, пиразинамид, SQ109 300 мг Группа 4: изониазид HR20ZM, рифампицин 20 мг / кг, пиразинамид, моксифлоксацин 400 мг
До 372 участников будут рандомизированы в это исследование, при этом 124 участника будут рандомизированы в контрольную группу и 62 участника в каждую экспериментальную группу.При ожидаемой потере для последующего наблюдения 5% окончательная мощность исследования по выявлению коэффициента риска 1,8 для конверсии культуры в отрицательную будет 90% при 5% уровне значимости.
Участники будут рандомизированы с использованием алгоритма вероятностной минимизации, основанного на месте, исходной бактериальной нагрузке, измеренной с помощью GeneXpert MTB / RIF®, и ВИЧ-статусе. Выделенная интенсивная фаза четырех экспериментальных групп будет проводиться ежедневно в течение двенадцати недель. В течение этого времени участники будут еженедельно посещать исследовательскую клинику для сбора мокроты, контроля безопасности и получения исследуемого лекарства.После завершения экспериментального лечения участники экспериментальных групп будут получать ежедневное лечение стандартной фазы продолжения в течение 14 недель, содержащее стандартные дозы RIF и INH, для завершения курса лечения туберкулеза. Участники контрольной группы получат восемь недель интенсивного лечения четырьмя препаратами (HRZE, затем 18 недель продолжительного лечения в фазе HR в соответствии с текущими рекомендациями ВОЗ.
)Все участники будут получать 25 мг витамина B6 (пиридоксина) с каждой дозой лечения, чтобы предотвратить невропатию, связанную с INH.
Промежуточные анализы эффективности будут проводиться во время испытания в заранее определенное время с целью выявления экспериментальных групп, которые работают ниже заранее установленного порога эффективности. Дальнейшего набора в это оружие не будет.
Гидроксилирование кандидата в противотуберкулезные препараты, SQ109, микобактериальным цитохромом P450
Abstract
Распространение штаммов с множественной лекарственной устойчивостью (MDR) самого смертоносного патогена Mycobacterium tuberculosis (Mtb) вызывает потребность в новых эффективных лекарствах.SQ109 показал активность против резистентных Mtb и уже прошел клинические испытания фазы II / III. Быстрая деградация SQ109 приписывается цитохрому P450 печени человека (CYP). Однако информации о взаимодействиях препарата с цитохромами Mtb нет. Здесь мы показываем, что Mtb CYP124, ранее отнесенный к метил-разветвленной липидмонооксигеназе, связывает и гидроксилатирует SQ109 in vitro . Кристаллическая структура комплекса CYP124 – SQ109 с разрешением 1,25 Å однозначно показывает две конформации лекарственного средства, обе расположены для гидроксилирования ω-метильной группы в транс-положении.Предположительно, гидроксилированный SQ109 образует стабилизирующие Н-связи со своей мишенью, микобактериальным мембранным белком Large 3 (MmpL3). Мы ожидаем, что Mtb CYP могут функционировать как аналоги метаболизирующих лекарства человеческих CYP, влияющих на фармакокинетику и фармакодинамику противотуберкулезных (противотуберкулезных) препаратов.
Введение
По данным Всемирной организации здравоохранения, туберкулез (ТБ) является одной из 10 основных причин смерти во всем мире. МТБ — основная причина смерти от одного инфекционного агента [1].В последнее время в многочисленных исследованиях сообщается о распространении штаммов с множественной лекарственной устойчивостью и широкой лекарственной устойчивостью, которые в последнем случае невозможно вылечить с помощью противотуберкулезных препаратов первого и даже второго ряда [2,3]. Угроза требует разработки новых лекарств для противотуберкулезной терапии, определения их мишеней и оценки их метаболической стабильности.
Одним из последних достижений в этой области стало открытие SQ109 [4], который в настоящее время проходит фазу II / III клинических испытаний для лечения туберкулеза легких с множественной лекарственной устойчивостью [5].SQ109 относится к 1,2-этилендиаминовому классу противотуберкулезных препаратов [6], состоящему из адамантановой головки и геранилового хвоста, которые, как предполагается, нарушают синтез сложной клеточной стенки Mtb [7]. На данный момент описано по крайней мере три механизма действия препарата [8]. Во-первых, он подавляет транспорт мономиколатов трегалозы посредством MmpL3 из цитоплазмы. Во-вторых, он подавляет дыхание, блокируя биосинтез менахинона MenA и MenG. Наконец, он действует как разобщитель, разрушая градиент pH и мембранный потенциал.SQ109 продемонстрировал многообещающее ингибирование роста клеток и очень низкий уровень спонтанной лекарственной устойчивости [6,7]. SQ109 показал активность in vitro и против известных устойчивых штаммов Mtb [6] и M. bovis BCG [9]. Он также обладает бактерицидным действием против M. smegmatis (Msm) и M. aurum , хотя и с пониженной активностью [9]. Более того, SQ109 активен против немикобактерий [10–13]. Исследования in vivo продемонстрировали эффективность SQ109 на модели мышиного туберкулеза [4].SQ109 также синергетически взаимодействует с другими противотуберкулезными препаратами, такими как рифампицин (RIF), изониазид и бедаквилин [9,14], что имеет решающее значение для комбинированной терапии [15].
SQ109 эффективно метаболизируется микросомами печени человека, собак, животных и мышей [16]. Было высказано предположение, что цитохромы P450 (CYP), CYP2D6 и CYP2C19 в первую очередь ответственны за метаболизм у людей. Однако, насколько нам известно, до сих пор не сообщалось о взаимодействии с Mtb CYP. Здесь мы показываем, что Mtb CYP124 может связывать и гидроксилировать SQ109.CYP124 (ген Rv2266) ранее приписывал активность по отношению к липидам с разветвленным метилом изопреноидного происхождения [17–20]. Здесь мы показываем, что SQ109 связывается с CYP124 с Kd app = 3,4 ± 0,3 мкМ и превращается в моногидроксилированный продукт с числом оборотов 0,60 ± 0,09 мин -1 . Мы получили кристаллическую структуру с разрешением 1,25 Å, которая выявила две близкие конформации SQ109, подтверждающие образование ω-концевого гидрокси-продукта. Наконец, учитывая молекулярный докинг, мы предполагаем, что вновь образованная гидроксильная группа SQ109 влияет на его связывание с предполагаемой мишенью для лекарственного средства, т.е.е., MmpL3, стабилизирующий SQ109-OH в связывающем кармане [21]. Наши результаты подтверждают гипотезу о том, что SQ109 является пролекарством, активируемым Mtb CYP. CYP124 представляет собой первый пример предполагаемого класса микобактериальных CYP, которые могут функционировать аналогично метаболизирующим лекарства человеческим CYP.
Результаты
CYP124, CYP125 и CYP142 связывают SQ109
Множественные субстраты были ранее идентифицированы для CYP124, включая холестерин, витамин D, их производные [18,20] и липиды с разветвленными метильными группами [17].Хотя его физиологическая функция (и, следовательно, естественный субстрат) еще не подтверждена, существует общий образец среди всех субстратов — метильный разветвленный хвост, плотно расположенный для ω-гидроксилирования в дистальном участке. Поэтому мы протестировали кандидатный противотуберкулезный препарат SQ109 как субстрат CYP124, поскольку его гераниловый хвост хорошо имитирует группу 2,5-диметилгексана.
Мы провели спектрофотометрический анализ титрования для оценки аффинности связывания лекарственного средства с активным центром.Разностный спектр CYP124 в УФ-видимой области показывает реакцию типа I при добавлении SQ109 с характерным пиком при 386 нм и впадиной при 421 нм, что соответствует известным метильноразветвленным субстратам [17,18,20] (рис. 1а). ). Кривая титрования соответствует модели сильного связывания с Kd app = 3,4 ± 0,3 мкМ. Значение аналогично значению для холест-4-ен-3-она (холестенон) 3,4 ± 0,6 мкМ и намного выше, чем для витамина D3 (VD3) и 1α-гидрокси-витамина D3 (1αOHVD3), 18 ± 2 мкМ и 34 ± 4 мкМ соответственно [20].
Рис. 1. Связывание и гидроксилирование кандидата в лекарство SQ109 с помощью Mtb CYPsa-c , разностные спектры и кривые титрования Mtb CYP124, CYP125 и CYP142 с SQ109, соответственно. d , Образование продукта SQ109 под действием CYP124 в восстановленной системе, обнаруженное с помощью ВЭЖХ. e , Структурная формула SQ109. Пунктирными линиями показана фрагментация SQ109, обнаруженная в спектрах МС-МС. f , МС-МС спектры SQ109 (для исходного молекулярного иона m / z = 331.4) окрашен в синий цвет, а продукт SQ109 после гидроксилирования CYP124 (для исходного молекулярного иона m / z = 347,4) окрашен в красный цвет. На вставке показан ион фрагмента с m / z = 85,2, обнаруженный только в спектре продукта и соответствующий монооксигенированному хвостовому фрагменту SQ109 (исходный ион фрагмента необработанного SQ109 m / z = 69,2).
Помимо CYP124, мы также протестировали Mtb CYP125 и CYP142 на связывание с SQ109. Ранее предполагалось, что все эти ферменты обладают сходной субстратной специфичностью, поскольку они способны связывать и гидроксилировать холестерин и его иммуноактивные производные [19,20].Подобно CYP124, CYP125 показал ответ типа I при добавлении SQ109 (рис. 1b). Удивительно, но SQ109 вызвал сдвиг типа II в спектре CYP142 с пиком при 434 нм и минимумом при 414 нм (рис. 1c), что указывает на очевидное взаимодействие диаминовой группы с гемовым железом. По сравнению с CYP124, как CYP125, так и CYP142 связывают SQ109 со значительно более низкой аффинностью (Kd app = 41 ± 3 мкМ и 52 ± 11 мкМ, соответственно).
CYP124 катализирует гидроксилирование SQ109
Затем мы измерили каталитическую активность в восстановленной системе, содержащей CYP124 / 125/142, SQ109, окислительно-восстановительные партнеры и систему регенерации NADPH.ЖХ-МС обнаружил предполагаемый продукт через час инкубации. Из трех белков только CYP124 проявил активность против SQ109 с числом оборота 0,60 ± 0,09 мин -1 (рис. 1d). Хотя и CYP124, и CYP125 ранее демонстрировали близкую субстратную специфичность [20], различная стереометрия связывания [19] может объяснить отсутствие продукта для последнего. Впоследствии MS-MS идентифицировала продукт CYP124. Исходный молекулярный ион m / z составлял 331,4 для субстрата и 347,4 для продукта, что предполагает добавление одного атома кислорода к SQ109 (рис.1е). Группу адамантана легко идентифицировать по характерному пику 135,2 (рис. 1д). Пик 69,2 в спектре субстрата представляет особый интерес, поскольку он соответствует амилену и исчезает в спектре продукта. Напротив, в продукте появляется пик при 85,2, указывая на то, что CYP124 катализирует гидроксилирование SQ109 в амиленовой части.
Предыдущее исследование метаболизма SQ109 in vitro и с помощью МС-анализа показало, что SQ109 (m / z 331,5) эффективно трансформировался микросомами разных видов в четыре разных продукта с m / z 361 (M1), 347 (M2). ), 195 (M3) и 363 (M4) [16].Рекомбинантные CYP человека, CYP2D6 и CYP2C19, могут интенсивно метаболизировать SQ109 до M1 и M4, в то время как CYP2C19 может также продуцировать M2 и M3. Здесь мы показываем, что Mtb CYP124 также способствует метаболизму SQ109 и катализирует только химически неблагоприятное ω-гидроксилирование с m / z, соответствующим продукту M2.
Кристаллическая структура комплекса CYP124 – SQ109
Чтобы определить способ связывания и положение гидроксилирования, мы сокристаллизовали SQ109 с CYP124, как описано ранее [20].Структура комплекса CYP124 – SQ109 была определена с разрешением 1,25 Å (регистрационный номер банка данных белка PDB ID: 6T0J). Общая структура напоминает комплекс CYP124-VD3 (PDB ID: 6T0G; ссылка 20, Cα-Cα RMSD составляет 0,2 Å, рис. 2a). 2 mF o — DF c составная карта пропусков однозначно показывает плотность SQ109 в двух конформациях, которые различаются только этилендиамин-адамантановой частью. В то же время геранильные хвосты в обеих конформациях расположены в позиции 4.0 Å выше Fe в типичной геометрии для ω-гидроксилирования (рис. 3а). Можно четко определить, что ближайший к гемному железу углерод соответствует ω-метильной группе в транс-положении. Таким образом, CYP124 катализирует регио- и стереоселективное гидроксилирование SQ109.
Рис. 2. Структура комплекса CYP124 с субстратамиa , наложение свободного от субстрата CYP124 (PDB ID: 2WM5; ссылка 17, бледно-зеленый), CYP124 – SQ109 (светло-розовый) и CYP124 – VD3 (PDB ID: 6T0G; ref.20, голубой) строений. b , суперпозиция SQ109 (фиолетовый), VD3 (ID PDB: 6T0G; ссылка 20, зеленый), 1αOHVD3 (ID PDB: 6T0H; ссылка 20, розовый), холестенон (ID PDB: 6T0F; ссылка 20, оранжевый) и PA (PDB ID: 2WM4; ссылка 17, пурпурный). c-e , лиганд-связывающие полости CYP124 для апоформы, комплексов SQ109 и VD3 соответственно.
Рис. 3. Поза привязки SQ109 к CYP124, карман для привязки CYP124 с SQ109. Для ясности показаны только боковые цепи из ближайшего окружения. 2mF o — DF c Составная карта пропусков имеет контур 1σ. б , 2D-схема переплетного кармана. Слабая водородная связь с HOH879 (3,5 Å) наблюдается только для конформации A SQ109 c , mF o — DF c Карта с контуром 3σ на заключительном этапе уточнения, который был использован для строительства SQ109.
Связывание SQ109 вызывает сходные структурные перестройки, о которых ранее сообщалось для комплекса фитановой кислоты (PA), а также наблюдались для других субстратов [17,20] (Рис. 2a).Вкратце, парное движение αF (K184 – G199), петли BC (S89-D115) и выпрямление αI на N-конце (S253-T271) приводит к образованию узкого туннеля, подходящего для длинных метил-разветвленных углеводородов. . N-конец αD (K132 – A139) изгибается к проксимальной части гема, что способствует образованию предполагаемого сайта связывания для окислительно-восстановительного партнера. Наконец, петля FG (G199 – D208) и упорядоченная петля «крышка» (W55-H69) закрывают активный центр от растворителя. Результат этих переходов показан для комплексов без субстрата, SQ109 и VD3 (рис.2c-e соответственно).
Геранильный хвост плотно заключен в узкий туннель с расширением для размещения положения метильного разветвления ω-5 (метил у C3 в SQ109, рис. 3b). Напротив, адамантан и этилендиамин более свободно располагаются в широкой полости в верхней части связывающего кармана. Взаимодействия SQ109 в основном гидрофобные (L60, F63, T96 и F212 взаимодействуют с адамантаном; F107, I111, L198, L263, V266, A267, F416, I417 фиксируют алифатическую цепь), в то время как в преобладающей конформации (A) , препарат потенциально может образовывать слабую водородную связь с HOH879 (рис.3, а, б). Структура комплекса снова подчеркивает замечательную гибкость, которая позволяет CYP124 адаптироваться к различным химически разнородным субстратам. Действительно, суперпозиция всех известных субстратов показывает, что верхняя часть активного центра может приспосабливаться к существенно различным головным радикалам, в то время как метил-разветвленный хвост остается закрепленным для ω-гидроксилирования (рис. 2b; среднеквадратичное расстояние между восемью концевыми атомами углерода субстратов). не более 0,6 Å).
Две общие черты между субстратами CYP124 были ранее идентифицированы: метил-разветвленный хвост и полярная голова [17].Важность полярной группы остается неясной, поскольку в большинстве опубликованных комплексов она не образует Н-связей с белком [17,20]. Более того, в кристаллической структуре CYP124 – VD3 (PDB ID: 6T0G; ссылка 20) полярное A-кольцо разупорядочено в верхней части кармана (рис. 2e). Отсутствие стабилизирующих Н-связей могло привести к возникновению двух конформаций адамантановой группы. Хотя меньшая полярность головной группы вряд ли ухудшит цикл CYP, это может повлиять на скорость реакции, как мы ранее наблюдали для VD3 и 1αOHVD3 [20].
Обсуждение
Семейство CYP хорошо представлено в Mtb, при этом идентифицировано 20 генов, в то время как функция большинства все еще неизвестна. Их сохранение во время редуктивной эволюции генома [22] указывает на важность Mtb CYP для выживания и / или патогенности. Сродство микромолярного связывания и обнаруженная каталитическая активность CYP124 с SQ109, полученные в ходе исследования, указывают на потенциальную роль CYPs в метаболизме ксенобиотиков в Mtb. Учитывая кристаллическую структуру комплекса CYP124 – SQ109 и функциональный анализ, мы определили, что CYP124 гидроксилирует SQ109 по ω-метильной группе в транс-положении.Способность гидроксилировать SQ109 не была обнаружена для двух других ферментов CYP, метаболизирующих стероиды Mtb — CYP125 и CYP142, хотя оба они были способны связывать препарат.
SQ109 является высокоэффективным лекарством-кандидатом против Mtb и, в меньшей степени, против Msm, со значениями МИК 0,3–0,6 мкМ и 9,4 мкМ соответственно [8]. MmpL3 предлагается в качестве одной из основных мишеней соединения для обоих организмов. Действительно, некоторые мутации в гене MmpL3 приводят к появлению устойчивых штаммов [7,23].Кристаллическая структура Msm MmpL3 в комплексе с SQ109 (PDB ID: 6AJG; ссылка 24) показала, что лекарство разрушает основные пары Asp-Tyr (D256-Y646 и Y257-D645), которые, по-видимому, имеют решающее значение для функции белка [24]. Однако SQ109 не блокирует активность флиппазы Mmpl3 в сферопластах, что указывает на другие молекулярные мишени [25]. Мы рассматриваем возможность того, что SQ109 является пролекарством, а не лекарством, которое сначала необходимо активировать CYP печени и / или Mtb. Это предположение было впервые сделано Chen et al. [9] основан на быстром метаболизме соединений микросомальными P450 [16]. Затем авторы предположили, что бактерицидная активность препарата может происходить от его метаболитов, потенциально продуцируемых микобактериальными цитохромами CYP. Они также заметили, что синергизм с RIF [9,14] может частично объясняться повышенным уровнем экспрессии CYPs в обработанных RIF микобактериях [26].
Чтобы проверить эту идею, мы провели молекулярную стыковку определенного метаболита — SQ109-OH с кристаллической структурой комплекса Msm MmpL3-SQ109 (PBD ID: 6AJG) [24].Структура показывает, что вновь образованная группа ОН может поместиться в карман связывания SQ109 и образовать благоприятные водородные связи (рис. 4а). Лучшие позы для стыковки подтверждают способность SQ109-OH к водородной связи либо с S301, либо с атомами кислорода основной цепи A637 и I297 (рис. 4c). Мы также выполнили молекулярный док-эксперимент, используя созданную модель на основе гомологии Mtb MmpL3. Его связывающий карман в некоторой степени аналогичен карману Msm, отличаясь только четырьмя остатками, а именно S301: A296, I319: T314, V638: L633 и L686: V681 (остаток в Msm: остаток в Mtb).Утраченная возможность водородного связывания с S301 в этом случае может быть компенсирована соединением с S295 (Рис. 4e) или Mtb-специфическим T314 (Рис. 4f), что также было подтверждено стыковкой. Дополнительная стабилизация SQ109-OH может способствовать ингибированию активности флиппазы, наблюдаемой для других препаратов, направленных на Mmpl3 [25], таких как AU1235 [27] и BM212 [28]. Таким образом, наши результаты идентифицируют первый пример Mtb CYP, участвующего в биотрансформации противотуберкулезных препаратов.
Рис. 4. Стыковка SQ109-OH в Msm и Mtb MmpL3a , Карман для привязки в кристаллической структуре Msm MmpL3-SQ109 (PDB ID: 6AJG; исх.24). b , стыковка SQ109 с Msm MmpL3, топ-3 стыковочных позы, полученных с помощью AutoDock Vina и повторно оцененных с помощью Convex-PL . c , стыковка SQ109-OH с Msm MmpL3, топ-3 стыковочных позы, полученных с AutoDock Vina . d , стыковка SQ109 с гомологически смоделированным Mtb MmpL3, первая позиция стыковки, полученная с помощью AutoDock Vina и повторно оцененная с помощью Convex-PL . e , стыковка SQ109-OH с Mtb MmpL3, топ-7 стыковочных поз, полученных с помощью AutoDock Vina и повторно оцененных с помощью Convex-PL . f , стыковка SQ109-OH с Mtb MmpL3, первая позиция стыковки, полученная с помощью AutoDock Vina . Остатки, различающиеся в карманах связывания Mtb и Msm MmpL3, подчеркнуты. Остатки, мутации в которых связаны с устойчивостью к SQ109, окрашены в красный цвет (Msm — Y257C, S293A / T и I297F; Mtb — S288T; ссылка 24). Возможные водородные связи показаны пунктирными линиями.
Активация пролекарств ферментами Mtb ранее была продемонстрирована для изониазида, пиразинамида и этионамида [29].Эти реакции катализируют различные классы ферментов: каталаза-пероксидаза, кодируемая геном katG [30], пиразинамидаза [31] и микобактериальные монооксигеназы Байера-Виллигера [32]. Также было показано, что ацетилтрансферазы и фосфотрансферазы Mtb дезактивируют аминогликозиды (противотуберкулезные препараты второго ряда). Превращение ксенобиотиков (включая противотуберкулезные соединения) в Mtb также было показано посредством N-алкилирования, амидирования, гидролиза сложного эфира и восстановления нитрогруппы [29]. В этой работе мы расширяем существующие знания и демонстрируем участие фермента Mtb CYP в гидроксилировании противотуберкулезного препарата.Учитывая важность этой группы ферментов в метаболизме ксенобиотиков у человека и значительное количество CYP в Mtb, мы предполагаем, что CYP Mtb могут участвовать в метаболизме различных классов соединений. В этом отношении оценка метаболизма кандидата в противотуберкулезные препараты с использованием всей клеточной системы [33,34] или изолированных ферментов Mtb может быть полезным инструментом в открытии противотуберкулезных препаратов.
Материалы и методы
Клонирование, экспрессия и очистка рекомбинантных CYP124
кДНК, кодирующих CYP125 (ген Rv3545c), CYP142 (ген Rv3518c) и CYP124 (ген Rv2266), были амплифицированы с помощью ПЦР геномной ДНК Mtb h47Rv Институт экспериментальной ветеринарии им. Вышелесского НАН Беларуси.Плазмиды экспрессии для каждого белка были созданы с использованием вектора pTrc99a. Белки экспрессировали и очищали, как описано ранее [18]. КДНК, кодирующая ферредоксин-1 шпината (Fdx1), была амплифицирована из общей РНК, выделенной из проростков Spinacia oleracea . Fdx1 был экспрессирован в E.coli и очищен с использованием металл-аффинной и анионообменной хроматографии.
Исследования связывания субстрата
Для определения констант связывания лиганда (значения Kd app ) CYPs, оптическое титрование выполняли с использованием двухлучевого спектрофотометра Cary 5000 UV-VIS NIR (Agilent Technologies, Санта-Клара, Калифорния) в Кварцевые кюветы с длиной оптического пути 1 см.Исходные растворы стероидов были приготовлены с концентрацией 10 мМ в 45% гидроксипропил-бета-циклодекстрине (HPCD). Титрование повторяли не менее трех раз, и Kd app рассчитывали, как описано ранее [18].
Анализ каталитической активности
Каталитическая активность CYP Mtb была восстановлена в 50 мМ фосфате калия (pH 7,4), содержащем 0,5 мкМ CYP, 2 мкМ шпината Fdx1, 0,5 мкМ адренодоксинредуктазоподобного флавопротеина (Arh2, мутант A18G), 100 мкМ субстрат, 1 мМ глюкозо-6-фосфат, 1 ед. / мл глюкозо-6-фосфатдегидрогеназы и 0.4 мМ β-НАДФН. Белки (CYPs, Fdx1 и Arh2) предварительно инкубировали со стероидными субстратами в буферном растворе в течение 10 мин при 30 ° C. Реакцию запускали добавлением системы, регенерирующей НАДФН, содержащей глюкозо-6-фосфат, глюкозо-6-фосфатдегидрогеназу и β-НАДФН. После 1 ч инкубации при 30 ° C реакцию останавливали, реакционную смесь экстрагировали и подвергали анализу LC-MS. Активность CYP124 оценивалась как число оборота — нмоль метаболизированного продукта / нмоль CYP / мин.
Идентификация продукта SQ109
Использовали прибор для ВЭЖХ Agilent серии 1200, оснащенный масс-спектрометром Agilent Triple Quad 6410. Образцы анализировали градиентным элюированием на колонке Zorbax Eclipse Plus C18 (2,1 × 50 мм; 1,8 мкм). TFA (0,1% об. / Об. В воде) использовали в качестве подвижной фазы A и ацетонитрил в качестве подвижной фазы B. Градиент составлял 20-50% B за 0-7 мин. Скорость потока составляла 400 мкл / мин. Температура колонки поддерживалась на уровне 35 ± 1 ° C. Масс-спектрометрические эксперименты проводились с источником ионизации электрораспылением (ESI) в режиме положительных ионов.Скорость потока распыляющего газа была установлена на 9,5 л / мин, температура осушающего газа — на 350 ° C, капиллярное напряжение — на 4000 В, а распылитель — на 35 фунтов на квадратный дюйм. Анализ ESI-MS / MS проводился в режиме «продукт-ион» с различными значениями фрагментатора (135, 150 и 200 В) и энергий столкновения (10 и 20 В).
Кристаллизация, сбор данных и определение кристаллической структуры
CYP124 – SQ109 кристаллизовали методом «сидячей капли» в 96-луночных планшетах для кристаллизации с коммерчески доступными наборами (Qiagen) при 20 ° C с соотношением белок / маточный раствор 1: 1 с концентрация лиганда 100 мкМ.Кристаллы получали из 0,3 М Mg (HCO 2 ) 2 и 0,1 М Трис pH 8,5. Глицерин (20%) в качестве криопротектора добавляли перед быстрым замораживанием в жидком азоте.
Дифракционные данные были собраны на канале ID23-1 Европейского центра синхротронного излучения (ESRF). Стратегия сбора данных была оптимизирована в BEST [35]. Данные обрабатывались в программном пакете XDS [36]. Статистика сбора кристаллографических данных представлена в таблице 1.
Таблица 1 Сбор кристаллографических данных и статистика уточненияФазовая проблема была решена путем молекулярной замены в Phaser [37] из PHENIX [38], где сгенерирована поли-ala модель свободного от субстрата CYP124 (код PDB ID 2WM5 ; ссылка 17) была использована в качестве стартовой модели. Пространственная группа была P12 1 1 и содержала одну молекулу на асимметричную единицу. Впоследствии модель была перестроена в PHENIX.AutoBuild [39]. Для уточнения модели использовались PHENIX.Refine [40] и Coot [41].На последних этапах уточнения карта mF o — DF c однозначно показывала SQ109 в активном сайте (рис. 4c). Окончательное отсечение разрешения определялось применением парного уточнения [42]. Качество полученной модели анализировали с помощью веб-сервера PHENIX.MolProbity [43] и Quality Control Check .
Фигуры, содержащие электронную плотность и молекулярные структуры, были получены с использованием PyMOL [44].
Молекулярный докинг
Трехмерный конформер SQ109-OH был создан в PyMOL [44] путем добавления гидроксигруппы к SQ109 из его комплекса с Msm MmpL3 (PDB ID: 6AJG; ссылка 24). Торсионные деревья лигандов были созданы в программе AutoDock Tools . Структура Msm MmpL3 была взята из его комплекса с SQ109 (PDB ID: 6AJG; ссылка 24). Структура Mtb MmpL3 была смоделирована с использованием веб-сервера Phyre 2 [45]. Модель первых 757 остатков была основана на гомологии с комплексом Msm MmpL3-ICA38 (PDB ID: 6AJJ; исх.24) со 100% достоверностью набрал Phyre 2 . Примечательно, что C-концевой домен Mtb MmpL3 (P758-L944) не моделировался из-за отсутствия покрытия выравнивания. Однако для стыковки он не использовался. Полярные водороды белковых молекул и лигандов были присвоены в PyMOL . Молекулярный докинг проводили по двум протоколам. Для первого мы использовали AutoDock Vina [46] с настройками по умолчанию, за исключением полноты , которая была установлена на 10.Для второго протокола мы использовали нашу собственную модификацию AutoDock Vina и функцию оценки Convex-PL [47] для восстановления, дополненную дополнительными дескрипторами, которые учитывают конформационную гибкость и сольватацию. Мы недавно применили этот протокол для предсказания позы в [48], где он обсуждается более подробно. Мы выполнили несколько симуляций AutoDock Vina , чтобы получить более разнообразные позы стыковки, и сгруппировали все результирующие конформации с порогом 1 Å с помощью RDKit [49].Чтобы подтвердить протоколы стыковки, мы сравнили стыкованные позы SQ109 с кристаллографическими (PDB ID: 6AJG; ссылка 24; рис. 4, a, b и d). Единственное существенное различие заключалось в амиленовой части молекулы, что может быть связано с низким разрешением структуры. Мы визуально проверили десять лучших поз для стыковки, созданных по обоим протоколам.
Рисунки, иллюстрирующие взаимодействия между белками SQ109-OH и MmpL3, были получены с использованием PyMOL [44] и PLIP [50].
Доступность данных
Структура CYP124 в комплексе с SQ109 была депонирована в банке данных белков под регистрационным номером 6T0J. Дифракционные изображения и данные обработки были депонированы в Integrated Resource for Reproducibility in Macromolecular Crystallography (http://proteindiffraction.org/). Другие данные и материалы доступны по запросу у соответствующих авторов.
Работы авторов
Концептуализация, A.Gi., N.S .;
Методика, В.Б., С.Г., А.Г., Н.С.;
Расследование, S.B., T.V., I.G., E.M., P.S., M.K., Ant.K., A.Gu., A.Gi., N.S .;
Writing — Original Draft, S.B .;
Writing — Review & Editing, S.B., V.B., N.S., A.Gi., E.M., S.G., M.K .;
Сбор средств, V.B., N.S., A.Gi.,
Надзор, V.B., N.S., A.Gi.
Конфликт интересов
A.Gi. является сотрудником ООО «МТ-Медикалс». Остальные авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Мы благодарим С.Фатыхаве и О. Бокуту за отличную техническую помощь. Мы благодарим профессора Риту Бернхардт (Саарландский университет, Саарбрюккен, Германия) за предоставление конструкции экспрессии для Arh2. Работа поддержана совместным исследовательским грантом Белорусского республиканского фонда фундаментальных исследований (Б20Р-061) и Российского фонда фундаментальных исследований (20-54-00005). Мы благодарим группу структурной биологии ESRF и особенно А. Н. Попова за его помощь в сборе кристаллографических данных.Мы также благодарим Объединенный центр структурной геномики NIH за веб-сервер проверки качества. Благодарим Елену Базанову (LTTC, МФТИ) за языковую редакцию.
SQ109 для лечения МЛУ-ТБ
Агентство: Департамент здравоохранения и социальных служб
Филиал: Национальные институты здоровья
Контракт: 1R43AI088952-01
Номер отслеживания агентства: AI088952
Количество: 599 797 долларов США.00
Фаза: Фаза I
Программа: SBIR
Код темы обращения: НИАИД
Номер запроса: PHS2010-2
Аннотация
ОПИСАНИЕ (предоставлено заявителем): SQ109 — это низкомолекулярный перорально активный препарат, новый кандидат в клинические разработки для лечения всех форм туберкулеза (ТБ), в том числе множественной лекарственной устойчивости (МЛУ) и крайней лекарственной устойчивости. (ШЛУ) ТБ.SQ109 имеет уникальный фармакологический профиль, безопасен и хорошо переносится животными (90-дневная доза) и людьми, которым вводится разовая доза до 300 мг. Способность SQ109 убивать Mtb in vitro точно такая же для лабораторного штамма или клинических изолятов, независимо от фенотипа лекарственной чувствительности. Это говорит о том, что мишень SQ109 хорошо сохраняется среди Mtb, вызывающих заболевание. SQ109 также обладает замечательным синергическим действием с обоими наиболее важными противотуберкулезными препаратами первой линии, изониазидом (INH) и рифампицином (RIF).Небольшие количества SQ109 в сочетании со стандартными количествами RIF фактически сделали RIF-устойчивые клинические изоляты снова восприимчивыми к RIF in vitro. В этой заявке SBIR Phase 1 мы исследуем потенциал SQ109 для лечения МЛУ-ТБ при использовании в сочетании с противотуберкулезными препаратами первого и второго ряда. Мы исследуем два подхода: в первом подходе, который основан на замечательной синергии между SQ109 и RIF для уничтожения Mtb как в RIF, так и в штаммах RIFR, мы оценим, можем ли мы спасти использование RIF для лечения штаммов RIFR. Mtb в сочетании с SQ109.Во втором, более традиционном подходе, мы определим эффективность комбинаций препаратов на основе SQ109 с препаратами второго ряда, которые в настоящее время используются клиницистами для лечения пациентов с МЛУ-ТБ. SQ109 завершил доклинические исследования токсикологии, безопасности и фармакологии под руководством IND, а также исследование безопасности человека фазы 1A. В сотрудничестве с NIAID клиническое исследование фазы 1B для оценки безопасности и фармакокинетики SQ109, вводимого ежедневно в течение 2 недель, началось в мае 2009 года и завершится в марте 2010 года.После успешного завершения фазы 1B исследования SQ109 войдет в многонациональные клинические испытания для оценки эффективности SQ109 при лекарственно-чувствительном легочном ТБ и МЛУ-ТБ. АКТУАЛЬНОСТЬ ДЛЯ ОБЩЕСТВЕННОГО ЗДРАВООХРАНЕНИЯ: SQ109 является перорально активным лекарственным средством и новым кандидатом в клинические разработки для лечения всех форм туберкулеза (ТБ), включая туберкулез с множественной лекарственной устойчивостью (МЛУ) и ТБ с крайней лекарственной устойчивостью (ШЛУ). ТБ — это заразная бактериальная инфекция, вызываемая Mycobacterium tuberculosis (MTB), передающаяся от человека к человеку воздушно-капельным путем.ТБ убивает больше людей, чем какой-либо другой возбудитель болезни, и все же лекарства, используемые для лечения этого инфекционного заболевания, настолько неэффективны, что комбинация лекарств, вводимая в течение шести месяцев, является стандартной схемой лечения неосложненного лекарственно-чувствительного ТБ. Национальный институт аллергии и инфекционных заболеваний (NIAID) и Всемирная организация здравоохранения (ВОЗ) признают туберкулез одной из самых серьезных проблем со здоровьем в мире. Два миллиарда (одна треть) населения мира инфицированы туберкулезом. По оценкам, в 2007 году заболеваемость туберкулезом во всем мире составила более 9 миллионов человек, и эти недавно выявленные активные инфекции привели почти к 2 миллионам случаев смерти.По данным ВОЗ, более 450 000 из этих случаев ТБ были больны МЛУ-ТБ. ВОЗ и FDA США поощряют фармацевтические компании к разработке новых противотуберкулезных препаратов для лечения МЛУ-ТБ, ссылаясь на рост числа пациентов и острую потребность в новых эффективных лекарствах от МЛУ-ТБ. Клиническое испытание по установлению эффективности нового лекарственного средства для лечения МЛУ-ТБ будет сравнивать группу пациентов с МЛУ-ТБ, получавших стандартный режим дозирования, выбранный из противотуберкулезных препаратов 2-го ряда, со второй группой пациентов с МЛУ-ТБ, получавших новые препараты. препарат плюс тот же стандартный режим лечения, который использовался в первой группе.Чтобы правильно разработать новую схему лечения МЛУ-ТБ, клинические испытания выиграют от понимания того, насколько хорошо лекарства работают вместе у людей (фармакокинетика, взаимодействия) и насколько эффективен новый режим (антимикробная эффективность комбинаций лекарств). В этом исследовании предлагается изучить взаимодействие SQ109 с выбранными противотуберкулезными препаратами 1-го и 2-го ряда.
* Информация, указанная выше, актуальна на момент подачи. *
SQ109 подавляет пролиферацию Leishmania donovani путем нарушения внутриклеточного гомеостаза Ca 2+, коллапса митохондриального электрохимического потенциала (Δ Ψ m) и воздействия на ацидокальцисомы
Al-Salem W, Herricks JR, Hotez PJ (2016) Обзор висцеральный лейшманиоз во время конфликта в Южном Судане и его последствия для стран Восточной Африки.Parasit Vectors 9: 460. https://doi.org/10.1186/s13071-016-1743-7
Артикул PubMed PubMed Central Google Scholar
Альвар Дж., Велес И.Д., Берн С., Эрреро М., Дежо П., Кано Дж. (2012) Лейшманиоз во всем мире и глобальные оценки его заболеваемости. PLoS One 7: 35671. https://doi.org/10.1371/journal.pone.0035671
CAS Статья Google Scholar
Benaim G, Garcia C (2011) Ориентация на гомеостаз кальция в качестве терапии болезни Шагаса и лейшманиоза.Троп Биомед 28: 471–481
PubMed Google Scholar
Benaim G, Paniz-Mondolfi AE (2012) Новая роль амиодарона и дронедарона в лечении хронической чагасической кардиомиопатии. Нат Рев Кардиол 9: 605–609. https://doi.org/10.1038/nrcardio.2012.108
CAS Статья PubMed Google Scholar
Benaim G, Romero PJ (1990) Кальциевый насос в пузырьках плазматической мембраны из Leishmania braziliensis .Biochim Biophys Acta 1027: 79–84
CAS Статья Google Scholar
Бенаим Дж., Сандерс Дж. М., Гарсия-Маршан Y, Колина С., Лира Р., Кальдера А. Р., Пайарес Г., Саноя С., Бургос Дж. М., Леон-Россель А., Консепсьон Дж. Л., Шиджман А. Г., Левин М., Олдфилд Е., Urbina JA (2006) Амиодарон обладает внутренней активностью против Trypanosoma cruzi и действует синергетически с позаконасолом. J Med Chem 49: 892–899. https://doi.org/10.1021/jm050691f
CAS Статья PubMed Google Scholar
Benaim G, Hernandez-Rodriguez V, Mujica-Gonzalez S, Plaza-Rojas L, Silva M, Parra-Gimenez N, Garcia-Marchan (2012) In vitro anti- Trypanosoma cruzi активность дронедарона, роман Производное амиодарона с улучшенным профилем безопасности.Антимикробные агенты Chemother 56: 3720–3725. https://doi.org/10.1128/AAC.00207-12
CAS Статья PubMed PubMed Central Google Scholar
Benaim G, Casanova P, Hernandez-Rodriguez V, Mujica-Gonzalez S, Parra-Gimenez N, Plaza-Rojas L, Concepcion JL, Liu YL, Oldfield E, Paniz-Mondolfi A, Suarez AIone (2014) Дронедар , аналог амиодарона с улучшенной эффективностью против Leishmania mexicana . Антимикробные агенты Chemother 58: 2295–2303.https://doi.org/10.1128/AAC.01240-13
CAS Статья PubMed PubMed Central Google Scholar
Борисов С.Е., Богородская Е.М., Волченков Г.В., Кульчавеня Е.В., Марьяндышев А.О., Скорняков С.Н., Талибов О.Б., Тихонов А.М., Васильева И.А. (2018) Эффективность и безопасность режима химиотерапии SQ109 при множественном лекарственно-устойчивом туберкулезе. Tuber Lung Dis 96: 6–18. https://doi.org/10.21292/2075-1230-2018-96-3-6-18
Артикул Google Scholar
Dutcher JD (1968) Открытие и разработка амфотерицина B.Dis Chest 54: 296–298
Статья Google Scholar
Frézard F, Demicheli C, Ribeiro RR (2009) Пятивалентные сурьмы: новые перспективы для старых лекарств. Молекулы 14: 2317–2336. https://doi.org/10.3390/molecules14072317
CAS Статья PubMed PubMed Central Google Scholar
Гарсия-Гарсия V, Oldfield E, Benaim G (2016) Ингибирование роста Leishmania mexicana с помощью противотуберкулезного препарата SQ109.Антимикробные агенты Chemother 60: 6386–6389. https://doi.org/10.1128/AAC.00945-16
Артикул PubMed PubMed Central Google Scholar
Джотсна М., Анубха С., Сарман С. (2007) Химиотерапия лейшманиоза: прошлое, настоящее и будущее. Curr Med Chem 14: 1153–1169. https://doi.org/10.2174/092986707780362862
Артикул Google Scholar
Li K, Schurig-Briccio LA, Feng X, Upadhyay A, Pujari V, Lechartier B, Fontes FL, Yang H, Rao G, Zhu W, Gulati A, No JH, Cintra G, Bogue S, Liu YL , Molohon K, Orlean P, Mitchell DA, Freitas-Junior L, Ren F, Sun H, Jiang T, Li Y, Guo RT, Cole ST, Gennis RB, Crick DC, Oldfield E (2014) Открытие многоцелевых лекарств для лечения туберкулеза и другие инфекционные заболевания.J Med Chem 57: 3126–3139. https://doi.org/10.1021/jm500131s
CAS Статья PubMed PubMed Central Google Scholar
Макобонго MO, Einck L, Peek PM, Merrell DS (2013) In vitro характеристика антибактериальной активности SQ109 против Helicobacter pylori . PLoS One 8: 68917. https://doi.org/10.1371/journal.pone.0068917
CAS Статья Google Scholar
Martinez-Sotillo N, Pinto-Martinez A, Hejchman E, Benaim G (2019) Антипролиферативный эффект производного бензофурана, основанный на структуре амиодарона на Leishmania donovani , влияющий на митохондрии, ацидокальцисомы2 + и внутриклеточный каучук.Паразитол Инт 70: 112–117. https://doi.org/10.1016/j.parint.2019.02.006
CAS Статья PubMed Google Scholar
McCall LI, Zhang WW, Matlashewsk G (2013) Детерминанты развития болезни висцерального лейшманиоза. PLoS Pathog 9 (1): e1003053. https://doi.org/10.1371/journal.ppat.1003053
CAS Статья PubMed PubMed Central Google Scholar
Менез С., Буйзе М., Беснард М., Фаринотти Р., Луазо П.М., Барратт Г. (2006) Взаимодействие между милтефозином и амфотерицином В: последствия для их деятельности по отношению к эпителиальным клеткам кишечника и промастиготам Leishmania donovani in vitro.Антимикробные агенты Chemother 50: 3793–3800. https://doi.org/10.1128/AAC.00837-06
CAS Статья PubMed PubMed Central Google Scholar
Misra S, Naskar K, Sarkar D, Ghosh DK (1991) Роль Ca 2+ ión в прикреплении лейшмании к макрофагам. Mol Cell Biochem 102: 13–18
CAS Статья Google Scholar
Pinto-Martinez A, Hernandez-Rodriguez V, Rodriguez-Duran J, Hejchman E, Benaim G (2018a) Действие анти- Trypanosoma cruzi новой структуры на основе производного бензофурана.Exp Parasitol 189: 8–15. https://doi.org/10.1016/j.exppara.2018.04.010
CAS Статья PubMed Google Scholar
Pinto-Martinez AK, Rodriguez-Durán J, Serrano-Martin X, Hernandez-Rodriguez V, Benaim G (2018b) Механизм действия милтефозина на Leishmania donovani включает нарушение ацидокальцисомной функции и сфингозин-зависимая плазматическая мембрана Ca 2+ канал .Противомикробные агенты Chemother 62: 14–17. https://doi.org/10.1128/AAC.01614-17
Артикул Google Scholar
Prajapati V, Sharma S, Rai M, Ostyn B, Salotra P, Vanaerschot M, Dujardin J, Sundar S (2013) Чувствительность Leishmania donovani к милтефозину при индийском висцеральном лейшманиозе in vitro. Am J Trop Med Hyg 89: 750–754. https://doi.org/10.4269/ajtmh.13-0096
CAS Статья PubMed PubMed Central Google Scholar
Rakotomanga M, Blanc S, Gaudin K, Chaminade P, Loiseau PM (2007) Милтефозин влияет на метаболизм липидов у Leishmania donovani промастигот.Антимикробные агенты Chemother 51: 1425–1430. https://doi.org/10.1128/AAC.01123-06
CAS Статья PubMed PubMed Central Google Scholar
Ready PD (2014) Эпидемиология висцерального лейшманиоза. Clin Epidemiol 6: 147–154. https://doi.org/10.2147/CLEP.S44267
Артикул PubMed PubMed Central Google Scholar
Rodriguez-Duran J, Pinto-Martinez A, Castillo C, Benaim G (2019) Идентификация и электрофизиологические свойства сфингозин-зависимой плазматической мембраны канала Ca 2+ в Trypanosoma cruzi .FEBS J (в печати). https://doi.org/10.1111/febs.14947
Артикул Google Scholar
Sacksteder KA, Protopopova M, Barry CE, Andries K, Nacy CA (2012) Открытие и разработка SQ109: нового противотуберкулезного препарата с новым механизмом действия. Future Microbiol 7: 823–837. https://doi.org/10.2217/fmb.12.56
CAS Статья PubMed PubMed Central Google Scholar
Sawaya BP, Briggs JP, Schnermann J (1995) Нефротоксичность амфотерицина B: неблагоприятные последствия изменения свойств мембраны.J Am Soc Nephrol 6: 154–164
CAS PubMed Google Scholar
Серрано-Мартин X, Гарсиа-Марчан Y, Фернандес А., Родригес Н., Рохас Х, Висбаль Г., Бенаим Г. (2009a) Амиодарон дестабилизирует внутриклеточный гомеостаз Ca 2+ и биосинтез стеролов в . Антимикробные агенты Chemother 53: 1403–1410. https://doi.org/10.1128/AAC.01215-08
CAS Статья PubMed PubMed Central Google Scholar
Серрано-Мартин X, Паярес Г., ДеЛукка М., Мартинес Дж. К., Мендоса-Леон А., Бенаим Г. (2009b) Амиодарон и милтефозин синергетически вызывают паразитологическое излечение мышей, инфицированных Leishmania mexicana .Антимикробные агенты Chemother 53: 5108–5113. https://doi.org/10.1128/AAC.00505-09
CAS Статья PubMed PubMed Central Google Scholar
Урбина Ю.А. (2006) Механизмы действия аналогов лизофосфолипидов против трипаносоматидных паразитов. Trans R Soc Trop Med Hyg 100S: S9 – S16. https://doi.org/10.1016/j.trstmh.2006.03.010
CAS Статья Google Scholar
Вейга-Сантос П.К., Ли Л., Ламейра TM, де Карвалью Дж., Хуанг М., Галицци Н., Шан К., Ли Д., Гонсалес-Пакановска Д., Эрнандес-Родригес В., Бенаим Дж., Гуо РТ, Урбина Дж. А., Docampo R, de Souza W, Oldfield E (2015) SQ109, новый ведущий препарат для лечения болезни Шагаса.Противомикробные агенты Chemother 59: 1950–1961. https://doi.org/10.1128/AAC.03972-14
CAS Статья PubMed PubMed Central Google Scholar
Vermeersch M, da Luz RI, Toté K, Timmermans JP, Cos P, Maes L (2009) Чувствительность in vitro Leishmania donovani на стадиях промастигот и амастигот к антилейшманиальным референсным препаратам: практическая значимость различий между стадиями. Антимикробные агенты Chemother 53: 3855–3859.https://doi.org/10.1128/AAC.00548-09
CAS Статья PubMed PubMed Central Google Scholar
Всемирная организация здравоохранения (2003) В: Kindhauser MK (ed) Инфекционные болезни 2002: глобальная защита от угрозы инфекционных заболеваний, Женева, стр. 106–107
Infectex сообщает о положительных данных фазы IIb-III испытания SQ109 для лечения МЛУ-ТБ
Российская биотехнологическая компания Infectex сообщила о положительных результатах клинических испытаний фазы IIb-III препарата SQ109 для лечения пациентов с туберкулезом легких с множественной лекарственной устойчивостью (МЛУ-ТБ).
Обнаруженный учеными американской антиинфекционной фирмы Sequella и Национального института здоровья (NIH), SQ109 представляет собой новый низкомолекулярный препарат 1,2-этилендиамина.
Результаты исследования показали, что пациенты как в намерении лечить (ITT), так и в соответствии с протоколом (PP) испытали статистически значимое улучшение клиренса легочных бактерий.
В проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании фазы IIb-III оценивалась эффективность, безопасность и переносимость SQ109 в сочетании со стандартной схемой у 140 пациентов в семи клинических центрах страны.
Главный исполнительный директор Sequella доктор Кэрол Нэйси сказала: «Теперь наша цель — как можно скорее довести продукт до пациентов, чтобы повысить эффективность лечения и спасти тысячи жизней больных туберкулезом не только в России, но и во всем мире. Мир.»
«Теперь наша цель — как можно скорее довести продукт до пациентов, чтобы повысить эффективность лечения и спасти тысячи жизней».
Было обнаружено, что конверсия посева мокроты у пациентов с РР составила 80% к концу шестимесячного периода лечения, что значительно выше по сравнению с пациентами, получавшими стандартную схему лечения и комбинацию плацебо.
В 2011 году Infectex лицензировала права на разработку и коммерциализацию SQ109 у Sequella в Российской Федерации и Содружестве Независимых Государств.
В настоящее время продукт находится в рамках исследовательского нового препарата Sequella в США (IND) и прошел три испытания фазы I в США и два испытания фазы II на лекарственно-чувствительных пациентах с туберкулезом в Африке.
Изображение: в мокроте обнаружены бактерии, вызывающие ТБ. Фото: любезно предоставлено TimVickers.
Тематические отчеты
Беспокоитесь ли вы о темпах инноваций в вашей отрасли?
В отчетеGlobalData по темам TMT за 2021 год рассказывается все, что вам нужно знать о темах революционных технологий и о том, какие компании лучше всего могут помочь вам в цифровой трансформации вашего бизнеса.
Узнать большеСвязанные компании
RWS Life Sciences
Переводческие услуги для фармацевтических и медико-биологических компаний
28 августа 2020
Репозиторий
Индивидуальный поиск рентабельной доклинической модели рака для доклинических исследований
28 августа 2020
Veeva Systems
Облачные программные решения для медико-биологической отрасли
28 августа 2020
.

