Какие бывают типы литиевых батарей. Как устроены литий-ионные аккумуляторы. Где применяются литиевые элементы питания. Почему взрываются литиевые батареи. Как правильно эксплуатировать Li-ion аккумуляторы.
Типы и устройство литиевых батарей
Литиевые батареи бывают нескольких основных типов:
- Литий-ионные (Li-ion)
- Литий-полимерные (Li-pol)
- Литий-железо-фосфатные (LiFePO4)
- Литий-тионилхлоридные (Li-SOCl2)
Самыми распространенными являются литий-ионные аккумуляторы. Они состоят из следующих основных компонентов:
- Анод — обычно графит
- Катод — оксиды металлов с внедренными ионами лития
- Электролит — проводник ионов лития между электродами
- Сепаратор — пористая полимерная мембрана, разделяющая электроды
При зарядке ионы лития движутся от катода к аноду, при разрядке — в обратном направлении. Это обеспечивает высокую плотность энергии и большое количество циклов заряда-разряда.
Форм-факторы литиевых элементов
Литиевые элементы питания выпускаются в нескольких форм-факторах:

Цилиндрические
Имеют форму цилиндра. Наиболее распространены типоразмеры 18650, 21700. Используются в портативной электронике, электроинструментах, электронных сигаретах.
Призматические
Имеют прямоугольную форму. Применяются в смартфонах, планшетах, ноутбуках. Позволяют эффективно использовать внутреннее пространство устройств.
Ламинированные (пакетные)
Плоские и гибкие элементы в алюминиевой оболочке. Используются в тонких устройствах — смартфонах, умных часах. Обеспечивают высокую емкость при минимальной толщине.
Области применения литиевых батарей
Литиевые элементы питания нашли широкое применение в различных сферах:
- Портативная электроника — смартфоны, ноутбуки, планшеты, камеры
- Электротранспорт — электромобили, электровелосипеды, электросамокаты
- Электроинструмент — дрели, шуруповерты, пилы
- Системы автономного и резервного питания
- Медицинское оборудование
- Космическая и военная техника
Популярность литиевых батарей обусловлена их преимуществами:
- Высокая плотность энергии
- Большое количество циклов заряда-разряда
- Низкий саморазряд
- Отсутствие эффекта памяти
- Широкий диапазон рабочих температур
Причины взрывов литиевых аккумуляторов
Несмотря на высокую безопасность современных литий-ионных батарей, в редких случаях возможны их возгорания и взрывы. Основные причины:

Короткое замыкание внутри элемента
Может произойти из-за:
- Механического повреждения батареи
- Производственного брака (попадание металлических частиц между электродами)
- Образования дендритов лития, пробивающих сепаратор
Перегрев батареи
Приводит к разложению электролита и бурной химической реакции. Возможные причины перегрева:
- Превышение допустимого тока заряда или разряда
- Использование неисправного зарядного устройства
- Воздействие высокой внешней температуры
Чрезмерный заряд или разряд
Выход за пределы допустимого диапазона напряжений вызывает необратимые изменения в структуре электродов. Это может привести к внутреннему короткому замыканию.
Правила безопасной эксплуатации литиевых аккумуляторов
Чтобы избежать опасных ситуаций при использовании литий-ионных батарей, следует соблюдать ряд правил:
- Использовать только оригинальные или сертифицированные зарядные устройства
- Не допускать механических повреждений аккумулятора
- Избегать воздействия высоких температур
- Не превышать максимально допустимый ток заряда и разряда
- Не разбирать и не модифицировать аккумулятор
- При появлении вздутия или других признаков неисправности немедленно прекратить использование
Соблюдение этих простых правил позволит безопасно и эффективно использовать литиевые батареи в различных устройствах.

Перспективы развития литиевых аккумуляторов
Технологии литиевых батарей продолжают активно развиваться. Основные направления исследований:
- Увеличение удельной емкости
- Повышение безопасности
- Сокращение времени заряда
- Увеличение срока службы
- Снижение стоимости производства
Перспективными разработками являются:
- Твердотельные литиевые аккумуляторы
- Литий-серные батареи
- Литий-воздушные элементы
Эти технологии позволят значительно увеличить запас хода электромобилей, время автономной работы портативных устройств и эффективность систем накопления энергии.
Утилизация литиевых батарей
Отработавшие литиевые аккумуляторы требуют правильной утилизации:
- Нельзя выбрасывать в обычный мусор — это опасно для окружающей среды
- Необходимо сдавать в специализированные пункты приема
- Многие магазины электроники принимают старые батареи на переработку
- Из литиевых аккумуляторов извлекают ценные металлы для повторного использования
Правильная утилизация позволяет снизить негативное воздействие на экологию и сохранить ресурсы для производства новых батарей.

Литиевый элемент питания — Википедия
Не следует путать с литий-ионным аккумулятором.
Литиевый элемент — одноразовый (неперезаряжаемый) гальванический элемент, в котором в качестве анода используется литий или его соединения. Катод и электролит литиевого элемента может быть разных видов, поэтому термин «литиевый элемент» объединяет группу элементов с одинаковым материалом анода.
Литиевый (Li/FeS2) гальванический элемент формфактора АА, 1,5 В[1]
Литий-железо-дисульфидные (Li/FeS2) гальванические элементы формфактора АА, 1,5 В
Литиевые гальванические элементы формфактора CR123A, 3 В
Миниатюрный литиевый гальванический элемент ДМЛ-120 (МЛ2325, аналог CR2325)
Устройство миниатюрного литиевого элемента CR2032
В зависимости от выбранного типоразмера и используемых химических материалов, литиевый элемент питания может производить напряжение 1,5 В (совместим с щелочными элементами) или 3 В. Литиевые элементы питания широко распространены в современной портативной электронной технике.
Литиевые элементы питания широко распространены в современной портативной электронной технике.
Содержание
- 1 История
- 2 Достоинства
- 3 Химические процессы
- 3.1 Тионилхлоридный катод
- 4 Применение
- 4.1 Типоразмеры
- 5 См. также
- 6 Примечания
Этот раздел статьи ещё не написан. Согласно замыслу одного или нескольких участников Википедии, на этом месте должен располагаться специальный раздел. |
К достоинствам литиевых элементов можно отнести[2]:
- меньшую, чем у серебра и ртути, дефицитность;
- возможность выполнения особо плоских элементов (толщиной 1-1,5 мм), позволяющих производить особо плоские устройства, такие как наручные часы;
- возможность получения различных рабочих напряжений (1,5: 2,8; 3 и 3,5 В), что невозможно реализовать в других видах гальванических элементов;
- исключительно малые токи саморазряда и высокая степень герметичности, что позволяет хранить литиевые элементы до начала эксплуатации 5-7 лет без нарушения герметичности;
- возможность хранения и работы в широком диапазоне отрицательных и положительных температур.

Химические процессыПравить
| Тип | Катод | Электролит | Номинальное напряжение | ЭДС холостого хода | Вт*ч/кг | Вт*ч/л |
|---|---|---|---|---|---|---|
| Li-MnO2 «CR» |
диоксид марганца | Перхлорат лития в растворителе (пропиленкарбонат, диметоксиэтан)[3][4][5] | 3 В | 3,3 В | 280 | 580 |
| Li-(CF)x «BR» |
Фторид углерода | Тетрафторборат лития в пропиленкарбонате, диметоксиэтане, гамма-бутиролактоне | 3 В | 3,1 В | 360-500 | 1000 |
| Li-FeS2 «FR» |
пропиленкарбонат, диоксолан, диметоксиэтан | 1,4-1,6 В | 1,8 В | |||
| Li-SOCl2 «E» |
Тионилхлорид | Тетрахлоралюминат лития в тионилхлориде | 3,5 В | 3,65 В | 500-700 | 1200 |
| Li-SO2Cl2 | Сульфурилхлорид | 3,7 В | 3,95 В | 330 | 720 | |
| Li-SO2 | Диоксид серы | Бромид лития | 2,85 В | 3,0 В | 250 | 400 |
| Li-I2 | Иод | Иодид лития[6] | 2,8 В | 3,1 В | ||
| Li-Ag2CrO4 | Хромат серебра | Перхлорат лития | 3,1-2,6 В | 3,45 В | ||
| Li-Ag2V4O11, Li-SVO, Li-CSVO | Оксид серебра+Оксид ванадия | Гексафторфосфат лития или гексафтороарсенат лития в пропиленкарбонате с диметоксиэтаном | ||||
| Li-CuO «GR» |
Окись меди | Перхлорат лития в диоксолане | 1,5 В | 2,4 В | ||
| Li-Cu4O(PO4)2 | Copper oxyphosphate | |||||
| Li-CuS | Сульфид меди | 1,5 В | ||||
| Li-PbCuS | Сульфид свинца и сульфид меди | 1,5 В | 2,2 В | |||
| Li-FeS | Сульфид железа | Пропиленкарбонат, диоксолан, диметоксиэтан | 1,5-1,2 В | |||
| Li-Bi2Pb2O5 | Lead bismuthate | 1,5 В | 1,8 В | |||
| Li-Bi2O3 | Оксид висмута | 1,5 В | 2,04 В | |||
| Li-V2O5 | Оксид ванадия | 3,3/2,4 В | 3,4 В | 120/260 | 300/660 | |
| Li-CuCl2 | Хлорид меди | LiAlCl4 или LiGaCl4 в SO2.
|
||||
| Li/Al-MnO2, «ML» | Оксид марганца | 3 В[7] | ||||
| Li/Al-V2O5, «VL» | Оксид ванадия | 3 В[8] | ||||
| Li-Se | Селен | 1,9 В[9] | ||||
| Li-air | Углерод | 1800-660[10] | 1600-600[10] | |||
| Li-FePO4 | Феррофосфат лития | Этиленкарбонат, диметилкарбонат, перхлорат лития | 3,0-3,2 В | 3,2 В | 90-160[11][12] | 325[12] |
Тионилхлоридный катодПравить
В качестве положительного электрода в т. н. литийтионилхлоридных батарейках применяется тионилхлорид. Химический процесс в батарее:
- 4Li+2SOCl2→4LiCl+S+SO2{\displaystyle {\mathsf {4Li+2SOCl_{2}\rightarrow 4LiCl+S+SO_{2}}}}
Напряжение новой батареи 3. 65 В, окончание разряда 3.0 В. Характеристика разряда плоская с резким падением напряжения в конце ёмкости.
65 В, окончание разряда 3.0 В. Характеристика разряда плоская с резким падением напряжения в конце ёмкости.
Эти батарейки отличаются высокой плотностью энергии (0.5 кВт*ч/кг, 1.2 кВт*ч/л), длительными сроками работы (свыше 20 лет, саморазряд ~1 %/год) и широким температурным диапазоном (до −80..+130 °C).[13] Однако их применение ограничено профессиональными применениями в связи с токсичностью содержимого и риском взрывного разрушения при коротком замыкании.
Батареи этого типа обладают склонностью к пассивации — осаждению плёнки хлорида лития на литиевом электроде при длительном отсутствии нагрузки или малых токах потребления. При этом внутреннее сопротивление батареи значительно растет. При нагружении батарея через некоторое время восстанавливает характеристики.[14]
Литиевые элементы нашли применение в устройствах, предъявляющих высокие требования к элементам питания на протяжении длительного срока службы, таким как электрокардиостимулятор и другие имплантируемые медицинские устройства. Такие устройства могут работать автономно до 15 лет. Применение литиевых элементов в устройствах с небольшим сроком службы не всегда оправдано. Так, литиевый элемент может прослужить дольше, чем детская игрушка, для которой он был приобретен.
Диапазон применения литиевых элементов практически аналогичен применению щелочных элементов — это большое количество различных устройств, таких как часы или фотокамера.
Такие устройства могут работать автономно до 15 лет. Применение литиевых элементов в устройствах с небольшим сроком службы не всегда оправдано. Так, литиевый элемент может прослужить дольше, чем детская игрушка, для которой он был приобретен.
Диапазон применения литиевых элементов практически аналогичен применению щелочных элементов — это большое количество различных устройств, таких как часы или фотокамера.
ТипоразмерыПравить
Основная статья: Типоразмеры гальванических элементов
Небольшие («таблеточные») литиевые элементы часто используются в портативных электронных устройствах с малым энергопотреблением (часы, калькуляторы), а также в компьютерах для питания энергозависимой памяти CMOS и часов.
- CR-V3
- ↑ Energizer EA91 (Lithium/Iron Disulfide (Li/FeS2)) Архивная копия от 12 июля 2019 на Wayback Machine, официальное описание производителя.
- ↑ Варламов Р. Г. Современные источники питания. Справочник. М.: ДМК, 1998. — 192 с.
 ISBN 5-89818-010-9
ISBN 5-89818-010-9
- ↑ Duracell Duracell Primary Lithium Coin Cell Article Information Sheet (неопр.) (1 июля 2015). Дата обращения: 2 января 2018. Архивировано из оригинала 3 января 2018 года.
- ↑ Energizer Energizer Product Safety Data Sheet, Coin/Button Lithium Manganese Dioxide Batteries (неопр.) (1 января 2017). Дата обращения: 2 января 2018. Архивировано из оригинала 8 сентября 2017 года.
- ↑ DongGuan TianQiu Enterprise Co., Ltd Material Safety Data Sheet, Li-Mn Button Cell CR2025 (неопр.) (1 января 2016). Дата обращения: 2 января 2018. Архивировано из оригинала 3 января 2018 года.
- ↑ Mallela, V. S.; Ilankumaran, V.; Rao, N. S. (2004). “Trends in cardiac pacemaker batteries”. Indian Pacing and Electrophysiology Journal.
 4 (4): 201—212. PMC 1502062. PMID 16943934.
4 (4): 201—212. PMC 1502062. PMID 16943934. - ↑ Electronic Components — Panasonic Industrial Devices (неопр.). www.panasonic.com. Архивировано из оригинала 13 ноября 2013 года.
- ↑ Electronic Components — Panasonic Industrial Devices (неопр.). www.panasonic.com. Архивировано из оригинала 25 ноября 2013 года.
- ↑ Eftekhari, Ali (2017). “The rise of lithium–selenium batteries”. Sustainable Energy & Fuels. 1: 14—29. DOI:10.1039/C6SE00094K.
- ↑ 1 2 Christensen, J.; Albertus, P.; Sanchez-Carrera, R. S.; Lohmann, T.; Kozinsky, B.; Liedtke, R.; Ahmed, J.; Kojic, A. (2012). “A Critical Review of Li∕Air Batteries”. Journal of the Electrochemical Society. 159 (2): R1. DOI:10.1149/2.086202jes.
- ↑ Large-Format, Lithium Iron Phosphate (неопр.
 ). JCWinnie.biz (23 февраля 2008). Дата обращения: 24 апреля 2012. Архивировано из оригинала 18 ноября 2008 года.
). JCWinnie.biz (23 февраля 2008). Дата обращения: 24 апреля 2012. Архивировано из оригинала 18 ноября 2008 года.
- ↑ 1 2 Great Power Group, Square lithium-ion battery (неопр.). Дата обращения: 31 декабря 2019. Архивировано 3 августа 2020 года.
- ↑ All About Batteries, Part 7: Lithium Thionyl Chloride (неопр.). Дата обращения: 1 октября 2020. Архивировано 1 сентября 2017 года.
- ↑ Особенности работы литий-тионилхлоридных батарей (неопр.). Дата обращения: 1 октября 2020. Архивировано из оригинала 22 июля 2019 года.
Почему взрываются литий ионные аккумуляторы? Все про Li-ion (литиевые аккумуляторы)
Вероятность взрыва литиевого аккумулятора при использовании правильной BMS (платы управления АКБ) штатного зарядного устройства, отсутствии давления на элементы саму аккумуляторную батарею, должной герметизации и изоляции, минимальна или отсутствует вовсе.
Ушли прошлое времена, когда аккумуляторы производились преимущественным содержанием кадмия и имели низкий уровень взрывобезопасности. Почему же, вопреки максимальной безопасности современных АКБ, иногда происходят взрывы Li-Ion аккумуляторов?
Такие батареи включают в себя анод и катод. Их разделяет пористый сепаратор из полимера. В аноде зачастую применяется графит, катоде в роли активного вещества выступают оксиды переходных металлов интегрированными ионами лития. Электрохимическая ячейка заполняется электролитом. При начальной зарядке, выполняемой производителем, на аноде формируется защитный слой. Он состоит из разложившегося электролита и оберегает электроды от контакта с электролитом. Наиболее распространенной причиной взрыва литиевого аккумулятора считается короткое замыкание в электрохимической ячейке.
Почему взрываются литий ионные аккумуляторы?
Вызвать электрическое взаимодействие катода с анодом способны разные факторы, к примеру:
- Физическое повреждение ячейки.

- Нарушение производственной технологии – попадание частиц металла между катодом и анодом, дефектная нарезка электродов (в результате повреждается пористый сепаратор).
- «Прорастание» через сепаратор дендритов лития. Происходит из-за низких температур и чрезмерно быстрой зарядки – когда ионы лития не успевают занять свои места в кристалле анода. Также может происходить из-за существенной разницы между емкостями анода и активного вещества катода.
Короткое замыкание приводит к нагреву аккумулятора, разложению ион-проводящего слоя на аноде (при 70–90 °С), реакции лития с электролитом, выделению летучих углеводородов. При нагреве до 180–200 °С материал катода вступает в реакцию диспропорционирования, выделяется кислород и начинается самовозгорание со стремительным ростом температуры. Далее взаимодействовать с электролитом начинает графит, а при нагреве до 660 °C расплавляется алюминиевый токоприемник.
Другие причины взрыва литий ионного аккумулятора
Кроме короткого замыкания в электрохимической ячейке, к самовозгоранию и взрыву литиевой аккумуляторной батареи способны привести:
- перегрев АКБ;
- зарядка на повышенных токах;
- превышение предельного значения напряжения;
- чрезмерно глубокая разрядка.

Все эти факторы провоцируют тепловой разгон и разложение электролита в процессе его реакции с электродами. Большинство современных производителей литий-ионных АКБ максимально снизили их взрывоопасность, используя многоступенчатые системы защиты. В этих целях успешно применяются предохранители, контроллеры, клапаны, изоляционные материалы, балансиры заряда, сенсоры.
Чтобы оградить себя от неприятных сюрпризов, приобретайте АКБ надежных производителей и соблюдайте правила эксплуатации. Прежде всего:
- не допускайте тепловых и механических воздействий на батарею;
- не подвергайте ее деформации, прокалыванию и другим воздействиям;
- не разбирайте;
- не используйте вздувшийся или потекший аккумулятор, отсоедините его от источника потребления и будьте осторожны, чтобы не закоротить контакты АКБ;
- используйте только оригинальные зарядные устройства.
Подробнее о том, как правильно пользоваться Li-Ion аккумулятором, читайте здесь.
Samsung 35E 18650 индийских рупий | Соединение батареи
Описание
Незащищенная батарея с плоским верхом 18650
Samsung 35E — это перезаряжаемый литий-ионный аккумулятор, в котором используется химический состав INR (литий-никель-марганец), и он является одним из самых емких аккумуляторов 18650, доступных на рынке. Благодаря емкости 3500 мАч и более 500 циклам зарядки 35E — отличное решение для длительного использования.
В качестве защищенного элемента с максимальной скоростью непрерывного разряда 8 А и клеммами с плоским верхом эта батарея идеально подходит для OEM-аккумуляторов для портативной электроники со средним и высоким энергопотреблением.
Перезаряжаемые и многоразовые
Инвестируйте в перезаряжаемую батарею, которая прослужит долгие годы — эту батарею можно заряжать более 500 раз.
Высокая скорость разряда
Максимальная непрерывная скорость разряда 8 А для электроники с высоким энергопотреблением, отлично подходит для изготовления аккумуляторов для устройств, требующих минимальной скорости разряда.
Срок годности 3 года
Запасайтесь и храните запасные батареи с уверенностью — литий-ионные батареи имеют срок годности более 3 лет, что гарантирует, что у вас всегда будет свежая замена, когда она вам понадобится.
Отличительные особенности
» Очень большая емкость 3500 мАч обеспечивает длительную работу всех ваших устройств
» Плоская верхняя клемма идеально подходит для использования при изготовлении аккумуляторных батарей OEM
Обратите внимание, что эти аккумуляторы имеют плоские клеммы и могут быть несовместимы с некоторыми устройствами.
Технические характеристики
| Марка | Samsung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MPN | 35E-18650-3000-FLAT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Color | Pink | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Size | 18650 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemistry | Li-ion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| INR (LiNiMnCoO2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Voltage | 3. 6V 6V | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacity | 3500 мАч | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Терминал | Плоский верх | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Защищенный | № | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Срок годности 40 9090 лет | 37 2 Charge & Discharge
Размеры
Technical Data
ВНИМАНИЕ: НЕЗАЩИЩЕННЫЙ ЛИТИЙ-ИОННЫЙ АККУМУЛЯТОРЕсли аккумуляторы с литий-ионными (литий-ионными) аккумуляторами не оснащены и не защищены печатной платой (модулем схемы защиты) и/или аналогичным устройством, они не рекомендуются BatteryJunction.com, нашей материнской и ассоциированной компаниями или соответствующими производителями, поскольку самостоятельный продукт. Неправильное использование ионно-литиевых аккумуляторных батарей может привести к серьезным травмам или повреждению имущества.Подробнее Будьте осторожны при работе с литий-ионными аккумуляторами, так как они очень чувствительны к зарядным характеристикам и могут взорваться или сгореть при неправильном обращении. Не может быть предоставлена явная или подразумеваемая гарантия совместимости с каким-либо устройством. Пожалуйста, изучите информацию и убедитесь, что этот аккумулятор совместим с предметом, с которым вы собираетесь его использовать. Заряжайте только в интеллектуальном зарядном устройстве, предназначенном для определенного типа ионно-литиевых аккумуляторов. Не смешивайте старые и новые, бывшие в употреблении и неиспользованные батареи. Не бросать в огонь. Правила и законы, касающиеся переработки и утилизации ионно-литиевых аккумуляторов, различаются в разных странах, а также в зависимости от штата и местных органов власти. Пожалуйста, обратитесь в местную юрисдикцию относительно надлежащей утилизации. Многие розничные магазины предлагают бесплатную утилизацию аккумуляторов. Read Less Specifications
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 73″ / 18,55 мм
73″ / 18,55 мм  Перед использованием убедитесь, что пользователь имеет соответствующие знания о зарядке, разрядке и сборке литий-ионных аккумуляторов. Всегда заряжайте в/на огнеупорной поверхности. Никогда не оставляйте заряжающиеся аккумуляторы без присмотра. Мы не несем ответственности за ущерб в случае внесения каких-либо изменений в аккумуляторы/зарядные устройства любой формы или формы (включая, помимо прочего, изготовление упаковки). Мы не несем ответственности за любой ущерб, вызванный неправильным использованием или неправильным обращением с литий-ионными аккумуляторами и зарядными устройствами.
Перед использованием убедитесь, что пользователь имеет соответствующие знания о зарядке, разрядке и сборке литий-ионных аккумуляторов. Всегда заряжайте в/на огнеупорной поверхности. Никогда не оставляйте заряжающиеся аккумуляторы без присмотра. Мы не несем ответственности за ущерб в случае внесения каких-либо изменений в аккумуляторы/зарядные устройства любой формы или формы (включая, помимо прочего, изготовление упаковки). Мы не несем ответственности за любой ущерб, вызванный неправильным использованием или неправильным обращением с литий-ионными аккумуляторами и зарядными устройствами. 
 ) x 0,75 дюйма (диаметр)
) x 0,75 дюйма (диаметр) 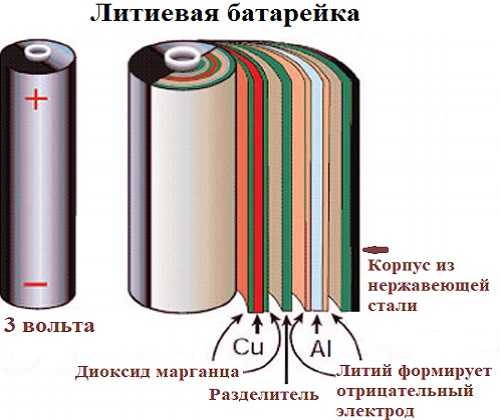 В литиевых батареях используются три типа элементов: цилиндрические, призматические и карманные. Для целей этого блога все элементы литий-железо-фосфатные (LiFePO4) и 3,2 вольта (V).
В литиевых батареях используются три типа элементов: цилиндрические, призматические и карманные. Для целей этого блога все элементы литий-железо-фосфатные (LiFePO4) и 3,2 вольта (V). 

 Точно так же энергетический элемент предназначен для доставки высокой энергии. Но что именно это означает и чем отличаются литиевые силовые элементы от энергетических элементов?
Точно так же энергетический элемент предназначен для доставки высокой энергии. Но что именно это означает и чем отличаются литиевые силовые элементы от энергетических элементов?  Например, в электроинструменте пользователь ожидает, что инструмент будет работать в общей сложности около часа до зарядки, но пользователь скутера не будет счастлив, если его скутер выйдет из строя после одного часа использования.
Например, в электроинструменте пользователь ожидает, что инструмент будет работать в общей сложности около часа до зарядки, но пользователь скутера не будет счастлив, если его скутер выйдет из строя после одного часа использования.  Научитесь соединять аккумуляторы последовательно или параллельно.
Научитесь соединять аккумуляторы последовательно или параллельно. 


