Как устроен гальванический элемент. Какие бывают виды гальванических элементов. Где применяются гальванические элементы. Как работает гальванический элемент.
Что такое гальванический элемент
Гальванический элемент — это химический источник тока, в котором энергия химической реакции преобразуется в электрическую энергию. Принцип его работы основан на протекании окислительно-восстановительной реакции между двумя электродами, погруженными в электролит.
Основные компоненты гальванического элемента:
- Анод — отрицательный электрод, на котором происходит реакция окисления
- Катод — положительный электрод, на котором происходит реакция восстановления
- Электролит — проводящая среда между электродами
- Сепаратор — разделитель между электродами
- Корпус
Устройство гальванического элемента
Рассмотрим устройство простейшего гальванического элемента на примере элемента Даниэля-Якоби:
- Цинковый электрод (анод) погружен в раствор сульфата цинка
- Медный электрод (катод) погружен в раствор сульфата меди
- Электроды соединены проводником
- Между растворами находится пористая перегородка или солевой мостик
При замыкании цепи начинается окислительно-восстановительная реакция:
- На аноде цинк окисляется: Zn → Zn2+ + 2e-
- На катоде ионы меди восстанавливаются: Cu2+ + 2e- → Cu
В результате возникает электрический ток во внешней цепи.
Принцип работы гальванического элемента
Принцип работы гальванического элемента основан на протекании окислительно-восстановительной реакции между электродами. Как это происходит:
- На аноде (отрицательном электроде) протекает реакция окисления — атомы металла отдают электроны и переходят в раствор в виде ионов
- Освободившиеся электроны по внешней цепи переходят к катоду
- На катоде (положительном электроде) происходит реакция восстановления — положительные ионы принимают электроны
- Движение ионов в электролите замыкает цепь
За счет разности потенциалов между электродами возникает электродвижущая сила (ЭДС) и электрический ток во внешней цепи.
Виды гальванических элементов
Существует несколько основных видов гальванических элементов:
Марганцево-цинковые (солевые) элементы
Самые распространенные и дешевые. Анод — цинк, катод — диоксид марганца. Электролит — хлорид аммония или хлорид цинка. Напряжение 1,5 В.
Щелочные (алкалиновые) элементы
Более мощные и долговечные. Анод — цинк, катод — диоксид марганца. Электролит — гидроксид калия. Напряжение 1,5 В.
Литиевые элементы
Высокая энергоемкость и срок хранения. Анод — литий, катод — различные соединения. Электролит — неводный. Напряжение 3-3,7 В.
Серебряно-цинковые элементы
Высокая удельная энергия. Анод — цинк, катод — оксид серебра. Электролит — гидроксид калия. Напряжение 1,5-1,6 В.
Применение гальванических элементов
Гальванические элементы широко применяются в различных областях:
- Портативная электроника (телефоны, ноутбуки, фотоаппараты)
- Бытовая техника (часы, пульты, фонарики)
- Медицинские приборы (слуховые аппараты, кардиостимуляторы)
- Автомобильная электроника
- Системы автономного электропитания
- Военная и космическая техника
Выбор типа элемента зависит от требуемых характеристик — напряжения, емкости, срока службы, стоимости.
Преимущества и недостатки гальванических элементов
Основные преимущества гальванических элементов:
- Простота конструкции
- Надежность
- Длительный срок хранения
- Широкий диапазон рабочих температур
- Невысокая стоимость
Недостатки:
- Ограниченный ресурс (одноразовые)
- Саморазряд при хранении
- Возможность вытекания электролита
- Экологические проблемы утилизации
Несмотря на недостатки, гальванические элементы остаются одним из самых распространенных химических источников тока благодаря простоте и надежности.
Перспективы развития гальванических элементов
Основные направления совершенствования гальванических элементов:
- Повышение удельной энергоемкости
- Увеличение срока службы и хранения
- Снижение саморазряда
- Расширение диапазона рабочих температур
- Уменьшение содержания вредных веществ
- Разработка новых электрохимических систем
Перспективными считаются литий-ионные, литий-полимерные, литий-воздушные и другие системы с высокими удельными характеристиками. Ведутся исследования по созданию биоразлагаемых гальванических элементов.
Гальванические элементы (батарейки). Виды и устройство. Работа
В первых опытах ученых в емкость с кислотой опускали две металлические пластины: медную и цинковую. Пластины соединяли проводником, после чего на медной пластине появлялись газовые пузырьки, а цинковая пластина стала растворяться. Было доказано, что по проводнику проходит электрический ток. Это исследование начинал итальянский ученый Гальвани, от него и получили название гальванические элементы.
После этого ученый Вольта разработал цилиндрическую форму этого элемента в виде вертикального столбика, включающего в себя набор колец меди, цинка и сукна, соединенных друг с другом, и пропитанных кислотой. Разработанный Вольтом вертикальный элемент полуметровой высоты вырабатывал напряжение, которое мог почувствовать человек.
Гальванические элементы — это источники электрической энергии, вырабатывающие электрический ток методом химического взаимодействия двух металлов в электролите. Химическая энергия в гальванических элементах преобразуется в электрический ток.
Виды и особенности устройства
Гальванические элементы широко используются для питания разных электронных устройств, приборов, цифровой техники и делятся на три основных вида:- Солевые.
- Щелочные.
- Литиевые.
Солевые батарейки
Такие батарейки относятся к марганцево-цинковым элементам питания, и являются наиболее применяемыми в настоящее время.
Достоинствами солевых батареек являются:
- Приемлемые электрические параметры для многих областей использования.
- Удобство применения.
- Малая цена ввиду небольших расходов на изготовление.
- Простая технология изготовления.
- Дешевое и доступное сырье.
Длительное время этот вид батареек является наиболее популярным, благодаря соотношению качества и цены. Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси. Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония. Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция. Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.
В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите. Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3. Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Щелочные батарейкиЩелочные элементы питания появились в середине прошлого века. В них в качестве окислителя выступает диоксид марганца, а в качестве восстановителя порошковый цинк. Это дает возможность увеличить поверхность. Для предохранения от коррозии раньше применялось амальгамирование. Но после запрета на ртуть используют очищенные цинковые порошки с добавлением других металлов и ингибиторов коррозии.
Активным веществом анода щелочной (алкалиновой) батарейки стал очищенный цинк в виде порошка с добавлением алюминия, индия или свинца. Активная смесь катода включает в себя диоксид марганца, ацетиленовую сажу или графит. Электролит алкалиновых батареек состоит из едкого натра или калия с добавлением оксида цинка.
Порошковый анод позволяет значительно повысить использование активной смеси, в отличие от солевых батареек. Алкалиновые батарейки обладают значительно большей емкостью, чем солевые, при равных габаритных размерах. Они хорошо себя показали в работе на морозе.
Особенностью устройства алкалиновых элементов является порошковый цинк, поэтому вместо цинкового стакана используют стальной корпус для положительного вывода. Активная смесь положительного электрода находится возле внутренней стенки стального корпуса. В алкалиновой батарейке есть возможность разместить больше активной смеси положительного электрода, в отличие от солевой.
В активную смесь вставляется целлофановый сепаратор, смоченный электролитом. По центру батарейки проходит латунный отрицательный электрод. Остальной объем между сепаратором и отрицательным токоотводом заполняется анодной пастой в виде порошкового цинка, пропитанного густым электролитом. Обычно в качестве электролита используют щелочь, насыщенную специальными соединениями цинка. Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
По многим основным параметрам алкалиновые гальванические элементы превосходят солевые элементы. Поэтому в настоящее время увеличивается объем производства щелочных батареек.
Литиевые гальванические элементы применяются в различных современных устройствах. Они выпускаются различных типоразмеров и видов.
Существуют литиевые батарейки и литиевые аккумуляторы, имеющие между собой большие отличия. Батарейки имеют в составе твердый органический электролит, в отличие от других видов элементов. Литиевые элементы используются в местах, где требуются средние и малые токи разряда, стабильное рабочее напряжение. Литиевый аккумулятор можно перезаряжать определенное количество раз, а батарейки не предназначены для этого, и используются только один раз. Их запрещается вскрывать или перезаряжать.
Основные требования к производству:
- Надежная герметизация корпуса. Нельзя допускать утечки электролита и проникновения внутрь других веществ из внешней среды. Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
- Изготовление должно проходить в герметичных помещениях с аргоновой атмосферой и контролем влажности.
Форма литиевых аккумуляторов бывает цилиндрической, дисковой или призматической. Габариты практически не отличаются от других видов батареек.
Область использованияЛитиевые гальванические элементы обладают более длительным сроком работы, по сравнению с другими элементами. Область применения очень широка:
- Космическая промышленность.
- Авиационное производство.
- Оборонная промышленность.
- Детские игрушки.
- Медицинская техника.
- Компьютеры.
- Фото- и видеокамеры.
- Широкий интервал рабочих температур.
- Компактные размеры и масса.
- Длительная эксплуатация.
- Стабильные параметры в различных условиях.
- Большая емкость.
- Возможность внезапного возгорания при несоблюдении правил пользования.
- Высокая цена, по сравнению с другими видами батареек.
Действие гальванических элементов основано на том, что два разных металла в среде электролита взаимодействуют между собой, в результате чего во внешней цепи образуется электрический ток.
Такие химические элементы сегодня называют батарейками. Величина напряжения батарейки зависит от применяемых видов металлов и от числа элементов, находящихся в ней. Все устройство батарейки расположено в металлическом цилиндре. Электроды представляют собой металлические сетки с напылением восстановителя и окислителя.
Батарейки не могут восстанавливать утраченные свойства, так как в них осуществляется прямое преобразование химической энергии окислителя и восстановителя в электрическую. Химические реагенты при функционировании батарейки постепенно расходуются, а электрический ток уменьшается.
Отрицательный вывод батарейки выполнен из цинка или лития, он теряет электроны и является восстановителем. Другой положительный вывод играет роль окислителя, его изготавливают из оксида магния или солей металлов. Состав электролита в обычных условиях не пропускает через себя электрический ток. При замыкании электрической цепи начинается распад электролита на ионы, что обуславливает появление его электрической проводимости. Электролит состоит чаще всего из раствора кислоты или солей натрия и калия.
Похожие темы:
Принцип работы гальванического элемента
Все о гальваническом элементе
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
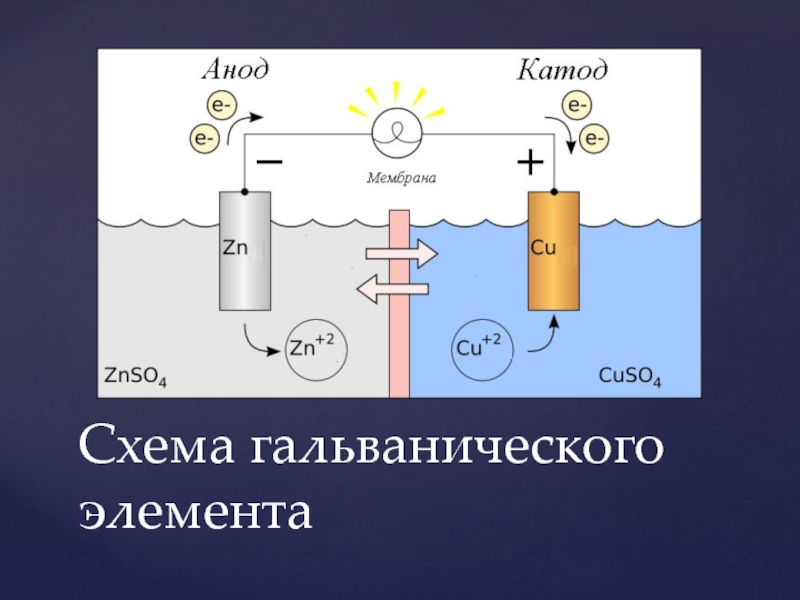
Схема гальванического элемента
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Устройство и принцип работы гальванического элемента
Металл, погруженный в раствор электролита, называется электродом.
Электроды — это система двух токопроводящих тел — проводников первого и второго рода.
К проводникам первого рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда — электроны.
К проводникам второго рода относятся расплавы и растворы электролитов; носители заряда — ионы.
Устройство, состоящее из двух электродов, называется гальваническим элементом.
| Рис. 2. Схема медно-цинкового гальванического элемента |
Рассмотрим гальванический элемент Якоби—Даниэля (схема приведена на рис. 2). Он состоит из цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
В гальваническом элементе электрод, сделанный из более активного металла, т.е. металла, расположенного левее в ряду напряжений, называют анодом, а электрод, сделанный из менее активного металла — катодом.
На поверхности цинкового электрода (анода) возникает двойной электрический слой и устанавливается равновесие:
Zn0 – 2ē ←→ Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медного электрода (катода) также возникает двойной электрический слой и устанавливается равновесие:
Cu2+ + 2ē ←→ Cu0.
В результате возникает электродный потенциал меди.
Так как потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, то при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате этого процесса равновесие на цинковом электроде смещается вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы или не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе гальванического элемента Якоби—Даниэля протекают следующие процессы:
1. Анодный процесс, процесс окисления:
Zn0 – 2ē → Zn2+.
2. Катодный процесс, процесс восстановления:
Cu2+ + 2ē → Cu0.
3. Движение электронов во внешней цепи.
4. Движение ионов в растворе: анионов SO42– к аноду, катионов Cu2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получим:
Zn + Cu2+ = Zn2+ + Cu.
В результате протекании данной реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. Поэтому суммарную химическую реакцию, протекающую в гальваническом элементе, называют токообразующей реакцией.
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделенными: на отрицательном электроде (аноде) происходит процесс окисления, на положительном электроде (катоде) — процесс восстановления.
Необходимым условием работы гальванического элемента является разность потенциалов электродов. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности между потенциалом катода и потенциалом анода элемента:
ЭДС = Eк – Ea . (1)
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определенный порядок в записи схемы элемента: записанный слева электрод должен быть отрицательным. Например, схема элемента Якоби—Даниэля записывается в виде:
Zn │ ZnSO4 ║ CuSO4 │ Cu .
Гальванический элемент: схема, принцип работы, применение
Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.
Химические источники тока
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора. Кроме того, схема двух гальванических элементов предполагает наличие катода и анода. Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.
Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде – восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Пример гальванического элемента
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля. Он включает в себя медную пластинку, которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод). Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.
Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Zn = Zn2+ + 2e-
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Cu2+ + 2e- = Cu
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Понравилась статья? Расскажите друзьям: Оцените статью, для нас это очень важно:Проголосовавших: 3 чел.
Средний рейтинг: 3.7 из 5.
8.2. Устройство и принцип действия гальванических элементов
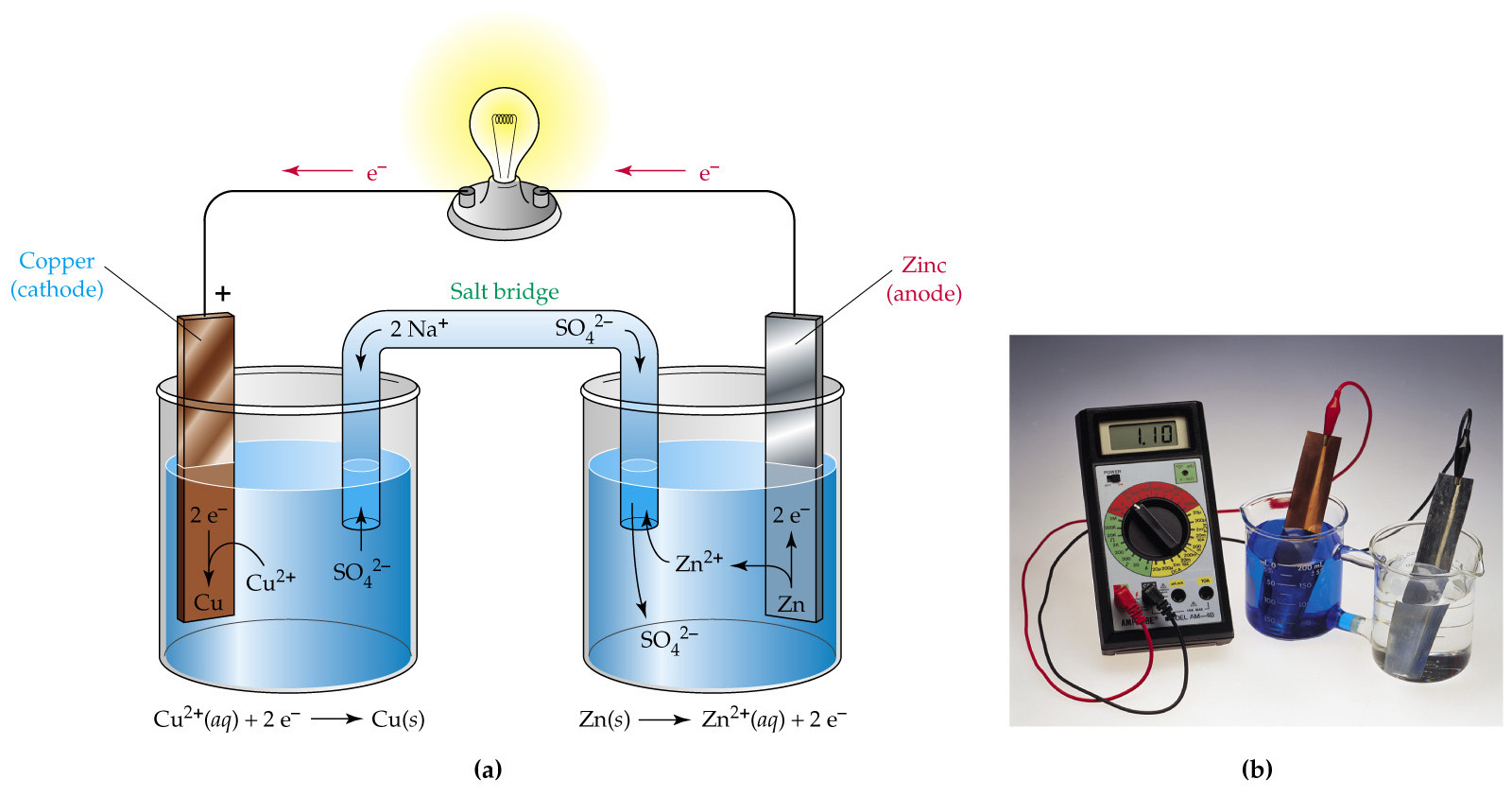
Гальванический элемент (ГЭ) — это устройство для превращения химической энергии в электрическую. ГЭ состоит из двух электродов (полуэлементов). Простейший полуэлемент состоит из металлической пластинки, опущенной в раствор своей соли. Более активный металл называется анодом. На его поверхности протекает процесс окисления. При работе ГЭ анод заряжается отрицательно. На менее активном металле, называемом катодом, протекает процесс восстановления. При работе гальванического элемента катод заряжается положительно. На рис.15 представлена схема медно-цинкового гальванического элемента Якоби-Даниеля.
Рисунок 15. — Медно-цинковый элемент Якоби-Даниеля
Медный и цинковый электроды соединены металлическим проводником, образующим внешнюю цепь гальванического элемента. Растворы солей CuSO4 и ZnSO4 соединены между собой солевым мостиком, образующим внутреннюю цепь гальванического элемента. Солевой мостик (электролитический ключ)— это стеклянная трубка, заполненная раствором электролита.
Цинковый электрод является анодом; на нем протекает процесс окисления:
Zn0 – 2e—Zn2+.
Катионы Zn2+ переходят в раствор, вследствие чего раствор приобретает положительный заряд, а электрод – отрицательный.
Электроны, отданные цинком, поступают во внешнюю цепь и мигрируют к меди.
Медный электрод является катодом; на нем протекает процесс восстановления:
Cu 2+ + 2e—Cu0.
Катионы Cu2+ принимают электроны, поступающие из внешней цепи, восстанавливаются и осаждаются на медном электроде. В результате раствор приобретает отрицательный заряд, а электрод – положительный.
Схема медно-цинкового гальванического элемента записывается следующим образом:
(-) Zn / Zn2+ // Cu2+/ Cu (+),
где / обозначает поверхность раздела металл-раствор, а также ОВ потенциал (электродный потенциал), возникающий на поверхности электрода вследствие того, что металл и раствор имеют разноименные заряды;
// обозначают границу раздела двух растворов, а так же диффузионный потенциал, возникающий из-за их разноименных зарядов.
Суммируя уравнения окислительно-восстановительных полуреакций, получаем уравнение суммарной токообразующей реакции:
Катод: Zn0 – 2e—Zn2+ 1
Анод: Cu 2+ + 2e—Cu0 1
Zn0 + Cu2+Zn2+ + Cu0
Эдс гальванического элемента рассчитывают как разность окислительно-восстановительных потенциалов катода и анода:
Е=φ(катод) – φ(анод).
Помимо окислительно-восстановительных и диффузионных потенциалов, возникновение электрического тока в гальваническом элементе происходит за счет мембранных потенциалов, возникновение которых обусловлено неравномерным распределением заряженных частиц (например, ионов) по обе стороны мембраны. Именно такое распределение ионов характерно для клеток человека (таблица 6).
Таблица 6 — Ионный состав нервной клетки
-
Ионы
Внутренняя среда
Внешняя среда
К+
400 ммоль/л
20 ммоль/л
Na+
50 ммоль/л
440 ммоль/л
Cl‾
120 ммоль/л
550 ммоль/л
Для каждого проникающего иона мембранный потенциал рассчитывается по уравнению Нернста:
где [X] внешн. среда и [x] внутр. среда — это концентрации иона во внешней и внутренней средах соответственно, моль/л;
n — заряд иона.
Мембранные потенциалы клеток называют биопотенциалами. Метод регистрации биопотенциалов используется при исследовании деятельности различных органов, например, при диагностике сердечных заболеваний (электрокардиография). Регистрация биопотенциалов мозга (электроэнцефалограмма) в ряде случаев позволяет судить о патологических нарушениях центральной нервной системы.
Классификация гальванических элементов по устройству
Различают три типа гальванических элементов: химические, концентрационные и топливные.
Химические гальванические элементы состоят из различных электродов. Примером является медно-цинковый элемент Якоби-Даниеля. Концентрационные элементы состоят из одинаковых электродов и отличаются только концентрацией электролитов них:
(–) Zn / ZnSO4 aq // ZnSO4 aq / Zn (+)
СМ(1) СМ(2)
В топливных элементах энергия, выделяющаяся при горении топлива, превращается в электрическую энергию:
С3Н8 + 5 О2 → 3 СО2 + 4 Н2О.
Классификация гальванических элементов по назначению
Различают элементы, используемые как химические источники тока, и элементы, применяемые для потенциометрических методов анализа.
Принцип работы гальванического элемента
В современных условиях наиболее распространенными химическими источниками тока являются гальванические элементы. Несмотря на их отдельные недостатки, они получили широкое распространение в электронике, проводится постоянная работа по их совершенствованию. Принцип работы гальванического элемента достаточно прост. В водный раствор серной кислоты погружаются медная и цинковая пластины, которые, затем, играют роль положительного и отрицательного полюса.
Принцип действия гальванического элемента
При соединении полюсов с помощью проводника происходит появление простейшей электрической цепи. Протекание тока внутри элемента будет происходить от отрицательного заряда к положительному, то есть от цинковой пластины к медной. Движение заряженных частиц по внешней цепи будет осуществляться в обратном направлении.
При воздействии электрического тока движение остатков серной кислоты, а также ионов водорода будет происходить в различных направлениях. При этом, водород передает заряд на медную пластину, а остаток кислоты – на цинковую пластину. Таким образом, на клеммах будет осуществляться поддержка напряжения. Одновременно, на медной пластине оседают пузырьки водорода, ослабляющего общее действие элемента и создающего дополнительное напряжение.
Такое напряжение известно, как электродвижущая сила поляризации. Чтобы избежать этого явления, в состав вводится вещество, способное поглощать атомы водорода и выполнять функцию деполяризации.
Гальванические элементы: преимущества и недостатки
Для изготовления современных гальванических элементов используются самые различные материалы. Наиболее распространенными являются материалы на основе угольно-цинковых элементов, используемых для пальчиковых батареек.
Их основным положительным качеством считается относительно низкая стоимость. Однако, такие элементы обладают невысокой мощностью и небольшим сроком хранения. Наиболее оптимальным вариантом служит использование щелочных элементов. Здесь в качестве электролита выступает не уголь, а раствор щелочи. При разрядке не происходит выделение газа, что позволяет обеспечить полную герметичность. Щелочные элементы отличаются более высоким сроком хранения.
Общий принцип работы гальванического элемента для всех их видов совершенно одинаковый. Например, элементы на основе оксида ртути конструктивно напоминают щелочные. Они отличаются повышенной устойчивостью к высокой температуре, высокой механической прочностью и стабильным значением напряжения. Недостатком является токсичность ртути, требующая осторожного обращения с отработанными элементами.
устройство и работа солевых, щелочных и литиевых батарей и аккумуляторов
Разные виды гальванических элементов преобразовывают свою химическую энергию в электрический ток. Своё название они получили в честь итальянского учёного Гальвани, который проводил первые подобные эксперименты и исследования. Электричество вырабатывается благодаря химическому взаимодействию двух металлов (обычно цинка и меди) в электролите.
Принцип действия
Учёные помещали в ёмкости с кислотой медную и цинковую пластинку. Их соединяли проводником, на первой образовывались пузырьки газа, вторая начинала растворяться. Это доказывало то, что по проводнику протекает электрический ток. После Гальвани опытами занялся Вольт. Он создал элемент цилиндрической формы, похожий на вертикальный столбец. В его составе были цинковые, медные и суконные кольца, предварительно пропитанные кислотой. Первый элемент имел высоту в 50 см, и выработанное им напряжение чувствовалось человеком.
Принцип работы заключается в том, что два вида металла в электролитической среде вступают во взаимодействие, в результате которого по внешней цепи начинает проходить ток. Современные гальванические элементы и аккумуляторы называют батарейками. Их напряжение зависит от используемого металла. Устройство помещено в цилиндр из мягкой жести. В качестве электродов выступают сетки с окислительным и восстановительным напылением.
Преобразование химической энергии в электричество исключает возможность восстановления свойств батареек. Ведь при работе элемента реагенты расходуются, из-за чего уменьшается ток. Восстановителем обычно служит отрицательный вывод из лития или цинка. Во время функционирования он теряет электроны. Положительную часть изготавливают из металлических солей или оксида магния, она выполняет работу окислителя.
В обычных условиях электролит не пропускает ток, он распадается на ионы только во время замыкания цепи. Именно это обуславливает появление проводимости. В качестве электролита используют раствор кислоты, натриевые или калиевые соли.
Разновидности элементов
Батарейки используют для питания приборов, устройств, техники, игрушек. Все гальванические элементы по схеме делят на несколько видов:
- солевые;
- щелочные;
- литиевые.
Наиболее популярные — солевые батарейки, изготовленные из цинка и марганца. Элемент сочетает в себе надёжность, качество и приемлемую цену. Но в последнее время производители снижают или полностью прекращают их изготовление, так как со стороны фирм, выпускающих бытовую технику, к ним постепенно повышают требования. Основные преимущества гальванических батарей этого типа:
- универсальные параметры, позволяющие использовать их в разных областях;
- лёгкая эксплуатация;
- невысокая стоимость;
- простые условия производства;
- доступное и недорогое сырье.
Среди недостатков выделяют небольшой срок службы (не более двух лет), уменьшение свойств из-за низких температур, уменьшение ёмкости при повышении тока и снижение напряжения во время работы. Когда солевые батарейки разряжаются, они могут потечь, так как положительный объем электрода выталкивает электролит. Проводимость повышают графит и сажа, активная смесь состоит из диоксида марганца. Срок эксплуатации напрямую зависит от объёма электролита.
В прошлом столетии появились первые щелочные элементы. Роль окислителя в них играет марганец, а восстановителя — цинковый порошок. Корпус батарейки амальгамируют во избежание появления коррозии. Но использование ртути запретили, поэтому их покрывали смесями из цинкового порошка с ингибиторами ржавчины.
Активное вещество в устройстве гальванического элемента — это цинк, индий, свинец и алюминий. В активную массу входят сажа, марганец и графит. Электролит изготавливают из калия и натрия. Сухой порошок значительно повышает функционирование батарейки. При таких же габаритах, как у солевых видов, щелочные имеют большую ёмкость. Они продолжают хорошо работать даже при сильном морозе.
Литиевые элементы используют для питания современной техники. Их выпускают в виде батареек и аккумуляторов разных размеров. В составе первых находится твёрдый электролит, в других устройствах — жидкий. Такой вариант подходит для приборов, требующих стабильного напряжения и средних зарядов тока. Литиевые аккумуляторы можно заряжать несколько раз, батарейки используют только однажды, их не вскрывают.
Сфера применения
К производству гальванических элементов выдвигают ряд требований. Корпус батареек должен быть надёжным и герметичным. Электролит не должен вытекать, а также нельзя допускать попадания внутрь устройства посторонних веществ. В некоторых случаях при вытекании жидкости она загорается. Повреждённый элемент нельзя использовать. Габариты у всех батареек практически одинаковы, отличаются только размеры аккумуляторов. Элементы могут иметь разную форму: цилиндрическую, призматическую или дисковую.
У всех типов устройств есть общие достоинства: они компактны и имеют незначительный вес, приспособлены к разным диапазонам рабочей температуры, обладают большой ёмкостью и стабильно работают в разных условиях. Есть также и некоторые недостатки, но они касаются определённых типов элементов. Солевые служат недолго, литиевые устроенные так, что могут воспламеняться при разгерметизации.
Сферы применения батареек многочисленны:
- цифровая техника;
- детские игрушки;
- медицинские приборы;
- оборонная и авиационная промышленность;
- космическое производство.
Гальванические элементы легко использовать, они доступны по стоимости. Но с некоторыми видами нужно обращаться аккуратно и не использовать их в случае повреждения. Перед приобретением батареек нужно внимательно изучить инструкцию прибора, который они будут питать.
Принцип действия гальванических элементов — Справочник химика 21
В этой главе будут обсуждены способы условного разделения химических реакций на две физически различные части одна из них характеризуется легкой отдачей электронов, а другая-их легким присоединением. Если нам удастся получить электроны, перетекающие вниз (тут мы пользуемся гравитационной аналогией), это позволит использовать такой поток для выполнения внешней работы. На этом основан принцип действия гальванического элемента. Кроме того, если удастся найти способы переноса электронов вверх из областей, где в них имеется потребность, в области, где их присутствие нежелательно, то мы сможем запасать энергию, чтобы воспользоваться ею позже, или осуществлять химические реакции, которые в нормальных условиях не являются самопроизвольными. Таков принцип действия электролитических элементов. [c.157]На примере элемента Даниэля рассмотрим принцип действия гальванического элемента. Если замкнуть электроды металлическим проводником электрического тока или подключить к нему какой-либо приемник электрической энергии, то под действием его э. д. с. (Е = фсц — ф2п) электроны от более электроотрицательного 2п-электрода начнут перемещаться по металлическому проводнику к менее электроотрицательному Си-электроду. В результате этого на 2п-электроде создастся некоторый недостаток электронов, а на Си — избыток по сравнению с содержанием их на электродах в исходном (неработающем) состоянии. Это приведет к установлению на электродах гальванического элемента неравновесных электростатических потенциалов меньшего, чем равновесный — на цинковом (ф2п фси)- Следовательно, термодинамическое равновесие в системе нарушится. [c.238]
Чтобы пояснить принцип действия гальванических элементов, мы обсудили простейшие гальванические элементы с солевыми мостиками. Конструкция используемых в технике гальванических элементов должна обеспечивать им большую прочность и портативность. Мы обсудили устройство трех электрических батарей свинцовой аккумуляторной батареи, ни-кель-кадмиевой батареи и сухого элемента. Первые две из них поддаются перезарядке, но сухой элемент не подлежит перезарядке. [c.234]
Принцип действия гальванических элементов [c.132]
Рассмотрим принцип действия гальванических элементов на примере элемента Даниэля — Якоби. Если в раствор сульфата меди поместить цинковую пластину, то на ее поверхности будет происходить окислительно-восстановительная реакция [c.246]
II. Как осуществляется преобразование химической энергии в электрическую Каков принцип действия гальванических элементов [c.297]
Гальванический элемент. В гальваническом элементе энергия химического процесса преобразуется в энергию электрического тока. К какому типу относятся химические реакции, возникающие в гальванических элементах, можно выяснить при рассмотрении принципа действия гальванического элемента, составленного из двух гальванических пар, например Zn°/Zn и u°/ u» (рис. 60). [c.158]
Одни атомы или ионы притягивают электроны сильнее, чем другие. Когда электроны получают возможность перетекать от менее притягивающих их атомов или ионов к сильнее притягивающим их атомам или ионам, достигается более устойчивая ситуация и происходит выделение энергии. Если не принять специальных мер, эта энергия рассеивается в форме тепла, т. е. приводит к повышению беспорядка (энтропии). Но если удается физически разделить полуреакции, в одной из которых высвобождаются, а в другой поглощаются электроны, то поток электронов из одной области в другую можно использовать для вьшолнения электрической работы. На этом принципе основано действие всех гальванических элементов. [c.193]
По принципу действия последние подразделяются на два типа. Конструкция одного типа предусматривает наличие в приборе бесконечно большого внутреннего сопротивления, так что при подключении его к гальваническому элементу электроды последнего остаются практически разомкнутыми и термодинамическое равновесие в нем не нарушается. Это — современные ламповые вольтметры и потенциометры. Их используют при проведении особо точных измерений. [c.242]
В большинстве случаев гальванические элементы изготавливают в виде сухих батарей или батарей аккумуляторов. Принцип их действия рассматривается в ряде учебных пособий по физике, поэтому здесь будет описана лишь схема работы самого современного из гальванических элементов — топливного элемента [c.255]
Чуть выше мы рассмотрели, как работает гальванический элемент, и очень коротко поговорили о том, как положительно (с точки зрения человека) использовать принцип его действия. Однако [c.171]
Таким образом, измеряя равновесные значения э.д.с. гальванического элемента при нескольких температурах, можно рассчитать характеристики ДО, А5 и ДЯ для протекающей в элементе реакции. Чтобы получить равновесное значение э.д.с. элемента, необходимо проводить измерения так, чтобы в цепи отсутствовал ток. В настоящей работе для измерения э.д.с. применяется высокоомный милливольтметр, в качестве которого можно использовать обычные рН-метры (pH-121, рН-340 универсальный иономер ЭВ-74 и другие принцип действия рН-метра описан в Работе 6 Гидролиз . [c.59]
Аккумуляторы — химические источники тока многократного действия, по принципу работы не отличающиеся от гальванических элементов, но накапливающие электрическую энергию при своем заряде и отдающие ее при разряде. [c.356]
Электролиз — это окислительно-восстановительный процесс, в котором стадии окисления и восстановления происходят на электронах под действием электрического тока. Таким образом, электролиз представляет собой способ проведения на электродах химических реакций, не протекающих самопроизвольно, при подведении к электродам электрической энергии. При электролизе электрическая энергия превращается в химическую. Аппарат для электролиза — — действует по принципу, обратному для рассмотренных выше гальванических элементов, в которых энергию самопроизвольно протекающей реакции превращают в электрическую. [c.226]
Для точного измерения э. д. с. гальванических элементов наиболее пригодным является описанный ранее компенсационный метод с применением потенциометров. Существуют электронные вольтметры, которые дают возможность непосредственно измерять с достаточной точностью малые напряжения и э. д. с. цепей. Действие этих вольтметров основано на принципе усиления крайне слабых токов электронными усилителями. Такие приборы могут быть успешно использованы в потенциометрическом анализе для измерения э. д. с. или для наблюдения за ее изменением. Все измерители напряжения включают в цепь только параллельно измеряемой системе. [c.55]
ТОПЛИВНЫЕ ЭЛЕМЕНТЫ, гальванические элементы, в к-рых электрич. энергия образуется благодаря хим. р-ции между восстановителем и окислителем, непрерывно поступающими к электродам извне (о принципе действия Т. э. см, Химические источники тока). Восстановителем на отрицат. электроде чаще всего служит Н2, иногда гидразин, окислителем на положительном — О2 или воздух. Материал электродов оказывает на электрохим. р-цию существ, каталитич. действие (см. Электрокатализ). Совокупность батареи Т. э. и устройств для обеспечения и регулирования подачи реагентов, отвода продуктов р-ции и тепла и т. п. наз. электрохим. генератором. [c.584]
Полярографические системы, используемые в анализаторах на кислород, могут питаться от внешнего или внутреннего источника напряжения, необходимого для получения предельного диффузионного тока данного вещества. Принцип действия этих двух систем один и тот же. Полярографические системы с внутренним источником напряжения работают так же, как гальванический элемент они, очевидно, более удобны для приборов переносного типа, полевых и лабораторных, где желательно не иметь специальных источников напряжения. [c.111]
Поскольку во время работы гальванического элемента происходят процессы переноса электронов, такому переносу в принципе могут способствовать правильно выбранные катализаторы. Катализатор может принимать участие в процессе адсорбции, переносе электрона и в поверхностной реакции, и наилучшим катализатором будет тот, который повышает скорости адсорбций и поверхностной реакции. Однако катализатор не должен адсорбировать веш,ество с такой высокой теплотой адсорбции, которая затруднила бы образование активированного комплекса и последующее разложение его до конечных продуктов. Следовательно, при подборе катализаторов в данном случае приходится сталкиваться с теми же проблемами, что и при подборе катализаторов для газофазных реакций. С появлением топливных элементов были приложены большие усилия для решения некоторых трудно-поддающихся проблем катализа, таких, нанример, как подбор подходящего катализатора, который может действовать в условиях, соответствующих обратимому электроду, а именно в условиях химического равновесия и в присутствии электролита. [c.377]
Последовательное расположение металлов по значению их стандартных потенциалов называется электрохимическим рядом напряжений. Более отрицательные значения потенциалов соответствуют большей способности металлов вступать в химические реакции. Чем дальше один от другого в ряду напряжений расположены металлы, тем большую ЭДС можно от них получить. При замыкании внешней цепи электродов возникает электрический ток. На этом основан принцип действия химических источников электрической энергии — гальванических элементов. [c.13]
Принцип действия купроксных выпрямителей основан на различном сопротивлении прохождению тока от слоя закиси меди к меди и обратно. Между медью и закисью меди создается прослойка— запирающий слой толщиной 0,01—0,1 мк. Этот слой обладает малым сопротивлением для тока при протекании его от закиси меди к меди и очень большим сопротивлением для тока в обратном направлении. На рис. 90 изображен элемент меднозакисного выпрямителя с односторонним слоем, а на рис. 91 — с двусторонним. Такие отдельные элементы собирают в блоки. В гальванических цехах распространены купроксные выпрямители ВКГ-1 (на 6 в, 600 а) и ВКГ-ЮО (на 9—12 в, 600 а). Допустимая температура в обычных условиях эксплуатации купроксных выпрямителей 45° С. [c.245]
В принципе всякий процесс можно провести равновесно. Для этого необходимо, чтобы каждое действие встречало равное себе противодействие. Рассмотренный выше пример касался давлений по обе стороны поршня. Но равновесно может передаваться теплота, если источник и приемник теплоты находятся при одинаковой температуре. Равновесно может идти химическая реакция, если она протекает в гальваническом элементе, и электродвижущей силе, возникающей на [c.22]
Принцип действия большинства газоанализаторов для определения h3S, HF, SO2, Оз, НС1, F, H N основан на засасывании газовой смеси и поглощении определяемого газа из пробы поглотительным раствором, после чего измеряют э.д.с. гальванического элемента с ионселективным электродом. [c.266]
В зависимости от источника напряжения, необходимого для получения предельного диффузионного тока, полярографические системы, используемые в анализаторах на кислород, делятся на системы с внешним и внутренним источниками тока. Принцип действия этих двух систем один и тот же. В полярографических системах с внутренним источником тока отрицательный потенциал на индикаторном электроде создается так же, как в гальваническом элементе — путем замыкания электродов внешним сопротивлением. При этом Е [c.131]
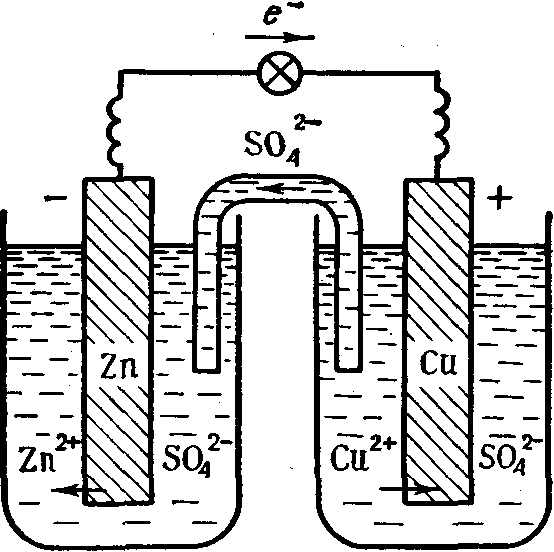
Гальванический элемент. В гальваническом элементе энергия химического процесса преобразуется в энергию электрического тока. К какому типу химических реакций относятся реакции, возникающие в гальванических элементах, можно выяснить при рассмотрении принципа действия гальванического элемента, составленного из двух гальванических пар, например ZnVZn» и u / u (рис. 46). Нейтральные атомы цинка теряют электроны, которые по внешней цепи (металлический провод) переходят к паре u / u», а по внутренней цепи (трубка с раствором электролита) ионы SO4″ движутся в противоположном направлении. В целом химический процесс выражается уравнением [c.141]
АККУМУЛЯТОРЫ электрические, гальванические элементы, предназначенные для многократного использования (об устройстве и принципе действия А. см. XnMuve inir источники тока). При заряде А. реагенты регенерируют в результате пропускания через систему ллектрич. тока от внеш. источника в направлении, обратном направлению тока при разряде. Способность к регенерации обычно обеспечивают подбором таких реагентов, к-рые в окисл. и восстановл, со- [c.16]
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ, химические источники тока, состоящие из одной гальванич. ячейки. В состав такой ячейки входит ионпроводящий электролит, два разнородных электрода и реагенты (о принципе действия см. Химические источники тока). В нек-рых случаях электрохимически активный материал электрода может служить реагентом. Г. э. используют как самостоят. источники электрич. энергии или как составные части гальванич. батареи. Г. э. бывают одноразового использования (см. Первичные элементы), многократного действия (см. Аккумуляторы) и с непрерывной подачей реагентов (см. Топливные элементы). Ранее термин — Г. э. относился только к первичным элементам. [c.119]
АККУМУЛЯТОРЫ электрические (от лат. a umulator- собиратель, накопитель), хим. источники тока многократного действия. При заряде от внеш. источника электрич. тока в А. накапливается энергия, к-рая при разряде вследствие хим. р-ции непосредственно превращ. снова в электрическую и выделяется во внеш. цепь. По принципу работы и осн. элементам конструкции А. не отличаются от гальванических элементов, но электродные р-ции, а также суммарная токообразующая р-ция в А. обратимы. Поэтому после разряда А. может быть снова заряжен пропусканием тока в обратном направлении на положит, электроде при этом образуется окислитель, на отрицательном-восстановитель. [c.67]
Обратимся теперь к той теме электрохимии, которая по своему смыслу как бы противоположна электролизу. Для проведения электролиза необходим внешний источник электрического потенциала, позволяющий осуществлять окислительную и восстановительную реакции на двух электродах. В отличие от этого для создания гальванического элемента выбирают такие электроды и электролитические вещества, которые обладают электрохимической энергией, достаточной для самопроизвольного протекания окислительного и восстановительного процессов. Таким образом, гальванический элемент служит источником электрохимической энергии, и именно по этой причине создаются подобные элементы. Прежде чем перейти к рассмотрению гальванических элементов, имеюших практическое применение, необходимо разобраться в электрохимических принципах их действия. [c.288]
Преимущество аккз уляторов и химических источников тока как источников питания электрических цепей в том, что они обеспечивают действительно постоянное напряжение, не имеющее пульсаций, присущих источникам, работающим от сети переменного тока. Однако для питания большинства приборов вполне пригодны изготавливаемые промышленностью стабилизированные источники питания. Они удобны в работе и более предпочтительны, чем аккумуляторы и батареи гальванических элементов. Принципы действия и конструкция таких источников весьма просты и подробно рассмотрены в специальной литературе. [c.60]
ПЕРВИЧНЫЕ ЭЛЕМЕНТЫ, гальванические элементы одноразового использования (об устройстве и принципе действия П. э. см. Химические источники тока). После израсходования запаса реагентоБ П. э. становятся неработоспособными. Восстановителем, на отрицат. электроде служит обычно Zn, окислителем на положительном — оксиды Мп, Hg или др. металлов, а также соли. Разрядное напряжение П. э. 0,5—3,5 В, емкость 10″ — 10 А >4, уд. энергия [c.429]
Измерение э. д. с. гальванического элемента с помощью потенциометра ППТВ-1. Для точных измерений э. д. с. пользуются потенциометрами, в основу принципа действия которых положена приведенная ранее компенсационная схема. [c.290]
Одной из причин коррозии является возникновение микро- и макрокорро-зионных гальванических элементов. Принцип действия коррозионного гальванического э.пемента заключается в том, что на аноде металл переходит в раствор в виде положительно заряженных ионов. В растворе ионы металла соединяются с отрицательно заряженными ионами электролита и образуют нейтральные молекулы. Эквивалентное число электронов, освободившееся от ионов металла на аноде, перетекает к катоду. Здесь электроны соединяются с положительно заряженными ионами электролита и также образуют нейтральные молекулы. [c.8]
Гальванические элементы и батареи. Принцип их действия основан на получении электрического тока за счет химической реакции. Наиболее распространенными, которые в настоящее время поступают в продажу, являются элементы марганцово-цинковой системы. Электрохимическая схема их — 2п ЫН4С1 Мп02(С)Ч-. Электрический ток в них образуется за счет окислительно-восстановительной реакции [c.43]
Вторичные элементы [3, 4] (аккумуляторы, аккумуляторные батареи) представляют собой гальванические элементы, в которых активные вещества образуются только при их заряжении от внешнего источника электрического тока. Таким образом, вторичные элементы служат для накопления и хранения электрической энергии. Наиболее важный (и старейший) вторичный элемент — свинцовый аккумулятор. Изобретателями этого аккумулятора обычно считают Синстедена (1854) и Планте (1859). Однако, судя по значительно более ранней лекции Фарадея для юношества, ему был известен принцип действия свинцового аккумулятора. Пригодный для практического использования аккумулятор, по-видимому, впервые был сконструирован Планте в 1860 г. Свинцовые аккумуляторы служат прежде всего в автомобилях и в качестве источников энергии для железнодорожной сигнализации, подводных лодок (это единственные электромобили , реально используемые на практике) и т. д. [c.126]
В, зависимости от источника напряжения, необходимого для получения предельного диффузионного тока, амперметрические системы, используемые в анализаторах на кислород, делятся на системы с внешним и внутренним источником тока. Принцип действия этих двух систем один и тот же. Если используется внутренний источник тока, отрицательный потенциал на индикаторном электроде создается так же, как в гальваническом элементе, — путем замыкания электродов внешним сопротивлением. При этом катода = — анода- поскольку янутреннее сопротивление (электродов и электролитов) ничтожно мало. Электроды подбирают таким образом, чтобы напряжение на них соотвегствовало потенциалу восстановления кислорода от — 0,5 до — 0,9 В. [c.240]
Гальванический элемент: устройство, принцип работы, виды
Люди довольно часто сталкиваются с электрохимическими элементами в повседневной жизни: от одноразовых батареек АА в пультах дистанционного управления ТВ до литий-ионных батарей в смартфонах. Существует два типа таких ячеек: гальванические и электролитические. Первые получают свою энергию от самопроизвольных окислительно-восстановительных реакций (ОВР), в то время как вторые требуют внешний источник электронов, например, блока питания переменного тока. Оба элемента состоят из анода (А) и катода (К), изготавливаемых из разнородных металлов и электролитов.
Что это такое
В любом электрохимическом процессе электроны переходят из одного вещества в другое, что обусловлено ОВР. Восстановитель представляет собой вещество, которое теряет электроны и в процессе окисляется. Связанная энергия определяется разностью потенциалов между валентными электронами в атомах различных элементов.
Принцип работыГальванический элемент — это устройство, которое преобразует химическую энергию в электрическую, используя электрохимию, а в быту называется батареей.
В такой ячейке есть контейнер, в котором содержится раствор концентрированного сульфата меди (CuSO4), а внутри раствора вставлен медный стержень — катод. Внутри контейнера находится пористый сосуд, заполненный концентрированной серной кислота (h3SO4), в нее вставлен цинковый стержень — анод. Таким образом, когда провод соединяет медный и цинковый стержни, по нему начинает протекать электрический ток.
Дополнительная информация. Реакции окисления и восстановления разделяются на части, называемые полуреакциями. Внешняя цепь используется для проведения потока электронов между электродами гальванического элемента. Электроды изготавливают из любых проводящих материалов, таких как металлы, полупроводники, графит и даже полимеры.
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.
Два типа ячеекГальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».
Александро ВольтВ 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник компании «Energizer», представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее.
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Виды
Гальванические элементы классифицируются, как щелочные и нещелочные. Стандартная щелочная сухая батарея имеет цинковый А и К из диоксида марганца. Электролит выполнен в виде некислотной пасты. Обычно электролитом, используемым в щелочных батарейках — есть гидроксид калия. Она выполнена в форме стальной банки, заполненной диоксидом марганца в самой внутренней области К, и заполнена цинком и электролитом в центральной области А. Электролит, окружающий А, запускает химреакцию между ними.
График окислительно-восстановительной реакцииТипичная нещелочная батарея с сухими элементами имеет цинковый А и К из углеродного стержня/ диоксида марганца. Электролит обычно представляет собой кислое пастообразное вещество из смеси хлорида аммония и хлорида цинка. Физически она имеет обратную щелочной батареи конструкцию. Цинковый контейнер служит внешним анодом, тогда как углеродный стержень/ диоксид марганца занимает внутреннюю область в качестве К. Электролит смешивается с К и обеспечивает химическую реакцию между К и А.
Общее мнение специалистов говорит о том, что химически щелочная батарея имеет преимущества по отношению к нещелочной. Хотя последние более надежные и дешевые, тем не менее, щелочные, нужны, когда требуется быстрое, сильнотоковое потребление, например, вспышка на камере с быстрой перезарядкой.
Щелочные батареи
Эта конструкция ячейки получила свое название благодаря использованию щелочных водных растворов в качестве электролитов. Химия щелочных устройств была впервые введена в начале 60-х годов. И сразу стала крупнейшим конкурентом цинк-углеродной ячейки. Эти элементы обладают многими признанными преимуществами по сравнению с цинк-углеродом, включая более высокую плотность энергии, длительный срок хранения, превосходное сопротивление утечке, лучшие характеристики, как в непрерывном, так и в прерывистых рабочих циклах, и более низкое внутреннее сопротивление, что позволяет им работать при высоких скоростях разряда.
Щелочные батареиЦинк в порошкообразной форме увеличивает площадь поверхности анода, что обеспечивает большее взаимодействие частиц. Это снижает внутреннее сопротивление и увеличивает плотность мощности. Катод, MnO2, произведен синтетически из-за его превосходства над природным MnO2, что дает рост плотности энергии. Как и в цинковой в углеродной ячейке, графит добавляется к катоду для увеличения проводимости.
Электролит КОН, обеспечивает высокую ионную проводимость. Оксид цинка часто включают для замедления коррозии цинкового анода. Производное от целлюлозы и гелеобразующего агента делают щелочной элемент более дорогим, чем цинк-углерод, но более экономичным, особенно в ситуациях с высоким расходом, когда плотность энергии щелочного элемента намного выше.
Половинные реакции:
- Zn + 2OH — -> ZnO + h3O + 2 e —
- 2MnO2 + h3O + 2 e — -> Mn2O 3 + 2OH —
Общая реакция:
- Zn + 2MnO2 -> ZnO + Mn2O3 E = 1,5 В
Существуют и другие конструкции ячеек, которые относятся к категории щелочных, в том числе оксиды ртути, серебра и цинка. Ртуть и серебро дают еще более высокую плотность энергии, но стоят намного дороже и постепенно исключаются требованиями международных организаций из-за их высокой токсичности.
Солевые ячейки
Аккумуляторы с сухими элементами — это устройства, в которых используется электролит с очень низким содержанием влаги. Они контрастируют с батареями с мокрыми элементами, такими как свинцово-кислотные, в которых используется жидкий электролит. Электролит, используемый в большинстве устройств с сухими элементами, является пастой, которая, хотя и содержит влагу, тем не менее остается относительно сухой. Наиболее часто используемые формы сухих элементов — это батареи типа «С», «А», 9 вольт батарейки и для электронных часов.
Сухой элементВажно! Сухих элементы вырабатывают электроэнергию путем преобразования химической энергии в электричество. Выходные данные зависят от типа батареи с сухими элементами. Более популярными являются конструкции с использованием цинка и углерода или цинка и диоксида марганца.
Эти материалы помещаются в пасту электролита внутри батареи. Они реагируют друг с другом посредством химического процесса, в котором электролит, диоксид углерода или марганца реагирует с цинком, создавая электричество.
Литиевые аккумуляторы
Литий-ионная технология включает в себя несколько химических процессов: ионы лития хранятся в аноде или отрицательном электроде, и транспортируются во время разряда к катоду или положительному электроду в органическом электролите.
Наиболее популярными материалами являются графит для анода и оксид металла для катода на основе никеля, марганца и кобальта. Все эти материалы обладают хорошими свойствами интеркалирования лития, что позволяет хранить большое количество энергии.
Литий-ионный элементВыбор аккумуляторной технологии зависит от требований эксплуатации по производительности, сроку службы, безопасности и стоимости, причем каждый тип аккумулятора обеспечивает определенные функциональные возможности.
Преимущества литий-ионных аккумуляторов:
- Высокая плотность энергии. Высокая плотность энергии является одним из главных преимуществ технологии литиевых батарей, для того чтобы работать дольше.
- Саморазряд. Одной из проблем многих аккумуляторов является скорость саморазряда. Литий-ионные элементы в том, что скорость их саморазряда намного ниже, чем у Ni-Cad и NiMH. Обычно составляет около 5% в первые 4 часа после зарядки, но затем падает до 1 или 2% в месяц.
- Низкие эксплуатационные расходы, поскольку требуют технического обслуживания для обеспечения их производительности.
- Разнообразие типов: для бытовой электроники, для электроинструментов и электромобилей.
У таких батарей есть один существенный недостаток — им требуется встроенная схема защиты. Кроме того они страдают от старения и могут выдержать 500–1000 циклов зарядки-разрядки.
Устройство гальванического элемента
Гальваническая ячейка представляет собой простое устройство, с помощью которого химическая энергия преобразуется в электрическую энергию.
Строение гальванического элемента для литиевых батарей:
- Анод, при разряде отдает электроны во внешнюю цепь и окисляется во время электрохимической реакции. Большинство коммерческих элементов в настоящее время используют электрод на основе углерода/графита, однако можно использовать металл или сплав.
- Катод, на разряде принимает электроны из внешней цепи и восстанавливается во время электрохимической реакции. Обычно это переходный металлический оксид или фосфат.
- Электролит.
Обратите внимание! Строение электролита ионный проводник, при этом электронный изолятор, разделяет два электрода и обеспечивает среду для переноса заряда внутри ячейки между анодом и катодом. Электролитом обычно является неводный неорганический растворитель, содержащий растворенную соль лития, например LiPF6 в пропиленкарбонате.
Принцип работы
Литиевая батарея известна как «электронный насос» из-за носителей заряда, перемещающихся между двумя электродами во время зарядки и разрядки. Электрическое (насосное) давление или разность потенциалов между положительной и отрицательной клеммами называется напряжением или электродвижущей силой (ЭДС). Свободная энергия, связанная с переносом электронов вокруг внешней цепи и ионов лития между двумя интеркалирующими электродами, связана с разницей в химическом потенциале лития в двух электродах.
Элементы батареи накапливают энергию химически в своих электроактивных материалах. Эта химическая энергия преобразуется в электрическую энергию по требованию, посредством электрохимической реакции окисления-восстановления.
Аккумуляторная батарейкаКлетки построены в разряженном состоянии. При зарядке положительный электрод, катод, материал окисляется, ионы Li + де-интеркалируются из слоистого интеркалирующего литиевого источника, например LiCoO2, проходят через электролит.
Когда элемент разряжается, на отрицательном электроде происходит реакция окисления, ионы Li + де-интеркалируются из анода и мигрируют через электролит, чтобы быть повторно интеркалированными в материал катода. Одновременная реакция электрохимического восстановления протекает на положительном электроде и принимает электроны из внешнего контура, ионы Li + из электролита, чтобы преобразовать исходный материал. Переход от электронного тока к ионному току происходит на границе раздела электрод/электролит.
- Реакция восстановления положительного электрода (катода): Li 1 -xCoO 2 + xLi + + xe- → LiCoO2
- Реакция окисления отрицательного электрода (анода): LiC 6 → xLi + + xC6 + e-
- Общая обратимая, окислительно-восстановительная, клеточная реакция: LiC 6 + CoO 2 C6 + LiCoO 2
Область использования
Электрохимия имеет множество важных применений, особенно в промышленности. Ее процессы используются для изготовления электрических батарей. Они имеют множество применений, включая:
- Топливный элемент преобразует химическую потенциальную энергию, получаемую при окислении топлива, например, газа, водорода, углеводородов, спиртов в электрическую энергию.
- Различные виды пьезозажигалок для газа.
- Электрические приборы, такие как мобильные телефоны.
- Цифровые камеры-литиевые.
- Слуховые аппараты (оксидно-серебряные).
- Электронные часы (ртутные/оксидно-серебряные).
- Военные источники тока (тепловые).
- Батарейки A, AA, AAA, D, C и другие.
Использование химических реакций для производства электричества в настоящее время является приоритетом для многих исследователей. Возможность адекватно использовать химические реакции в качестве источника энергии в значительной степени поможет решить проблемы загрязнения окружающей среды.
Гальванический элемент: определение, схема и работа
Гальванический или гальванический элемент — это электрохимический элемент, который преобразует химическую энергию в электрическую. Это достигается за счет использования энергии окислительно-восстановительных реакций, происходящих внутри клетки. Чтобы понять эту операцию подробно, мы должны сначала понять, что такое окислительно-восстановительная реакция.
Что такое окислительно-восстановительная реакция?
Слово «окислительно-восстановительный потенциал» является сокращением от «восстановление-окисление».Комбинативная фраза представляет собой две химические реакции, которые происходят одновременно с обменом электронами. Реагент, который теряет свои электроны, называется окисленным, тогда как реагент, который приобретает те же самые электроны, называется восстановленным. Обратите внимание на то, что одно вызывает другое, и именно эта причинная природа реакции дает реакции «красный бык» ее название.
Вот простой эксперимент, иллюстрирующий окислительно-восстановительную реакцию.
В химическом стакане находится раствор сульфата меди (CuSo4), в который погружена полоска цинка.Медь более электроотрицательна, чем цинк, а это означает, что она проявляет большую тенденцию к притяжению электронов и образованию отрицательных ионов меди. Как только полоска погружается в раствор, ионы меди (Cu2 +) захватывают электроны цинка, образуя атомы меди (Cu), которые осаждаются коричневатым слоем на полоске, в то время как атомы цинка (Zn) теперь лишены электроны становятся ионами цинка (Zn2 +), которые растворяются в растворе. По окончании реакции полоска стала тяжелее, и раствор стал насыщен цинком.
В быстрой реакции между металлами медь восстанавливается, поскольку она получает электроны, в то время как цинк окисляется, поскольку он теряет электроны (вспомните OIL RIG). Электричество — это просто поток электронов — электроны, которыми обмениваются в ходе реакции, можно использовать, скажем, для питания лампочки, но этого нельзя добиться в нашем стакане, поскольку электроны в нем небрежно рассредоточены. Чтобы обуздать их, мы должны каким-то образом, прежде чем они будут захвачены медью, направить каждый электрон в лампочке. Этого можно добиться не одним, а двумя стаканами.
Схема гальванического элемента
Теперь рассмотрим этот прибор, который представляет собой гальванический элемент.
Первый стакан содержит сульфат цинка (ZnSO4), в который погружена полоска цинка, а соседний стакан содержит сульфат меди (CuSO4), в который погружена полоска меди. Однако две полоски соединены внешней цепью, проводником, который соединен с лампочкой.
Элемент назван «гальваническим» в честь его изобретателя, физика Луиджи Гальвани.В 1780 году Гальвани продемонстрировал, что, когда два разных металла соединяются друг с другом на одном конце, а другие концы соединяются лапами лягушки, ноги сжимаются, указывая на поток электричества. Он назвал свой абсурдный аппарат «звериной схемой». Однако, чтобы бросить вызов Гальвани, Алессандро Вольта разработал ту же клетку без единого биологического компонента. Это было невероятное достижение, и по этой причине термины «гальванический» и «гальванический» используются как синонимы.
Несмотря на то, что их схемы работали, изобретатели ошибались относительно , почему они работали.Гальвани считал, что виновата лягушка, а Вольта полагал, что это были свойства отдельных металлов. В конце концов, именно Фарадей был прав, понимая, что электрическая энергия была получена в результате химических реакций, что источник напряжения был чисто химическим. Именно Фарадей придумал термины, которые теперь образуют электрический и электронный жаргон: металлы он назвал электродами — катодом и анодом , раствор, в который они были погружены, он назвал электролитом , и вовлеченные сущности он назвал ионами — катионов и анионов .
Как только цинковый и медный электроды погружаются в соответствующие сульфатные электролиты, начинается окислительно-восстановительная реакция: медь начинает притягивать электроны цинка. Так же, как это произошло в эксперименте с одним стаканом, атомы цинка в первом стакане окисляются и, следовательно, теряют свои электроны и становятся ионами цинка, которые растворяются в растворе сульфата цинка. Ионы меди в соседнем стакане уменьшаются по мере того, как они приобретают эти электроны и становятся атомами меди, которые осаждаются на полосе.
Однако, хотя два стакана физически разделены, электроды соединены внешним проводником. Электроны, а не рассеиваются, направляются к медному электроду через этот проводник. Однако, поскольку на этом проводнике находится лампочка, электроны не имеют другого выхода, пока не достигнут медной полосы, кроме как пройти через лампочку. Цинковый электрод, поскольку он питает электроны, является анодом батареи или отрицательной клеммой, в то время как медный электрод, который притягивает или принимает электроны, является катодом или положительной клеммой батареи.Поскольку один металл должен красть электроны у другого металла (или неметалла), электроотрицательность определяет направление тока в цепи.
(Фото: Wikimedia Commons)
Однако этикетки соответствуют стандартным соглашениям. Анод батареи, цинковая полоска — и это может сбить с толку читателя — на самом деле положительный, так как он лишен электронов из-за окисления, в то время как катод батареи, медная полоска, на самом деле отрицательный, так как он изобилует электронами из-за снижение.Цинк — это положительный электрод , , но отрицательный вывод , , тогда как медь — отрицательный электрод , , но положительный вывод , . Это различие очень важно.
Что такое Соляной мост?
Даже если электроны успешно проходят через проводник и, следовательно, через лампочку, лампочка не светится, потому что цепь еще не завершена. Завершает схему трубка на схеме, ножки которой погружены в оба стакана.Это называется соляным мостиком. Солевой мостик — это пористое вещество, состоящее из соли, по которой электроны не могут перемещаться, но катионы и анионы могут. Запрещая поток электронов, он автоматически исключает себя от участия или вмешательства в процесс. Его единственная цель — обменять ионы и замкнуть цепь.
Когда цинк окисляется и растворяется в растворе в виде катиона цинка, катион цинка проходит через мостик и попадает в соседний стакан. Там он образует сульфат цинка, замещая катион меди, который, смешанный с сульфат-анионом перед восстановлением, образует раствор сульфата меди.Точно так же, когда катион меди восстанавливается с образованием атома меди, оставшийся сульфат-анион проходит через мостик и попадает в первый стакан. Там он соединяется с окисленными катионами цинка с образованием сульфата цинка. Обмен гарантирует, что реакция сбалансирована или что цепь замкнута. Представление гальванического элемента или двух стаканов, соединенных пористым солевым мостиком, можно дополнительно свести к следующему:
Поскольку реакции восстановления и окисления протекают физически разделенными в двух разных стаканах, каждый стакан или блок называется полуячейкой. .Природа напряжения, в силу особого направления потока электронов, является постоянным. Величина этого постоянного напряжения представляет собой арифметическую разность напряжений в двух полуячейках. Разница дает относительную меру легкости растворения двух электродов в электролите. Следовательно, напряжение является функцией свойств обоих электродов и — электролита. Помните — и это стоит еще раз упомянуть — что напряжение чисто химическое.
Батареи сегодня содержат не один гальванический элемент, а пару или два из них, соединенных последовательно. Аккумулятор 12 В обычно состоит из 6 гальванических элементов. Батарея «умирает», когда все ее анионы растворяются в электролите, а все ее катионы осаждаются на электроде. Имейте в виду, что не все батареи используют цинк, медь и их сульфаты в качестве электродов и электролита. Что необходимо, так это разница в электроотрицательности электродов.
Большинство батарей фактически основаны на свинце и оксиде свинца в качестве анода и катода соответственно. Даже солевой мостик не обязательно должен состоять из той же соли, что и металлы. Просто нужно обеспечить необходимое количество катионов и анионов, чтобы уравновесить реакцию. В нашем примере, если бы он состоял из калия, он отдал бы два катиона калия на один катион цинка.
Гальваническая ячейка и электролитическая ячейка
Наконец, однажды мертвые гальванические элементы не могут быть восстановлены или перезаряжены.Вот почему нужно время от времени менять батарейки в будильнике или пульте дистанционного управления. Тип электрохимической ячейки, которую можно перезаряжать, — это электролитическая ячейка. Электролитическая ячейка также состоит из двух стаканов, заполненных электролитом, в которые погружены электроды, но она обеспечивает полную противоположность тому, что делает гальванический элемент: он преобразует электрическую энергию в химическую энергию.
Статьи по теме
Статьи по теме
Электроды подключены к источнику электроэнергии через внешнюю цепь.Однако потенциал, создаваемый этим источником, превышает потенциал, создаваемый окислительно-восстановительной реакцией. Причем источник установлен в направлении против направления . Следовательно, в результате своего большего потенциала он преодолевает силу входящих электронов и заставляет их менять свое направление. Затем электроны перетекают от медной полосы к цинковой полосе, так что теперь медь окисляется, а цинк восстанавливается. Таким образом, в отличие от гальванического элемента, который вырабатывает ток в результате окислительно-восстановительной реакции, электролитический элемент использует электрический ток для запуска окислительно-восстановительной реакции.Позже аккумулятор можно заменить лампочкой, сделав гальванический элемент только полностью заряженным.
Электрохимические ячейки | Безграничная химия
Гальванические элементы
Гальванический элемент — это устройство, которое вырабатывает электрический ток из энергии, выделяемой в результате спонтанной окислительно-восстановительной реакции в двух полуячейках.
Цели обучения
Напомним, что восстановление происходит на катоде, а окисление происходит на аноде в гальваническом элементе
Основные выводы
Ключевые моменты
- Окисление описывает потерю электронов молекулой, атомом или ионом.
- Редукция описывает усиление электронов молекулой, атомом или ионом.
- Электроны всегда текут от анода к катоду.
- Полуячейки соединены солевым мостиком, который позволяет ионам в растворе перемещаться из одной полуячейки в другую, так что реакция может продолжаться.
Ключевые термины
- окислительно-восстановительный потенциал : обратимая химическая реакция, в которой одна реакция является окислением, а обратная — восстановлением.
- полуэлемент : любая из двух частей электрохимической ячейки, содержащая электрод и электролит.
- гальванический элемент : Элемент, например аккумулятор, в котором в результате необратимой химической реакции вырабатывается электричество; аккумулятор, который нельзя перезарядить.
Электрохимический элемент — это устройство, вырабатывающее электрический ток из энергии, выделяющейся в результате спонтанной окислительно-восстановительной реакции. Этот вид ячейки включает гальваническую или гальваническую ячейку, названную в честь Луиджи Гальвани и Алессандро Вольта.Эти ученые провели несколько экспериментов с химическими реакциями и электрическим током в конце 18 века.
Электрохимические ячейки имеют два проводящих электрода, называемых анодом и катодом. Анод определяется как электрод, на котором происходит окисление. Катод — это электрод, на котором происходит восстановление. Электроды могут быть изготовлены из любых достаточно проводящих материалов, таких как металлы, полупроводники, графит и даже проводящие полимеры. Между этими электродами находится электролит, содержащий ионы, которые могут свободно перемещаться.
В гальваническом элементе используются два разных металлических электрода, каждый в растворе электролита. Анод подвергнется окислению, а катод — восстановлению. Металл анода окислится, переходя от степени окисления 0 (в твердой форме) к положительной степени окисления, и он станет ионом. На катоде ион металла в растворе будет принимать один или несколько электронов от катода, и степень окисления иона снизится до 0. Это образует твердый металл, который откладывается на катоде.Два электрода должны быть электрически соединены друг с другом, чтобы обеспечить поток электронов, который покидает металл анода и проходит через это соединение к ионам на поверхности катода. Этот поток электронов представляет собой электрический ток, который можно использовать для работы, например, для поворота двигателя или включения света.
Пример реакции
Принцип действия гальванического элемента — это одновременная реакция окисления и восстановления, называемая окислительно-восстановительной реакцией. Эта окислительно-восстановительная реакция состоит из двух полуреакций.В типичном гальваническом элементе окислительно-восстановительная пара представляет собой медь и цинк, представленные в следующих полуэлементных реакциях:
Цинковый электрод (анод): Zn (s) → Zn 2+ (водн.) + 2 e —
Медный электрод (катод): Cu 2+ (водн.) + 2 e — → Cu (s)
Ячейки построены в отдельных стаканах. Металлические электроды погружены в растворы электролита. — [/ latex]), которые проходят через провод к медному катоду.- \ rightarrow \ text {Cu} [/ latex]). Во время реакции будет использоваться цинковый электрод, и металл будет уменьшаться в размерах, в то время как медный электрод станет больше из-за осажденной меди, которая образуется. Солевой мостик необходим, чтобы заряд не проходил через ячейку. Без солевого мостика электроны, образующиеся на аноде, будут накапливаться на катоде, и реакция прекратится.
Гальванические элементы обычно используются в качестве источника электроэнергии. По своей природе они производят постоянный ток.Батарея — это набор гальванических элементов, соединенных параллельно. Например, свинцово-кислотная батарея имеет элементы с анодами из свинца и катодами из диоксида свинца.
Ячейки электролитические
Электролиз использует электрическую энергию, чтобы вызвать химическую реакцию, которая затем протекает в электролитической ячейке.
Цели обучения
Вспомните три компонента, необходимые для создания электролитической ячейки
Основные выводы
Ключевые моменты
- Электрометаллургия — это процесс восстановления металлов из металлических соединений для получения металла в чистой форме с помощью электролиза.
- Электролиз иногда можно рассматривать как запуск несамопроизвольного гальванического элемента.
- Электроды из металла, графита и полупроводников широко используются в электролизе.
- Другие системы, в которых используется электролитический процесс, используются для производства металлического натрия и калия, газообразного хлора, гидроксида натрия и хлората калия и натрия.
Ключевые термины
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
- электролитический : Относящийся к электролизу или использующий его.
В химии и производстве электролиз — это метод использования постоянного электрического тока (DC) для запуска в противном случае не спонтанной химической реакции. Электролиз является коммерчески важным этапом в процессе отделения элементов из природных источников, таких как руда.
Электролиз — это прохождение постоянного электрического тока через ионное вещество, которое либо расплавлено, либо растворено в подходящем растворителе, что приводит к химическим реакциям на электродах и разделению материалов.
Электролиз иногда можно рассматривать как запуск несамопроизвольного гальванического элемента. В зависимости от того, насколько свободно элементы отдают электроны (окисление) и насколько энергетически выгодно элементам получать электроны (восстановление), реакция может не быть спонтанной. Путем подачи извне энергии для преодоления энергетического барьера спонтанной реакции желаемая реакция «разрешается» протекать при особых обстоятельствах.
Основные компоненты, необходимые для проведения электролиза:
- Электролит: вещество, содержащее свободные ионы, переносящие электрический ток.Если ионы неподвижны, как в твердой соли, то электролиз не может происходить.
- Источник постоянного тока (DC): обеспечивает энергию, необходимую для создания или разряда ионов в электролите. Электрический ток переносится электронами во внешней цепи.
- Два электрода: электрический проводник, который обеспечивает физический интерфейс между электрической цепью, обеспечивающей энергию, и электролитом.
Типичная электролизная ячейка : Ячейка, используемая в элементарных химических экспериментах для получения газа в качестве продукта реакции и измерения его объема.
Широко используются электроды из металла, графита и полупроводников. Выбор подходящего электрода зависит от химической активности электрода и электролита, а также от стоимости производства.
Другие системы, в которых используется электролитический процесс, используются для производства металлического натрия и калия, газообразного хлора, гидроксида натрия и хлората калия и натрия.
Обозначение электрохимической ячейки
Обозначение ячейки — это сокращение, которое выражает определенную реакцию в электрохимической ячейке.
Цели обучения
Создание соответствующей записи электрохимической ячейки для данной электрохимической реакции
Основные выводы
Ключевые моменты
- Анод и катод ячейки (полуэлементы) разделены двумя полосами или косыми чертами, которые представляют собой солевой мостик.
- Анод расположен слева, а катод — справа.
- Отдельные твердые, жидкие или водные фазы в каждой полуячейке написаны разделенными одной полосой.
- Концентрации растворенных веществ могут быть указаны в скобках после обозначения фазы (s, l, g или aq).
Ключевые термины
- полуэлемент : любая из двух частей электрохимической ячейки, содержащая электрод и электролит.
- электрод : Клемма, через которую электрический ток проходит между металлическими и неметаллическими частями электрической цепи. При электролизе электроды помещают в раствор отдельно.\ text {o} _ {\ text {окисление}} [/ latex]
Обозначения ячеек — это сокращенное описание гальванических или гальванических (спонтанных) ячеек. Условия реакции (давление, температура, концентрация и т. Д.), Анод, катод и компоненты электрода описаны в этом уникальном сокращении.
Напомним, что окисление происходит на аноде, а восстановление происходит на катоде. Когда анод и катод соединены проволокой, электроны текут от анода к катоду.
Типичный гальванический элемент : Типичное расположение полуэлементов, соединенных в гальванический элемент.- \ rightleftharpoons 2 \ text {Ag} (\ text {s}) [/ latex]
Правила нотации ячеек
1. Сначала описывается анодный полуэлемент; следует катодная полуячейка. В пределах данной полуячейки сначала указываются реагенты, а в последнюю очередь — продукты. Описание реакции окисления идет первым, а реакция восстановления — последним; когда вы ее читаете, ваши глаза движутся в направлении потока электронов. Ионы зрителя не включены.
2. Одна вертикальная линия (|) проведена между двумя химическими соединениями, которые находятся в разных фазах, но находятся в физическом контакте друг с другом (например,г., твердый электрод | жидкость с электролитом). Двойная вертикальная линия (||) представляет собой солевой мостик или пористую мембрану, разделяющую отдельные полуячейки.
3. Фаза каждого химического вещества (s, l, g, aq) указана в скобках. Если электролиты в ячейках не соответствуют стандартным условиям, концентрациям и / или давлению, они заключаются в скобки с обозначением фазы. Если концентрация или давление не указаны, предполагается, что электролиты в ячейках находятся в стандартных условиях (1.00 М или 1,00 атм и 298 К).
Используя эти правила, мы составили обозначение ячейки:
Cd (s) | Cd 2+ (водн., 0,15 M) || Ag + (водн., 0,20 M) | Аг (ов)
2.1: Гальванические элементы — Chemistry LibreTexts
Цели обучения
- Чтобы понять основы гальванических элементов
- Для подключения напряжения от гальванического элемента к основной окислительно-восстановительной системе
В любом электрохимическом процессе электроны перетекают от одного химического вещества к другому в результате окислительно-восстановительной (окислительно-восстановительной) реакции.Окислительно-восстановительная реакция происходит, когда электроны переходят от окисляемого вещества к восстанавливаемому. Восстановитель — это вещество, которое теряет электроны и окисляется в процессе; Окислитель — это вещество, которое приобретает электроны и восстанавливается в процессе. Соответствующая потенциальная энергия определяется разностью потенциалов между валентными электронами в атомах разных элементов.
Поскольку восстановление невозможно без окисления и наоборот, окислительно-восстановительная реакция может быть описана как две полуреакции , одна представляет собой процесс окисления, а другая — процесс восстановления.{-}} \ nonumber \]
Каждая полуреакция написана, чтобы показать, что на самом деле происходит в системе; \ (\ ce {Zn} \) — это восстановитель в этой реакции (он теряет электроны), а \ (\ ce {Br2} \) — окислитель (он получает электроны). Сложение двух половинных реакций дает общую химическую реакцию (Уравнение \ (\ PageIndex {1} \)). Окислительно-восстановительная реакция уравновешивается, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Как и любое сбалансированное химическое уравнение, весь процесс электрически нейтрален; то есть чистый заряд одинаков для обеих сторон уравнения.
В любой окислительно-восстановительной реакции количество электронов, потерянных в результате реакции (й) окисления, равно количеству электронов, полученному в результате реакции (й) восстановления.
В большинстве наших обсуждений химических реакций мы предполагали, что реагенты находятся в тесном физическом контакте друг с другом. Кислотно-основные реакции, например, обычно проводят с кислотой и основанием, диспергированными в одной фазе, такой как жидкий раствор. Однако с помощью окислительно-восстановительных реакций можно физически разделить полуреакции окисления и восстановления в космосе, если существует полная цепь, включая внешнее электрическое соединение, такое как провод, между двумя полуреакциями.По мере развития реакции электроны текут от восстановителя к окислителю через это электрическое соединение, производя электрический ток, который можно использовать для выполнения работы. Аппарат, который используется для выработки электричества в результате спонтанной окислительно-восстановительной реакции или, наоборот, который использует электричество для запуска неспонтанной окислительно-восстановительной реакции, называется электрохимическим элементом .
Есть два типа электрохимических ячеек: гальванические ячейки и электролитические ячейки. Гальванические клетки названы в честь итальянского физика и врача Луиджи Гальвани (1737–1798), который наблюдал, как рассеченные мышцы ног лягушки подергивались при применении небольшого электрического разряда, демонстрируя электрическую природу нервных импульсов.Гальванический (гальванический) элемент использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции (\ (ΔG <0 \)), для выработки электричества. Этот тип электрохимического элемента часто называют гальваническим элементом в честь его изобретателя, итальянского физика Алессандро Вольта (1745–1827). Напротив, электролитическая ячейка потребляет электроэнергию от внешнего источника, используя ее, чтобы вызвать неспонтанную окислительно-восстановительную реакцию (\ (ΔG> 0 \)). Оба типа содержат два электрода , которые представляют собой твердые металлы, подключенные к внешней цепи, которая обеспечивает электрическое соединение между двумя частями системы (рисунок \ (\ PageIndex {1} \)).Полуреакция окисления происходит на одном электроде (анод ), а полуреакция восстановления происходит на другом (катод ). Когда цепь замкнута, электроны текут от анода к катоду. Электроды также соединены электролитом, ионным веществом или раствором, который позволяет ионам перемещаться между отсеками электродов, тем самым поддерживая электрическую нейтральность системы. В этом разделе мы сосредоточимся на реакциях, происходящих в гальванических элементах.
Рисунок \ (\ PageIndex {1} \): Электрохимические ячейки. Гальванический элемент (слева) преобразует энергию, выделяемую в результате спонтанной окислительно-восстановительной реакции, в электрическую энергию, которую можно использовать для выполнения работы. Окислительные и восстановительные полуреакции обычно протекают в отдельных отсеках, которые соединены внешней электрической цепью; Кроме того, второе соединение, которое позволяет ионам перемещаться между отсеками (показано здесь вертикальной пунктирной линией, обозначающей пористый барьер), необходимо для поддержания электрической нейтральности.Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток. В электролитической ячейке (справа) внешний источник электроэнергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только один отсек. В обоих типах электрохимических ячеек анод является электродом, на котором происходит полуреакция окисления, а катод является электродом, на котором происходит полуреакция восстановления.{2+} (водн.) + Cu (s)} \ label {20.3.4} \]Мы можем вызвать эту реакцию, вставив цинковый стержень в водный раствор сульфата меди (II). По мере протекания реакции цинковый стержень растворяется, и образуется масса металлической меди. Эти изменения происходят спонтанно, но вся выделяемая энергия находится в форме тепла, а не в форме, которую можно использовать для выполнения работы.
Рисунок \ (\ PageIndex {2} \): Реакция металлического цинка с водными ионами меди (II) в одном отсеке.{2 +}} \) ионов в растворе уменьшается (Рисунок \ (\ PageIndex {3b} \)). Таким образом, мы провели ту же реакцию, что и с использованием одного химического стакана, но на этот раз окислительная и восстановительная полуреакции физически отделены друг от друга. Электроны, которые высвобождаются на аноде, проходят через провод, создавая электрический ток. Таким образом, гальванические элементы преобразуют химическую энергию в электрическую, которую затем можно использовать для работы. Рисунок \ (\ PageIndex {3} \): Реакция металлического цинка с водными ионами меди (II) в гальванической ячейке.(а) Гальванический элемент можно сконструировать, вставив медную полоску в стакан, содержащий 1 М водный раствор ионов Cu 2 + и полоску цинка, в другой стакан, содержащий 1 М водный раствор Zn. 2 + ионов. Две металлические полоски соединены проводом, по которому течет электричество, а химические стаканы соединены солевым мостиком. Когда переключатель замыкается для замыкания цепи, цинковый электрод (анод) самопроизвольно окисляется до ионов Zn 2 + в левом отсеке, а ионы Cu 2 + одновременно восстанавливаются до металлической меди при медный электрод (катод).(b) По мере развития реакции анод из цинка теряет массу, поскольку он растворяется с образованием ионов Zn 2 + (водн.), в то время как катод Cu набирает массу по мере восстановления ионов Cu 2 + (водн.). с металлической медью, которая осаждается на катоде. (CC BY-SA-NC; анонимно)Электролит в солевом мостике служит двум целям: он замыкает цепь, неся электрический заряд, и поддерживает электрическую нейтральность в обоих растворах, позволяя ионам перемещаться между ними. Идентичность соли в солевом мостике не имеет значения, пока составляющие ионы не вступают в реакцию или не подвергаются окислительно-восстановительной реакции в рабочих условиях ячейки.{2 +}} \) решение. В отсутствие солевого мостика или какой-либо другой подобной связи реакция быстро прекратится, поскольку электрическая нейтральность не может быть сохранена.
Вольтметр можно использовать для измерения разницы электрических потенциалов между двумя отсеками. Открытие переключателя, который соединяет провода с анодом и катодом, предотвращает протекание тока, поэтому химическая реакция не происходит. Однако при замкнутом переключателе внешняя цепь замкнута, и электрический ток может течь от анода к катоду.Потенциал (\ (E_ {cell} \)) ячейки, измеренный в вольтах, представляет собой разность электрического потенциала между двумя половинными реакциями и связан с энергией, необходимой для перемещения заряженной частицы в электрическом поле. . В описанной нами ячейке вольтметр показывает потенциал 1,10 В (рисунок \ (\ PageIndex {3a} \)). Поскольку электроны из полуреакции окисления высвобождаются на аноде, анод в гальваническом элементе заряжается отрицательно. Катод, притягивающий электроны, заряжен положительно.
Не все электроды подвергаются химическому превращению во время окислительно-восстановительной реакции. Электрод может быть изготовлен из инертного металла с высокой проводимостью, такого как платина, чтобы предотвратить его реакцию во время окислительно-восстановительного процесса, где он не проявляется в общей электрохимической реакции. Это явление проиллюстрировано в Примере \ (\ PageIndex {1} \).
Гальванический (гальванический) элемент преобразует энергию, выделяемую спонтанной химической реакцией , в электрическую энергию.Электролитическая ячейка потребляет электроэнергию от внешнего источника для запуска несамопроизвольной химической реакции .
Пример \ (\ PageIndex {1} \)
Химик сконструировал гальванический элемент, состоящий из двух стаканов. В одном стакане находится полоска олова, погруженная в водный раствор серной кислоты, а в другом — платиновый электрод, погруженный в водный раствор азотной кислоты. Два раствора соединены солевым мостиком, а электроды соединены проволокой.{2+} (водн.) + 2НО (г) + 4х3О (л)} \ nonumber \]
Для гальванического элемента
- запишите половину реакции, которая происходит на каждом электроде.
- указывают, какой электрод является катодом, а какой — анодом.
- указывают, какой электрод является положительным электродом, а какой — отрицательным.
Дано: гальванический элемент и окислительно-восстановительная реакция
Запрошено: полуреакций, идентичность анода и катода, а также назначение электродов как положительное или отрицательное
Стратегия:
- Укажите полуреакцию окисления и полуреакцию восстановления.Затем определите анод и катод по полуреакции, которая происходит на каждом электроде.
- По направлению потока электронов назначьте каждый электрод как положительный, так и отрицательный.
Решение
A В полуреакции восстановления нитрат восстанавливается до оксида азота. (Оксид азота затем реагировал бы с кислородом воздуха с образованием NO 2 с его характерным красно-коричневым цветом.) В полуреакции окисления металлическое олово окисляется.{-}} \ nonumber \]
Таким образом, нитрат восстанавливается до NO, а оловянный электрод окисляется до Sn 2 + .
Поскольку реакция восстановления происходит на платиновом электроде, это катод. И наоборот, реакция окисления происходит на оловянном электроде, поэтому это анод.
B Электроны текут от оловянного электрода по проволоке к платиновому электроду, где переходят в нитрат. Электрическая цепь замыкается солевым мостиком, который обеспечивает диффузию катионов к катоду и анионов к аноду.{-}} \ end {align *} \]
- Ответ б
Pt электрод в растворе перманганата является катодом; в растворе олова — анод.
- Ответ c
Катод (электрод в стакане с раствором перманганата) положительный, а анод (электрод в стакане, который содержит раствор олова) — отрицательный.
Построение диаграмм ячеек (нотация ячеек)
Поскольку описать словами любой гальванический элемент несколько затруднительно, были разработаны более удобные обозначения.В этой линейной нотации, называемой диаграммой ячейки, идентичность электродов и химический состав отсеков указываются их химическими формулами, причем анод написан в крайнем левом углу, а катод — в крайнем правом углу. Фазовые границы показаны одиночными вертикальными линиями, а солевой мостик, имеющий две фазовые границы, — двойной вертикальной линией. Таким образом, диаграмма ячейки \ (\ ce {Zn / Cu} \), показанная на рисунке \ (\ PageIndex {3a} \), записывается следующим образом:
Рисунок \ (\ PageIndex {4} \): диаграмма ячеек включает концентрации раствора, если они указаны.Термин + M предназначен для обозначения подходящей концентрации вида. Если разновидностью является газ, вместо этого вы подставляете давление.Гальванические элементы могут иметь иное устройство, нежели примеры, которые мы видели до сих пор. Например, напряжение, создаваемое окислительно-восстановительной реакцией, можно более точно измерить, используя два электрода, погруженные в один стакан, содержащий электролит, замыкающий цепь. {+} (aq)} \ nonumber \]
Гальванический элемент с одним отсеком изначально будет показывать такое же напряжение, что и гальванический элемент, построенный с использованием отдельных отсеков, но он будет быстро разряжаться из-за прямой реакции реагента на аноде с окисленным элементом катодной окислительно-восстановительной пары.{2 +} (водн.) + 2NO (г) + 4h3O (l)} \ nonumber \]
Дано: Гальванический элемент и окислительно-восстановительная реакция
Спросил: Схема ячеек
Стратегия:
Используя описанные символы, напишите диаграмму ячейки, начиная с полуреакции окисления слева.
Решение
Анодом является оловянная полоска, а катодом — электрод \ (\ ce {Pt} \). Начиная с анода слева, мы обозначим фазовую границу между электродом и раствором олова вертикальной чертой.{-}} \)) не участвует в общей реакции, поэтому не требует специального указания. Катодный отсек содержит водную азотную кислоту, которая участвует в общей реакции, вместе с продуктом реакции (\ (\ ce {NO} \)) и электродом \ (\ ce {Pt} \). {2 +} (aq) \, || \, HNO3 (aq) \, | \, NO (g) \, | \, Pt_ ( s)} \ nonumber \]
Концентрации раствора не указаны, поэтому они не включены в эту диаграмму ячеек.+ (aq, \; 1 \, M) \, | \, Ag (s)} \ nonumber \]
Сводка
Гальванический (гальванический) элемент использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции, для выработки электричества, тогда как электролитический элемент потребляет электрическую энергию от внешнего источника, чтобы вызвать реакцию. Электрохимия — это изучение взаимосвязи между электричеством и химическими реакциями. Реакция окисления-восстановления, которая происходит во время электрохимического процесса, состоит из двух полуреакций, одна представляет собой процесс окисления, а другая — процесс восстановления.Сумма полуреакций дает общую химическую реакцию. Общая окислительно-восстановительная реакция уравновешивается, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Электрический ток создается потоком электронов от восстановителя к окислителю. Электрохимическая ячейка может либо генерировать электричество в результате спонтанной окислительно-восстановительной реакции, либо потреблять электричество для запуска несамопроизвольной реакции. В гальваническом (гальваническом) элементе энергия спонтанной реакции генерирует электричество, тогда как в электролитическом элементе электрическая энергия расходуется для запуска неспонтанной окислительно-восстановительной реакции.Оба типа ячеек используют два электрода, которые обеспечивают электрическое соединение между системами, разделенными в пространстве. Окислительная полуреакция происходит на аноде, а восстановительная полуреакция происходит на катоде. Солевой мостик соединяет разделенные растворы, позволяя ионам перемещаться в любой раствор, обеспечивая электрическую нейтральность системы. Вольтметр — это устройство, которое измеряет поток электрического тока между двумя полуреакциями. Потенциал ячейки, измеряемый в вольтах, — это энергия, необходимая для перемещения заряженной частицы в электрическом поле.Электрохимическая ячейка может быть описана с использованием линейных обозначений, называемых диаграммой ячейки, в которой вертикальные линии указывают границы фаз и расположение солевого мостика. Сопротивление потоку заряда на границе называется потенциалом перехода.
Гальванический элемент— обзор
Для гальванического элемента
(122) M (Hg) | MX (cin S) | AgX (s) | Ag (s),
, который включает химическую реакцию
(123 ) M (Hg) + AgX (s) ⇆MX (solv) + Ag (s),
ЭДС определяется соотношением
(124) −nFE = ∑β = 1v∑i = 1kωi (β) μi ( β).
В уравнениях. (122) и (123), M (Hg) представляет собой электрод из амальгамы щелочного металла, MX — сольватированный галогенид щелочного металла M с концентрацией c в растворителе S, и AgX (s) / Ag (s) — серебро. галогенидно-серебряный электрод. Уравнение (124) представляет собой общее выражение для электродвижущей силы E гальванического элемента без жидкостного перехода, в котором произвольная реакция ячейки ω1Y1 + ω2Y2 +… ⇆ωiYi +… ,, имеет место между k компонентов в ν фазах. В уравнении. (124) n — число молей электронов, перенесенных во время этого процесса от анода к катоду через внешнюю цепь, F число Фарадея и μ (β) i химический потенциал компонента Y и в фазе β.Ячейки с жидкостными переходами требуют электродвижущей силы E в уравнении. (124) следует заменить на величину E — E D , где E D — потенциал диффузии из-за жидкостного перехода. Стандартный потенциал E ° для ячейки, исследованной по формуле. (122) определяется соотношением
(125) FE ° = — [μAg * + μMX∞ − μAgX * −μM (Hg) sat].
То есть E ° было бы измеренной ЭДС, если бы все компоненты находились в своих стандартных состояниях.Следовательно, для данного примера, уравнение. (124) можно записать как
(126) E = E ° −RTFlnaMXaM (Hg) = E ′ ° −2RTFln (acy ′ ±)
, если концентрация металла в амальгаме остается постоянной для серии измерений.
Уравнение (126) снова относится к типу, заданному формулой. (98). Анализ данных по разбавленным растворам вместе с уравнениями (99) и (100) дает E ′ ° и K A в качестве желаемой информации. Константа ассоциации K A , полученная таким образом, согласуется с таковыми из измерений теплот разбавления или проводимости.
Согласно формуле. (126) эталонный потенциал E ′ ° при активности a M (Hg) определяется соотношением
(127) E ′ ° = E ° + RTFlnaM (Hg)
и дает стандартный потенциал E °, если известна активность a M (Hg) . Следовательно, энергия Гиббса перехода электролита MX из чистого в бесконечно разбавленное состояние в растворителе S доступна:
(128) μMX∞ − μMX * = ΔsolGMX∞ = −FE ° + μAgX * −μMX *.
Измерения ЭДС как функции температурного выхода Δ sol H ∞ MX в соответствии с калориметрическими данными.
Измерения ЭДС также широко используются для расчета коэффициентов активности при концентрациях, превышающих предел достоверности модельных расчетов. Для этого уравнение. (126) используется для определения y ± , y ± = α y ′ ± , после предварительного определения E ′ ° из данных разбавленного раствора.
Металлацикл · Гальванические элементы
Гальванические элементы преобразуют химическую энергию в электрическую. В последующем обсуждении мы рассмотрим, как устроены гальванические элементы физически и как мы можем измерять и прогнозировать напряжение, создаваемое гальваническим элементом известного состава.
Теория гальванических элементов
Основным практическим аппаратом электрохимии является ячейка, устройство, которое преобразует изменение свободной энергии, связанное со спонтанной окислительно-восстановительной реакцией, в электрическую энергию.Хотя процесс преобразования энергии звучит технически, на практике идея довольно проста: мы просто разделяем «дающего» и «принимающего» электроны в пространстве, так что электроны должны течь, чтобы осуществить окислительно-восстановительную реакцию. Подумайте об энергии, генерируемой бейсбольным мячом, перемещающимся от руки питчера к перчатке кетчера на расстоянии девяноста футов. Разделение бросающего и улавливающего позволяет нам использовать энергию мяча во время его полета к своей тарелке. Точно так же, разделив процессы окисления и восстановления в космосе и соединив их проводящим проводом, мы можем использовать энергию, связанную с током, протекающим через провод, когда происходят реакции.Устройство, в котором для выработки электрического тока используется спонтанная окислительно-восстановительная реакция, называется гальваническим элементом .
Любой практический гальванический элемент содержит два компонента: «восстанавливающую» систему, которая высвобождает электроны, и «окислительную» систему, которая поглощает электроны. Однако, ограничиваясь теоретическими ситуациями, мы можем представить себе половину гальванического элемента как устройство, которое либо выпускает электроны в забвение, либо забирает их из забвения. Полуреакция , связанная с такой полуячейкой , включает электроны в свое химическое уравнение: мы указываем высвобождение электронов, записывая их на стороне продуктов, и поглощение электронов, записывая их на стороне реагентов.-} \ rightarrow \ mathrm {Cu} (s) $$
Как написано, это уравнение представляет собой «окислительную» систему, которая забирает электроны из проволоки. Аппарат для этого электрода выглядит довольно утомительно. Кусок металлической меди, прикрепленный к проводящему проводу (который также может быть сделан из меди, но не обязательно), погружают в раствор ионов меди (II) и невинного противоаниона.
Концентрация ионов меди (II) в растворе связана с напряжением на ячейках, содержащих полуячейку Cu | Cu 2+ , как мы скоро увидим.Так же, как изменения свободной энергии зависят от концентраций (напомним, \ (\ Delta G = -RT \ ln K \)), напряжения в ячейках также зависят от концентраций. Концентрации 1,0 моль / л являются стандартом в электрохимии, поэтому мы можем представить наш стандартный медный электрод в обозначении ячейки как «Cu | Cu 2+ (1 M)». Вертикальная черта указывает на фазовую границу между твердой металлической медью и водными ионами меди (II). Думайте об этой нотации как о текстовой форме описанного выше аппарата.
Конечно, эта установка не будет самопроизвольно всасывать электроны из воздуха.Чтобы фактически сделать его частью практического элемента, мы должны подключить его к источнику электронов — восстанавливающему электроду с достаточной энергией, чтобы поставлять электроны для восстановления меди (II). Оказывается, металлический цинк прекрасно работает. Металлический цинк может отдать два электрона, чтобы стать катионом цинка (II), и это будет происходить самопроизвольно в присутствии катионов меди (II) (Δ G ° = –212,3 кДж / моль). {2 +}} (водн.) $$
Практические проблемы: солевые мостики и электролиты
Тогда мы можем подключить медный электрод к цинковому и ожидать, что произойдет какое-то волшебство…
Объединение двух полуэлементов: будут ли электроны перетекать со стороны цинка на сторону меди?У нас есть восстановительный металл (Zn), связанный с супом окисляющих катионов (Cu 2+ ). Разве электроны не должны самопроизвольно перемещаться из одной стороны в другую? Вначале будут, но процесс очень быстро остановится. Почему? Наша нынешняя установка представляет собой разомкнутую цепь: когда электроны движутся слева направо, положительный заряд будет накапливаться слева, а отрицательный — справа.Энергия, необходимая для поддержания такого разделения зарядов, намного больше, чем энергия, которую может дать любая окислительно-восстановительная реакция. После минимального разделения зарядов электроны самопроизвольно потекут в другую сторону, чтобы каждый электрод оставался нейтральным. Ток не может течь в разомкнутой цепи!
Нам нужен механизм, возвращающий противоположные заряды в каждый стакан, когда электроны текут слева направо по проводу. Если бы катионы и анионы в растворе могли каким-то образом прыгать между стаканами, мы могли бы гарантировать, что даже когда электроны протекают по проволоке, общие заряды на обоих электродах остаются близкими к нулю.Канал, называемый соляным мостиком , делает свое дело: ионы могут проходить через солевой мостик, чтобы уравновесить заряд, передаваемый при движении электронов по проводу. На практике солевой мостик может быть таким же простым, как кусок смоченной фильтровальной бумаги между двумя стаканами. Более сложные солевые мостики представляют собой U-образные трубки с пористыми пробками на обоих концах, которые позволяют ионам перемещаться между стаканами. Невинные ионы (щелочные металлы и анионы, которые универсально растворимы в воде, такие как галогениды или нитраты) добавляются к растворам в каждом химическом стакане для увеличения проводимости растворов; эти проводящие растворы называются электролитами .
При установленном солевом мостике чистый заряд в каждом стакане остается очень близким к нулю при протекании тока.В этом устройстве есть все ключевые элементы гальванического элемента: восстанавливающий электрод, который высвобождает электроны, окислительный электрод, который захватывает их, и солевой мостик, гарантирующий, что каждый электрод поддерживает нулевой общий заряд. Восстановительный электрод (Zn | Zn 2+ в нашем примере) называется анодом , а окисляющий электрод (Cu 2+ | Cu) называется катодом .Один хороший способ запомнить это — отметить, что в солевом мостике иона движутся к кат ода и ионов движутся к ода . Поместив электрическое устройство (например, лампочку) вдоль провода, мы можем использовать падение напряжения, связанное с окислительно-восстановительной реакцией, для питания устройства.
В работающем гальваническом элементе катионы текут к катоду, а анионы — к аноду.Теперь, когда мы увидели, как устроен типичный гальванический элемент, давайте исследуем, как определить напряжение на элементе.\ circ \)) — напряжение на ячейке. Отрицательный знак гарантирует, что отрицательная свободная энергия соответствует положительному напряжению — электрики связывают батареи и другие источники электроэнергии с положительным напряжением. В некотором смысле, приведенное выше уравнение просто отражает определение Вольт как 1 Джоуль на кулон: умноженные на кулоны вольты равны джоулям. Маленькие кружки рядом с \ (G \) и \ (E \) показывают, что это соотношение относится к стандартным условиям: концентрация всех ионов в растворе 1 моль / л, давление любых газов 1 бар и 25 ° C.
Как и энергия, напряжение наиболее полезно в качестве относительной (а не абсолютной) величины. То, что мы определяем как «ноль» напряжения, не так важно; относительные различия в напряжении («падения» напряжения или разность потенциалов) — вот что мы используем для выполнения электрических работ. Тем не менее, мы должны согласовать общую нулевую точку, чтобы напряжения, измеренные разными людьми, были сопоставимы, а нулевое напряжение для гальванических элементов определяется как напряжение на стандартном водородном электроде (SHE).
Определение SHE как эталона нулевого напряжения предполагает стандартный эксперимент по измерению напряжения других полуэлементов. Подключаем интересующую полуячейку к ШЭ и измеряем генерируемое при этом напряжение. Полуячейка может обладать достаточной окислительной способностью, чтобы вытягивать электроны из газообразного водорода, образуя протоны в SHE. В этом случае напряжение, соответствующее полуячейке, положительное (по соглашению). Электроны будут самопроизвольно течь от SHE к заказной полуячейке (что произойдет с pH раствора в SHE?).
Если полуэлемент не может окислять водород в SHE, то он должен восстанавливать протоны в SHE (если только полуэлемент не является сам по себе SHE, и в этом случае он ничего не сделает!). Восстановление — это обратная реакция окисления, поэтому, если полуячейка не может окислять водород в SHE, то он должен самопроизвольно окисляться протонами в SHE. В этом случае напряжение на полуячейке будет отрицательным, и электроны будут течь в обратном направлении, от полуячейки к SHE.
Стандартный эксперимент по измерению напряжения был проведен на всех типах полуэлементов (и список продолжает расти по сей день). В таблицах стандартных восстановительных потенциалов перечислены напряжения, связанные с полуэлементами. Обратите внимание, что для истинного понимания того, что означают напряжения, необходимо понимать схему стандартного эксперимента (и распознавать SHE в качестве стандартного электрода). Учтите, что использование невероятно электроположительного электрода Li | Li + в качестве эталона нулевого напряжения сделало бы напряжение почти любого другого электрода положительным — металлический литий почти всегда будет служить анодом и выделять электроны.Согласно соглашению, положительные напряжения соответствуют самопроизвольному восстановлению полуэлемента SHE (поэтому их называют восстановительными потенциалами ), а отрицательные напряжения соответствуют самопроизвольному окислению SHE.
Напряжения в ячейках произвольной формы при стандартных условиях
Ни в одной практичной батарее не используется стандартный водородный электрод по двум причинам: (1) с газообразным водородом сложно работать, и (2) в SHE используется безумно дорогой платиновый электрод.Вместо этого в практичных батареях используются металлы, соли металлов и другие твердые или жидкие вещества, с которыми проще обращаться и которые дешевле. Нас часто интересует расчет ожидаемого напряжения на батарее этого типа. Прежде чем тратить деньги на создание двух полуэлементов и их соединение друг с другом, мы хотели бы быть достаточно уверены, что полученная батарея будет обеспечивать напряжение, достаточное для питания наших устройств! Этот расчет представляет большой интерес для таких компаний, как Energizer и Duracell!
Стандартный эксперимент по измерению напряжения показывает нам напряжение полуэлемента относительно SHE, но как мы можем определить напряжение на двух произвольных полуэлементах? Основная идея состоит в том, чтобы использовать тот факт, что свободная энергия Гиббса \ (G \) является функцией состояния.Поскольку \ (\ Delta G \) и \ (E \) связаны линейно согласно уравнению (5), напряжение ячейки \ (E \) также является функцией состояния: его значение зависит только от идентичности и концентраций реагентов. и продукты окислительно-восстановительной реакции, питающей аккумулятор. Путь, по которому мы превращаем реагенты в продукты, не важен; \ (E \) будет тем же самым, независимо от того, как мы разделим процесс, ведущий от реагентов к продуктам.
Рассмотрим комбинацию медных и цинковых электродов, с которыми мы работали до сих пор.{2 +}} (водн.) $
Кажется, что стандартные восстановительные потенциалы меди и цинка имеют отношение к этой реакции, но как так? Представьте, что мы вводим в процесс газообразный водород и протоны следующим образом. Сначала газообразный водород используется для восстановления меди (II) до меди с двумя протонами в качестве побочного продукта. Эти же два протона затем используются для окисления металлического цинка до цинка (II), регенерируя газообразный водород. \ circ \ ll 0 \)).Это выпадает из математики, когда мы используем уравнение (7), но это также согласуется с нашими интуитивными представлениями о свободной энергии. Когда они соединены вместе, электроны с большой силой будут течь от окисленной стороны (помните, она теряет электроны) к восстановленной стороне. Точно так же, как сильная кислота активно реагирует с сильным основанием, сильный окислитель сильно оттягивает электроны от сильного восстановителя. И окислительно-восстановительные, и кислотно-основные реакции протекают интенсивно, потому что реагенты имеют гораздо более высокую свободную энергию Гиббса, чем продукты.В первом случае мы используем высвободившуюся свободную энергию для выполнения электрических работ в цепи. В последнем случае энергия кислотно-щелочной реакции может выделяться в виде тепла, использоваться для фазового перехода или даже преобразовываться в электрическую работу!
Стандартные восстановительные потенциалы основаны не только на SHE, но и на стандартных концентрациях, давлениях и температурах всех реагентов. Любые расчеты, в которых используются только стандартные восстановительные потенциалы, такие как «закон Бурделла», неявно предполагают, что все компоненты в ячейке находятся в стандартных условиях.Конечно, как только мы действительно подключаем ячейку к нагрузке, ее состояние начинает меняться! Как рассчитать напряжение на элементе, когда его компоненты находятся в нестандартных условиях?
Напряжение в нестандартных условиях
Прежде чем раскрывать количественные детали того, как рассчитать нестандартное напряжение, давайте концептуально подумаем о проблеме в контексте кислотно-щелочной химии. Рассмотрим кислотно-щелочную реакцию между гидроксидом и уксусной кислотой (связь с электрохимией станет ясной, поверьте мне).-O_2CCH_3} $$
Если мы хотим выжать из реакции (9) как можно больше энергии, с каких концентраций реагентов и продуктов нам следует начать? Реакция идет самопроизвольно в прямом направлении, поэтому ясно, что мы должны начинать только с реагентов — любые присутствующие продукты ограничивают степень реакции в соответствии с принципом Ле Шателье. Мы получаем максимальную отдачу, когда начинаем только с гидроксида и уксусной кислоты. (Так работает большинство химических реакций — продукт — это то, что нам нужно , а не то, что у нас есть .)
Та же идея применима к окислительно-восстановительным реакциям: мы получаем больше всего электроэнергии от реакции в гальванической ячейке, когда мы начинаем только с тех веществ, которые реагируют спонтанно. Однако стандартные условия требуют, чтобы все частицы присутствовали в концентрации 1,0 М, что фактически запрещает нам начинать только с реагентов. Например, в нашем цинк-медном элементе и цинк (II), и медь (II) должны присутствовать в ячейке в концентрации 1,0 M, чтобы применялась метка «стандартные условия»…но медь (II) — это реагент, а цинк (II) — это продукт! Ой! Урок здесь в том, что стандартное напряжение не обязательно является оптимальным.
По аналогии с кислотно-щелочной реакцией, увеличение концентрации веществ, которые реагируют спонтанно (и / или уменьшение концентрации продуктов), должно увеличивать наблюдаемое напряжение. Согласно реакции (6), увеличение [Cu 2+ ] и уменьшение [Zn 2+ ] должно увеличивать напряжение элемента.{2 +}] _ {eq}}} $$
Концентрации в (10) отражают состояние неограниченного равновесия, когда мы позволили ячейке «работать» в течение бесконечного количества времени (другими словами, состояние, когда батарея полностью разряжена). Мы также можем записать коэффициент реакции в той же форме, что и \ (K \), который обобщается на любое ограниченное состояние равновесия ячейки. В состоянии ограниченного равновесия соответствующее напряжение «толкает» состояние, чтобы гарантировать, что оно остается равномерным и постоянным во времени.\ circ = 1 \) обязательно. Стандартное состояние связано с некоторым напряжением и соответствующим изменением свободной энергии согласно уравнению (5). В последующем обсуждении мы будем предполагать, что реакция является спонтанной в прямом направлении в стандартном состоянии. Это означает, что \ (Q \) будет самопроизвольно увеличиваться в сторону \ (K \), если ячейку закоротить и оставить для разряда. В этом случае уменьшение \ (Q \) требует ввода энергии. Мы настроили все таким образом, потому что все гальванические элементы настроены таким образом, со спонтанной прямой реакцией.
Теперь представьте, что требуется некоторое количество свободной энергии \ (\ Delta G \), чтобы «подтолкнуть» ячейку из стандартного состояния в нестандартное состояние с меньшим коэффициентом реакции \ (Q_ \ mathrm {ns} \) и большее напряжение \ (E_ \ mathrm {ns} \). Эта энергия — всего лишь энергия зарядки, необходимая для перемещения [Zn 2+ ] и [Cu 2+ ] от 1,0 М до их значений в интересующем состоянии. Чтобы рассчитать энергию заряда, мы можем признать, что «толчок» на самом деле является спонтанной окислительно-восстановительной реакцией клетки, работающей в обратном , из стандартного состояния в нестандартное состояние с большим количеством присутствующих реагентов.\ circ \) в большего размера \ (Q_ \ mathrm {ns} \), за исключением того, что толкать не нужно. Вместо этого энергия будет высвобождаться при переходе от стандартных условий к нестандартным, потому что этот сдвиг теперь представляет собой (спонтанное) образование продуктов.
Почему полезен расчет этой «энергии зарядки» \ (\ Delta G \)? Мы можем использовать стандартное напряжение, рассчитанное по (7), чтобы получить 90% пути к нестандартному напряжению, а затем использовать энергию заряда для завершения работы.\ circ $$
Это говорит нам о том, что при стандартных условиях напряжение элемента является стандартным напряжением — как и должно быть! Также обратите внимание на то, что по мере уменьшения \ (Q \) напряжение ячейки имеет тенденцию повышаться. Другими словами, подача большего количества реагентов и / или меньшего количества продуктов приводит к увеличению напряжения ячейки. Естественно, что при увеличении \ (Q \) за счет введения продуктов или удаления реагентов напряжение ячейки падает. Вот как работает батарея при нормальной работе: ее окислительно-восстановительная реакция протекает в прямом направлении, образуя продукты и потребляя реагенты, пока напряжение не станет настолько низким, что она не сможет питать что-либо полезное.
← Назад
Гальванические или гальванические элементы — Электрохимия
Гальванические элементы, также известные как гальванические элементы , представляют собой электрохимические элементы, в которых спонтанные реакции окисления-восстановления производят электрическую энергию.
Электрохимические ячейки имеют два проводящих электрода , называемых анодом и катодом. Электроды могут быть изготовлены из любых достаточно проводящих материалов, таких как металлы, полупроводники, графит и даже проводящие полимеры.Между этими электродами находится электролит , который содержит ионы, которые могут свободно перемещаться.
Электронный поток наблюдается как на аноде, так и на катоде: анод подвергнется окислению (потеря электронов), а катод подвергнется восстановлению (усиление избирательности).
— Металл анода окислится, переходя от степени окисления 0 (в твердой форме) к положительной степени окисления, и он станет ионом.
— На катоде ион металла в растворе будет принимать один или несколько электронов от катода, и степень окисления иона снизится до 0.Это образует твердый металл, который откладывается на катоде.Направление потока электронов
Два электрода должны быть электрически соединены друг с другом, чтобы обеспечить поток электронов, который покидает металл анода и проходит через это соединение к ионам на поверхности катода.
Этот поток электронов представляет собой электрический ток, который можно использовать для работы, например, для поворота двигателя или включения света. Батарея — это набор гальванических элементов, соединенных параллельно.Например, свинцово-кислотная батарея имеет элементы с анодами из свинца и катодами из диоксида свинца.
Полууравнения
Принцип действия гальванического элемента — это одновременная реакция окисления и восстановления, называемая окислительно-восстановительной реакцией. Эта окислительно-восстановительная реакция состоит из двух полуреакций. В типичном гальваническом элементе окислительно-восстановительная пара представляет собой медь и цинк, представленные в следующих полуэлементных реакциях:
— Цинковый электрод (анод): Zn (s) → Zn2 + (водный) + 2 e–
— Медный электрод (катод): Cu2 + (водный раствор) + 2 e– → Cu (s)Потенциал ячейки
Стандартный Потенциалы ячеек (разность двух электродов) могут быть рассчитаны из потенциалов полуреакций:
Потенциал клетки = потенциал восстановления + потенциал окисления
При определении стандартного потенциала клеток необходимо идентифицировать окисленные и восстановленные виды.Это можно сделать с помощью серии занятий. Таблица стандартных восстановительных потенциалов отображает восстановительные потенциалы в порядке убывания. Виды наверху имеют большую вероятность восстановления, в то время как те, что внизу, имеют большую вероятность окисления. Следовательно, когда разновидность наверху соединяется с разновидностью внизу, та, которая находится наверху, становится восстановленной, а та, что внизу, окисляется. Положительный потенциал клетки указывает на то, что реакция протекает самопроизвольно в том направлении, в котором она написана.Потенциал элемента для всех гальванических / гальванических элементов положительный, потому что гальванический элемент генерирует потенциал.
Практические вопросыАкадемия Хана
Изучение метаболизма с помощью гальванических элементов
Официальная подготовка MCAT (AAMC)Chemistry online Flashcards Вопрос 17
Пакет вопросов по химии Отрывок 19, вопрос 111
Практический экзамен 2 Раздел C / P Отрывок 6 Вопрос 29
Ключевые точки• Электрохимический элемент, также называемый гальваническим или гальваническим элементом, представляет собой устройство, которое вырабатывает электрический ток из энергии, выделяемой в результате спонтанной окислительно-восстановительной реакции в двух полуячейках.
• Анод подвергнется окислению (потеря электронов) и восстановление (усиление избирательности) на катоде.
• Электроны покидают металл анода и проходят через соединительный провод к ионам на поверхности катода.
• Потенциал клетки = потенциал восстановления + потенциал окисления.
Ключевые терминыЭлектроды : электрический проводник, который обеспечивает физический интерфейс между электрической цепью, обеспечивающей энергию, и электролитом.
Электролит : вещество, содержащее свободные ионы, переносящие электрический ток.
Активный электрод: электрод , участвующий в окислительно-восстановительной реакции электрохимической ячейки; масса активного электрода изменяется в процессе окислительно-восстановительной реакции
Анод: электрод в электрохимической ячейке, на котором происходит окисление; информация об аноде записана на левой стороне солевого мостика в обозначении ячейки
Катод: электрод в электрохимической ячейке, на котором происходит восстановление; информация о катоде записана на правой стороне солевого мостика в обозначении ячейки
Обозначение ячейки: сокращенное обозначение реакций в электрохимической ячейке
Потенциал элемента : разность электрических потенциалов, возникающая при соединении разнородных металлов; движущая сила потока заряда (тока) в окислительно-восстановительных реакциях
Гальванический элемент : электрохимический элемент, в котором протекает спонтанная реакция окисления-восстановления; электрохимические ячейки с положительными потенциалами ячеек; также называется гальванический элемент
Инертный электрод : электрод, который пропускает ток, но не участвует в реакции окисления-восстановления в электрохимической ячейке; масса инертного электрода не изменяется в процессе окислительно-восстановительной реакции; инертные электроды часто делают из платины или золота, потому что эти металлы химически неактивны.
Гальванический элемент: другое название гальванического элемента
Коммерческие гальванические элементы
Поскольку гальванические элементы могут быть автономными и портативными, их можно использовать в качестве батарей и топливных элементов. Батарея (аккумулятор) Гальванический элемент (или серия гальванических элементов), который содержит все реагенты, необходимые для производства электричества. представляет собой гальванический элемент (или ряд гальванических элементов), содержащий все реагенты, необходимые для производства электричества. Напротив, топливный элемент — это гальванический элемент, который требует постоянного внешнего источника одного или нескольких реагентов для выработки электричества.представляет собой гальванический элемент, которому для выработки электроэнергии требуется постоянный внешний источник одного или нескольких реагентов. В этом разделе мы описываем химию некоторых наиболее распространенных типов батарей и топливных элементов.
Батареи
Существует два основных типа батарей: одноразовых или первичных батарей, в которых электродные реакции необратимы и которые не могут быть перезаряжены; и перезаряжаемых или вторичных батарей, которые образуют нерастворимый продукт, который прилипает к электродам.Эти батареи можно заряжать, подавая электрический потенциал в обратном направлении. В процессе зарядки аккумуляторная батарея временно преобразуется из гальванической ячейки в электролитическую.
Батареи — это тщательно спроектированные устройства, основанные на тех же фундаментальных законах, что и гальванические элементы. Основное различие между батареями и гальваническими элементами, которые мы описали ранее, заключается в том, что в коммерческих батареях в качестве реагентов используются твердые вещества или пасты, а не растворы, чтобы максимизировать электрическую мощность на единицу массы.Использование высококонцентрированных или твердых реагентов имеет еще один положительный эффект: концентрации реагентов и продуктов не сильно меняются по мере разряда батареи; следовательно, выходное напряжение остается стабильным во время процесса разряда. Такое поведение отличается от поведения ячейки Zn / Cu, выход которой логарифмически уменьшается по мере протекания реакции (рис. 19.11 «Вариация»). Когда батарея состоит из более чем одного гальванического элемента, элементы обычно подключаются последовательно, то есть положительный (+) вывод одного элемента соединяется с отрицательным (-) выводом следующего и т. Д.Таким образом, общее напряжение батареи является суммой напряжений отдельных ячеек.
Сухая камера Leclanché
Сухой элемент, безусловно, самый распространенный тип батарей, используется в фонариках, электронных устройствах, таких как Walkman и Game Boy, и во многих других устройствах. Хотя сухой элемент был запатентован в 1866 году французским химиком Жоржем Лекланше и ежегодно продается более 5 миллиардов таких элементов, детали химического состава его электродов до сих пор полностью не изучены.Несмотря на свое название, сухая батарея Leclanché состоит из электролита, который представляет собой кислотную пасту на водной основе, содержащую MnO2, Nh5Cl, ZnCl2, графит и крахмал. фактически является «влажной ячейкой»: электролит представляет собой кислотную пасту на водной основе, содержащую MnO 2 , NH 4 Cl, ZnCl 2 , графит и крахмал (часть (а) на рисунке 19.13 «Три вида Первичные (неперезаряжаемые) батареи »). Половозвращения на аноде и катоде можно резюмировать следующим образом:
Уравнение 19.74
катод: 2MnO 2 (с) + 2NH 4 + (водный) + 2e — → Mn 2 O 3 (с) + 2NH 3 (водный) + H 2 О (л)Уравнение 19.75
анод: Zn (s) → Zn 2+ (водн.) + 2e —Ионы Zn 2+ , образующиеся при окислении Zn (ов) на аноде, реагируют с NH 3 , образовавшимся на катоде, и ионами Cl —, присутствующими в растворе, поэтому общая реакция в ячейке выглядит следующим образом:
Уравнение 19.76
всего: 2MnO 2 (т) + 2NH 4 Cl (водный) + Zn (т) → Mn 2 O 3 (т) + Zn (NH 3 ) 2 Cl 2 (т) + H 2 O (л)Сухой элемент выдает около 1,55 В и недорог в производстве. Однако это не очень эффективно для производства электроэнергии, потому что только относительно небольшая часть MnO 2 , которая находится рядом с катодом, фактически восстанавливается, и только небольшая часть цинкового катода фактически потребляется при разряде ячейки.Кроме того, сухие элементы имеют ограниченный срок хранения, поскольку анод из цинка самопроизвольно реагирует с NH 4 Cl в электролите, вызывая коррозию корпуса и позволяя содержимому вытекать.
Щелочная батарея Батарея, состоящая из элемента Лекланше, адаптированная для работы в щелочных (основных) условиях. По сути, это ячейка Лекланше, адаптированная для работы в щелочных или щелочных условиях. Половинные реакции, которые происходят в щелочной батарее, следующие:
Уравнение 19.77
катод: 2MnO 2 (с) + H 2 O (l) + 2e — → Mn 2 O 3 (с) + 2OH — (водный)Уравнение 19.78
анод: Zn (s) + 2OH — (водн.) → ZnO (s) + H 2 O (l) + 2e —Уравнение 19.79
всего: Zn (s) + 2MnO2 (s) → ZnO (s) + Mn2O3 (s)Эта батарея тоже выдает около 1.5 В, но у него более длительный срок хранения и более постоянное выходное напряжение при разряде элемента, чем у сухого элемента Leclanché. Хотя производство щелочных батарей дороже, чем сухих элементов Leclanché, улучшенные характеристики делают эту батарею более рентабельной.
Батарейки кнопочные
Хотя некоторые из небольших батарей button , используемых для питания часов, калькуляторов и фотоаппаратов, представляют собой миниатюрные щелочные элементы, большинство из них основаны на совершенно другом химическом составе.В этих батареях анодом является цинк-ртутная амальгама, а не чистый цинк, а катод использует в качестве окислителя либо HgO, либо Ag 2 O, а не MnO 2 (часть (b) на рисунке 19.13 «Три вида Первичные (неперезаряжаемые) батареи »). Катодные и общие реакции, а также выход ячеек для этих двух типов кнопочных батарей следующие:
Уравнение 19.80
катод (Hg): HgO (т) + H 2 O (л) + 2e — → Hg (л) + 2OH — (водн.)Уравнение 19.81
всего (Hg): Zn (тв) + 2HgO (тв) → Hg (l) + ZnO (тв) Ecell = 1,35 ВУравнение 19.82
катод (Ag): Ag 2 O (тв) + H 2 O (л) + 2e — → 2Ag (тв) + 2OH — (водн.)Уравнение 19.83
общее (Ag): Zn (тв) + 2Ag2O (тв) → 2Ag (тв) + ZnO (тв) Ecell = 1,6 ВОсновными преимуществами ртутных и серебряных элементов являются их надежность и высокое отношение выхода к массе.Эти факторы делают их идеальными для приложений, где малый размер имеет решающее значение, например, для камер и слуховых аппаратов. К недостаткам относится дороговизна и экологические проблемы, вызванные удалением тяжелых металлов, таких как Hg и Ag.
Литий-йодная батарея
Ни одна из описанных выше батарей на самом деле не является «сухой». Все они содержат небольшое количество жидкой воды, которая значительно увеличивает массу и вызывает потенциальные проблемы с коррозией. Следовательно, значительные усилия были затрачены на разработку безводных батарей.
Одной из немногих коммерчески успешных безводных батарей является литий-йодная батарея Батарея, которая состоит из анода из металлического лития и катода, содержащего твердый комплекс I2, со слоем твердого LiI между ними, который обеспечивает диффузию Li + ионы .. Анод — металлический литий, а катод — твердый комплекс I 2 . Их разделяет слой твердого LiI, который действует как электролит, обеспечивая диффузию ионов Li + .Электродные реакции следующие:
Уравнение 19.84
катод: I 2 (s) + 2e — → 2I — (LiI)Уравнение 19.85
анод: 2Li (s) → 2Li + (LiI) + 2e —Уравнение 19.86
всего: 2Li (s) + I2 (s) → 2LiI (s) Ecell = 3.5 ВКардиостимулятор. Рентгеновский снимок пациента, показывающий расположение и размер кардиостимулятора, работающего от литий-йодной батареи.
Как показано в части (c) на рисунке 19.13 «Три вида первичных (неперезаряжаемых) батарей», типичная литий-йодная батарея состоит из двух элементов, разделенных металлической никелевой сеткой, которая собирает заряд с анода. Из-за высокого внутреннего сопротивления, вызванного твердым электролитом, может потребляться только слабый ток.Тем не менее, такие батареи оказались долговечными (до 10 лет) и надежными. Поэтому они используются в приложениях, где частая замена затруднена или нежелательна, например, в кардиостимуляторах и других медицинских имплантатах, а также в компьютерах для защиты памяти. Эти батареи также используются в охранных передатчиках и дымовых пожарных извещателях. Другие батареи на основе литиевых анодов и твердых электролитов находятся в стадии разработки, используя, например, TiS 2 в качестве катода.
Рисунок 19.13 Три вида первичных (неперезаряжаемых) батарей
(a) Сухой элемент Лекланше фактически является «влажным элементом», в котором электролит представляет собой кислотную пасту на водной основе, содержащую MnO 2 , NH 4 Cl, ZnCl 2 , графит и крахмал. Несмотря на дешевизну в производстве, элемент не очень эффективен в производстве электроэнергии и имеет ограниченный срок хранения. (b) В кнопочной батарее анодом является цинк-ртутная амальгама, а катодом может быть либо HgO (показано здесь), либо Ag 2 O в качестве окислителя.Кнопочные батареи надежны и имеют высокое отношение выходной мощности к массе, что позволяет использовать их в таких приложениях, как калькуляторы и часы, где их малый размер имеет решающее значение. (c) Литий-йодная батарея состоит из двух элементов, разделенных металлической никелевой сеткой, которая собирает заряд с анодов. Анодом является металлический литий, а катодом — твердый комплекс I 2 . Электролит представляет собой слой твердого LiI, который позволяет ионам Li + диффундировать от катода к аноду.Хотя этот тип батареи вырабатывает относительно небольшой ток, он очень надежен и долговечен.
Сухие элементы, кнопочные батареи и литий-йодные батареи являются одноразовыми и не подлежат перезарядке после разрядки. Напротив, аккумуляторные батареи обладают значительными экономическими и экологическими преимуществами, поскольку их можно многократно заряжать и разряжать. В результате затраты на производство и утилизацию резко снижаются за определенное количество часов использования батареи.Две распространенные аккумуляторные батареи — это никель-кадмиевая батарея и свинцово-кислотная батарея, о которых мы расскажем ниже.
Никель-кадмиевый (NiCad) аккумулятор
Никель-кадмиевый аккумулятор типа A, который состоит из элемента на водной основе с кадмиевым анодом и сильно окисленным никелевым катодом. Или NiCad , аккумулятор используется в небольших электрических приборах и устройствах, таких как дрели, портативные пылесосы и т. Д. Цифровые тюнеры AM / FM. Это элемент на водной основе с кадмиевым анодом и сильно окисленным никелевым катодом, который обычно называют оксогидроксидом никеля (III), NiO (OH).Как показано на Рисунке 19.14 «Никель-кадмиевая (NiCad) батарея, аккумуляторная батарея», конструкция максимизирует площадь поверхности электродов и минимизирует расстояние между ними, что снижает внутреннее сопротивление и делает возможным довольно высокий ток разряда.
Рисунок 19.14 Никель-кадмиевый (NiCad) аккумулятор, аккумулятор
Никель-кадмиевые батареисодержат кадмиевый анод и сильно окисленный никелевый катод. Такая конструкция увеличивает площадь поверхности электродов и минимизирует расстояние между ними, что дает батарее как высокий ток разряда, так и большую емкость.
Электродные реакции при разряде никель-кадмиевой батареи следующие:
Уравнение 19.87
катод: 2NiO (OH) (s) + 2H 2 O (l) + 2e — → 2Ni (OH) 2 (s) + 2OH — (водн.)Уравнение 19.88
анод: Cd (s) + 2OH — (водн.) → Cd (OH) 2 (s) + 2e —Уравнение 19.89
всего: Cd (s) + 2NiO (OH) (s) + 2h3O (l) → Cd (OH) 2 (s) + 2Ni (OH) 2 (s) Ecell = 1,4 ВПоскольку продукты полуреакций разряда представляют собой твердые частицы, которые прилипают к электродам [Cd (OH) 2 и 2Ni (OH) 2 ], общая реакция легко обращает вспять при перезарядке элемента. Хотя никель-кадмиевые элементы легкие, перезаряжаемые и обладают большой емкостью, они имеют определенные недостатки. Например, они имеют тенденцию быстро терять емкость, если не позволяют полностью разрядиться перед подзарядкой, они плохо хранятся в течение длительного периода после полной зарядки и представляют собой серьезные проблемы для окружающей среды и утилизации из-за токсичности кадмия.
Разновидностью никель-кадмиевой батареи является никель-металлогидридная батарея (NiMH), используемая в гибридных автомобилях, устройствах беспроводной связи и мобильных компьютерах. Общее химическое уравнение для этого типа батареи выглядит следующим образом:
NiO (OH) (т) + MH → Ni (OH) 2 (т) + M (т)Емкость никель-металлгидридных батарей на 30–40% выше, чем у никель-кадмиевых; он более экологичен, поэтому хранение, транспортировка и утилизация не подлежат экологическому контролю; и он не так чувствителен к подзарядке памяти.Однако он имеет на 50% большую скорость саморазряда, ограниченный срок службы и более высокий уровень обслуживания, и он дороже, чем никель-кадмиевый аккумулятор.
Свинцово-кислотный аккумулятор (свинцовый аккумулятор)
Свинцово-кислотный аккумулятор Аккумулятор, состоящий из пластины или сетки из губчатого свинцового металла, катода, содержащего порошкообразный PbO2, и электролита, который обычно представляет собой водный раствор h3SO4. используется для обеспечения пусковой мощности практически в каждом автомобильном и судовом двигателе, представленном на рынке.Морские и автомобильные аккумуляторы обычно состоят из нескольких последовательно соединенных ячеек. Общее напряжение, генерируемое батареей, равно потенциалу на элемент ( E ° элемент ), умноженному на количество ячеек. Как показано на рисунке 19.15 «Один элемент свинцово-кислотной батареи», анод каждого элемента свинцовой аккумуляторной батареи представляет собой пластину или решетку из губчатого металлического свинца, а катод представляет собой аналогичную решетку, содержащую порошкообразный диоксид свинца (PbO ). 2 ). Электролит обычно представляет собой приблизительно 37% -ный (по массе) раствор серной кислоты в воде с плотностью 1.28 г / мл (около 4,5 M H 2 SO 4 ). Поскольку окислительно-восстановительно-активные частицы представляют собой твердые частицы, нет необходимости разделять электроды. Электродные реакции в каждой ячейке во время разряда следующие:
Уравнение 19.90
катод: PbO2 (т) + HSO4- (вод) + 3H + (водн) + 2e- → PbSO4 (т) + 2h3O (л) Экатод ° = 1,685 ВУравнение 19.91
анод: Pb (s) + HSO4− (водный) → PbSO4 (s) + H + (водный) + 2e− Eanode ° = −0.356 ВУравнение 19.92
всего: Pb (тв) + PbO2 (тв) + 2HSO4- (водн.) + 2H + (водн.) → 2PbSO4 (тв) + 2h3O (ж) Ecell ° = 2,041 ВРисунок 19.15 Один элемент свинцово-кислотной батареи
Аноды в каждой ячейке перезаряжаемой батареи представляют собой пластины или сетки из свинца, содержащие губчатый металлический свинец, в то время как катоды представляют собой аналогичные сетки, содержащие порошкообразный диоксид свинца (PbO 2 ). Электролит — водный раствор серной кислоты.Значение E ° для такого элемента составляет около 2 В. При последовательном соединении трех таких элементов получается аккумулятор на 6 В, тогда как типичный автомобильный аккумулятор на 12 В содержит шесть последовательно соединенных элементов. При правильном обращении этот тип аккумуляторной батареи большой емкости можно многократно разряжать и перезаряжать.
По мере разряда ячейки на электродах образуется порошок PbSO 4 . Кроме того, серная кислота потребляется и образуется вода, что снижает плотность электролита и обеспечивает удобный способ контроля состояния батареи путем простого измерения плотности электролита.
Когда к свинцово-кислотной батарее подается внешнее напряжение, превышающее 2,04 В на элемент, электродные реакции меняются, и PbSO 4 преобразуется обратно в металлический свинец и PbO 2 . Однако, если аккумулятор заряжается слишком сильно, может произойти электролиз воды, что приведет к выделению потенциально взрывоопасного газообразного водорода. (Для получения дополнительной информации об электролизе см. Раздел 19.7 «Электролиз».) Образовавшиеся таким образом пузырьки газа могут вытеснить некоторые частицы PbSO 4 или PbO 2 из решеток, позволяя им упасть на дно решетки. ячейке, где они могут накапливаться и вызывать внутреннее короткое замыкание.Таким образом, процесс зарядки необходимо тщательно контролировать, чтобы продлить срок службы батареи. Однако при надлежащем уходе свинцово-кислотный аккумулятор можно разрядить и перезарядить тысячи раз. В автомобилях генератор переменного тока подает электрический ток, который вызывает обратную реакцию разряда.
Топливные элементы
Топливный элемент — это гальванический элемент, который требует постоянной внешней подачи реагентов, поскольку продукты реакции постоянно удаляются.В отличие от батареи, он не накапливает химическую или электрическую энергию; топливный элемент позволяет извлекать электрическую энергию непосредственно из химической реакции. В принципе, это должен быть более эффективный процесс, чем, например, сжигание топлива для приведения в действие двигателя внутреннего сгорания, который вращает генератор, который обычно имеет КПД менее 40%, а на самом деле КПД топливного элемента обычно составляет от 40% до 60%. К сожалению, значительные проблемы с ценой и надежностью препятствовали широкому внедрению топливных элементов.На практике их использование ограничено приложениями, в которых масса может быть существенным фактором стоимости, например пилотируемыми космическими аппаратами США.
В этих космических аппаратах используется водородно-кислородный топливный элемент, для которого требуется постоянный ввод H 2 (г) и O 2 (г), как показано на Рис. 19.16 «Водородный топливный элемент вырабатывает электрическую энергию непосредственно из химического вещества. Реакция ». Электродные реакции следующие:
Уравнение 19.93
катод: O 2 (г) + 4H + + 4e — → 2H 2 O (г)Уравнение 19.94
анод: 2H 2 (г) → 4H + + 4e —Уравнение 19.95
всего: 2h3 (г) + O2 (г) → 2h3O (г)Рисунок 19.16 Водородный топливный элемент вырабатывает электрическую энергию непосредственно в результате химической реакции
Водород окисляется до протонов на аноде, и электроны переносятся через внешнюю цепь на катод, где кислород восстанавливается и соединяется с H + с образованием воды.Твердый электролит позволяет протонам диффундировать от анода к катоду. Хотя топливные элементы представляют собой практически экологически чистые средства получения электроэнергии, их стоимость и технологическая сложность до сих пор ограничивали их применение.
Общая реакция представляет собой практически экологически чистое преобразование водорода и кислорода в воду, которая затем собирается и используется в космических аппаратах. Хотя этот тип топливного элемента должен выдавать 1,23 В при стандартных условиях, на практике устройство выдает только около 0.9 В. Одним из основных препятствий на пути к достижению большей эффективности является тот факт, что четырехэлектронное восстановление O 2 (g) на катоде по сути является довольно медленным, что ограничивает ток, который может быть достигнут. Все основные производители автомобилей проводят крупные исследовательские программы, связанные с топливными элементами: одной из наиболее важных целей является разработка лучшего катализатора для восстановления O 2 .
Сводка
Батарея — это автономный блок, который вырабатывает электричество, тогда как топливный элемент — это гальванический элемент, который требует постоянного внешнего источника одного или нескольких реагентов для выработки электричества.Одним из типов батарей является сухой элемент Leclanché , который содержит электролит в кислой пасте на водной основе. Эта батарея называется щелочной батареей , если она адаптирована для работы в щелочных условиях. Батарейки-пуговицы имеют высокое отношение мощности к массе; Литий-йодные батареи состоят из твердого электролита; никель-кадмиевый аккумулятор (NiCad) является перезаряжаемым; и свинцово-кислотная батарея , которая также является перезаряжаемой, не требует, чтобы электроды находились в отдельных отсеках.Топливный элемент требует внешней подачи реагентов, поскольку продукты реакции постоянно удаляются. В топливном элементе энергия не сохраняется; электрическая энергия обеспечивается химической реакцией.
Key Takeaway
- Коммерческие батареи — это гальванические элементы, в которых в качестве реагентов используются твердые частицы или пасты, чтобы максимизировать электрическую мощность на единицу массы.
Концептуальные проблемы
-
Какие преимущества дает использование щелочной батареи по сравнению с сухой батареей Leclanché?
-
Почему плотность жидкости в свинцово-кислотных аккумуляторах падает, когда аккумулятор разряжен?
-
Какой тип батареи вы бы использовали для каждого приложения и почему?
- питание электродвигателя скутера
- резервный аккумулятор для смартфона
- питание iPod
-
Почему гальванические элементы используются в качестве батарей и топливных элементов? В чем разница между батареей и топливным элементом? В чем преимущество использования высококонцентрированных или твердых реагентов в батарее?
Ответ
-
- аккумулятор свинцовый
- литий-йодная батарея
- NiCad, NiMH или литий-ионный аккумулятор (перезаряжаемый)
Числовая задача
-
Эта реакция характерна для свинцовой аккумуляторной батареи:
Pb (s) + PbO 2 (s) + 2H 2 SO 4 (водн.) → 2PbSO 4 (s) + 2H 2 O (л)Если у вас аккумулятор с электролитом плотностью 1.15 г / см 3 и содержит 30,0% серной кислоты по массе, потенциал больше или меньше, чем у стандартной ячейки?
Ответ
-
[H 2 SO 4 ] = 3,52 M; E > E °

