Что такое химические стабилизаторы. Как действуют различные типы стабилизаторов в полимерах и других веществах. Для чего применяются стабилизаторы в пищевой и других отраслях промышленности. Каковы преимущества и недостатки использования стабилизаторов.
Что такое химические стабилизаторы
Химические стабилизаторы — это вещества, которые добавляют в различные материалы и продукты для предотвращения или замедления нежелательных химических процессов. Их основная функция — повысить стабильность и срок годности продукции.
Стабилизаторы могут действовать различными способами:
- Нейтрализовать свободные радикалы
- Связывать ионы металлов
- Поглощать УФ-излучение
- Ингибировать окислительные процессы
- Предотвращать распад полимерных цепей
В зависимости от механизма действия и химической природы выделяют несколько основных типов стабилизаторов.
Основные виды химических стабилизаторов
Антиоксиданты
Антиоксиданты предотвращают окислительные процессы, нейтрализуя свободные радикалы. Наиболее распространены фенольные и аминные антиоксиданты. Они широко применяются для стабилизации полимеров, масел, жиров.

УФ-стабилизаторы
УФ-стабилизаторы поглощают ультрафиолетовое излучение, предотвращая фотодеструкцию полимеров и других веществ. К ним относятся бензофеноны, бензотриазолы, оксибензофеноны.
Термостабилизаторы
Термостабилизаторы повышают устойчивость веществ к термическому разложению при нагревании. Часто применяются для полимеров. Наиболее эффективны фосфиты, фенолы, амины.
Акцепторы кислот
Акцепторы кислот нейтрализуют кислоты, образующиеся при разложении некоторых полимеров (например, ПВХ). К ним относятся соли металлов, эпоксиды, карбонаты.
Механизмы действия стабилизаторов в полимерах
Стабилизаторы в полимерах действуют по нескольким основным механизмам:
- Дезактивация свободных радикалов, образующихся при распаде полимерных цепей
- Разложение гидропероксидов — промежуточных продуктов окисления
- Образование прочных комплексов с ионами металлов-катализаторов окисления
- Поглощение УФ-излучения, вызывающего фотодеструкцию
- Нейтрализация кислот, выделяющихся при деструкции
Часто для эффективной защиты полимера используют комбинации стабилизаторов с разными механизмами действия.

Применение стабилизаторов в пищевой промышленности
В пищевой промышленности стабилизаторы выполняют несколько важных функций:
- Предотвращают расслоение эмульсий и суспензий
- Сохраняют консистенцию продуктов
- Увеличивают срок годности
- Улучшают внешний вид и текстуру
Наиболее распространенные пищевые стабилизаторы:
- Каррагинан (E407)
- Пектин (E440)
- Камеди (E410-E419)
- Модифицированные крахмалы (E1400-E1451)
- Целлюлоза и ее производные (E460-E469)
Использование стабилизаторов в других отраслях
Помимо пищевой промышленности, стабилизаторы широко применяются в следующих областях:
Производство полимеров и пластмасс
Стабилизаторы добавляют для предотвращения деструкции при переработке и эксплуатации. Это позволяет значительно увеличить срок службы изделий.
Лакокрасочная промышленность
УФ-стабилизаторы и антиоксиданты повышают стойкость покрытий к выцветанию и растрескиванию под действием солнечного света.
Косметика
Стабилизаторы предотвращают расслоение эмульсий, окисление активных компонентов, рост микроорганизмов в косметических средствах.

Фармацевтика
Различные стабилизаторы используются для повышения срока годности и сохранения активности лекарственных препаратов.
Преимущества и недостатки применения стабилизаторов
Использование стабилизаторов имеет как положительные, так и отрицательные стороны.
Преимущества:
- Увеличение срока годности продукции
- Улучшение потребительских свойств
- Снижение потерь при хранении и транспортировке
- Расширение ассортимента продукции
Недостатки:
- Возможное негативное влияние на здоровье при избыточном потреблении
- Маскировка низкого качества исходного сырья
- Удорожание продукции
- Снижение натуральности состава
При правильном применении преимущества стабилизаторов значительно перевешивают их недостатки. Однако важно соблюдать нормы их использования и информировать потребителей о составе продукции.
Перспективы развития химии стабилизаторов
Основные направления развития в области стабилизаторов:
- Создание более эффективных и безопасных стабилизаторов природного происхождения
- Разработка «умных» стабилизаторов с контролируемым высвобождением активных компонентов
- Получение многофункциональных стабилизаторов, сочетающих несколько механизмов действия
- Использование нанотехнологий для повышения эффективности стабилизаторов
- Разработка биоразлагаемых стабилизаторов для экологичных материалов
Дальнейшее развитие химии стабилизаторов позволит создавать более совершенные материалы и продукты с улучшенными свойствами и увеличенным сроком службы.

Химические стабилизаторы — Справочник химика 21
Известные химические стабилизаторы следует прежде всего разделить па две большие группы металлсодержащие (I) и органические (II). В табл. 31 представлены элементы, входящие в состав молекул химических соединений, используемых для стабилизации ПВХ. [c.176]МЕТАЛЛСОДЕРЖАЩИЕ ХИМИЧЕСКИЕ СТАБИЛИЗАТОРЫ [c.180]
Вообще, введение стабилизаторов этой группы в соответствующие композиции с ПВХ (обязательно в смеси с другими химическими стабилизаторами — мыла Ва или Са, Вп-органические соединения) всегда имеет четкое ограничение — следствие электрофильных [c.193]
При хранении замороженных продуктов поддерживают значительно более низкую температуру, чем при хранении охлажденных при этом жизнедеятельность микрофлоры практически прекращается, а ферментативные процессы в замороженном мясе сильно затормаживаются.
 Поэтому индивидуальные особенности замороженных продуктов проявляются слабее, чем охлажденных, а режимы их хранения более разнообразны. Для замороженных продуктов в настоящее время намечается тенденция в применении различных химических стабилизаторов, замедляющих ферментативные процессы с целью удлинения сроков хранения, или герметичных упаковок, изолирующих продукт от воздействия кислорода воздуха. Но даже и в этих условиях основным регулируемым параметром остается температура продукта.
Поэтому индивидуальные особенности замороженных продуктов проявляются слабее, чем охлажденных, а режимы их хранения более разнообразны. Для замороженных продуктов в настоящее время намечается тенденция в применении различных химических стабилизаторов, замедляющих ферментативные процессы с целью удлинения сроков хранения, или герметичных упаковок, изолирующих продукт от воздействия кислорода воздуха. Но даже и в этих условиях основным регулируемым параметром остается температура продукта. Нестабилизованный полиамидный корд по сравнению с вискозным имеет пониженную стойкость к длительным тепловым воздействиям. В последнее десятилетие найдены пути (введение специальных химических стабилизаторов), позволяющие в значительной степени повысить стойкость полиамидного корда к тепловым воздействиям. Стабилизованный полиамидный корд имеет существенное преимущество перед нестабилизованным по стойкости к нагреву и превосходит вискозный корд по относительным и абсолютным показателям прочности после теплового воздействия. [c.514]
[c.514]
Обращает внимание аномальное поведение РЬО при распаде ПВХ в динамических условиях по сравнению с его поведением в статических условиях. В условиях переработки (вальцевание) значительно возрастает эффективность РЬО как химического стабилизатора, связывающего HG1. Это объясняется совместным присутствием РЬО и стеариновой кислоты, выбранной в данной серии опытов в качестве лубриканта. В условиях термо механического воздействия идет химическая реакция, приводящая к образованию стеарата свинца, например по схеме [c.191]
Методом ИК-спектроскопии установлено, что у металлических мыл этой группы в порядке последовательности Ве, Мд, Са, 8г, Ва уменьшается преимущественно ковалентная связь металл — кислород 3 . Поэтому наименее эффективными химическими стабилизаторами-акцепторами НС1 являются соединения Mg и Са, по-видимому, за счет их очень высокой электроположительности. Ва и 8г по эффективности близки. [c.193]
Таким образом, брутто-действие химических стабилизаторов этого типа более сложное, чем солей РЬ.
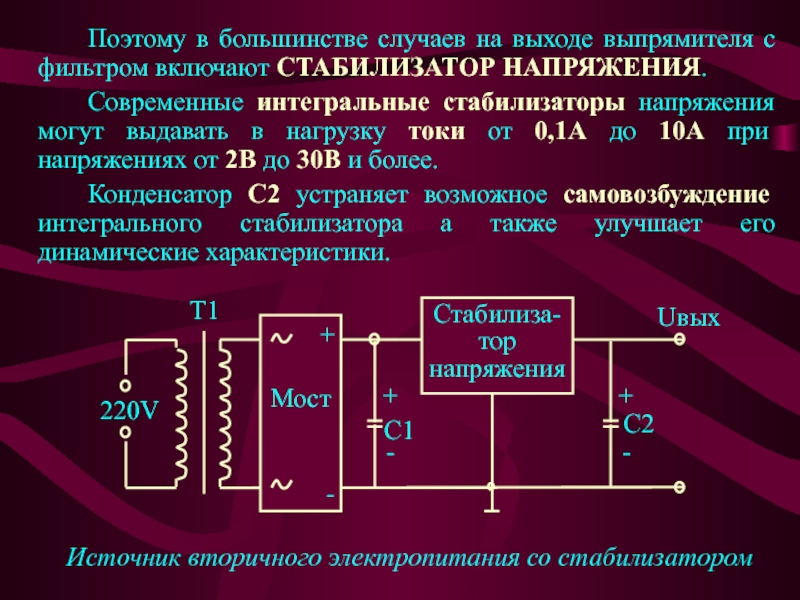 [c.198]
[c.198] Влияние ООС на процесс структурирования ПВХ. В присутствии ООС, так же как и других металлсодержащих химических стабилизаторов ПВХ ингибируются реакции, ведущие к образованию сшитых или разветвленных макромолекул. Лишь когда органические производные Sn переходят по реакции с НС1 в соответствующие хлориды, растворимость ПВХ резко ухудшается. Этот факт позволяет сформулировать положение, согласно которому структурирование ПВХ связано с присутствием электрофильных
Таким образом, в качестве химических стабилизаторов-антиоксидантов ПВХ могут исиользоваться различные замещенные моно-п бисфенолов. Предпочтение следует отдавать тем продуктам, которые более эффективны и образуют неокрашенные продукты пх превращения. [c.263]
Таким образом, сажа при фотораспаде ПВХ выполняет функции химических стабилизаторов-обрывателей цепных процессов. Полный механизм действия сажи до сих пор изучен недостаточно. Однако в зависимости от условий сажа может пе только замедлять, но и ускорять окисление [c. 315]
315]
ООС — ингибиторы реакции дегидрохлорирования ПВХ, снижающие скорость элиминирования НС1 как на воздухе, так и в азоте и сочетающие одновременно многие функции химических стабилизаторов ПВХ, должны давать синергические комбинации, например по показателю времени термостабильности т, с соединениями, связывающими НСЛ или более эффективно ингибирующими распад ПВХ (рис. 80). Соответствующее синергическое увеличение [c.340]
Возможность регулирования физической структуры полимера путем введения в него зародышеобразователей, являющихся одновременно химическими стабилизаторами полимера, вскрывает [c.278]
Механизм действия химических стабилизаторов сводится к образованию определенного pH среды, предупреждению окислительновосстановительных процессов и к увеличению растворимости лекарственных веществ — солюбилизации (см. подразд. 11.5).
Соединения, используемые в качестве химических стабилизаторов ацетагов целлюлозы. [c.91]
[c.91]
Таким образом исходя из многообразия механи.1мов процессов старения АЦ и пластмасс на их основе в качестве химических стабилизаторов АЦ должны применяться комплексные сочетания стабилизаторов В качестве таких комплексных сочетаний стабилизаторов АЦ и термопластов наего основе должны входить цветостабнлизагоры. В состав цветостабилизаторов [c.92]
По данным ряда зарубежных фирм известно об изготовлении кордшнуров и кордткани, которые не требуют термофиксации вследствие введения специальных химических стабилизаторов в процессе формования волокон. Перспективно в производстве клиновых ремней использование кордшнура из модифицированного малоусадочного волокна лавсан. [c.147]
В соответствии с предложенной классификацией оловоорганические стабилизаторы и органические фосфиты характеризуются функциями ингибиторов термического дегидрохлорирования ПВХ. В их присутствии заметно снижается скорость элиминирования НС1 при деструкции полимера в инертной атмосфере.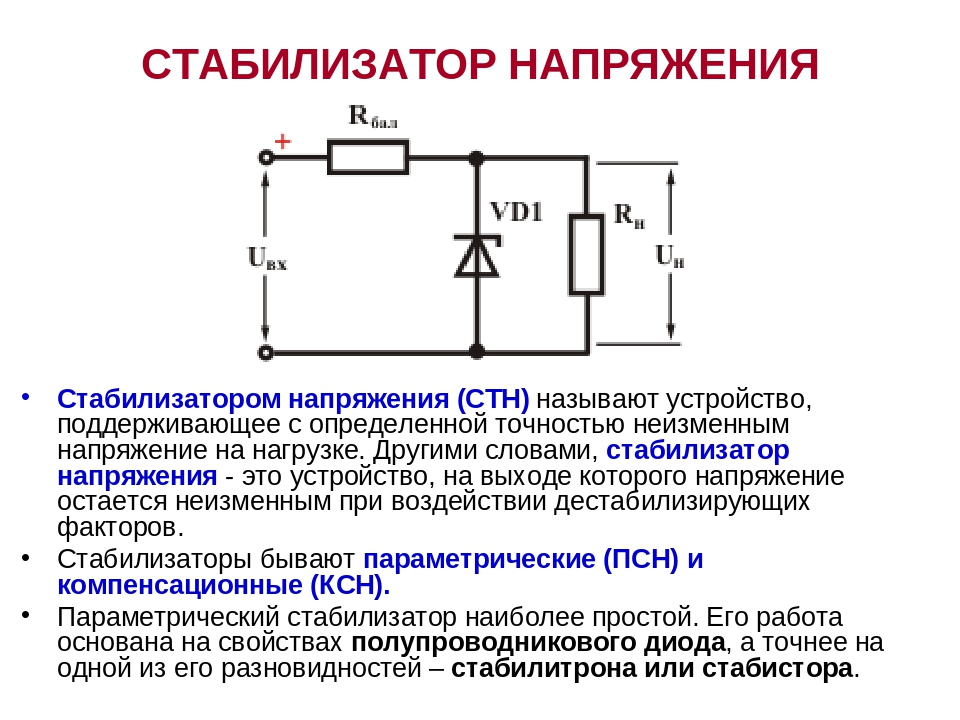 Эти соединения, равно как и основные солиРЬ, соли жирных кислот Ва, d, 2пиСа фенолы и бисфенолы эпоксисоединения и др., являются химическими стабилизаторами, ибо а) связывают выделяющийся из ПВХ НС1 б) ингибируют свободнорадикальные реакции (окислительного или [c.178]
Эти соединения, равно как и основные солиРЬ, соли жирных кислот Ва, d, 2пиСа фенолы и бисфенолы эпоксисоединения и др., являются химическими стабилизаторами, ибо а) связывают выделяющийся из ПВХ НС1 б) ингибируют свободнорадикальные реакции (окислительного или [c.178]
Преимущественно это свинцовые мыла, к которым относятся соли жирных кислот, сочетающие высокую эффективность химических стабилизаторов (связывание НС1) с отличной смазываю1цей способностью. [c.183]
Стабилизаторы и их действие — Справочник химика 21
Протонные стабилизаторы поля. Для повышения стабильности магнитного поля в спектрометрах высокого разрешения применяют стабилизаторы, действие которых основано на использовании явления ЯМР. С этой целью в зазор магнита [c.114] Хлоркаучук, как и большинство высокохлорированных полимеров, в отсутствие стабилизатора склонен к гелеобразованию в неблагоприятных условиях. Механизм гелеобразования сложен и зависит от типа присутствующих агентов. Общим является авто-каталитическое дегидрохлорирование, ведущее к образованию поперечных связей и к гелеобразованию. Большинство стабилизаторов действуют как акцепторы кислоты и предотвращают автоката-литическую реакцию [9]. [c.207]
Общим является авто-каталитическое дегидрохлорирование, ведущее к образованию поперечных связей и к гелеобразованию. Большинство стабилизаторов действуют как акцепторы кислоты и предотвращают автоката-литическую реакцию [9]. [c.207]
При получении некоторых типов полимерных дисперсий необходимо предварительно эмульгировать мономер, нерастворимый в непрерывной фазе. Стабилизация таких эмульсий типа масло/масло аналогична стабилизации полимерных дисперсий. Растворимый компонент стабилизатора действует по тем же самым общим принципам, так что для его выбора используют те [c.79]
Эмульгаторы — вещества, придающие устойчивость эмульсиям, т. е. являющиеся их стабилизаторами. Действие эмульгаторов обусловлено тем, что, сосредоточиваясь на поверхности разделов двух жидких фаз, они препятствуют обратному слиянию капель. Имеются две группы эмульгаторов, механизм действия которых принципиально различен. К первой, наиболее важной, группе относят ПАВ, растворимые в обеих фазах Эмульсий (или в одной из них), сильно адсорбирующиеся на гра- [c.13]
К первой, наиболее важной, группе относят ПАВ, растворимые в обеих фазах Эмульсий (или в одной из них), сильно адсорбирующиеся на гра- [c.13]
Свинцовые соли — весьма эффективные стабилизаторы, действие которых различно в зависимости от их состава. Например, с фосфатными пластификаторами рекомендуется применять силикат, но не стеарат свинца. Двухосновной стеарат свинца более эффективен, чем обычное свинцовое мыло. При испытании водопроводных труб из поливинилхлорида со свинцовыми стабилизаторами концентрация соединений свинца в водных вытяжках оказалась довольно низкой — °. Соли лития и стронция также находят применение в качестве стабилизирующих добавок. [c.248]
Для предотвращения этих явлений как во время технологических операций, так и в процессе эксплуатации в полихлорвиниловую смесь вводят вещества, называемые стабилизаторами, действие которых основано на их способности связываться с хлористым водородом. При связывании хлористого водорода приостанавливается каталитическое влияние последнего на дальнейший процесс разложения смолы. [c.113]
[c.113]
В группу органических светостабилизаторов входят бесцветные или светло-желтые органические соединения, которые сильно поглощают наиболее опасный для большинства полимеров свет с длинами волн 280-400 нм. Большинство этих стабилизаторов действует по физическому механизму, часто их называют УФ-абсорберами (УФА). Наиболее распространенные органические и металлорганические стабилизаторы приведены в табл. 2.7. [c.59]
Часто применяют сразу два или несколько стабилизаторов, поскольку установлено, что многие комбинации стабилизаторов действуют синергически, т. е. их стабилизирующее действие оказывается сильнее суммарного действия отдельных стабилизаторов. Применение таких комбинаций позволяет снизить расход стабилизирующих веществ. [c.49]
Стабилизаторы, как правило, изменяют физические свойства покрытия (см. стр. 120). Во многих патентах отмечается, что стабилизаторы действуют и как блескообразователи. [c.115]
[c.115]
Развитие старения предотвращается соединениями, взаимодействующими с активными центрами и со сравнительно стабильными промежуточными продуктами, способными генерировать активные центры. Для большинства наиболее распространенных стабилизаторов каучуков и резин значение длины прямой кинетической цепи близко к 1, так что изыскание других более эффективных стабилизаторов, действующих по этому принципу, мало перспективно СбОИ. Однако традиционные антиоксиданты удаляются из резин при работе изделий в жидких средах при эксплуатации изделий в условиях сравнительно высоких температур в вакууме наблюдается улетучивание антиоксидантов антиоксиданты легко мигрируют из резин при контакте с другими материалами. В этих случаях непроизводительный расход антиоксидантов снижает стойкость резин к тепловому старению [57]. [c.61]
Химическая стабилизация вторичных процессов, развивающихся при фотолизе ПВХ, например обрыв радикальных реакций, антиокислительное действие, разрушение хромофорных группировок и пр. Стабилизаторы этого типа не поглощают УФ-свет, по крайней мере это не их главная функция. Здесь часто используются сложные смеси обычных органических и Sn-содержащих стабилизаторов, действующих синергически [c.296]
Стабилизаторы этого типа не поглощают УФ-свет, по крайней мере это не их главная функция. Здесь часто используются сложные смеси обычных органических и Sn-содержащих стабилизаторов, действующих синергически [c.296]
Окислительные свойства перекиси водорода основаны на сравнительно легком отщеплении одного из атомов кислорода. Перекись водорода при разложении выделяет значительное количество, тепла. Она склонна к самопроизвольному разложению на воду и кислород. При добавлении стабилизаторов стойкость Н2О2 настолько повыщается, что ее можно безопасно транспортировать. Разложение перекиси водорода становится ощутимым лишь тогда,, когда создаются для этого условия или когда она приходит в соприкосновение с веществами, во много раз ускоряющими ее разложение. Свет оказывает лишь очень слабое ускоряющее действие на разложение перекиси водорода. Скорость разложения разбавленного раствора перекиси водорода возрастает с увеличением концентрации пропорционально корню квадратному из количества поглощенной энергии. [c.121]
[c.121]
Синергический эффект по какому-либо свойству или показателю преимущественно следует ожидать в том случае, если применяются смеси стабилизаторов, действующих по различным механиз- [c.338]
Вследствие наличия третичных атомов углерода полипропилен чувствителен к действию кислорода, особенно при повышенных температурах, что обусловливает его большую склонность к старению по сравнению с полиэтиленом и сополимерами этилена с пропиленом. Поэтому в процессе переработки в полипропилен добавляют стабилизаторы. [c.13]
Из возможностей модификации заслуживает внимания введение пластификаторов. Потери пластификаторов в материале в зависимости от его предыстории необходимо компенсировать. Это особенно важно, если после введения добавок ожидается изменение вязкости расплава. При этом следует учитывать, что некоторые стабилизаторы действуют также и как пласти
НПО «Альтернатива» — Стабилизаторы
К группе пищевых стабилизаторов (см. табл. 1.1, функциональный класс 21) относятся вещества, главной технологической функцией которых являются стабилизация гомогенной пищевой системы, образованной из двух или более несмешивающихся веществ, или улучшение степени гомогенизации этой системы.
табл. 1.1, функциональный класс 21) относятся вещества, главной технологической функцией которых являются стабилизация гомогенной пищевой системы, образованной из двух или более несмешивающихся веществ, или улучшение степени гомогенизации этой системы.
Принцип действия стабилизаторов в пищевых системах аналогичен действию эмульгаторов, от которых они отличаются пониженной поверхностной активностью, что обусловлено особенностями строения молекул. В молекулах стабилизатора гидрофильные группы, как правило, равномерно распределяются по всей длине молекулы и изменяют характер ее поведения на границе раздела фаз.
По своему поведению в пищевых системах стабилизаторы занимают промежуточное положение между эмульгаторами и загустителями, при этом эффект стабилизации может быть достигнут как за счет адсорбции их молекул на межфазных границах, образуемых частицами дисперсной фазы и дисперсионной среды, так и за счет повышения вязкости дисперсионной среды, содержащей частицы дисперсной фазы.
Часто добавки этого функционального класса в пищевых системах проявляют смежные технологические функции эмульгаторов, загустителей и комплексообразователей. Большинство из них описано в соответствующих разделах (см. 3.1, 3.2).
В табл. 3.34 приведены основные представители добавок, выделенных в соответствии с СанПиН 2.3.2.560—96 в самостоятельный функциональный класс — класс стабилизаторов.
Таблица 3.34
Стабилизаторы, разрешенные к применению при производстве пищевых продуктовв Российской Федерации
|
Е- номер |
Пищевая добавка |
Пищевые продукты |
Максимальный уровень в продуктах |
|
Е263 |
Ацетат кальция |
Согласно ТИ |
Согласно ТИ |
|
Е383 |
Глицерофосфат кальция |
То же |
То же |
|
Е570 |
Жирные кислоты (из пищевых жиров) |
» |
» |
|
Е501 |
Карбонат калия |
» |
» |
|
Е999 |
Квиллайи экстракт |
Напитки безалкогольные на ароматизаторах, сидр |
0,2 г/л в расчете на безводный экстракт |
|
Е387 |
Оксистеарин |
Масло растительное, жиры кулинарные |
1,25 г/кг |
|
E1201- |
Поливинилпирролидон, |
|
|
|
Е1202 |
Поливинилполипирролидон |
|
|
|
Е1200 |
Полидекстрозы А и N |
Согласно ТИ |
Согласно ТИ |
|
Е1505 |
Триэтил цитрат |
Яичный белок сухой |
То же |
|
Е460 |
Целлюлоза |
Согласно ТИ |
» |
|
E460i |
микрокристаллическая |
|
|
|
Е460іі |
порошкообразная |
|
|
|
Е464 |
Гид роксипропил метилцел -люлоза |
|
|
|
Е463 |
Гидрокси пропил целлюлоза |
|
|
|
Е466 |
Карбоксиметилцеллюлоза и карбоксиметилцеллюлозы натриевая соль (КМЦ) |
|
|
|
Е469 |
Карбоксиметилцеллюлоза ферментированная |
|
|
|
Е461 |
Метилцеллюлоза |
|
|
|
Е465 |
Метил эти лцеллюлоза |
|
|
|
Е467 |
Этилгидроксиэтилцеллюлоза |
|
|
|
Е462 |
Этилцеллюлоза |
|
|
натуральные кондитерские, гелообразователи и стабилизаторы
Содержание:
Без загустителей многие продукты просто невозможно сделать — например, всем известное желе не загустеет без желатина или агар-агара. Благодаря загустителям удается получить продукты с нужной консистенцией, сохранить и улучшить структуру продукта. Загустители используют при изготовлении мармелада, конфет, йогуртов, муссов, плавленых сырков, цукатов, мясных и рыбных консервов, и это далеко не полный список. Рассказываем, какие натуральные загустители используются в современной пищевой промышленности, какими свойствами они обладают и чем могут быть полезны.
Благодаря загустителям удается получить продукты с нужной консистенцией, сохранить и улучшить структуру продукта. Загустители используют при изготовлении мармелада, конфет, йогуртов, муссов, плавленых сырков, цукатов, мясных и рыбных консервов, и это далеко не полный список. Рассказываем, какие натуральные загустители используются в современной пищевой промышленности, какими свойствами они обладают и чем могут быть полезны.
Загустители в пищевой промышленности
При производстве пищевых продуктов загустители используют очень активно, ведь благодаря этим добавкам можно значительно улучшить потребительские свойства продукта. Загустители помогают увеличить и сохранить вязкость продукта, удержать влагу внутри, стабилизировать пенную структуру кондитерских изделий. Некоторые загустители обладают свойствами гелеобразователей. Самые востребованные пищевые загустители:
Натуральные кондитерские загустители
Загустители вносят большой вклад в развитие кондитерской промышленности, ведь благодаря этим добавкам можно создавать разнообразные десерты, сохраняющие нужную консистенцию и структуру. Торты с желейными слоями, кондитерские глазури, конфеты «птичье молоко», мармелады и замороженные десерты — все эти продукты содержат загустители.
Торты с желейными слоями, кондитерские глазури, конфеты «птичье молоко», мармелады и замороженные десерты — все эти продукты содержат загустители.
Гуаровая камедь (пищевая добавка Е412)
Гуаровую камедь получают из экстракта семян зернобобовых культур. Вещество представляет собой порошок кремового цвета без запаха и вкуса, хорошо растворимый в воде. Гуаровая камедь стабильна при замораживании и оттаивании, она повышает вязкость продуктов, выступает как загуститель, повышает устойчивость готовых продуктов к низким температурам.
Используется как: стабилизатор для желе и джемов, молочных продуктов и замороженных десертов, сиропов и пищевых концентратов; улучшитель в хлебопекарном производстве; уплотнитель для соусов.
Ксантановая камедь (пищевая добавка Е415)
Этот полисахарид получают путем ферментации из кукурузы. Представляет собой белый порошок без запаха и вкуса, хорошо растворимый в воде, молоке, а также сахарных и солевых растворах. Ксантановая камедь устойчива к высоким температурам и воздействию кислот, механическому воздействию. Применяется как влагоудерживающий агент, сильный и надежный загуститель, стабилизатор структуры готового продукта.
Применяется как влагоудерживающий агент, сильный и надежный загуститель, стабилизатор структуры готового продукта.
Используется при производстве напитков, соусов, молочных продуктов, рыбных и овощных консервов, хлебных изделий; ксантановую камедь добавляют в фарш для повышения его эластичности.
Пищевой желатин
Желатин — это белковый продукт, его изготавливают из хрящей, сухожилий и костей (эти ткани богаты коллагеном) путем долгого кипячения в воде. Полученный раствор выпаривают и охлаждают, получается желе — его разрезают на куски, а потом высушивают и измельчают в гранулы. Получается тот самый желатин, который мы привыкли видеть в упаковках. В состав желатина входит аминокислота глицин (в самом мясе ее мало), которая известна своими свойствами повышать умственную работоспособность и стрессоустойчивость, улучшать качество сна. Желатин также является поставщиком калорий в организм, это вещество 200 лет назад даже позиционировали как дешевый питательный продукт для нуждающихся.
Желатин используется при изготовлении фруктовых желе, мармелада, рыбного или мясного холодца. Его добавляют в кисломолочные продукты в качестве стабилизатора, а при производстве вина и пива он используется как осветлитель.
Загуститель агар-агар
Это вещество получают из морских водорослей путем вываривания, вымораживания и обезвоживания. Водоросли содержат белковые вещества, а также грубые волокна, углеводы и воду, они богаты кальцием, железом и йодом. Агар-агар не является источником калорий, эта смесь полисахаридов не усваивается в кишечнике, но зато способствует очищению организма и стимулирует перистальтику.
Агар-агар — сильный загуститель, в этом качестве он сильнее желатина в 4 раза, способен образовывать плотный студень в разных растворах. Представляет собой порошок белого или белого с оттенком цвета, растворяется только в горячей воде (от 90 °C), при температуре 35–40 °C застывает крепким гелем. Агар-агар устойчив к повторному нагреванию и охлаждению, не теряет своих свойств.
Используется при производстве зефира, мороженого, мармеладов, пудингов, студней, йогуртов, сыра, сгущенного молока, аналогов икры рыб.
Крахмал
Пищевой крахмал — натуральный загуститель, смесь природных полисахаридов, представляет собой порошок желтоватого цвета. Его получают из зерен кукурузы, клубней картофеля, зерен пшеницы и риса — крахмал накапливается в клетках растений.
Крахмал может быть картофельным, пшеничным, кукурузным, рисовым (в зависимости от того, из какого растения он извлечен), частично их свойства отличаются. Он повышает вязкость растворов, может создавать студенистость. В холодной воде крахмал не растворяется.
Используется как загуститель при производстве подлив, киселей, соусов, детских пюре, кондитерских глазурей и кремов; как связующее вещество в колбасных и мясных изделиях; часто применяется как влагоудерживающий агент.
Как сделать пищевой загуститель
Многие рецепты кондитерских изделий требуют использования специальных загустителей. И если в домашних условиях пакетика с нужным загустителем может просто не оказаться под рукой, можно заменить его другим, более доступным ингредиентом.
И если в домашних условиях пакетика с нужным загустителем может просто не оказаться под рукой, можно заменить его другим, более доступным ингредиентом.
- Сметанный соус к мясу или овощам можно сделать гуще при помощи обычной муки. Для этого муку пассируют, потом добавляют сметану. Вкус соуса меняется незначительно. Вместо муки для загущения можно использовать крахмал, но только если у соуса ярко выраженные вкус и запах, так как крахмал влияет на естественный вкус сметаны.
- Загустить сливки для крема можно с помощью желатина, крахмала или яичного белка. В случае с крахмалом важно не переборщить — нельзя использовать больше 1 столовой ложки крахмала на 200 мл сливок, иначе можно испортить вкус продукта.
- Сметанный крем можно сделать гуще при помощи желатинового порошка, агар-агара или сливочного масла. Как пищевой загуститель для сметаны также используется крахмал, а некоторые кондитеры допускают использование муки.
Загустители натурального происхождения не вредят человеческому организму, а чаще даже приносят пользу — например, как питательный желатин. Благодаря загустителям в нашем мире есть множество вкусных и красивых продуктов: желе, мармелад, соусы, пастила, муссы, заливные блюда. При правильном использовании загустители делают готовый продукт лучше, улучшают его консистенцию и делают привлекательнее.
Для того, чтобы добавить коментарий, авторизируйтесь.
Как бы вы охарактеризовали химию как науку?
- Образование
- Наука
- Химия
- Как бы вы охарактеризовали химию как науку?
Химия — это отрасль науки, изучающая состав и свойства вещества, а также изменения, которым оно претерпевает. Химия — это гораздо больше, чем набор фактов и совокупности знаний. Все дело в материи, то есть всем, что имеет массу и занимает пространство.
Материя состоит из чистых веществ или смесей чистых веществ.Переход от одного вещества к другому — это то, что химики называют химическим изменением, или химической реакцией , и это большое дело, потому что, когда оно происходит, создается совершенно новое вещество.
Общая область химии настолько огромна, что изначально была подразделена на несколько различных областей специализации. Но теперь существует огромное количество совпадений между различными областями химии, как и между различными науками.
Вот традиционные области химии:
-
Аналитическая химия: Эта отрасль активно занимается анализом веществ.Химики из этой области химии могут пытаться выяснить, какие вещества находятся в смеси (качественный анализ) или сколько конкретного вещества присутствует (количественный анализ) в чем-то. В аналитической химии используется много приборов.
-
Биохимия: Эта отрасль специализируется на живых организмах и системах. Биохимики изучают химические реакции, которые происходят на молекулярном уровне организма — уровне, где предметы настолько малы, что люди не могут их напрямую увидеть.
Биохимики изучают такие процессы, как пищеварение, обмен веществ, размножение, дыхание и т. Д.
 Иногда бывает трудно отличить биохимика от молекулярного биолога, потому что они оба изучают живые системы на микроскопическом уровне. Однако биохимик больше концентрируется на происходящих реакциях.
Иногда бывает трудно отличить биохимика от молекулярного биолога, потому что они оба изучают живые системы на микроскопическом уровне. Однако биохимик больше концентрируется на происходящих реакциях. -
Биотехнология: Это относительно новая область науки, которая представляет собой применение биохимии и биологии при создании или изменении генетического материала или организмов для конкретных целей.Его используют в таких областях, как клонирование и создание устойчивых к болезням сельскохозяйственных культур, и он может в будущем устранить генетические заболевания.
-
Неорганическая химия: Этот раздел занимается изучением неорганических соединений, таких как соли. Он включает изучение структуры и свойств этих соединений. Это также предполагает изучение отдельных элементов соединений. Химики-неорганики, вероятно, сказали бы, что это изучение всего, кроме углерода, которое они оставляют химикам-органикам.
Так что же такое соединения и элементы? Просто больше об анатомии материи.
 Материя состоит либо из чистых веществ, либо из смесей чистых веществ, а сами вещества состоят из элементов или соединений.
Материя состоит либо из чистых веществ, либо из смесей чистых веществ, а сами вещества состоят из элементов или соединений. -
Органическая химия: Это исследование углерода и его соединений. Вероятно, это самая организованная из областей химии. Существуют миллионы органических соединений, и тысячи новых открываются или создаются каждый год. Такие отрасли, как полимерная, нефтехимическая и фармацевтическая промышленность, зависят от химиков-органиков.
-
Физическая химия: В этом разделе выясняется, как и почему химическая система ведет себя именно так. Физические химики изучают физические свойства и поведение вещества и пытаются разработать модели и теории, описывающие это поведение.
градусов ненасыщенности (или IHD, индекс дефицита водорода)
градусов ненасыщенности (индекс дефицита водорода): Как молекулярная формула соединения может дать полезные подсказки о его структуре..jpg)
Сегодня мы поговорим о быстром и полезном вычислении, которое мы можем выполнить, чтобы получить количество [кратных связей + колец] в неизвестной структуре, просто зная молекулярную формулу. Мы называем это индексом дефицита водорода или, чаще, просто « градусов ненасыщенности ».
Вот сокращенная версия:
Оглавление
- Что такого хорошего в IHD?
- Игра с молекулярными формулами: степени ненасыщенности
- Для углеводорода без колец или двойных связей количество атомов водорода равно удвоенному количеству атомов углерода плюс 2
- Каждая двойная связь или кольцо уменьшает количество водорода на 2
- Каждое кольцо или двойная связь называется «степенью ненасыщенности»
- Пример: бензол (4 степени ненасыщенности)
- А как насчет молекул, содержащих кислород?
- А как насчет галогенов?
- Азот — это немного сложно
- Единая формула для степеней ненасыщенности
- Применение формулы IHD к четырем примерам из реальной жизни
- Проверь себя!
1. Что такого хорошего в IHD?
Что такого хорошего в IHD?
Самое лучшее в IHD — это то, что это простое в использовании уравнение, которое дает вам полезную информацию о структуре неизвестного соединения. На это уходит буквально минута. Расчет степени ненасыщенности — это первая задача, которую я рекомендую выполнять, когда вы сталкиваетесь с определением структуры неизвестного соединения с известной молекулярной формулой. В предыдущем посте мы увидели, что этот расчет оказался кладкой при определении структуры боковой цепи феромона предплюсны оленя.
Прежде чем мы начнем, посмотрим, сможете ли вы применить уравнение в рамке выше, чтобы найти степени ненасыщенности в этих чрезвычайно хорошо известных молекулах, формулы которых приведены ниже.
- C 9 H 8 O 4
- C 21 H 30 O 2
- C 17 h31NO4
- C 11 НЕТ
Последние три молекулы являются несколько «непослушными» примерами, запрещенными в большинстве штатов. Надеюсь, это будет для вас стимулом провести расчеты! (ответы внизу поста).
Надеюсь, это будет для вас стимулом провести расчеты! (ответы внизу поста).
2. Игра с молекулярными формулами: степени ненасыщенности
Давайте начнем это обсуждение с поиска закономерностей в молекулярных формулах. Начнем с углеводородов, не содержащих двойных связей или колец.
Можете ли вы увидеть взаимосвязь между количеством атомов углерода и количеством атомов водорода?
Точнее, можете ли вы придумать формулу?
3.Для углеводорода без колец или двойных связей количество атомов водорода равно удвоенному количеству атомов углерода, плюс 2
Вы должны быть в состоянии увидеть, что для углеводорода без колец или двойных связей количество атомов водорода равно до удвоенного количества атомов углерода плюс 2.
Итак, для такой молекулы, как додекан (C 12 ), мы ожидаем увидеть (12 x 2) + 2 = 26 атомов водорода.
Теперь: что происходит с молекулярной формулой, когда мы добавляем к молекуле двойную связь?
4. Каждая двойная связь или кольцо уменьшает количество водорода на 2
Каждая двойная связь или кольцо уменьшает количество водорода на 2
Вы должны увидеть, что с каждой кратной связью (π-связью) количество атомов водорода в формуле уменьшается на два. Этин (2 π-связи) имеет на два атома водорода меньше, чем этен (1 π-связь), который имеет на два атома водорода меньше, чем этан (ноль π-связей).
Углеводороды, содержащие π-связи, часто называют «ненасыщенными» углеводородами. Их можно обработать водородом (Pd / C, H 2 ), чтобы получить соответствующий алкан без π-связей, который в таком случае называют «насыщенным» водородом.(Сравните «ненасыщенные жиры», которые содержат алкены, и «насыщенные жиры», которые не содержат).
Поскольку каждая пи-связь приводит к потере 2 атомов водорода из молекулярной формулы, мы называем это «степенью ненасыщенности ».
Обратимся к циклическим соединениям. Вы замечаете подобный эффект?
Стоит! Каждое кольцо в молекуле уменьшает количество атомов водорода на два.
5. Каждое кольцо или двойная связь называется «степенью ненасыщенности»
Следовательно, каждое кольцо вводит в молекулу «степень ненасыщенности».
Вы можете спросить: а что, если у нас есть молекула с кольцами и кратными связями? Посмотреть на себя.
Эффект аддитивный. То есть, «степени ненасыщенности» — это сумма количества двойных связей и колец.
Обратите внимание, что он не сообщает вам, сколько двойных связей присутствует или сколько колец присутствует. Он просто сообщает вам их сумму .
6. Пример: бензол (4 степени ненасыщенности)
Например, таким образом, молекулярная формула C 6 H 6 (4 степени ненасыщенности) удовлетворяется молекулами с
- 4 пи-связями
- 3 пи-связи и кольцо ( бензол )
- две пи-связи и два кольца (очень нестабильный бензол Дьюара, синтезированный в 1963 г.
 )
) - одна пи-связь и три кольца (еще более нестабильный бензвален, контактное взрывчатое вещество, синтезирован в 1971 г.)
- и да, даже с нулевыми пи-связями и четырьмя кольцами (присман, синтезирован в 1973 г.).
[Историческое примечание: формула бензола была известна как C 6 H 6 от Майкла Фарадея в 1825 году, но правильная структура не была предложена до 1865 года (Кекуле), а не подтвердил до 1929 года, Рентгеновские исследования Кэтрин Лонсдейл [h / t BRSM]. Просто напоминание о том, что знание молекулярной формулы только поможет вам. ]
Полезный совет: если вы видите 4 степени ненасыщенности в неизвестной молекуле, подумайте, что «бензольное кольцо» — хорошее место для начала.
7. А как насчет молекул, содержащих кислород?
Пока все хорошо. Давайте двигаться дальше. А как насчет молекул с кислородом?
Действуют те же правила! Мы можем рассчитать количество атомов водорода по количеству атомов углерода, как если бы кислорода не существовало.
Обратите внимание, что π-связь, которая содержит кислород, все еще считается «степенью ненасыщенности» (см. Формальдегид, CH 2 O).
8. Что насчет галогенов?
ОК. А как насчет галогенов, таких как хлор, фтор, йод и бром?
Для целей нашей формулы, связывающей атомы водорода с атомами углерода для молекул без колец или двойных связей, галогенов можно считать атомами водорода. То есть четыреххлористый углерод (CCl 4 ) имеет ту же степень ненасыщенности (ноль), что и CH 4 .
Таким образом, мы можем изменить уравнение для молекулы без двойных связей или колец следующим образом:
9. Азот — это немного сложно
Мы оставили азот напоследок, потому что это немного странно. Постарайтесь увидеть, как азот влияет на нашу формулу.
Хорошо, вы могли заметить, что мы не можем игнорировать азот, как кислород .
Чтобы уравнение работало с азотом, можно добавить количество азота к правой части уравнения, например:
Попробуйте это с кадаверином (C 5 H 14 N 2 ), который не содержит двойных связей или колец.
10. Единая формула для степеней ненасыщенности
До сих пор наше уравнение применялось только к «насыщенным» соединениям без двойных связей или колец.
Как мы можем использовать это, чтобы составить общую формулу для «степеней ненасыщенности», которая на самом деле… полезна?
Математическое время.Если мы переместим левую часть вправо, мы получим следующее:
Ноль в данном случае соответствует степени ненасыщенности.
Если мы введем двойную связь или кольцо, уравнение вернет «2».
Каждая последующая степень ненасыщенности увеличивает это число на 2. Например, 2-хлорпиридин C 5 H 4 NCl дает нам 8:
Теперь 8 не является степенью ненасыщенности. Это просто количество атомов водорода, «отсутствующих» в соответствующем нециклическом алкане с таким же количеством углерода.
Чтобы это уравнение дало нам фактические степени ненасыщенности, , нам нужно разделить все на два .
Мы действительно можем конденсировать вещи, используя символы H, C, N и X для обозначения атомов водорода, углерода, азота и галогенов соответственно.
Это наша окончательная форма для уравнения «степени ненасыщенности» или «индекса дефицита водорода», если хотите.
11. Применение формулы IHD к четырем примерам из реальной жизни
Хорошо, теперь о тех реальных примерах, которые я упомянул выше.
- C 9 H 8 O 4
- C 21 H 30 O 2
- C 17 h31NO 4 26 H 23 C НЕТ 2
Давайте включим каждый из них в нашу формулу. Вы должны получить:
- C 9 H 8 O 4 [6 степеней ненасыщенности]
- C 21 H 30 O 2 [7 степеней ненасыщенности]
- C 17 h31NO 4 [8 степеней ненасыщенности]
- C 11 H 15 NO 2 [5 степеней ненасыщенности]
Теперь давайте посмотрим на каждую из молекул. Вы обнаружите, что рассчитанные степени ненасыщенности согласуются с суммой [кратных связей и колец] в молекуле.
Вы обнаружите, что рассчитанные степени ненасыщенности согласуются с суммой [кратных связей и колец] в молекуле.
Супер полезный. Очень просто.
Со структурой перед вами это кажется очевидным. Но если вы имеете дело с неизвестным, это может быть очень полезно, как мы видели в предыдущем посте с гормоном оленьей предплюсны.
В следующем посте мы начнем вникать в тайны спектроскопии. Мы начнем с одного из простейших спектроскопических методов — УФ-видимой спектроскопии — и покажем, как его можно использовать для получения подсказок о структурах различных молекул.
Проверь себя!
19 Классные химические реакции, доказывающие, что наука увлекательна
Химия может быть одной из самых завораживающих, но и опасных наук. Смешивание определенных химикатов может вызвать довольно неожиданные реакции, которые могут быть интересны для демонстрации. Хотя некоторые реакции можно наблюдать ежедневно, например, смешивание сахара с кофе, некоторые требуют контролируемых условий для визуализации эффектов. Но есть некоторые химические реакции, наблюдать за которыми просто потрясающе, и их легко провести в химических лабораториях.
Но есть некоторые химические реакции, наблюдать за которыми просто потрясающе, и их легко провести в химических лабораториях.
В целях вашей безопасности самый простой выход — посмотреть видео с такими впечатляющими химическими реакциями, прежде чем вы подумаете о том, чтобы воспроизвести их, чтобы лучше понять уровень риска и необходимые меры безопасности.
Вот список из 19 самых потрясающих химических реакций, которые доказывают, что наука всегда крута.
1. Полиакрилат натрия и вода
Полиакрилат натрия — это сверхабсорбентный полимер. Подводя итог реакции, ионы полимера притягивают воду путем диффузии.Полимер поглощает воду за секунды, что приводит к почти мгновенному превращению в гелеобразное вещество. Именно это химическое вещество используется в подгузниках для поглощения отработанной жидкости. Технически это не химическая реакция, потому что химическая структура не меняется и не происходит реакции с молекулами воды. Скорее, это демонстрация поглощения в макроуровне.
Скорее, это демонстрация поглощения в макроуровне.
2. Диэтилцинк и воздух
Диэтилцинк — очень нестабильное соединение.При контакте с воздухом он горит с образованием оксида цинка, CO2 и воды. Реакция происходит, когда диэтилцинк вступает в контакт с молекулами кислорода. Химическое уравнение выглядит следующим образом:
Zn (C2H5) 2 + 5O2 → ZnO + 4CO2 + 5h3O
3. Цезий и вода
Источник: Giphy Цезий — один из наиболее реактивных щелочных металлов. При контакте с водой он реагирует с образованием гидроксида цезия и газообразного водорода. Эта реакция происходит так быстро, что вокруг цезия образуется водородный пузырь, который поднимается на поверхность, который затем подвергает цезий воздействию воды, вызывая дальнейшую экзотермическую реакцию, таким образом воспламеняя газообразный водород. Этот цикл повторяется до тех пор, пока не будет исчерпан весь цезий.
Этот цикл повторяется до тех пор, пока не будет исчерпан весь цезий.
4. Глюконат кальция
Глюконат кальция обычно используется для лечения дефицита кальция. Однако, когда он нагревается, он вызывает огромное расширение молекулярной структуры. Это приводит к образованию пены, напоминающей серую змею, вызванной испарением воды и дегидратацией гидроксильных групп внутри соединения. Говоря менее научным языком, при нагревании глюконат кальция быстро разлагается. Реакция следующая:
2C 12 H 22 CaO 14 + O 2 → 22H 2 O + 21C + 2CaO + 3CO 2
5.Трииодид азота
Это соединение можно приготовить дома, но имейте в виду, что это очень опасно. Соединение образуется в результате осторожной реакции йода и аммиака. После высыхания исходных компонентов образуется NI3 — очень реактивное соединение. Простое прикосновение пера вызовет взрыв этого очень опасного контактного взрывчатого вещества.
Соединение образуется в результате осторожной реакции йода и аммиака. После высыхания исходных компонентов образуется NI3 — очень реактивное соединение. Простое прикосновение пера вызовет взрыв этого очень опасного контактного взрывчатого вещества.
6. Дихромат аммония
При воспламенении дихромата аммония он разлагается экзотермически с образованием искр, золы, пара и азота.
7. Перекись водорода и иодид калия
Когда перекись водорода и иодид калия смешиваются в надлежащих пропорциях, перекись водорода разлагается очень быстро. В эту реакцию часто добавляют мыло, чтобы в результате образовалось пенистое вещество. Мыльная вода улавливает кислород, продукт реакции, и создает множество пузырьков.
8. Хлорат калия и конфеты
Мармеладные мишки — это, по сути, просто сахароза.Когда мармеладные мишки попадают в хлорат калия, он вступает в реакцию с молекулой глюкозы в сахарозе, что приводит к сильно экзотермической реакции горения.
9. Реакция Белоусова-Жаботинского (BZ)
Реакция BZ образуется при осторожном сочетании брома и кислоты. Реакция является ярким примером неравновесной термодинамики, которая приводит к красочным химическим колебаниям, которые вы видите на видео выше.
10.Окись азота и сероуглерод
Часто называемая реакцией «лай собаки», это химическая реакция, возникающая в результате воспламенения сероуглерода и закиси азота. Реакция дает яркую синюю вспышку и очевидный звук глухой. Реагенты реакции быстро разлагаются в процессе горения.
Реакция дает яркую синюю вспышку и очевидный звук глухой. Реагенты реакции быстро разлагаются в процессе горения.
11. Сплав NaK и вода
Сплав NaK представляет собой металлический сплав, образованный смешением натрия и калия вне воздуха — обычно в керосине.Этот чрезвычайно реактивный материал может реагировать с воздухом, но еще более бурная реакция происходит при контакте с водой.
12. Термит и лед
Вы когда-нибудь думали, что смешивание огня и льда может привести к взрыву?
СВЯЗАННЫЕ: 11 ЛУЧШИХ ХИМИЧЕСКИХ КАНАЛОВ НА YOUTUBE
Вот что происходит, когда вам немного помогает Thermite, который представляет собой смесь алюминиевого порошка и оксида металла. Когда эта смесь воспламеняется, происходит экзотермическая окислительно-восстановительная реакция, т. е.е. химическая реакция, в которой энергия высвобождается в виде электронов, которые переходят между двумя веществами. Таким образом, когда термит помещается поверх льда и воспламеняется с помощью пламени, лед немедленно загорается, и выделяется большое количество тепла в виде взрыва. Однако нет какой-либо убедительной научной теории о том, почему термит вызывает взрыв. Но одно ясно из демонстрационного видео — не пробуйте это дома.
е.е. химическая реакция, в которой энергия высвобождается в виде электронов, которые переходят между двумя веществами. Таким образом, когда термит помещается поверх льда и воспламеняется с помощью пламени, лед немедленно загорается, и выделяется большое количество тепла в виде взрыва. Однако нет какой-либо убедительной научной теории о том, почему термит вызывает взрыв. Но одно ясно из демонстрационного видео — не пробуйте это дома.
13.Осциллирующие часы Бриггса-Раушера
Реакция Бриггса-Раушера — одна из очень немногих колеблющихся химических реакций. Реакция дает визуально ошеломляющий эффект за счет изменения цвета раствора. Для инициирования реакции смешивают три бесцветных раствора. Полученный раствор будет циклически менять цвет с прозрачного на янтарный в течение 3-5 минут и в итоге станет темно-синим. Три раствора, необходимые для этого наблюдения, представляют собой разбавленную смесь серной кислоты (H 2 SO 4 ) и йодата калия (KIO 3 ), разбавленную смесь малоновой кислоты (HOOOCCH 2 COOH), моногидрата сульфата марганца.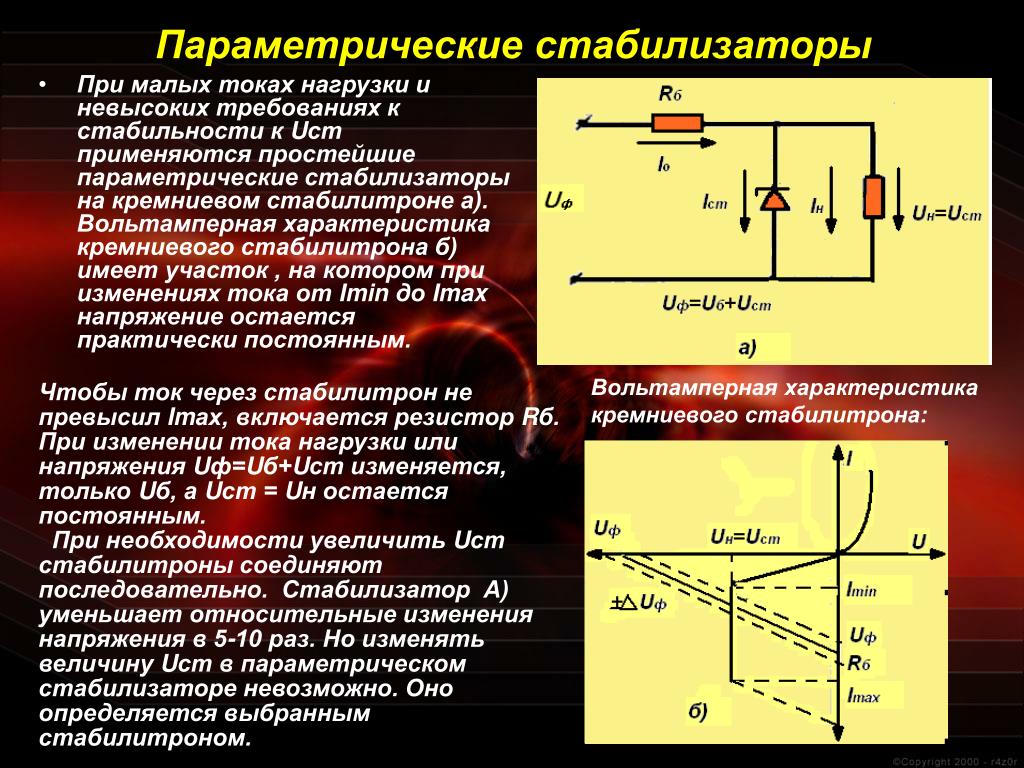 (МнСО 4 .H 2 O) и крахмал витекс и, наконец, разбавленный пероксид водорода (H 2 O 2 ).
(МнСО 4 .H 2 O) и крахмал витекс и, наконец, разбавленный пероксид водорода (H 2 O 2 ).
14. Supercool Water
Возможно, вы не заморозите окружающую среду, как Эльза в фильме «Холодное сердце», но вы, безусловно, можете заморозить воду прикосновением к этому классному научному эксперименту. Эксперимент с супер холодной водой заключается в охлаждении очищенной воды до -24 ° C (-11 ° F). Охлажденную бутылку можно медленно вынуть и постучать по дну или по бокам, чтобы запустить процесс кристаллизации.Поскольку очищенная вода не имеет примесей, молекулы воды не имеют ядра для образования твердых кристаллов. Внешняя энергия, обеспечиваемая в виде крана или удара, заставит молекулы переохлажденной воды образовывать твердые кристаллы посредством зародышеобразования и запустит цепную реакцию по кристаллизации воды по всей бутылке.
15. Феррожидкость
Ферромагнитная жидкость состоит из наноразмерных ферромагнитных частиц, взвешенных в жидкости-носителе, такой как органический растворитель или вода.Изначально обнаруженные Исследовательским центром НАСА в 1960-х годах в рамках исследования по поиску методов контроля жидкостей в космосе, феррожидкости при воздействии сильных магнитных полей будут создавать впечатляющие формы и узоры. Эти жидкости могут быть приготовлены путем объединения пропорций соли Fe (II) и соли Fe (III) в основном растворе с образованием валентного оксида (Fe 3 O 4 ).
16. Гигантский пузырь с сухим льдом
Сухой лед всегда является забавным веществом для различных экспериментов.Если вам удастся найти немного сухого льда, попробуйте в этом эксперименте создать гигантский пузырь из простых материалов.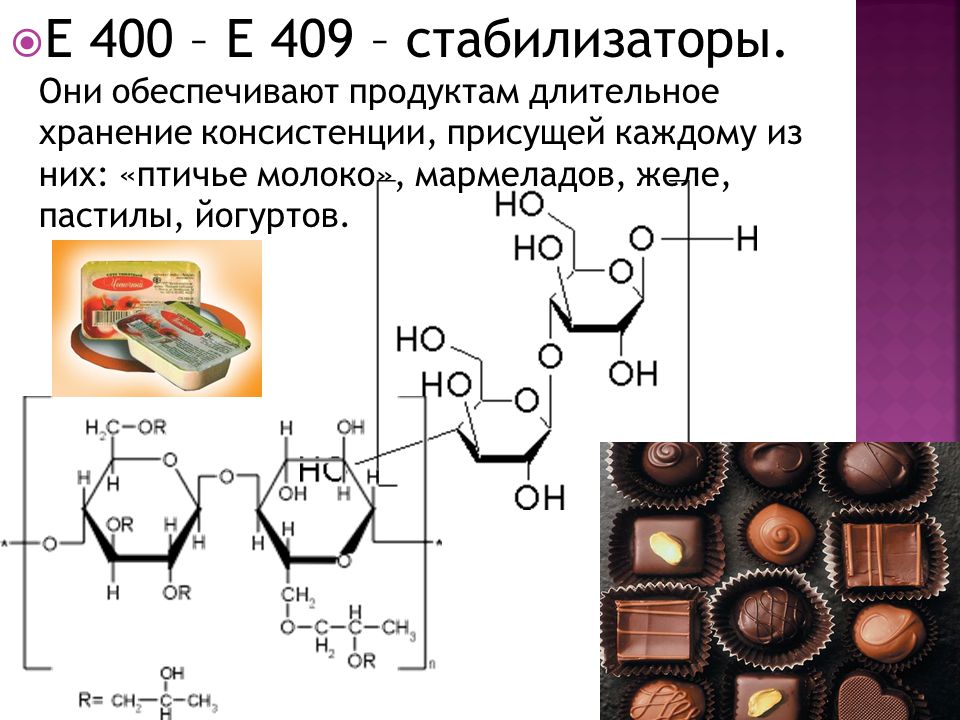 Возьмите миску и наполовину наполните ее водой. Смочите жидкое мыло водой и перемешайте. Пальцами намочите края миски и добавьте в раствор сухой лед. Окуните полоску ткани в мыльную воду и протяните ее по всему краю миски. Подождите, пока пары сухого льда не задержатся внутри пузыря, который начнет постепенно расширяться.
Возьмите миску и наполовину наполните ее водой. Смочите жидкое мыло водой и перемешайте. Пальцами намочите края миски и добавьте в раствор сухой лед. Окуните полоску ткани в мыльную воду и протяните ее по всему краю миски. Подождите, пока пары сухого льда не задержатся внутри пузыря, который начнет постепенно расширяться.
17. Змея фараона
Змея фараона — это простая демонстрация фейерверка.Когда тиоцианат ртути воспламеняется, он распадается на три продукта, и каждый из них снова распадается на еще три вещества. Результатом этой реакции является растущий столб, напоминающий змею, с выделением пепла и дыма. Хотя все соединения ртути токсичны, лучший способ провести этот эксперимент — в вытяжном шкафу. Также существует серьезная опасность пожара. Однако самое простое решение — посмотреть видео, если у вас нет доступа к материалам.
18. Эффект Мейснера
Охлаждение сверхпроводника ниже температуры перехода сделает его диамагнитным.Это эффект, при котором объект будет отталкиваться от магнитного поля, а не тянуться к нему. Эффект Мейснера также привел к концепции транспортировки без трения, при которой объект может левитировать по рельсам, а не прикрепляться к колесам. Однако этот эффект также можно воспроизвести в лаборатории. Вам понадобится сверхпроводник и неодимовый магнит, а также жидкий азот. Охладите сверхпроводник жидким азотом и поместите сверху магнит, чтобы наблюдать левитацию.
19. Сверхтекучий гелий
Охлаждение гелия до достижения его лямбда-точки (-271 ° C) сделает его сверхтекучим, известным как гелий II. Эта сверхтекучая жидкость образует тонкую пленку внутри контейнера и будет подниматься против силы тяжести, чтобы найти более теплые области. Тонкая пленка имеет толщину около 30 нм и имеет капиллярные силы, превышающие силу тяжести, которая удерживает жидкость в контейнере.
IB Химия — Расширенное эссе
Расширенное эссе по химии
Ниже приводится обзор расширенного руководства по написанию сочинений для химия (документы IBO)
Расширенное эссе по химии дает студентам возможность чтобы исследовать определенный аспект материалов в нашей окружающей среде.Такие расширенные эссе должны характеризоваться определенным химическим акцент в более общем наборе критериев исследования.
Результат исследования должен быть последовательным и структурированным. написания, которое эффективно рассматривает конкретную проблему или исследование вопрос и приходит к определенному, предпочтительно личному, выводу.
Выбор темы
Важно, чтобы расширенное эссе имело четкий химический акцент. и не имеет более тесного отношения к другому предмету.Химия — это наука, которая занимается составом, характеристикой и преобразованием веществ. Таким образом, расширенное эссе по химии должно включать химические принципы и теория, и подчеркивают сущность химии, относящейся к изучению материи и ее изменений терпит.
Хотя одинаковые критерии оценки применяются ко всем расширенным эссе, для расширенного эссе по химии выбранная тема должна позволяют подход, который явно включает химию.Где тема можно подойти с разных точек зрения, лечение к материалу следует подходить с точки зрения химии. Например, расширенное эссе в междисциплинарной области, такой как биохимия будет ли, если оно зарегистрировано как расширенное эссе по химии, будет оцениваться по его химический состав, а не его биологическое содержание.
Объем темы и связанных с ней исследований должен позволяют рассмотреть все критерии.Хорошая тема — та, где отдельный вопрос исследования четко сфокусирован и поддается лечению эффективно в пределах лимита слов. Пожалуй, самый важный фактор — это глубина изучения темы, которую может дать студент. Широкие или сложные темы опросов (например, исследования в области здравоохранения проблемы, вызванные загрязнением воды, химиотерапия для лечения рака или использование спектроскопии в химическом анализе) не позволит учащийся обсуждать противоречивые идеи и теории, а также углубленный личный анализ в пределах слов.
Некоторые темы могут быть непригодны для исследования из соображений безопасности вопросы. Например, эксперименты с токсичными или опасными химическими веществами, следует избегать канцерогенных веществ или радиоактивных материалов. если нет надлежащего предохранительного оборудования и квалифицированного надзора.
Другие темы могут быть неподходящими, потому что результат уже хороший известны и задокументированы в стандартных учебниках, и студент не может иметь возможность показать любой личный вклад.Примером может служить исследование реакции щелочных металлов с водой, как это уже описано по программе. Однако при принятии решения необходимо проявлять некоторую осторожность. подходит тема или нет; например, ранее исследование аллотропов углерода можно было бы подумать тривиальным но сегодня этого не было бы.
Примеры названий эссе
Следующие примеры названий расширенных эссе по химии: предназначены только для ознакомления.Пары иллюстрируют, что целевые темы (обозначенный первым заголовком) следует поощрять, а не расширять темы (обозначены вторым заголовком).
«Соотношение газов, выделяющихся на положительном электроде во время электролиз поваренного солевого раствора »лучше, чем« Электролиз решений ».
«Спектрофотометрическое определение следовых количеств свинца. в питьевой воде »лучше, чем« Анализ воды ».
«Влияние жевательной резинки без сахара на pH слюны. во рту после еды »лучше, чем« Кислотно-щелочная химия ».
«Как можно выделить и очистить природный окислитель рутин? из семян китайского Scholartree? »лучше, чем« Добыча натуральных продуктов из растений ».
Более того, это может помочь, если учащийся дополнительно определит и уточнит тема, выбранная для изучения, в виде исследовательского вопроса или утверждения.
Название
Соотношение газов, выделяющихся на положительном электроде во время электролиз поваренной соли
Исследовательский вопрос
Есть ли связь между концентрацией водного раствора натрия раствор хлорида и соотношение количеств кислорода и хлора газ, который выделяется на положительном электроде во время электролиза.
Название
Содержание кофеина в чашке чая
Исследовательский вопрос
Время, необходимое для заваривания чашки чая в определенной рекламе. чайные листья значительно изменяют количество кофеина, который растворяется в напитке?
Название
Анализ желе клубники методом бумажной хроматографии
Исследовательский вопрос
Применение бумажной хроматографии для определения наличия клубники желе из 24 стран на 5 континентах все содержат одинаковые красные красители.
Лечение темы
Расширенное эссе по химии может быть основано на литературе, теоретической модели или экспериментальные данные. Какая бы категория или комбинация категории, студент должен убедиться, что достаточно данных доступен для оценки и что тема может быть точно исследована используя локально доступные ресурсы.
Студенты, которые решили написать расширенное эссе на основе литературы и / или опросы должны гарантировать, что их расширенное эссе ясно показывает его химическая основа.Эссе, написанные на уровне газеты или новостной журнал вряд ли получит высокую оценку.
Поскольку химия — экспериментальная наука, студенты сильно поощряются к проведению экспериментальной работы в рамках своих исследований, хотя это не обязательно. Для размещения своих исследований в соответствующем контексте, студенты должны исследовать область расследование до начала каких-либо экспериментальных работ.Где возможно, они должны обращаться к оригинальным исследованиям с использованием научных журналов, личных коммуникации и Интернет. Учебники никогда не должны быть единственными источник информации.
Все эссе, включающие экспериментальную работу, проделанную студентом должен включать четкое и краткое описание экспериментального Работа. Студенты должны четко указать, есть ли у них лично разработали эксперимент, или укажите источник существующего эксперимента метод, который они использовали, и сообщают, как они адаптировались и улучшили на него.Все сочинения должны проходить под контролем школьного руководителя.
Многие из лучших эссе написаны студентами, исследующими относительно простые явления с использованием аппаратуры и материалов, которые можно найти в большинство школьных лабораторий, и такой подход следует поощрять. Если практическая работа проводится в промышленной или университетской лаборатории, эссе должно сопровождаться письмом от внешнего научного руководителя описание характера надзора и уровня руководства предоставлена.Директор школы должен убедиться, что описанная работа в эссе является подлинным и по сути принадлежит студенту.
Данные, собранные в ходе эксперимента, разработанного студентом, мало ценность, если она не проанализирована с использованием соответствующих научных методов, оценивается и, возможно, сравнивается с соответствующими моделями.
Можно написать расширенное эссе по химии, в котором студент использовал данные, собранные где-то еще, в качестве основного источника.В таких случаях элемент личного анализа и оценки крайне важный.
В любом расширенном эссе по химии учащиеся должны уметь продемонстрировать что они понимают теорию, лежащую в основе любой экспериментальной работы, и изложите любые сделанные предположения. Они должны показать понимание полученные результаты и уметь интерпретировать их со ссылкой на поставлен исследовательский вопрос. Они должны критически относиться к неадекватным экспериментальным дизайн, ограничения экспериментального метода и любые систематические ошибки.
Следует поощрять учащихся к рассмотрению нерешенных вопросов в свои исследования, и предложить новые вопросы и области для дальнейшего расследование в своем заключении. На протяжении всего эссе студенты должны четко подчеркивать свой личный вклад.
Интерпретация критериев оценки
Критерий A: исследовательский вопрос
Многие исследовательские вопросы можно сформулировать как актуальный вопрос или вопросов.Типичный пример: «Какой газ выделяется, когда цинк добавляется в раствор сульфата меди (II) и какие факторы влияют на его образование? ». Однако в расширенных эссе по химии это прекрасно. разумно сформулировать вопрос исследования как утверждение или как гипотеза, а не реальный вопрос. «Анализ количество алюминия в дезодорантах для подмышек трех разных марок методом видимой спектроскопии »и« Кинетика окисления йодид-ионов с перекисью водорода в кислых растворах » два таких примера, когда уместно утверждение, а не вопрос.Каким бы способом он ни был сформулирован, его следует четко обозначить как вопрос исследования и изложен на видном месте во введении.
Критерий B: введение
Цель введения — поставить вопрос исследования в контекст, то есть связать исследовательский вопрос с существующими знаниями по химии. Обычно целесообразно включать также лежащие в основе химическая теория, необходимая для понимания того, как вопрос исследования возник.Некоторые исследовательские вопросы требуют некоторых базовых знаний это не связано с химией — например, «окаменелости найденные в разных пластах горных пород в определенном месте, содержат разное количество серы? ». Чтобы эссе имело смысл, было бы важно указать возраст пород и дать некоторые геологический фон. В таких случаях только необходимое нехимическое информация должна быть представлена во введении, так как эссе будет быть отмеченным его химическим составом.Если необходимо добавить еще нехимическая (например, геологическая) информация, то соответствующая место для него — приложение.
Критерий C: расследование
То, как будет проводиться расследование, будет сильно зависеть много о том, содержит ли эссе выполненную экспериментальную работу студентом. Что касается неэкспериментальных эссе, учащиеся должны стараться чтобы четко показать, как были выбраны данные.Они должны различать между первоисточниками (оригинальные научные публикации, личные коммуникации, интервью) и вторичные источники (учебники, газеты статей, обзоров) и покажите, насколько надежны эти источники находятся. Для экспериментальной работы необходимо предоставить достаточную информацию. чтобы работа могла быть повторена в случае необходимости независимым рабочий. Студенты должны четко указать, какие эксперименты они проводят. разработали сами и которые они изменили, адаптировали или улучшили из существующих методов.
Критерий D: знание и понимание тема изучена
Студенты должны показать, что они полностью понимают основную химию за контекст их исследовательского вопроса и их последующие расследование. От них не ожидается объяснение основ химии формирования часть курса химии Дипломной программы, но они ожидаются показать, что они полностью понимают соответствующие принципы и идеи и может правильно их применить.Они также должны продемонстрировать, что они понимать теорию, лежащую в основе любых используемых методов или устройств.
Критерий E: аргументированный аргумент
Студенты должны осознавать необходимость дать своим сочинениям основу развивающегося аргумента. Хороший аргумент по химии почти обязательно включать рассмотрение и сравнение разных подходов и методы, имеющие прямое отношение к вопросу исследования. Простой описательные или повествовательные отчеты, в которых отсутствует анализ, обычно выдвигать аргумент, и его следует избегать.
Критерий F: применение аналитических и оценочных навыки, соответствующие предмету
Полное понимание надежности всех данных, используемых для поддержки аргумент должен быть показан. Несоответствующий экспериментальный план или систематические ошибки должны быть выявлены. Величина неопределенностей в физических данных следует оценивать и обсуждать. Приближения в моделях следует учитывать и тщательно проверять все допущения.Где возможно, качество доступных источников или полученных данных должны быть проверены вторичными источниками или прямыми расчетами.
Критерий G: использование языка, соответствующего предмет
Следует последовательно использовать правильную химическую терминологию и номенклатуру и эффективно на протяжении всего расширенного эссе. Соответствующие химические формулы (включая структурные формулы), сбалансированные уравнения (включая символы) и механизмы.Правильные единицы для всегда должны указываться физические количества и надлежащее использование значительных цифры не ожидается.
Критерий H: заключение
Заключение должно соответствовать представленным аргументам и не следует просто повторять материал во введении или вводить новые или посторонние моменты в аргументе. В химии это почти всегда уместно рассмотреть нерешенные вопросы и предложить области для дальнейшего расследования.
Критерий I: формальное представление
Этот критерий относится к степени соответствия эссе академическим стандартам о том, как следует быть представленным. Представление эссе без библиографии или которые не дают ссылок считается неприемлемым (уровень 0). Эссе которые пропускают один из обязательных элементов — титульный лист, оглавление, номера страниц — считаются не лучше, чем удовлетворительные (максимум уровень 2), а эссе, в которых отсутствуют два из них, в лучшем случае считаются плохими (максимальный уровень 1).
Эссе не должно превышать 4000 слов повествования. Графики, рисунки, расчеты, диаграммы, формулы и уравнения не входят в количество слов. Для экспериментов, в которых рассчитываются численные результаты из данных, полученных при изменении одной из переменных, обычно Хорошая практика показать один пример расчета. Остаток может отображаться в табличной или графической форме.
Критерий J: аннотация
Реферат оценивается по ясности, с которой в нем представлен обзор исследования и эссе, а не качества исследования вопрос, ни качество аргументов или выводов.
Критерий K: целостное суждение
Качества, которые награждаются в соответствии с этим критерием, включают следующее.
Интеллектуальная инициатива: способы продемонстрировать это в химии эссе включают выбор темы и исследовательский вопрос, а использование новых или инновационных подходов к решению исследовательского вопроса.
Проницательность и глубина понимания: они, скорее всего, будут продемонстрировано как следствие детального исследования и тщательного размышления, и хорошо информированным и аргументированным аргументом, который последовательно и эффективно решает вопрос исследования.
Оригинальность и креативность: они будут очевидны благодаря очевидным свидетельствам личного подхода, подкрепленного серьезными исследованиями и аргументацией.
Ресурсы
Критерии оценки
Названия прошлых эссе
Пример расширенного эссе 2013 г.
Пример расширенного эссе 2013 г.
Пример расширенного эссе 2013 г.
Пример расширенного эссе 2012 г.
Пример расширенного эссе 2012 г.
Расширенный отчет экзаменатора эссе 2012
границ в химии
Frontiers in Chemistry — это широко известный и качественный журнал, в котором публикуются тщательно отрецензированные исследования в области химических наук.Главный редактор Стива Суиба из Университета Коннектикута поддерживает выдающийся редакционный совет международных исследователей. Этот мультидисциплинарный журнал с открытым доступом находится на переднем крае распространения научных знаний и важных открытий среди ученых, лидеров отрасли и общественности во всем мире.
Химия — это отрасль науки, связанная со всеми другими основными областями исследований. Вездесущность химии проявляется в нашей повседневной жизни от электронных устройств, которые мы все используем для общения, до продуктов, которые мы едим, до нашего здоровья и благополучия, до различных форм энергии, которые мы используем.Хотя в химии существует множество подтем и специальностей, фундаментальное звено во всех этих областях — это то, как атомы, ионы и молекулы соединяются и расходятся в том, что некоторые называют «танцем жизни».
Все специальные разделы справочника Frontiers in Chemistry открыты для публикации выдающихся научных публикаций, обзорных статей, комментариев и идей по различным аспектам химии. В прошлых формах публикаций часто присутствовали определенные дисциплины, чаще всего аналитическая, неорганическая, органическая и физическая химия, но в наши дни эти линии и рамки довольно размыты, и разрозненность этих дисциплин, кажется, размывается.Химия важна как для фундаментальных, так и для прикладных областей исследований и производства, и действительно, очертания академических и промышленных исследований также часто являются искусственными. Совместные исследования по всем специальностям химии приветствуются и поддерживаются по мере нашего продвижения вперед. Это захватывающие времена, и область химии является важным и значительным вкладом в наши коллективные знания.
Все материалы для Frontiers in Chemistry должны соответствовать рекомендациям, представленным в нашем Контрольном списке для подачи.От авторов требуется сообщать данные, использованные для характеристики новых и известных соединений.
Авторам рекомендуется подавать Контрольный список характеристик вместе со своей рукописью. ( .xlsx файл ) Контрольный список не будет опубликован, но поможет редакторам-рецензентам и младшим редакторам оценить полноту представленных данных.
Frontiers in Chemistry является членом Комитета по этике публикаций.

