Что такое электропроводность растворов. Как определить силу электролита. Какие факторы влияют на электропроводность. Как провести эксперимент по измерению электропроводности различных веществ.
Что такое электропроводность водных растворов
Электропроводность — это способность вещества проводить электрический ток. В водных растворах электропроводность обусловлена наличием ионов, которые могут свободно перемещаться и переносить электрический заряд. Чем больше ионов содержится в растворе, тем выше его электропроводность.
Основные факторы, влияющие на электропроводность водных растворов:
- Концентрация ионов
- Подвижность ионов
- Температура раствора
- Природа растворенного вещества
Классификация веществ по электропроводности
По способности проводить электрический ток в водных растворах вещества делятся на три группы:
- Сильные электролиты — вещества, полностью диссоциирующие на ионы в водных растворах. Обладают высокой электропроводностью.
- Слабые электролиты — вещества, частично диссоциирующие на ионы. Обладают умеренной электропроводностью.
- Неэлектролиты — вещества, не диссоциирующие на ионы. Практически не проводят электрический ток.
Как определить силу электролита
Силу электролита можно определить по степени его диссоциации в водном растворе:
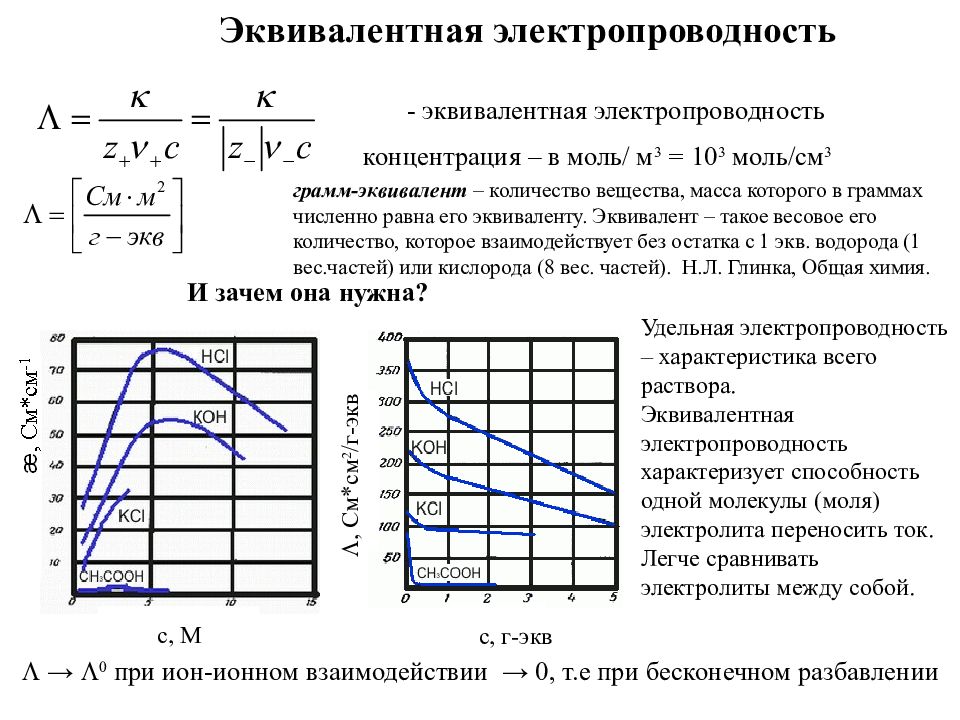
- Сильные электролиты: степень диссоциации α > 30%
- Электролиты средней силы: 3% < α < 30%
- Слабые электролиты: α < 3%
Чем выше степень диссоциации, тем больше ионов образуется в растворе и тем выше его электропроводность.
Примеры сильных и слабых электролитов
К сильным электролитам относятся:
- Сильные кислоты: HCl, HNO3, H2SO4
- Сильные основания: NaOH, KOH
- Растворимые соли: NaCl, KNO3, CuSO4
Примеры слабых электролитов:
- Слабые кислоты: CH3COOH, H2CO3
- Слабые основания: NH4OH, Mg(OH)2
- Малорастворимые соли: AgCl, CaCO3
Факторы, влияющие на электропроводность растворов
На электропроводность водных растворов оказывают влияние следующие факторы:
- Концентрация ионов. Чем выше концентрация, тем больше электропроводность.
- Природа ионов. Ионы с меньшим радиусом и большим зарядом обладают более высокой подвижностью.
- Температура. При повышении температуры электропроводность растет.
- Вязкость раствора. Более вязкие растворы имеют меньшую электропроводность.
- Степень диссоциации электролита. Сильные электролиты дают больше ионов.
Измерение электропроводности растворов
Для измерения электропроводности водных растворов используются специальные приборы — кондуктометры. Они позволяют быстро и точно определить удельную электропроводность раствора.
Принцип работы кондуктометра основан на измерении сопротивления раствора между двумя электродами. Чем меньше сопротивление (выше проводимость), тем больше ионов содержится в растворе.
Подготовка к эксперименту по измерению электропроводности
Для проведения эксперимента по измерению электропроводности водных растворов потребуется следующее оборудование и материалы:
- Кондуктометр или самодельный измеритель проводимости
- Химические стаканы
- Дистиллированная вода
- Водопроводная вода
- Растворы различных веществ (кислот, оснований, солей)
- Твердые вещества (NaCl, CaCO3)
- Промывалка с дистиллированной водой
- Салфетки для протирания электродов
Порядок проведения эксперимента
- Подготовьте все необходимые растворы и оборудование.
- Проверьте работу кондуктометра на дистиллированной воде (проводимость должна быть близка к нулю).
- Измерьте электропроводность водопроводной воды.
- Проверьте электропроводность твердых веществ (NaCl, CaCO3), а затем их водных растворов.
- Измерьте электропроводность приготовленных растворов различных веществ.
- После каждого измерения тщательно промывайте и протирайте электроды.
- Запишите результаты измерений в таблицу.
Анализ результатов эксперимента
После проведения измерений проанализируйте полученные результаты:

- Сравните электропроводность различных веществ
- Определите, какие вещества являются сильными и слабыми электролитами
- Объясните различия в электропроводности схожих веществ
- Сделайте выводы о факторах, влияющих на электропроводность растворов
Применение знаний об электропроводности растворов
Понимание электропроводности водных растворов имеет важное практическое значение в различных областях:
- Аналитическая химия: определение концентрации веществ
- Экология: контроль качества воды
- Медицина: анализ биологических жидкостей
- Промышленность: контроль технологических процессов
- Сельское хозяйство: анализ почв и удобрений
Вопросы для самопроверки
Для лучшего усвоения материала ответьте на следующие вопросы:
- Что такое электропроводность раствора?
- Какие факторы влияют на электропроводность водных растворов?
- Чем отличаются сильные и слабые электролиты?
- Как изменится электропроводность раствора при его разбавлении?
- Почему дистиллированная вода практически не проводит электрический ток?
Заключение
Изучение электропроводности водных растворов позволяет глубже понять природу электролитов и их поведение в растворах. Эти знания имеют широкое практическое применение в различных областях науки и техники. Проведение экспериментов по измерению электропроводности помогает закрепить теоретические знания и развить практические навыки работы с растворами и измерительным оборудованием.
АнЛан | каталог сетевого и кабельного оборудования
Шкафы и стойки 19″Кабельная продукция
Компоненты СКС
Кабельные лотки (металлические)
Оптика
Инструмент, протяжки
Монтажные материалы
Источники электропитания
Активное оборудование
Кабель-каналы и аксессуары для монтажа
Труба гофрированная, гладкая, металлорукав
Оборудование для электрических сетей
Электротехнические шкафы
Видеонаблюдение
Освещение
Электроустановочные изделия
Климатическое оборудование
Компания AnLan – один из лидеров на рынке сетевого оборудования в России. В нашем каталоге представлен широкий ассортимент оборудования и комплектующих для создания сетей разной сложности. Продажа сетевого оборудования — от кабелей до шкафов – основное направление деятельности нашего магазина.
В нашем каталоге представлен широкий ассортимент оборудования и комплектующих для создания сетей разной сложности. Продажа сетевого оборудования — от кабелей до шкафов – основное направление деятельности нашего магазина.
Компания смело может гарантировать высокое качество продукции, т.к. напрямую сотрудничает с отечественными и заграничными производителями и является официальным поставщиком большинства из них. Сотрудничество с нами подразумевает для наших клиентов и партнеров ряд неоспоримых преимуществ:
- Ассортимент сетевого оборудования интернет-магазина АнЛан насчитывает сотни позиций и постоянно пополняется. Какой бы товар Вам не потребовался, Вы всегда сможете найти его на страницах нашего сайта, будь то шкафы телекоммуникационные или оптический патч корд.
- Продажа сетевого оборудования осуществляется по доступным ценам. Но для оптовых покупателей предусмотрены значительные скидки.
- Цены в магазине АнЛан вполне конкурентоспособны, т.к.
 компания является прямым дилером многих известных производителей сетевого оборудования – Cabeus, Legrand, DKC, APC, D-link, Ecoplast, Hyperline, и других.
компания является прямым дилером многих известных производителей сетевого оборудования – Cabeus, Legrand, DKC, APC, D-link, Ecoplast, Hyperline, и других. - Оборудование является полностью совместимым и отвечает принятым российским и мировым стандартам качества.
- Все сетевое оборудование предусматривает гарантию.
В нашем каталоге представлено только проверенное сертифицированное оборудование, выполняющее свои основные функции на высшем уровне.
Прямая и обратная полярность при сварке
В литературе по методам сварки и инструкциях к сварочным аппаратам нередко встречаются выражения «прямая и обратная полярность». От выбора полярности зависит процесс сварки, качество шва, расход электрода, глубина проплавления. Начинающим сварщикам важно знать, что означает прямая и обратная полярность, чтобы правильно подбирать режимы сварки в конкретных ситуациях.
В этой статье:
- Дуговая сварка — режимы полярности
- Отличия режимов сварки
- Влияние полярности на сварку
- Сварка полуавтоматом
- Сварка инвертором
- Электрододержатель
- Сварочные электроды
- Выбор инвертора и его эксплуатация
Дуговая сварка — режимы полярности
Для горения электрической дуги, которой осуществляется сварка, требуется источник тока и замыкание полюсов с небольшим воздушным зазором 3-5 мм. Источником тока может быть сварочный инвертор, преобразователь, выпрямитель, генератор. Понятие полярности возможно только у источников постоянного тока, поскольку у трансформаторов, вырабатывающих переменный ток, направление движения электронов меняется до 100 раз в секунду.
Источником тока может быть сварочный инвертор, преобразователь, выпрямитель, генератор. Понятие полярности возможно только у источников постоянного тока, поскольку у трансформаторов, вырабатывающих переменный ток, направление движения электронов меняется до 100 раз в секунду.
Соответственно, заряд тоже меняется с положительного на отрицательный многократно за секунды. При такой «скачке» с хаотичным движением, постоянной полярности быть не может. На постоянном токе отрицательно заряженные электроны движутся от минуса к плюсу. Их направление постоянное, что дает определенные свойства:
У сварочного аппарата постоянного тока есть два гнезда для подключения кабелей держателя и массы. В держатель вставляется электрод и сварщик манипулирует им, ведя шов. Кабель массы через зажим «крокодил» крепится к изделию.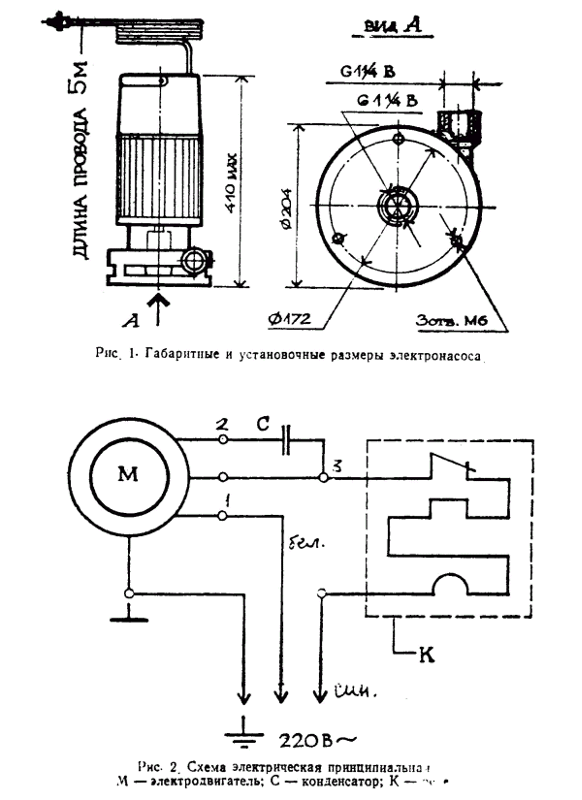
Если держатель установить в разъем «-«, а кабель массы подключить к «+», получится прямая полярность. При подключении наоборот (держатель к «+», а массу к «-«) полярность будет обратная.
Отличия режимов сварки
Рассмотрим, чем отличается прямая и обратная полярность при сварке. По законам физики постоянный ток течет в одном направлении от минуса к плюсу (движение электронов с отрицательным зарядом). При этом тепло всегда концентрируется на плюсе. Соответственно, где «+», там температура будет выше.
При сварке на прямой полярности «+» на изделии. Это обеспечивает больший нагрев поверхности и, в то же время, не перегревает электрод. На его кончике пятно тепла будет анодным. Работа дугой с обратной полярностью означает «плюс» на кончике электрода и образование катодного теплового пятна. За счет этого расходник нагревается больше, а изделие меньше. Разница в температуре составляет около 1000º С.
Влияние полярности на сварку
Теперь обсудим, как полярность, а именно локализация нагрева, сказываются на процессе сварки.
Достоинства и недостатки прямой полярности
Концентрация теплового пучка на изделии дает следующие результаты:
Сварка TIG цветных металлов, например меди, ведется на прямой полярности. Лучше всего применять такой режим при работах с металлами сечением от 4 мм и выше. Но тонкие листовые заготовки на прямой полярности будут прожигаться. Еще стороны может сильно «повести» при сварке и потребуется рихтовка деталей. Не получится использовать электроды для переменного тока при сварке постоянным с «плюсом» на держателе. Разбрызгивание металла при таком режиме тоже повышается.
Достоинства и недостатки обратной полярности
Использование обратной полярности дает следующие особенности при сварке:
Обратную полярность лучше использовать при сварке тонких металлов, чтобы электрод не прилипал, но при этом не было прожогов. В случае ведения прерывистой дугой коротких швов тепловложение уменьшается еще больше.
Соединение толстых заготовок 6-10 мм происходит гораздо хуже, поскольку нет нужной глубины проплавления. При «минусе» на держателе легче добиться качественного шва на нержавейке, алюминии, высокоуглеродистой стали или чугуне. Если требуется наплавить присадочный металл под последующую проточку, то на обратной полярности отделение капли происходит гораздо быстрее.
Если требуется наплавить присадочный металл под последующую проточку, то на обратной полярности отделение капли происходит гораздо быстрее.
Источник видео: Территория сварки R
Но кончик электрода от повышенного нагрева укорачивается тоже быстро, поэтому будет перерасход по материалам. Если обмазка электрода чувствительна к перегреву, то от удержания длительной непрерывной дуги покрытие может осыпаться, и голый стержень станет не пригодным для сварки. При снижении силы тока до минимального, дуга начинает «скакать» и управлять сварочной ванной становится сложнее, поэтому при сварке тонколистовой стали пригодятся дополнительные функции в инверторе, о которых упомянем ниже.
Сварка полуавтоматом
Если предстоит варить самозащитной порошковой проволокой без газа, то потребуется обратная полярность. В отличие от инвертора, у которого достаточно поменять местами разъемы кабеля держателя и массы, у полуавтомата горелка крепится к рукаву. В нем проложен канал для проволоки, силовой провод, шланг подачи защитного газа и провода управления. Просто в разъем с массой горелку не вставить — не подойдет по форме.
В отличие от инвертора, у которого достаточно поменять местами разъемы кабеля держателя и массы, у полуавтомата горелка крепится к рукаву. В нем проложен канал для проволоки, силовой провод, шланг подачи защитного газа и провода управления. Просто в разъем с массой горелку не вставить — не подойдет по форме.
Для смены полярности полуавтомата есть несколько способов, в зависимости от конфигурации оборудования. У одних моделей нужно поменять местами разъемы в нижней части (силовой кабель горелки имеет отдельный выход с гнездом, как у массы). У других — открыть боковую крышку и переподключить кабеля к клеммам (обычно они разных цветов). Потребуется рожковый ключ.
Сварка инвертором
Сварка ведется неотрывной дугой с зазором 3-5 мм. Чем быстрее проводить электрод над одним местом стыка, тем меньше глубина проплавления. При замедлении глубина провара увеличивается. Если предстоит подряд сваривать стыки с разной толщиной сторон, можно выставить силу тока на аппарате для самого большого сечения в конструкции, а глубину провара регулировать скоростью ведения электрода. Только дугу при этом всегда держат на более толстом металле, кратковременно перенося на тонкий, чтобы избежать прожогов.
Только дугу при этом всегда держат на более толстом металле, кратковременно перенося на тонкий, чтобы избежать прожогов.
Сварка на обратной полярности чаще всего применяется для соединения тонких листовых материалов сечением 1-3 мм. Но даже концентрирование теплового пучка на кончике электрода не всегда спасает от прожогов. Чтобы предупредить дефекты шва, используют прерывистую дугу. Ее поджигают касанием об изделие и накладывают короткие швы без отступов. Отрыв кончика электрода от изделия на высоту 2 см приводит к затуханию дуги. Затем кончик снова подносят и он загорается без постукивания. Такие паузы дают дополнительное время для остывания шва и исключают прожоги.
Электрододержатель
Сварочные электроды
Выбор инвертора и его эксплуатация
Чтобы быстро переключать полярность при работе с тонкими и толстыми металлами, у инвертора должны быть надежные разъемы силовых кабелей. Хлипкие тонкие штырьки в разъеме и невысокий бортик для фиксации быстро износятся от частых перестановок. Тогда возникнет люфт, в гнездах кабеля будут болтаться, образуется повышенное сопротивление и перегрев. Сила сварочного тока будет падать, а между разъемом и гнездом даже возможно образование электрической дуги.
Тогда возникнет люфт, в гнездах кабеля будут болтаться, образуется повышенное сопротивление и перегрев. Сила сварочного тока будет падать, а между разъемом и гнездом даже возможно образование электрической дуги.
Подбирайте надежные инверторы ММА с прочными гнездами, чтобы при смене полярности ничего не изнашивалось и не болталось. Если у Вас уже есть инвертор и его разъемы изношены, их можно заменить на более крепкие, выбрав из каталога соединительных кабельных разъемов.
Сварка тонкого металла 1.0-1.5 мм покрытым электродом — это сложная задача для новичка. Справиться с ней без прожогов помогут инверторы РДС с функцией «Антиприлипание». Когда кончик электрода погружается в сварочную ванну, аппарат «чувствует» это и выключает сварочный ток. В результате нет удерживающей силы, Вам не требуется наклонять держатель влево-вправо, чтобы оторвать электрод от поверхности. Обмазка расходника не осыпается при этом.
Функция «Форсаж дуги» тоже помогает при сварке тонкого металла на обратной полярности. Когда электрод вот-вот прилипнет, инвертор автоматически повышает силу тока на 10 А, сохраняя электрическую дугу. Как только Вы восстановили воздушный зазор, аппарат сам понижает силу тока до прежнего значения, исключая прожоги.
Когда электрод вот-вот прилипнет, инвертор автоматически повышает силу тока на 10 А, сохраняя электрическую дугу. Как только Вы восстановили воздушный зазор, аппарат сам понижает силу тока до прежнего значения, исключая прожоги.
Ответы на вопросы: особенности прямой и обратной полярности при сварке
При какой полярности шов более красивый внешне?
СкрытьПодробнее
При обратной. Тепло на кончике электрода выше, быстрее отделение капли, шов получается более чешуйчатым и без наплывов. Такой режим применим для лицевых сторон изделия, если толщину металла можно проплавить на обратной полярности.
На каком режиме снижается разбрызгивание металла при работе полуавтоматом?
СкрытьПодробнее
На обратной полярности брызг меньше. Если сварка ведется на лицевой стороне изделия и потом предстоит зачистка всех прилипших капель, лучше переключите полуавтомат на обратную полярность.
Если сварка ведется на лицевой стороне изделия и потом предстоит зачистка всех прилипших капель, лучше переключите полуавтомат на обратную полярность.
Как уменьшить ширину шва при обратной полярности?
СкрытьПодробнее
Чтобы шов был более узким при режиме обратной полярности, требуется быстрее вести электрод.
Электрод при резке становится красным, что делать?
СкрытьПодробнее
Скорее всего, у Вас подключена обратная полярность. Поменяйте силовые кабеля в гнездах местами. Работа при прямом подключении («+» на изделии), экономит расход электрода на 20-40% и снижает его нагрев.
На какой полярности варить алюминий полуавтоматом?
СкрытьПодробнее
На обратной. Алюминий имеет низкую температуру плавления и при перегреве потечет. Поэтому тепловой пучек концентрируют на электроде. Но для разрушения оксидной пленки нужен полуавтомат с импульсом (Pulse), иначе глубокого провара не получится.
Алюминий имеет низкую температуру плавления и при перегреве потечет. Поэтому тепловой пучек концентрируют на электроде. Но для разрушения оксидной пленки нужен полуавтомат с импульсом (Pulse), иначе глубокого провара не получится.
Остались вопросы
Оставьте Ваши контактные данные и мы свяжемся с Вами в ближайшее время
Обратная связь
Вернуться к списку
7: Электропроводность водных растворов (эксперимент)
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 95541
- Колледж Санта-Моники
- Колледж Санта-Моники
Объективы
- Для наблюдения электропроводности веществ в различных водных растворах
- Для определения раствор сильный или слабый электролит
- Чтобы интерпретировать химическую реакцию, наблюдая за проводимостью водного раствора.

Электропроводность основана на потоке электронов. Металлы являются хорошими проводниками электричества, потому что они позволяют электронам проходить через весь кусок материала. Таким образом, электроны текут как «море электронов» через металлы. Для сравнения, дистиллированная вода является очень плохим проводником электричества, поскольку через воду проходит очень мало электричества. Высокоионизированные вещества сильные электролиты . Сильные кислоты и соли являются сильными электролитами, так как полностью ионизируются (диссоциируют или расслаиваются) в растворе. Ионы переносят электрический заряд через раствор, создавая электрический ток. Ток, если он достаточен, зажжет один или оба светодиода на измерителе проводимости , показанном справа.
Слабоионизированные вещества слабые электролиты . Слабые кислоты и основания можно отнести к разряду слабых электролитов, поскольку они не полностью диссоциируют в растворе.
Вещества, не проводящие электрический ток, называются неэлектролитами . Неэлектролиты не ионизируются; они не содержат подвижных ионов. Светодиоды кондуктометра не загорятся, потому что нет ионов, переносящих электрический ток. В таблице ниже перечислены примеры сильных, слабых и неэлектролитов.
Неэлектролиты не ионизируются; они не содержат подвижных ионов. Светодиоды кондуктометра не загорятся, потому что нет ионов, переносящих электрический ток. В таблице ниже перечислены примеры сильных, слабых и неэлектролитов.
Сильные электролиты
Сильные кислоты
| Наименование | Формула |
|---|---|
|
Соляная кислота |
\(\ce{HCl}\) ( водный раствор ) |
|
Бромистоводородная кислота |
\(\ce{HBr}\) ( aq ) |
|
Йодоводородная кислота |
\(\ce{HI}\) ( aq ) |
|
Азотная кислота |
\(\ce{HNO3}\) ( водный ) |
|
Серная кислота |
\(\ce{h3SO4}\) ( водный раствор ) |
|
Хлорная кислота |
\(\ce{HClO4}\) ( водный раствор ) |
|
Хлорная кислота |
\(\ce{HClO3}\) ( водный ) |
Прочные основания
| Название | Формула |
|---|---|
|
Гидроксид натрия |
\(\ce{NaOH}\) ( водный ) |
|
Гидроксид калия |
\(\ce{KOH}\) ( aq ) |
|
Гидроксид кальция |
\(\ce{Ca(OH)2}\) ( водный ) |
|
Гидроксид бария |
\(\ce{Ba(OH)2}\) ( водный ) |
Растворимые соли
| Наименование | Формула |
|---|---|
|
Хлорид натрия |
\(\ce{NaCl}\) ( водный раствор ) |
|
Карбонат калия |
\(\ce{K2CO3}\) ( водный ) |
|
Сульфат меди(II) |
\(\ce{CuSO4}\) ( водный раствор ) |
Слабые электролиты
Слабые кислоты
| Наименование | Формула |
|---|---|
|
Уксусная кислота |
\(\ce{HC2h4O2}\) ( ) |
|
Угольная кислота |
\(\ce{h3CO3}\) ( водный раствор ) |
|
Лимонная кислота |
\(\ce{C6H8O7}\) ( водный раствор ) |
|
Фосфорная кислота |
\(\ce{h4PO4}\) ( aq ) |
Слабые основания
| Наименование | Формула |
|---|---|
|
Аммиак |
\(\ce{Nh4}\) ( aq ) |
|
Гидроксид аммония |
\(\ce{Nh5OH}\) ( водный ) |
|
Гидроксид магния |
\(\ce{Mg(OH)2}\) ( водный ) |
| Большинство других баз |
Малорастворимые соли
| Наименование | Формула |
|---|---|
|
Хлорид серебра |
\(\ce{AgCl}\) ( с ) |
|
Карбонат кальция |
\(\ce{CaCO3}\) ( с ) |
|
Сульфат бария |
\(\ce{BaSO4}\) ( с ) |
Неэлектролиты
| Наименование | Формула |
|---|---|
|
Вода дистиллированная |
\(\ce{h3O}\) ( л ) |
|
Метанол |
\(\ce{Ch4OH}\) ( водный ) |
Процедура
Материалы и оборудованиеизмеритель проводимости, промывочная бутыль с дистиллированной водой, большой стакан для промывки/отходов, маленькие стаканы, салфетки Kimwipes, твердый хлорид натрия, твердый карбонат кальция
Растворы: уксусная кислота, нитрат алюминия, гидроксид аммония, гидроксид кальция, лимонная кислота, этанол, соляная кислота, гидроксид магния, сульфат магния, азотная кислота, йодид калия, хлорид натрия, гидроксид натрия, сахароза
Безопасность
Будьте осторожны с соляной, азотной, серной и концентрированной уксусной кислотой. Несмотря на низкую концентрацию, некоторые люди могут иметь повышенную чувствительность кожи. Если вы чувствуете покалывание или изменение цвета кожи, немедленно промойте большим количеством воды в течение 15 минут. Сообщите об этом своему инструктору как можно скорее.
Несмотря на низкую концентрацию, некоторые люди могут иметь повышенную чувствительность кожи. Если вы чувствуете покалывание или изменение цвета кожи, немедленно промойте большим количеством воды в течение 15 минут. Сообщите об этом своему инструктору как можно скорее.
Требуемые средства индивидуальной защиты (СИЗ): лабораторный халат, защитные очки, закрытая обувь
Тестирование электропроводности – доказательства наличия ионов в водном растворе
- Измеритель имеет батарею 9 В и два параллельных медных электрода. Используйте промывочную бутыль с дистиллированной водой и большой химический стакан с надписью «отходы», чтобы промыть медные электроды. Высушите салфеткой Kimwipe. При включении фары не должны светиться каким-либо цветом. Если они есть, повторите полоскание и сушку.
Примечание
НЕ ПОДВЕРГАЙТЕ ПЕЧАТНУЮ ПЛАТУ ВОЗДЕЙСТВИЮ ВОДЫ. Только медные электроды следует промывать водой.
- Поместите глюкометр печатной платой вверх (батарея будет внизу).
 Всегда устанавливайте счетчик таким образом, чтобы печатная плата не намокла. На этой стороне есть руководство по возможным измерениям электропроводности:
Всегда устанавливайте счетчик таким образом, чтобы печатная плата не намокла. На этой стороне есть руководство по возможным измерениям электропроводности:
| Весы | Красный светодиод | Зеленый светодиод | Проводимость |
|---|---|---|---|
| 0 | от | от | низкий или отсутствует |
| 1 | тусклый | от | низкий |
| 2 | средний | от | средний |
| 3 | яркий | тусклый | высокий |
| 4 | очень яркий | средний | очень высокий |
Примечание
Включите измеритель и погрузите медные электроды для проверки электропроводности. Тщательно промывайте дистиллированной водой после каждого теста и сушите салфетками Kimwipes. Выключайте глюкометр между использованиями.
Тщательно промывайте дистиллированной водой после каждого теста и сушите салфетками Kimwipes. Выключайте глюкометр между использованиями.
- Поместите 5 мл дистиллированной воды в небольшой чистый химический стакан. Протестируйте и запишите свои результаты.
- Поместите 5 мл водопроводной воды в небольшой чистый химический стакан. Протестируйте и запишите свои результаты.
- Поместите около 0,2 г твердого хлорида натрия (\(\ce{NaCl}\)) в небольшой чистый химический стакан и проверьте электропроводность. Добавьте 5 мл дистиллированной воды к хлориду натрия; проверить электропроводность раствора. Вылейте этот раствор в раковину и промойте стакан.
- Поместите около 0,2 г твердого карбоната кальция (\(\ce{CaCO3}\) в небольшой чистый химический стакан и проверьте электропроводность. Добавьте 5 мл дистиллированной воды к карбонату кальция; проверьте электропроводность раствора. Утилизируйте этот раствор. в раковину и ополосните стакан.

- Используйте по 5 мл каждого из следующих веществ в стакане на 100 мл для проверки электропроводности.
Обязательно ополаскивайте и высушите электроды между тестами, используя промывочную бутыль с контейнером для отходов и салфетки Kimwipes.
Вылейте раствор и ополосните химический стакан в раковине между тестами. Утилизируйте раствор из стакана для отходов вместе с неопасными отходами в вытяжном шкафу.
- уксусная кислота, 0,1 М \(\ce{HC2h4O2}\)
- нитрат алюминия, 0,1 М \(\ce{Al(NO3)3}\)
- гидроксид аммония, 0,1 М \(\ce{Nh5OH}\) ( aq )
- гидроксид кальция насыщенный \(\ce{Ca(OH)2}\)
- лимонная кислота, 0,1 М \(\ce{C6H8O7}\)
- этанол, \(\ce{Ch4Ch3OH}\)
- соляная кислота, 0,1 М \(\ce{HCl}\)
- магния гидроксид насыщенный \(\ce{Mg(OH)2}\)
- сульфат магния, 0,1 М \(\ce{MgSO4}\)
- азотная кислота, 0,1 М \(\ce{HNO3}\)
- калия йодид, 0,1 М \(\ce{KI}\)
- хлорид натрия, 0,1 М \(\ce{NaCl}\)
- гидроксид натрия, 0,1 М \(\ce{NaOH}\)
- сахароза, 0,1 М \(\ce{C12h32O11}\)
Лабораторный отчет: Электропроводность водных растворов
Тестирование электропроводности – подтверждение содержания ионов в водном растворе
|
Раствор |
Наблюдения: красный светодиод | зеленый светодиод |
Проводимость |
Сильный, слабый или неэлектролитный |
Ионизированный, частично ионизированный или неионизированный |
|---|---|---|---|---|
|
пример: \(\ce{LiOH}\) ( водный раствор ), \(\ce{HNO2}\) ( водный раствор ), метанол (л) |
красный яркий, зеленый тусклый красный тусклый, зеленый выключен красный выключен, зеленый выключен |
высокий низкий нет |
сильный электролит слабый электролит неэлектролит |
ионизированный частично ионизированный неионизированный |
|
вода дистиллированная, \(\ce{h3O}\) ( л ) |
||||
|
водопроводная вода \(\ce{h3O}\) ( л ) |
||||
|
твердый хлорид натрия, \(\ce{NaCl}\) ( s ) |
||||
|
раствор хлорида натрия, \(\ce{NaCl}\) ( aq ) |
||||
|
твердый карбонат кальция, \(\ce{CaCO3}\) ( с ) |
||||
|
раствор карбоната кальция, \(\ce{CaCO3}\) ( aq ) |
||||
|
уксусная кислота, \(\ce{HC2h4O2}\) ( aq ) |
|
нитрат алюминия, \(\ce{Al(NO3)3}\) ( aq ) |
||||
|
гидроксид аммония, \(\ce{Nh5OH}\) ( aq ) |
||||
|
гидроксид кальция, \(\ce{Ca(OH)2}\) ( aq ) |
||||
|
угольная кислота, \(\ce{h3CO3}\) ( ) |
||||
|
этанол, \(\ce{Ch4Ch3OH}\) |
||||
|
соляная кислота, \(\ce{HCl}\) ( aq ) |
||||
|
гидроксид магния, \(\ce{Mg(OH)2}\) ( aq ) |
||||
|
сульфат магния, \(\ce{MgSO4}\) ( водный ) |
||||
|
азотная кислота, \(\ce{HNO3}\) ( водный ) |
||||
|
калия йодид, \(\ce{KI}\) ( aq ) |
||||
|
хлорид натрия, \(\ce{NaCl}\) ( водный ) |
||||
|
гидроксид натрия, \(\ce{NaOH}\) ( водный ) |
||||
|
сахароза, \(\ce{C12h32O11}\) ( водный раствор ) |
Вопросы
- Почему электроды кондуктометра, а также все химические стаканы необходимо промывать дистиллированной водой после каждого измерения электропроводности?
- Почему дистиллированная вода является более слабым проводником, чем водопроводная вода?
- Почему твердый хлорид натрия действует как неэлектролит, в то время как водный раствор \(\ce{NaCl}\) действует как сильный электролит?
- Классифицируйте каждое из следующего как неионизированное, частично ионизированное или ионизированное .
Запишите каждое соединение, как оно существует в водном растворе, т.е. \(\ce{NaCl (водн.) -> Na + (водн.) +Cl — (водн.)}\)
- \(\ce{HCl}\) ( водн. ) – сильная кислота
- \(\ce{Ca(OH) 2 }\) ( aq ) – сильное основание
- \(\ce{HC2H 3 O 2 }\) ( aq ) – слабая кислота
- \(\ce{Ba(OH) 2 }\) ( aq ) – слабое основание
- Для химической реакции
\[\ce{H 2 SO 4 (водн.) + 2 NaOH (водн.) -> Na 2 SO 4 (водн.) + 2 H 2 O (ж.)}\]
Напишите полное ионное уравнение:
Напишите суммарное ионное уравнение:
- Для химической реакции
\[\ce{KNO 3 (водн.) + NaCl (водн.) -> NaNO 3 (водн.) + KCl (водн.)}\]
Запишите полное ионное уравнение:
Запишите результирующее ионное уравнение уравнение:
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или Страница
- Автор
- Колледж Санта-Моники
- Лицензия
- CC BY-NC
- Показать страницу TOC
- № на стр.
-
- Теги
-
- электролит
Toyota Camry Fuse Type — Google Suce
AlledbildershoppingVideOsmapsNewsbücher
Sucoptionen
Toyota Camry Fuses & Parts — Carid.com
WWW.Carid.com — Carid.com
www.carid.com. 30 из 2954 · Предохранители и компоненты Toyota Camry · Standard® — Держатель предохранителя Intermotor™ · WVE® — Реле питания вспомогательного оборудования · WVE® — Главное реле · Denso® — Задний …
Предохранители и блоки предохранителей для Toyota Camry для продажи на eBay
www.ebay.co.uk › … › Автомобильные предохранители и блоки предохранителей
Тип предохранителя. Патронный предохранитель · Быстродействующий предохранитель · Макси-предохранитель · Мини-предохранитель · Сила тока. 0–20 А · 21–40 А · 41–60 А · 61–80 А · Тип. Предохранитель · Блок предохранителей …
0–20 А · 21–40 А · 41–60 А · 61–80 А · Тип. Предохранитель · Блок предохранителей …
Ähnliche Fragen
Как починить предохранитель в Toyota Camry?
Тип отвода предохранителя для Toyota Camry (гибрид) 2018/2019 — DashCamTalk
dashcamtalk.com › форум › темы › fuse-tap-type-…
Я нашел свой блок предохранителей, но не имея никакого представления о предохранителях, я не уверен, что я … Тип отвода предохранителей для Toyota Camry 2018/2019 (гибрид).
Руководство по замене электрических предохранителей Toyota Camry — 2012–2016 гг. Camry с фото иллюстрированными подножками.
Руководство по замене электрических предохранителей Toyota Camry — с 2018 по 2022 …
paulstravelpictures.com › 2018-2022-Toyota-Camry…
Как проверить или заменить перегоревший электрический предохранитель или неисправное реле в электрических панелях моторного отсека или салона XV70 8-го поколения …
Блок предохранителей Toyota Camry
www. japotoparts.com › … › Блок предохранителей Toyota Camry
japotoparts.com › … › Блок предохранителей Toyota Camry
45,00 € Auf Lager
Блок предохранителей Toyota Camry Год выпуска 2003 Месяцы гарантии 3 Месяца Код классификации A2 Тип двигателя Бензин Объем двигателя 2362 Единица измерения одометра …
Код двигателя: 2AZFE
Расположение: Передний левый
Предохранитель Toyota Camry 2018 года. Взаимозаменяем с
parts.toyota.com › Toyota_2018_Camry › FUSE
Предохранитель. Взаимозаменяем с
2020 Toyota Camry Предохранитель 12 Вольт — YouTube
www.youtube.com Это также покажет расположение 2 разных …
Dauer: 4:06
Прислано: 26.10.2020
2007 Toyota Camry Предохранитель прикуривателя/адаптера питания DIY — YouTube
www.youtube.com › смотреть
16.06.2020 · 20 Toyota Camry — Camry 7 Fuses — Как проверить предохранители Предохранитель адаптера питания/сигареты своими руками.

