Что такое сероводород и какова его молекулярная структура. Каковы химические и физические свойства H2S. Как образуется сероводород в природе и промышленности. Как определить полярность и гибридизацию молекулы H2S.
Структура и свойства сероводорода (H2S)
Сероводород (H2S) представляет собой бесцветный газ с характерным запахом тухлых яиц. Это токсичное и легковоспламеняющееся соединение, играющее важную роль в природе и промышленности. Давайте подробнее рассмотрим структуру и свойства молекулы H2S.
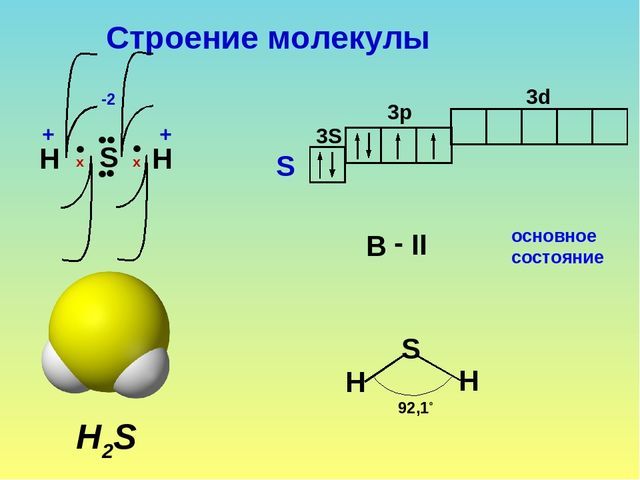
Структура Льюиса H2S
Структура Льюиса сероводорода выглядит следующим образом:
- Центральный атом — сера (S)
- Два атома водорода (H) соединены одинарными связями с серой
- На атоме серы есть две неподеленные электронные пары
Чтобы нарисовать структуру Льюиса H2S, нужно выполнить следующие шаги:
- Подсчитать общее число валентных электронов: 1 (H) × 2 + 6 (S) = 8
- Разместить атомы: S в центре, H по бокам
- Соединить атомы одинарными связями
- Распределить оставшиеся электроны в виде неподеленных пар на сере
Молекулярная геометрия H2S
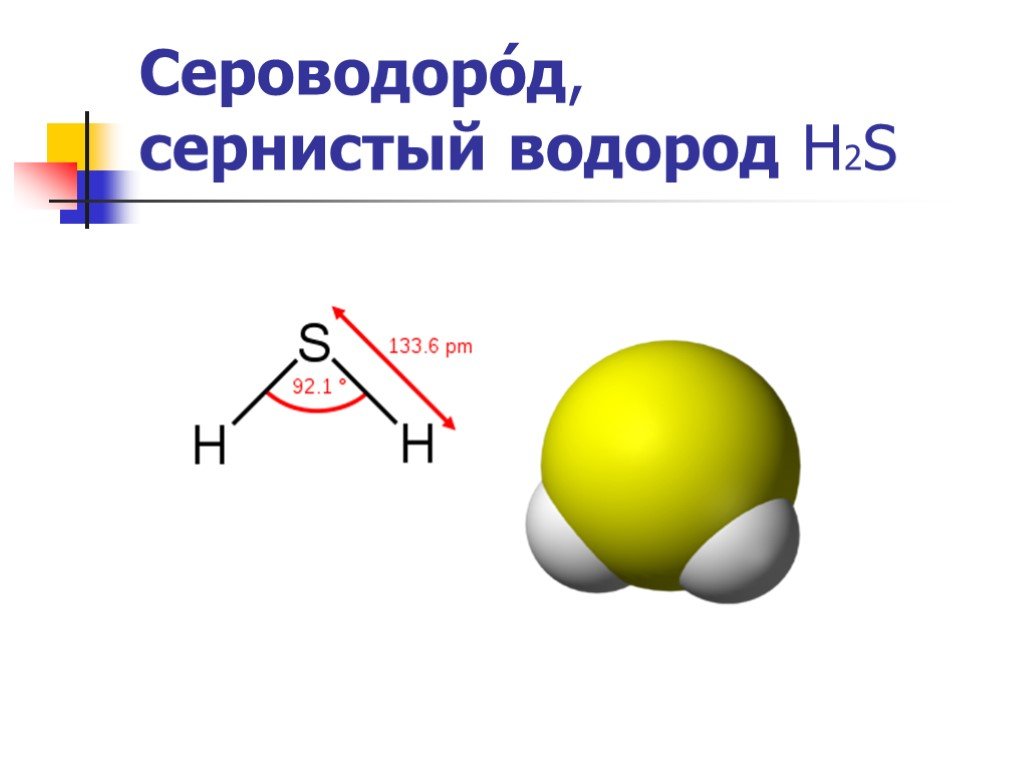
Молекула H2S имеет угловую (изогнутую) форму. Это объясняется наличием двух неподеленных электронных пар на атоме серы, которые отталкиваются друг от друга и от связывающих электронных пар.
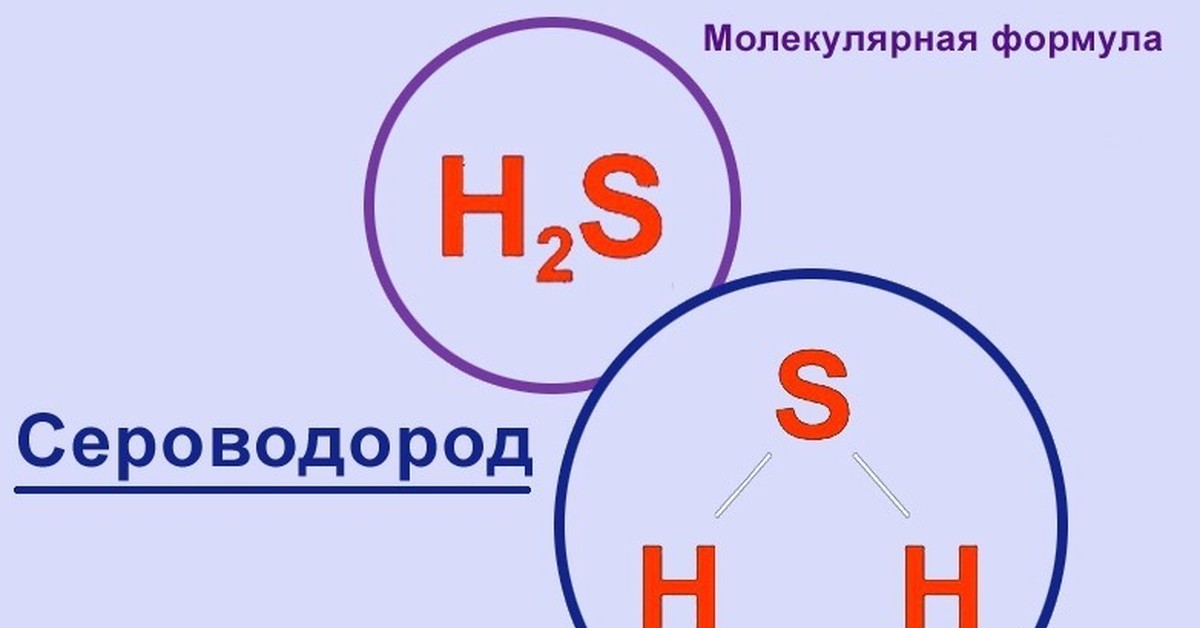
Основные характеристики геометрии H2S:
- Молекулярная геометрия: угловая (V-образная)
- Электронная геометрия: тетраэдрическая
- Валентный угол H-S-H: 92.1°
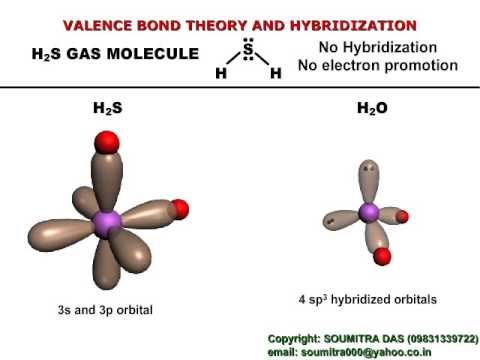
Особенности гибридизации H2S
Интересной особенностью сероводорода является отсутствие гибридизации центрального атома серы. Это объясняется правилом Драго, согласно которому гибридизация не происходит при выполнении следующих условий:
- Центральный атом находится в 3 периоде или ниже
- Есть хотя бы одна неподеленная электронная пара
- Электроотрицательность концевых атомов меньше 2.5
H2S соответствует всем этим критериям:
- Сера находится в 3 периоде
- На сере есть 2 неподеленные пары
- Электроотрицательность водорода 2.1 (меньше 2.5)
Таким образом, в молекуле H2S отсутствует гибридизация, что влияет на ее геометрию и свойства.
Полярность молекулы H2S
Является ли сероводород полярным соединением? Чтобы ответить на этот вопрос, нужно учесть несколько факторов:
- Геометрия молекулы: угловая (несимметричная)
- Электроотрицательность: S (2.5) > H (2.1)
- Дипольные моменты связей S-H не компенсируют друг друга
На основании этих данных можно сделать вывод, что H2S является полярной молекулой с ненулевым дипольным моментом. Разница электроотрицательностей S и H создает частичные заряды на атомах, а угловая геометрия приводит к тому, что векторы дипольных моментов связей не компенсируются.

Физические и химические свойства H2S
Сероводород обладает рядом характерных свойств:
- Агрегатное состояние: газ при нормальных условиях
- Цвет: бесцветный
- Запах: резкий, напоминающий тухлые яйца
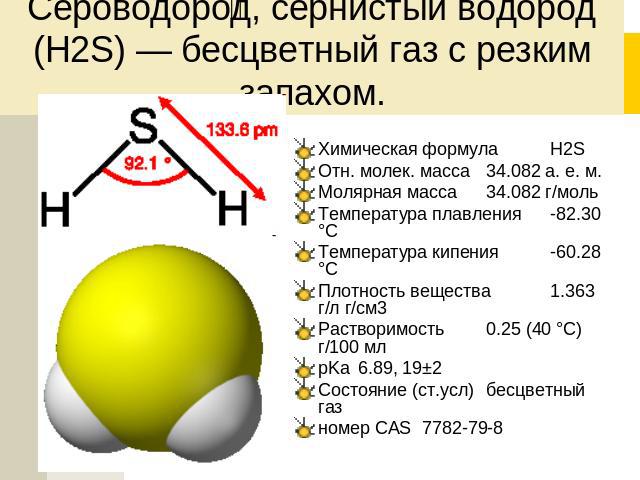
- Молярная масса: 34.08 г/моль
- Температура плавления: -85.5°C
- Температура кипения: -60.7°C
- Растворимость в воде: 0.4 г/100 мл (20°C)
- Токсичность: высокая
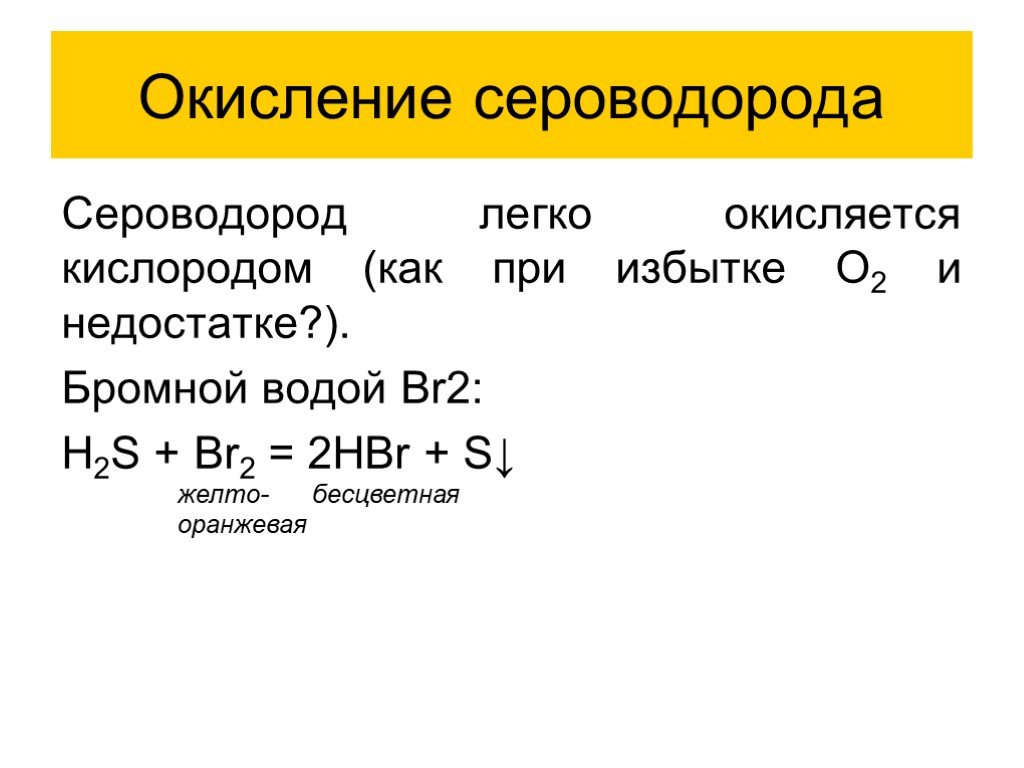
Химические свойства H2S:
- Проявляет кислотные свойства в водных растворах
- Легко окисляется, образуя серу или оксиды серы
- Реагирует с металлами, образуя сульфиды
- При горении образует SO2 и H2O
Образование и применение сероводорода
Сероводород встречается в природе и может быть получен искусственно. Основные источники и способы получения H2S:
- Природные источники:
- Вулканические газы
- Сероводородные источники
- Продукт гниения органических веществ
- Промышленное получение:
- Побочный продукт нефтепереработки
- Реакция сульфидов металлов с кислотами
- Гидролиз сульфидов щелочных металлов
Несмотря на токсичность, сероводород находит применение в различных областях:

- Производство серной кислоты и элементарной серы
- Получение сульфидов металлов
- Аналитическая химия (качественный анализ)
- Медицина (бальнеология)
Влияние сероводорода на окружающую среду и здоровье человека
Сероводород является опасным загрязнителем атмосферы и представляет серьезную угрозу для здоровья человека. Рассмотрим основные аспекты его воздействия:
Экологические последствия
- Образование кислотных дождей при окислении H2S до SO2
- Негативное влияние на растительность и водные экосистемы
- Коррозия металлических конструкций и разрушение строительных материалов
Влияние на здоровье человека
Токсическое действие сероводорода зависит от его концентрации в воздухе:
- 0.0005-0.13 ppm: порог обнаружения запаха
- 10-20 ppm: раздражение глаз и дыхательных путей
- 50-100 ppm: сильное раздражение, головная боль, тошнота
- 300-500 ppm: отек легких, угроза жизни
- >700 ppm: быстрая потеря сознания, летальный исход
Хроническое воздействие даже низких концентраций H2S может приводить к нарушениям нервной и сердечно-сосудистой систем.
Методы обнаружения и нейтрализации сероводорода
Для контроля содержания сероводорода в воздухе и промышленных выбросах применяются различные методы:
Методы обнаружения
- Органолептический метод (по запаху)
- Химические индикаторы (изменение цвета)
- Электрохимические сенсоры
- Газовая хроматография
Методы нейтрализации
Для очистки газовых выбросов от сероводорода используются:
- Абсорбция растворами щелочей или аминов
- Каталитическое окисление
- Биологическая очистка
- Мембранные технологии
Выбор метода зависит от концентрации H2S, объема выбросов и требуемой степени очистки.
Заключение
Сероводород (H2S) — это простое, но интересное химическое соединение с уникальными свойствами и структурой. Его молекулярная геометрия, отсутствие гибридизации и полярность определяют его физические и химические характеристики. Несмотря на токсичность, H2S играет важную роль в природе и промышленности. Понимание свойств и поведения сероводорода необходимо для его безопасного использования и контроля в различных сферах деятельности человека.
Аминовая очистка
Назначение
Сероводород, соединения меркаптановой серы и углекислый газ являются наиболее распространенными «загрязнителями» углеводородного сырья. Ввиду их высокого коррозионного воздействия на выполненные из углеродистой стали оборудование и трубопроводы, эти соединения должны быть удалены из сырьевого потока, если их концентрация превышает допустимую.
Удаление соединений сероводорода и углекислого газа водными растворами аминов – наиболее «популярный» метод с более чем пятидесятилетней историей.
Область применения установок аминовой очистки:
- Очистка газа от h3S, CO2 и частично от соединений меркаптановой серы
- Очистка сжиженных углеводородных газов (СУГ)
- Удаление CO2 из синтез-газа
- Очистка дымовых газов и получение СО2
Рис. 1 3D-модель установки аминовой очистки
Рис. 2 Чертеж установки аминовой очистки
Выбор типа амина
Тип и концентрация водного раствора амина – критически важные параметры для определения всего процесса очистки. Ниже приведены типичные массовые концентрации растворов аминов.
Ниже приведены типичные массовые концентрации растворов аминов.
Моноэтаноламин (МЭА): 20% для удаления CO2 и h3S, 32% для удаления преимущественно СО2.
Диэтаноламин (ДЭА): 20…25% для удаления h3S и CO2.
Метилдиэтаноламин (МДЭА): 30…55% для селективного удаления h3S в присутствии CO2, удаления h3S и CO2 при использовании активатора (пиперазин).
Дигликольамин (ДГА): 50 % для удаления h3S, CO2 и до 70% «легких» меркаптанов.
Технологическая схема
Рис. 3 Принципиальная схема установки аминовой очистки
Газ подается в нижнюю часть колонны-абсорбера (1). Поднимаясь вверх по колонне, газ контактирует с раствором амина. В качестве контактных устройств применяются либо клапанные тарелки, либо неструктурированная насадка. Выбор типа контактного устройства определяется для каждого конкретного случая в отдельности. Количество теоретических ступеней контакта для типичного абсорбера – 7. Пройдя контактную часть абсорбера, газ поступает в секцию каплеуловителя. Назначение данной секции – максимально возможное снижение величины уноса раствора амина с потоком очищенного сырья. Далее, очищенный газ отводится за пределы установки. Колонна-абсорбер стандартно оборудована датчиками температуры для отслеживания изменения температуры по высоте аппарата.
Назначение данной секции – максимально возможное снижение величины уноса раствора амина с потоком очищенного сырья. Далее, очищенный газ отводится за пределы установки. Колонна-абсорбер стандартно оборудована датчиками температуры для отслеживания изменения температуры по высоте аппарата.
Раствор амина по сигналу автоматического контроллера уровня отводится из нижней части колонны посредством автоматического клапана. При снижении давления из раствора амина выделяются фракции легкокипящих углеводородов. Разделение образовавшейся смеси происходит в сепараторе (2). Выделившийся в процессе сепарации газ отводится из верхней части аппарата в факельную систему сжигания «кислых» газов или в блок термической деструкции.
После сепарации раствор амина проходит механическую очистку в последовательно расположенных мешотчатом (3) и угольном (4) фильтрах.
Далее, очищенный от механических примесей раствор насыщенного амина поступает в теплообменник (5), где происходит нагрев за счет теплообмена с потоком регенерированного амина из ребойлера (7).
Из теплообменника (5) раствор амина подается в колонну-десорбер (6). Подвод тепла, необходимого для процесса регенерации, происходит в ребойлере (7). Источником тепла может быть как прямой подогреватель (газовая горелка, термоэлектрический нагреватель), так и косвенный (пар или горячее масло). АВО рефлюкса (8) обеспечивает частичную конденсацию паров из колонны-десорбера, формируя тем самым поток рефлюкса.
Регенерированный амин отводится из переливной секции ребойлера (7) и подается в теплообменник (5) для нагрева потока насыщенного амина, после чего подпорным насосом подается в секцию АВО амина (12).
Охлажденный регенерированный амин подается в колонну-абсорбер нагнетательным насосом (13).
Решения «ГазСёрф»
Установка аминовой очистки в США, Оклахома
Установка аминовой очистки в США, Оклахома
Previous Next
Установка аминовой очистки в США, Оклахома
Установка аминовой очистки в США, Оклахома
Previous Next
Документация на ХОББИТ-Т-h3S — Газоанализатор сероводорода
Аналитприбор / Документация / Документация ХОББИТ-Т-h3S
Цена: По запросу
Доставка: В любой регион
Доставка продукции осуществляется транспортными компаниями на Ваш выбор. Подробнее о доставке и оплате
Подробнее о доставке и оплате
Оформить заявку
Есть вопросы? Задать вопрос специалисту.
- Описание
- Цены 3
- Документация 19
ОКА, ХОББИТ-Т Переносные: Методика калибровки Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 147.5 КБ |
ХОББИТ-Т Взрывозащищенное исполнение: Руководство по эксплуатации Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: |
ХОББИТ-Т на DIN-рейку без ЦИ: Методика калибровки Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 78. |
ХОББИТ-Т на DIN-рейку без ЦИ: Руководство по эксплуатации Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 527.9 КБ |
ХОББИТ-Т на DIN-рейку с ЦИ: Габаритные чертежи Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 280.2 КБ |
ХОББИТ-Т на DIN-рейку с ЦИ: Методика калибровки Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 78.6 КБ |
ХОББИТ-Т на DIN-рейку с ЦИ: Паспорт Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 98. |
ХОББИТ-Т на DIN-рейку с ЦИ: Руководство по эксплуатации Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: |
ХОББИТ-Т на DIN-рейку с ЦИ: Схема электрическая соединений Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 268.2 КБ |
ХОББИТ-Т Переносной взрывозащищенный: Руководство по эксплуатации Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 706.5 КБ |
ХОББИТ-Т Переносной: Руководство по эксплуатации Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 687. |
ХОББИТ-Т Стационарный: Габаритные чертежи (Приложение Е к РЭ) Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 548 КБ |
ХОББИТ-Т Стационарный: Инструкция по расчету и монтажу линий связи (Приложение Д к РЭ) Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 9.4 MБ |
ХОББИТ-Т Стационарный: Инструкция по ручному управлению (Приложение Г к РЭ) Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 554.6 КБ |
ХОББИТ-Т Стационарный: Методика калибровки Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 78. |
ХОББИТ-Т Стационарный: Паспорт Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 101.3 КБ |
ХОББИТ-Т Стационарный: Руководство по эксплуатации Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 478.6 КБ |
ХОББИТ-Т Стационарный: Схема электрическая соединений Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 578.9 КБ |
ХОББИТ-Т: Методика поверки Для скачивания файла перейдите по ссылке: СКАЧАТЬ Размер файла: 4. |
Документация
Рекомендуем:
ХОББИТ-Т-CO2
Газоанализатор диоксида углерода
Макс. кол-во каналов: 16
Тип прибора: Стационарный
Сенсор: Оптический
Цифровая индикация: Да
Измерение: CO2
Взрывозащита: Да
Подробнее
ХОББИТ-Т-SO2
Газоанализатор диоксида серы
Макс. кол-во каналов: 16
Тип прибора: Стационарный
Сенсор: Электрохимический
Цифровая индикация: Да
Измерение: SO2
Взрывозащита: Да
Подробнее
ХОББИТ-Т-HF
Газоанализатор фтористого водорода
Макс. кол-во каналов: 16
Тип прибора: Стационарный
Сенсор: Электрохимический
Цифровая индикация: Да
Измерение: HF
Взрывозащита: Да
Подробнее
ХОББИТ-Т-Nh4
Газоанализатор аммиака
Макс. кол-во каналов: 16
Тип прибора: Стационарный
Сенсор: Электрохимический
Цифровая индикация: Да
Измерение: Nh4
Взрывозащита: Да
Подробнее
h3S Структура Льюиса, молекулярная геометрия, гибридизация и диаграмма МО
h3S или газообразный сероводород по своей природе бесцветен.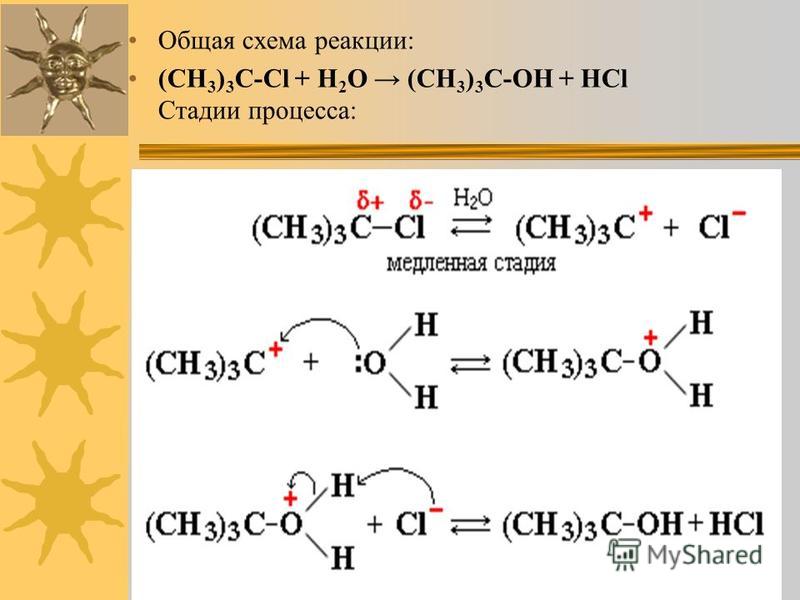 Со многими другими названиями домашних животных, такими как кислый газ, канализационный газ и т. Д., Этот газ также ядовит и вызывает коррозию.
Со многими другими названиями домашних животных, такими как кислый газ, канализационный газ и т. Д., Этот газ также ядовит и вызывает коррозию.
Я уверен, вы не ожидаете хорошего запаха от этого газа! Ну да, вы правы, сероводород пахнет тухлыми яйцами!!
Молярная масса h3S 34,08 г/моль, плотность 1,363 г дм-3. Температура плавления и температура кипения h3S составляют -82 ℃ и -60 ℃ соответственно.
h3S имеет ковалентную связь, потому что атом серы завершает свой октет, разделяя 2 электрона с 2 атомами водорода, и, таким образом, образует ковалентную связь.
Я тоже специально написал об этом, посмотрите пост о ковалентных связях h3S.
Давайте проверим эти основы с объяснением структуры Льюиса h3S.
Структура Льюиса h3S
Структура Льюиса h3S представлена ниже.
Теперь, чтобы понять это, нам нужно знать шаги, чтобы сначала нарисовать структуру Льюиса.
В первую очередь важно определить, сколько валентных электронов присутствует в соединении.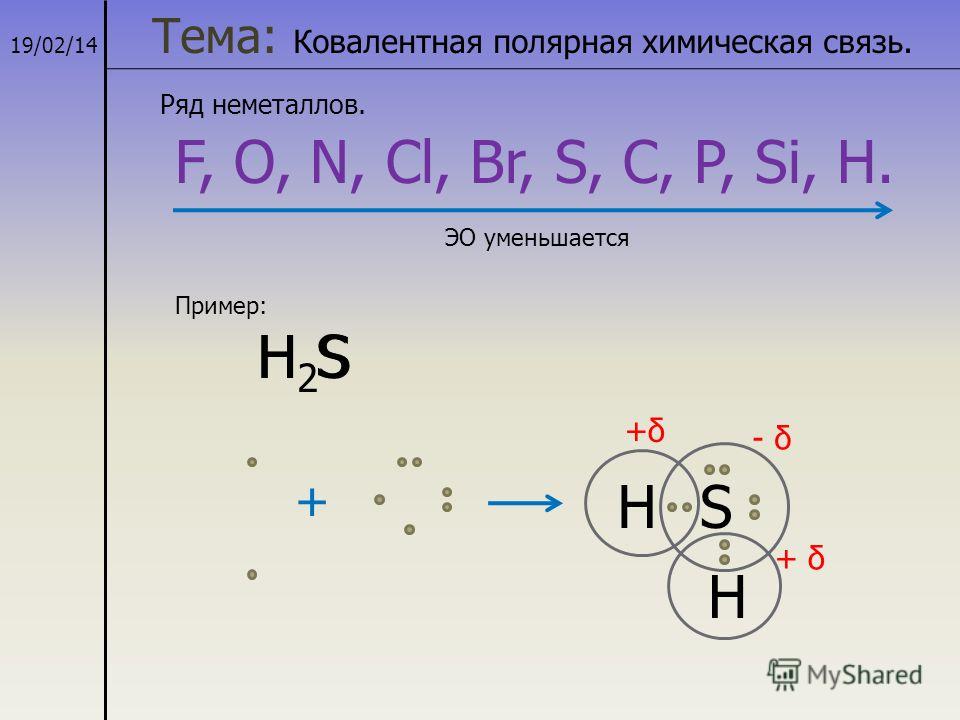
В этом соединении валентный электрон будет следующим:
валентный электрон водорода = 1
2* атом водорода = 2
валентный электрон серы = 6
Таким образом, общий валентный электрон = 2 + 6 = 8
3 90 следующая работа будет заключаться в обнаружении центрального атома.
Центральный атом — это в основном атом с наибольшим количеством мест связывания. Здесь центральным атомом будет атом серы.
После нахождения центрального атома нам нужно нарисовать скелетную структуру h3S только с одинарными связями.
Полезно знать, что структура Льюиса состоит из электронов и атомов, выполняющих свой октет. Каждый атом пытается выполнить свой октет, чтобы достичь стабильности.
В этом соединении сера имеет 6 электронов, поэтому для получения октета, то есть 8 электронов, ей нужно еще 2 электрона. Точно так же водород имеет только 1s-оболочку, и его октет может быть заполнен только 2 электронами.
Таким образом, водороду нужно всего на 1 электрон больше, чтобы обрести стабильность.
Теперь следующей задачей для рисования структуры Льюиса h3S будет заполнение оставшихся электронов (после образования одинарных связей на эскизе) вокруг атома серы.
Наконец, нам нужно проверить, что все атомы имеют наименьший возможный формальный заряд, чтобы завершить структуру Льюиса h3S.
Чтобы сделать все это обучение рисованию структуры Льюиса немного более простым, я записал шаги ниже.
Шаг 1 : Узнайте общее количество валентных электронов в молекуле. Обратите внимание на знаки +, – при расчете.
Шаг 2: Выберите центральный атом; обычно это атом с наибольшим количеством мест связывания.
Шаг 3 : Нарисуйте скелетную структуру только с одинарными связями.
Шаг 4: Заполните октет атомов оставшимися электронами. Имейте в виду, что нужно начинать с электроотрицательных атомов и переходить к электроположительным.
Шаг 5: Укажите несколько связей, если это необходимо для заполнения октета атомов.
Шаг 6: Наконец убедитесь, что все атомы имеют минимально возможный формальный заряд. Вы можете рассчитать то же самое с помощью приведенной ниже формулы
Переходя к следующей теме, давайте прольем свет на гибридизацию h3S!
Гибридизация h3S
Согласно правилу Драго, h3S не имеет гибридизации.
Правило Драго. Это правило гласит, что смешения орбиталей или, можно сказать, гибридизации не происходит, если разница энергий между атомными орбиталями атомов слишком велика.
Так что гибридизации центрального атома не будет. Существуют определенные условия для того, чтобы это правило вступило в силу, а именно:
1. Центральный атом должен находиться в 3-м периоде или ниже 3-го периода, по крайней мере, с одной неподеленной парой.
2. Окружающие атомы должны иметь электроотрицательность ниже или равную 2,5.
3. В центральном атоме не должно быть положительного заряда.
В центральном атоме не должно быть положительного заряда.
Это правило справедливо для 6 молекул, т.е. Ph4, Ash4, Sbh4, h3S, h3Se, h3Te
Безусловно, h3S соответствует всем условиям.
Центральный атом, то есть сера, находится в 3-м периоде, имеет 2 неподеленные пары и не имеет положительного заряда. Кроме того, электроотрицательность водорода равна 2,1.
Таким образом, это объясняет отсутствие гибридизации h3S.
Кроме того, добавляя к этому правилу, еще один фактор заключается в том, что вакантная орбиталь Серы и 1s-орбиталь Водорода имеют очень большую разницу в энергии.
Значит, гибридной орбитальной формации не существует. Таким образом, это еще одно объяснение, говорящее о том, что h3S не имеет гибридизации.
Геометрическая структура h3S
Молекулярная геометрия h3S изогнута.
Другим важным моментом является электронная геометрия h3S, которая является тетраэдрической. Теперь, прежде чем перейти к разнице между этими двумя, давайте посмотрим, как их найти.
Теперь, прежде чем перейти к разнице между этими двумя, давайте посмотрим, как их найти.
Итак, обе геометрии можно найти на графике VSEPR. Схема прилагается ниже!
Из этой диаграммы видно, что h3S представляет собой молекулу типа AX2E2, где X представляет окружающие атомы, а E представляет неподеленные пары центрального атома.
Таким образом, можно сказать, что молекулярная геометрия h3S искривлена.
Переходим к разнице между электронной геометрией и молекулярной геометрией.
По сути, молекулярная геометрия учитывает только атомы молекул при определении формы. В то время как электронная геометрия рассматривает все присутствующие электроны.
Более поздний вариант также учитывает неподеленную пару, что приводит к существенной разнице в форме.
Еще один момент, о котором следует помнить, это то, что отталкивание между двумя неподеленными парами в h3S также играет важную роль в формировании его изогнутой молекулярной геометрии.
Отталкивание изменяет форму пары связей с прямой на изогнутую.
Все это объясняет молекулярную геометрию h3S.
Молекулярно-орбитальная (МО) диаграмма h3S
Молекулярно-орбитальная диаграмма h3S может быть объяснена следующим образом.
Это МО-диаграмма h3S. Левая часть будет содержать атомные орбитали серы, т.е. 3s2 3px2 3py1 3pz1.
А справа будут атомные орбитали водорода.
8 валентных электронов заполнены на МО-орбиталях. Также присутствуют две несвязывающие орбитали. Антисвязывающие орбитали свободны, а связывающие орбитали заполнены.
Из МО-диаграммы h3S мы также можем узнать о порядке связи, длине связи и стабильности связи соединения.
Также следует иметь в виду, что вакантные орбитали серы и 1s водорода имеют большую разницу в энергии. Но диаграмму МО можно построить и после этого!
давайте также изучим методы приготовления h3S в подтеме ниже.
Полярность h3S
Молекула h3S считается полярной молекулой, так как молекула имеет изогнутую форму. Диполь между обеими связями H-S не компенсирует друг друга и имеет чистый дипольный момент.
Для более подробной информации прошу вас также прочитать один раз статью о полярности h3S.
Препарат h3S
Сероводород можно получить различными способами, некоторые из них:
Наиболее распространенным способом является подготовка из высокосернистого газа (любого газа с высоким содержанием сероводорода).
Сероводород можно получить обработкой водорода расплавленной элементарной серой при ~450℃.
Лабораторная подготовка – Реакция сульфида железа и сильной кислоты в генераторе Киппа.
FeS + 2HCl ——-> FeCl2 + h3S
Еще один качественный анализ, в котором тиоацетамид используется для получения h3S.
Ch4C(S)Nh3 + h3O ———> Ch4C(O)Nh3 + h3S
6 h3O + Al2S3 ——–> 3h3S +2 Al(OH)3 — еще одна реакция образования сероводорода.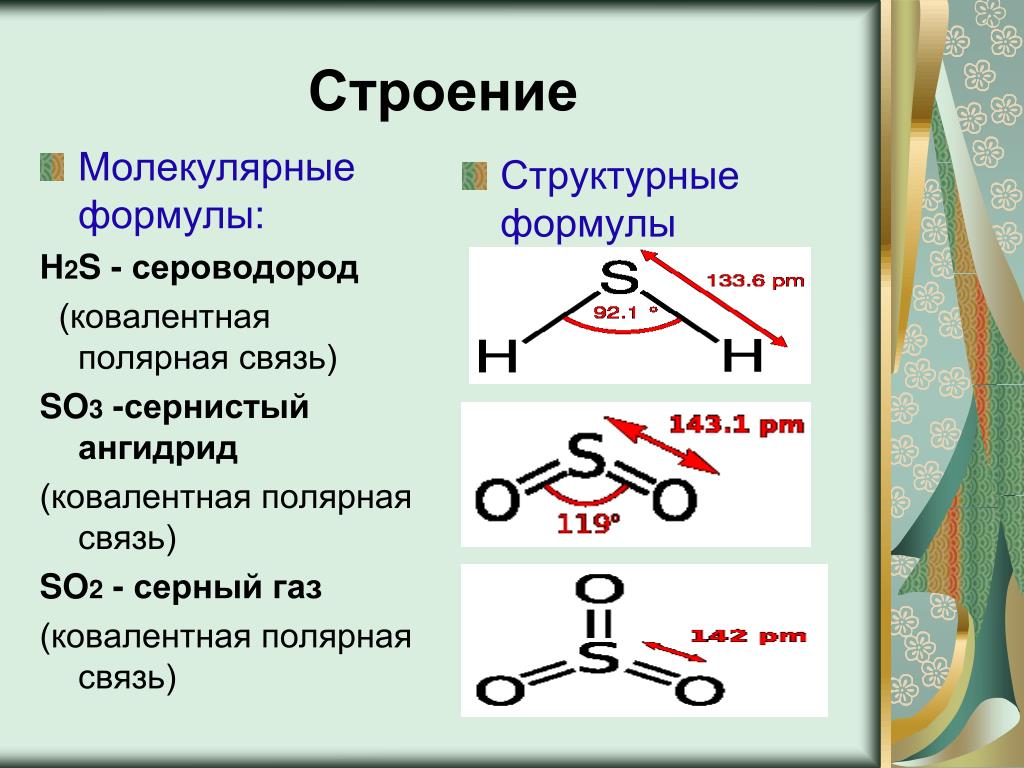
Все мы знаем, что h3S используется во многих реакциях для образования различных соединений.
Для легкого понимания этих реакций нам нужно сначала иметь представление о структуре, связывании и гибридизации сероводорода, которые объяснялись выше!
Заключение
Эта статья посвящена структуре Льюиса, гибридизации и связыванию h3S. Эти вещи очень важно знать, чтобы мы могли легко изучать уравнения, включающие h3S.
Надеюсь, после прочтения статьи вы узнали немного об этом соединении. Хотя предстоит еще многому научиться, лучше идти шаг за шагом! Ведь химия — это очень обширный предмет!
Если у вас есть какие-либо вопросы по любой теме этой статьи, не стесняйтесь спрашивать меня в любое время!
Молекулярная геометрия h3S, структура Льюиса Sh3, валентный угол, форма
Главная > Химия > Молекулярная геометрия h3S и ее структура льюиса
Сероводород представляет собой бесцветный газ с молекулярной массой 34,08 г·моль −1 . Он ядовит и легко воспламеняется с запахом тухлого газа. Это также опасно для окружающей среды.
Он ядовит и легко воспламеняется с запахом тухлого газа. Это также опасно для окружающей среды.
В этой статье мы обсудим следующие вещи: молекулярную геометрию сероводорода (h3S), электронную геометрию, структуру Льюиса, угол связи, полярность, гибридизацию и т. д.
| Название молекулы Сероводород (H 2 S) | ||||
| Bond angle | 92.1º | |||
| Molecular geometry of H 2 S | Bent or V-shaped | |||
| Electron geometry H 2 S | Тетраэдрический | |||
| Гибридизация | NIL (NOT Hybridization) | NIL (NOT Hybridization) | NIL (NO)0249 2 S | 8 |
| The formal charge of H 2 S | 0 |
Hydrogen sulfide is produced by anaerobic digestion in which microorganisms break down the organic matter в отсутствие кислорода.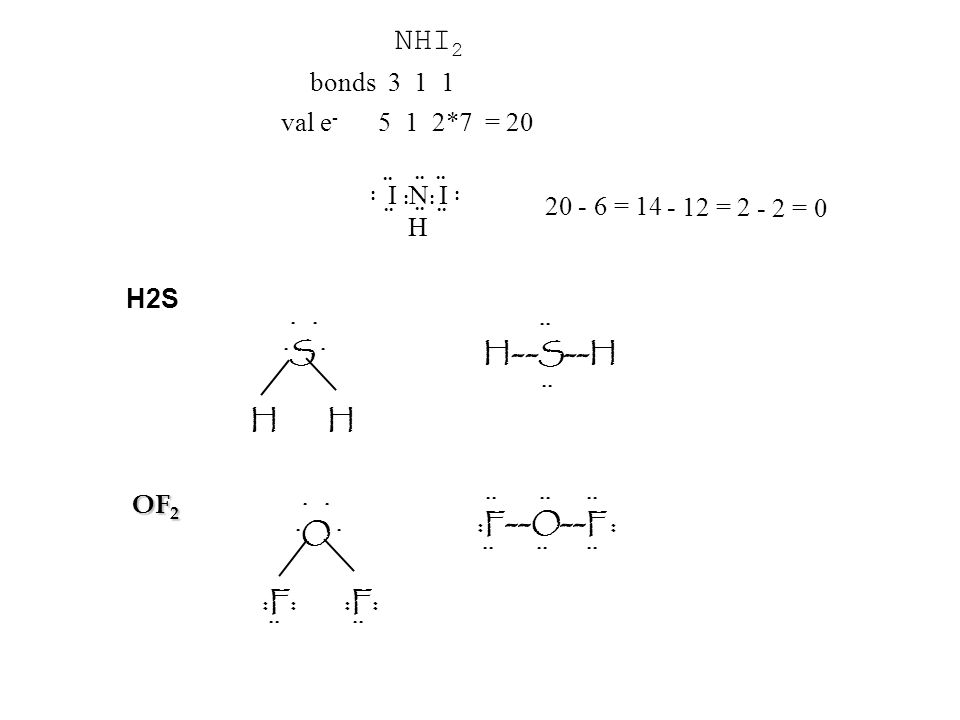 Он также встречается в вулканических газах и в колодезной воде. Его также можно получить путем выделения из кислого газа.
Он также встречается в вулканических газах и в колодезной воде. Его также можно получить путем выделения из кислого газа.
Как нарисовать структуру Льюиса h3S/Sh3 и найти ее гибридизацию?
Структура Льюиса h3S содержит два атома водорода и один атом серы. Сера является центральным атомом и содержит 2 неподеленные пары, тогда как оба водорода связаны с центральным атомом с помощью одинарной связи.
Структура Льюиса Sh3 очень полезна для определения его электронной геометрии, молекулярной формы, количества общих пар и неподеленных пар электронов.
Выполните следующие шаги, чтобы нарисовать структуру точек Льюиса для h3S
Шаг 1: На первом этапе определите общее количество валентных электронов, присутствующих в h3S. Как мы знаем, водород имеет только один валентный электрон на своей последней оболочке, а сера принадлежит к 16-й группе в периодической таблице, поэтому она содержит 6 электронов на своей последней оболочке.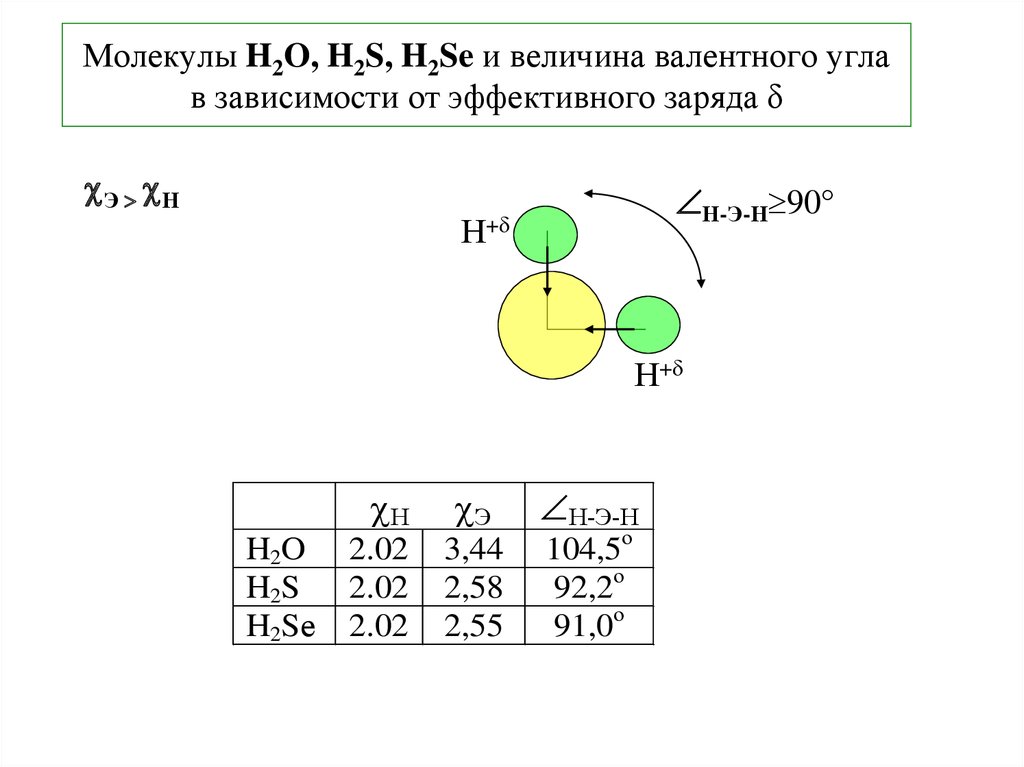
⇒ Валентный электрон водорода = 1×2 = 2
⇒ Валентный электрон серы = 6
∴ Общее количество валентных электронов, доступных для рисования структуры Льюиса h3S = 1×2 + 6 = 8 валентных электронов
2Шаг 2: Найдите центральный атом для рисования структуры точек Льюиса для h3S. Определить центральный атом в молекуле h3S можно двумя способами.
- Найдите центральный атом, найдя наименее электроотрицательный атом в молекуле h3S. Ясно, что сера имеет меньшую электроотрицательность по сравнению с водородом, потому что водород имеет более высокую склонность притягивать электроны, кроме того, водороду требуется только два электрона, чтобы заполнить свою валентную оболочку.
- Поместите в центр атом с большей валентностью. Ясно, что у Серы валентность равна 6, а у Водорода только 1. Таким образом, Сера должна располагаться в центре диаграммы Льюиса.
Шаг 3: Теперь постройте структуру h3S, соединив одинарную связь с центральным атомом.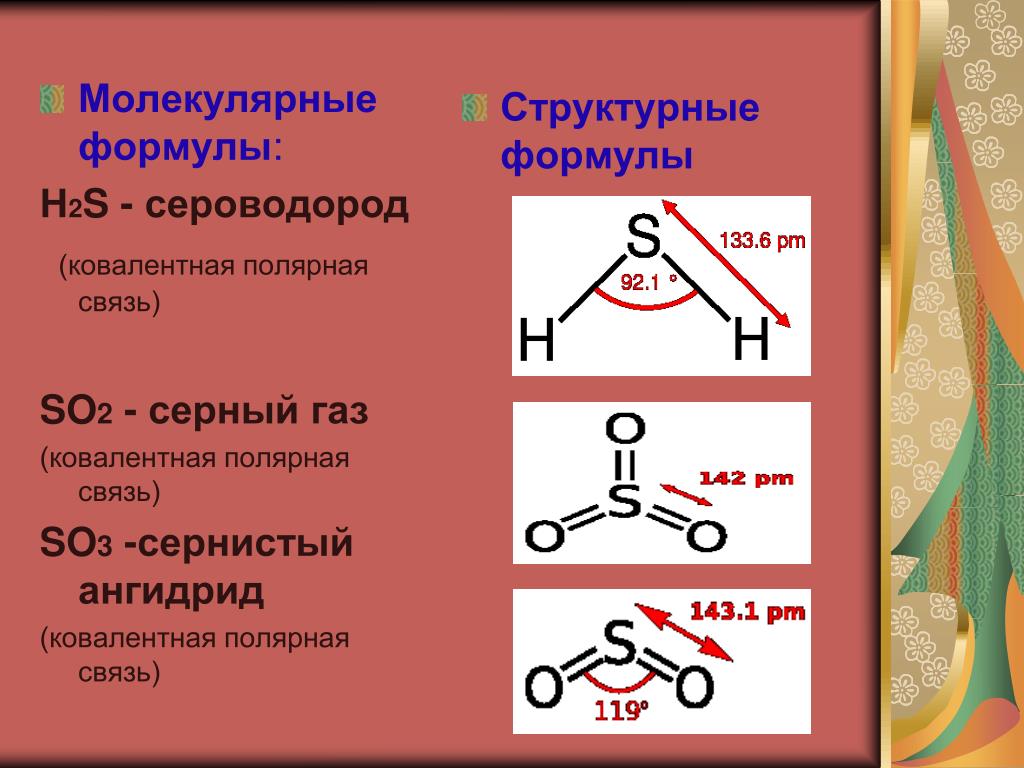
Шаг 4: После размещения центрального атома и соединения с ним одинарной связи мы должны выполнить правило октетов для каждого атома в h3S, чтобы выполнить последнее требование диаграммы Льюиса.
Атому водорода нужно только два электрона, чтобы заполнить его октет, а атому серы нужно восемь электронов, чтобы заполнить октет.
Внешняя оболочка водорода уже заполнена, потому что он разделяет два электрона уже с помощью одинарной связи. Таким образом, нет необходимости размещать электроны вокруг водорода.
Теперь для серы нам нужно 8 электронов, но только 4 электрона разделены с помощью двух одинарных связей. Таким образом, мы должны поместить еще 4 электрона вокруг серы, чтобы завершить ее правило октетов и выполнить критерии для рисования структуры точек Льюиса для Sh3.
Структура Льюиса для Sh3 или h3S
Шаг 5: Теперь, на последнем шаге, минимизируйте заряды атома h3S путем преобразования неподеленных пар в ковалентные связи.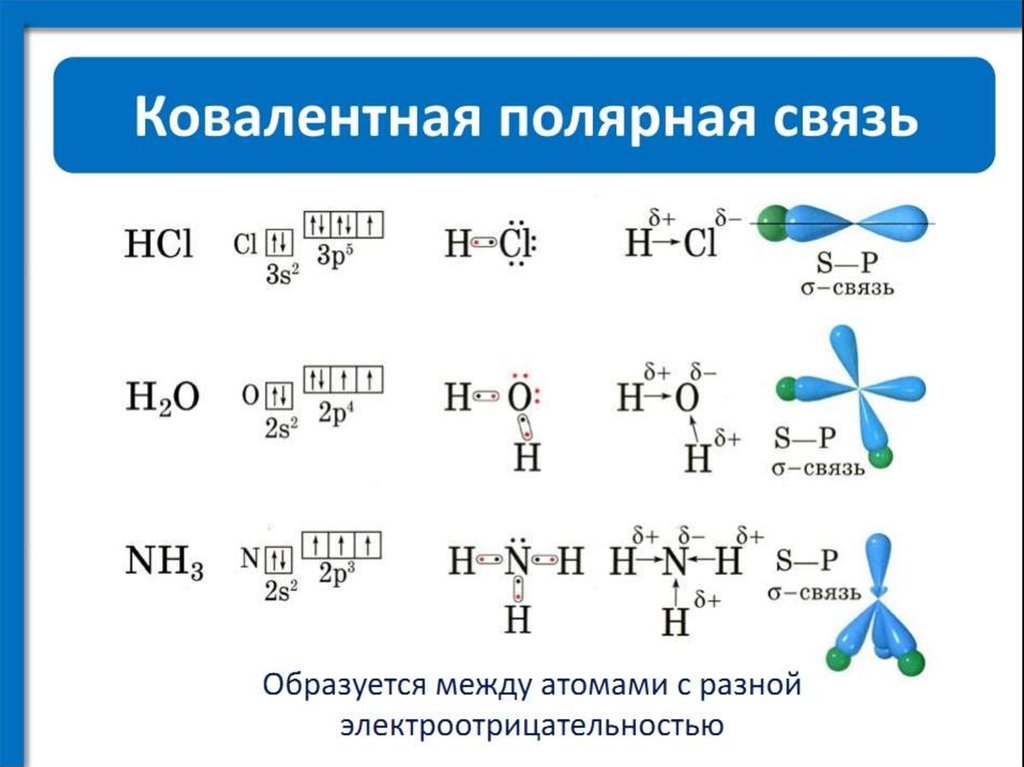
Но на атоме нет заряда (формальный заряд водорода и серы равен нулю), поэтому нет необходимости создавать ковалентную связь.
Эта структура Льюиса также называется структурой Льюиса дигидросульфида или структурой Льюиса дигидросульфида моносульфида.
Также проверьте –
- Калькулятор формального начисления
- Калькулятор структуры Льюиса
- Как нарисовать структуру Льюиса?
Гибридизация h3S
Вас может удивить тот факт, что h3S не образует никакой гибридизации. Это можно объяснить с помощью правила Драго.
Молекула, подпадающая под действие правила Драго, не имеет гибридизации и имеет наименьший валентный угол.
Согласно правилу Драго, в некоторых условиях молекула не образует гибридизации. Условия-
- Центральный атом расположен в 3-м периоде или ниже 3-го периода.
- Хотя бы одна неподеленная пара на центральном атоме.
- Электроотрицательность концевого атома меньше примерно 2,5.
Итак, в случае h3S центральный атом т.е. серы находится в 3-м периоде, у него 2 неподеленные пары. Кроме того, электроотрицательность концевых атомов (водорода) составляет 2,1, что меньше 2,5.
Следовательно, согласно правилу Драго, h3S не имеет гибридизации.
Еще одно объяснение, почему у h3S нет гибридизации –
Правило Драго гласит, что гибридизация не происходит, если разница энергий между атомными орбиталями атомов слишком велика.
«В h3S нет гибридизации. Концепция гибридизации гласит, что только орбитали с одинаковой ориентацией и меньшей разницей в энергии могут объединяться для образования гибридных орбиталей.
Поскольку вакантная орбиталь S имеет гораздо более высокую энергию по сравнению с 1s-орбиталью атома H. Следовательно, эти элементы не образуют гибридных орбиталей».
Таким образом, h3S не имеет гибридизации.
Пример: в h3S, h3Se, h3Te, Ph4, Ash4, Sbh4 и т. д. по правилу Драго гибридизация не происходит.
Какова электронная и молекулярная геометрия h3S?
Молекулярная геометрия h3S искривлена. Это связано с тем, что две неподеленные пары электронов на центральном атоме серы отталкивают друг друга, а также соседние электроны связанной пары, в результате эта электронная пара (неподеленная пара и пара связи) занимает положение, в котором отталкивание становится минимальным, и они достигают стабильность (в электронных парах не существует дополнительной силы отталкивания).
Следовательно, окончательная форма или молекулярная геометрия h3S выглядит как изогнутая структура или V-образная форма.
Согласно теории ВСЕПР, для уменьшения отталкивания. электронные пары перемещаются на максимальный угол друг относительно друга и становятся устойчивыми.
Кроме того, геометрия электронов для h3S является тетраэдрической , потому что 4 электрона, которые образуют 2 неподеленные пары вокруг атома серы, расположены в тетраэдрической геометрии.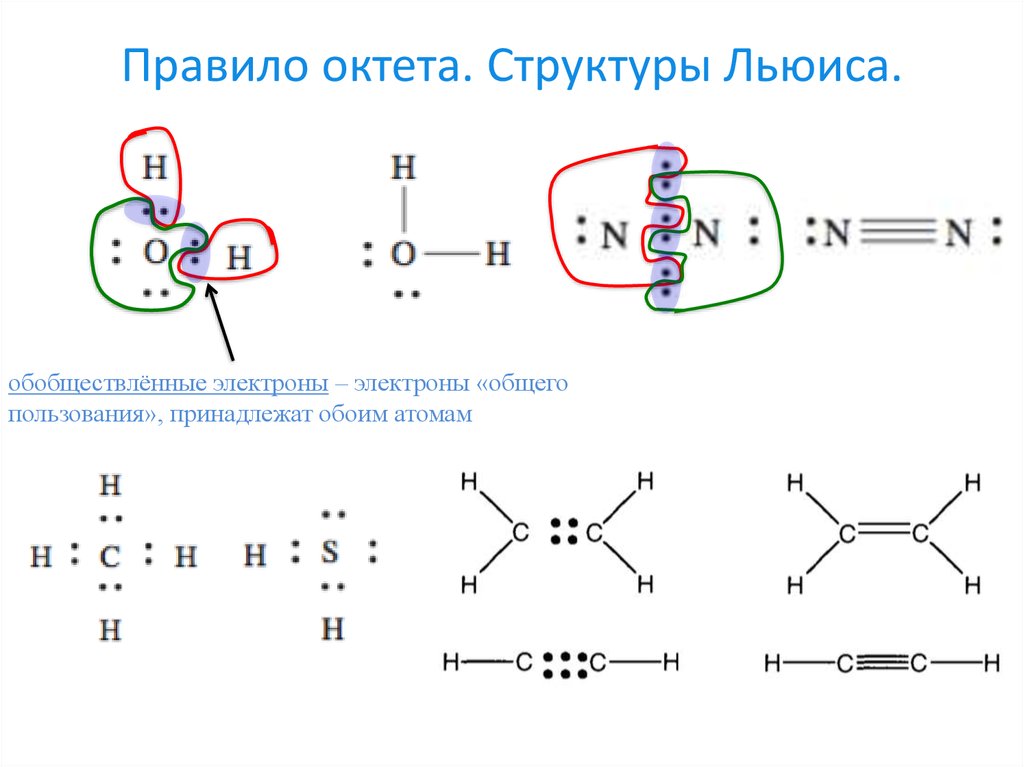
молекулярная геометрия или форма h3S
Для определения электронной и молекулярной геометрии h3S важную роль играют его структура Льюиса и теория VSEPR.
Электронная геометрия рассматривает все электроны, а также неподеленные пары для определения геометрии h3S, тогда как молекулярная геометрия рассматривает только связанные атомы молекул для определения формы h3S.
Другой способ определения электронной/молекулярной геометрии h3S
Метод AXN очень полезен для определения электронной геометрии или формы молекулы h3S. Но вы должны создать структуру Льюиса h3S для использования этого метода.
Метод AXN –
- А представляет центральный атом.
- X представляет собой связанную пару электронов.
- N представляет неподеленную пару электронов.
Согласно структуре Льюиса h3S –
- Сера является центральным атомом.
- 2 связанные пары электронов присоединены к центральному атому серы.
- 2 неподеленные пары на центральном атоме серы.
Таким образом, общая формула сероводорода AX 2 N 2 для определения молекулярной или электронной геометрии h3S.
Итак, AX 2 N 2 дает изогнутую молекулярную геометрию h3S и тетраэдрическую геометрию электрона в соответствии с диаграммой формы VSEPR.
Валентный угол h3S равен 92,1°.
Также проверьте:- Как определить валентный угол?
Является ли h3S полярным или неполярным и его дипольный момент
Хорошо, мы знаем, что полярная молекула имеет некоторый дипольный момент из-за неравного распределения зарядов, тогда как неполярная молекула имеет одинаковое распределение зарядов, что приводит к нулевому дипольному моменту, потому что они компенсируют друг друга из-за симметричной формы молекула.
Полярность h3S зависит от его молекулярной формы, электроотрицательности и дипольного момента.
Молекула h3S имеет неполярные связи , поскольку электроотрицательность связей (H-S) меньше 0,5, так как электроотрицательность водорода составляет 2,20, а электроотрицательность серы составляет 2,58, а их разница составляет 0,38.
По шкале Полинга, если разница электроотрицательностей атомов меньше 0,5, связь считается неполярной.
Но в целом молекула h3S слегка полярна , потому что она нелинейна и имеет искривленную молекулярную геометрию, а центральный атом (S) более электроотрицательный, чем (H), следовательно, отрицательный заряд развивается на атоме S и положительный заряд на атоме H.
Это индуцирует некоторый чистый дипольный момент в h3S, что делает его слегка полярной молекулой.
Чистый дипольный момент h3S равен 0,95D .
Пожалуйста, прочтите эту статью, чтобы развеять все сомнения относительно – Является ли h3S полярным или неполярным?
Также проверьте –
- Как определить полярная или неполярная молекула?
В математическом термине дипольный момент может быть выражен как
⇒ произведение зарядов двух атомов на расстояние между ними
∴ D = Q * R
⇒ D обозначает дипольный момент
⇒ Q обозначает заряд атомов
⇒ R обозначает расстояние между атомами.
Свойства сероводорода
- h3S немного плотнее воздуха.
- Химическая формула сероводорода – h3S или Sh3.
- Молекулярная масса 34,08 г·моль −1
- h3S имеет температуру кипения −60 °C и температуру плавления −82 °C.
- Имеет резкий запах, как у тухлых яиц.
- Давление пара 1740 кПа.
- h3S магнитная восприимчивость −25,5·10 −6 см 3 /моль.
- Сероводород действует как восстановитель.
- Его показатель преломления составляет 1,000644
Сероводород может быть получен при обработке сульфида железа сильной кислотой, такой как HCl, в стандартном лабораторном препарате.
⇒ FeS + 2 HCl → FeCl 2 + H 2 S
Большинство сульфидов металлов и неметаллов после воздействия воды выделяют сероводород.
⇒ 6 H 2 O + Al 2 S 3 → 3 H 2 S + 2 Al(OH) 3
h3S имеет много названий, например: моносульфид дигидрогена, канализационный газ, сероводород, кислый газ, сульфан, гидрид серы и т. д. сульфид в этой статье. Сделайте краткий обзор этого-
- Валентный угол h3S составляет 92,1°.
- h3S не имеет гибридизации, так как это соединение Драго.
- h3S в целом имеет очень слабую полярность по своей природе из-за минимальной полярности, существующей в связях H-S.
- Дипольный момент h3S равен 0,95D.
- Молекулярная геометрия h3S искривлена.
- Электронная пара вызывает отталкивание, поэтому форма h3S выглядит как изогнутая молекулярная геометрия.
- Электронная геометрия для h3S является тетраэдрической.

 6 КБ
6 КБ 7 КБ
7 КБ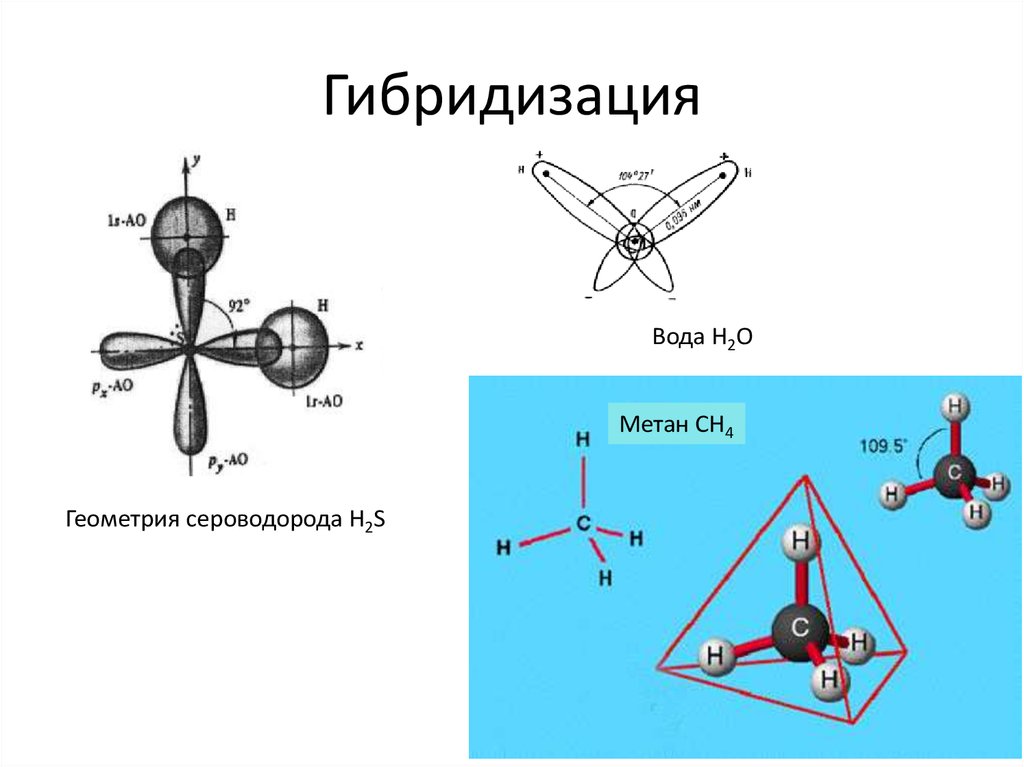 9 КБ
9 КБ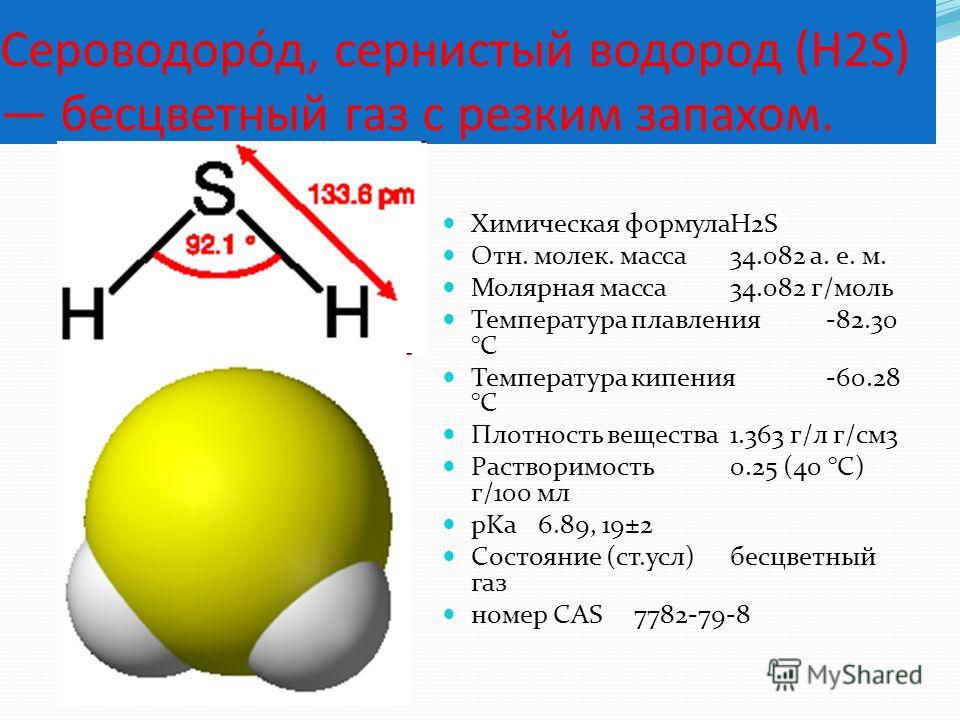 5 КБ
5 КБ 5 MБ
5 MБ