Урок 27. Состав и физические свойства воды – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.
Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.
Содержание
- Состав и строение воды
- Физические свойства воды
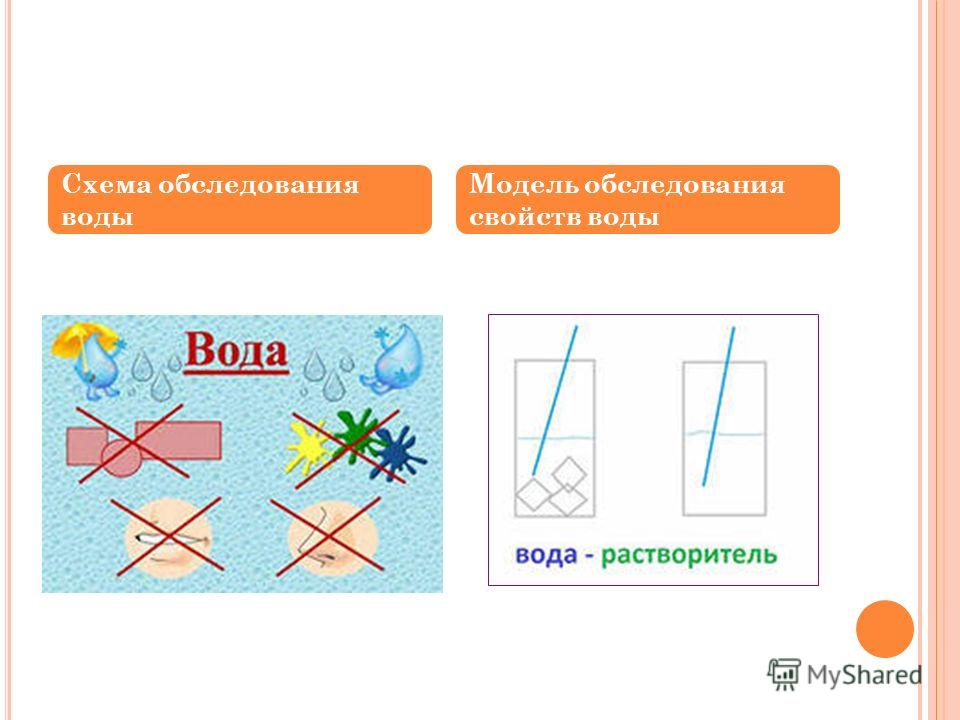
- Вода как растворитель
Состав и строение воды
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
105). Относительная молекулярная масса воды равна:
Следовательно, молярная масса воды равна:
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.
Физические свойства воды
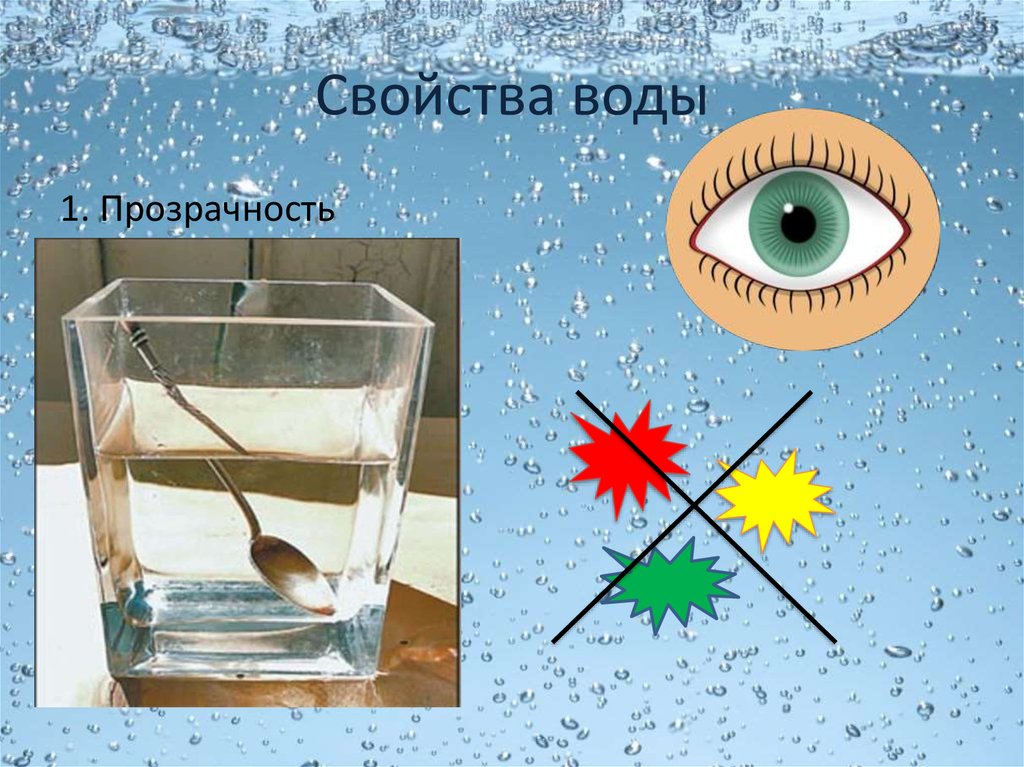
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см3, а плотность жидкой воды — примерно 1,00 г/см3. Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.
При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается. Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время. И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально. Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).
Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).
Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Если у вас возникли вопросы, пишите их в комментарии.
Урок 28. Химические свойства воды →
← Урок 26. Получение водорода и его применение
Свойства воды — презентация онлайн
СВОЙСТВА ВОДЫ
ВОДА — Н О (оксид водорода) — простейшее
2
устойчивое соединение водорода с кислородом.
Количество ВОДЫ на поверхности Земли оценивается в
1,39×1018 т.
ПРЕСНЫХ ВОД в реках, озерах, болотах и
водохранилищах составляет 2×1014 т.
Масса ледников Антарктики, Антарктиды и
высокогорных районов 2,4×1016т, примерно столько же
имеется ПОДЗЕМНЫХ ВОД, причем только небольшая
их часть — пресные.
В атмосфере находится примерно 1,3×1013 т ВОДЫ.
ВОДА входит в состав минералов и горных пород,
присутствует в почве.
ВОДА является обязательным компонентом всех живых
организмов.
ВОДА — самое распространенное вещество на
Земле. Молекулы воды обнаружены в
межзвездном пространстве.
ВОДА входит в состав комет,
большинства планет солнечной
системы и их спутников.
3/4 поверхности земного шара
покрыты водой в виде океанов,
морей, рек и озер.
ВОДА имеет очень большое значение в жизни
растений, животных и человека.
Происхождение жизни на Земле обязано ВОДЕ.
СВОЙСТВА
это совокупность
биохимических,
физических,
химических,
физико-химических,
органолептических,
и других свойств воды
ВОДЫ
Вода очень необычная по своим
физико-химическим свойствам.
Многие свойства воды аномальны.
ВОДА не имеет запаха, цвета и вкуса.
ВОДУ очень трудно окислить, сжечь или разложить
на составные части.
ВОДА — химически стойкое вещество.
ВОДА — универсальный растворитель.
Она растворяет больше солей и прочих веществ,
чем любое другое вещество.
Она окисляет почти все металлы и разрушает даже самые
твердые горные породы.
ВОДА — единственное известное нам
вещество, которое встречается в
естественных условиях на
поверхности Земли в твердом, жидком
и газообразном состояниях.
Расположение молекул
Стройными рядами
Тесновато
Простор
1. СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ.
МОЛЕКУЛА ВОДЫ СОСТОИТ ИЗ 2 АТОМОВ ВОДОРОДА
И 1 АТОМА КИСЛОРОДА, КОТОРЫЕ НАХОДЯТСЯ ДРУГ
ОТНОСИТЕЛЬНО ДРУГА ПОД УГЛОМ 104,5°
8. Молекула воды
Схема образования молекулы воды — изодного атома кислорода и двух атомов
водорода:
9. Строение молекулы воды
Самаяпростая
принятая
сегодня модель молекулы воды –
тетраэдр.
В действительности одиночных
молекул воды при нормальных
температуре и давлении не
существует.
Хотя молекула воды в целом
электронейтральна, она представляет собою все же
диполь, т.е. с одного края у нее преобладает
отрицательный заряд, а с другого — положительный.
Между собой диполи способны организовывать
соединения, когда одна молекула воды отрицательно заряженным краешком притягивает к себе
другую молекулу за ее положительный краешек.
Образуется водородная связь.
11.
 АНОМАЛИИ ВОДЫ Вода-самое аномальное соединение на земном шареПоверхностное
АНОМАЛИИ ВОДЫ Вода-самое аномальное соединение на земном шареПоверхностноенатяжение
обусловлено
силами притяжения между молекулами.
Внутри воды силы притяжения между молекулами
взаимно
компенсируются,
а
на
молекулы,
находящиеся
вблизи
поверхности,
действует
нескомпенсированная
результирующая
сила,
направленная внутрь от ее поверхности.
Поверхностное натяжение стремится уменьшить
поверхность жидкости до минимума.
Поверхностное натяжение влияет на условия
обмерзания сооружений, испарение, волнение,
влажность
снежного
покрова
и
другие
гидроледотермические явления.
Среди существующих в природе жидкостей
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ВОДЫ
уступает только ртути.
С поверхностным натяжением воды связано
ее сильное смачивающее действие (способность
«прилипать» к поверхности многих твердых тел).
Смачивание. При соприкосновении твердого тела
с водой смачивание наблюдается в том случае, когда
взаимодействие между их молекулами сильнее
взаимодействия между молекулами самой воды.

В этом случае вода будет стремиться увеличить
поверхность соприкосновения и растечется по
твердому телу.
Когда же взаимодействие между молекулами
твердого тела и молекулами воды более слабое, чем
между молекулами самой воды, вода будет
стремиться сократить поверхность соприкосновения с
твердым телом.
По отношению к твердым телам вода обладает
свойством полного и частичного смачивания и
полного несмачивания.
Явление смачивания позволяет воде подниматься
по капиллярным сосудам секвойи на высоту 115,8 м
15. Аномалия плотности
Плотность большинства веществ — жидкостей,кристаллов и газов — при нагревании уменьшается, а
при охлаждении увеличивается, вплоть до процесса
кристаллизации или конденсации.
Плотность воды при охлаждении от 100 до 4ºС
возрастает, однако, достигнув максимального
значения при температуре 4ºС, плотность при
дальнейшем
охлаждении
воды
начинает
уменьшаться.
Максимальная плотность воды (1.
 00 г·см-3)
00 г·см-3)наблюдается при температуре 4ºС, а не при
температуре замерзания 0ºС.
ПЛОТНОСТЬ ВОДЫ при переходе ее из твердого
состояния в жидкое не уменьшается, как у других
веществ, а возрастает.
Плотность льда — 916,7 кг/м³
воды — 999,8 кг/м³
В жидком состоянии при 4°С ее
плотность максимальна и больше
плотности льда.
Поэтому
лед
плавает
на
поверхности воды.
В лабораторных условиях х.ч. вода была
охлаждена в капиллярах до температуры -38ºС
При -120 °C вода она становится сверхвязкой или
тягучей, как патока, а при температуре ниже -135
°C она превращается в «стеклянную» или
«стекловидную» воду – твердое вещество, в
котором отсутствует кристаллическая структура.
Аномалия изменения объема при замерзании.
Замерзание воды происходит внезапно
скачкообразно, при этом её плотность резко
снижается более, чем на 8%, а объём также резко
возрастает примерно на 11 %.
Температура замерзания
воды с увеличением
давления понижается, а не
повышается, как это
следовало бы ожидать.
ВОДА имеет
аномально
высокие
температуры
замерзания
(0°С) и
кипения
(+100°С).
(Морская вода
замерзает при
более низкой
температуре: 1,9° при
солености 35%)
Вода плохо проводит электрический
ток, но становится хорошим
проводником,
если
в
ней
растворены
даже
небольшие
количества ионных веществ.
Теплота испарения ВОДЫ выше
теплоты испарения любых других
жидкостей, а теплота
кристаллизации уступает лишь
аммиаку.
20. Аномалия удельной теплоемкости [4,18 Дж/кг].
• Ни одно вещество в мире не поглощает и не отдаетсреде столько тепла, сколько вода. Теплоемкость
воды в 3100 раз больше воздуха, 10 раз больше
чем у стали и в 30 раз больше ртути.
• С поверхности морей, океанов, суши испаряется за
год 520000 км3 воды, которые, конденсируясь,
отдают много тепла холодным и полярным
регионам.
• Вода в организме человека составляет 70-90%. от
веса тела.
 Не обладай вода такой теплоемкостью,
Не обладай вода такой теплоемкостью,обмен веществ в теплокровных и холоднокровных
организмах был бы невозможен.
В ночное время, а также при переходе
от лета к зиме вода остывает
медленно, а днем или при переходе от
зимы к лету так же медленно
нагревается, являясь, таким образом,
РЕГУЛЯТОРОМ ТЕМПЕРАТУРЫ НА
ЗЕМНОМ ШАРЕ.
22. Легче всего вода нагревается и быстрее всего охлаждается в своеобразной «температурной яме», соответствующей +37 °С —
Легче всего вода нагревается и быстреевсего охлаждается в своеобразной
«температурной яме», соответствующей
+37 °С — температуре человеческого тела.
При отрицательных температурах
также обнаружен минимум этой
характеристики. Он приходится на
– 20°С.
Аномалия теплоты плавления.
Вода обладает высокой удельной теплотой плавления.
Теплота плавления льда равна 79,7 кал·г-1, т. е. вода и
лед при 0°С отличаются по содержанию скрытой
энергии почти на 80 калорий. Она эквивалентна расходу
количества теплоты при нагреве того же количества
воды на 80°С (от 20 до 100°С).

Воду очень трудно заморозить, а лед — растопить.
Аномалия скрытой теплоты парообразования.
Скрытая теплота парообразования очень велика — 539
кал·г-1 при температуре 100°С.
Для испарения 1 л воды, нагретого до 100°С
требуется в 6 раз больше тепла, чем для нагрева его от
20° до 100°С.
Аномалия диэлектрической постоянной.
Диэлектрическая постоянная воды при 20°С равна
81 единице, а у большинства других веществ она
находится в пределах от 2 до 3 единиц.
Следствием такой большой диэлектрической
постоянной является сильное ионизирующее
свойство воды (расщепление растворенных веществ
на ионы) и параллельная ей большая способность к
растворению различных веществ.
Способность поляризации в магнитном поле.
Аномалия коэффициента преломления света.
Коэффициент преломления света в воде 1.34.
По волновой теории света он должен быть равным 9.
25. Еще несколько удивительных свойств…
• Ни одна жидкость не поглощает газы с такойжадностью, как вода.
 Но она их также легко отдает.
Но она их также легко отдает.Дождь растворяет в себе все ядовитые газы
атмосферы. Вода — ее мощный природный фильтр,
очищающий атмосферу от всех вредных и ядовитых
газов.
Чтобы превратить 1 кг водопроводной воды в пар необходимо 2260 кДж тепла.
Для талой воды потребуется уже 2268,38 кДж. Разность в 8,38 кДж.
Водородные протоны в молекуле Н2О вращаются вокруг собственных осей и,
значит, обладают моментом количества движения или имеют спин.
Когда протоны вращаются в одну сторону, их моменты складываются, и
получается молекула пáраводы.
Если же они вращаются в разные стороны, возникает разность моментов, и
получается молекула όртоводы.
Молекулы параводы и ортоводы находятся на разных энергетических
уровнях.
Соотношение в обычной воде между ортоводой и параводой (¾ :¼)
Талая вода обладает
повышенной биологической
активностью т.к. содержит
большое количество параводы.
Долголетие горцев можно
объяснить и этим фактором
тоже.

Аномальные свойства воды вызваны
особенностями строения ее молекулы.
Все многообразие свойств воды и необычность их
проявления определяется физической природой этих
атомов, способом их объединения в молекулу и
группировкой образовавшихся молекул.
Аномальные свойства воды объясняются
существованием в ней водородных связей,
которые связывают между собой молекулы
как в жидком, так и в твердом состоянии.
Последующий материал излагается на правах
гипотезы,
ибо пока не получил полного научного
подтверждения
Особая группа свойств воды —
ПАМЯТЬ ВОДЫ
Особенности физических свойств воды и
многочисленные короткоживущие водородные связи
между соседними атомами водорода и кислорода в
молекуле воды создают благоприятные возможности
для образования особых структур-ассоциатов
(кластеров), воспринимающих, хранящих и
передающих самую различную информацию.
По мнению С.В.Зенина, вода состоит не из
отдельных молекул, а из крупных соединений,
включающих до 900 молекул — так называемых
кластеров.

Вода представляет собой иерархию
правильных объемных структур «ассоциатов»
(clathrates), в основе которых лежит
кристаллоподобный «квант воды», состоящий
из 57 ее молекул, которые взаимодействуют
друг с другом за счет свободных водородных
связей. При этом 57 молекул воды (квантов),
образуют структуру, напоминающую
тетраэдр. Тетраэдр в свою очередь состоит
из 4 додекаэдров (правильных 12гранников). 16 квантов образуют
структурный элемент, состоящий из 912
молекул воды.
Вода на 80% состоит из таких элементов, 15% — кванты-тетраэдры и 3% классические молекулы Н2О. Таким образом, структура воды связана с так
называемыми платоновыми телами (тетраэдр, додекаэдр), форма которых
связана с золотой пропорцией.
ВОДА, состоящая из множества кластеров различных
типов, образует иерархическую пространственную
жидкокристаллическую структуру, которая может
воспринимать и хранить огромные объемы информации.
Исследования показали, что чувствительность
информационной системы воды оказалась настолько
высокой, что она способна ощущать влияние не только
тех или иных внешних воздействий, но и форм
окружающих предметов, воздействия человеческих
эмоций и мыслей.
Емото Масару сфотографировал
кристаллы воды в различных
уголках земного шара.
Фотографии были опубликованы
в книге под названием
«Послание воды»
Емото Масару
Фотоаппарат Емото Масару
с вмонтированным
микроскопом
Для
получения
фотографий
микрокристаллов капельки воды помещали
в 100 чашек Петри и резко охлаждали в
морозильнике в течение 2 часов. Затем
они помещались в специальный прибор,
который состоит из холодильной камеры
и микроскопа с подключенным к нему
фотоаппаратом.
При температуре –5°С в темном поле
микроскопа под увеличением 200—500 раз
рассматривались образцы и делались
снимки наиболее характерных кристаллов.
Кристалл дистиллированной
воды, не подвергнутый
никакому воздействию
Кристалл
ключевой воды
Кристалл
антарктического льда
Кристалл воды,
прослушавший
«Пастораль» Бетховена
Вода, прослушавшая
тяжёлый рок
Вода после
приказа:
«Сделать это»
Вода получала
электромагнитные
излучения любви и
благодарности от
телевизора
Слова:
«Ты меня достал»
Слово
«Адольф Гитлер»
Вода, взятая из озера
Fujiwara, до молитвы
Кристалл той же воды
после молитвы
буддистского
первосвященника Като
Фонтан в Лувре,
Франция
Слова «Любовь и
благодарность»,
произнесенные на
английском языке
.
 . . на японском
. . на японскомязыке
. . . на немецком
языке
Слова, подобные слову «дурак»
уничтожают кластеры. Негативные
фразы и слова формируют крупные
кластеры или вообще их не создают, а
положительные, красивые слова и фразы
создают мелкие, напряженные кластеры.
Более мелкие кластеры дольше хранят
память воды.
ВОДА
– самое загадочное вещество в природе после ДНК.
Она обладает уникальными свойствами,
ещё полностью не объяснены и не все известны.
Чем дольше ее изучают, тем больше находят
новых аномалий и загадок в ней.
Большинство из этих аномалий
обеспечивают жизнь на Земле.
Нам и всему живому на Земле обязательно
необходима чистая и добрая ВОДА.
15.1: Структура воды — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53837
В своей известной поэме «Сказание о древнем мореплавателе» Сэмюэл Кольридж написал: «Вода, везде вода, ни капли для питья». Кольридж говорил о том, что он был в океане, но у него не было воды, потому что он убил альбатроса (очевидно, это принесло несчастье всем на корабле). Около \(75\%\) поверхности Земли покрыто водой. Основной составной частью человеческого тела (более \(60\%\)) является вода. Эта простая молекула играет важную роль во всех видах процессов.
Кольридж говорил о том, что он был в океане, но у него не было воды, потому что он убил альбатроса (очевидно, это принесло несчастье всем на корабле). Около \(75\%\) поверхности Земли покрыто водой. Основной составной частью человеческого тела (более \(60\%\)) является вода. Эта простая молекула играет важную роль во всех видах процессов.
Структура воды
Вода представляет собой простую молекулу, состоящую из одного атома кислорода, связанного с двумя разными атомами водорода. Из-за более высокой электроотрицательности атома кислорода связи являются полярными ковалентными ( полярные связи ). Атом кислорода притягивает общие электроны ковалентных связей в значительно большей степени, чем атомы водорода. В результате атом кислорода приобретает частичный отрицательный заряд \(\left( \delta — \right)\), а каждый атом водорода приобретает частичный положительный заряд \(\left( \delta + \right)\). Молекула принимает изогнутую структуру из-за двух неподеленных пар электронов на атоме кислорода. \text{o}\), что немного меньше идеального \(1093\) гибридная атомная орбиталь.
\text{o}\), что немного меньше идеального \(1093\) гибридная атомная орбиталь.
Изогнутая форма молекулы воды имеет решающее значение, поскольку полярные связи \(\ce{O-H}\) не компенсируют друг друга, а молекула в целом полярна. На рисунке ниже показана чистая полярность молекулы воды. Кислород — отрицательный конец молекулы, а область между атомами водорода — положительный конец молекулы.
Рисунок \(\PageIndex{2}\): Вода является полярной молекулой, так как большая электронная плотность находится вокруг более электроотрицательного атома кислорода. Полярные молекулы притягиваются друг к другу диполь-дипольными силами, так как положительный конец одной молекулы притягивается к отрицательному концу соседней молекулы. В случае воды высокополярные связи \(\ce{O-H}\) приводят к очень малой электронной плотности вокруг атомов водорода. Каждый атом водорода сильно притягивается к неподеленной паре электронов соседнего атома кислорода. Они называются водородными связями и сильнее, чем обычные диполь-дипольные силы.
Каждый атом водорода сильно притягивается к неподеленной паре электронов соседнего атома кислорода. Они называются водородными связями и сильнее, чем обычные диполь-дипольные силы.
Поскольку каждый атом кислорода имеет две неподеленные пары, он может образовывать водородные связи с атомами водорода двух отдельных других молекул. На рисунке ниже показан результат — приблизительно тетраэдрическая геометрия вокруг каждого атома кислорода, состоящая из двух ковалентных связей и двух водородных связей.
Рисунок \(\PageIndex{4}\): В результате наличия двух ковалентных связей и двух водородных связей геометрия вокруг каждого атома кислорода приблизительно тетраэдрическая.Резюме
- Вода представляет собой молекулярное соединение, состоящее из полярных молекул изогнутой формы.
- Атом кислорода приобретает частичный отрицательный заряд, а атом водорода приобретает частичный положительный заряд.

Эта страница под названием 15.1: Структура воды распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ЛИЦЕНЗИЯ ПОД
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

-
- Теги
-
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
2.11: Биохимические свойства воды
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 30616
- Сюзанна Ваким и Мандип Грюал
- Колледж Бьютт
Голубой мрамор
Его часто называют «водной планетой», и ему дали прозвище «голубой мрамор». Вы, наверное, просто называете это «домом». Почти три четверти нашей родной планеты покрыты водой, и без нее жизнь на Земле, какой мы ее знаем, не могла бы существовать. Вода, как и углерод, играет особую роль в живых существах. Он необходим всем известным формам жизни. Хотя вода состоит из простых молекул, каждая из которых содержит всего три атома, ее структура придает ей уникальные свойства, которые помогают объяснить, почему она жизненно важна для всех живых организмов.
Вода, как и углерод, играет особую роль в живых существах. Он необходим всем известным формам жизни. Хотя вода состоит из простых молекул, каждая из которых содержит всего три атома, ее структура придает ей уникальные свойства, которые помогают объяснить, почему она жизненно важна для всех живых организмов.
Химическая структура и свойства воды
Вероятно, вы уже знакомы со многими свойствами воды. Например, вы наверняка знаете, что вода без вкуса, без запаха и прозрачна. В небольших количествах он также бесцветен. Однако, когда наблюдается большое количество воды, например, в озере или океане, она на самом деле светло-голубого цвета. Голубой оттенок воды является внутренним свойством и обусловлен избирательным поглощением и рассеянием белого света. Эти и другие свойства воды зависят от ее химического строения.
Прозрачность воды важна для организмов, живущих в воде. Поскольку вода прозрачна, через нее может проходить солнечный свет. Солнечный свет необходим водным растениям и другим водным организмам для фотосинтеза.
Солнечный свет необходим водным растениям и другим водным организмам для фотосинтеза.
Химическая структура воды
Каждая молекула воды состоит из одного атома кислорода и двух атомов водорода, поэтому она имеет химическую формулу H 2 O. Расположение атомов в молекуле воды показано на рисунке \( \PageIndex{2}\), объясняет многие химические свойства воды. В каждой молекуле воды ядро атома кислорода (с 8 положительно заряженными протонами) притягивает электроны гораздо сильнее, чем ядра водорода (только с одним положительно заряженным протоном). Это приводит к отрицательному электрическому заряду вблизи атома кислорода (из-за «притяжения» отрицательно заряженных электронов к ядру кислорода) и положительному электрическому заряду вблизи атомов водорода. Разница в электрическом заряде между различными частями молекулы называется 9.0028 полярность
. Полярная молекула — это молекула, в которой часть молекулы заряжена положительно, а часть молекулы — отрицательно. Рисунок \(\PageIndex{2}\): Эта модель представляет собой атомную диаграмму воды, показывающую два атома водорода и атом кислорода в центре.
Рисунок \(\PageIndex{2}\): Эта модель представляет собой атомную диаграмму воды, показывающую два атома водорода и атом кислорода в центре.
Вода является хорошим растворителем
Вода считается очень хорошим растворителем в биохимических реакциях. На рисунке \(\PageIndex{3}\) показано, как вода растворяет соли. Поваренная соль (NaCl) состоит из положительно заряженного иона натрия и отрицательно заряженного иона хлорида. Кислород воды притягивается к положительному иону Na. Водороды воды притягиваются к отрицательному иону Cl.
Рисунок \(\PageIndex{3}\): На этой диаграмме показаны положительные и отрицательные части молекулы воды. На нем также показано, как заряд, например, иона (например, Na или Cl) может взаимодействовать с молекулой воды.Водородная связь
Противоположные электрические заряды притягиваются друг к другу. Поэтому положительная часть одной молекулы воды притягивается к отрицательным частям других молекул воды. Из-за этого притяжения между атомами водорода и кислорода соседних молекул воды образуются связи, как показано на рисунке \(\PageIndex{4}\).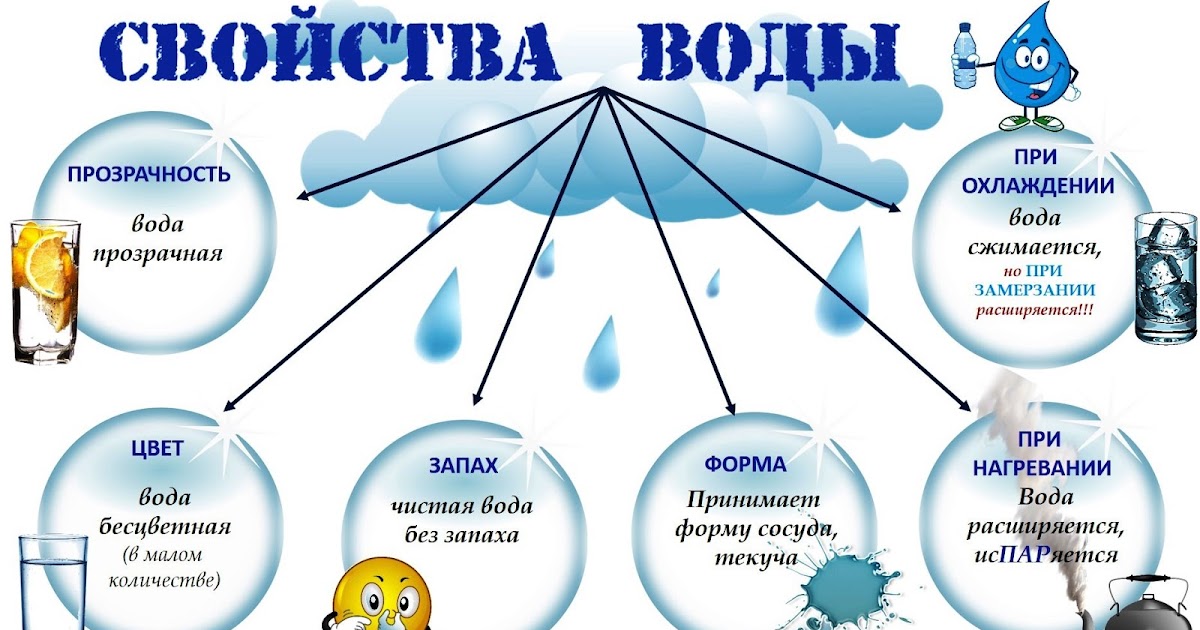 В этом типе связи всегда участвует атом водорода, поэтому он называется 9.0028 водородная связь .
В этом типе связи всегда участвует атом водорода, поэтому он называется 9.0028 водородная связь .
Водородные связи также могут образовываться внутри одной большой органической молекулы. Например, водородные связи, которые образуются между различными частями белковой молекулы, изгибают молекулу, придавая ей характерную форму, что важно для функций белка. Водородные связи также удерживают вместе две нуклеотидные цепи молекулы ДНК.
Рисунок \(\PageIndex{4}\): Водородные связи образуются между положительно и отрицательно заряженными частями молекул воды. Связи удерживают молекулы воды вместе. Как вы думаете, как это может повлиять на свойства воды?Липкая, влажная вода
Вода обладает некоторыми необычными свойствами благодаря своим водородным связям. Одним из свойств является когезия , склонность молекул воды слипаться. Силы сцепления между молекулами воды ответственны за явление, известное как поверхностное натяжение . Молекулы на поверхности не имеют других подобных молекул со всех сторон и, следовательно, они сильнее связываются с молекулами, непосредственно связанными с ними на поверхности. Например, если вы капнете небольшое количество воды на очень гладкую поверхность, молекулы воды будут слипаться и образовывать капли, а не растекаться по поверхности. То же самое происходит, когда вода медленно капает из прохудившегося крана. Вода падает из крана не в виде отдельных молекул воды, а в виде капель воды. Склонность воды слипаться в капли также иллюстрируется каплями росы на рисунке \(\PageIndex{5}\).
Молекулы на поверхности не имеют других подобных молекул со всех сторон и, следовательно, они сильнее связываются с молекулами, непосредственно связанными с ними на поверхности. Например, если вы капнете небольшое количество воды на очень гладкую поверхность, молекулы воды будут слипаться и образовывать капли, а не растекаться по поверхности. То же самое происходит, когда вода медленно капает из прохудившегося крана. Вода падает из крана не в виде отдельных молекул воды, а в виде капель воды. Склонность воды слипаться в капли также иллюстрируется каплями росы на рисунке \(\PageIndex{5}\).
Другим важным физическим свойством воды является адгезия . С точки зрения воды адгезия — это соединение молекулы воды с другим веществом, например, с боковыми сторонами жилок листа. Этот процесс происходит потому, что водородные связи уникальны тем, что они разрываются и восстанавливаются с большой частотой. Эта постоянная перегруппировка водородных связей позволяет определенному проценту всех молекул в данном образце связываться с другим веществом. Эта характеристика захвата, которую образуют молекулы воды, вызывает капиллярность способность жидкости течь против силы тяжести в узком пространстве. Примером капиллярного действия является ситуация, когда вы опускаете соломинку в стакан с водой. Кажется, что вода поднимается вверх по соломинке еще до того, как вы кладете рот на соломинку. Вода создала водородные связи с поверхностью соломинки, заставляя воду прилипать к краям соломинки. Поскольку водородные связи продолжают меняться местами на поверхности соломинки, молекулы воды меняются местами, и некоторые из них начинают подниматься по соломинке.
Эта постоянная перегруппировка водородных связей позволяет определенному проценту всех молекул в данном образце связываться с другим веществом. Эта характеристика захвата, которую образуют молекулы воды, вызывает капиллярность способность жидкости течь против силы тяжести в узком пространстве. Примером капиллярного действия является ситуация, когда вы опускаете соломинку в стакан с водой. Кажется, что вода поднимается вверх по соломинке еще до того, как вы кладете рот на соломинку. Вода создала водородные связи с поверхностью соломинки, заставляя воду прилипать к краям соломинки. Поскольку водородные связи продолжают меняться местами на поверхности соломинки, молекулы воды меняются местами, и некоторые из них начинают подниматься по соломинке.
Адгезия и капиллярное действие необходимы для выживания большинства организмов. Именно этот механизм отвечает за транспорт воды у растений через корни и стебли, а у животных — через мелкие кровеносные сосуды.
Водородные связи также объясняют, почему температура кипения воды (100°C) выше, чем температура кипения подобных веществ без водородных связей. Из-за относительно высокой температуры кипения воды большая часть воды существует на Земле в жидком состоянии. Жидкая вода необходима всем живым организмам. Следовательно, наличие жидкой воды позволяет жизни выжить на большей части планеты.
Из-за относительно высокой температуры кипения воды большая часть воды существует на Земле в жидком состоянии. Жидкая вода необходима всем живым организмам. Следовательно, наличие жидкой воды позволяет жизни выжить на большей части планеты.
Кроме того, вода имеет высокую удельную теплоемкость, поскольку для повышения или понижения температуры воды требуется много энергии. В результате вода играет очень важную роль в регулировании температуры. Поскольку клетки состоят из воды, это свойство помогает поддерживать гомеостаз.
Плотность льда и воды
Температура плавления воды равна 0°C. Ниже этой температуры вода находится в твердом состоянии (лед). В отличие от большинства химических веществ, вода в твердом состоянии имеет меньшую плотность, чем вода в жидком состоянии. Это происходит потому, что вода расширяется при замерзании. Опять же, причиной является водородная связь. Водородные связи заставляют молекулы воды менее эффективно выстраиваться во льду, чем в жидкой воде. В результате молекулы воды во льду разнесены дальше друг от друга, что придает льду меньшую плотность, чем жидкая вода. Вещество с меньшей плотностью плавает на веществе с большей плотностью. Это объясняет, почему лед плавает в жидкой воде, тогда как многие другие твердые тела опускаются на дно жидкой воды.
В результате молекулы воды во льду разнесены дальше друг от друга, что придает льду меньшую плотность, чем жидкая вода. Вещество с меньшей плотностью плавает на веществе с большей плотностью. Это объясняет, почему лед плавает в жидкой воде, тогда как многие другие твердые тела опускаются на дно жидкой воды.
В большом водоеме, таком как озеро или океан, вода с наибольшей плотностью всегда опускается на дно. Вода наиболее плотная при температуре около 4°С. В результате вода на дне озера или океана обычно имеет температуру около 4°С. В климате с холодными зимами этот слой воды температурой 4°C изолирует дно озера от отрицательных температур. Озерные организмы, такие как рыбы, могут пережить зиму, оставаясь в этой холодной, но незамерзшей воде на дне озера.
Обзор
- Опишите строение молекулы воды. Что такое полярность и почему вода полярна?
- Объясните, как внутренняя полярность молекулы воды делает ее хорошим растворителем?
- Объясните, как водородные связи заставляют молекулы жидкой воды слипаться.

- Что такое капиллярное действие? Привести пример.
- Какое свойство воды помогает поддерживать гомеостаз и как?
Принадлежности
- Water Planet от НАСА/Роберта Симмона и Марит Джентофт-Нильсен, общественное достояние через Wikimedia Commons
- Water by Lumen Learning, лицензия CC BY 2.0
- Растворяющаяся соль Чарльза Молнара и Джейн Гейр, лицензия CC BY 4.0
- Водородное связывание от Lumen Learning с лицензией CC BY 2.0
- Капли воды Службы охраны рыбных ресурсов и дикой природы США, общественное достояние на Викискладе .
- Текст адаптирован из книги «Биология человека» по лицензии CK-12, лицензия CC BY-NC 3.0
Эта страница под названием 2.11: Биохимические свойства воды распространяется под лицензией CK-12 и была создана, изменена и/или курирована Сюзанной Ваким и Мандипом Грюалом через исходный контент, отредактированный в соответствии со стилем и стандартами платформы LibreTexts.

