Что такое электролиз расплавов и растворов. Какие процессы происходят на катоде и аноде при электролизе. Как проводится электролиз различных веществ. Где применяется электролиз в промышленности и технике.
Что такое электролиз и как он происходит
Электролиз — это процесс разложения вещества под действием постоянного электрического тока. При электролизе происходят окислительно-восстановительные реакции на электродах, погруженных в расплав или раствор электролита.
Основные компоненты электролиза:
- Электролит — вещество, проводящее электрический ток вследствие диссоциации на ионы (расплав или раствор)
- Катод — отрицательный электрод, на котором происходит процесс восстановления
- Анод — положительный электрод, на котором происходит процесс окисления
- Источник постоянного тока
Под действием электрического поля положительно заряженные ионы (катионы) движутся к катоду, а отрицательно заряженные (анионы) — к аноду. На электродах происходят электрохимические реакции.
Особенности электролиза расплавов
При электролизе расплавов солей, оснований или оксидов происходит разложение только самого электролита, так как вода отсутствует. Основные особенности:
- На катоде всегда восстанавливаются катионы металлов до свободных атомов: Men+ + ne— = Me0
- На аноде окисляются анионы кислотных остатков или гидроксид-ионы
- Продукты электролиза — чистые вещества (металлы, неметаллы, газы)
Например, при электролизе расплава хлорида натрия NaCl происходят следующие процессы:
Катод: Na+ + e— = Na0
Анод: 2Cl— — 2e— = Cl2
Суммарное уравнение: 2NaCl = 2Na + Cl2
Особенности электролиза водных растворов
При электролизе водных растворов в реакциях участвуют не только ионы электролита, но и молекулы воды. Поэтому процессы на электродах зависят от активности веществ.
Процессы на катоде при электролизе растворов:
- Если металл, образующий катион, находится в ряду напряжений до Al включительно — восстанавливается вода: 2H2O + 2e— = H2 + 2OH—
- Если металл между Al и H — восстанавливаются и катионы металла, и вода
- Если металл после водорода — восстанавливаются только катионы металла: Men+ + ne— = Me0
Процессы на аноде при электролизе растворов:
- Если анион бескислородный (кроме F—) — окисляется анион: 2Cl— — 2e— = Cl2
- Если анион кислородсодержащий или F— — окисляется вода: 2H2O — 4e— = O2 + 4H+
Примеры электролиза различных веществ
Электролиз расплава гидроксида калия KOH
Катод: K+ + e— = K0
Анод: 4OH— — 4e— = O2 + 2H2O

Суммарно: 4KOH = 4K + O2 + 2H2O
Электролиз раствора сульфата меди(II) CuSO4
Катод: Cu2+ + 2e— = Cu0
Анод: 2H2O — 4e— = O2 + 4H+
Суммарно: 2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
Применение электролиза в промышленности
Электролиз широко используется в различных отраслях промышленности и техники:
- Получение активных металлов (алюминий, магний, натрий и др.)
- Очистка металлов от примесей (рафинирование меди)
- Получение водорода и кислорода
- Гальваническое покрытие изделий металлами
- Электрохимическая обработка металлов
- Электросинтез химических веществ
Таким образом, электролиз является важнейшим электрохимическим процессом, имеющим огромное практическое значение в современных технологиях.
Электролиз как окислительно-восстановительный процесс
С точки зрения химии электролиз представляет собой совокупность окислительно-восстановительных реакций, протекающих на электродах под действием электрического тока. Рассмотрим, какие процессы происходят в ходе электролиза:На катоде — процесс восстановления:
- Катионы металлов или водорода принимают электроны и восстанавливаются
- Степень окисления элементов понижается
На аноде — процесс окисления:
- Анионы кислотных остатков или гидроксид-ионы отдают электроны и окисляются
- Степень окисления элементов повышается
При этом катод является восстановителем, а анод — окислителем. Электроны движутся от анода к катоду по внешней цепи.

Как составлять уравнения электролиза
Для правильного составления уравнений электролиза необходимо придерживаться следующего алгоритма:
- Записать уравнение диссоциации электролита на ионы
- Определить, какие процессы будут протекать на катоде и аноде
- Записать отдельно катодный и анодный процессы
- Уравнять число электронов в катодном и анодном процессах
- Сложить уравнения катодного и анодного процессов
- Сократить подобные члены и получить суммарное уравнение электролиза
Использование этого алгоритма позволяет корректно описать любой процесс электролиза.
Факторы, влияющие на электролиз
На протекание процесса электролиза и его результаты влияют следующие факторы:
- Природа электролита (состав, концентрация)
- Материал электродов
- Плотность тока
- Температура
- pH среды
- Наличие примесей в электролите
Изменяя эти параметры, можно управлять процессом электролиза и получать требуемые продукты с заданными характеристиками.
Законы Фарадея для электролиза
Количественные закономерности электролиза описываются законами Фарадея:

Первый закон Фарадея:
Масса вещества, выделившегося на электроде, прямо пропорциональна количеству прошедшего через раствор электричества.
Второй закон Фарадея:
При прохождении через различные электролиты одинакового количества электричества массы выделившихся веществ пропорциональны их химическим эквивалентам.
Эти законы позволяют рассчитывать количество продуктов электролиза и необходимое для процесса количество электричества.
Электролиз расплавов и растворов (солей, щелочей, кислот).
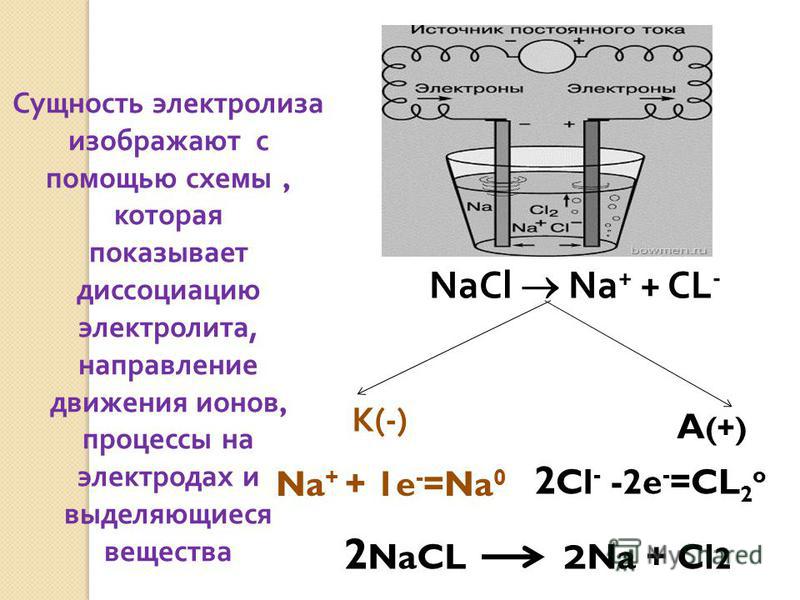
Что такое электролиз? Для более простого понимания ответа на этот вопрос давайте представим себе любой источник постоянного тока. У каждого источника постоянного тока всегда можно найти положительный и отрицательный полюс:
Подсоединим к нему две химически стойких электропроводящих пластины, которые назовем электродами. Пластину, присоединенную к положительному полюсу назовем анодом, а к отрицательному катодом:
Далее, представьте, что у вас есть возможность опустить эти два электрода в расплав хлорида натрия:
Хлорид натрия является электролитом, при его расплавлении происходит диссоциация на катионы натрия и хлорид-ионы:
NaCl = Na+ + Cl−
Очевидно, что заряженные отрицательно анионы хлора направятся к положительно заряженному электроду – аноду, а положительно заряженные катионы Na+ направятся к отрицательно заряженному электроду – катоду.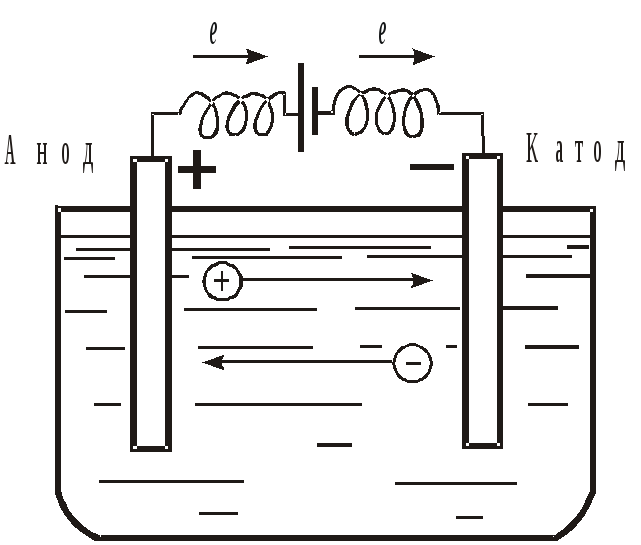 В результате этого и катионы Na+ и анионы Cl− разрядятся, то есть станут нейтральными атомами. Разрядка происходит посредством приобретения электронов в случае ионов Na+ и потери электронов в случае ионов Cl−. То есть на катоде протекает процесс:
В результате этого и катионы Na+ и анионы Cl− разрядятся, то есть станут нейтральными атомами. Разрядка происходит посредством приобретения электронов в случае ионов Na+ и потери электронов в случае ионов Cl−. То есть на катоде протекает процесс:
Na+ + 1e− = Na0,
А на аноде:
Cl− − 1e− = Cl
Поскольку каждый атом хлора имеет по неспаренному электрону, одиночное существование их невыгодно и атомы хлора объединяются в молекулу из двух атомов хлора:
Сl∙ + ∙Cl = Cl2
Таким образом, суммарно, процесс, протекающий на аноде, правильнее записать так:
2Cl− − 2e− = Cl2
То есть мы имеем:
Катод: Na+ + 1e− = Na0
Анод: 2Cl− − 2e− = Cl2
Подведем электронный баланс:
Na+ + 1e− = Na0 |∙2
2Cl− − 2e− = Cl2 |∙1<
Сложим левые и правые части обоих уравнений полуреакций, получим:
2Na+ + 2e− + 2Cl− − 2e−= 2Na0 + Cl2
Сократим два электрона аналогично тому, как это делается в алгебре получим ионное уравнение электролиза:
2Na++ 2Cl− = 2Na0 + Cl2
далее, объединив ионы Na+ и Cl− получим, уравнение электролиза расплава хлорида натрия:
2NaCl(ж.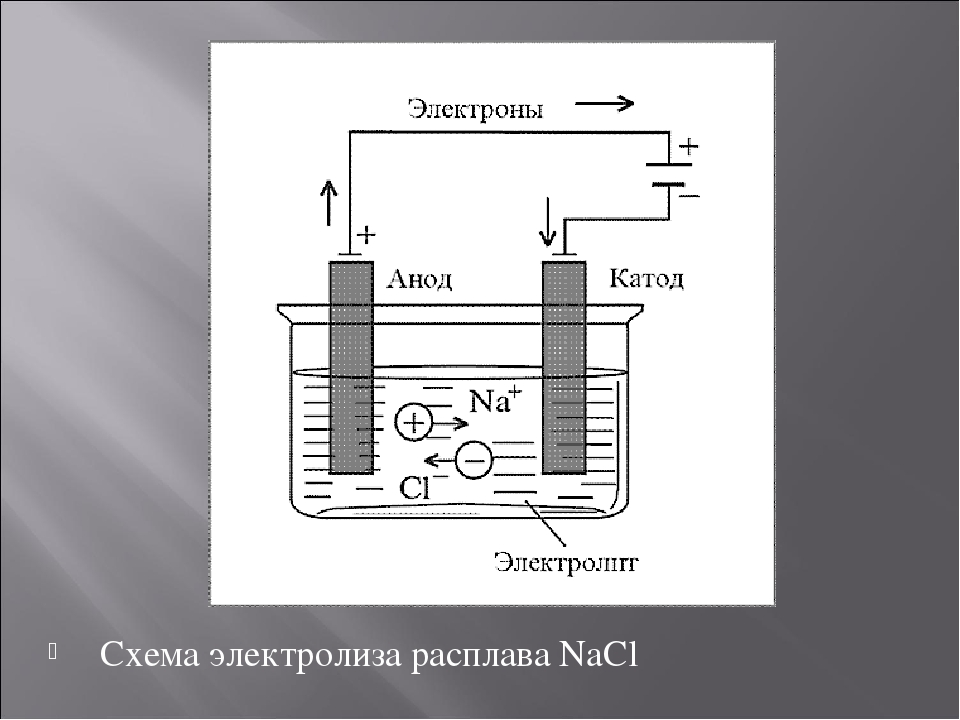 ) => 2Na + Cl2
) => 2Na + Cl2
Рассмотренный выше случай является с теоретической точки зрения наиболее простым, поскольку в расплаве хлорида натрия из положительно заряженных ионов были только ионы натрия, а из отрицательных – только анионы хлора.
Другими словами, ни у катионов Na+, ни у анионов Cl− не было «конкурентов» за катод и анод.
А, что будет, например, если вместо расплава хлорида натрия ток пропустить через его водный раствор? Диссоциация хлорида натрия наблюдается и в этом случае, но становится невозможным образование металлического натрия в водном растворе. Ведь мы знаем, что натрий – представитель щелочных металлов – крайне активный металл, реагирующий с водой очень бурно. Если натрий не способен восстановиться в таких условиях, что же тогда будет восстанавливаться на катоде?
Давайте вспомним строение молекулы воды. Она представляет собой диполь, то есть у нее есть отрицательный и положительный полюсы:
Именно благодаря этому свойству, она способна «облеплять» как поверхность катода, так и поверхность анода:
При этом могут происходить процессы:
Катод:
2H2O + 2e− = 2OH− + H2
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом, получается, что если мы рассмотрим раствор любого электролита, то мы увидим, что катионы и анионы, образующиеся при диссоциации электролита, конкурируют с молекулами воды за восстановление на катоде и окисление на аноде.
Так какие же процессы будут происходить на катоде и на аноде? Разрядка ионов, образовавшихся при диссоциации электролита или окисление/восстановление молекул воды? Или, возможно, будут происходить все указанные процессы одновременно?
В зависимости от типа электролита при электролизе его водного раствора возможны самые разные ситуации. Например, катионы щелочных, щелочноземельных металлов, алюминия и магния просто не способны восстановиться в водной среде, так как при их восстановлении должны были бы получаться соответственно щелочные, щелочноземельные металлы, алюминий или магний т.е. металлы, реагирующие с водой.
В таком случае является возможным только восстановление молекул воды на катоде.
Запомнить то, какой процесс будет протекать на катоде при электролизе раствора какого-либо электролита можно, следуя следующим принципам:
1) Если электролит состоит из катиона металла, который в свободном состоянии в обычных условиях реагирует с водой, на катоде идет процесс:
2H2O + 2e− = 2OH− + H2
Это касается металлов, находящихся в начале ряда активности по Al включительно.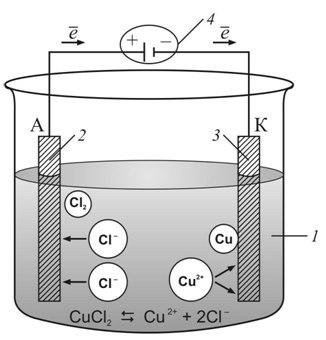
2) Если электролит состоит из катиона металла, который в свободном виде не реагирует с водой, но реагирует с кислотами неокислителями, идут сразу два процесса, как восстановления катионов металла, так и молекул воды:
2H2O + 2e− = 2OH− + H2
Men+ + ne = Me0
К таким металлам относятся металлы, находящиеся между Al и Н в ряду активности.
3) Если электролит состоит из катионов водорода (кислота) или катионов металлов, не реагирующих с кислотами неокислителями — восстанавливаются только катионы электролита:
2Н+ + 2е− = Н2 – в случае кислоты
Men+ + ne = Me0 – в случае соли
На аноде тем временем ситуация следующая:
1) Если электролит содержит анионы бескислородных кислотных остатков (кроме F−), то на аноде идет процесс их окисления, молекулы воды не окисляются. Например:
2Сl− − 2e = Cl2
S2- − 2e = So
Фторид-ионы не окисляются на аноде поскольку фтор не способен образоваться в водном растворе (реагирует с водой)
2) Если в состав электролита входят гидроксид-ионы (щелочи) они окисляются вместо молекул воды:
4ОН− − 4е− = 2H2O + O2
3) В случае того, если электролит содержит кислородсодержащий кислотный остаток (кроме остатков органических кислот) или фторид-ион (F−) на аноде идет процесс окисления молекул воды:
2H2O – 4e− = O2 + 4H+
4) В случае кислотного остатка карбоновой кислоты на аноде идет процесс:
2RCOO− − 2e− = R-R + 2CO2
Давайте потренируемся записывать уравнения электролиза для различных ситуаций:
Пример №1
Напишите уравнения процессов протекающих на катоде и аноде при электролизе расплава хлорида цинка, а также общее уравнение электролиза.
Решение
При расплавлении хлорида цинка происходит его диссоциация:
ZnCl2 = Zn2+ + 2Cl−
Далее следует обратить внимание на то, что электролизу подвергается именно расплав хлорида цинка, а не водный раствор. Другими словами, без вариантов, на катоде может происходить только восстановление катионов цинка, а на аноде окисление хлорид-ионов т.к. отсутствуют молекулы воды:
Катод: Zn2+ + 2e− = Zn0 |∙1
Анод: 2Cl− − 2e− = Cl2 |∙1
ZnCl2 = Zn + Cl2
Пример №2
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора хлорида цинка, а также общее уравнение электролиза.
Так как в данном случае, электролизу подвергается водный раствор, то в электролизе, теоретически, могут принимать участие молекулы воды. Так как цинк расположен в ряду активности между Al и Н то это значит, что на катоде будет происходить как восстановление катионов цинка, так и молекул воды.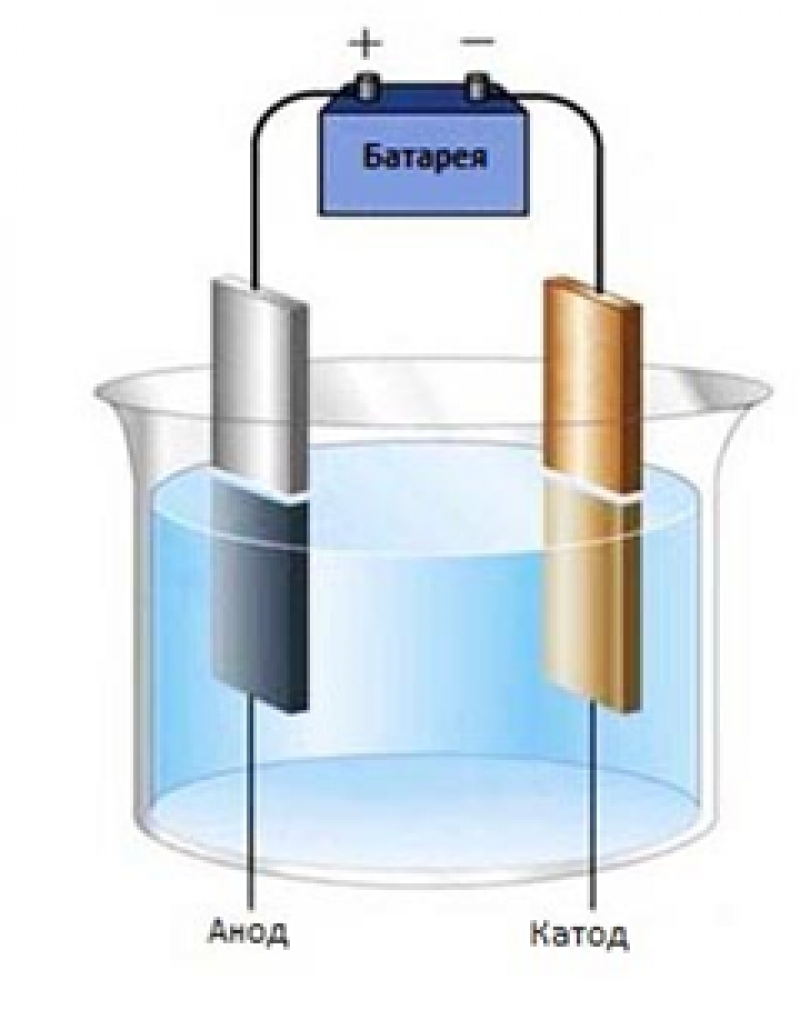
Катод:
2H2O + 2e− = 2OH− + H2
Zn2+ + 2e− = Zn0
Хлорид-ион является кислотным остатком бескислородной кислоты HCl, поэтому в конкуренции за окисление на аноде хлорид-ионы «выигрывают» у молекул воды:
Анод:
2Cl− − 2e− = Cl2
В данном конкретном случае нельзя записать суммарное уравнение электролиза, поскольку неизвестно соотношение между выделяющимися на катоде водородом и цинком.
Пример №3
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора нитрата меди, а также общее уравнение электролиза.
Нитрат меди в растворе находится в продиссоциированном состоянии:
Cu(NO3)2 = Cu2+ + 2NO3−
Медь находится в ряду активности правее водорода, то есть на катоде восстанавливаться будут катионы меди:
Катод:
Cu2+ + 2e− = Cu0
Нитрат-ион NO3− — кислородсодержащий кислотный остаток, это значит, что в окислении на аноде нитрат ионы «проигрывают» в конкуренции молекулам воды:
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом:
Катод: Cu2+ + 2e− = Cu0 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+
Полученное в результате сложения уравнение является ионным уравнением электролиза. Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
2Cu(NO3)2 + 2H2O = 2Cu0 + O2 + 4HNO3
Пример №4
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора ацетата калия, а также общее уравнение электролиза.
Решение:
Ацетат калия в водном растворе диссоциирует на катионы калия и ацетат-ионы:
СН3СООК = СН3СОО− + К+
Калий является щелочным металлом, т.е. находится в ряду электрохимическом ряду напряжений в самом начале. Это значит, что его катионы не способны разряжаться на катоде. Вместо них восстанавливаться будут молекулы воды:
Катод:
2H2O + 2e− = 2OH− + H2
Как уже было сказано выше, кислотные остатки карбоновых кислот «выигрывают» в конкуренции за окисление у молекул воды на аноде:
Анод:
2СН3СОО− − 2e− = CH3−CH3 + 2CO2
Таким образом, подведя электронный баланс и сложив два уравнения полуреакций на катоде и аноде получаем:
Катод: 2H2O + 2e− = 2OH− + H2 |∙1
Анод: 2СН3СОО− − 2e− = CH3−CH3 + 2CO2 |∙1
2H2O + 2СН3СОО− = 2OH− + Н2+ CH3−CH3 + 2CO2
Мы получили полное уравнение электролиза в ионном виде. Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
2H2O + 2СН3СООK = 2KOH + Н2+ CH3−CH3 + 2CO2
Пример №5
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора серной кислоты, а также общее уравнение электролиза.
Серная кислота диссоциирует на катионы водорода и сульфат-ионы:
H2SO4 = 2H+ + SO42-
На катоде будет происходить восстановление катионов водорода H+ , а на аноде окисление молекул воды, поскольку сульфат-ионы являются кислородсодержащими кислотными остатками:
Катод: 2Н+ + 2e− = H2 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
4Н+ + 2H2O = 2H2 + O2 + 4H+
Сократив ионы водорода в левой и правой и левой части уравнения получим уравнение электролиза водного раствора серной кислоты:
2H2O = 2H2 + O2
Как можно видеть, электролиз водного раствора серной кислоты сводится к электролизу воды.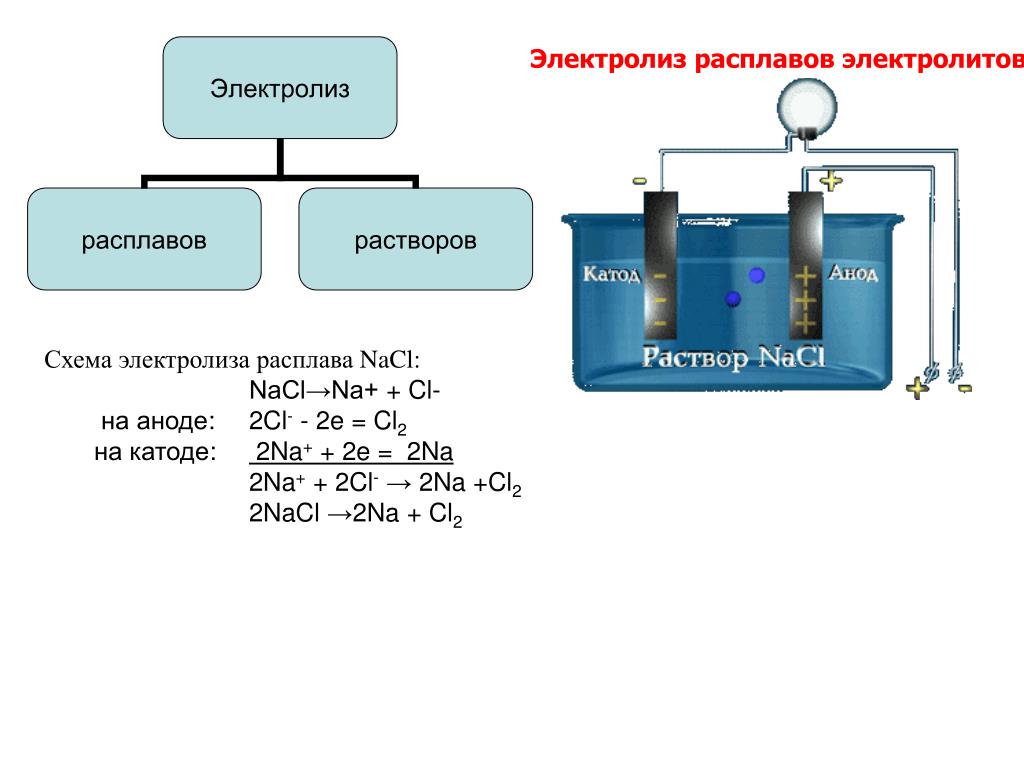
Пример №6
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора гидроксида натрия, а также общее уравнение электролиза.
Диссоциация гидроксида натрия:
NaOH = Na+ + OH−
На катоде будут восстанавливаться только молекулы воды, так как натрий – высокоактивный металл, на аноде только гидроксид-ионы:
Катод: 2H2O + 2e− = 2OH− + H2 |∙2
Анод: 4OH− − 4e− = O2 + 2H2O |∙1
4H2O + 4OH− = 4OH− + 2H2 + O2 + 2H2O
Сократим две молекулы воды слева и справа и 4 гидроксид-иона и приходим к тому, что, как и в случае серной кислоты электролиз водного раствора гидроксида натрия сводится к электролизу воды:
2H2O = 2H2 + O2
ЕГЭ. Электролиз расплавов. Примеры
Электролиз расплавов (скачать pdf)
Напомним, что на катоде происходит восстановление катионов, а на аноде – окисление анионов. В электролизе расплавов вода отсутствует, следовательно, любые (даже активные) металлы могут быть восстановлены на катоде. В случае кислородсодержащих кислотных остатков необходимо следовать следующему правилу: атомы кислорода окисляются до простого вещества и выделяется оксид неметалла.
В электролизе расплавов вода отсутствует, следовательно, любые (даже активные) металлы могут быть восстановлены на катоде. В случае кислородсодержащих кислотных остатков необходимо следовать следующему правилу: атомы кислорода окисляются до простого вещества и выделяется оксид неметалла.
1. Соли:
CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu2+ + 2Cl–
Расписываем процессы, происходящие на катоде и аноде. Так как воды нет, любой металл будет восстанавливаться на катоде:
К: Cu2+ + 2e → Cu0
A: 2Cl– – 2e → Cl2
Пишем суммарное уравнение:
CuCl2 → Cu + Cl2
Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na+ + SO42–
Расписываем процессы, происходящие на катоде и аноде. В данном случае ср находится в степени окисления +6, т.е. окислить ее уже нельзя, следовательно, окисляем кислород до простого вещества. Сера переходит в оксид с той же степенью окисления:
В данном случае ср находится в степени окисления +6, т.е. окислить ее уже нельзя, следовательно, окисляем кислород до простого вещества. Сера переходит в оксид с той же степенью окисления:
К: Na+ + 1e → Na0
A: 2SO42– – 4e → O20 + 2SO3
Анодный процесс по шагам:
1) сначала пишем окисление кислорода до простого вещества и SO3:
SO42– → O20 + SO3
2) Далее расставляем коэффициенты:
2SO42– → O20 + 2SO3
3) Уравниваем электроны: в левой части заряд 4– (так как заряд сульфат-иона 2– и их два), в правой – заряд 0, так как ионов нет. Следовательно, из левой части мы должны отнять 4 электрона, тем самым делая заряд 0 в обеих частях уравнения:
2SO42– – 4e → O20 + 2SO3
Сравниваем катодный и анодный процессы: количество принимаемых и отдаваемых электронов должно быть одинаковым.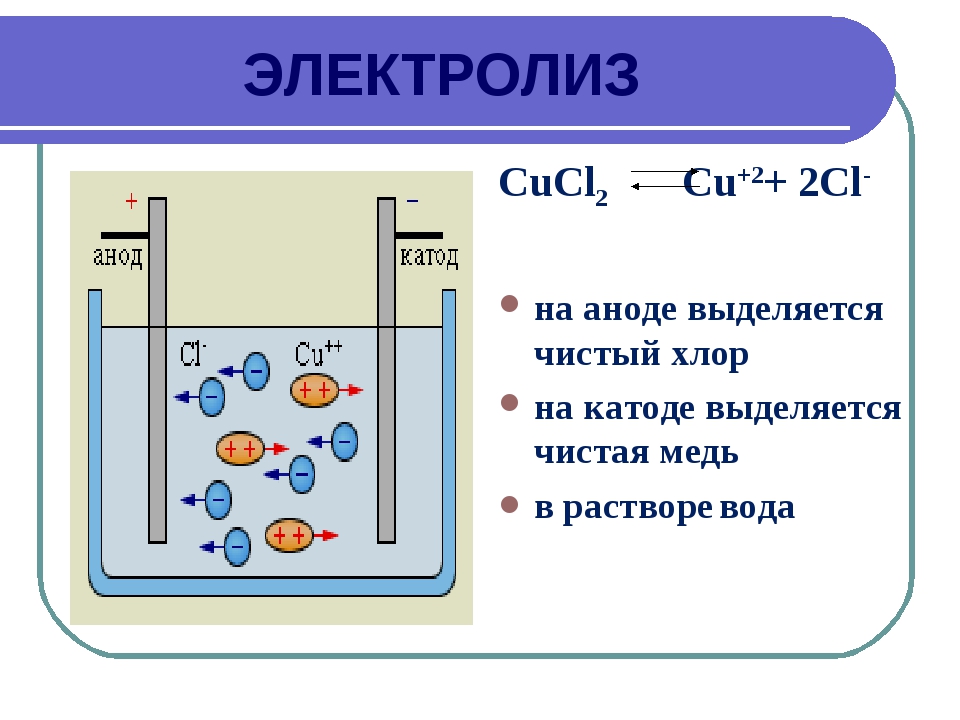
К: 4Na+ + 4e → 4Na0
A: 2SO42– – 4e → O20 + 2SO3
Теперь складываем левые и правые части катодного и анодного процессов:
2Na2SO4 → 4Na0 + O20 + 2SO3.
2. Щелочи:
KOH
Расписываем диссоциацию на ионы:
KOH → K+ + OH–
Расписываем процессы, происходящие на катоде и аноде:
К: K+ +1e → K0
A: 4OH– – 4e → O20 + 2H2O
Анодный процесс по шагам:
1) Понимаем, что окисляться будет кислород до простого вещества (водород уже имеет степень окисления +1 и далее не может быть окислен). Также будет выделение воды – почему? Потому что больше ничего написать и не получится: 1) H
+ написать не можем, так как OH– и H+ не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H+ +2e → H2), а на аноде протекают только процессы окисления.
OH–  → O20 + H2O
2) Расставляем коэффициенты:
4OH–  → O20 + 2H2O
3) Уравниваем число электронов в левой и правой ча
Электролиз расплавов и растворов (солей, щелочей, кислот) / Справочник :: Бингоскул
Сильнейшим окислительно — восстановительным действием обладает электрический ток. С помощью воздействия электрического тока на вещество можно получить чистый металл. Этот метод называется электролизом.
Электролиз – процесс, при котором происходит разложение вещества электрическим током.
Процесс электролиза может протекать только в веществах, проводящих электрический ток, то есть электролитах. К электролитам относят представителей основных классов неорганических соединений – кислоты, соли, щелочи.
Для протекания процесса требуется устройство, называемое электролизером.
Данное устройство работает от внешнего источника питания, который подает электрический ток.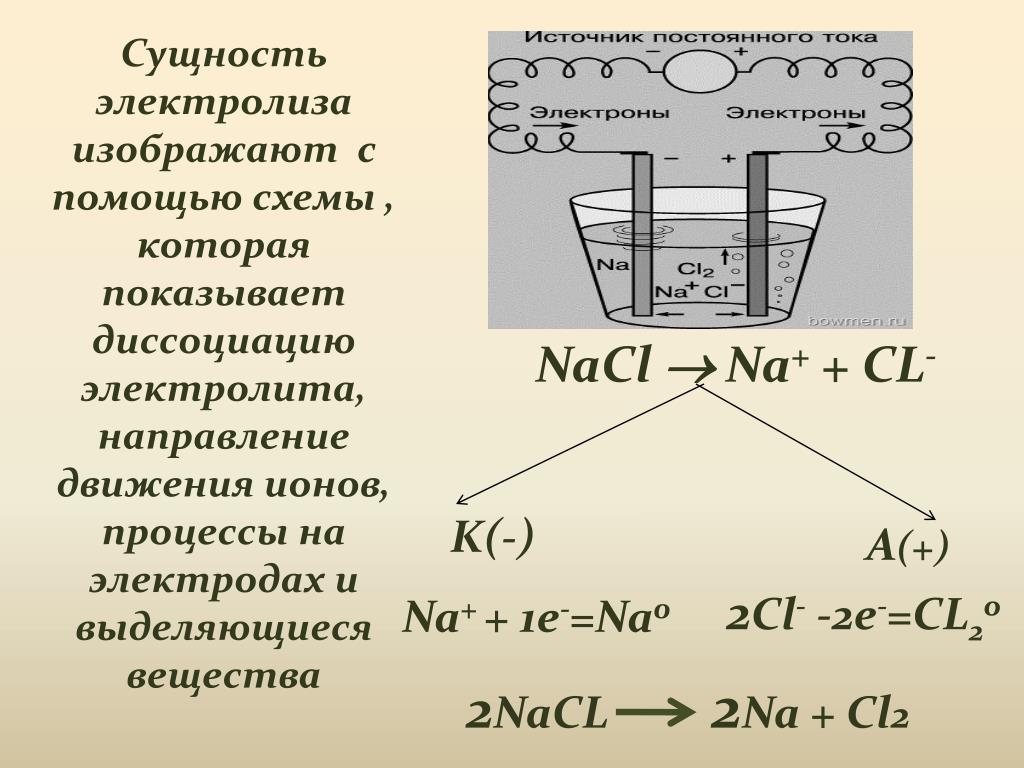 Представляет собой емкость, в которую опущены два электрода (катод и анод), заполнена емкость электролитом. При подаче электрического тока происходит разложение вещества. Для того чтобы узнать протекает электролиз или нет, в цепь включают лампочку, если лампочка загорается, значит в системе есть ток, если при замыкании цепи, лампочка не горит, то электролиз не протекает – вещество является не электролитом.
Представляет собой емкость, в которую опущены два электрода (катод и анод), заполнена емкость электролитом. При подаче электрического тока происходит разложение вещества. Для того чтобы узнать протекает электролиз или нет, в цепь включают лампочку, если лампочка загорается, значит в системе есть ток, если при замыкании цепи, лампочка не горит, то электролиз не протекает – вещество является не электролитом.
Катод (-) – является отрицательно заряженным электродом, катионы ( + ) перемещаются к нему и происходит процесс восстановления.
Анод (+) – положительно заряженный электрод, к нему перемещаются анионы (-) и происходит процесс окисления.
Можно выделить два типа электролиза для расплавов и растворов. Ход этих двух процессов происходит по-разному. Зависит по большей части это от содержания воды в растворе, которая тоже принимает участие в процессе. В расплаве происходит разложение только вещества.
В расплаве происходит разложение только вещества.
Особенности электролиза расплавов
В расплаве электролит непосредственно подвергается воздействию электрического тока. Металл всегда образуется на катоде, а продукт анода зависит от природы вещества.
При разложении расплава оснований на катоде образуется металл, а на аноде окисляется кислород. (расплав соли – это чистое вещество без примесей в основном твердые вещества)
Разложение расплавов солей происходит по-разному у бескислородных и кислородосодержащих. У бескислородной соли на аноде окисляется анион – кислотный остаток, а у кислородосодержащей – окисляется кислород.
Рассмотрим пример электролиза расплава бескислородной соли – хлорида калия. Под действием постоянного электрического тока соль разлагается на катионы калия и анионы хлора.
Катионы K+ перемещаются к катоду и принимают электроны, происходит восстановление металлического калия.
- Катодный процесс: K+ + e— → K0
Анионы Cl— движутся к аноду, отдавая электроны, происходит образование газообразного хлора.
- Анодный процесс: 2Cl— — 2e— → Cl20↑
Суммарное уравнение процесса электролиза расплава хлористого калия можно представить следующим образом:
- 2KCl (эл.ток) 2K0 + Cl20↑
Особенности электролиза растворов
В растворах электролитов, помимо самого вещества, присутствует вода. Под действием электрического тока водный раствор электролита разлагается.
Процессы, происходящие на катоде и аноде, различаются.
1. Процесс на катоде не зависит от материала, из которого он изготовлен. Однако, зависит от положения металлов в электрохимическом ряду напряжений.
2. Процесс на аноде зависит от материала, из которого состоит анод и от его природы.
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается Me => Men+ + ne
б) На не растворимом аноде (графит, платина) обычно окисляются анионы S—, J—, Br—, Cl—, OH— и молекулы H2O:
- 2J— => J20 + 2e;
- 4OH— => O2 + 2H2O + 4e;
- 2H2O => O2 + 4H+ + 4e
Рассмотрим примеры различных вариантов электролиза растворов:
1. Разложение бескислородной соли на нерастворимом электроде
Разложение бескислородной соли на нерастворимом электроде
Чтобы ознакомиться с этим вариантом электролиза, возьмем йодистый калий. Под действием тока ионы калия устремляются к катоду, а ионы йода к аноду.
Калий находится в диапазоне активности слева от алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется атомарный водород.
- Катод: 2H2O + 2e— → H2 + 2OH—
Процесс протекает на нерастворимом аноде и в состав соли входит бескислородный остаток, поэтому на аноде образуется йод.
- Анод: 2I—— 2e— → I20
В результате можно создать общее уравнение электролиза:
- 2KI + 2H2O (эл.ток) 2KOH + I2 + H2↑
2. Разложение бескислородной соли на растворимом электроде (медь)
Рассмотрим на примере хлорида натрия. Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
- NaCl → Na+ + Cl—
- Катод: Cu2+ + 2e— → Cu0
- Анод: Cu0 — 2e— → Cu2+
В растворе концентрация хлорида натрия остается неизменной, поэтому составить общее уравнение реакции процесса не представляется возможным.
3. Разложение кислородосодержащей соли на нерастворимом (инертном) электроде
Возьмем для примера раствор нитрата калия. В процессе электролиза происходит распад на ионы калия и кислотного остатка.
В ряду активности металлов калий находится левее алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется газообразный водород.
- Катод: 2H2O + 2e— → H2 + 2OH—
Молекулы воды окисляются на аноде и выделяется кислород.
- Анод: 2H2O — 4e— → O2 + 4H+
В результате получаем общее уравнение электролиза:
4. Электролиз раствора щелочи на инертном электроде
В случае разложения щелочи в процесс электролиза включаются молекулы воды и гидроксид-ионы.
Барий находится левее алюминия, поэтому на катоде происходит восстановление воды и выделение водорода.
- Катод: 2H2O + 2e— → H2 + 2OH—
На аноде откладываются молекулы кислорода.
- Анод: 4OH— — 4e— → O2 + 4H+
Получаем суммарное уравнение электролиза:
5. Электролиз раствора кислоты на инертном электроде
При разложении азотной кислоты под действием электрического тока в процесс вступают катионы водорода и молекула воды.
- HNO3 → H+ + NO3—
- Катод: 2H+ + 2e— → H2
- Анод: 2H2O — 4e— → O2 + 4H+
На катоде выделяется водород, на аноде – кислород. Получаем суммарное уравнение процесса:
Применение электролиза
Процессы электролиза нашли свое применение в промышленности в первую очередь для получения чистых металлов электрохимическим путем. Побочными продуктами этого процесса являются кислород и водород, поэтому он является промышленным способом получения этих газов. Очень часто применяют для очистки металлов от примесей и защиты от коррозии.
Смотри также:
Электролиз расплавов | Дистанционные уроки
05-Апр-2013 | комментариев 14 | Лолита Окольнова
Мы уже рассматривали электролиз растворов солей, теперь давайте разберем электролиз расплавов веществ.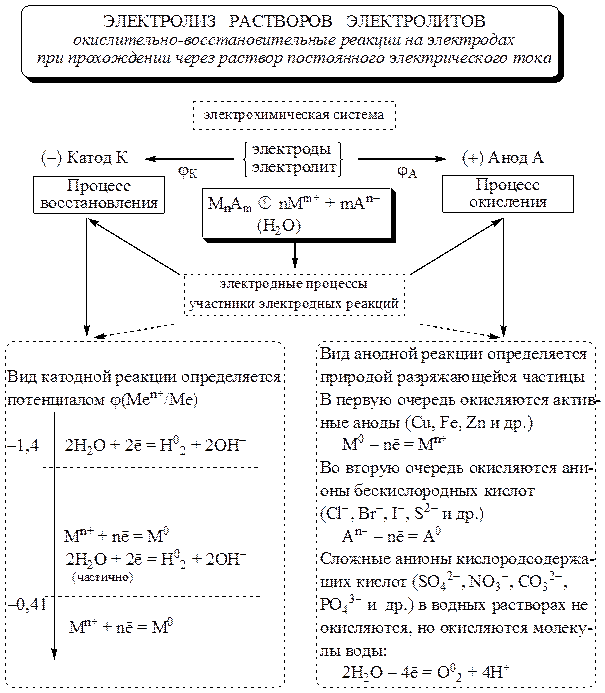
В этой лекции мы рассмотрим электролиз расплавов трех видов веществ:
- электролиз расплавов оксидов;
- электролиз расплавов оснований;
- электролиз расплавов солей.
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионыокисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
-
КАТод — КАТионы (ионы у катода)
-
АНод — АНионы (ионы у анода)
На катоде идет восстановление: Me n+ + ne— = Me0, т.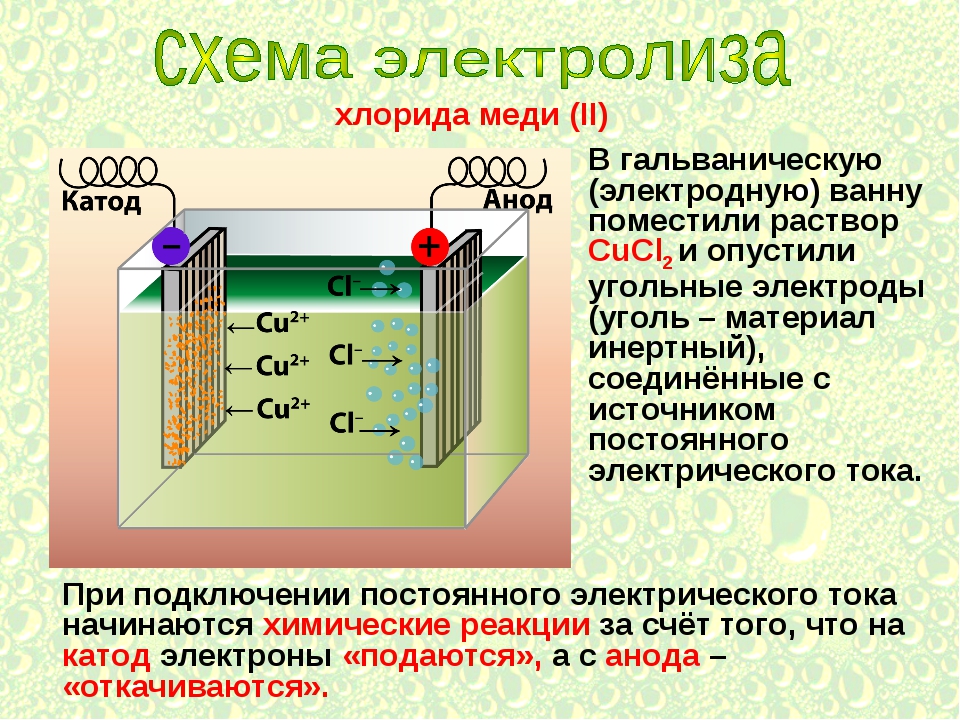 е. на катоде выделяется металл.
е. на катоде выделяется металл.
На аноде окисляется кислород: O-2 -2e— = O2
Возьмем для примера электролиз расплава оксида калия: 2K2O -> 4K + O2
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл:
Me n+ +ne— = Me0
На аноде будет окисляться кислород в составе гидроксид-группы:
4OH− −4e =2H2O + O2
Электролиз расплавов солей
1. Электролиз расплава бескислородной соли:
На катоде всегда восстанавливается металл: Me n+ +ne— = Me0
На аноде окисляется бескислородный анион: A n- — ne— = A0
Электролиз расплава NaCl: 2NaCl = 2Na + Cl2
2. Электролиз расплава кислородсодержащей соли (элемент аниона не в высшей степени окисления):
Электролиз расплава кислородсодержащей соли (элемент аниона не в высшей степени окисления):
На катоде всегда восстанавливается металл: Me n+ +ne— = Me0
На аноде будет окисляться элемент аниона: SO3 2- — 2e— = SO3
Например, электролиз расплава сульфита натрия:
Na2SO3 = 2Na + SO3
S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 — SO3
3. Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления):
На катоде все без изменений 🙂
На аноде — т.к. элемент уже в высшей степени окисления, то окисляться будет кислород:
2CO3-2 — 4e—= 2CO2 + O2
Например, электролиз расплава карбоната натрия:
2Na2CO3 = 4Na + 2CO2+ O2
Важно понимать, что эти реакции не идут сами по себе.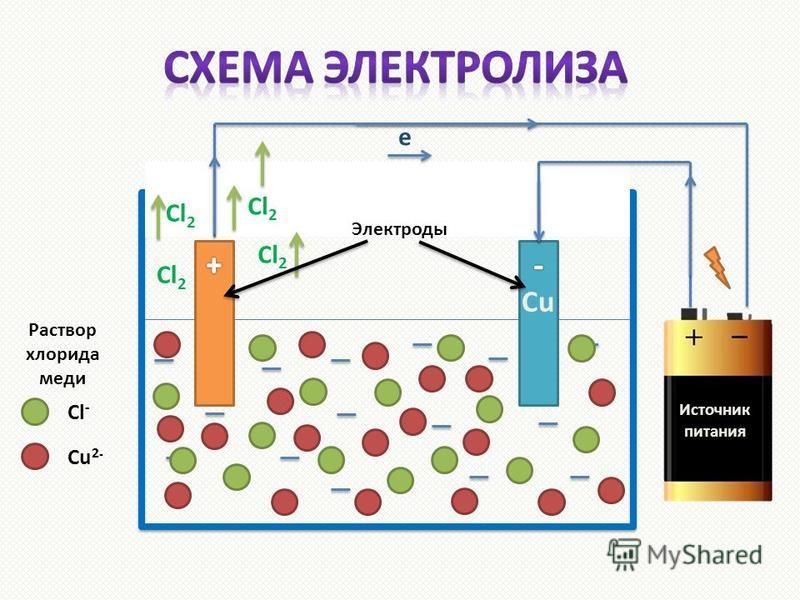 Их протекание возможно только при действии электрического тока.
Их протекание возможно только при действии электрического тока.
[TESTME 57]
Еще на эту тему:
Обсуждение: «Электролиз расплавов»
(Правила комментирования)определение и сущность, правила применения
Электролизом называется химический процесс при постоянном токе, заставляющий перемещаться ионы в требуемом направлении. Этот процесс нашел применение в многих отраслях промышленности – химической, металлургической и других. Любой раствор состоит из частиц, которые имеют положительный и отрицательный заряды.
Такое состояние является нестабильным, так как противоположные заряды притягиваются. Таким образом появляется частица с нейтральным зарядом или другими словами новая молекула другого вещества. В статье будет описан механизм электролиза, как он происходит, работает, в каких сферах он нашел применение.
Что такое электролиз.
В чём заключается процесс
Для организации процесса перемещения ионов в растворе нужно только два электрода и источник тока.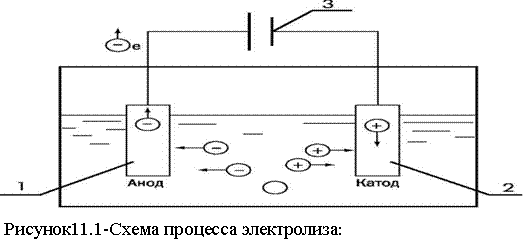 Положительно заряженный электрод, называемый анодом, способствует окислению анионов, то есть отрицательно заряженных частиц, а также нейтральных молекул. Катод, то есть отрицательно заряженный электрод, притягивает к себе положительно заряженные ионы и нейтральные молекулы.
Положительно заряженный электрод, называемый анодом, способствует окислению анионов, то есть отрицательно заряженных частиц, а также нейтральных молекул. Катод, то есть отрицательно заряженный электрод, притягивает к себе положительно заряженные ионы и нейтральные молекулы.
Особенности процессов, происходящих на катоде, заключаются в том, что здесь восстанавливаются обычно сильные окислители. Таким образом, с помощью двух пластинок с разницей потенциалов, помещённых в электролит, можно получать новые вещества, менять состояние электродов и раствора.
Электролиз широко применяется для осуществления следующих процессов:
- Получение веществ в чистом состоянии.Этот процесс используется для того, чтобы обработать горные породы и получить чистые вещества. Так образуются алюминий, двуокись марганца, водород, перекись водорода.
- Очистка сточных вод.В результате помещения в такие растворы электролитов происходит не только обеззараживание воды, но и образование взвесей, которые выпадают в осадок.
- Нанесение тонких покрытий.Под воздействием тока ионы металла осаждаются на предмете, формируя тонкую декоративную или защитную плёнку.
Этот список на самом деле гораздо обширней, поскольку с помощью разницы потенциалов можно с минимальными затратами добиваться значительного эффекта для разных целей.
Пример химической реакции электролиза.
Правила электролиза водных растворов
Электролиз на катоде зависит только от положения металла в электрохимическом ряду напряжений:
- если катион электролита стоит левее алюминия (включительно), на катоде восстанавливается вода с выделением водорода, а катионы металла остаются в растворе:
2H2O+2e–= H2↑+2OH– (Li…Al) - если катион электролита стоит между алюминием и водородом, на катоде восстанавливаются и вода, и катионы металла;
Men++ne–= Me; 2H2O+2e– = H2↑+2OH– (Mn…Pb) - если катион электролита стоит правее водорода, на катоде восстанавливается только катионы металла:
Men++ne–= Me (Cu…Au) - если в растворе электролита находится несколько металлов, первыми восстанавливаются катионы металла, который в ряду напряжений стоит правее остальных.

- Электролиз на анодезависит только от материала, из которого изготовлен анод:
- в случае растворимого анода (металлы, которые окисляются в процессе электролиза – железо, медь, цинк, серебро) – всегда идет процесс окисления металла анода:
Me-ne–= Men+ - в случае нерастворимого анода (золото, платина, графит):
- идет процесс окисления аниона при электролизе растворов солей бескислородных кислот, за исключением фторидов:
Acm-me–= Ac - идет процесс окисления воды в остальных случаях (электролиз оксикислот и фторидов) – анион остается в растворе:
2H2O-4e–= 4H++O2↑ - при электролизе растворов щелочей окисляются гидроксид-ионы:
4OH–-4e–= 2H2O+O2↑
- идет процесс окисления аниона при электролизе растворов солей бескислородных кислот, за исключением фторидов:
- восстановительная активность анионов уменьшается в ряду (соответственно увеличивается способность окисляться):
- I–; Br–; S2-; Cl–; OH–; SO42-; NO3–; F–
- в случае растворимого анода (металлы, которые окисляются в процессе электролиза – железо, медь, цинк, серебро) – всегда идет процесс окисления металла анода:
Промышленное применение электролиза
Электролиз широко используется в следующих сферах промышленности:
- Выделение и очистка металлов.

- Получение алюминия, магния, натрия, кадмия.
- Получение щелочей, хлора, водорода.
- Очистка меди, никеля, свинца.
- Процессы напыления защитных покрытий с целью защиты металлов от коррозии.лектролиз (от греч. «лизис» – разложение, растворение, распад) – это совокупность физико-химических явлений на находящихся в жидкости электродах при прохождении электрического тока. Например, погрузив в воду два электрода и подключив их к источнику постоянного тока, мы обнаружим, что вокруг электродов выделяются пузырьки – это газы водород и кислород. При их образовании уменьшается масса воды, то есть она разлагается на входящие в её состав элементы.
Если электроды погружать не в воду, а в растворы или расплавы солей, кислот и щелочей, то можно наблюдать выделение других газов и даже твёрдых веществ, оседающих на поверхности электродов. По этой причине электролиз широко применяют в технике. Рассмотрим самые важные направления его применения. Но перед этим запомним, что электрод, присоединяемый к «+» источника тока, называют анодом, а электрод, присоединяемый к «–» источника тока, называют катодом.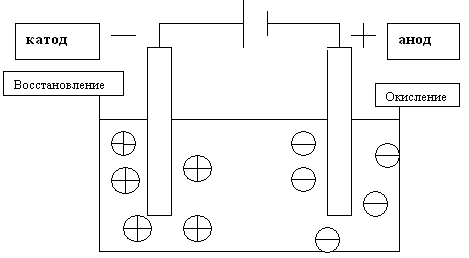
Получение рафинированной меди.
Электрометаллургия
Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). В ванну опускают угольные стержни, которые служат анодами, а сама ванна – катодом. При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны.
Электрометаллургия.
Рафинирование (очистка) меди
Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название – медный купорос) и опускают две пластины: анод – толстую пластину из неочищенной меди и катод – тонкий лист из чистой меди.
При пропускании электрического тока анод постепенно растворяется, примеси выпадают в осадок, а на катоде оседает чистая медь. Аналогичным способом получают и другие чистые металлы – никель, свинец, золото.
Гальваностегия
Для придания изделиям красивого внешнего вида, прочности или для предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними.
Результат гальваностегии.
Гальванопластика
Это электролитическое осаждение металла на поверхности какого-либо предмета для воспроизведения его формы. Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
Интересное по теме: Что такое закон Ома
Гальванополировка
Если резное металлическое изделие поместить в раствор электролита и включить ток, то наиболее сильное электрическое поле образуется у микроскопических выступов на поверхности этого изделия. Если оно подключено к «+» источника тока, то наиболее интенсивно ионы металла будут «вырываться» именно из выступов, и поверхность металла выровняется.
Электрофорез
От греч. «форезис» – перенесение), это лечебная процедура. Электроды накладывают на тело человека. Между телом и электродом помещают бумагу или ткань, пропитанную электропроводящим лекарственным препаратом. При включении тока начинается движение заряженных частиц из бумаги или ткани в кожу, а затем в тело человека. Так происходит процесс ввода лекарств, скорость которого можно регулировать, изменяя силу тока. Электролиз применяют также и для синтеза различных неорганических и органических веществ; это изучается в отдельной науке – электрохимии.
Электролиз применяют также и для синтеза различных неорганических и органических веществ; это изучается в отдельной науке – электрохимии.
Процессы, протекающие при электролизе
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путем электролиза. Кроме того, электролиз используется для рафинирования (очистки) меди, никеля, свинца, а также для получения водорода, кислорода, хлора и ряда других химических веществ.
Сущность электролиза заключается в выделении из электролита при протекании через электролитическую ванну постоянного тока частиц вещества и осаждении их на погруженных в ванну электродах (электроэкстракция) или в переносе веществ с одного электрода через электролит на другой (электролитическое рафинирование).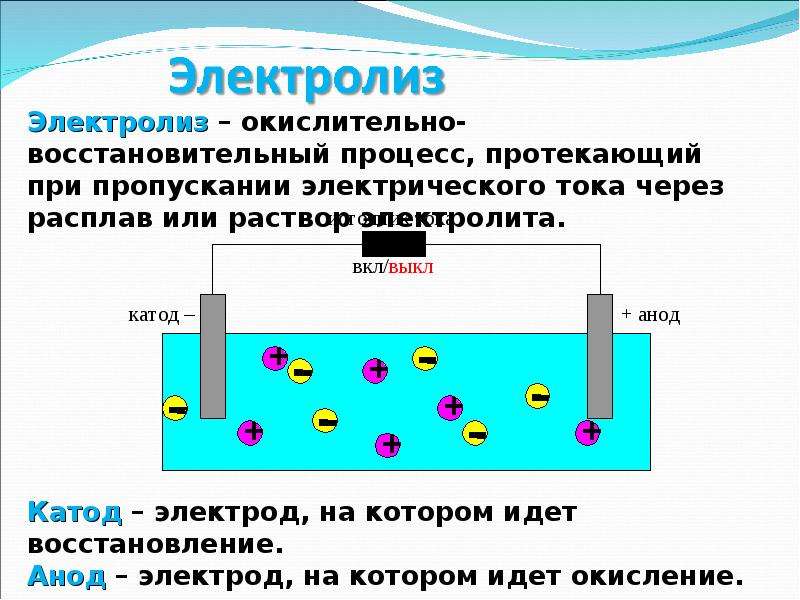 В обоих случаях цель процессов – получение возможно более чистых незагрязненных примесями веществ.
В обоих случаях цель процессов – получение возможно более чистых незагрязненных примесями веществ.
В отличие от электронной электропроводности металлов в электролитах (растворах солей, кислот и оснований в воде и в некоторых других растворителях, а также в расплавленных соединениях) наблюдается ионная электропроводность.
Электролиты являются проводниками второго рода. В этих растворах и расплавах имеет место электролитическая диссоциация – распад на положительно и отрицательно заряженные ионы. Если в сосуд с электролитом – электролизер поместить электроды, присоединенные к электрическому источнику энергии, то в нем начнет протекать ионный ток, причем положительно заряженные ионы – катионы будут двигаться к катоду (это в основном металлы и водород), а отрицательно заряженные ионы – анионы (хлор, кислород) – к аноду.
Что такое электролиз.
У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху.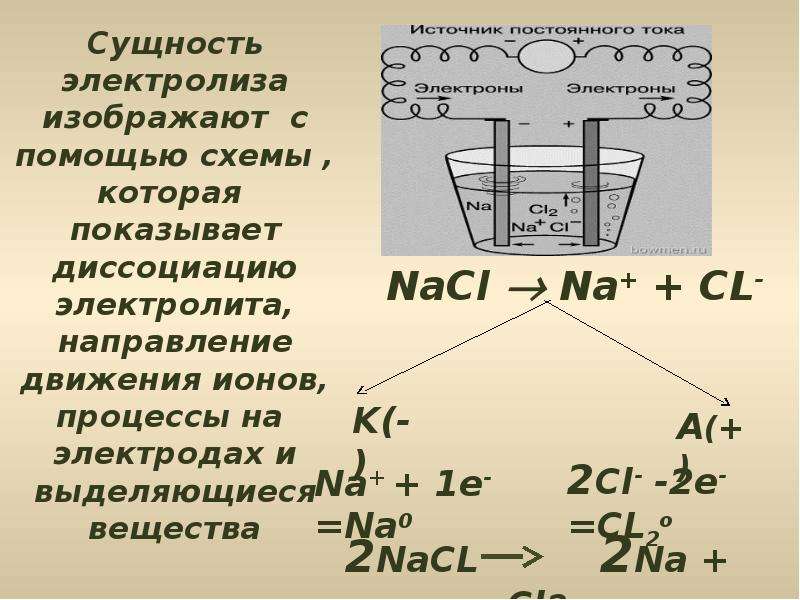 Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду (рис. 1). При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию).
Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду (рис. 1). При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию).
Если же анод может растворяться в электролите по мере обеднения последнего, то частицы его, растворяясь в электролите, приобретают положительный заряд и направляются к катоду, на котором осаждаются, тем самым осуществляется перенос материала с анода на катод. Так как при этом процесс ведут так, чтобы содержащиеся в металле анода примеси не переносились на катод, такой процесс называется электролитическим рафинированием.
Если электрод поместить в раствор с ионами того же вещества, из которого он изготовлен, то при некотором потенциале между электродом и раствором не происходит ни растворения электрода, ни осаждения на нем вещества из раствора. Такой потенциал называется нормальным потенциалом вещества. Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс).
Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс).
Электролиз медного купороса.
Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. Если в электролите имеются ионы разных металлов, то первыми на катоде выделяются ионы, имеющие меньший отрицательный нормальный потенциал (медь, серебро, свинец, никель), щелочноземельные металлы выделить труднее всего. Кроме того, в водных растворах всегда имеются ионы водорода, которые будут выделяться ранее, чем все металлы, имеющие отрицательный нормальный потенциал, поэтому при электролизе последних значительная или даже большая часть энергии затрачивается на выделение водорода.
Путем специальных мер можно воспрепятствовать в известных пределах выделению водорода, однако металлы с нормальным потенциалом меньше 1 В (например, магний, алюминий, щелочноземельные металлы) получить электролизом из водного раствора не удается.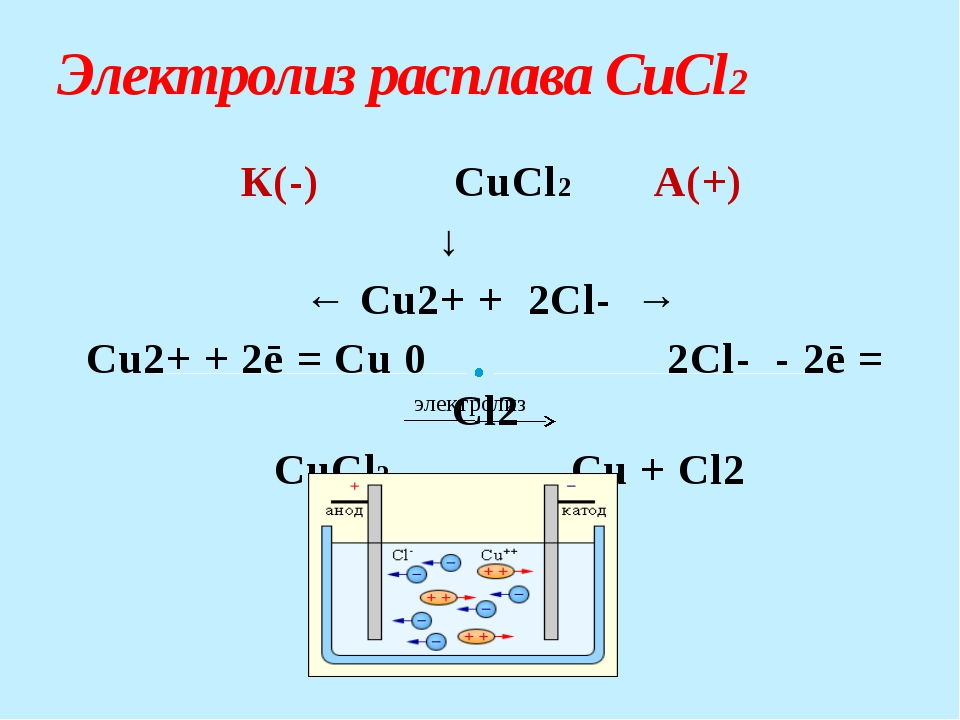 Их получают разложением расплавленных солей этих металлов. Нормальные электродные потенциалы веществ, указанные в табл. 1, являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
Их получают разложением расплавленных солей этих металлов. Нормальные электродные потенциалы веществ, указанные в табл. 1, являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
Разность между действительным потенциалом электрода при электролизе и нормальным для него потенциалом называют перенапряжением. Оно увеличивает потери энергии при электролизе.
С другой стороны, увеличивая перенапряжение для ионов водорода, можно затруднить его выделение на катоде, что позволяет получить электролизом из водных растворов ряд таких более отрицательных по сравнению с водородом металлов, как свинец, олово, никель, кобальт, хром и даже цинк. Это достигается ведением процесса при повышенных плотностях тока на электродах, а также введением в электролит некоторых веществ.
Течение катодных и анодных реакций при электролизе определяется следующими двумя законами Фарадея.
Масса вещества mэ, выделившегося при электролизе на катоде или перешедшего с анода в электролит, пропорциональна количеству прошедшего через электролит электричества Iτ: mэ = α/τ,здесь а – электрохимический эквивалент вещества, г/Кл.
Масса выделенного при электролизе вещества одним и тем же количеством электричества прямо пропорциональна атомной массе вещества А и обратно пропорциональна его валентности n: mэ = А / 96480n, здесь 96480 – число Фарадея, Кл х моль-1.
Интересно почитать: то такое датчик Холла.
Таким образом, электрохимический эквивалент вещества α= А / 96480n представляет собой массу вещества в граммах, выделяемую единицей проходящего через электролитическую ванну количества электричества – кулоном (ампер-секундой). Для меди А = 63,54, n =2, α =63,54/96480-2= 0,000329 г/Кл, для никеля α =0,000304 г/Кл, для цинка α=0,00034 г/Кл. В действительности масса выделившегося вещества всегда меньше указанной, что объясняется рядом побочных процессов, проходящих в ванне (например, выделением водорода на катоде), утечками тока и короткими замыканиями между электродами.
Химические реакции при электролизе.
Теоретическая часть
Электролиз – совокупность окислительно-восстановительных реакций, протекающих под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне. Электролиз проводят в особых приборах – электролизерах. Это сосуд с раствором или расплавом электролита и опущенными в него электродами из металла или графита. К электродам прикладывают разность потенциалов от внешнего источника постоянного тока. Катод отдает электроны частицам вещества в электролите и восстанавливает их. Анод отбирает электроны от частиц в электролите, окисляя их.
При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне. Электролиз проводят в особых приборах – электролизерах. Это сосуд с раствором или расплавом электролита и опущенными в него электродами из металла или графита. К электродам прикладывают разность потенциалов от внешнего источника постоянного тока. Катод отдает электроны частицам вещества в электролите и восстанавливает их. Анод отбирает электроны от частиц в электролите, окисляя их.
Электролиз расплавов оснований.
При электролизе процессы окисления и восстановления протекают на различных электродах – аноде и катоде. Анод – это электрод, на котором происходит процесс окисления. При электролизе анод заряжен положительно. Катод – это электрод, на котором происходит процесс восстановления. При электролизе катод заряжен отрицательно. На окислительно-восстановительные процессы, протекающие при электролизе, влияют различные факторы:
- Природа электролита и растворителя;
- Материал электродов;
- Режим электролиза (напряжение, сила тока, температура).

Различают 2 типа электролиза: электролиз расплава и электролиз растворов электролитов. Электролиз расплавов оксидов На катоде идет восстановление катионов металла: Men++ nē = Me0 , т.е. на катоде выделяется металл. На аноде окисляется кислород: O –2 –2ē = O2 Например, электролиз расплава оксида калия: 2K2O = 4K + O2 При изучении алюминия, способов получения металлов, надо знать электролиз оксида алюминия. Металлический алюминий получают электролизом раствора глинозема Al2O3 в расплавленном криолите Na2AlF6 при 960–970°С. Электролиз Al2O3 можно представить следующей схемой: в расплаве оксид алюминия диссоциирует: Al2O3= Al3++ AlO3 3– , на катоде восстанавливаются ионы Al3+ : Al3++3ē Al0 , на аноде окисляются ионы AlO3 3– : 4AlO3 3– – 12ē 2Al2O3 + 3O2. Суммарное уравнение процесса: 2Al2O3 4Al + 3O2. Жидкий алюминий собирается на дне электролизера.
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл: Men+ +nē = Me0 На аноде будет окисляться кислород в составе гидроксид-группы: 4OH− −4ē =2h3O + O2 Электролиз расплавов солей 1. Электролиз расплава бескислородной соли: На катоде всегда восстанавливается металл: Men + nē = Me0 На аноде окисляется бескислородный анион: A n– – nē = A0 Например: Электролиз расплава NaCl: 2NaCl = 2Na + Cl2 2.Электролиз расплава кислородсодержащей соли (элемент аниона находится не в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде будет окисляться элемент аниона: SO3 2– – 2ē = SO3 0 Например, электролиз расплава сульфита натрия: Na2SO3 = 2Na + SO3 Сера S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 (SO3). 3.
Электролиз расплава бескислородной соли: На катоде всегда восстанавливается металл: Men + nē = Me0 На аноде окисляется бескислородный анион: A n– – nē = A0 Например: Электролиз расплава NaCl: 2NaCl = 2Na + Cl2 2.Электролиз расплава кислородсодержащей соли (элемент аниона находится не в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде будет окисляться элемент аниона: SO3 2– – 2ē = SO3 0 Например, электролиз расплава сульфита натрия: Na2SO3 = 2Na + SO3 Сера S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 (SO3). 3.
Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде: т.к. элемент уже в высшей степени окисления, то окисляться будет кислород, например: 2CO3 –2 – 4ē = 2CO2 + O2 Например, электролиз расплава карбоната натрия: 2Na2CO3 = 4Na + 2CO2+ O2 Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока. Электролиз растворов На катоде могут протекать следующие реакции восстановления.
Электролиз растворов На катоде могут протекать следующие реакции восстановления.
Электролиз расплавов оснований.
Катодные процессы: Li K Ca Na Mg Al Li+K +Ca2+Na+Mg2+Al3+ Mn Zn Fe Ni Sn Pb Mn2+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ h3 2H+ Cu Hg Ag Pt Au Cu2+Hg2 2+Ag+ Pt2+Au3+ Восстанавливается вода: 2h3O+2ē=h3↑+2OH− ; M n+ не восстанавливается Восстанавливаются катионы металла и вода: Mn++nē=M0 2h3O+2ē=h3↑+2OH−Восстанавливаются катионы металла: M n++ nē=М0 а) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений после водорода, происходит выделение металлов на катоде: (-) Cu2++ 2ē → Cu. б) при электролизе растворов солей, содержащих катионы, расположенные между алюминием и водородом, на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода: (-) Zn2++ 2ē → Zn; (-) 2h3O + 2ē → h3↑ + 2OH– . в) если растворы солей содержат катионы, находящиеся в ряду напряжения до алюминия, то в водном растворе такие ионы восстановленными быть не могут, на катоде выделяется водород: (-) 2h3O + 2ē → h3↑ + 2OH– .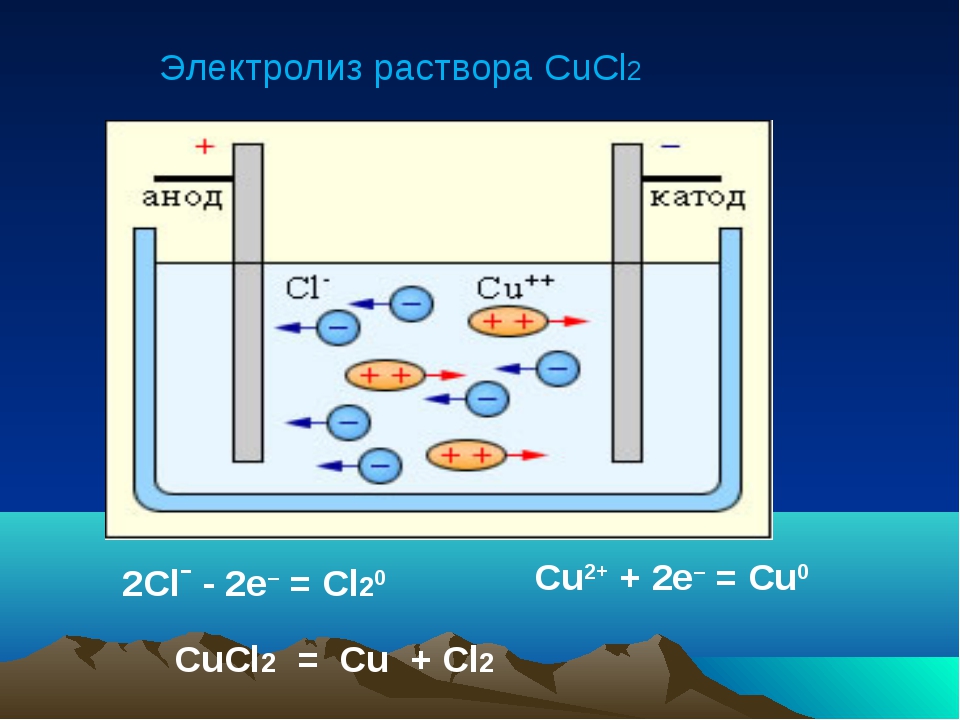 Процесс на аноде зависит от материала анода и от природы аниона. На аноде протекают реакции окисления.
Процесс на аноде зависит от материала анода и от природы аниона. На аноде протекают реакции окисления.
Как работает электролиз.
Заключение
Рейтинг автора
Автор статьи
Инженер по специальности «Программное обеспечение вычислительной техники и автоматизированных систем», МИФИ, 2005–2010 гг.
Написано статей
Более подробно об электролизе рассказано в статье ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ И РАСПЛАВОВ СОЛЕЙ. А также в нашей группе ВК можно задавать вопросы и получать на них подробные ответы от профессионалов. Для этого приглашаем читателей подписаться и вступить в группу. В завершение статьи хочу выразить благодарность источникам, откуда мы черпали информацию во время подготовки материала:
www.fizika.ru
www.ksma.ru
www.elektro.guru
www.prosto-o-slognom.ru
www.electricalschool.info
www.elektrovesti.net
Предыдущая
ТеорияЧто такое статическое электричество и как от него избавиться
СледующаяТеорияЧто такое резонанс, в чем его польза и опасность
Электролиз — Знаешь как
Электролизом называется химический процесс, происходящий при пропускании электрического тока через раствор электролита или через расплавленный электролит. При прохождении электрического тона через раствор электролита находящиеся в растворе положительные ионы направляются к катоду, а отрицательные — к аноду и здесь разряжаются. Образовавшиеся нейтральные атомы и группы атомов или выделяются из раствора, или вступают во взаимодействие между собой, образуя так называемые вторичные продукты электролиза.
При прохождении электрического тона через раствор электролита находящиеся в растворе положительные ионы направляются к катоду, а отрицательные — к аноду и здесь разряжаются. Образовавшиеся нейтральные атомы и группы атомов или выделяются из раствора, или вступают во взаимодействие между собой, образуя так называемые вторичные продукты электролиза.
Электролиз что это
При рассмотрении механизма электролиза нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются еще ионы Н• и ОН’ из воды. Эти ионы перемещаются в электрическом поле так же, как и ионы электролита: водородные ионы — к катоду, а гидроксильные — к аноду. Таким образом, у катода одновременно могут разрядиться два иона: положительный ион электролита (обычно ион металла) и ион водорода из воды.
Какой из них разрядится, — это прежде всего зависит от их относительного положения в ряду напряжений, а также от концентрации ионов и в некоторых случаях от материала электрода, у которого происходит разряд. В общем, чем легче металл отдает свои электроны, чем больше его отрицательный потенциал (по абсолютной величине), тем труднее разряжаются его ионы. Отсюда следует, что при прочих равных условиях легче всего должны разряжаться ионы золота и ионы других малоактивных металлов, труднее всего ионы металлов, стоящих в начале ряда напряжений. Так как ион любого металла, стоящего справа от водорода, легче разрядить, чем ион водорода, то при электролизе солей меди, ртути и др. на катоде выделяются соответствующие металлы.
В общем, чем легче металл отдает свои электроны, чем больше его отрицательный потенциал (по абсолютной величине), тем труднее разряжаются его ионы. Отсюда следует, что при прочих равных условиях легче всего должны разряжаться ионы золота и ионы других малоактивных металлов, труднее всего ионы металлов, стоящих в начале ряда напряжений. Так как ион любого металла, стоящего справа от водорода, легче разрядить, чем ион водорода, то при электролизе солей меди, ртути и др. на катоде выделяются соответствующие металлы.
Ионы металлов, стоящих в ряду напряжений слева от водорода, разряжаются труднее, чем ионы водорода, и тем труднее, чем они дальше отстоят от него. Поэтому при электролизе солей наиболеe aктивных металлов: натрия, калия и кальция, а также магния и алюминия, когда разница между электродными потенциалами металла и водорода очень велика, разряжаются почти исключительно ионы водорода и у катода выделяется газообразный водород. По мере разряда водородных ионов диссоциируют все новые и новые количества молекул воды, вследствие чего у катода накапливаются гидроксильные ионы и раствор становится щелочным.
Иная картина получается при электролизе солей менее активных металлов, стоящих левее водорода, как, например, цинка, железа, никеля и др. Хотя теоретически и здесь должны были бы в первую очередь разряжаться водородные ионы, однако практически у катода происходит выделение металлов. Это кажущееся противоречие объясняется ничтожной концентрацией ионов водорода (сравнительно с концентрацией ионов металла) и особым влиянием вещества электродов, сильно затрудняющим разряд водородных ионов .
Посмотрим теперь, что происходит у анода. К аноду передвигаются отрицательные ионы электролита и гидроксильные ионы воды. Если отрицательные ионы не содержат кислорода, как, например, ионы Cl’, Br’, S», то разряжаются именно эти ионы, а не гидроксильные, которые теряют свой заряд значительно труднее, и у анода происходит выделение хлора, брома, серы. Если же отрицательные ионы содержат кислород (ионы SO4«, NO3‘ и др.), то на аноде выделяется газообразный кислород. В этих случаях, повидимому, гидроксильные ионы воды разряжаются легче, чем ионы кислотных остатков.
При разряде гидроксильных ионов образуются электронейтральные группы ОН, которые не могут существовать в свободном состоянии и сейчас же превращаются в молекулы воды и кислорода:
4OН’ — 4е = 2Н2O + O2
Таким образом, причиной выделения кислорода является разряд гидроксильных ионов. По мере разряда последних диссоциируют новые молекулы воды и у анода происходит накопление водородных ионов.
Рассмотрим несколько типичных случаев электролиза.
1. Электролиз р а с т в о р а СuCl2. Раствор содержит ионы Сu•• и Cl’ и незначительное количество Н• и ОН’ ионов из
воды. При пропускании тока ионы меди перемещаются к катоду, а ионы хлора — к аноду. Принимая от катода по два электрона, ионы Сu•• превращаются в нейтральные атомы, выделяющиеся из раствора. Катод постепенно покрывается медью. В то же время ионы Cl’, достигая анода, отдают ему электроны и превращаются в атомы хлора, которые, соединяясь попарно, образуют молекулы Сl2. У анода выделяется хлор.
У анода выделяется хлор.
Схема электролиза раствора CuCl2
У катода происходит процесс восстановления, у анода — процесс окисления.
2. Электролиз раствора K2SO4. Раствор содержит ионы К• и SO4», а также водородные и гидроксильные ионы воды. Так как ионы калия разряжаются труднее, чем ионы водорода, а ионы SO4» труднее, чем ионы ОН’, то при пропускании тока у катода разряжаются ионы водорода и выделяется водород, а у анода — ионы гидроксила и выделяется кислород.
Схема электролиза раствора K2SO4
Таким образом, при электролизе раствора K2SO4 не разряжается ни один из ионов растворенного электролита, а происходит лишь разложение воды. В то же время, вследствие разряда водородных и гидроксильных ионов воды и непрерывного перемещения ионов К• к катоду, а ионов SO4« к аноду, у катода образуется раствор щелочи (КОН), а у анода раствор кислоты (H2SO4).
Для разложения электролита нужна некоторая определенная минимальная величина напряжения, называемая потенциалом разложения данного электролита. Так, например, если опустить в раствор хлорной меди CuCI2два платиновых электрода и приложить к ним разность потенциалов 0,8 вольта, то вначале ток проходит через раствор, но затем быстро ослабевает и, наконец, совсем прекращается. Причиной прекращения тока является накопление на одном электроде меди, а на другом хлора (адсорбированного платиной), вследствие чего возникает новый элемент, состоящий из меди и хлора в растворе их ионов и дающий ток обратного направления. Указанное явление носит Название поляризации электродов, а электродвижущая сила образовавшегося таким образом элемента называется электродвижущей силой поляризации. Величина ее для молярного раствора СuСl2 легко находится по таблице нормальных потенциалов путем вычитания из потенциала хлора потенциала меди; 1,36 — 0,34 = 1,02 вольта.
Понятно, что для поддержания электролиза нужно приложить извне к электродам разность потенциалов не меньшую, а даже несколько большую, чем 1,02 вольта, чтобы преодолеть электродвижущую силу поляризации.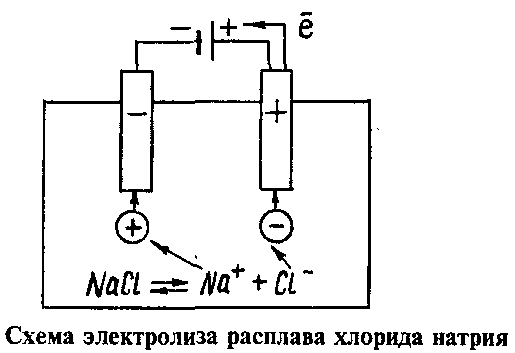 Эта величина и является потенциалом разложения электролита. Из предыдущего видно, что для ее нахождения нужно из потенциала вещества, выделяющегося у анода, вычесть потенциал вещества, выделяющегося у катода. Таким образом, потенциал разложения СuСl2 в молярном растворе равняется 1,02 вольта, потенциал разложения ZnCl2 при тех же условиях будет равняться 1,36— (—0,763) = 2,123 вольта и т. д. Потенциалы разложения кислородных кислот и щелочей в нормальных растворах почти одинаковы (около 1,67 вольта), так как во всех случаях разряжаются одни и те же ионы.
Эта величина и является потенциалом разложения электролита. Из предыдущего видно, что для ее нахождения нужно из потенциала вещества, выделяющегося у анода, вычесть потенциал вещества, выделяющегося у катода. Таким образом, потенциал разложения СuСl2 в молярном растворе равняется 1,02 вольта, потенциал разложения ZnCl2 при тех же условиях будет равняться 1,36— (—0,763) = 2,123 вольта и т. д. Потенциалы разложения кислородных кислот и щелочей в нормальных растворах почти одинаковы (около 1,67 вольта), так как во всех случаях разряжаются одни и те же ионы.
Если в растворе одновременно присутствуют различные катионы и анионы, то электролиз наступает тогда, когда напряжение будет достаточно велико, чтобы разрядить один из имеющихся видов катионов и анионов. Поэтому электролизом часто пользуются при анализе для отделения одного металла от другого. Например, из раствора, содержащего СuСl2 и ZnCl2, при напряжении, допустим, 1,2 вольта будет выделяться только медь, но не цинк, так как потенциал разложения ZnCl2 значительно выше 1,2 вольта.
В приведенных выше примерах электролиза предполагалось, что электроды сделаны из инертного материала, например из угля. При употреблении таких электродов ионы разряжаются как у катода, так и у анода. Иначе протекает процесс, если анод состоит из какого-нибудь металла. В этом случае разряд ионов происходит только у катода; у анода же, наоборот, ионы металла переходят в раствор.
Так, например, если подвергать электролизу раствор сернокислого никеля NiSО4, взяв в качестве анода пластинку металлического никеля, то на катоде, как обычно, выделяется никель, у анода же гидроксильные ионы не разряжаются и никакого выделения кислорода не происходит, но зато никель постепенно растворяется. Растворение никеля можно объяснить присущей всякому металлу способностью посылать в раствор свои ионы. При обычных условиях, когда металл погружен в воду (или в раствор), переход его ионов в раствор быстро, прекращается вследствие появления, на металле отрицательного заряда. В данном же случае благодаря работе источника тока свободные электроны непрерывно «откачиваются» из никелевой пластинки, поэтому ничто не препятствует переходу все новых и новых ионов никеля в раствор.
Схема электролиза раствора NiSO4 (при никелевом аноде)
Следовательно, электролиз никелевой соли при никелевом аноде сводится к выделению никеля на катоде и постепенному растворению анода. В то же время количество никелевой соли в растворе остается неизменным.
Применение растворимых анодов широко используется для покрытия одних металлов другими гальваническим путем. Тот предмет, который хотят покрыть каким-нибудь металлом, например серебром, погружают в раствор серебряной соли, где он служит катодом. В качестве анода берут кусок металлического серебра. Затем пропускают ток до тех пор, пока на поверхности предмета не отложится слой серебра достаточной толщины.
На растворении анодов основаны также электролитические способы очистки некоторых металлов .
Одним из важных технических применений электролиза является гальванопластика — способ получения точных металлических копий с рельефных, предметов путем осаждения на их поверхности электролитическим путем более или менее толстого слоя металла. Этот способ был открыт русским академиком Б. С. Якоби (1801 —1874) в 30-х годах прошлого столетия. «Гальванопластика принадлежит исключительно России, — писал о своем открытии Якоби, — здесь она получила свое начало и образование». Первым практически важным применением гальванопластики в России было изготовление точных клише для печатания различных государственных бумаг, в том числе денежных знаков.
Этот способ был открыт русским академиком Б. С. Якоби (1801 —1874) в 30-х годах прошлого столетия. «Гальванопластика принадлежит исключительно России, — писал о своем открытии Якоби, — здесь она получила свое начало и образование». Первым практически важным применением гальванопластики в России было изготовление точных клише для печатания различных государственных бумаг, в том числе денежных знаков.
Электролизу можно подвергать не только водные растворы электролитов, но и многие вещества в расплавленном состоянии. Плавление, так же как и растворение, разрушая кристаллическую решетку вещества, делает подвижными ионы, которые до этого были связаны в твердом кристалле, и дает им возможность перемещаться в электрическом поле. Электролизом расплавленной окиси алюминия получают один из важнейших металлов современной техники — алюминий. Почти все легко окисляющиеся металлы, как натрий, калий, кальций и др., тоже получаются путем электролиза их расплавленных солей или оснований.
201 202 203
Вы читаете, статья на тему Электролиз
Электролиз — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Электролитическая ячейка против гальванической ячейки
- Участники и атрибуты
Использование электрического тока для стимуляции несамопроизвольной реакции.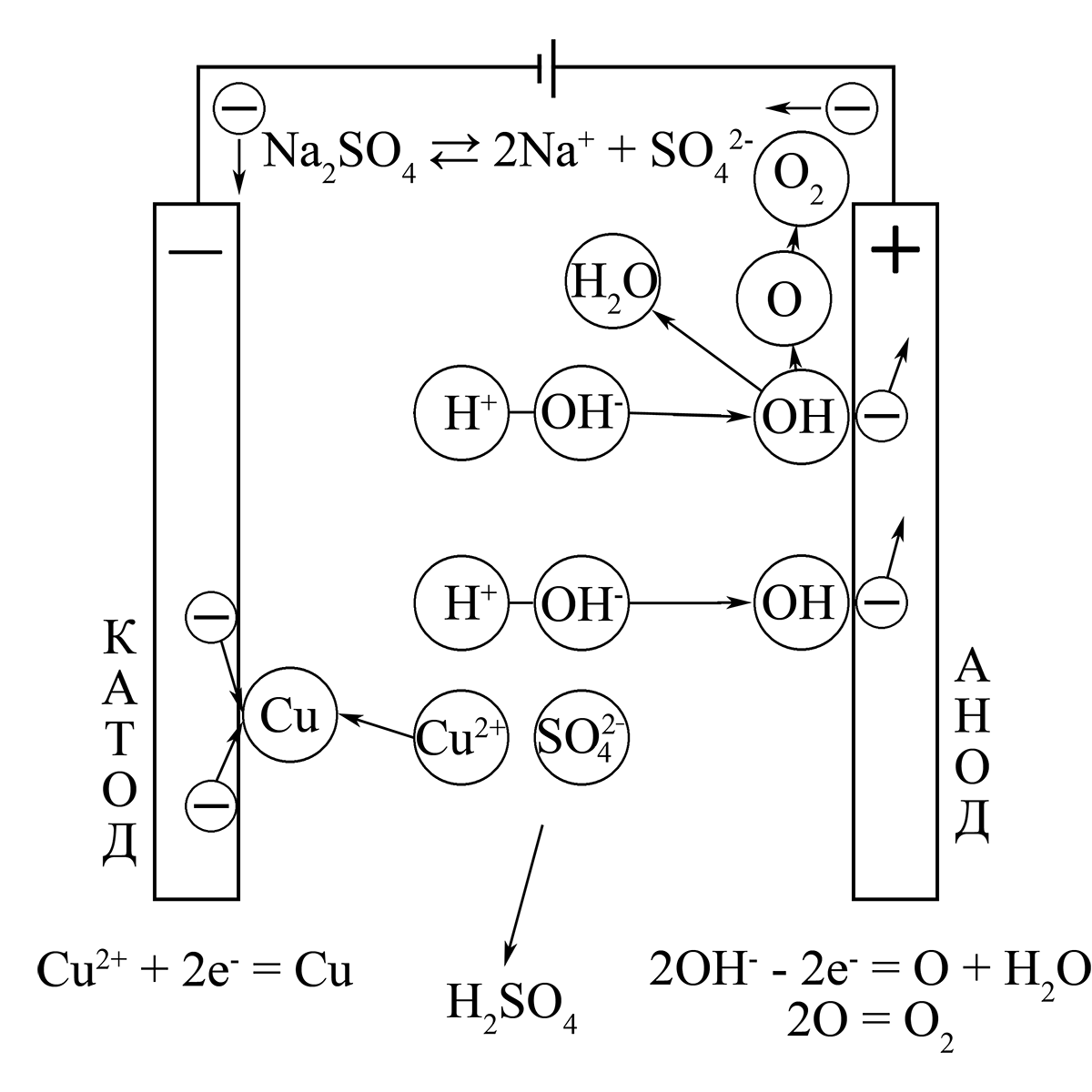 Электролиз можно использовать для разделения вещества на его исходные компоненты / элементы, и именно благодаря этому процессу был обнаружен ряд элементов, которые до сих пор производятся в современной промышленности. В электролизе — электрический ток, который он пропускает через электролит в раствор, чтобы стимулировать поток ионов, необходимый для протекания в противном случае не спонтанной реакции. Процессы, включающие электролиз, включают: электрорафинирование , электросинтез и хлорщелочной процесс .
Электролиз можно использовать для разделения вещества на его исходные компоненты / элементы, и именно благодаря этому процессу был обнаружен ряд элементов, которые до сих пор производятся в современной промышленности. В электролизе — электрический ток, который он пропускает через электролит в раствор, чтобы стимулировать поток ионов, необходимый для протекания в противном случае не спонтанной реакции. Процессы, включающие электролиз, включают: электрорафинирование , электросинтез и хлорщелочной процесс .
Электролитическая ячейка и гальваническая ячейка
Пример. Когда мы электролизуем воду, пропуская через нее электрический ток, мы можем разделить ее на водород и кислород.
\ [2 H_2O (l) \ rightarrow 2H_2 (g) + O_2 (g) \]
Дополнительная информация: Электролиз воды
Электролитическая ячейка — это, по сути, гальваническая ячейка несамопроизвольной реакции (фактически, если мы изменили поток электричества в гальванической ячейке, превысив необходимое напряжение, мы создали бы электролитическую ячейку). Электролитические ячейки состоят из двух электродов (один действует как катод, а второй — как анод) и электролита. В отличие от гальванического элемента, реакции с использованием электролитических элементов должны быть электрически индуцированы, а его анод и катод меняются местами (анод слева, катод справа).
Электролитические ячейки состоят из двух электродов (один действует как катод, а второй — как анод) и электролита. В отличие от гальванического элемента, реакции с использованием электролитических элементов должны быть электрически индуцированы, а его анод и катод меняются местами (анод слева, катод справа).
| Гальванический | Электролитический |
| Окисление: X → X + + e — (отрицательный анод) | Y → Y + + e — (положительный анод ) |
| Редукция: Y + + e — → Y (положительный катод) | X + + e — → X (отрицательный катод) |
| В целом: X + Y + → X + + Y (G <0) | X + + Y → X + Y + (G> 0) |
| Эта реакция является спонтанной и высвободит энергию | Это реакция несамопроизвольная и будет поглощать энергию |
Соавторы и авторство
16. 7. Электролиз: использование электричества для химии
7. Электролиз: использование электричества для химии
До сих пор мы обсуждали, как можно производить электричество в результате химических реакций в батареях. Вместо этого некоторые реакции будут использовать электричество, чтобы вызвать реакцию. В этих реакциях к реагентам передается электрическая энергия, заставляя их реагировать с образованием продуктов. Эти реакции имеют много применений. Например, электролиз — это процесс, при котором электричество пропускается через жидкость или раствор, чтобы вызвать реакцию.Реакции электролиза не начнутся, если в систему не будет подана энергия извне. В случае реакций электролиза энергию обеспечивает аккумулятор. Думайте об электролизе и электролитических ячейках как о противоположности электрохимических элементов:
|
Ячейки электрохимические |
Ячейки электролитические |
|
|---|---|---|
| Преобразование энергии |
Химическая промышленность → Электротехника |
Электрический → Химический |
| Самопроизвольная химическая реакция? |
Есть |
Нет |
| Значение E ° |
Положительно |
отрицательный |
В электрохимической ячейке спонтанная окислительно-восстановительная реакция используется для создания электрического тока; в электролитической ячейке произойдет обратное — потребуется электрический ток, чтобы вызвать несамопроизвольную химическую реакцию.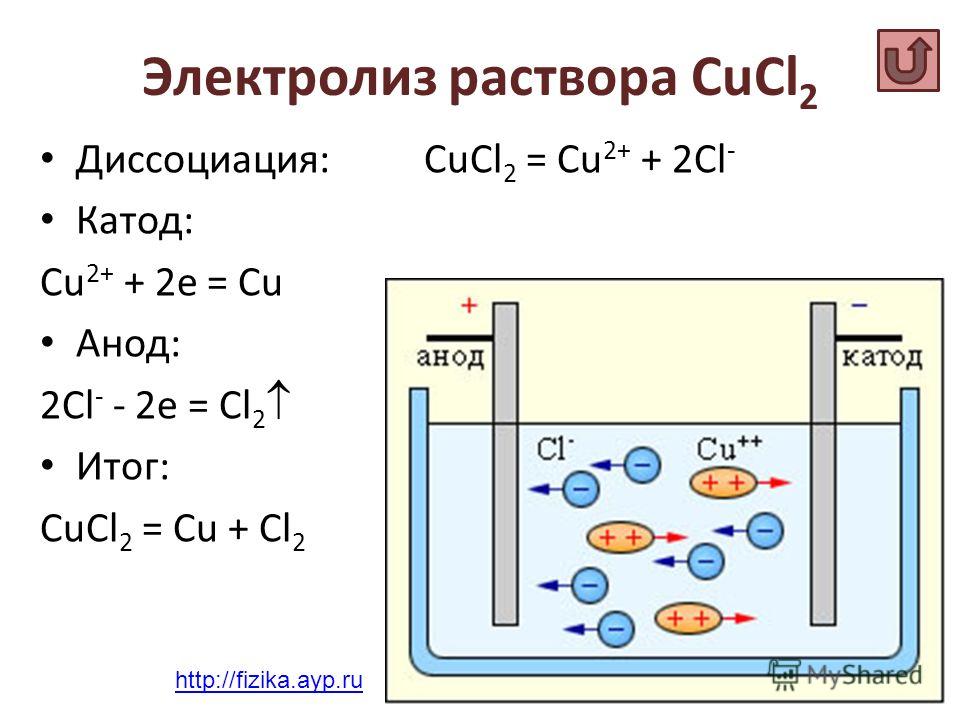 Мы рассмотрим три примера электролитического процесса, сохраняя наше обсуждение на самом базовом уровне: электролиз расплавленного хлорида натрия, электролиз воды и гальваника.
Мы рассмотрим три примера электролитического процесса, сохраняя наше обсуждение на самом базовом уровне: электролиз расплавленного хлорида натрия, электролиз воды и гальваника.
Если электроды, подключенные к клеммам батареи, поместить в жидкий хлорид натрия, ионы натрия будут перемещаться к отрицательному электроду и уменьшаться, в то время как ионы хлора перемещаются к положительному электроду и окисляются.-} \ rightarrow 2 \ ce {Na} + \ ce {Cl_2} \]
При соответствующей обработке аккумулятора можно добиться прочного прилипания восстанавливаемого в процессе электролиза металла к электроду. Использование электролиза для покрытия одного материала слоем металла называется гальваника . Обычно гальваникой покрывают дешевый металл слоем более дорогого и привлекательного металла. Многие женщины покупают украшения, покрытые золотом. Иногда гальваника используется для получения металла с поверхности, который лучше проводит электричество. Если вы хотите иметь поверхностные свойства золота (привлекательный, коррозионно-стойкий или хороший проводник), но не хотите, чтобы изготовление всего объекта из цельного золота было дорогостоящим, ответом может быть использование дешевого металла. чтобы сделать объект, а затем нанесите на его поверхность тонкий слой золота.
Если вы хотите иметь поверхностные свойства золота (привлекательный, коррозионно-стойкий или хороший проводник), но не хотите, чтобы изготовление всего объекта из цельного золота было дорогостоящим, ответом может быть использование дешевого металла. чтобы сделать объект, а затем нанесите на его поверхность тонкий слой золота.
Для серебряной пластины такой предмет, как ложка (посуда с покрытием дешевле, чем чистое серебро), ложку помещают в положение катода в установке для электролиза с раствором нитрата серебра.При включении тока ионы серебра мигрируют через раствор, касаются катода (ложки) и прилипают к нему. При наличии достаточного времени и осторожности всю ложку можно покрыть слоем серебра. Анодом для этой операции часто может быть большой кусок серебра, из которого ионы серебра будут окисляться, и эти ионы будут попадать в раствор. Это способ обеспечить стабильную подачу ионов серебра для процесса нанесения покрытия.
- Половина реакции на катоде:
\ [\ ce {Ag ^ +} + \ ce {e ^ -} \ rightarrow \ ce {Ag} \]
- Полуреакция на аноде:
\ [\ ce {Ag} \ rightarrow \ ce {Ag ^ +} + \ ce {e ^ -} \]
Некоторый процент проданных золотых и серебряных украшений гальванизирован. Точки подключения в электрических переключателях часто покрываются золотом для улучшения электропроводности, а большинство хромированных деталей в автомобилях хромированы.
Точки подключения в электрических переключателях часто покрываются золотом для улучшения электропроводности, а большинство хромированных деталей в автомобилях хромированы.
Электролиз расплавленного хлорида натрия
Если мы посмотрим на латинские корни слова «электролиз», мы узнаем, что оно означает, по сути, «разрушение» ( лизис, ) с помощью электричества. В нашем первом примере электролитической ячейки будет рассмотрено, как можно использовать электрический ток для разрушения ионного соединения на его элементы.Следующее уравнение представляет собой распад NaCl ( l ) :
2NaCl ( л ) → 2Na ( л ) + Cl 2 (г)
В этом процессе участвуют следующие полуреакции:
|
E ° |
|||
| уменьшение | 2Na + (л) + 2e — → Na (с) |
-2. |
|
| окисление | Класс — (л) → Класс 2 (г) + 2 e — |
-1,36 В |
|
|
|
|||
|
Требуемое сетевое напряжение |
— 4.07V |
||
Обратите внимание, что при суммировании полуреакций получается отрицательное напряжение (-4,07 В). Это говорит нам, что общая реакция НЕ будет спонтанной, и для того, чтобы эта реакция произошла, потребуется минимум 4,07 вольт.
Как мы увидим, наша установка будет во многом похожа на наши электрохимические ячейки. Нам потребуются электроды и электролит, чтобы проводить электрический ток.
Нам потребуются электроды и электролит, чтобы проводить электрический ток.
В нашем примере с NaCl электроды просто пропускают ток, но в противном случае не будут напрямую участвовать в реакции.Электролитом будет фактический расплавленный (расплавленный) NaCl. Электроды и электролит должны пропускать электрический ток. Необходимо использовать расплавленный NaCl, потому что твердые ионные соединения не несут электрический заряд.
Некоторые ключевые отличия от устройства электрохимической ячейки:
- Две половинные реакции не разделены солевым мостиком.
- Потребуется электрохимический элемент (или другой источник электрического тока).
Другое важное примечание:
- Анод электролитической ячейки является местом окисления, а катод — местом восстановления, как и в электрохимической ячейке.
- В электрохимической ячейке анод отрицательный, а катод положительный, но в электролитической ячейке все наоборот — анод положительный, а катод отрицательный.

Внимательно изучите схему нашей установки, уделяя особое внимание отслеживанию пути электронов. Пока электроны не совершат полный цикл, реакция не произойдет.
-
- Электроны «производятся» в батарее на аноде, в месте окисления.
- Электроны покидают электрохимическую ячейку через внешнюю цепь.
- Эти отрицательные электроны создают отрицательный электрод в электролитической ячейке, который притягивает положительные ионы Na + в электролите. Ионы Na + соединяются со свободными электронами и восстанавливаются (2Na + + 2e — → Na).
- Между тем, отрицательный Cl — притягивается к положительному электроду электролитической ячейки. На этом электроде хлор окисляется, выделяя электроны (Cl — → Cl 2 + 2 e — ).
- Эти электроны проходят через внешнюю цепь, возвращаясь в электрохимическую ячейку.
Электролиз воды
Наш второй пример электролиза и электролитических ячеек связан с разложением воды. Мы обнаружим ситуацию, очень похожую на электролиз расплавленного NaCl. Следующее уравнение представляет разделение H 2 O ( l ) :
2H 2 O ( л ) → 2H 2 ( г ) + O 2 (г)
Может быть труднее предсказать вовлеченные полуракции, но они:
|
E ° |
|||
| уменьшение | 2H 2 O ( л ) + 2e — → H 2 + 2 OH — |
-0.83 В |
|
| окисление | 2H 2 O ( л ) → O 2 + 4H + + 4e — |
-1,23 В |
|
(см. Примечание ниже для чистого уравнения) Примечание ниже для чистого уравнения) |
|
||
|
Требуемое сетевое напряжение |
— 2.06V |
||
Настройка будет очень похожа на наш последний пример с некоторыми небольшими отличиями. Вода плохо переносит заряд, поэтому в воду добавляется электролит. Можно использовать уксус или слабую кислоту (уксусную кислоту). Для сбора образовавшихся газов водорода и кислорода часто добавляют перевернутые пробирки, как показано на схеме ниже.
Опять же, обратите особое внимание, чтобы проследить путь электронов. Пока электроны не совершат полный цикл, реакция не произойдет.
2H 2 O ( л ) + 2e — → H 2 ( г ) + 2 OH — (водн.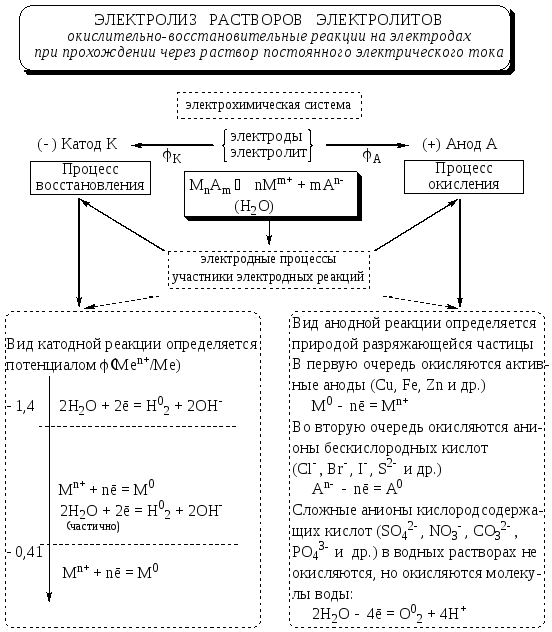 )
)
2H 2 O ( л ) → O 2 (г) + 4H + (водн.) + 4e —
-
- Электроны «производятся» в батарее на аноде, в месте окисления.
- Электроны покидают электрохимическую ячейку через внешнюю цепь.
- Эти отрицательные электроны создают отрицательный электрод в электролитической ячейке, который вызывает уменьшение содержания воды.
Обратите внимание, что область вокруг этого электрода станет основной по мере образования ионов OH —.
- При этом вода в положительном электроде будет окисляться.
- Электроны, образующиеся в процессе окисления, возвращаются в электрохимическую ячейку.
Примечание о сбалансированном уравнении электролиза воды:
Из полуреакций вы можете заметить, что сложение уравнений изначально не дает нам нашего чистого уравнения:
2H 2 O ( л ) → 2H 2 ( г ) + O 2 (г)
После того, как вы уравновесите количество электронов (умножьте уравнение редукции на 2), вы обнаружите, что в сумме уравнения на самом деле составляют:
6H 2 O ( л ) → 2H 2 ( г ) + O 2 (г) + 4H + (водн.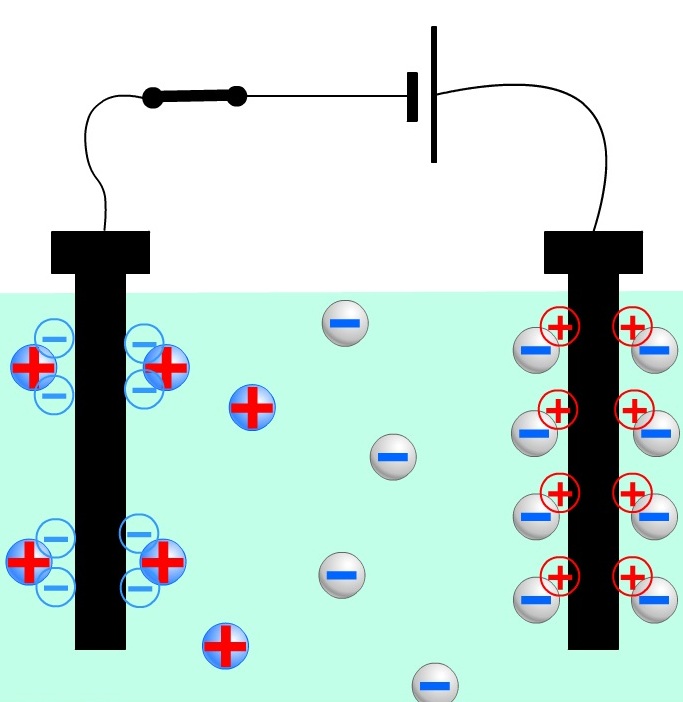 ) + 4 OH — (водн. )
) + 4 OH — (водн. )
Ионы водорода и гидроксида объединятся с образованием 4 моль H 2 O ( l ) .Определение чистого количества H 2 O ( l ) дает нам окончательное уравнение:
2H 2 O ( л ) → 2H 2 ( г ) + O 2 (г)
Сводка
- Электрохимические ячейки состоят из анода и катода в двух отдельных растворах. Эти растворы соединены солевым мостиком и токопроводящим проводом.
- Электрический ток состоит из потока заряженных частиц.
- Электрод, на котором происходит окисление, называется анодом, а электрод, на котором происходит восстановление, называется катодом.
- При нанесении гальванических покрытий объект, который нужно покрыть, выполнен в виде катода.
Словарь
- Электрохимический элемент — расположение электродов и ионных растворов, в котором окислительно-восстановительная реакция используется для производства электричества (также известного как батарея).

- Электролиз — химическая реакция, вызываемая электрическим током.
- Гальваника — процесс, в котором электролиз используется как средство покрытия объекта слоем металла.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или широко) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
-
Фонд CK-12 Шарон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Электролиз. Электролиз растворов. Электролиз расплавов
Электролиз — это окислительно-восстановительный процесс, который происходит на электродах, когда электрический ток пропускается через расплав или раствор.
Электролиз — еще один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно проводить дома. Нужен источник тока, два электрода (виды электродов, любые случаи этих процессов будут рассмотрены позже) и, конечно же, электролит. Электролит — это раствор, проводящий электрический ток.
Электролит — это раствор, проводящий электрический ток.
Имеется электролиза растворов и электролиз расплавов. Оба эти процесса существенно отличаются друг от друга. Отличие в том, что в наличии растворитель. При электролизе растворов помимо ионов вещества в процессе участвуют ионы растворителя. При электролизе расплавляется — только ионы самого вещества.
Чтобы получить желаемый продукт (газ, металл или неметалл), нужно выбрать электрод и раствор электролита. Электроды могут быть из любых материалов, проводящих электрический ток. Чаще всего используются металлы и сплавы, неметаллические электроды могут быть, например, графитовыми стержнями (или углеродными). Реже в качестве электрода используется жидкость.
Положительно заряженный электрод является анодом. Электрод заряжен отрицательно, является катодом. Во время электролиза происходит окисление анода (он растворяется) и восстановление катода.Следовательно, анод следует брать так, чтобы растворение не влияло на химический процесс, протекающий в растворе или расплаве. Такой анод называется инертным электродом . В качестве инертного анода может использоваться графит (углерод) или платина.
В качестве катода можно взять металлическую пластину (она не растворяется). Подходит медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавеющая сталь.
В домашних условиях из тех веществ, которые присутствуют практически в каждом, вы легко можете получить, например, кислород, водород, хлор, медь, серу, а также слабую кислоту или щелочь!
Но будьте осторожны с хлором — этот газ ядовит !!
Первый опыт проведем с целью получения водорода и кислорода.
Сделайте электролит из раствора пищевой соды (также можно взять кальцинированную соду), поместите в него электроды и включите блок питания. Как только через раствор пойдет ток, сразу становятся видны пузырьки газа, которые образуются на электродах: на «+» будет выделяться кислород, на «-» водород
Это потому, что отрицательные ионы OH — вызывают накопление около анода «+» и восстановление кислорода, а около катода «-» аккумулируют ионы щелочного металла, содержащиеся в растворе кальцинированной соды (Na 2 CO 3 ) с положительным зарядом (Na + ) и одновременным восстановлением водорода.Восстановление ионов натрия до чистого металла (Na) не происходит, поскольку металлический натрий находится в левой части водорода в диапазоне напряжений металлов.
Li Следующим опытом электролиза будет чистая медь (Cu). Для этого нам понадобится раствор сульфата меди CuSO 4 , который содержит растворенную медь.Медь стоит после водорода в диапазоне напряжений металлов, поэтому на электроде она будет выделяться.
Приготовьте раствор медного купороса, поместите в него электроды и включите питание. Как и в предыдущем опыте с раствором кальцинированной соды, анод «+» будет восстанавливать кислород. В то же время катод «-» будет покрывать темно-красный слой (медь-Cu), который восстанавливается из раствора до чистого металла.
У нас было 2 опыта электролиза растворов и можем подвести итог:
Катионы обычно все металлы и водород. Но в некоторых химических соединениях катионы — это газы и неметаллы.
Это зависит от степени окисления элемента в химическом соединении.
Будет еще один опыт электролиза.На этот раз пропустим ток через раствор хлорида натрия (NaCl). Но должен вас предупредить, этот электролиз следует проводить в хорошо проветриваемом помещении, так как выделяющийся из раствора чистый газ — хлор (Cl 2 ) очень токсичен. если вы хотите собрать этот газ (или другой газ), вы можете использовать следующую схему.
Итак, приступим. Приготовьте раствор хлорида натрия (NaCl).Положительный полюс источника питания соединяется с инертным электродом (например, графитовым стержнем), отрицательный полюс может быть из любого подходящего материала, проводящего ток. Поместите электроды в раствор и включите питание. Через несколько секунд вы уже можете почувствовать неприятный запах хлора (это хлор!). Не переборщите с запахом! Хлор выделяется на аноде в виде маленьких пузырьков («+»). Чем дольше будет процесс электролиза, тем больше будет концентрация хлора рядом с электролитом.Если вы собираете хлор в пробирке или банке (хлор тяжелее воздуха, он будет найден на дне), не пытайтесь «понюхать» его в банке — может сильно отравиться! (Статья про хлор).
Итак, чистый газообразный хлор восстанавливается на аноде. На катоде из раствора извлекают чистый водород (H 2 ) и извлекают H 2 и извлекают натрий, который немедленно реагирует с водой и образует едкий натр.
Электролиз расплавов
При электролизе расплавов в процесс вовлекаются ионы вещества, подвергаемого электролизу.Например, при электролизе расплавленной соли (NaCl) на аноде будет выделяться тот же газ — хлор, но на катоде будет восстанавливаться чистый металл — натрий (Na), а не водород. Это метод, используемый в промышленности для получения металлического натрия и других щелочных металлов.
Таким же способом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)) с проведением тока через расплавы их солей.
1
Электролиз
2
Вещества Вещи определенного состава.
3
Соединения Соединения нельзя физически разделить на элементы, как смеси. Необходимо использовать химическую реакцию для разделения соединений на элементы. Можно использовать несколько различных типов химических реакций.
4
Электролиз для разрушения Электролиз: использование электричества для разрушения соединения на его элементы. Постоянный ток (DC) В воде на отрицательно заряженном катоде происходит реакция восстановления, при которой электроны (e-) от катода передаются катионам водорода для образуют водородный газ (половина реакции, уравновешенная кислотой): Катод (восстановление): 2H + (aq) + 2e- → h3 (g) На положительно заряженном аноде происходит реакция окисления, генерирующая газообразный кислород и отдающая электроны катоду для замкните цепь: Анод (окисление): 2h3O (l) → O2 (g) + 4H + (водн.) + 4e- Те же половинные реакции могут быть уравновешены основанием, как указано ниже.Не все полуреакции необходимо уравновешивать кислотой или основанием. Многим нравится перечисленное здесь окисление или восстановление воды. Чтобы добавить половину реакции, обе они должны быть сбалансированы кислотой или основанием. Катод (восстановление): 2h3O (l) + 2e− → h3 (g) + 2OH− (aq) Анод (окисление): 4OH− (aq) → O2 (g) + 2h3O (l) + 4e− Объединение любой из половин реакции пара приводит к одинаковому общему разложению воды на кислород и водород: Общая реакция: 2h3O (l) → 2h3 (g) + O2 (g) Таким образом, количество образованных молекул водорода в два раза превышает количество молекул кислорода.Если предположить, что температура и давление для обоих газов одинаковы, полученный газообразный водород имеет вдвое объем произведенного газообразного кислорода. Количество электронов, проталкиваемых через воду, в два раза превышает количество генерируемых молекул водорода и в четыре раза больше количества генерируемых молекул кислорода. Вода (постоянный ток) Газообразный водород + газообразный кислород h3O (DC) H O
5
Электролиз воды, кислорода, водорода
6
Как мы можем проверить собранные газы?
7
Ограничения электролиза Современные технологии с использованием пакетов мембран из полимерных электролитов, также называемые протонообменными мембранами или PEM, были разработаны для более эффективного электролиза воды, чем предыдущие электролизеры на щелочных растворах.Эти системы электролиза PEM могут быть спроектированы как система уравновешенного давления, где O 2 и H 2 работают при одном и том же давлении, или как система перепада давления, где O 2 и H 2 работают при разных давлениях. Преимущество электролиза под высоким давлением H 2 состоит в том, что он сводит к минимуму необходимость механического сжатия второй стадии для создания давления для хранения. В конструкциях с перепадом или сбалансированным давлением регулирование давления газов O 2 и H 2 чрезвычайно важно для эффективности и срока службы электролизера PEM.Equilibar предлагает семейство регуляторов противодавления для управления процессом электролиза в диапазоне давлений, высоких или низких, с максимальной точностью. Исследователи в области энергетики оптимизируют электролиз для получения водорода в качестве источника энергии из возобновляемых источников. Ветровые турбины и фотоэлектрические элементы могут использоваться в качестве источников электроэнергии для электролизера для производства водорода для водородных топливных элементов. Цель состоит в том, чтобы увеличить использование возобновляемых источников энергии и снизить выбросы углерода. Кислород, образующийся в результате реакции, может быть использован для различных целей, включая пригодный для дыхания O2 для космических путешествий и подводных лодок. Электролиз с проточной ячейкой, который используется для космических полетов, использует электролизер с проточной водой для выработки кислорода из воды, достаточного для удовлетворения метаболических потребностей экипажа. Многие современные конструкции электролизеров требуют последующего разделения газа и жидкости, что создает проблемы в условиях микрогравитации.Одной из проблем является двухфазный поток, вызванный образованием пузырьков в электролизере. Исследователи из Университета Колорадо в Боулдере предложили альтернативную конфигурацию электролизера и построили прототип с вакуумным регулятором Equilibar®. Ознакомьтесь с ситуацией по ссылке справа. Регулятор обратного давления Equilibar® имеет купольную нагрузку и, благодаря своей новой конструкции с несколькими отверстиями, обеспечивает мгновенное надежное управление в самых сложных условиях. Конструкция с нагруженным куполом означает, что требуется давление жидкости (обычно воздух или азот) на купол регулятора противодавления, соответствующее желаемому входному давлению.
Ток, проходящий через раствор на положительном электроде — аноде, восстанавливает отрицательно заряженные ионы (в нашем случае кислород).Отрицательно заряженные ионы называются анионами . На отрицательном электроде — катоде — положительные ионы (в данном случае водород и медь) перевернуты. Положительные ионы называются катионами .
Электролиз раствора пищевой соли. Схема получения газа
Определение электролиза | Чегг.com
Электролиз — это химический процесс, при котором постоянный электрический ток (I) пропускается через электролит, содержащий ионные соединения, которые могут находиться в расплавленном состоянии или в водной фазе. Во время электролиза анион движется к аноду, а катион движется к катоду. Экспериментальная установка, в которой происходит электролиз, называется электролитической ячейкой.
Электролитические ячейки: В электролитической ячейке происходит реакция электролиза. Реакции, происходящие в электролитической ячейке, всегда не являются спонтанными.Внешняя электронная энергия используется для запуска этой неспонтанной реакции. В этой ячейке анод расположен справа, а катод — слева.
На аноде происходит реакция окисления, а на катоде — реакция восстановления. Анионы мигрируют к аноду и высвобождаются. Точно так же катионы мигрируют к катоду и откладываются.
Если в растворе присутствует более одного катиона или аниона:
Электрохимический ряд: Электрохимический ряд — это ряд расположения металлов в восстановительном потенциале металлов.
Связь между зарядом и током в электролитической ячейке связана следующими уравнениями.
Окисление:
Приобретение кислорода или потеря водорода или потеря электрона в частицах во время окислительно-восстановительной реакции называется окислением.Во время электролиза на аноде происходит окисление. Например.
Восстановление:
Потеря кислорода или увеличение водорода или увеличение количества электрона в частицах во время окислительно-восстановительной реакции называется восстановлением. Во время электролиза восстановление происходит на катоде. Например:
Что такое электролиз и пример?
Электролиз — это химический процесс, при котором постоянный электрический ток (I) пропускается через электролит, содержащий ионные соединения, которые могут находиться либо в расплавленном состоянии, либо в водной фазе.Во время электролиза анион движется к аноду, а катион движется к катоду. Экспериментальная установка, в которой происходит электролиз, называется электролитической ячейкой.
Электролитические ячейки: В электролитической ячейке происходит реакция электролиза. Реакции, происходящие в электролитической ячейке, всегда не являются спонтанными. Внешняя электронная энергия используется для запуска этой неспонтанной реакции. В этой ячейке анод расположен справа, а катод — слева.
На аноде происходит реакция окисления, а на катоде — реакция восстановления. Анионы мигрируют к аноду и высвобождаются. Точно так же катионы мигрируют к катоду и откладываются.
Если в растворе присутствует более одного катиона или аниона:
Металлургия; электролитическая очистка
Одно из наиболее важных применений электролиза — это металлургические процессы. Извлечение и очистка большинства металлов из его руд осуществляется с помощью электролиза. Электролиз — это химический процесс, при котором постоянный электрический ток пропускается через электролит, содержащий ионные соединения, которые могут находиться либо в расплавленном состоянии, либо в водной фазе. Во время электролиза анион движется к аноду, а катион движется к катоду.
Гальваника
Гальваника — это процесс покрытия одного металла поверх другого. Обычно химически активные металлы защищаются покрытием из нереактивных металлов для предотвращения коррозии за счет увеличения срока службы материалов и в качестве изоляторов. Гальваника также применяется для украшения орнаментов.
Как в реальной жизни используется электролиз?
Металлургия; электролитическая очистка
Одно из наиболее важных применений электролиза — это металлургические процессы.Извлечение и очистка большинства металлов из его руд осуществляется с помощью электролиза. Электролиз — это химический процесс, при котором постоянный электрический ток пропускается через электролит, содержащий ионные соединения, которые могут находиться либо в расплавленном состоянии, либо в водной фазе. Во время электролиза анион движется к аноду, а катион движется к катоду.
Гальваника
Гальваника — это процесс покрытия одного металла поверх другого. Обычно химически активные металлы защищаются покрытием из нереактивных металлов для предотвращения коррозии за счет увеличения срока службы материалов и в качестве изоляторов.Гальваника также применяется для украшения орнаментов.
Электротипирование
Электротипирование — это процесс, в котором маркированная восковая фигура, покрытая углеродом, действует как электроды, на которые осаждаются тонкие листы металлической меди.
Электроремонт
Электроремонт — это процесс, при котором воск наносится на части, кроме поврежденных частей оборудования или механизмов, и погружается в электролизную ванну. Во время электролиза поврежденная часть залечивается напылением металла.
Электрический элемент
Разница в напряжении электрического элемента возникает из-за электролиза. Эти электрические элементы могут вырабатывать электричество.
Электролиз воды
Производство чистого газообразного водорода и газообразного кислорода без каких-либо вредных веществ — очень сложный процесс. Этого можно достичь гидролизом. Электролиз воды дает газообразный водород и газообразный кислород в качестве продуктов.
Почему алюминий нужно извлекать электролизом?
Одно из наиболее важных применений электролиза — это металлургические процессы.Извлечение и очистка большинства металлов из его руд осуществляется с помощью электролиза. Электролиз — это химический процесс, при котором постоянный электрический ток пропускается через электролит, содержащий ионные соединения, которые могут находиться либо в расплавленном состоянии, либо в водной фазе. Во время электролиза анион движется к аноду, а катион движется к катоду. Экспериментальная установка, в которой происходит электролиз, называется электролитической ячейкой.
При извлечении металлов в качестве электролита используется раствор металлов, смешанных с другими металлами или примесями.При извлечении алюминия алюминиевая руда, бокситы подвергаются множеству обработок, удаляются все более крупные примеси и, наконец, получается оксид алюминия. От оксида алюминия алюминий очищают гидролизом. При электролизе раствор оксида алюминия в расплавленном криолите (руда алюминия) используется в качестве раствора электролита. Углеродные стержни используются в качестве анода, а углеродная футеровка вдоль стенок стального резервуара действует как катод. Ячейка работает с разностью потенциалов, но при больших токах около или более и температуре.Во время электролиза алюминий выделяется на катоде, а кислород выделяется на аноде. Электролиз проводится для извлечения алюминия, поскольку он занимает более высокое место в ряду реактивности. Только элементы, более реактивные, чем интересующий элемент, могут уменьшить его. Элементами выше алюминия в ряду реакционной способности являются цезий, франций, рубидий, калий, натрий, литий, барий, радий, стронций, кальций, магний и бериллий. Эти элементы также извлекаются электролизом и имеют различное промышленное применение.Очищенные таким образом элементы используются для восстановления другого металла, и тогда стоимость производства будет выше. Было бы недоступно управлять промышленностью, покупая более дорогое сырье. Поэтому прямой электролиз — это правильный способ извлечения алюминия, хотя электролиз является более дорогостоящим процессом. Электролиз. — ppt видео онлайн скачать
Презентация на тему: «Электролиз» — стенограмма презентации:
Включая элементы и соединения. Элемент — это только 1 тип атома Соединение — 2 или более типов атомов, химически связанных
Водород — «Поп-тест» Кислородный газ — «Повторное зажигание»
Может использоваться только с жидкостью, которая проводит электричество, или с расплавленным металлическим сплавом. Электролиз и контроль давления в электролизере —
Электролиз воды — это электрохимический процесс, в котором электричество расщепляет воду на водород и кислород. Эта реакция происходит в электролизере или электролизере, содержащем электролитическую среду между анодом и катодом. Технология электролизеров
Применение для электролиза
Технология Equilibar, используемая для электролиза для выработки кислорода в космосе

 71 В
71 В 