Что такое биосенсоры и как они работают. Какие виды биосенсоров существуют. Для чего используются биосенсоры в медицине. Как развиваются технологии биосенсоров. Какие перспективы у биосенсоров в будущем.
Что такое биосенсоры и принцип их работы
Биосенсоры — это аналитические устройства, использующие биологические материалы для обнаружения химических веществ. Они состоят из двух основных компонентов:
- Биорецептор — биологический компонент (ферменты, антитела, нуклеиновые кислоты и др.), который распознает целевое вещество
- Преобразователь — физический компонент, который преобразует биологический сигнал в измеримый электрический сигнал
Принцип работы биосенсора заключается в следующем:
- Биорецептор специфически связывается с целевым аналитом
- Это взаимодействие вызывает изменения в биорецепторе (конформационные, электрохимические и др.)
- Преобразователь детектирует эти изменения и генерирует соответствующий сигнал
Таким образом, биосенсоры позволяют быстро и специфично определять наличие и концентрацию различных веществ в образце. Их главные преимущества — высокая чувствительность, селективность и возможность миниатюризации.
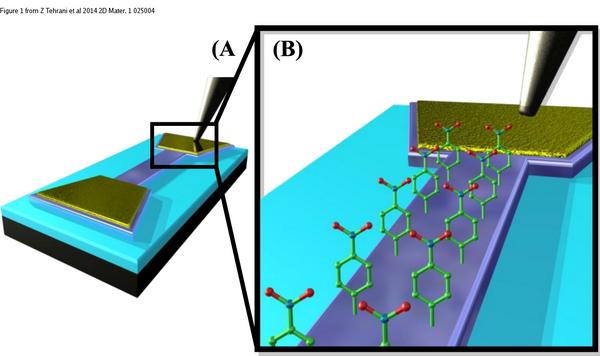
Основные виды биосенсоров
Существует несколько основных типов биосенсоров в зависимости от используемого биорецептора и способа преобразования сигнала:
По типу биорецептора:
- Ферментные биосенсоры
- Иммуносенсоры (на основе антител)
- ДНК-сенсоры
- Клеточные биосенсоры
- Аптасенсоры (на основе аптамеров)
По типу преобразователя:
- Электрохимические (амперометрические, потенциометрические)
- Оптические
- Пьезоэлектрические
- Термические
Выбор типа биосенсора зависит от задачи анализа, свойств определяемого вещества и требуемых характеристик.
Применение биосенсоров в медицине
Биосенсоры находят широкое применение в медицинской диагностике благодаря своим уникальным возможностям:
- Экспресс-анализ биологических жидкостей (кровь, моча и др.)
- Непрерывный мониторинг физиологических параметров
- Диагностика инфекционных заболеваний
- Определение биомаркеров рака и других патологий
- Контроль действия лекарственных препаратов
Наиболее распространенный пример — глюкометры для контроля уровня сахара в крови у диабетиков. Также разрабатываются биосенсоры для диагностики сердечно-сосудистых заболеваний, онкомаркеров, гормонов и других важных показателей.

Современные тенденции в разработке биосенсоров
Основные направления развития технологий биосенсоров включают:
- Повышение чувствительности и специфичности
- Миниатюризация и создание портативных устройств
- Разработка мультипараметрических биосенсоров
- Использование наноматериалов и нанотехнологий
- Создание неинвазивных и имплантируемых биосенсоров
- Интеграция с мобильными устройствами и облачными технологиями
Активно ведутся исследования по созданию «умных» биосенсоров с возможностью беспроводной передачи данных и автоматического анализа результатов.
Перспективы использования биосенсоров
Биосенсорные технологии имеют огромный потенциал для развития персонализированной и превентивной медицины. В будущем биосенсоры могут найти следующее применение:
- Непрерывный мониторинг здоровья с помощью носимых устройств
- Ранняя диагностика заболеваний на основе анализа биомаркеров
- Персонализированный подбор терапии и контроль ее эффективности
- Создание «умных» имплантатов для автоматической доставки лекарств
- Мониторинг окружающей среды и контроль качества продуктов питания
Развитие биосенсоров позволит сделать медицинскую диагностику более доступной, быстрой и точной, что значительно повысит качество здравоохранения.
Преимущества и недостатки биосенсоров
Биосенсорные технологии обладают рядом важных преимуществ по сравнению с традиционными методами анализа:
Преимущества:
- Высокая чувствительность и специфичность
- Быстрота анализа (от нескольких секунд до минут)
- Возможность миниатюризации и создания портативных устройств
- Простота использования, не требуется сложная пробоподготовка
- Возможность проведения анализа в режиме реального времени
- Низкая стоимость анализа при массовом производстве
Недостатки:
- Ограниченный срок хранения биологических компонентов
- Чувствительность к условиям окружающей среды (pH, температура)
- Возможность неспецифических взаимодействий
- Сложность разработки и производства
Несмотря на определенные недостатки, преимущества биосенсоров делают их перспективным инструментом для медицинской диагностики и мониторинга здоровья.
Примеры инновационных разработок биосенсоров
Ученые активно работают над созданием новых типов биосенсоров с улучшенными характеристиками. Вот несколько интересных примеров:
Графеновые биосенсоры
Использование графена в качестве материала для преобразователя позволяет значительно повысить чувствительность биосенсоров. Графеновые биосенсоры могут детектировать отдельные молекулы аналита.
Биосенсоры на основе аптамеров
Аптамеры — это короткие одноцепочечные молекулы ДНК или РНК, способные специфически связываться с целевыми молекулами. Они обладают высокой аффинностью и стабильностью, что делает их перспективными биорецепторами.
Имплантируемые биосенсоры
Разрабатываются миниатюрные биосенсоры, которые можно имплантировать под кожу для непрерывного мониторинга различных показателей. Например, имплантируемые глюкометры для диабетиков.
Мультипараметрические биосенсоры
Создаются биосенсорные системы, способные одновременно определять несколько параметров. Это позволяет получать более полную картину состояния организма.
Эти и другие инновации открывают новые возможности для применения биосенсоров в медицине и других областях.
Биосенсор — все статьи и новости
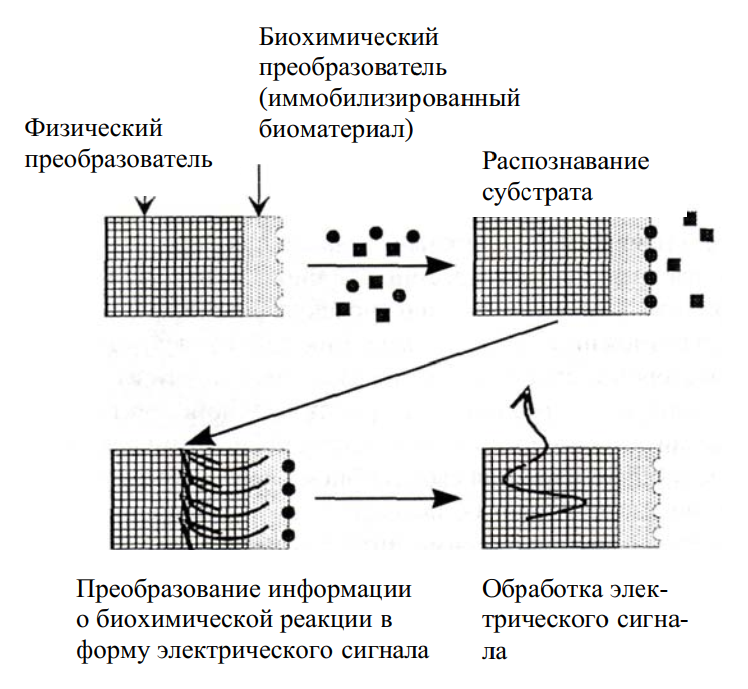
Биосенсор — прибор, который анализирует химический состав биологических соединений, используя биохимические реакции, протекающие в органеллах, клетках или тканях. Все биосенсоры состоят из трех частей: биоселективного элемента, чувствительного к искомому соединению, содержащемуся в анализируемом веществе; преобразователя (трансдьюсера), преобразовывающего результат взаимодействия этого элемента с анализируемым веществом в другой сигнал, который проще измерить; электронного устройства, отображающего этот сигнал в удобном для пользователя виде.
В качестве биоселективного элемента могут использоваться все виды биологических структур, такие как ферменты, антитела, рецепторы, живые клетки и пр. Трансдьюсерами могут быть различные преобразователи: электрохимические, оптические, гравитационные, калориметрические и резонансные системы. Теоретически любой биоселективный элемент можно комбинировать с любым из возможных трансдьюсеров, вследствие чего возникает большое разнообразие различных типов возможных биосенсоров.
Наиболее распространенными являются сенсоры с ферментами и иммобилизованными клетками в качестве биоселективного элемента. Так, созданы клеточные биосенсоры для определения фенолов, глутамина, тиразина, молочных кислот и пр., существуют клеточные биосенсоры для анализа качества воды и сточных вод. Отдельной строкой можно указать так называемые биочипы, содержащие массивы биоселектиных элементов и способные делать множественный, в том числе и генетический, анализ биологического вещества. Главным преимуществом биосенсоров является скорость анализа, несопоставимо более высокая, чем скорость традиционных аналитических методов.
Автором биосенсорной концепции и создателем первого биосенсора считается американский биохимик Лейланд Кларк. В 1962 году, использовав изобретенный им «кислородный электрод», он создал прибор, определяющий содержание кислорода в биологической ткани (в первую очередь, в крови).
Сегодня наиболее популярным коммерческим биосенсором является глюкометр, в считанные секунды определяющий в крови содержание сахара.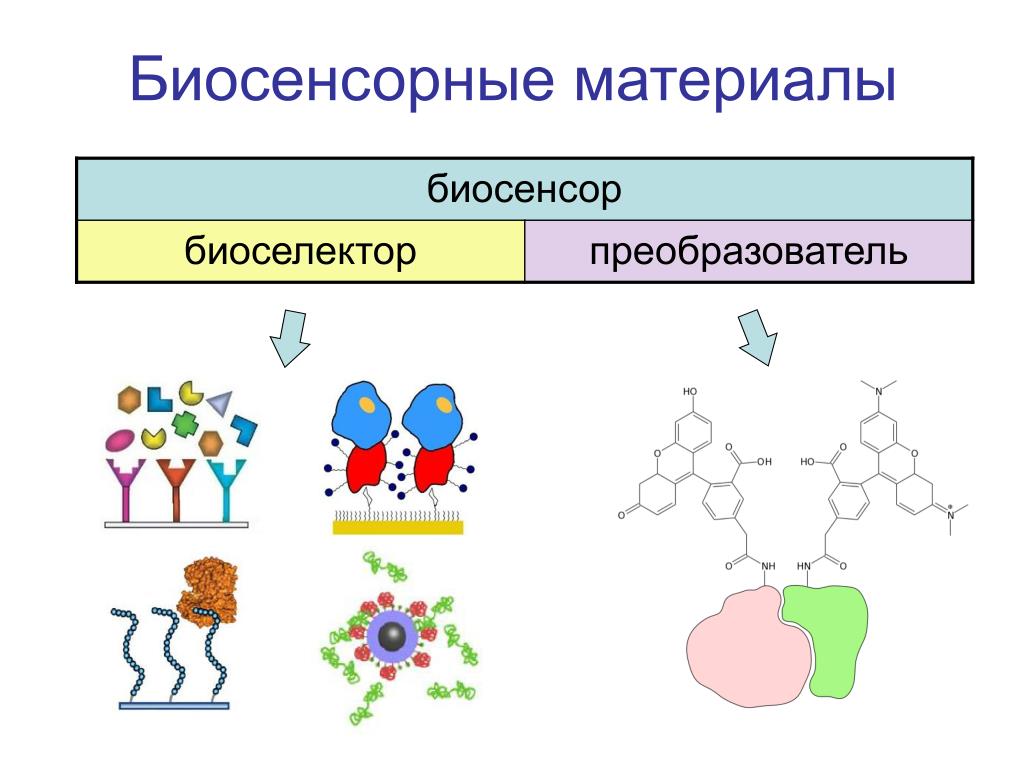
Фото: PerPlex/Wikimedia Commons
Биологи научились быстро пересобирать белковые биосенсоры под нужный патоген
Alfredo Quijano-Rubio et al. / Nature, 2021
Биосенсоры на основе белков играют важную роль в синтетической биологии. В фундаментальных исследованиях белковые сенсоры используют для изучения процессов, протекающих в клетках, а в медицине с их помощью, например, надеются предсказывать эффективность терапии для пациентов с онкологическими заболеваниями. Подобные сенсоры создаются на основе существующих в природе белков. Для этого подбирается белковый домен, который может связываться с целевой молекулой-мишенью, и соединяется с репортерным доменом, который выдает читаемый сигнал. Главный недостаток такого подхода — трудозатратность, потому что требуется много биоинженерных преобразований, чтобы получить эффективный биосенсор из этих двух доменов. Поэтому исследователи ищут универсальную платформу, на основе которой можно будет легко создавать биосенсоры на белковые молекулы различных патогенов или маркеров заболеваний, просто заменяя в нем необходимые «детали».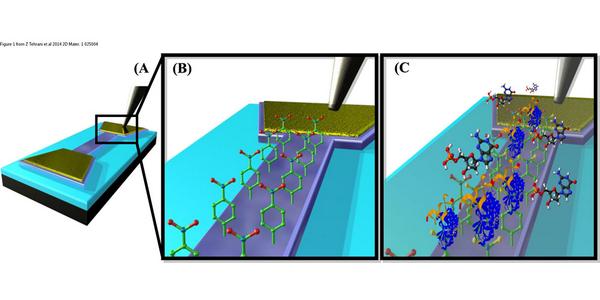
В качестве биосенсора может служить белковая система, обладающая двумя почти равными энергетическими состояниями. И присутствие молекулы-мишени должно регулировать, будет ли протекать реакция в сторону видимого ответа, например свечения или смены цвета.
Ученые выделяют три требования к потенциальной сенсорной системе: изменение в системе должно приводить к видимому результату; изменение в системе, которое приводит к видимому результату, не должно зависеть от молекулы-мишени, чтобы систему в целом можно было использовать для детекции разных веществ; и, наконец, система должна легко поддаваться настройке, чтобы можно было детектировать вещества с разными энергетическими характеристиками связывания с сенсором, и чтобы можно было регулировать минимальную детектируемую концентрацию.
Исследователи из Вашингтонского университета под руководством Дэвида Бэйкера (David Baker) создали белковую систему, которая удовлетворяет этим требованиям. Компоненты системы биологи назвали достаточно просто: клетка и ключ. Обе части содержат по кусочку люциферазы, и только когда ключ присоединяется к клетке, люцифераза становится целой и запускает реакцию свечения. В составе клетки два домена: сама клетка и соединенная с ней защелка. Защелка прикрывает собой то место, куда должен присоединиться ключ. В присутствии молекулы-мишени защелка связывается с ней, освобождая место для ключа, и издаваемое свечение говорит о том, что реакция прошла успешно.
Клетка с защелкой и ключ биосенсорной системы. В присутствии молекулы-мишени защелка связывается с ней, освобождая место для ключа.
Alfredo Quijano-Rubio et al. / Nature, 2021
Система устроена таким образом, что энергии связывания ключа с клеткой недостаточно, чтобы превзойти энергетические затраты открытия клетки в отсутствии мишени. Но в присутствии мишени дополнительная энергия связывания мишени с защелкой заставляет защелку открыться и приводит к свечению. Поскольку ключ и клетка всегда одни и те же, систему можно перестраивать под разные мишени, просто меняя связывающий ее домен в защелке. Функционирование системы зависит от термодинамического равновесия, поэтому задавая необходимые энергии связывания в системе, можно регулировать минимально детектируемые концентрации веществ.
Но в присутствии мишени дополнительная энергия связывания мишени с защелкой заставляет защелку открыться и приводит к свечению. Поскольку ключ и клетка всегда одни и те же, систему можно перестраивать под разные мишени, просто меняя связывающий ее домен в защелке. Функционирование системы зависит от термодинамического равновесия, поэтому задавая необходимые энергии связывания в системе, можно регулировать минимально детектируемые концентрации веществ.
Работоспособность системы проверили на ботулотоксине — ядовитом веществе, нейротоксине, который вырабатывается анаэробными бактериями и часто становится причиной серьезных отравлений консервами. Попадание ботулотоксина в организм с пищей вызывает сильные нарушения в работе нервной системы и паралич скелетных мышц. Моментальное определение причины отравления помогло бы быстрее оказать необходимую помощь, а превентивное тестирование пищи – предотвратить подобные случаи. Исследователи показали, что ответ на присутствие ботулотоксина Б виден уже через несколько минут. Схожим способом авторы работы определили наличие в растворе белка HER2, повышенная экспрессия которого у человека указывает на развитие определенных типов рака молочной железы, и маркера инфаркта миокарда.
Слева: схема «клетки» биосенсора на ботулотоксин: желтым выделена часть люциферазы, зеленым — домен, который связывается с молекулой ботулотоксина. Справа: интенсивность люминесценции системы в зависимости от времени в секундах.
Alfredo Quijano-Rubio et al. / Nature, 2021
Ученые не прошли мимо и пандемии коронавируса: они показали возможность детекции антител к ковиду и белка-«шипа» (spike protein) вируса, который он использует для проникновения в клетку. Также удалось обнаружить и присутствие вируса гепатита Б и антител к нему.
Авторы работы отмечают, что их разработка должна быть удобна в клиническом применении: вся реакция проходит в одной пробирке, результат виден практически мгновенно, и его можно точно оценить с помощью простой камеры мобильного телефона. De novo созданные белки хорошо нарабатываются клетками, поэтому проблем с массовым производством биосенсоров возникнуть не должно.
Ученые охотно ищут применение новейших биотехнологий для детекции заболеваний. Например, системы на основе технологии CRISPR-Cas: система SHERLOCK точно обнаруживает даже небольшие мутации, а еще один сенсор ищет коронавирус, также выдавая ответ, который можно считать при помощи камеры смартфона.
Вера Сысоева
БИОСЕНСОРЫ • Большая российская энциклопедия
-
В книжной версии
Том 3. Москва, 2005, стр. 524
-
Скопировать библиографическую ссылку:
Авторы: Ю. М. Евдокимов
Схема устройства биосенсора.
БИОСЕ́НСОРЫ, компактные аналитические устройства; состоят из биодатчика, генерирующего «первичный» сигнал при взаимодействии с определёнными компонентами анализируемой среды (биологически активные вещества, гербициды, ОВ, ионы металлов, водорода и т. д.), и преобразователя, который превращает «первичный» сигнал биодатчика в информацию о свойствах среды. Б. можно рассматривать как упрощённую модель сенсорных систем, напр. органов чувств (отсюда назв.). Б. позволяют осуществлять быстрый анализ компонентов окружающей среды (экологич. диагностика), дать оценку качества продуктов питания, установить наличие солей тяжёлых металлов, токсинов, антибиотиков и др. соединений в образцах разл. происхождения, в т. ч. в биологич. жидкостях. Учение о биосенсорах – биосенсорика, находясь на стыке разных областей знаний, основывается на новейших достижениях в области молекулярной биологии, биотехнологии, химии и физики полимеров, микроэлектроники, компьютерной техники и др.
д.), и преобразователя, который превращает «первичный» сигнал биодатчика в информацию о свойствах среды. Б. можно рассматривать как упрощённую модель сенсорных систем, напр. органов чувств (отсюда назв.). Б. позволяют осуществлять быстрый анализ компонентов окружающей среды (экологич. диагностика), дать оценку качества продуктов питания, установить наличие солей тяжёлых металлов, токсинов, антибиотиков и др. соединений в образцах разл. происхождения, в т. ч. в биологич. жидкостях. Учение о биосенсорах – биосенсорика, находясь на стыке разных областей знаний, основывается на новейших достижениях в области молекулярной биологии, биотехнологии, химии и физики полимеров, микроэлектроники, компьютерной техники и др.
Биодатчик (его называют также биологически чувствительным или биоактивным элементом) может быть представлен молекулами любых биополимеров, целыми клетками или кусочками тканей, а также одноцепочечными молекулами ДНК или олигонуклеотидами (такие Б. называются геносенсорами или биочипами). Как правило, некоторое число биологич. молекул зафиксировано на поверхности носителя (или в его составе) таким образом, чтобы сохранялись их исходные свойства. Биодатчик обнаруживает определённые соединения и «сообщает» об их наличии изменением формы, массы, цвета, свойств поверхности, изменением или поглощением теплоты, а также появлением ионов водорода, кислорода или новых соединений. В соответствии с многообразием «первичных» сигналов существуют разные типы преобразователей – электрохимические, гравиметрические и т. д.
В основе работы любого Б. лежат процессы, происходящие между молекулами биодатчика и молекулами анализируемой среды, – молекулярное узнавание. +}.$$
+}.$$
При помощи кислородного электрода можно определить концентрацию кислорода; используя методы колориметрии, амперометрии или по изменению люминесценции – следить за накоплением пероксида водорода; калориметрические методы позволяют учитывать выделение теплоты ($Q$), $\ce{pH}$-чувствительные электроды – изменение концентрации ионов водорода. Т. о., по желанию (в зависимости от конкретных условий) можно конструировать разные Б. для определения концентрации одного и того же вещества (в данном случае – глюкозы).
Б. делят также на 2 группы в зависимости от особенностей их конструкции. В «классических» Б. биодатчики являются структурной частью преобразователя сигнала. Во 2-й группе Б. биодатчики представлены плёнками, мембранами или одноразовыми колонками, которые контактируют с преобразователем только во время анализа. Осн. требованиями, предъявляемыми к Б., являются простота и удобство в работе, низкая стоимость анализа, возможность проведения непрерывного быстрого анализа.
Российские ученые создали сверхчувствительные биосенсоры
https://ria.ru/20200128/1563966509.html
Российские ученые создали сверхчувствительные биосенсоры
Российские ученые создали сверхчувствительные биосенсоры
Российские ученые из Центра фотоники и двумерных материалов МФТИ разработали принципиально новую конструкцию биосенсора, который во много раз чувствительнее, а… РИА Новости, 28.01.2020
2020-01-28T14:13
2020-01-28T14:13
2020-01-28T14:13
наука
биология
физика
химия
здоровье
открытия — риа наука
московский физико-технический институт
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn23.img.ria. ru/images/7e4/1/1c/1563967542_0:56:901:563_1920x0_80_0_0_239f5cb6044b11d0d86bddbbdbed165e.jpg
ru/images/7e4/1/1c/1563967542_0:56:901:563_1920x0_80_0_0_239f5cb6044b11d0d86bddbbdbed165e.jpg
МОСКВА, 28 янв — РИА Новости. Российские ученые из Центра фотоники и двумерных материалов МФТИ разработали принципиально новую конструкцию биосенсора, который во много раз чувствительнее, а также значительно дешевле существующих аналогов. Описание приведено в журнале Sensors. Биосенсор — электрохимический датчик, позволяющий в реальном времени определять состав биологических жидкостей. Единственное на сегодняшний день массовое бытовое применение биосенсоров — в приборах для моментального измерения уровня глюкозы в крови. Но футурологи обещают, что в недалеком будущем бытовые электронные приборы, анализирующие при помощи биосенсоров состав пота, слюны, глазной жидкости и других выделений, смогут идентифицировать личность, делать медицинские анализы, ставить диагнозы, непрерывно контролировать состояние здоровья и составлять оптимальный рацион питания для конкретного человека в зависимости от текущего состояния его организма.Биосенсоры могли бы быть встроены в смартфоны, умные часы и другие гаджеты уже сейчас, но главными препятствиями являются их высокая стоимость и низкая чувствительность.Ученые из МФТИ нашли недорогой способ, как поднять чувствительность биологических датчиков до уровня, достаточного для их применения в бытовых приборах.»Традиционный биосенсор состоит из кольцевого резонатора и волновода, расположенного в одной плоскости с резонатором, — приводятся в пресс-релизе института слова первого автора статьи Кирилла Воронина, сотрудника лаборатории нанооптики и плазмоники МФТИ. — Мы решили попробовать разнести эти два элемента, поместить их в разные плоскости, расположить колечко над волноводом».Раньше никто из исследователей не пытался так делать, потому что в лабораторных условиях гораздо проще изготовить одноуровневую плоскую конструкцию, совмещающую кольцевой резонатор и волновод на единой подложке.Двухъярусную конструкцию биосенсора сложнее изготавливать в единичных экспериментальных экземплярах, но зато проще и дешевле при массовом производстве на заводах микроэлектроники, где все технологические процессы ориентированы на послойное размещение активных элементов. Но главное, предложенная объемная конструкция биосенсора позволяет добиться от него во много раз большей чувствительности.Работа биосенсоров основана на том, что за счет поглощения органических молекул поверхностью датчика происходит небольшое изменение показателя преломления последней. Это изменение фиксируется с помощью резонатора, так как даже самые слабые колебания показателя преломления вызывают значительное смещение резонансных пиков. Поэтому биосенсор способен откликаться чуть ли не на каждую органическую молекулу, попадающую на поверхность датчика.»У нас полосковый волновод расположен под резонатором, в толще диэлектрика, — объясняет один из соавторов работы Алексей Арсенин, ведущий научный сотрудник лаборатории нанооптики и плазмоники МФТИ. — Резонатор же находится на границе раздела, между диэлектрической подложкой и внешней средой. Это позволяет значительно поднять его чувствительность путем подбора показателей преломления двух сред».В предложенной учеными новой компоновке биосенсора вся его оптическая часть — источник и детектор излучения — располагается внутри диэлектрика. Снаружи же остается только чувствительная зона конструкции — золотое колечко диаметром несколько десятков микрометров и толщиной несколько десятков нанометров.
Но главное, предложенная объемная конструкция биосенсора позволяет добиться от него во много раз большей чувствительности.Работа биосенсоров основана на том, что за счет поглощения органических молекул поверхностью датчика происходит небольшое изменение показателя преломления последней. Это изменение фиксируется с помощью резонатора, так как даже самые слабые колебания показателя преломления вызывают значительное смещение резонансных пиков. Поэтому биосенсор способен откликаться чуть ли не на каждую органическую молекулу, попадающую на поверхность датчика.»У нас полосковый волновод расположен под резонатором, в толще диэлектрика, — объясняет один из соавторов работы Алексей Арсенин, ведущий научный сотрудник лаборатории нанооптики и плазмоники МФТИ. — Резонатор же находится на границе раздела, между диэлектрической подложкой и внешней средой. Это позволяет значительно поднять его чувствительность путем подбора показателей преломления двух сред».В предложенной учеными новой компоновке биосенсора вся его оптическая часть — источник и детектор излучения — располагается внутри диэлектрика. Снаружи же остается только чувствительная зона конструкции — золотое колечко диаметром несколько десятков микрометров и толщиной несколько десятков нанометров.
https://ria.ru/20190429/1553148124.html
https://ria.ru/20191202/1561859825.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn24. img.ria.ru/images/7e4/1/1c/1563967542_9:0:894:664_1920x0_80_0_0_58ec3056f29e219fe3efc80a23e71269.jpg
img.ria.ru/images/7e4/1/1c/1563967542_9:0:894:664_1920x0_80_0_0_58ec3056f29e219fe3efc80a23e71269.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
биология, физика, химия, здоровье, открытия — риа наука, московский физико-технический институт
МОСКВА, 28 янв — РИА Новости. Российские ученые из Центра фотоники и двумерных материалов МФТИ разработали принципиально новую конструкцию биосенсора, который во много раз чувствительнее, а также значительно дешевле существующих аналогов. Описание приведено в журнале Sensors.Биосенсор — электрохимический датчик, позволяющий в реальном времени определять состав биологических жидкостей. Единственное на сегодняшний день массовое бытовое применение биосенсоров — в приборах для моментального измерения уровня глюкозы в крови.
Но футурологи обещают, что в недалеком будущем бытовые электронные приборы, анализирующие при помощи биосенсоров состав пота, слюны, глазной жидкости и других выделений, смогут идентифицировать личность, делать медицинские анализы, ставить диагнозы, непрерывно контролировать состояние здоровья и составлять оптимальный рацион питания для конкретного человека в зависимости от текущего состояния его организма.
Биосенсоры могли бы быть встроены в смартфоны, умные часы и другие гаджеты уже сейчас, но главными препятствиями являются их высокая стоимость и низкая чувствительность.
Ученые из МФТИ нашли недорогой способ, как поднять чувствительность биологических датчиков до уровня, достаточного для их применения в бытовых приборах.
«Традиционный биосенсор состоит из кольцевого резонатора и волновода, расположенного в одной плоскости с резонатором, — приводятся в пресс-релизе института слова первого автора статьи Кирилла Воронина, сотрудника лаборатории нанооптики и плазмоники МФТИ. — Мы решили попробовать разнести эти два элемента, поместить их в разные плоскости, расположить колечко над волноводом».
— Мы решили попробовать разнести эти два элемента, поместить их в разные плоскости, расположить колечко над волноводом».
Раньше никто из исследователей не пытался так делать, потому что в лабораторных условиях гораздо проще изготовить одноуровневую плоскую конструкцию, совмещающую кольцевой резонатор и волновод на единой подложке.
Двухъярусную конструкцию биосенсора сложнее изготавливать в единичных экспериментальных экземплярах, но зато проще и дешевле при массовом производстве на заводах микроэлектроники, где все технологические процессы ориентированы на послойное размещение активных элементов. Но главное, предложенная объемная конструкция биосенсора позволяет добиться от него во много раз большей чувствительности.
Работа биосенсоров основана на том, что за счет поглощения органических молекул поверхностью датчика происходит небольшое изменение показателя преломления последней. Это изменение фиксируется с помощью резонатора, так как даже самые слабые колебания показателя преломления вызывают значительное смещение резонансных пиков. Поэтому биосенсор способен откликаться чуть ли не на каждую органическую молекулу, попадающую на поверхность датчика.
«У нас полосковый волновод расположен под резонатором, в толще диэлектрика, — объясняет один из соавторов работы Алексей Арсенин, ведущий научный сотрудник лаборатории нанооптики и плазмоники МФТИ. — Резонатор же находится на границе раздела, между диэлектрической подложкой и внешней средой. Это позволяет значительно поднять его чувствительность путем подбора показателей преломления двух сред».
В предложенной учеными новой компоновке биосенсора вся его оптическая часть — источник и детектор излучения — располагается внутри диэлектрика. Снаружи же остается только чувствительная зона конструкции — золотое колечко диаметром несколько десятков микрометров и толщиной несколько десятков нанометров.
2 декабря 2019, 19:00НаукаРазработан способ по анализу крови узнать продолжительность жизниXII Научная Школа «SPR биосенсоры Biacore в биомедицинских исследованиях»
06. 11.2020
11.2020
XII Научная Школа «SPR биосенсоры Biacore в биомедицинских исследованиях»
Учебная программа XII Научной Школы«SPR биосенсоры Biacore в биомедицинских исследованиях»
16 ноября 2020г.
Время: (Москва)
10:00 – 10:30 Подключение / регистрация участников
10:30 — 11:00 Выступления организаторов Школы, знакомство с преподавателями
11:00 — 13:00 Лекция 1
«SPR биосенсоры типа Biacore» (проф. А.С.Иванов)
● Эффект поверхностного плазмонного резонанса (SPR)
● Принцип действия и устройство SPR биосенсоров Biacore
● Новейшие модели биосенсоров Biacore S200 и Biacore 8К
● Лабораторная инфраструктура для обеспечения работы SPR биосенсора
● Что можно анализировать с помощью SPR биосенсора
● Вопросы
17 ноября 2020г.
Время: (Москва)
10:00 – 10:30 Подключение / регистрация участников
10:30 — 12:30 Экспертный курс №1
«SPR биосенсор Biacore 8K. Поиск потенциальных прототипов новых лекарств» (к.б.н. Калужский Л.А.)
● Подготовка библиотеки низкомолекулярных соединений к анализу на биосенсоре Biacore 8K.
● Скрининг библиотеки низкомолекулярных соединений по взаимодействию с белком-мишенью
● Анализ и интерпретация результатов SPR скрининга.
● Анализ кинетики взаимодействия низкомолекулярного соединения с белком-мишенью на биосенсоре Biacore 8K.
23 ноября 2020г.
Время: (Москва)
10:30 – 11:00 Подключение / регистрация участников
11:00 — 13:00 Лекция 2
«Применение биосенсоров Biacore в фундаментальных научных исследованиях» (проф. А.С.Иванов)
● Оптические чипы Biacore и способы иммобилизации лигандов
● Анализ различных межмолекулярных взаимодействий
● Олигомеризация белков и пептидов
● Молекулярный фишинг в белковой интерактомике
● Вопросы
24 ноября 2020г.
Время: (Москва)
10:00 – 10:30 Подключение / регистрация участников
10:30 — 12:30 Экспертный курс №2
«Ориентированная нековалентная иммобилизация биомолекул на оптический чип SPR биосенсора» (к.б.н. Яблоков Е.О.)
● Виды нековалентной ориентированной иммобилизации лигандов
● Демонстрация ориентированной нековалентной иммобилизации на CAP-чип на примере биотинилированного in vivo фермента
● Демонстрация ориентированной нековалентной иммобилизации за HIS-tag
Форма заявки и программа школы
Возврат к списку
Аптамеры РНК, микрочипы под кожу и карманные биосенсоры
Аптамеры РНК, микрочипы под кожу и карманные биосенсоры — Государственная информационная система промышленностиПервый выпуск информационного бюллетеня посвящен трем актуальным направлениям развития технологий в медицине — использованию аптамеров РНК для целевой доставки противораковых препаратов, имплантируемым микрочипам для контроля лечения хронических заболеваний и «карманным» биосенсорам для диагностики острых респираторных инфекций.
Просмотр документа
Государственная информационная система промышленности
Техническая поддержка
Получить техническую и консультационную поддержку можно, написав запрос по адресу support@gisp. gov.ru.
gov.ru.
В запросе
необходимо задать вопрос, либо описать возникшую проблему и указать контактную информацию, по
которой с Вами смогут связаться специалисты группы поддержки.
Кроме того, с 09:00 до 18:00 по московскому времени поддержка оказывается по телефону +7 (495) 120-46-54.
Обратная связь
Получить техническую и консультационную поддержку можно, написав запрос по адресу [email protected].
В запросе необходимо задать вопрос, либо описать возникшую проблему и указать контактную информацию, по которой с Вами смогут связаться специалисты группы поддержки.
Кроме того, с 09:00 до 18:00 по московскому времени поддержка оказывается по телефону +7 (495) 120-46-54.
ФИЦ ПНЦБИ РАН — Биосенсоры и биотопливные элементы
Сотрудники Пущинского Института биохимии и физиологии микроорганизмов РАН, обособленного подразделения Федерального исследовательского центра Пущинский научный центр биологических исследований РАН, объединили российских и иностранных специалистов в области разработок биосенсоров и биотопливных элементов. Со стороны ИБФМ РАН соавторами стали доктор химических наук Анатолий Николаевич Решетилов и кандидат биологических наук Юлия Викторовна Плеханова.
Результатом совместной работы исследователей из ФИЦ ПНЦБИ РАН и их иностранных коллег из Индии и Бразилии стала коллективная монография «Macro, Micro, and Nano-Biosensors: Potential Applications and Possible Limitations». Книга вышла в 2020 году в издательстве Springer International Publishing.
В книге рассмотрены биосенсоры и биотопливные элементы макро микро и наноразмеров. Также показано применение этих устройств для обнаружения химических и биологических объектов, рассмотрены биотопливные элементы и биосенсоры с автономным питанием для оценки здоровья человека и анализа окружающей среды.
Также показано применение этих устройств для обнаружения химических и биологических объектов, рассмотрены биотопливные элементы и биосенсоры с автономным питанием для оценки здоровья человека и анализа окружающей среды.
Четыре главы книги посвящены научным достижениям Лаборатории биосенсоров ИБФМ РАН за последние 10 лет.
Анатолий Николаевич Решетилов – заведующий лабораторией биосенсоров, профессор, доктор химических наук, Заслуженный деятель науки и техники Московской области. Автор более 350 публикаций, 16 патентов. Наиболее значительными достижениями считает создание биосенсоров для мониторинга окружающей среды, детекции биологически активных соединений для медицины, аналитических систем для мониторинга ферментационных процессов. Наибольшее внимание в работе уделяется созданию биосенсоров на основе электрохимических преобразователей, в качестве которых применяются амперометрические и потенциометрические электроды. Для создания биосенсоров биологическим материалом служат клетки микроорганизмов, ферменты, антитела/антигены, молекулы ДНК. В лаборатории постоянно проходят практику, выполняют курсовые и дипломные работы, обучаются в магистратуре и аспирантуре студенты Самарского, Тульского и др. университетов. К настоящему времени защищено семь кандидатских диссертаций по тематикам биосенсорных исследований.
Ссылка на превью о книге и авторах: https://www.springer.com/gp/book/9783030554897#aboutAuthors
Подробнее с исследованиями лаборатории можно ознакомиться на ее странице.
Носимые биосенсоры для мониторинга здравоохранения
Бандодкар, А. Дж., Джирапан, И. и Ван, Дж. Носимые химические сенсоры: современные проблемы и перспективы на будущее. ACS Sens. 1 , 464–482 (2016).
Артикул CAS Google Scholar
Heikenfeld, J. et al. Носимые датчики: модальности, проблемы и перспективы. Lab Chip 18 , 217–248 (2018).
Артикул CAS PubMed PubMed Central Google Scholar
Мацеу, Г., Флореа, Л. и Даймонд, Д. Достижения в разработке носимых химических сенсоров для мониторинга биологических жидкостей. Sens. Приводы B Chem. 211 , 403–418 (2015).
Артикул CAS Google Scholar
Лю Ю., Фарр, М. и Сальваторе, Г. А. Лаборатория на коже: обзор гибкой и растягиваемой электроники для носимого мониторинга здоровья. АСУ Нано 11 , 9614–9635 (2017).
Артикул CAS PubMed Google Scholar
Amjadi, M., Kyung, K.U., Park, I. & Sitti, M. Растягиваемые, устанавливаемые на кожу и носимые датчики деформации и их потенциальные применения: обзор. Adv. Функц. Матер. 26 , 1678–1698 (2016).
Артикул CAS Google Scholar
Бария, М., Найин, Х. Й. и Джави, А.Носимые датчики пота. Nat. Электрон. 1 , 160–171 (2018).
Артикул Google Scholar
Кларк, Л. К. мл. И Лайонс, К. Электродные системы для непрерывного мониторинга в сердечно-сосудистой хирургии. Ann. NY Acad. Sci. 102 , 29–45 (1962).
Артикул CAS PubMed Google Scholar
Абделлатиф, М.С., Сулейман, А. и Гильбо, Г. Г. Оптоволоконный сенсор на основе ферментов для определения глюкозы. Анал. Lett. 21 , 943–951 (1988).
Артикул CAS Google Scholar
Арнольд М.А. Оптоволоконный датчик на основе ферментов. Анал. Chem. 57 , 565–566 (1985).
Артикул CAS PubMed Google Scholar
Зейтц, В. Р. Химические сенсоры на основе волоконной оптики. Анал. Chem. 56 , 16A – 34A (1984).
Артикул CAS Google Scholar
Уорд, М. Д. и Баттри, Д. А. Детектирование межфазной массы in situ с помощью пьезоэлектрических преобразователей. Наука 249 , 1000–1007 (1990).
Артикул CAS PubMed Google Scholar
Мурамацу, Х., Дикс, Дж. М., Тамия, Э. и Карубе, И. Пьезоэлектрический кристаллический биосенсор, модифицированный протеином А для определения иммуноглобулинов. Анал. Chem. 59 , 2760–2763 (1987).
Артикул CAS PubMed Google Scholar
Janshoff, A., Galla, H. J. & Steinem, C. Пьезоэлектрические масс-чувствительные устройства в качестве биосенсоров — альтернатива оптическим биосенсорам? Angew. Chem.Int. Эд. Англ. 39 , 4004–4032 (2000).
Артикул CAS PubMed Google Scholar
Нгех-Нгвайнби, Дж., Сулейман, А. А. и Гильбо, Г. Г. Пьезоэлектрические кристаллические биосенсоры. Биосенс. Биоэлектрон. 5 , 13–26 (1990).
Артикул CAS PubMed Google Scholar
Хилдич, П. И. и Грин, М.J. Одноразовые электрохимические биосенсоры. Аналитик 116 , 1217–1220 (1991).
Артикул CAS PubMed Google Scholar
Фрю, Дж. Э. и Хилл, Х. А. О. Электрохимические биосенсоры. Анал. Chem. 59 , 933A – 944A (1987).
Артикул CAS PubMed Google Scholar
Bindra, D. S. et al.Разработка и исследования in vitro игольчатого датчика глюкозы для подкожного мониторинга. Анал. Chem. 63 , 1692–1696 (1991).
Анал. Chem. 63 , 1692–1696 (1991).
Артикул CAS PubMed Google Scholar
Уилсон, Г. С. и Гиффорд, Р. Биосенсоры для измерений in vivo в реальном времени. Биосенс. Биоэлектрон. 20 , 2388–2403 (2005).
Артикул CAS PubMed Google Scholar
Родбард Д. Непрерывный мониторинг глюкозы: обзор успехов, проблем и возможностей. Diabetes Technol. Ther. 18 (Приложение 2), S3 – S13 (2016).
PubMed Google Scholar
Чжэн, Г., Патольски, Ф., Цуй, Ю., Ван, У. У. и Либер, К. М. Мультиплексное электрическое обнаружение маркеров рака с помощью массивов датчиков на основе нанопроволоки. Nat. Biotechnol. 23 , 1294–1301 (2005).
Артикул CAS PubMed Google Scholar
Покорски, Дж. К., Нам, Дж. М., Вега, Р. А., Миркин, К. А. и Аппелла, Д. Х. Модифицированная циклопентаном ПНК повышает чувствительность сканометрического обнаружения ДНК на основе наночастиц. Chem. Commun. (Камб.) 0 , 2101–2103 (2005).
Артикул CAS Google Scholar
Торп, Х.H. Исключение посредников: ДНК-биосенсоры, основанные на электрохимическом окислении. Trends Biotechnol. 16 , 117–121 (1998).
Артикул CAS Google Scholar
Ван, Дж. И Фром, Д. Н. Биосенсоры для генных чипов. Nucleic Acids Res. 28 , 3011–3016 (2000).
Артикул CAS PubMed PubMed Central Google Scholar
Оденталь, К. Дж. И Гудинг, Дж. Дж. Введение в электрохимические ДНК-биосенсоры. Аналитик 132 , 603–610 (2007).
Артикул CAS PubMed Google Scholar
Ван Дж. Электрохимические биосенсоры глюкозы. Chem. Ред. 108 , 814–825 (2008).
Артикул CAS PubMed Google Scholar
Джонсон, Б. Н. и Мутарасан, Р. Биосенсинг с использованием консольных датчиков динамического режима: обзор. Биосенс. Биоэлектрон. 32 , 1–18 (2012).
Артикул CAS PubMed Google Scholar
Ньюман Дж. Д. и Тернер А. П. Домашние биосенсоры глюкозы в крови: коммерческая перспектива. Биосенс. Биоэлектрон. 20 , 2435–2453 (2005).
Артикул CAS PubMed Google Scholar
Mani, V., Chikkaveeraiah, B.V, Patel, V., Gutkind, J. S. & Rusling, J. F. Сверхчувствительный иммуносенсор для белков биомаркеров рака с использованием пленочных электродов из наночастиц золота и мультиферментной амплификации. АСУ Нано 3 , 585–594 (2009).
Артикул CAS PubMed PubMed Central Google Scholar
Ким Дж., Кэмпбелл А. С. и Ван Дж. Носимые неинвазивные эпидермальные датчики глюкозы: обзор. Таланта 177 , 163–170 (2018).
Артикул CAS PubMed Google Scholar
Тирни, М. Дж., Тамада, Дж. А., Поттс, Р. О., Йованович, Л. и Гарг, С. Клиническая оценка биографа GlucoWatch: непрерывный неинвазивный монитор глюкозы для пациентов с диабетом. Биосенс. Биоэлектрон. 16 , 621–629 (2001).
Артикул CAS Google Scholar
Вашист, С. К. Системы непрерывного мониторинга глюкозы: обзор. Диагностика (Базель) 3 , 385–412 (2013).
Артикул CAS Google Scholar
Mannoor, M. S. et al. Беспроводное обнаружение бактерий на зубной эмали на основе графена. Nat. Commun. 3 , 763 (2012).
Артикул CAS Google Scholar
Старший, М. Новартис подписывается на Google Smart Lens. Nat. Biotechnol. 32 , 856 (2014).
Артикул CAS Google Scholar
Koh, A. et al. Мягкое носимое микрофлюидное устройство для улавливания, хранения и колориметрического определения пота. Sci. Пер. Med. 8 , 366ra165 (2016).
Артикул CAS PubMed PubMed Central Google Scholar
Gao, W. et al. Полностью интегрированные наборы переносных датчиков для комплексного анализа потоотделения на месте. Природа 529 , 509–514 (2016).
Артикул CAS PubMed PubMed Central Google Scholar
Kim, J. et al. Переносной биодатчик мочевой кислоты слюнной капы со встроенной беспроводной электроникой. Биосенс. Биоэлектрон. 74 , 1061–1068 (2015).
Артикул CAS PubMed PubMed Central Google Scholar
Bandodkar, A. J. et al. Неинвазивный мониторинг глюкозы на основе татуировок: исследование, подтверждающее правильность концепции. Анал. Chem. 87 , 394–398 (2015).
Артикул CAS Google Scholar
Martín, A. et al. Эпидермальная микрофлюидная электрохимическая система обнаружения: улучшенный отбор проб пота и обнаружение метаболитов. ACS Sens. 2 , 1860–1868 (2017).
Артикул CAS Google Scholar

Sempionatto, J. R. et al. Платформа беспроводного датчика электролитов и метаболитов на основе очков. Lab Chip 17 , 1834–1842 (2017).
Артикул CAS PubMed PubMed Central Google Scholar
Lee, H. et al. Электрохимическое устройство на основе графена с термореактивными микроиглами для мониторинга и терапии диабета. Nat. Nanotechnol. 11 , 566–572 (2016).
Артикул CAS PubMed PubMed Central Google Scholar
Emaminejad, S. et al. Автономная экстракция пота и анализ для диагностики муковисцидоза и глюкозы с использованием полностью интегрированной носимой платформы. Proc. Natl Acad. Sci. США 114 , 4625–4630 (2017).
Артикул CAS Google Scholar
Jeerapan, I., Семпионатто, Дж. Р., Павинатто, А., Ю, Дж. М. и Ван, Дж. Растягиваемые биотопливные элементы как носимые текстильные датчики с автономным питанием. J. Mater. Chem. Матер. Энергетическая устойчивость. 4 , 18342–18353 (2016).
Артикул CAS PubMed PubMed Central Google Scholar
Мунже, Р. Д., Мутукумар, С., Джаганнатх, Б. и Прасад, С. Новая парадигма носимых диагностических биосенсоров на основе пота с использованием ионных жидкостей комнатной температуры (RTIL). Sci. Отчет 7 , 1950 (2017).
Артикул CAS PubMed PubMed Central Google Scholar
Imani, S. et al. Носимая химико-электрофизиологическая гибридная биосенсорная система для мониторинга здоровья и физической формы в реальном времени. Nat. Commun. 7 , 11650 (2016).
Артикул CAS PubMed PubMed Central Google Scholar

Ким, Дж., Кумар, Р., Бандодкар, А. Дж. И Ван, Дж. Современные материалы для печатных носимых электрохимических устройств: обзор. Adv. Электрон. Матер. 3 , 1600260 (2017).
Артикул CAS Google Scholar
Bandodkar, A. J., Mohan, V., Lopez, C. S., Ramirez, J. & Wang, J. Самовосстанавливающиеся чернила для автономного ремонта печатных электрохимических устройств. Adv. Электрон. Матер. 1 , 1500289 (2015).
Артикул CAS Google Scholar
Ву, Х., Гао, В. и Инь, З. Материалы, устройства и системы мягкой биоэлектроники для точной терапии. Adv. Здоровьеc. Матер. 6 , 1700017 (2017).
Артикул CAS Google Scholar
Стоппа, М. и Чиолерио, А. Носимая электроника и интеллектуальный текстиль: критический обзор.Датчики (Базель) 14 , 11957–11992 (2014).
Артикул CAS Google Scholar
Бандодкар, А. Дж. И Ван, Дж. Неинвазивные носимые электрохимические датчики: обзор. Trends Biotechnol. 32 , 363–371 (2014).
Артикул CAS Google Scholar
Bandodkar, A. J., Jia, W. Z. & Wang, J.Носимые электрохимические устройства на основе татуировок: обзор. Электроанализ 27 , 562–572 (2015).
Артикул CAS Google Scholar
Джин, Х., Абу-Райя, Ю. С. и Хэйк, Х. Передовые материалы для мониторинга здоровья с помощью носимых устройств на коже. Adv. Здоровьеc. Матер. 6 , 1700024 (2017).
Артикул CAS Google Scholar
Пивек, Л., Эллис, Д. А., Эндрюс, С. и Джойнсон, А. Рост популярности носимых устройств для здоровья потребителей: обещания и препятствия.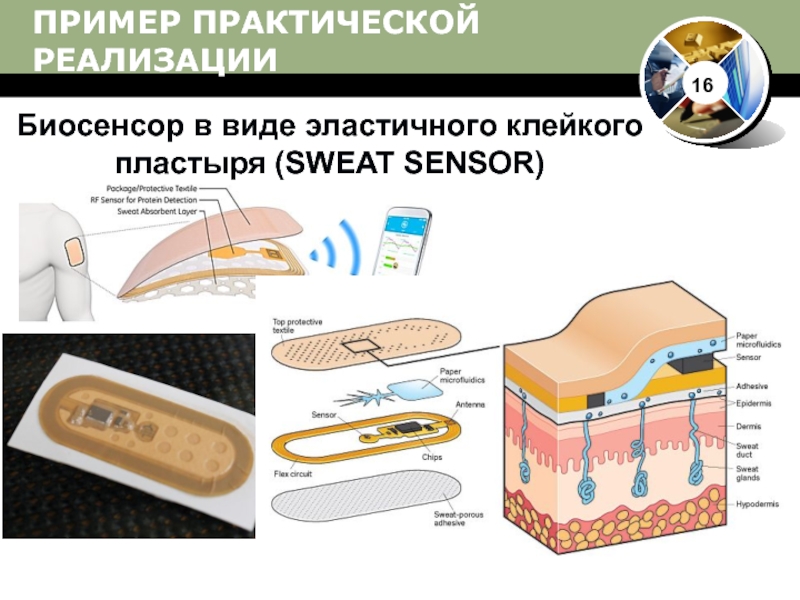 PLoS Med. 13 , e1001953 (2016).
PLoS Med. 13 , e1001953 (2016).
Артикул PubMed PubMed Central Google Scholar
Yang, Y. & Gao, W. Носимая и гибкая электроника для непрерывного молекулярного мониторинга. Chem. Soc. Ред. https://doi.org/10.1039/c7cs00730b (2018).
Xue, X. Y. et al. Электронная кожа с автономным питанием для определения уровня глюкозы в жидкости организма на основе процесса связывания пьезо-ферментативной реакции. Nano Energy 26 , 148–156 (2016).
Артикул CAS Google Scholar
Han, W. et al. Носимая неинвазивная электронная кожа с автономным питанием для анализа потоотделения на основе пьезобиосенсорной единичной матрицы наночастиц фермент / ZnO. ACS Appl.Матер. Интерфейсы 9 , 29526–29537 (2017).
Артикул CAS PubMed PubMed Central Google Scholar
Morris, D. et al. Био-чувствительный тканевый патч со встроенной оптической системой обнаружения пота. Sens. Приводы B Chem. 139 , 231–236 (2009).
Артикул CAS Google Scholar
Виндмиллер, Дж. Р. и Ван, Дж. Носимые электрохимические сенсоры и биосенсоры: обзор. Электроанализ 25 , 29–46 (2013).
Артикул CAS Google Scholar
Jia, W. et al. Электрохимические тату-биосенсоры для неинвазивного мониторинга лактата в потоотделении человека в режиме реального времени. Анал. Chem. 85 , 6553–6560 (2013).
Артикул CAS PubMed PubMed Central Google Scholar
Gualandi, I. et al. Текстильные органические электрохимические транзисторы как платформа носимых биосенсоров. Sci. Отчет 6 , 33637 (2016).
Sci. Отчет 6 , 33637 (2016).
Артикул CAS PubMed PubMed Central Google Scholar
Caldara, M., Colleoni, C., Guido, E., Re, V. & Rosace, G. Оптический мониторинг pH пота с помощью переносного датчика из текстильной ткани на основе ковалентно связанного лакмус-3-глицидоксипропилтриметоксисилана покрытие. Sens. Приводы B Chem. 222 , 213–220 (2016).
Артикул CAS Google Scholar
Чой, Д. Х., Ким, Дж. С., Каттинг, Г. Р. и Сирсон, П. С. Носимый потенциометрический датчик хлоридного пота: критическая роль солевого мостика. Анал. Chem. 88 , 12241–12247 (2016).
Артикул CAS PubMed Google Scholar
Лю Дж., Лю Р. и Сюй К. Точность неинвазивного определения глюкозы на основе спектроскопии в ближнем инфракрасном диапазоне. заявл. Spectrosc. 69 , 1313–1318 (2015).
Артикул CAS PubMed Google Scholar
Ben Mohammadi, L. et al. Оценка in vivo сенсора ближнего инфракрасного диапазона на основе микросхемы для непрерывного мониторинга уровня глюкозы. Биосенс. Биоэлектрон. 53 , 99–104 (2014).
Артикул CAS PubMed Google Scholar
Sonner, Z. et al. Микрофлюидика эккриновой потовой железы, включая распределение биомаркеров, транспорт и влияние на биочувствительность. Биомикрофлюидика 9 , 031301 (2015).
Артикул CAS PubMed PubMed Central Google Scholar
Thennadil, S. N. et al. Сравнение концентрации глюкозы в интерстициальной жидкости, капиллярной и венозной крови во время быстрых изменений уровня глюкозы в крови. Diabetes Technol. Ther. 3 , 357–365 (2001).
Ther. 3 , 357–365 (2001).
Артикул CAS PubMed Google Scholar
Кэмпбелл А.С., Ким Дж. И Ван Дж. Носимые электрохимические спиртовые биосенсоры. Curr. Opin. Электрохим. 10 , 126–135 (2018).
Артикул CAS PubMed PubMed Central Google Scholar
Фог-Андерсен, Н., Алтура, Б. М., Алтура, Б. Т., Сиггаард-Андерсен, О. Состав межклеточной жидкости. Clin. Chem. 41 , 1522–1525 (1995).
CAS PubMed Google Scholar
Venugopal, M. et al. Клиническая оценка новой сенсорной системы интерстициальной жидкости для дистанционного непрерывного мониторинга алкоголя. IEEE Sens. J. 8 , 71–80 (2008).
Артикул CAS Google Scholar
Венугопал, М., Арья, С. К., Чернокур, Г. и Бхансали, С. Непрерывная оценка кортизола в ISF в реальном времени с использованием спектроскопии электрохимического импеданса. Sens. Приводы A Phys. 172 , 154–160 (2011).
Артикул CAS PubMed PubMed Central Google Scholar
Bandodkar, A.J. et al. Потенциометрические ионоселективные датчики на основе татуировок для мониторинга pH эпидермиса. Аналитик 138 , 123–128 (2013).
Артикул CAS PubMed Google Scholar
Bandodkar, A. J. et al. Потенциометрические датчики натрия для эпидермальных татуировок с беспроводной передачей сигнала для непрерывного неинвазивного мониторинга потоотделения. Биосенс. Биоэлектрон. 54 , 603–609 (2014).
Артикул CAS PubMed Google Scholar
Гуиноварт Т. , Бандодкар А.Дж., Виндмиллер, Дж. Р., Андраде, Ф. Дж. И Ван Дж. Потенциометрический датчик татуировки для контроля содержания аммония в поте. Аналитик 138 , 7031–7038 (2013).
, Бандодкар А.Дж., Виндмиллер, Дж. Р., Андраде, Ф. Дж. И Ван Дж. Потенциометрический датчик татуировки для контроля содержания аммония в поте. Аналитик 138 , 7031–7038 (2013).
Артикул CAS PubMed Google Scholar
Kim, J. et al. Переносной временный датчик татуировки для отслеживания следов металлов в поту человека в реальном времени. Электрохим. Commun. 51 , 41–45 (2015).
Артикул CAS Google Scholar
Kim, J. et al. Неинвазивный мониторинг алкоголя с использованием носимой ионнофоретико-биодатной системы на основе татуировок. ACS Sens. 1 , 1011–1019 (2016).
Артикул CAS Google Scholar
Wang, L. et al. Сплетение сенсорных волокон в электрохимическую ткань для мониторинга состояния здоровья в режиме реального времени. Adv. Функц. Матер. 28 , 1804456 (2018).
Артикул CAS Google Scholar
Мойер, Дж., Уилсон, Д., Финкельштейн, И., Вонг, Б. и Поттс, Р. Корреляция между глюкозой в поту и глюкозой в крови у субъектов с диабетом. Diabetes Technol. Ther. 14 , 398–402 (2012).
Артикул CAS PubMed Google Scholar
Sakaguchi, K. et al. Оценка минимально инвазивной системы для измерения площади глюкозы под кривой во время пероральных тестов на толерантность к глюкозе: полезность мониторинга пота для точного измерения. J. Diabetes Sci. Technol. 7 , 678–688 (2013).
Артикул PubMed PubMed Central Google Scholar
Lee, H. et al. Носимое / одноразовое устройство для мониторинга уровня глюкозы в крови с помощью многоступенчатого трансдермального модуля доставки лекарств. Sci. Adv. 3 , e1601314 (2017).
Sci. Adv. 3 , e1601314 (2017).
Артикул CAS PubMed PubMed Central Google Scholar
Curto, V. F. et al. Мониторинг pH пота в реальном времени на основе носимой химической микрожидкостной платформы со штрих-кодом, включающей ионные жидкости. Sens. Приводы B Chem. 171 , 1327–1334 (2012).
Артикул CAS Google Scholar
Mu, X. et al. Пластырь на бумажной основе для диагностики муковисцидоза. Chem. Commun. (Камб.) 51 , 6365–6368 (2015).
Артикул CAS Google Scholar
Huang, X. et al. Эластичные беспроводные датчики и функциональные подложки для эпидермальной характеристики пота. Малый 10 , 3083–3090 (2014).
Артикул CAS PubMed Google Scholar
Oncescu, V., O’Dell, D. & Erickson, D. Медицинский аксессуар на базе смартфона для колориметрического определения биомаркеров в поте и слюне. Лабораторный чип 13 , 3232–3238 (2013).
Артикул CAS PubMed Google Scholar
Kim, S. B. et al. Сверхабсорбирующие полимерные клапаны и колориметрические химические составы для дискретного отбора проб с временной последовательностью и анализа пота на хлориды с помощью мягкой микрофлюидики, закрепленной на коже. Малый 14 , e1703334 (2018).
Артикул CAS PubMed Google Scholar
Секин, Ю.и другие. Флюорометрическое микрожидкостное устройство с интерфейсом кожи и модуль визуализации смартфона для количественного анализа химического состава пота на месте. Lab Chip 18 , 2178–2186 (2018).
Артикул CAS PubMed Google Scholar

Киннамон, Д., Ганта, Р., Лин, К. С., Мутукумар, С. и Прасад, С. Портативный биосенсор для мониторинга уровня кортизола в поте человека с небольшим объемом пота. Sci. Отчет 7 , 13312 (2017).
Артикул CAS PubMed PubMed Central Google Scholar
Ciui, B. et al. Носимая беспроводная повязка с тирозиназой и датчики с микроиглами: для скрининга меланомы. Adv. Здоровьеc. Матер. 7 , e1701264 (2018).
Артикул CAS PubMed Google Scholar
Chen, Y. et al. Кожеподобная биосенсорная система через электрохимические каналы для неинвазивного мониторинга уровня глюкозы в крови. Sci. Adv. 3 , e1701629 (2017).
Артикул PubMed PubMed Central Google Scholar
Lipani, L. et al. Неинвазивный, трансдермальный, избирательный и специфический мониторинг глюкозы с помощью платформы на основе графена. Nat. Nanotechnol. 13 , 504–511 (2018).
Артикул CAS PubMed Google Scholar
Гибсон Л. Э. и Кук Р. Э. Тест на концентрацию электролитов в поте при муковисцидозе поджелудочной железы с использованием пилокарпина с помощью ионтофореза. Педиатрия 23 , 545–549 (1959).
CAS PubMed Google Scholar
Коул Д. Э. и Баучер М. Дж. Использование нового устройства для сбора образцов (Macroduct) в анионном анализе человеческого пота. Clin. Chem. 32 , 1375–1378 (1986).
CAS PubMed Google Scholar
Мацеу, Г., Фэй, К., Вайллант, А., Койл, С. и Даймонд, Д. Носимое устройство для контроля скорости потоотделения с помощью анализа изображений. IEEE Trans.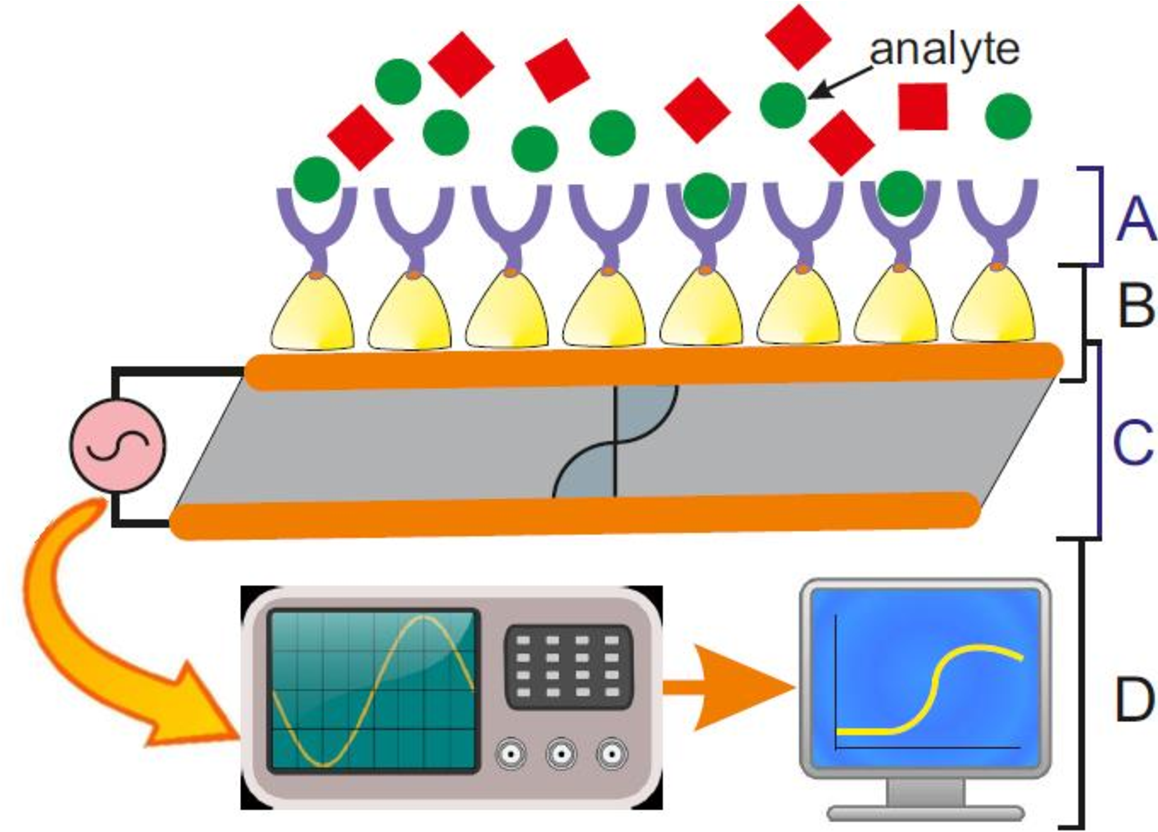 Биомед. Англ. 63 , 1672–1680 (2016).
Биомед. Англ. 63 , 1672–1680 (2016).
Артикул PubMed Google Scholar
Tai, L.C. et al. Мониторинг содержания метилксантина с помощью переносных датчиков пота. Adv. Матер. 30 , e1707442 (2018).
Артикул CAS PubMed Google Scholar
Kim, J. et al. Одновременный мониторинг пота и межклеточной жидкости с помощью единой носимой биосенсорной платформы. Adv. Sci. (Weinh.) 5 , 1800880 (2018).
Google Scholar
Фарандос, Н. М., Йетисен, А. К., Монтейро, М. Дж., Лоу, К. Р. и Юн, С. Х. Датчики контактных линз в диагностике глаза. Adv. Здоровьеc. Матер. 4 , 792–810 (2015).
Артикул CAS PubMed Google Scholar
Бака, Дж. Т., Файнголд, Д. Н. и Ашер, С. А. Анализ глюкозы в слезах для неинвазивного выявления и мониторинга сахарного диабета. Ocul. Прибой. 5 , 280–293 (2007).
Артикул PubMed Google Scholar
Тайсен, Дж. Х. и Торн, Н. А. Экскреция мочевины, натрия, калия и хлорида в человеческих слезах. г. J. Physiol. 178 , 160–164 (1954).
Артикул CAS PubMed Google Scholar
Мицубаяси, К. и Аракава, Т. Кавитас датчики: датчики с контактными линзами и датчики для каппы. Электроанализ 28 , 1170–1187 (2016).
Артикул CAS Google Scholar
Панкратов Д., Гонсалес-Аррибас Э., Блюм З. и Шлеев С. Биоэлектроника на основе слезы. Электроанализ 28 , 1250–1266 (2016).
Артикул CAS Google Scholar

Сен, Д. К. и Сарин, Г. С. Уровень глюкозы в слезах у нормальных людей и у пациентов с диабетом. руб. J. Ophthalmol. 64 , 693–695 (1980).
Артикул CAS PubMed PubMed Central Google Scholar
Chu, M. X. et al. Биосенсор с мягкими контактными линзами для мониторинга уровня глюкозы в слезе in situ в качестве неинвазивной оценки уровня сахара в крови. Таланта 83 , 960–965 (2011).
Артикул CAS PubMed Google Scholar
Chu, M. et al. Биомедицинский сенсор с мягкими контактными линзами для глазного биомониторинга слезного содержимого in situ. Биомед. Микроустройства 13 , 603–611 (2011).
Артикул CAS PubMed Google Scholar
Мисима С., Гассет А., Клайс С. Д. мл. И Баум Дж. Л. Определение объема слезной жидкости и слезоточивости. Инвест. Офтальмол. 5 , 264–276 (1966).
CAS PubMed Google Scholar
Фуллард Р. Дж. И Карни Л. Г. Суточные вариации ферментов слезы человека. Exp. Eye Res. 38 , 15–26 (1984).
Артикул CAS PubMed Google Scholar
Yan, Q. et al. Измерение уровня глюкозы в слезе с помощью амперометрического биосенсора глюкозы / капиллярной трубки. Анал. Chem. 83 , 8341–8346 (2011).
Артикул CAS PubMed Google Scholar
Стучелл, Р. Н., Фельдман, Дж. Дж., Фаррис, Р. Л., Мандель, И. Д. Влияние техники сбора на состав слезы. Инвест. Офтальмол. Vis. Sci. 25 , 374–377 (1984).
CAS PubMed Google Scholar
Грин-Черч, К. Б., Николс, К. К., Кляйнхольц, Н. М., Чжан, Л. и Николс, Дж. Дж. Исследование протеома слезной пленки человека с использованием нескольких протеомных подходов. Мол. Vis. 14 , 456–470 (2008).
Б., Николс, К. К., Кляйнхольц, Н. М., Чжан, Л. и Николс, Дж. Дж. Исследование протеома слезной пленки человека с использованием нескольких протеомных подходов. Мол. Vis. 14 , 456–470 (2008).
CAS PubMed PubMed Central Google Scholar
Алексеев В. Л., Дас С., Finegold, D. N. & Asher, S.A. Фотонно-кристаллический глюкозочувствительный материал для неинвазивного мониторинга уровня глюкозы в слезной жидкости. Clin. Chem. 50 , 2353–2360 (2004).
Артикул CAS PubMed Google Scholar
Бен-Моше, М., Алексеев, В. Л. и Ашер, С. А. Быстродействующие сенсоры на основе фотонных кристаллов глюкозы с кристаллической коллоидной матрицей. Анал. Chem. 78 , 5149–5157 (2006).
Артикул CAS PubMed Google Scholar
Domschke, A., March, W. F., Kabilan, S. & Lowe, C. Первоначальное клиническое испытание голографического неинвазивного сенсора глюкозы с контактными линзами. Diabetes Technol. Ther. 8 , 89–93 (2006).
Артикул CAS PubMed Google Scholar
Халил О.С. Неинвазивный фотонно-кристаллический материал для определения глюкозы в слезах. Clin. Chem. 50 , 2236–2237 (2004).
Артикул CAS PubMed Google Scholar
Цай, З., Смит, Н. Л., Чжан, Дж. Т. и Ашер, С. А. Двумерные фотонно-кристаллохимические и биомолекулярные сенсоры. Анал. Chem. 87 , 5013–5025 (2015).
Артикул CAS PubMed Google Scholar
Эльшериф М., Хассан М. У., Йетисен А. К. и Батт Х. Биосенсоры для носимых контактных линз для непрерывного мониторинга уровня глюкозы с помощью смартфонов. ACS Nano 12 , 5452–5462 (2018).
ACS Nano 12 , 5452–5462 (2018).
Артикул CAS PubMed PubMed Central Google Scholar
Сунг, Ю., Кампа, Ф. и Ши, У. К. Самостоятельная многоцветная флуоресцентная микроскопия для смартфонов с открытым исходным кодом. Биомед. Опт. Экспресс 8 , 5075–5086 (2017).
Артикул CAS PubMed PubMed Central Google Scholar
Яо Х., Афанасьев А., Лахдесмаки И. и Парвиз Б. А. Двойной микромасштабный датчик глюкозы на контактной линзе, испытанный в условиях, имитирующих состояние глаза. Proc. IEEE Micro. Электро. Мех. Syst. 2011 , 25–28 (2011).
Google Scholar
Yao, H. et al.Контактная линза со встроенной телекоммуникационной схемой и датчиками для беспроводного и непрерывного мониторинга уровня глюкозы в слезе. J. Micromech. Microeng. 22 , 075007 (2012).
Артикул CAS Google Scholar
Ляо, Ю. Т., Яо, Х. Ф., Лингли, А., Парвиз, Б. и Отис, Б. П. А. КМОП-датчик глюкозы 3 мкВт для беспроводного мониторинга уровня глюкозы в слезах контактных линз. IEEE J. Твердотельные схемы 47 , 335–344 (2012).
Артикул Google Scholar
Kim, J. et al. Носимые интеллектуальные сенсорные системы, встроенные в мягкие контактные линзы для беспроводной диагностики глаза. Nat. Commun. 8 , 14997 (2017).
Артикул PubMed PubMed Central Google Scholar
Park, J. et al. Мягкие умные контактные линзы с интегрированными беспроводными схемами, датчиками глюкозы и дисплеями. Sci. Adv. 4 , eaap9841 (2018).
Артикул CAS PubMed PubMed Central Google Scholar

Kownacka, A. E. et al. Клинические доказательства использования неинвазивного биосенсора для определения уровня глюкозы в слезе в качестве альтернативы болезненному уколу пальцем для лечения диабета с использованием биополимерного покрытия. Биомакромолекулы 19 , 4504–4511 (2018).
Артикул CAS PubMed PubMed Central Google Scholar
Зубарева Т.В., Киселева З.М. Содержание катехоламинов в слезной жидкости здоровых людей и больных глаукомой. Ophthalmologica 175 , 339–344 (1977).
Артикул CAS PubMed Google Scholar
Zhou, L. et al. Углубленный анализ протеома слезы человека. J. Proteomics 75 , 3877–3885 (2012).
Артикул CAS PubMed Google Scholar
Пфаффе, Т., Купер-Уайт, Дж., Бейерлейн, П., Костнер, К. и Пуньядера, К. Диагностический потенциал слюны: текущее состояние и будущие применения. Clin. Chem. 57 , 675–687 (2011).
Артикул CAS PubMed Google Scholar
Джавид, М. А., Ахмед, А. С., Дюран, Р. и Тран, С. Д. Слюна как средство диагностики заболеваний полости рта и системных заболеваний. J. Oral Biol. Краниофак. Res. 6 , 66–75 (2016).
Артикул PubMed Google Scholar
Госвами Ю., Мишра Р., Агравал А. П. и Агравал Л. А. Биомаркеры слюны: обзор мощного диагностического инструмента. IOSR J. Dent. Med. Sci. 14 , 80–87 (2015).
Google Scholar
Campuzano, S., Yanez-Sedeno, P. & Pingarron, J.М. Электрохимические биоаффинные сенсоры для определения биомаркеров слюны. Trends Analyt. Chem. 86 , 14–24 (2017).
Артикул CAS Google Scholar
Soni, A. & Jha, S. K. Неинвазивный биосенсор глюкозы на бумажной полоске для анализа слюны. Биосенс. Биоэлектрон. 67 , 763–768 (2015).
Артикул CAS PubMed Google Scholar
Стивенс Р. С., Соелберг С. Д., Ниар С. и Ферлонг С. Е. Обнаружение кортизола в слюне с помощью переносной биосенсорной системы поверхностного плазмонного резонанса с фильтрующим потоком. Анал. Chem. 80 , 6747–6751 (2008).
Артикул CAS PubMed PubMed Central Google Scholar
Yamaguchi, M. et al. Переносной монитор симпатической нервной системы, использующий активность амилазы слюны, и ее подтверждение при оценке утомляемости водителя. Биосенс. Биоэлектрон. 21 , 1007–1014 (2006).
Артикул CAS PubMed Google Scholar
Баллеста Клавер, Дж., Валенсия Мирон, М. К. и Капитан-Валлви, Л. Ф. Одноразовый электрохемилюминесцентный биосенсор для определения лактата в слюне. Аналитик 134 , 1423–1432 (2009).
Артикул CAS PubMed Google Scholar
Zangheri, M. et al. Простой и компактный аксессуар для смартфона для количественного иммуноанализа бокового потока на основе хемилюминесценции для определения кортизола в слюне. Биосенс. Биоэлектрон. 64 , 63–68 (2015).
Артикул CAS PubMed Google Scholar
Mahosenaho, M. et al. Одноразовый биосенсор для определения альфа-амилазы в слюне человека. Микрохим. Acta 170 , 243–249 (2010).
Артикул CAS Google Scholar

Сони, А. и Джа, С. К. Неинвазивный биосенсор глюкозы в слюне для смартфонов. Анал. Чим. Acta 996 , 54–63 (2017).
Артикул CAS PubMed PubMed Central Google Scholar
Zhang, L., Yang, W., Yang, Y., Liu, H. & Gu, Z. Тестирование α-амилазы слюны на смартфоне для личных психологических измерений. Аналитик 140 , 7399–7406 (2015).
Артикул CAS PubMed PubMed Central Google Scholar
Roda, A. et al. Напечатанное на 3D-принтере устройство для хемилюминесцентного биосенсора на базе смартфона для определения содержания лактата в ротовой жидкости и поте. Аналитик 139 , 6494–6501 (2014).
Артикул CAS PubMed PubMed Central Google Scholar
Aguirre, A. et al. Сиалохимия: диагностический инструмент? Crit. Rev. Oral Biol. Med. 4 , 343–350 (1993).
Артикул CAS PubMed PubMed Central Google Scholar
Кауфман, Э. и Ламстер, И. Б. Диагностические применения слюны — обзор. Crit. Rev. Oral Biol. Med. 13 , 197–212 (2002).
Артикул PubMed PubMed Central Google Scholar
Чиаппин, С., Антонелли, Г., Гатти, Р., Де Пало, Э. Ф. Образец слюны: новый лабораторный инструмент для диагностики и базовых исследований. Clin. Чим. Acta 383 , 30–40 (2007).
Артикул CAS PubMed PubMed Central Google Scholar
Стрекфус, К. Ф. и Биглер, Л. Р. Слюна как диагностическая жидкость. Oral Dis. 8 , 69–76 (2002).
Артикул CAS PubMed PubMed Central Google Scholar
Мандель, И. Д. Диагностическое использование слюны. J. Oral Pathol. Med. 19 , 119–125 (1990).
Артикул CAS PubMed PubMed Central Google Scholar
Мэлон, Р. С. П., Садир, С., Балакришнан, М. и Корколес, Е. П. Биосенсоры на основе слюны: неинвазивный инструмент мониторинга для клинической диагностики. Biomed Res. Int. 2014 , 962903 (2014).
Артикул CAS PubMed PubMed Central Google Scholar
Чичарро, Дж. Л., Люсия, А., Перес, М., Вакеро, А. Ф. и Уренья, Р. Состав слюны и упражнения. Sports Med. 26 , 17–27 (1998).
Артикул CAS PubMed PubMed Central Google Scholar
Сингх М. Неинвазивный инструмент диагностики патологических состояний слюнных биомаркеров. Внутр. J. Pharm. Биол. Arch. 5 , 1–12 (2014).
Google Scholar
Гатти, Р. и Де Пало, Э. Ф. Обновление: гормоны слюны и физические упражнения. Сканд. J. Med. Sci. Спорт 21 , 157–169 (2011).
Артикул CAS PubMed Google Scholar
Viswanath, B., Choi, C. S., Lee, K. & Kim, S. Последние тенденции в разработке диагностических инструментов для сахарного диабета с использованием слюны пациента. Trends Analyt. Chem. 89 , 60–67 (2017).
Артикул CAS Google Scholar
Kim, J. et al. Неинвазивный биосенсор для каппы для непрерывного мониторинга метаболитов в слюне. Аналитик 139 , 1632–1636 (2014).
Артикул CAS PubMed Google Scholar
Segura, R. et al. Новый подход к оценке анаэробного метаболизма: измерение лактата в слюне. руб. J. Sports Med. 30 , 305–309 (1996).
руб. J. Sports Med. 30 , 305–309 (1996).
Артикул CAS PubMed PubMed Central Google Scholar
Сантос, Р. В. Т., Алмейда, А. Л. Р., Каперуто, Э. К., Мартинс, Э. мл. И Коста Роза, Л. Ф. Б. П. Влияние бега на 30 км на корреляцию лактата слюны и лактата в крови. Сост. Биохим. Physiol. B Biochem. Мол. Биол. 145 , 114–117 (2006).
Артикул CAS PubMed Google Scholar
Arakawa, T. et al. Биосенсор в капе с телеметрической системой для контроля уровня глюкозы в слюне: новый датчик кавитаса. Биосенс. Биоэлектрон. 84 , 106–111 (2016).
Артикул CAS PubMed Google Scholar
Ямагути М., Мицумори М. и Кано Ю. Неинвазивное измерение уровня глюкозы в крови с помощью слюны. IEEE Eng. Med. Биол. Mag. 17 , 59–63 (1998).
Артикул CAS PubMed Google Scholar
Agrawal, R. et al. Неинвазивный метод определения уровня глюкозы по слюне. J. Diabetes Metab. 4 , 2–5 (2013).
Google Scholar
Чжан В., Ду Ю. и Ван М. Л. Неинвазивный мониторинг глюкозы с использованием нанобиосенсора слюны. Sens. Biosensing Res. 4 , 23–29 (2015).
Артикул Google Scholar
Jurysta, C. et al. Концентрация и экскреция глюкозы в слюне у здоровых и больных диабетом. J. Biomed. Biotechnol. 2009 , 430426 (2009).
Артикул CAS PubMed PubMed Central Google Scholar
Кэмпбелл, М. Дж. А. Глюкоза в слюне людей, не страдающих диабетом, и пациентов с диабетом. Arch. Oral Biol. 10 , 197–205 (1965).
10 , 197–205 (1965).
Артикул CAS Google Scholar
Абикшиет П., Рамеш В. и Оза Н. Оценка глюкозы в слюнной секреции пациентов с сахарным диабетом. Diabetes Metab. Syndr. Ожирение. 5 , 149–154 (2012).
PubMed PubMed Central Google Scholar
Ценг, П., Напье, Б., Гарбарини, Л., Каплан, Д. Л. и Оменетто, Ф. Г. Функциональные трехслойные ВЧ-датчики для монтируемого на зубах беспроводного мониторинга полости рта и потребления пищи. Adv. Матер. 30 , e1703257 (2018).
Артикул CAS Google Scholar
Lee, Y. et al. Беспроводная внутриротовая гибридная электроника для количественного определения потребления натрия в режиме реального времени для лечения гипертонии. Proc. Natl Acad. Sci. США 115 , 5377–5382 (2018).
Артикул CAS Google Scholar
Сарпешкар Р. Универсальные принципы сверхнизкого энергопотребления и энергоэффективного дизайна. IEEE Trans. Circuits Syst. II 59 , 193–198 (2012).
Артикул Google Scholar
De Marcellis, A., Depari, A., Ferri, G., Flammini, A. & Sisinni, E. КМОП-интегрированный низковольтный маломощный управляемый по времени интерфейс для химических резистивных датчиков. Sens. Приводы B Chem. 179 , 313–318 (2013).
Артикул CAS Google Scholar
Zhang, Y. et al. Получение как высокой энергии, так и высокой плотности мощности за счет скручивания трех гибридных волокон на основе углеродных нанотрубок. Angew. Chem. Int. Эд. Англ. 54 , 11177–11182 (2015).
Артикул CAS Google Scholar
Huang, Y. et al. Текстильная батарея NiCo // Zn на основе токопроводящей пряжи с высокой плотностью энергии и высокой емкостью. АСУ Нано 11 , 8953–8961 (2017).
Артикул CAS Google Scholar
Месин, Л. Нейронный алгоритм для неоднородной и адаптивной выборки биомедицинских данных. Comput. Биол. Med. 71 , 223–230 (2016).
Артикул Google Scholar
Zi, Y. et al. Гибридная трибоэлектрическая-пироэлектрическая-пьезоэлектрическая ячейка для высокоэффективного сбора энергии и измерения с автономным питанием. Adv. Матер. 27 , 2340–2347 (2015).
Артикул CAS Google Scholar
Zhang, K. & Yang, Y. Солнечные элементы с гетеропереходом на наностержнях InP / ZnO с усилением термофотронного эффекта для носимой электроники с автономным питанием. Adv. Функц. Матер. 27 , 1703331 (2017).
Артикул CAS Google Scholar
Wen, Z. et al. Текстиль с автономным питанием для носимой электроники путем гибридизации волоконных наногенераторов, солнечных элементов и суперконденсаторов. Sci. Adv. 2 , e1600097 (2016).
Артикул CAS PubMed PubMed Central Google Scholar
Bandodkar, A. J. et al. Мягкие, эластичные, электронные биотопливные элементы на основе кожи с высокой плотностью мощности для поглощения энергии человеческого пота. Energy Environ.Sci. 10 , 1581–1589 (2017).
Артикул Google Scholar
Ха, М., Парк, Дж., Ли, Й. и Ко, Х. Трибоэлектрические генераторы и датчики для носимой электроники с автономным питанием. АСУ Нано 9 , 3421–3427 (2015).
Артикул CAS Google Scholar
Kim, C.S. et al. Носимая электрокардиография с автономным питанием с использованием переносного термоэлектрического генератора энергии. ACS Energy Lett. 3 , 501–507 (2018).
Артикул CAS Google Scholar
Imani, S., Mercier, PP, Bandodkar, AJ, Kim, J. & Wang, J. in 2016 IEE E International Symp osium on Circuits and Systems (ISCAS) 1122– 1125 (IEEE, 2016).
Хан С.Ю., Зомая А.Ю. И Аббас А. Справочник по крупномасштабным распределенным вычислениям в умном здравоохранении (Springer, 2017).
Ли, М., Лу, В. и Рен, К. Безопасность данных и конфиденциальность в беспроводных телесетях. IEEE Wirel. Commun. 17 , 51–58 (2010).
Артикул Google Scholar
Коц, Д., Гюнтер, К. А., Кумар, С. и Вайнер, Дж. П. Конфиденциальность и безопасность в мобильном здравоохранении: повестка дня исследований. Компьютер 49 , 22–30 (2016).
Артикул PubMed PubMed Central Google Scholar
Димитриу, Т. и Иоаннис, К. на Первом международном симпозиуме по прикладным наукам о биомедицинских и коммуникационных технологиях, 2008 ISABEL’08 1–5 (IEEE, 2008).
Дэниэлс, Дж. С. и Пурманд, Н. Импедансные биосенсоры без этикеток: возможности и проблемы. Электроанализ 19 , 1239–1257 (2007).
Артикул CAS PubMed PubMed Central Google Scholar
Xiao, Y., Lubin, A. A., Heeger, A. J. и Plaxco, K. W. Электронное определение тромбина в сыворотке крови без маркировки с помощью сенсора на основе аптамера. Angew. Chem. Int. Эд. Англ. 44 , 5456–5459 (2005).
Артикул CAS Google Scholar
Hammami, A., Raymond, N. & Armand, M. Литий-ионные батареи: неконтролируемый риск образования токсичных соединений. Nature 424 , 635–636 (2003).
Артикул CAS PubMed Google Scholar
Лиссабона Д. и Сни Т. Обзор опасностей, связанных с первичными литиевыми и литий-ионными батареями. Process Saf. Environ. Prot. 89 , 434–442 (2011).
Артикул CAS Google Scholar
Xu, S. et al. Эластичные аккумуляторы с самоподобными змеевидными межсоединениями и встроенными системами беспроводной подзарядки. Nat. Commun. 4 , 1543 (2013).
Артикул CAS PubMed Google Scholar
Berchmans, S. et al. Эпидермальная щелочная перезаряжаемая батарея Ag-Zn для татуировок, предназначенная для печати, для носимой электроники. J. Mater. Chem. Матер. 2 , 15788–15795 (2014).
Артикул CAS Google Scholar
Кумар Р.и другие. Полностью напечатанный растягивающийся аккумулятор Zn-Ag 2 O через гиперэластичный переплет для носимой электроники с автономным питанием. Adv. Energy Mater. 7 , 1–8 (2017).
Артикул CAS Google Scholar
Qiu, Y.C. et al. Вертикально ориентированные углеродные нанотрубки на углеродных нановолокнах: иерархическая трехмерная углеродная наноструктура для высокоэнергетических гибких суперконденсаторов. Chem.Матер. 27 , 1194–1200 (2015).
Артикул CAS Google Scholar
Li, Q., Lu, X. F., Xu, H., Tong, Y. X. & Li, G. R. Carbon / MnO 2 массивы двустенных нанотрубок с быстрой передачей ионов и электронов для высокопроизводительных суперконденсаторов. ACS Appl. Матер. Интерфейсы 6 , 2726–2733 (2014).
Артикул CAS PubMed Google Scholar
Ван, К., Ян, Дж. И Фан, З. Дж. Углеродные материалы для суперконденсаторов с высокими объемными характеристиками: дизайн, прогресс, проблемы и возможности. Energy Environ. Sci. 9 , 729–762 (2016).
Артикул CAS Google Scholar
O’Connor, T. F. et al. Носимые органические солнечные элементы с высокой устойчивостью к циклическим изгибам: критерии выбора материалов. Sol. Energy Mater. Sol. Ячейки 144 , 438–444 (2016).
Артикул CAS Google Scholar
Kim, B.J. et al. Высокоэффективные и долговечные солнечные элементы из перовскита: к носимому источнику энергии. Energy Environ. Sci. 8 , 916–921 (2015).
Артикул CAS Google Scholar
Yang, J.H. и другие. Влияние дизайна одежды на получение пьезоэлектричества от совместного движения. Smart Mater. Struct. 25 , 1–15 (2016).
Артикул CAS Google Scholar
Pu, X. et al. Носимый самозарядный силовой текстиль на основе суперконденсаторов из гибкой пряжи и тканевых наногенераторов. Adv. Матер. 28 , 98–105 (2016).
Артикул CAS PubMed Google Scholar
О, Дж.Y. et al. Носимые термоэлектрические генераторы на основе нанолистов на основе химически расслоенных дихалькогенидов переходных металлов. Energy Environ. Sci. 9 , 1696–1705 (2016).
Артикул CAS Google Scholar
Лу, З. С., Чжан, Х. Х., Мао, К. П. и Ли, К. М. Носимый термоэлектрический генератор на основе шелковой ткани для сбора энергии из человеческого тела. заявл. Энергетика 164 , 57–63 (2016).
Артикул CAS Google Scholar
Джиа, В., Вальдес-Рамирес, Г., Бандодкар, А. Дж., Виндмиллер, Дж. Р. и Ван, Дж. Эпидермальные биотопливные клетки: сбор энергии из потоотделения человека. Angew. Chem. Int. Эд. Англ. 52 , 7233–7236 (2013).
Артикул CAS PubMed Google Scholar
Jia, W. Z. et al. Носимые текстильные биотопливные элементы для питания электроники. J. Mater. Chem. Матер. 2 , 18184–18189 (2014).
Артикул CAS Google Scholar
Бандодкар, А. Дж. И Ван, Дж. Носимые биотопливные элементы: обзор. Электроанализ 28 , 1188–1200 (2016).
Артикул CAS Google Scholar
Ogawa, Y. et al. Эластичный биотопливный элемент с ферментно-модифицированным проводящим текстилем. Биосенс. Биоэлектрон. 74 , 947–952 (2015).
Артикул CAS PubMed Google Scholar
Фальк М., Андоралов В., Силов М., Тоскано М. Д. и Шлеев С. Миниатюрный биотопливный элемент как потенциальный источник энергии для контактных линз, чувствительных к глюкозе. Анал. Chem. 85 , 6342–6348 (2013).
Артикул CAS PubMed Google Scholar
Граттьери, М. и Минтир, С. Д. Биосенсоры с автономным питанием. ACS Sens. 3 , 44–53 (2018).
Артикул CAS PubMed Google Scholar
Йетисен, А. К., Мартинес-Уртадо, Дж. Л., Гарсиа-Мелендрес, А., Васконселлос, Ф. Д. и Лоу, К. Р. Алгоритм для смартфонов с межфоновой повторяемостью для анализа колориметрических тестов. Sens. Приводы B Chem. 196 , 156–160 (2014).
Артикул CAS Google Scholar
Биосенсоры — обзор | Темы ScienceDirect
2.1 Типы биосенсоров
Биосенсоры можно классифицировать по способу физико-химической трансдукции или типу элемента биопознавания. По преобразователю биосенсоры можно разделить на электрохимические, оптические, тепловые и пьезоэлектрические биосенсоры [10].
Электрохимические биосенсоры [11] можно далее классифицировать как амперометрические биосенсоры (которые измеряют ток, возникающий при окислении или восстановлении электроактивного продукта или реагента), потенциометрические биосенсоры (которые измеряют потенциал электрода биосенсора относительно электрода сравнения), и кондуктометрические биосенсоры (которые измеряют изменение проводимости, возникающее в результате биохимической реакции).Электрохимические биосенсоры являются наиболее изученными биосенсорами, поскольку они обладают преимуществом низкого предела обнаружения, специфичности, простоты конструкции и простоты эксплуатации. Благодаря последним достижениям в области электронного оборудования, эти биосенсоры могут быть уменьшены до размеров «лаборатория на чипе» для мониторинга in vivo или в качестве портативного устройства для мониторинга на месте [11].
Оптические биосенсоры основаны на измерении поглощенного или испускаемого света в результате биохимической реакции.Оптические биосенсоры основаны на различных оптических методах, таких как абсорбция, флуоресценция, люминесценция, поверхностный плазмонный резонанс (SPR) и др. [12]. Среди них колориметрические биосенсоры широко исследуются из-за простоты обнаружения видимого изменения цвета, показываемого этими биосенсорами. Плазмонные свойства пленок из благородных металлов используются в биосенсорах на основе ППР. Появление волоконной оптики дало толчок развитию различных оптических биосенсоров.
Термобиосенсоры основаны на измерении тепловых изменений, происходящих при биохимическом распознавании.Большинство биохимических реакций связано с изменением энтальпии, а изменение температуры можно измерить с помощью чувствительных термисторов.
Пьезоэлектрические биосенсоры включают измерение изменения массы, происходящего в результате биомолекулярного взаимодействия. Пьезоэлектрические кристаллы используются для измерения изменения массы путем корреляции с изменением частоты колебаний пьезокристалла.
В зависимости от типа используемой единицы биораспознавания биосенсоры можно классифицировать как ферментативные, основанные на нуклеиновых кислотах, на основе аптамеров, на основе антител и целые клеточные биосенсоры [2].
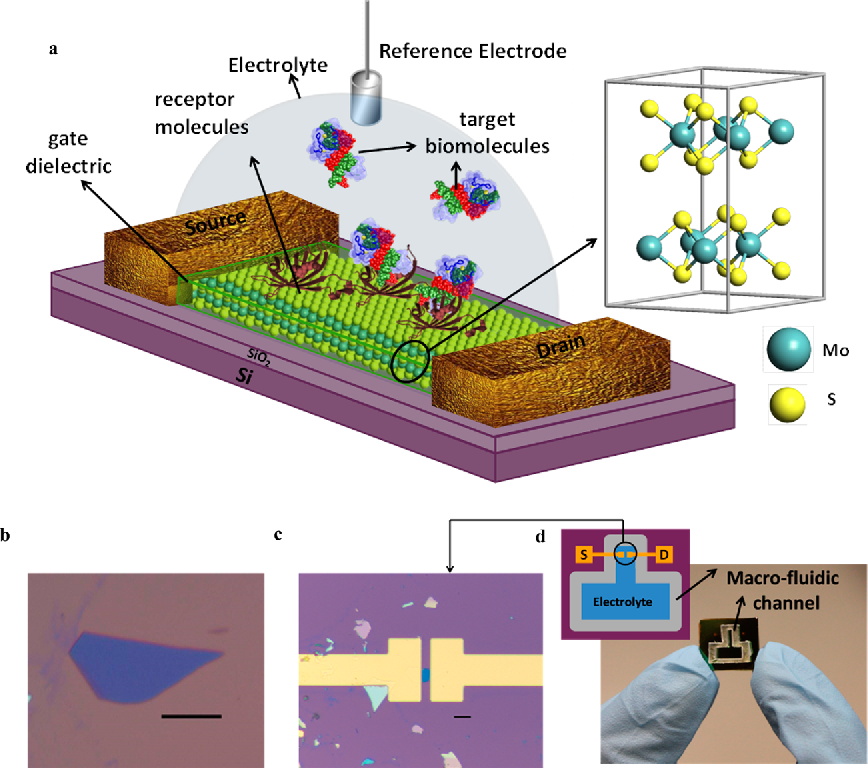
Границы | Последние достижения в области биосенсорных технологий для потенциальных приложений — обзор
Введение
Термин «биосенсор» относится к мощному и инновационному аналитическому устройству, включающему биологический чувствительный элемент с широким спектром приложений, таких как открытие лекарств, диагностика, биомедицина, безопасность и переработка пищевых продуктов, мониторинг окружающей среды, защита и безопасность. Первый биосенсор, изобретенный Кларком и Лайонс (1962) для измерения глюкозы в биологических образцах, использовал стратегию электрохимического обнаружения кислорода или перекиси водорода (Fracchiolla et al., 2013; Turner, 2013) с использованием электрода с иммобилизованным глюкозооксидазным электродом. С тех пор был достигнут невероятный прогресс (Turner, 2013) как в технологии, так и в применении биосенсоров с инновационными подходами, включающими электрохимию, нанотехнологии и биоэлектронику. Учитывая феноменальные достижения в области биосенсоров, этот обзор направлен на представление различных технических стратегий, принятых для разработки биосенсоров, чтобы предоставить фундаментальные знания и представить научный сценарий биосенсорной технологии.С акцентом на инструменты исследования, которые демонстрируют, как характеристики биосенсоров эволюционировали от классических электрохимических до оптических / визуальных, полимеров, кремнезема, стекла и наноматериалов для улучшения предела обнаружения, чувствительности и селективности. Интересно, что микробы и биолюминесценция (Du et al., 2007) также в значительной степени способствовали созданию биосенсоров на основе меток, в то время как биосенсоры без меток предполагали использование транзисторных или конденсаторных устройств и наноматериалов. Биосенсоры обеспечивают основу для понимания технологических усовершенствований оборудования, включая сложные высокопроизводительные машины для количественных биологов и портативные качественные или полуколичественные устройства для неспециалистов.Наконец, выделены текущие тенденции исследований, будущие проблемы и ограничения в этой области. Настоящий обзор разделен на различные подразделы, описывающие две основные технические стратегии, которым следуют различные типы биосенсорных устройств, начиная от электрохимических, оптических / визуальных, полимеров, кремнезема, стекла и наноматериалов. Эти устройства были разработаны для конкретных целей, и их обзор предоставит читателям исчерпывающие данные об устройствах биосенсоров и их применениях.
Технические стратегии
Технические стратегии (Turner, 2013), используемые в биосенсорах, основаны на детектировании на основе меток и без меток.Обнаружение на основе меток в основном зависит от конкретных свойств соединений-меток для целевого обнаружения. Эти типы биосенсоров хотя и надежны, но часто требуют комбинации специального чувствительного элемента, изготовленного с иммобилизованным целевым белком. С другой стороны, метод без метки (Citartan et al., 2013; Sang et al., 2015) позволяет обнаруживать целевые молекулы, которые не помечены или которые трудно пометить. Недавние междисциплинарные подходы к биотехнологии с биоинженерией, электротехникой и электроникой проложили путь к разработке биосенсоров без этикеток для различных методов обнаружения с широким спектром приложений в областях медицины и экологии.
Электрохимические биосенсоры
Классическое открытие глюкометра с использованием биосенсоров на основе глюкозооксидазы (Clark and Lyons, 1962) является первым в линии открытия электрохимических биосенсоров. Биосенсоры глюкозы широко популярны в больницах и диагностических клиниках, поскольку они необходимы пациентам с диабетом для периодического контроля уровня глюкозы в крови. Однако биосенсоры глюкозы часто имеют недостатки из-за нестабильной активности ферментов или неоднородности (Harris et al., 2013), для которого необходима дальнейшая калибровка. Фактически, эти потенциальные недостатки привели к изобретению ряда биомолекул (Turner, 2013; Wang et al., 2013), обладающих различными электрохимическими свойствами, что проложило путь к открытию более жизнеспособных биосенсоров глюкозы. В последнее время электрохимические биосенсоры (Wang et al., 2014) обычно изготавливают путем модификации поверхности металлических и угольных электродов с использованием биоматериалов, таких как ферменты, антитела или ДНК. Выходной сигнал биосенсора обычно генерируется при специфическом связывании или каталитических реакциях биоматериалов (Wang et al., 2014) на поверхности электрода. Необходимость открытия электрохимических сенсоров стала незаменимой для клинической диагностики заболеваний (Gruhl et al., 2013), где раннее обнаружение или мониторинг кажутся важными. В этом контексте разработка неферментативных биосенсоров часто рассматривается с использованием синтетических материалов вместо белков. Интересно, что различные типы биомолекул обладают разной электродной стабильностью и селективностью, что в конечном итоге способствует разработке новых типов электрохимических биосенсоров для различных целей.На основе их использования разработано несколько типов электрохимических биосенсоров. Как объяснялось выше, биосенсоры глюкозы (Harris et al., 2013) претерпели быструю эволюцию со времени разработки. С этой точки зрения Wang et al. (2014) проанализировали прогресс ферроценбороновой кислоты (FcBA) и бороновых кислот, модифицированных ферроценом (Fc), для разработки биосенсоров благодаря присутствию сайта связывания (то есть фрагмента бороновой кислоты) и электрохимически активной части (то есть остатка Fc). ). FcBA и его производные обладают уникальным свойством связывания с 1,2- или 1,3-диольными остатками сахаров, что приводит к образованию циклических сложноэфирных связей бороната.Окислительно-восстановительные свойства аддукта FcBA и сахара отличаются от свойств свободного FcBA, что составляет основу для электрохимического обнаружения. В дополнение к этому, бороновые кислоты обладают сродством к связыванию с ионами Fe — , что дает дополнительное преимущество для разработки нетрадиционных ионоселективных электродов с использованием иона F — . Углеводородные цепи, присутствующие в полипептидной цепи HbA1c, можно измерить с помощью электрохимического обнаружения на основе FcBA. Основным ограничением при использовании этого метода является требование иммобилизации производных FcBA (Wang et al., 2014) на поверхности электродов, так как эти производные добавляются в растворы образцов в качестве реагентов. Использование полимеров и / или серебряных электродов с подходящей модификацией производных FcBA может привести к улучшению электрохимического сенсора FcBA для биомедицинских областей, включая диагностику диабета, где измерение глюкозы будет дополнительным.
Электрохимический биосенсор для оценки уровней антиоксидантов и активных форм кислорода в физиологических системах (Mello et al., 2013) — еще одно современное изобретение.Основное применение в этой области — определение мочевой кислоты как основного конечного продукта метаболизма пуринов в жидкости организма (Erden and Kilic, 2013), что обеспечивает диагностический инструмент для различных клинических отклонений или заболеваний. Однако важно разработать экономичный и чувствительный метод. Электрохимический подход для измерения окисления мочевой кислоты, а также для количественного определения глюкозы кажется идеальным. Однако сходство мочевой кислоты с точки зрения окисления с аскорбиновой кислотой представляет собой серьезное экспериментальное препятствие для разработки высокочувствительного электрохимического биосенсора.Чтобы преодолеть это, ученые разработали биосенсор на основе амперометрического обнаружения (Erden and Kilic, 2013), который обладает способностью измерять как восстановительный, так и окислительный потенциалы. Учитывая стоимость и воспроизводимость этой процедуры, важно иммобилизовать или нанести трафаретную печать фермент на электроды или электроды на основе наноматериалов, которые идеально подходят для разработки одноразовых, селективных, экономичных и чувствительных биосенсоров мочевой кислоты для рутинного анализа. . В этом отношении недавние достижения в области трехмерной биопечати (Turner, 2013) направлены на создание биосенсоров с живыми клетками, инкапсулированными в трехмерных микросредах.В том же направлении был разработан новый беспроводной биосенсор каппы для определения уровня мочевой кислоты в слюне в режиме реального времени и непрерывным способом (Kim et al., 2015), и технология может быть расширена до носимых инструментов мониторинга для различных состояний здоровья и здоровья. фитнес-приложения. Электрохимические биосенсоры успешно использовались для измерения гормонов (Bahadir and Sezginturk, 2015), но их перспектива требует подробного рассмотрения. Еще одна потенциальная область развития технологий в области биосенсоров связана с нацеливанием на нуклеиновые кислоты.Хорошо известно, что экспрессия клеточной миРНК является идеальным биомаркером для диагностики начала заболевания, а нацеливание на них повышает эффективность генной терапии генетических нарушений. Обычно miRNA обнаруживают с помощью нозерн-блоттинга, микрочипов и полимеразной цепной реакции. Современные технологии обеспечивают идеальные электрохимические биосенсоры для обнаружения miRNA, основанные на детектировании без метки, включающем окисление гуанина после образования гибрида с участием miRNA (Hamidi-Asl et al., 2013) и его зонд захвата, заменяющий инозин.Все эти изобретения связаны с современными подходами к биофабрификации для продвижения технологии биосенсоров на основе электрохимии в биомедицине.
Мониторинг окружающей среды (Long et al., 2013; Verma and Bhardwaj, 2015) — еще один важный аспект, требующий биосенсорной технологии для быстрой идентификации остатков пестицидов и предотвращения опасностей для здоровья. Традиционные методы, такие как высокоэффективная жидкостная хроматография, капиллярный электрофорез и масс-спектрометрия, эффективны для анализа пестицидов в окружающей среде (Verma and Bhardwaj, 2015), однако существуют ограничения, например сложность, трудоемкость процедур, требование высококачественные инструменты и операционные возможности.Следовательно, простые биосенсоры, кажется, обладают огромными преимуществами, однако разработать унифицированный датчик для анализа различных классов пестицидов сложно. С этой целью были разработаны определенные биосенсоры на основе ферментов (Pundir and Chauhan, 2012; Verma and Bhardwaj, 2015), чтобы понять физиологическое воздействие пестицидов на окружающую среду, безопасность пищевых продуктов и контроль качества. Для этого были разработаны биосенсоры на основе ингибирования ацетилхолинэстеразы (AChE) (Pundir, Chauhan, 2012). За последние десять или два десятилетия для быстрого анализа этот метод был дополнительно усовершенствован с последними разработками биосенсоров на основе ингибирования AChE, включая методы иммобилизации и другие различные стратегии изготовления.Аналогичным образом были разработаны пьезоэлектрические биосенсоры (Marrazza, 2014) для обнаружения пестицидного воздействия органофосфатов и карбаматов в окружающей среде. Известно, что хлорорганические пестициды влияют на экосистему (Senthilkumaran, 2015), а такие пестициды, как эндосульфан, наносят значительный ущерб. Действительно, такие пестициды по-разному изменяют репродуктивную систему самцов и самок рыб (Senthilkumaran, 2015), и, учитывая эти факты, изобретение биосенсоров для тестирования водной экосистемы будет иметь большее значение с точки зрения биомагнификации.Чтобы удовлетворить спрос, электрохимический биосенсор претерпел революцию (Turner, 2013; Verma and Bhardwaj, 2015) с быстрым прогрессом в производстве и использовании наноматериалов, кварца или кремнезема. Важно уделять особое внимание выбору рецепторов для разработки биосенсора, использованию различных методов трансдукции и стратегий быстрого скрининга для применения биосенсора в пищевых продуктах, а также экологической безопасности и мониторингу. Чтобы сделать это возможным, производство биосенсоров кажется важным, и достижения в этой области были категорически объяснены ниже.
Оптические / визуальные биосенсоры
Как объяснялось выше, экологические или биомедицинские приложения требуют разработки простых, быстрых и сверхчувствительных биосенсоров. Это возможно с помощью иммобилайзеров (Guo, 2013; Ogi, 2013; Turner, 2013; Peng et al., 2014; Shen et al., 2014), начиная с золота, материалов на основе углерода, кремния, кварца или стекла. Фактически, включение наночастиц золота или квантовых точек с использованием микропроизводства обеспечивает новую технологию (Schneider and Clark, 2013) для разработки высокочувствительных и портативных биосенсоров на основе фермента цитохрома P450 для определенных целей.Кроме того, волоконно-оптические химические сенсоры имеют большое значение в различных областях, таких как открытие лекарств, биосенсор и биомедицина. Совсем недавно гидрогели, используемые в качестве сенсоров на основе ДНК, стали новыми материалами для иммобилизации с помощью волоконно-оптической химии (Dias et al., 2014). По сравнению с другими материалами, иммобилизация в гидрогелях происходит в 3D, что обеспечивает высокую нагрузочную способность воспринимающих молекул. Гидрогели (полиакриламид) представляют собой гидрофильные сшитые полимеры (Khimji et al., 2013) и могут быть изготовлены в различных формах для иммобилизации, от тонких пленок до наночастиц.Гидрогели считаются простым субстратом для иммобилизации ДНК с другими преимуществами, такими как захват, контролируемое высвобождение, усиление аналитов и защита ДНК. Эти особенности уникальны для гидрогелей по сравнению с другими материалами, которые обеспечивают биомолекулярную иммобилизацию (Khimji et al., 2013). Кроме того, хорошая оптическая прозрачность гидрогелей обеспечивает удобную стратегию визуального обнаружения. Детальные методы иммобилизации ДНК-биосенсоров (Khimji et al., 2013) в монолитных полиакриламидных гелях и гелевых микрочастицах часто рассматриваются как технический прогресс в области биосенсорных технологий.Обнаружение одиночных молекул также было разработано с использованием электрохимического окисления гидразина для обнаружения ДНК (Kwon and Bard, 2012).
Биосенсоры из диоксида кремния, кварца / кристалла и стекла
Последние методы в разработке биосенсоров привели к использованию кремнезема, кварца или кристаллов и материалов из стекла благодаря их уникальным свойствам. Среди них кремниевые наноматериалы обладают большим потенциалом для технологических достижений в области применения биосенсоров благодаря их биосовместимости, распространенности, электронным, оптическим и механическим свойствам.Кроме того, кремниевые наноматериалы не токсичны, что является важным условием биомедицинских и биологических применений. Кремниевые наноматериалы (Peng et al., 2014; Shen et al., 2014) предлагают широкий спектр применений, начиная от биовизуализации, биосенсинга и лечения рака. Кроме того, флуоресцентные кремниевые наноматериалы находят долгосрочное применение в биоимиджинге. Интересно, что кремниевые нанопроволоки в сочетании с наночастицами золота дают гибриды, которые используются (Shen et al., 2014) в качестве новых нанореагентов на основе кремния для эффективного лечения рака.Ковалентное присоединение тиол-модифицированных олигомеров ДНК к диоксиду кремния или стеклу обеспечивает пленки ДНК для лучшего использования в УФ-спектроскопии и методах гибридизации (Khimji et al., 2013). Несмотря на множество преимуществ использования наночастиц кремния, необходимо оценить широко распространенные проблемы, такие как разработка крупномасштабных недорогих методов производства и биосовместимость после биомолекулярного контакта. Решение этих проблем позволит кремниевым наноматериалам стать современными компонентами биосенсоров. Кварцевые микровесные биосенсоры без проводов и электродов представляют собой еще одну платформу для анализа взаимодействий между биомолекулами с высокой чувствительностью.Пульсации кварцевых генераторов возбуждались и регистрировались антеннами посредством электромагнитных волн без каких-либо проводных соединений. Это бесконтактное точное измерение является ключевой особенностью для разработки сверхвысокой чувствительности обнаружения белков в жидкостях с использованием приборов на основе кварцевых биосенсоров (Ogi, 2013). Учитывая уникальные свойства кремнезема, кварца или стекла, было разработано несколько новых биосенсоров с использованием передовых технологий для улучшения биоинструментов в биомедицинских технологиях, но экономическая эффективность и биобезопасность требуют внимания (Ogi, 2013; Turner, 2013; Peng et al., 2014; Шен и др., 2014).
Биосенсоры на основе наноматериалов
Широкий спектр наноматериалов, начиная от наночастиц золота, серебра, кремния и меди, материалов на основе углерода, таких как графит, графем и углеродные нанотрубки, используется для разработки иммобилизации биосенсоров (Li et al., 2011; Zhou et al. , 2012; Guo, 2013; Ko et al., 2013; Senveli, Tigli, 2013; Valentini et al., 2013; Lamprecht et al., 2014; Shen et al., 2014; Sang et al., 2015). Кроме того, материалы на основе наночастиц обеспечивают высокую чувствительность и специфичность для разработки электрохимических и других типов биосенсоров.Среди металлических наночастиц наночастицы золота имеют потенциальное применение из-за их устойчивости к окислению (Hutter and Maysinger, 2013) и почти не обладают токсичностью, в то время как другие наночастицы, такие как серебро, окисляются и проявляют токсичность, если используются для внутреннего применения в медицине, например, лекарственные препараты. Доставка. В целом использование наноматериалов для биосенсоров связано с потенциальными проблемами, которые необходимо решить, если они используются в биомедицине (Su et al., 2011). Кроме того, стратегии усиления сигнала на основе наночастиц имеют потенциальные преимущества и недостатки (Ding et al., 2013). Тем не менее наноматериалы считаются критическими компонентами в биоаналитических устройствах просто для повышения чувствительности и пределов обнаружения для обнаружения одиночных молекул (Turner, 2013). В этом контексте стоит упомянуть изобретение наночастиц на основе платины для электрохимической амплификации с ответом на одну метку для обнаружения низкой концентрации ДНК (Kwon and Bard, 2012). Точно так же полупроводниковые квантовые точки и нанокристаллы оксида железа, обладающие оптическими, а также магнитными свойствами, могут быть эффективно связаны с лигандами, нацеленными на опухоль, такими как моноклональные антитела, пептиды или небольшие молекулы, для нацеливания на опухолевые антигены с высокой аффинностью и специфичностью (Nie et al., 2007). Технология квантовых точек может применяться для понимания микросреды опухоли в терапевтических целях, а также для доставки наномедицинских средств (Jain, 2013). Использование биосенсоров с кантилеверами (милли-, микро- и нанокантилеверы) даже подвергается критическому анализу в связи с их потенциалом применения в различных областях.
Генетически кодированные или синтетические флуоресцентные биосенсоры
Разработка меченого биосенсора с использованием генетически кодируемой или синтетической флуоресценции проложила путь для понимания биологического процесса, включая различные молекулярные пути внутри клетки (Kunzelmann et al., 2014; Олдах и Чжан, 2014; Randriamampita и Lellouch, 2014). Фактически, открытие антител с флуоресцентной меткой было впервые сделано для изображения фиксированных клеток (Oldach and Zhang, 2014). Эта стратегия действительно предоставила новые способы разработки таких сенсоров с использованием биологических белков, связывания малых молекул с аналитами и вторичных мессенджеров. Совсем недавно были разработаны флуоресцентные биосенсоры для анализа моторных белков с использованием обнаружения отдельных молекул с определенной концентрацией аналита (Kunzelmann et al., 2014). Несмотря на эти преимущества, методология обнаружения и анализа зондов кажется сложной. Изобретение зеленого флуоресцентного белка и других флуоресцентных белков дало несколько преимуществ с точки зрения конструкции и эффективности оптического зонда (Oldach and Zhang, 2014). До последнего десятилетия генетически закодированные биосенсоры, нацеленные на молекулы, связанные с производством энергии, активными формами кислорода и цАМФ, обеспечивали лучшее понимание физиологии митохондрий (De et al., 2014). Точно так же цГМФ является важной сигнальной молекулой и лекарственной мишенью для сердечно-сосудистой системы.В связи с этим были разработаны биосенсоры на основе резонансного переноса энергии Ферстера (FRET) (Thunemann et al., 2014) для визуализации цГМФ, цАМФ и Ca 2+ в клетках. Некоторые из этих сенсоров эффективно работают в первичной культуре и визуализации живых клеток in vivo (Oldach and Zhang, 2014; Randriamampita and Lellouch, 2014). В настоящее время выяснено довольно много ключевых аспектов для разработки сенсоров для визуализации живых животных. Оптимизируя такие подходы, малоугловое рассеяние рентгеновских лучей для разработки кальциевых сенсоров и зондов флуоресцентного резонансного переноса энергии для определения киназ называют лучшими методами биосенсоров в современной физиологии (Oldach and Zhang, 2014).Таким образом, было разработано несколько биосенсоров на основе микробных и клеточных органелл с конкретными мишенями (Su et al., 2012). Как объяснялось ранее, электрохимические, электромеханические и оптические биосенсоры разработаны для обнаружения miRNA гораздо более эффективно, чем другие молекулярные методы (Johnson and Mutharasan, 2014). Учитывая появление in vivo визуализации с помощью низкомолекулярных биосенсоров, было выявлено лучшее понимание клеточной активности и многих других молекул, начиная от ДНК, РНК и миРНК (Khimji et al., 2013; Тернер, 2013; Джонсон и Мутарасан, 2014). Теперь трансформация в этой области требует полногеномного подхода с использованием более совершенных оптических генетических биосенсоров. В настоящее время также широко признано, что оптические биосенсоры с комбинацией флуоресценции и малых молекул / наноматериалов достигли большего успеха с точки зрения приложений и чувствительности.
Микробные биосенсоры посредством синтетической биологии и генетической / белковой инженерии
Более поздняя тенденция в мониторинге окружающей среды и биоремедиации заключается в использовании современных инновационных технологий, основанных на генной / белковой инженерии и синтетической биологии, для программирования микроорганизмов с определенными выходными сигналами, чувствительностью и селективностью.Например, живая клетка, обладающая ферментативной активностью по разложению ксенобиотических соединений, найдет более широкое применение в биоремедиации (Park et al., 2013). Точно так же биосенсоры на основе микробного топлива были разработаны с целью мониторинга биохимической потребности в кислороде и токсичности в окружающей среде. Бактерии могут разрушать органический субстрат и вырабатывать электричество для ферментации. По сути, технология включает использование био-электрохимического устройства, которое контролирует мощность микробного дыхания для преобразования органических субстратов непосредственно в электрическую энергию.Несмотря на эти возможности, у микробных биосенсоров существуют ограничения из-за низкой удельной мощности с точки зрения производственных и эксплуатационных затрат. Прилагаются усилия для значительного повышения производительности и сокращения затрат с помощью новых системных подходов, в которых технологии предоставили платформу для разработки автономных микробных биосенсоров (Du et al., 2007; Sun et al., 2015). Другая область микробных биосенсоров раскрывает потенциальное применение для обнаружения пестицидов и тяжелых металлов (Gutierrez et al., 2015), в которых эукариотические микроорганизмы имеют преимущество перед прокариотическими клетками. Это в первую очередь связано с преимуществом разработки цельноклеточных биосенсоров (Gutierrez et al., 2015) с селективными и чувствительными приложениями, связанными с обнаружением токсичности тяжелых металлов и пестицидов. Более того, микробы высших эукариот могут иметь более широкую чувствительность к различным токсичным молекулам и иметь отношение к высшим животным. Интересно, что применение микробных биосенсоров разнообразно: от мониторинга окружающей среды до производства энергии.Инновационные стратегии предоставят новые биосенсоры с более высокой чувствительностью, чем селективность от микробного происхождения от эукариот до сконструированных прокариот. В будущем эти микробные биосенсоры (Du et al., 2007; Sun et al., 2015) найдут более широкое применение для мониторинга загрязнения окружающей среды металлами и устойчивого производства энергии.
Технологическое сравнение биосенсоров
В предыдущих разделах мы рассмотрели различные типы биосенсоров и их применение.В этой части мы сравнили биосенсоры с точки зрения технологии, специфичности и предела обнаружения, линейного диапазона, времени анализа, стоимости и портативности.
Инновации в электрохимических датчиках с высокопроизводительными методами, ориентированными на предел обнаружения, время анализа и портативность, обеспечили широкие потребительские рынки недорогих биосенсоров для тестов на глюкозу и беременность, использующих полоску иммобилизации против хорионического гонадотропина человека с технологией бокового потока (Turner, 2013 ). Иммобилизация аналитов с использованием полимеров и наноматериалов является ключом к повышению чувствительности и предела обнаружения.С этой точки зрения технология бокового потока позволяет напрямую доставлять образцы в желаемое место, чтобы создать определенные взаимодействия вместо случайных. Многие из вышеупомянутых биосенсоров использовали эту технологию и, по сути, проложили путь для биопроизводства с использованием контактного или бесконтактного формирования рисунка. Использование наноматериалов, таких как золото, серебро и биофабрификация на основе кремния, привело к появлению новых методов. Кроме того, нанесение полимерных покрытий на эти наноматериалы произвело революцию в контактном электрохимическом зондировании.Одним из основных преимуществ электрохимических сенсоров этого типа является чувствительность и специфичность при анализе в реальном времени. Однако ограничениями являются регенеративная способность или длительное использование полимеров / других материалов, однако снижение стоимости делает такие электрохимические датчики более доступными. Обнаружение единичного аналита с использованием контактного зондирования имеет огромные преимущества, например, измерение молекул в реальном времени с высокой специфичностью. Для этого были введены FRET, биолюминесцентный резонансный перенос энергии, флуоресцентные датчики и датчики на основе поверхностного плазмонного резонанса (Dias et al., 2014) для повышения специфичности и чувствительности с точки зрения обнаружения одиночных молекул. Эти методы имеют ограничения при обнаружении нескольких аналитов из-за перекрытия излучения сигналов, однако методы резонансной передачи энергии часто демонстрируются для обнаружения нескольких аналитов, что высоко ценится в клинической диагностике из-за разницы в биомаркерах между пациентами и родственными заболеваниями. Использование микро- или нанокантилеверов в качестве преобразователей при биофабрификации электрохимических сенсоров также имеет более широкие перспективы при обнаружении нескольких аналитов.Кроме того, бесконтактные датчики, использующие трехмерную биопечать с использованием струйной печати или лазерной прямой записи, обеспечивали лучшие результаты. Тем не менее, стоимость и настраиваемые возможности этих методов сильно ограничены. Интересно, что большинство этих высокопроизводительных биосенсоров были объединены с электрохимическим зондированием для конкретных приложений. Некоторые из наиболее известных чувствительных портативных амперометрических электрохимических биосенсоров, работающих в режиме реального времени, были разработаны (Kim et al., 2015) для диагностики заболеваний с использованием биологических жидкостей.В общем, электрохимические биосенсоры в сочетании с биофабрификацией имеют низкий предел обнаружения для специфичности обнаружения одного аналита с анализом в реальном времени, а также по доступной цене с учетом портативности устройства.
Оптические биосенсоры — следующая крупная технология в области биосенсоров, включающая оптоволоконную химию. Детектирование одиночных молекул, например ДНК или пептидов, лучше всего проводить с использованием поперечного сшивания на основе гидрогеля из-за того преимущества, что они обладают высокой нагрузочной способностью и гидрофильностью.Позднее был разработан оптический биосенсор для измерения ДНК (Kwon and Bard, 2012), который нашел более широкое применение в биомедицине и судебной медицине. Комбинация биологических материалов, таких как фермент / субстрат, антитело / антиген и нуклеиновые кислоты, произвела революцию в технологии оптических биосенсоров. Кроме того, в биосенсорную систему также можно включать микроорганизмы, клетки животных или растений и срезы тканей. Последние достижения в области молекулярной оптоэлектроники позволили даже предложить системы оптического биометрического распознавания.Интегрированная оптическая технология позволяет встраивать как пассивные, так и активные оптические компоненты на одну и ту же подложку для разработки минимизированных компактных сенсорных устройств с использованием изготовления нескольких датчиков на одном кристалле. В этом контексте высококачественные полимеры предоставили гибридные системы для оптических биосенсоров. Фактически, технология биосенсора на основе оптики была усовершенствована благодаря современным инновациям в анализе морфологии поверхности с использованием высокотехнологичной электронной и атомно-силовой микроскопии. Несмотря на это, предел обнаружения оптических биосенсоров никогда не был близок к фемто-уровню, учитывая стоимость оборудования и отсутствие портативности устройства.С этой целью современная оптическая технология с использованием наномеханических биосенсоров на основе микрокантилеверов и технологии поверхностного резонанса предоставила инновационные ДНК-чипы, по крайней мере, для специфического и чувствительного анализа в реальном времени (Scheller et al., 2014; Wang et al., 2015; Zhang et al. ., 2015). В основном преимущества оптических биосенсоров включают быстрый быстрый анализ с устойчивостью сигнала к электрическим или магнитным помехам и возможностью получения спектра информации. Но главный недостаток — высокая стоимость из-за определенных требований к приборам.Другие технические трудности включают сложность в иммобилизации, особенно для биофабрикатов, и необходимость в стерилизованной среде критически решать, чтобы в полной мере использовать оптические биосенсоры.
Биопроизводство механических устройств обеспечивает лучшие результаты для массовых биосенсоров. Действительно, как электрохимические, так и оптические биосенсоры максимально используют эту технологию для создания биосенсоров высочайшего качества. Основные достижения в технологиях микро- и нанообработки (Arlett et al., 2011) позволяют разрабатывать механические устройства с наноразмерными движущимися частями. Возможность изготовления таких структур с использованием процедур обработки полупроводников объединила принципы биофизики и биоинженерии в направлении прогресса практических микро- и нано-электромеханических биосенсоров, которые могут производиться в больших количествах (Arlett et al., 2011). Стекло, кремний и кварцевый материал успешно использовались либо после флюоресценции, либо с применением наночастиц золота. Хотя эти биосенсоры обладают большей точностью с точки зрения обнаружения одиночных молекул, дешевое массовое производство менее осуществимо (Peng et al., 2014; Шен и др., 2014). Многие проблемы все еще остаются в массовых сенсорах с точки зрения лучших улавливающих агентов для изготовления в наномасштабе с использованием изготовления микроэлектроники для высокопроизводительного анализа. В этой связи стоит упомянуть огромные возможности применения полупроводниковых материалов и технологии квантовых точек. Тем не менее, никакая существующая технология в биосенсорах не может выполнять одновременные количественные анализы в реальном времени для больших массивов, но использование изготовления кантилеверов в микро- и нанометрах может сделать это возможным (Dias et al., 2014).
Еще одна крупная техническая революция в биосенсорах — открытие генетически закодированных или синтетических флуоресцентных биосенсоров для анализа молекулярных механизмов биологических процессов (Kunzelmann et al., 2014; Oldach and Zhang, 2014; Randriamampita and Lellouch, 2014). Хотя эти датчики имеют огромные перспективы для обнаружения одиночных молекул с определенным измерением аналитов, методология, подготовка и обнаружение зонда сложны и также требуют высококлассного оборудования.Что касается биоматериалов, биосенсоры на основе микробного топлива также отличаются высокой чувствительностью и селективностью, однако методы массового производства и генной инженерии для создания штамма микробов требуют сложных процедур и высокой стоимости. Однако еще одним преимуществом микробных биосенсоров является возможность использовать их в качестве инструмента для биоремедиации, что имеет большее значение с точки зрения мониторинга окружающей среды. Однако разработка и выпуск такого генетически модифицированного штамма должны строго анализироваться с соблюдением соответствующих регулирующих законов и этического разрешения в дополнение к управлению производственными затратами.
Собрано с точки зрения Scheller et al. (2014), разработка различных платформ микро- и нанобиосенсоров, включающих интегрированные технологии, использующие электрохимические или оптические биоэлектронные принципы с комбинацией биомолекул или биологических материалов, полимеров и наноматериалов, необходима для создания высокочувствительных и миниатюрных устройств.
Текущие тенденции исследований, будущие проблемы и ограничения биосенсорной технологии
Интегрированные стратегии с использованием нескольких технологий, начиная от электрохимических, электромеханических и флуоресцентно-оптических биосенсоров и генно-инженерных микробов, являются современными методами для открытий биосенсоров (Таблица 1).Некоторые из этих биосенсоров имеют огромные перспективы применения в диагностике заболеваний и медицине (таблица 2). Поскольку потребность и потребность в использовании биосенсора для быстрого анализа с экономической эффективностью требует биофабрикации, которая проложит путь для идентификации активности от клеток до целого животного с пределом обнаружения с высокой точностью для отдельных молекул. Затем биосенсоры должны быть нацелены на работу в мультиплексных условиях. В этой ситуации требуется как двумерное, так и трехмерное обнаружение со сложными датчиками для нацеливания и количественного определения представляющих интерес небольших аналитов (Dias et al., 2014). При этом было сделано несколько важных открытий с использованием контактного или бесконтактного построения паттернов на разных уровнях. Следующий уровень развития должен быть направлен на открытие более надежных регенеративных биосенсоров для длительного использования. Если это произойдет, могут быть разработаны новые диагностические биосенсоры для терапевтов, которые в долгосрочной перспективе помогут как клиницистам, так и пациентам в более комплексном понимании болезней и терапии. Ввиду этого биосенсор на основе флуоресцентного резонансного переноса энергии обеспечивает отличную диагностическую процедуру для оценки эффективности лечения иматинибом при хроническом миелоидном лейкозе (Fracchiolla et al., 2013). Текущее использование аптамеров, аффител, пептидных массивов и молекулярно импринтированных полимеров является классическим примером перспективных исследовательских подходов в этой области (Citartan et al., 2013; Abe et al., 2014; Verma and Bhardwaj, 2015). Небольшой успех также достигается с небольшим количеством потенциальных молекул для новых терапевтических, противомикробных средств и доставки лекарств. Изобретение в этом направлении привело к открытию электрохимических биосенсоров как надежных аналитических устройств для обнаружения патогенов вируса птичьего гриппа в сложных матрицах (Grabowska et al., 2014). Более поздний отчет выявил потенциальные возможности применения биосенсоров на основе аффинности в спортивной медицине и анализе допинг-контроля (Mazzei et al., 2014). Совсем недавно были подробно рассмотрены различные носимые электрохимические биосенсоры для неинвазивного скрининга в режиме реального времени электролитов и метаболитов в биологических жидкостях в качестве индикаторов состояния здоровья пользователя (Bandodkar and Wang, 2014). Еще одно интересное приложение — оценка качества мяса и рыбы с использованием гипоксантиновых биосенсоров путем их изготовления (Lawal and Adeloju, 2012).Разработка биосенсоров для обнаружения боевых биологических агентов, начиная от бактерий, вирусов и токсинов, часто предпринимается с использованием различных устройств биосенсоров, начиная от электрохимических, нуклеиновых, кислотных, оптических и пьезоэлектрических, которые будут иметь огромное применение в вооруженных силах и здравоохранении, а также в обороне. и безопасность (Кумар и Рани, 2013). В совокупности сочетание наноматериалов и полимеров с различными типами биосенсоров обеспечит гибридные устройства для лучшего использования в вышеупомянутых приложениях (Citartan et al., 2013; Тернер, 2013). Кроме того, научный прогресс в разработке микробных биосенсоров с использованием подхода синтетической биологии будет в значительной степени способствовать мониторингу окружающей среды и потреблению энергии (Sun et al., 2015). Авторы этого отчета также подчеркнули важность использования микробных топливных элементов для разработки метода очистки воды и в качестве источников питания для датчиков окружающей среды. В более широкой перспективе мы выделили тип биосенсоров, потенциальное применение и характеристики, такие как способность обнаружения аналитов, время анализа, портативность, стоимость и индивидуальная настройка (таблица 3).
Таблица 1. Список биосенсоров с указанием принципа, применения и библиографии .
Таблица 2. Использование биосенсоров в диагностике заболеваний .
Таблица 3. Типы биосенсоров с применением и характеристиками .
В заключение, разработка биосенсоров в основном зависит от чувствительности, специфичности, нетоксичности, обнаружения малых молекул и экономической эффективности.Принятие во внимание этих характеристик в конечном итоге позволит решить критически важные параметры и проблемы, связанные с основными ограничениями технологии биосенсоров. Некоторый прогресс наблюдается в электрохимических сенсорах в сочетании с наноматериалами, что приводит к появлению новых типов биосенсоров (Kwon and Bard, 2012; Bandodkar and Wang, 2014). С этой точки зрения стоит упомянуть изобретение «электронной кожи» в виде печатных электрохимических биосенсоров с временной переносной татуировкой для физиологического и безопасного обнаружения химических ингредиентов (Windmiller et al., 2012а, б). В целом, лучшее сочетание биосенсоров и биопроизводства с подходами синтетической биологии с использованием либо электрохимических, либо оптических, либо биоэлектронных принципов или их комбинации будет ключом к успешной разработке мощных биосенсоров для современной эпохи.
Авторские взносы
Первый автор задумал и внес большой вклад в обзор, в то время как все другие авторы внесли свой вклад в организацию.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Финансирование
CS выражает признательность Департаменту науки и технологий (DST) за грант и стипендию DST-Women Scientist (WOS-A). BS является стипендиатом инновационной стипендии TATA от Департамента биотехнологии Индии. HP является стипендиатом Рамануджана от DST, Индия.
Список литературы
Читартан, М., Гопинатх, С. К., Томинага, Дж., И Танг, Т. Х. (2013). Безмаркированные методы сообщения о биомолекулярных взаимодействиях с помощью оптических биосенсоров. Аналитик 138, 3576–3592. DOI: 10.1039 / c3an36828a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кларк, Л. К. младший, и Лайонс, К. (1962). Электродные системы для непрерывного мониторинга в сердечно-сосудистой хирургии. Ann. Акад. Sci. 102, 29–45. DOI: 10.1111 / j.1749-6632.1962.tb13623.x
CrossRef Полный текст | Google Scholar
Дин Л., Бонд А. М., Чжай Дж. И Чжан Дж. (2013). Использование меток наночастиц для усиления сигнала в сверхчувствительных электрохимических биосенсорах сродства: обзор. Анал. Чим. Acta 797, 1–12. DOI: 10.1016 / j.aca.2013.07.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ду, З., Ли, Х. и Гу, Т. (2007). Обзор современного состояния микробных топливных элементов: перспективной технологии очистки сточных вод и биоэнергетики. Biotechnol. Adv. 25, 464–482. DOI: 10.1016 / j.biotechadv.2007.05.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грабовская, И., Малецка К., Яроцка У., Радецки Дж. И Радецка Х. (2014). Электрохимические биосенсоры для обнаружения вируса птичьего гриппа — текущее состояние и будущие тенденции. Acta Biochim. Pol. 61, 471–478.
Google Scholar
Гутьеррес, Дж. К., Амаро, Ф., и Мартин-Гонсалес, А. (2015). Цельноклеточные биосенсоры тяжелых металлов с использованием эукариотических микроорганизмов: обновленный критический обзор. Фронт. Microbiol. 6:48. DOI: 10.3389 / fmicb.2015.00048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хамиди-Асл, Э., Палчетти, И., Хашеминеджад, Э., и Машини, М. (2013). Обзор электрохимических биосенсоров для определения микроРНК. Таланта 115, 74–83. DOI: 10.1016 / j.talanta.2013.03.061
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харрис, Дж. М., Рейес, К., Лопес, Г. П. (2013). Общие причины нестабильности глюкозооксидазы при биосенсинге in vivo: краткий обзор. J. Diabetes Sci. Technol. 7, 1030–1038.
PubMed Аннотация | Google Scholar
Химджи, И., Келли, Э. Ю., Хелва, Ю., Хоанг, М., и Лю, Дж. (2013). Визуальные оптические биосенсоры на основе ДНК-функционализированных полиакриламидных гидрогелей. Методы 64, 292–298. DOI: 10.1016 / j.ymeth.2013.08.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, Дж., Имани, С., де Араужо, В. Р., Уорчалл, Дж., Вальдес-Рамирес, Г., Пайшао, Т. Р. и др. (2015). Переносной биодатчик мочевой кислоты слюнной капы со встроенной беспроводной электроникой. Биосенс.Биоэлектрон. 74, 1061–1068. DOI: 10.1016 / j.bios.2015.07.039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ко, П. Дж., Исикава, Р., Сон, Х., и Сандху, А. (2013). Платформа из пористого кремния для оптического обнаружения функционализированных магнитных частиц с помощью биочувствительности. J. Nanosci. Nanotechnol. 13, 2451–2460. DOI: 10.1166 / jnn.2013.7406
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кумар, Х., и Рани, Р. (2013). Разработка биосенсоров для обнаружения боевых биологических агентов: проблемы и проблемы. Sci. Прог. 96, 294–308. DOI: 10.3184 / 003685013X13777066241280
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Квон, С. Дж., И Бард, А. Дж. (2012). Анализ ДНК с применением электрохимической амплификации наночастиц Pt с ответом на одну метку. J. Am. Chem. Soc. 134, 10777–10779. DOI: 10.1021 / ja304074f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лампрехт, К., Хинтердорфер, П., Эбнер, А. (2014). Применение биосенсорной атомно-силовой микроскопии для мониторинга доставки лекарств и наночастиц. Эксперт. Opin. Препарат Делив. 11, 1237–1253. DOI: 10.1517 / 17425247.2014.8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лаваль, А. Т., и Аделоджу, С. Б. (2012). Прогресс и последние достижения в изготовлении и использовании гипоксантиновых биосенсоров для оценки качества мяса и рыбы: обзор. Таланта 100, 217–228.DOI: 10.1016 / j.talanta.2012.07.085
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, М., Ли, Р., Ли, К. М. и Ву, Н. (2011). Электрохимические и оптические биосенсоры на основе наноматериалов и наноструктур: обзор. Фронт. Biosci. (Schol Ed) 3: 1308–1331. DOI: 10.2741 / 228
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лонг, Ф., Чжу, А., Ши, Х. (2013). Последние достижения в области оптических биосенсоров для мониторинга окружающей среды и раннего предупреждения. Сенсоры (Базель) 13, 13928–13948. DOI: 10.3390 / s131013928
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маццей, Ф., Антиохия, Р., Ботре, Ф., Фаверо, Г., и Тортолини, К. (2014). Биосенсоры на основе аффинности в спортивной медицине и анализе допинг-контроля. Биоанализ 6, 225–245. DOI: 10.4155 / bio.13.308
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мелло, Л. Д., Киснер, А., Гуларт, М.О., Кубота, Л.Т. (2013). Биосенсоры для оценки антиоксидантов в биологических системах. Расческа. Chem. Экран с высокой пропускной способностью. 16, 109–120. DOI: 10.2174/138620713804806265
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ни, С., Син, Ю., Ким, Дж. Дж., И Саймонс, Дж. У. (2007). Применение нанотехнологий при раке. Annu. Преподобный Биомед. Англ. 9, 257–288. DOI: 10.1146 / annurev.bioeng.9.060906.152025
CrossRef Полный текст | Google Scholar
Оги, Х.(2013). Беспроводные безэлектродные биосенсоры кварцевого кристалла и микровесов для изучения взаимодействий между биомолекулами: обзор. Proc. Jpn. Акад. Сер. B Phys. Биол. Sci. 89, 401–417. DOI: 10.2183 / pjab.89.401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Олдах, Л., и Чжан, Дж. (2014). Генетически кодируемые флуоресцентные биосенсоры для визуализации фосфорилирования белков живыми клетками. Chem. Биол. 21, 186–197. DOI: 10.1016 / j.chembiol.2013.12.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Парк К., Юнг Дж., Сон Дж., Ким С. Х. и Чанг Б. Х. (2013). Закрепление чужеродных веществ на поверхности живых клеток с помощью пептида, специфичного для связывания Сортазы А. Chem. Commun. (Camb) 49, 9585–9587. DOI: 10.1039 / c3cc44753g
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Peng, F., Su, Y., Zhong, Y., Fan, C., Lee, S.T., and He, Y.(2014). Платформа из кремниевых наноматериалов для биоимиджинга, биосенсинга и терапии рака. В соотв. Chem. Res. 47, 612–623. DOI: 10.1021 / ar400221g
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пундир, С.С., Чаухан, Н. (2012). Биосенсоры на основе ингибирования ацетилхолинэстеразы для определения пестицидов: обзор. Анал. Биохим. 429, 19–31. DOI: 10.1016 / j.ab.2012.06.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Санг, С., Ван, Ю., Фэн, К., Вэй, Ю., Цзи, Дж., И Чжан, В. (2015). Прогресс новых методов без использования этикеток для биосенсоров: обзор. Crit. Rev. Biotechnol. 15, 1–17. DOI: 10.3109 / 07388551.2014.9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Scheller, F. W., Yarman, A., Bachmann, T., Hirsch, T., Kubick, S., Renneberg, R., et al. (2014). Будущее биосенсоров: личное мнение. Adv. Биохим. Англ. Biotechnol. 140, 1–28. DOI: 10.1007 / 10_2013_251
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сентилкумаран, Б. (2015). Нарушение эндокринной системы, вызванное пестицидами и аналогами половых стероидов, по-разному воздействует на гипоталамо-гипофизарно-гонадную систему во время гаметогенеза у костистых насекомых — обзор. Gen. Comp. Эндокринол. 219, 136–142. DOI: 10.1016 / j.ygcen.2015.01.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шен, М.Ю., Ли, Б. Р., Ли, Ю. К. (2014). Биосенсоры на основе полевых транзисторов с кремниевыми нанопроводами: от чувствительных до сверхчувствительных. Биосенс. Биоэлектрон. 60, 101–111. DOI: 10.1016 / j.bios.2014.03.057
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Су Т., Чжан З. и Луо К. (2012). Ратиометрическая флуоресцентная визуализация двойных биомолекулярных событий в отдельных живых клетках с использованием новой пары FRET биосенсора на основе mVenus / mKOkappa и одного флуоресцентного белкового биосенсора. Биосенс. Биоэлектрон. 31, 292–298. DOI: 10.1016 / j.bios.2011.10.034
CrossRef Полный текст | Google Scholar
Сан, Дж. З., Питер, К. Г., Си, Р. В., Чжай, Д. Д., Ляо, З. Х., Сан, Д. З. и др. (2015). Биосенсоры на основе микробных топливных элементов для мониторинга окружающей среды: обзор. Water Sci. Technol. 71, 801–809. DOI: 10.2166 / wst.2015.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тунеманн, М., Schmidt, K., de, W. C., Han, X., Jain, R.K, Fukumura, D., et al. (2014). Корреляционная прижизненная визуализация сигналов цГМФ и вазодилатации у мышей. Фронт. Physiol. 5: 394. DOI: 10.3389 / fphys.2014.00394
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валентини, Ф., Галаче, Ф. Л., Тамбурри, Э., и Паллески, Г. (2013). Однослойные углеродные нанотрубки / композитные пленки полипиррол-GOx для модификации золотых микроэлектродов для биосенсоров глюкозы: исследование расширенной линейности. Биосенс. Биоэлектрон. 43, 75–78. DOI: 10.1016 / j.bios.2012.11.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Верма, Н., Бхардвадж, А. (2015). Биосенсорная технология для пестицидов — обзор. заявл. Биохим. Biotechnol. 175, 3093–3119. DOI: 10.1007 / s12010-015-1489-2
CrossRef Полный текст | Google Scholar
Ван Б., Такахаши С., Ду Х. и Анзай Дж. (2014). Электрохимические биосенсоры на основе ферроценбороновой кислоты и ее производных: обзор. Биосенсоры (Базель) 4, 243–256. DOI: 10.3390 / bios4030243
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Дж., Чен, Г., Цзян, Х., Ли, З. и Ван, X. (2013). Достижения в области наноразмерных биосенсоров для биомедицинских приложений. Аналитик 138, 4427–4435. DOI: 10.1039 / c3an00438d
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван С., Пун Г. М. и Уилсон В. Д. (2015). Количественное исследование взаимодействий белок-нуклеиновая кислота с помощью поверхностного плазмонного резонанса биосенсора. Methods Mol. Биол. 1334, 313–332. DOI: 10.1007 / 978-1-4939-2877-4_20
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Виндмиллер, Дж. Р., Бандодкар, А. Дж., Пархомовский, С., и Ван, Дж. (2012a). Электроды для переноса штампа для электрохимического зондирования неплоских и негабаритных поверхностей. Аналитик 137, 1570–1575. DOI: 10.1039 / c2an35041f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Виндмиллер, Дж.Р., Бандодкар, А. Дж., Вальдес-Рамирес, Г., Пархомовский, С., Мартинес, А. Г., и Ван, Дж. (2012b). Электрохимическое зондирование на основе печатных временных трансферных татуировок. Chem. Commun. (Camb) 48, 6794–6796. DOI: 10.1039 / c2cc32839a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан З., Лю Дж., Ци З. М. и Лу Д. Ф. (2015). Исследование самосборных нанокомпозитных пленок in situ с помощью спектрального датчика ППР. Mater. Sci. Англ. C Mater.Биол. Прил. 51, 242–247. DOI: 10.1016 / j.msec.2015.02.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу, Ю., Чиу, К. В., и Лян, Х. (2012). Межфазные структуры и свойства органических материалов для биосенсоров: обзор. Сенсоры (Базель) 12, 15036–15062. DOI: 10.3390 / s121115036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Что такое биосенсоры?
Термин «биосенсор» является сокращением от «биологический датчик».«Устройство состоит из преобразователя и биологического элемента, которым может быть фермент, антитело или нуклеиновая кислота. Биоэлемент взаимодействует с исследуемым аналитом, и биологический ответ преобразуется преобразователем в электрический сигнал. В зависимости от конкретного применения биосенсоры также известны как иммуносенсоры, оптроды, резонансные зеркала, химические канарейки, биочипы, глюкометры и биокомпьютеры. Обычно цитируемое определение биосенсора:
.«Химическое сенсорное устройство, в котором биологически полученное распознавание связано с датчиком, что позволяет количественно определять некоторые сложные биохимические параметры.”
Части биосенсора
Каждый биосенсор состоит из:
- Биологический компонент, который действует как датчик
- Электронный компонент, который обнаруживает и передает сигнал
Биосенсорные элементы
В качестве биоэлементов в биосенсоре можно использовать самые разные вещества. Примеры:
- Нуклеиновые кислоты
- Белки, включая ферменты и антитела.Биосенсоры на основе антител также называют иммуносенсорами.
- Растительные белки или лектины
- Сложные материалы, такие как срезы тканей, микроорганизмы и органеллы
Сигнал, генерируемый при взаимодействии сенсора с анализируемым веществом, может быть электрическим, оптическим или тепловым. Затем он преобразуется с помощью подходящего преобразователя в измеряемый электрический параметр — обычно ток или напряжение.
Приложения
Биосенсорные зонды становятся все более сложными, в основном благодаря сочетанию достижений в двух технологических областях: микроэлектронике и биотехнологии.Биосенсоры — очень ценные устройства для измерения широкого спектра аналитов, включая органические соединения, газы, ионы и бактерии.
История биосенсоров
Первый эксперимент по выявлению происхождения биосенсоров был проведен Леландом Кларком. В своем эксперименте Кларк использовал платиновые (Pt) электроды для обнаружения кислорода. Он поместил фермент глюкозооксидазу (GOD) очень близко к поверхности платины, прижав ее к электродам куском диализной мембраны.Активность фермента изменялась в зависимости от концентрации кислорода в окружающей среде. Глюкоза реагирует с глюкозооксидазой (GOD) с образованием глюконовой кислоты и производит два электрона и два протона, тем самым уменьшая GOD. Восстановленный БОГ, электроны, протоны и окружающий кислород — все реагируют с образованием перекиси водорода и окисленного БОГ (исходная форма), тем самым делая больше БОГ доступным для взаимодействия с большим количеством глюкозы. Чем выше содержание глюкозы, тем больше потребляется кислорода и чем ниже содержание глюкозы, тем больше вырабатывается перекиси водорода.Это означает, что для определения концентрации глюкозы можно измерить либо увеличение перекиси водорода, либо уменьшение содержания кислорода.
Дополнительная литература
биосенсоров для аналитических целей | BMG LABTECH
Преимущества биосенсоров
Одним из объяснений более широкого использования биосенсоров является их превосходная специфичность. Эта замечательная особенность объясняется биологическим элементом, используемым для обнаружения интересующей молекулы.Биологические взаимодействия, такие как связывание антител со своими антигенами, преобразование субстрата ферментом или ассоциация двух комплементарных цепей ДНК, обычно очень специфичны, поскольку ни один организм не может позволить себе инициировать ненужные каскады реакций, поглощая много энергии. Например, микробные биосенсоры для вредного мышьяка основаны на пути исключения бактериального мышьяка. В присутствии As (III) будет экспрессироваться переносчик, который экспортирует токсин из микроорганизма. Вместо транспортной системы биосенсор экспрессирует As (III) -зависимо флуоресцентный репортерный ген.Поскольку сложный механизм устойчивости к As (III) запускается только в присутствии мышьяка, его распознавание гарантированно будет очень специфичным как в организме, так и в биосенсоре.
Еще одним преимуществом использования детектирования на основе биомолекул является скорость анализа. Аналит обычно распознается напрямую и сразу дает измеримый сигнал. Поэтому биосенсоры также обычно встраивают в портативные устройства для тестирования в местах оказания медицинской помощи. Например, биосенсоры используются в приборах для измерения уровня глюкозы, злоупотребления наркотиками, беременности и многих других.
Из-за прямого отклика биосенсора на анализируемое вещество они часто используются для мониторинга молекулы или связанного с ней процесса в реальном времени. Такой анализ не только дает количественную информацию о присутствии молекулы, но и добавляет временную составляющую присутствия аналита.
Для чего используются биосенсоры?
Об этом свидетельствуют несколько уже упомянутых примеров биосенсоров: области, в которых они используются, многочисленны и разнообразны.Далее будут представлены поля и типовые датчики.
Биосенсоры в пищевой промышленности и безопасности
Пищевая промышленность применяет биосенсоры для оценки безопасности продукции, а именно микробных загрязнителей, пестицидов и токсинов, или для мониторинга качества продукции путем обнаружения определенных компонентов пищевых продуктов. Одним из примеров оценки токсинов в пище на основе биомолекул является вышеупомянутый микробный биосенсор мышьяка. Он сообщает о наличии вредного мышьяка с помощью генетической регуляции механизма устойчивости, который при наличии опасности вместо системы транспортера мышьяка экспрессирует GFP.
Примером биосенсора, определяющего качество пищи, является датчик глутамата: глутамат усиливает вкус и присутствует в натуральных продуктах, но особенно часто добавляется в пищевые продукты с высокой степенью переработки. Обнаружение глутамата часто основывается на ферменте глутаматоксидазе, который специфически превращает глутамат в альфа-кетоглутарат. Подобно глюкометру, реакция, катализируемая глутаматоксидазой, обнаруживается внутри биосенсора по изменению тока, которое напрямую сообщает о присутствии глутамата усилителя вкуса.
Мониторинг окружающей среды с помощью биосенсоров
Биосенсоры также проверяют образцы окружающей среды или образцы, выпущенные в окружающую среду, на наличие загрязняющих веществ. Обычно используемое устройство измеряет биохимическую потребность в кислороде (БПК) воды или, более конкретно, микроорганизмов, живущих в ней. БПК важен для оценки органических ресурсов пробы воды, которые могут использоваться микроорганизмами для роста и, следовательно, вероятности загрязнения организмами. Обычно он измеряется в воде, предназначенной для слива.Коммерчески доступный биосенсор измеряет БПК с помощью комбинации микробов, потребляющих кислород в присутствии органических соединений, и электрода Кларка, который определяет концентрацию кислорода.
Недавно были разработаны новые биосенсоры, которые обнаруживают остаточные количества фармацевтических препаратов в сточных водах муниципальных очистных сооружений. Это особенно важно для предотвращения чрезмерного выброса загрязненной воды в окружающую среду и воздействия лекарственных препаратов на водные организмы. Сенсоры на основе клеток могут отслеживать две наиболее часто применяемые лекарственные цели: циклооксигеназу-1 (ЦОГ), которая ингибируется обычными болеутоляющими, и бета-адренергический рецептор, который блокируется лекарствами от гипертонии и аритмий.Линия клеток, чувствительных к ингибитору ЦОГ, основана на СНО, несущих флуоресцентный ратиометрический биосенсор. Подробное описание принципа анализа можно найти в примечании к приложению 322.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Общая стратегия создания низкомолекулярных биосенсоров у эукариот
Рецензент №1:
Реагирование на появление аналита, по-видимому, является основной целью этой работы. Однако биосенсоры такого типа были бы чрезвычайно полезны для одноклеточного анализа биологических процессов, таких как передача сигналов (вспомните о кальциевых красителях Цзянь).В этом свете для читателя важно знать, как эти сконструированные биосенсоры реагируют на потерю аналита, а также на его появление, что подробно рассматривается в данной статье. Я полагаю, что авторы уже провели эти эксперименты, и данные об изъятии аналитов хорошо дополнят данные, представленные в настоящее время на Рисунке 2 (в виде новых панелей G и H, показывающих динамику потери сигнала при удалении dig или prog).
Рецензент поднимает важный вопрос.Мы добавили новые панели G и H на рис. 2 и обсуждение последнего абзаца подраздела «TF-биосенсоры усиливают лиганд-зависимые ответы», характеризующие поведение TF-биосенсоров при удалении лиганда после активации. Мы наблюдаем быстрое снижение уровня флуоресценции с 50% снижением примерно через 5 часов и почти полным исчезновением через 10-15 часов. Дестабилизация, вероятно, происходит быстрее, чем наблюдается по флуоресценции, поскольку снижение сигнала флуоресценции зависит как от деградации биосенсоров TF после удаления лиганда, так и от деградации и разбавления ранее экспрессированного yEGFP.
Одно определение «биосенсор» требует только обнаружения определенного аналита. Более амбициозное определение охватывало бы количественную оценку аналита. Я был бы признателен, если бы авторы могли потратить несколько предложений на то, поддается ли их текущая стратегия количественной оценке или использование связанных межмолекулярных систем (то есть транскрипция репортерного гена) препятствует точной количественной оценке. Эта же проблема, вероятно, мешает этим биосенсорам быстро / точно реагировать на исчезновение аналита.Это отлично. Я не думаю, что авторов следует просить изобрести версию 2 системы для этой статьи, но я думаю, что было бы хорошей идеей, если бы авторы затронули эту проблему в тексте. Наличие стабильности белка при считывании делает биосенсор менее чувствительным (отсутствие амплификации от транскрипции), но также делает его более чувствительным к аналиту с точки зрения скорости и количественной оценки.
Мы благодарим рецензента за указание на необходимость различать сигнал от основной популяции по сравнению с одиночными клетками.Уровни точности и шума при разрешении одной клетки являются важными аспектами при принятии решения о том, подходят ли наши биосенсоры как в системе прямого слияния, так и в системе TF для различных применений. Мы добавили данные о событиях проточной цитометрии одиночных клеток, как показано на Рисунке 1 — Рисунке 1 и Рисунке 2 — Рисунке 2, вместе с обсуждением в подразделе «TF-биосенсоры усиливают лиганд-зависимые ответы». Мы наблюдаем более быстрый отклик при прямом слиянии за счет динамического диапазона.Мы также наблюдаем более жесткие распределения при использовании прямого слияния, что позволило бы более точно определить количество лиганда (Рисунок 1 — рисунок в приложении 1 и рисунок 2 — рисунок в приложении 2). При очень высоких уровнях лиганда TF-биосенсоры также демонстрируют плотное распределение, но при промежуточных концентрациях лиганда уровни GFP охватывают довольно широкий диапазон. Мы использовали FACS для выделения клеток из темного пика популяции и обнаружили, что эти клетки были неактивными. Дальнейшая оптимизация могла бы уменьшить шум в системе TF, например, интегрировать конструкции вместо использования плазмидной системы или изучить более крупную библиотеку промоторов.
Одна проблема, отсутствующая в этом исследовании, — это то, как присутствие биосенсора может изменить или повлиять на поведение клетки. Другими словами, прогестерон, который секвестрируется биосенсором, не может связываться с эндогенной мишенью. Кроме того, эта биосенсорная стратегия является «общей» (рис. 7А) только постольку, поскольку исследователь имеет доступ к высокоаффинному лиганд-связывающему домену на основе белка для конкретного аналита.
Рецензент правильно указывает на важность разработки биосенсоров с активностью, совместимой с предполагаемыми последующими приложениями.В этом исследовании мы выбрали два стероида, ортогональных пути биосинтеза дрожжевых стеролов, чтобы уменьшить биологические реакции хозяина. Мутации 3β-HSD, идентифицированные при отборе гистидина и анализах активации yEGFP, были повторно трансформированы в дрожжевые штаммы, не экспрессирующие наши TF-биосенсоры для количественной оценки с использованием ГХ / МС, поэтому улучшения в биопродукции 3β-HSD наблюдались как с биосенсорами прогестерона, так и без них. настоящее время.
Промотор CYC1, используемый для экспрессии биосенсоров TF, приводит к довольно низкой экспрессии и вызывает секвестрирование лишь небольшого количества лиганда.Если приложение было особенно чувствительным к очень незначительным изменениям концентрации лиганда, можно было бы использовать TF-биосенсор с еще более слабым промотором.
Верно и то, что этот метод требует в качестве отправной точки высокоаффинного лиганд-связывающего домена, но почти любая интересующая небольшая молекула будет иметь природный белок, который с ней взаимодействует. Использование вновь созданных связывающих веществ открывает возможность создания биосенсоров для лигандов с неподходящими или неизвестными связывающими белками.
Мы добавили текст в Обсуждение, чтобы обсудить эти ключевые моменты.
Рецензент № 2:
Эта работа впечатляет разнообразием конструктивных особенностей / изменений и приложений, реализованных в инженерных биосенсорах. Тем не менее, о большинстве этих функций сообщалось ранее (и в каждом случае авторы надлежащим образом цитировали их), и поэтому трудно определить новизну и полезность для более широкого научного сообщества. Если предполагаемый вывод авторов представляет собой общий подход к реализации множества различных стратегий для достижения улучшенного приложения конечной цели, и что их стратегия является обобщаемой, более эффективной или обладает некоторыми другими функциями, которых до сих пор не хватало, тогда рукопись должна была бы быть более непосредственной. продемонстрируйте это.В качестве одного примера, идея о том, что эти биосенсоры могут быть быстро перенесены с дрожжей на другие эукариоты, является убедительной и важной, но авторы не строго поддерживали это утверждение с помощью экспериментов, специально разработанных, чтобы показать и охарактеризовать переносимость организм-организм. То есть перенос набора белков и демонстрация их работы в других организмах может не быть достаточно систематическим исследованием, которое статистически поддерживает переносимость организм-организм. Если бы авторы могли лучше уточнить / прояснить вклад своей работы, это помогло бы заинтересовать читателей принять стратегии и выводы из этой работы.
Мы благодарим рецензента за предложение дальнейшего обсуждения ключевого вопроса переносимости наших биосенсоров на несколько организмов. Предыдущая работа показала, что условно дестабилизированные белки разрушаются высококонсервативной убиквитиновой протеасомной системой (Egeler et al., 2011). Опираясь на общие принципы стабильности белка и связывания лиганда, можно разработать биосенсоры в любом организме с аналогичным механизмом контроля качества белка. Тот факт, что наши биосенсоры, сконструированные на основе бактериального белкового каркаса, сохранили высокий уровень чувствительности с минимальными модификациями при разработке на дрожжах и использовании среди млекопитающих и растений, демонстрирует беспрецедентную переносимость для биосенсоров и предполагает, что возможна даже дальнейшая переносимость.Мы добавили текст в четвертый абзац Обсуждения, чтобы прояснить эти моменты.
Мы согласны с тем, что дальнейшая работа над переносимостью позволит нам лучше понять принципы использования биосенсоров в различных организмах, что, как мы полагаем, потребует нескольких новых биосенсоров, происходящих из нескольких каркасов LBD, что составит основу для интригующего последующего исследования.
Авторы продемонстрировали огромную гибкость в демонстрации нескольких потенциальных приложений.Однако глубина каждой из этих демонстраций была несколько недостаточной и выглядела скорее как минимальное доказательство принципиальных экспериментов. Например, авторы продемонстрировали повышенную биопродукцию прогестерона. Это действительно может служить убедительной моделью того, как создавать и использовать биосенсоры. Однако наблюдаемые эффекты были небольшими (~ 2 раза с большими ошибками). Возможно, если бы какое-либо из приложений было удалено более глубоко, более подробно или с большим эффектом, это оказало бы большее влияние на сообщество.
Результаты ГХ / МС показывают статистически значимое увеличение биопродукции прогестерона по сравнению с диким типом после 76 часового периода.

