Что такое иттрий и каковы его основные свойства. Где используется иттрий в промышленности и технике. Какова история открытия иттрия. Почему иттрий считается важным редкоземельным элементом.
Физические и химические свойства иттрия
Иттрий — химический элемент с атомным номером 39, относящийся к группе редкоземельных металлов. Это серебристо-белый металл, обладающий рядом интересных свойств:
- Атомная масса: 88,90585 а.е.м.
- Температура плавления: 1522°C
- Температура кипения: 3345°C
- Плотность: 4,47 г/см³
- Кристаллическая решетка: гексагональная
Каковы основные химические свойства иттрия? Иттрий довольно активный металл, легко окисляется на воздухе. Он реагирует с кислотами, образуя соли. При нагревании взаимодействует с галогенами, серой, углеродом. Интересно, что иттрий может существовать в двух кристаллических модификациях — α-Y и β-Y, переход между которыми происходит при 1482°C.
Области применения иттрия в промышленности
Благодаря своим уникальным свойствам, иттрий нашел широкое применение в различных отраслях:

Металлургия
Как влияет добавление иттрия на свойства сплавов? Легирование алюминиевых и магниевых сплавов иттрием значительно повышает их прочность и жаростойкость. Это позволяет использовать такие сплавы в авиакосмической промышленности и двигателестроении.
Электроника
Оксид иттрия используется при производстве люминофоров для цветных кинескопов и светодиодов. Иттриево-алюминиевый гранат (ИАГ) применяется в мощных лазерах.
Ядерная энергетика
Зачем используют иттрий в атомной промышленности? Тетраборид иттрия YB4 применяется для изготовления регулирующих стержней ядерных реакторов благодаря способности поглощать нейтроны.
История открытия и получения иттрия
Как был открыт иттрий? История этого элемента началась в 1787 году, когда шведский химик Карл Аррениус обнаружил новый минерал в карьере недалеко от деревни Иттербю. В 1794 году финский химик Юхан Гадолин выделил из этого минерала оксид нового элемента, который впоследствии назвали иттрием.
Когда удалось получить чистый металлический иттрий? Впервые металлический иттрий был получен в 1828 году немецким химиком Фридрихом Вёлером путем восстановления хлорида иттрия металлическим калием. Однако чистый иттрий удалось выделить только в начале 20 века.

Роль иттрия в современных технологиях
Какое значение имеет иттрий для развития высоких технологий? Иттрий и его соединения играют важную роль в ряде передовых технологических направлений:
- Производство высокотемпературных сверхпроводников
- Создание мощных постоянных магнитов
- Разработка новых керамических материалов
- Создание катализаторов для нефтехимии
Особенно перспективно применение иттрия в энергетике будущего — термоядерных реакторах и водородной энергетике.
Биологическая роль и воздействие на организм
Какое влияние оказывает иттрий на живые организмы? Иттрий не является биологически необходимым элементом и не выполняет известных функций в организме. Соединения иттрия малотоксичны, но при попадании внутрь могут накапливаться в костях и печени.
Есть ли опасность для здоровья при работе с иттрием? При работе с металлическим иттрием и его соединениями необходимо соблюдать меры предосторожности, так как вдыхание пыли может вызвать раздражение дыхательных путей. Особую осторожность следует проявлять при работе с радиоактивным изотопом иттрий-90, который используется в ядерной медицине.

Получение и производство иттрия
Как получают иттрий в промышленных масштабах? Основные этапы производства:
- Добыча руд, содержащих иттрий (монацит, ксенотим, бастнезит)
- Химическое разделение редкоземельных элементов
- Получение оксида иттрия
- Восстановление оксида до металла (обычно кальцием или литием)
Где находятся основные месторождения иттрия? Крупнейшие запасы иттрия сосредоточены в Китае, также добыча ведется в Австралии, США, Индии. В России перспективные месторождения находятся на Кольском полуострове и в Сибири.
Изотопы иттрия и их применение
Какие изотопы иттрия существуют в природе? В природе иттрий представлен одним стабильным изотопом 89Y. Искусственно получено более 30 радиоактивных изотопов.
Где применяются радиоактивные изотопы иттрия? Наиболее важное применение имеет изотоп 90Y:
- Лечение некоторых видов рака (радиоэмболизация)
- Палеотермометрия (определение температур древних океанов)
- Источники бета-излучения в промышленности
Перспективы использования иттрия в будущем
Какие новые области применения иттрия могут появиться в ближайшие годы? Ученые активно исследуют возможности использования иттрия в следующих направлениях:

- Квантовые компьютеры (кубиты на основе ионов иттрия)
- Аккумуляторы нового поколения
- Фотокатализаторы для очистки воды и воздуха
- Новые типы солнечных элементов
Развитие этих технологий может привести к значительному росту спроса на иттрий в будущем.
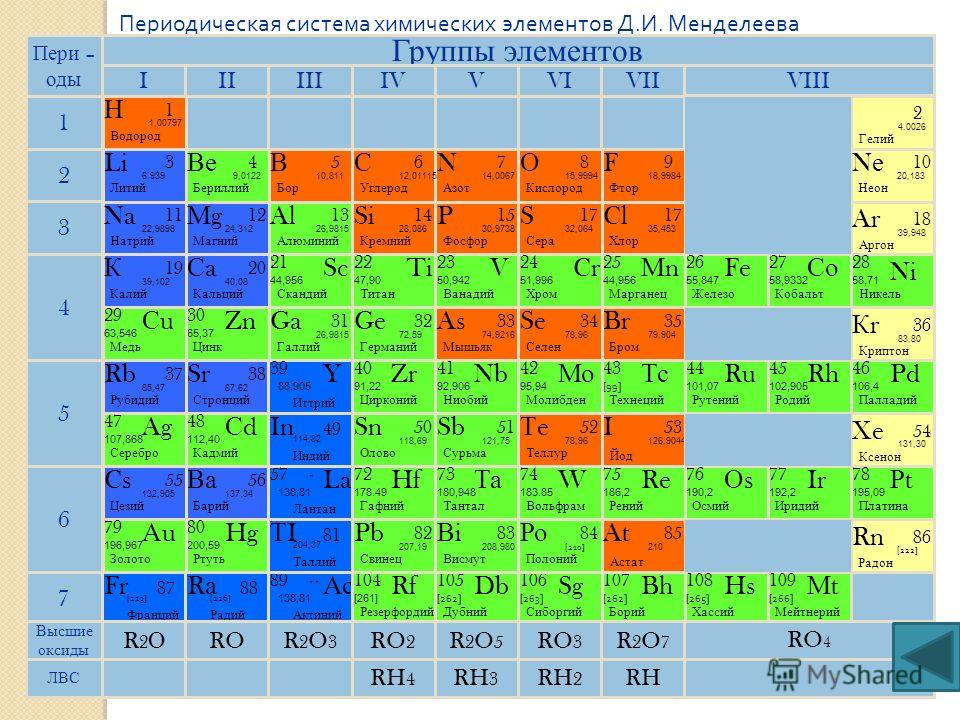
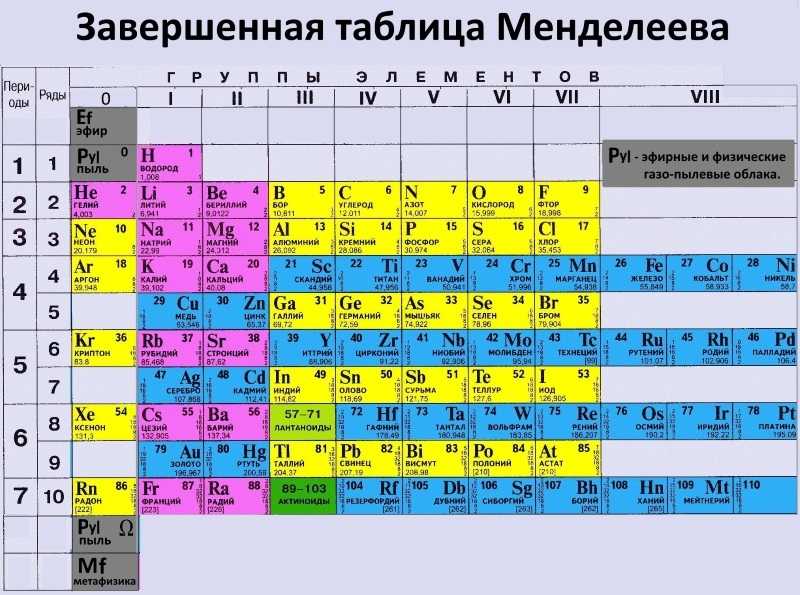
Иттрий
| Иттрий | |
|---|---|
| Атомный номер | 39 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
88,90585 а. е. м. (г/моль) |
| Радиус атома | 178 пм |
|
Энергия ионизации (первый электрон) |
615,4 (6,38) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d1 5s2 |
| Химические свойства | |
| Ковалентный радиус | 162 пм |
| Радиус иона | (+3e) 89,3 пм |
|
Электроотрицательность (по Полингу) |
1,22 |
| Электродный потенциал | 0 |
| Степени окисления | 3 |
| Плотность | 4,47 г/см³ |
| Молярная теплоёмкость | 26,52 Дж/(K·моль) |
| Теплопроводность | (17,2) Вт/(м·K) |
| Температура плавления | 1795 K |
| Теплота плавления | 11,5 кДж/моль |
| Температура кипения | 3 611 K |
| Теплота испарения | 367 кДж/моль |
| Молярный объём | 19,8 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,647 c=5,731 Å |
| Отношение c/a | 1,571 |
| Температура Дебая | [2] 280 K |
| Y | 39 |
| 88,90585 | |
| [Kr]4d15s2 | |
| Иттрий | |
Иттрий — элемент побочной подгруппы третьей группы пятого периода периодической системы химических элементов, атомный номер 39. Обозначается символом Y (Yttrium). Простое вещество
Обозначается символом Y (Yttrium). Простое вещество
История
Происхождение названия
Минерал иттербит, который дал имя иттрию, назван в честь деревни Иттербю (Ytterby) расположенной на острове Руслаген в Швеции. В дальнейшем, минерал иттербит изменил свое название на гадолинит в честь своего первого исследователя (и первооткрывателя иттрия) Юхана Гадолина, финского ученого.
Получение
Физические свойства
Иттрий — металл светло-серого цвета. Существует в двух кристаллических модификациях: α-Y с гексагональной решёткой типа магния (a=3,6474 Å; с=5,7306 Å; z=2; пространственная группа P63/mmc), β-Y с кубической объёмноцентрированной решёткой типа α-Fe (a=4,08 Å; z=2; пространственная группа
Im3m), температура перехода α↔β 1482 °C, ΔH перехода 4,98 кДж/моль.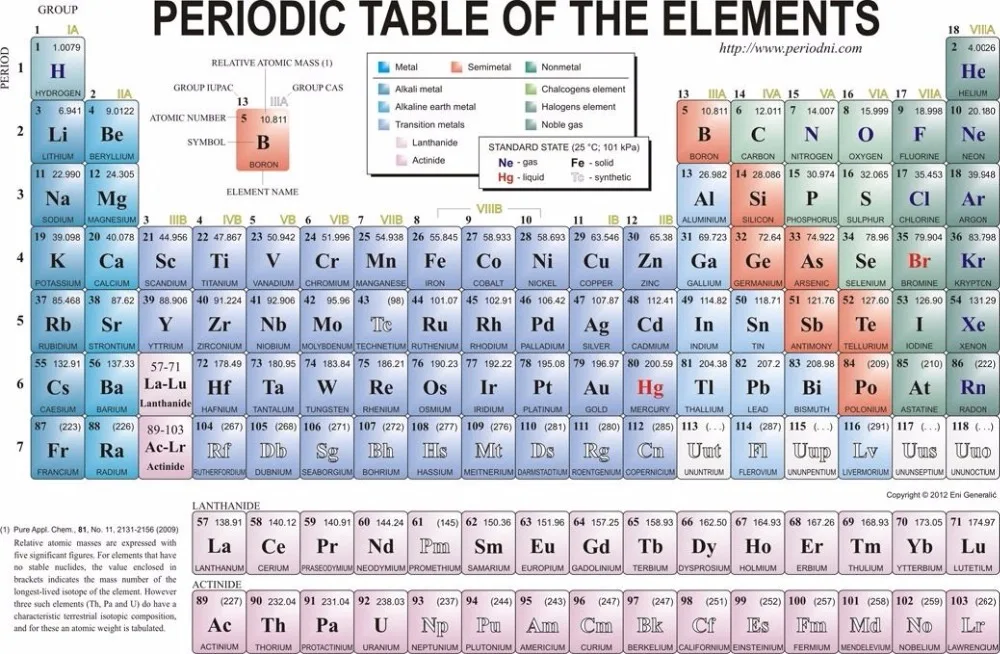 Температура плавления 1528 °C, температура кипения около 3320 °C. Иттрий легко поддается механической обработке.
Температура плавления 1528 °C, температура кипения около 3320 °C. Иттрий легко поддается механической обработке.
Изотопы
Иттрий моноизотопный элемент, в природе представлен одним стабильным нуклидом 89Y.
Химические свойства
Металл неустойчив на воздухе.
Применение
Иттриевая керамика
Керамика для нагревательных элементов
Хромит иттрия —это материал для лучших высокотемпературных нагревателей сопротивления способных эксплуатироваться в окислительной среде (воздух, кислород).
ИК — керамика
«Иттралокс»(Yttralox) — твёрдый раствор двуокиси тория в окиси иттрия. Для видимого света этот материал прозрачен, как стекло, но также он очень хорошо пропускает инфракрасное излучение, поэтому его используют для изготовления инфракрасных «окон» специальной аппаратуры и ракет, а также используют в качестве смотровых «глазков» высокотемпературных печей.
Огнеупорные материалы
Оксид иттрия — чрезвычайно устойчивый к нагреву на воздухе огнеупор, упрочняется с ростом температуры (максимум при 900—1000 °C), пригоден для плавки ряда высокоактивных металлов (в том числе и самого иттрия). Особую роль оксид иттрия играет при литье урана. Одной из наиболее важных и ответственных областей применения оксида иттрия в качестве жаропрочного огнеупорного материала является производство наиболее долговечных и качественных сталеразливочных стаканов (устройство для дозированного выпуска жидкой стали), в условиях контакта с движущимся потоком жидкой стали оксид иттрия наименее размываем. Единственным известным и превосходящим по стойкости оксид иттрия в контакте с жидкой сталью является оксид скандия, но он чрезвычайно дорог.
Термоэлектрические материалы
Важным соединением иттрия является его теллурид. Имея малую плотность, высокую температуру плавления и прочность, теллурид иттрия имеет одну из самых больших термо-э. д.с среди всех теллуридов, а именно 921 мкВ/К (у теллурида висмута например 280 мкВ/К) и представляет интерес для производства термоэлектрогенераторов с повышенным КПД.
д.с среди всех теллуридов, а именно 921 мкВ/К (у теллурида висмута например 280 мкВ/К) и представляет интерес для производства термоэлектрогенераторов с повышенным КПД.
Сверхпроводники
Один из компонентов иттрий-медь-бариевой керамики с общей формулой YBa2Cu3O7-δ — перспективного высокотемпературного сверхпроводника с температурой сверхпроводящего перехода около 90 К.
Бериллид иттрия (равно как и бериллид скандия) является одним из лучших конструкционных материалов аэрокосмической техники и плавясь при температуре около 1920 °C, начинает окисляться на воздухе при 1670 °C (!). Удельная прочность такого материала весьма высока, и при использовании его в качестве матрицы для наполнения нитевидными кристаллами (усами) можно создать материалы, имеющие фантастические прочностные и упругие характеристики.
Сплавы иттрия
Иттрий является металлом, обладающим рядом уникальных свойств, и эти свойства в значительной степени определяют очень широкое применение его в промышленности сегодня и, вероятно, ещё более широкое применение в будущем.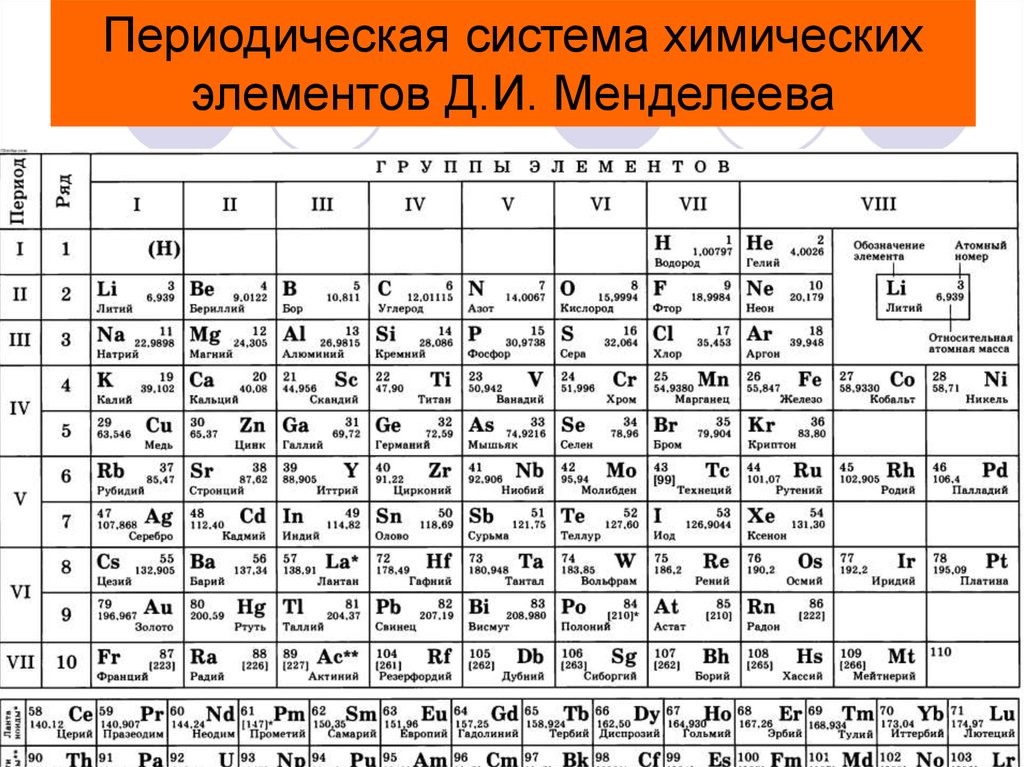 Предел прочности на разрыв для нелегированного чистого иттрия около 300 МПа (30 кг/мм). Очень важным качеством как металлического иттрия, так и ряда его сплавов является то обстоятельство, что будучи активным химически, иттрий при нагревании на воздухе покрывается пленкой оксида и нитрида, предохраняющих его от дальнейшего окисления до 1000 °C. Перспективными областями применения сплавов иттрия являются авиакосмическая промышленность, атомная техника, автомобилестроение. Очень важно то обстоятельство, что иттрий и его некоторые сплавы не взаимодействуют с расплавленным ураном и плутонием, и их использование позволяет применить их в ядерном газофазном ракетном двигателе.
Предел прочности на разрыв для нелегированного чистого иттрия около 300 МПа (30 кг/мм). Очень важным качеством как металлического иттрия, так и ряда его сплавов является то обстоятельство, что будучи активным химически, иттрий при нагревании на воздухе покрывается пленкой оксида и нитрида, предохраняющих его от дальнейшего окисления до 1000 °C. Перспективными областями применения сплавов иттрия являются авиакосмическая промышленность, атомная техника, автомобилестроение. Очень важно то обстоятельство, что иттрий и его некоторые сплавы не взаимодействуют с расплавленным ураном и плутонием, и их использование позволяет применить их в ядерном газофазном ракетном двигателе.
Легирование
Легирование алюминия иттрием повышает на 7,5 % электропроводность изготовленных из него проводов.
Иттрий имеет высокие предел прочности и температуру плавления, поэтому способен создать значительную конкуренцию титану в любых областях применения последнего (ввиду того, что большинство сплавов иттрия обладает большей прочностью, чем сплавы титана, а кроме того у сплавов иттрия отсутствует «ползучесть» под нагрузкой, которая ограничивает области применения титановых сплавов).
Иттрий вводят в жаростойкие сплавы никеля с хромом (нихромы) с целью повысить температуру эксплуатации нагревательной проволоки или ленты и с целью в 2—3 раза увеличить срок службы нагревательных обмоток (спиралей), что имеет громадное экономическое значение (использование вместо иттрия скандия ещё в несколько раз увеличивает срок службы сплавов).
Магнитные материалы
Изучается перспективный магнитный сплав — неодим-иттрий-кобальт.
Покрытия иттрием и его соединениями
Напыление (детонационное и плазменное) иттрия на детали двигателей внутреннего сгорания позволяет увеличить износостойкость деталей в 400—500 раз по сравнению с хромированием.
Люминофоры
Окись и ванадат иттрия, легированные ионами европия, используются в производстве кинескопов цветных телевизоров.
Оксосульфид иттрия, активированный европием, применяется для производства люминофоров в цветном телевидении (красная компонента), а активированный тербием — для черно-белого телевидения.
Дуговая сварка
Добавлением иттрия в вольфрам резко снижают работу выхода (у чистого иттрия 3,3 эВ), что используется для производства иттрированных вольфрамовых электродов для аргонодуговой сварки и составляет значительную статью расхода металлического иттрия.
Гексаборид иттрия имеет так же малую работу выхода (2,22 эВ) и применяется для производства катодов мощных электронных пушек (электронно-лучевая сварка и резка в вакууме).
Другие сферы применения
Тетраборид иттрия находит применение в качестве материала для управления атомным реактором (имеет малое газовыделение по гелию и водороду).
Ортотанталат иттрия синтезируется и используется для производства рентгеноконтрастных покрытий.
Синтезированны иттрий-алюминиевые гранаты («сиграны»)(ИАГ), имеющие ценные физико-химические свойства, могут применяться и в ювелирном деле, и уже довольно давно применяемые в качестве технологичных и относительно дешёвых твердотельных лазеров. 2
2
Элемент RefBy (Cell_Type complexType) (Visio XML)
Twitter LinkedIn Facebook Адрес электронной почты
- Статья
- Чтение занимает 3 мин
Указывает ссылку на страницу в документе.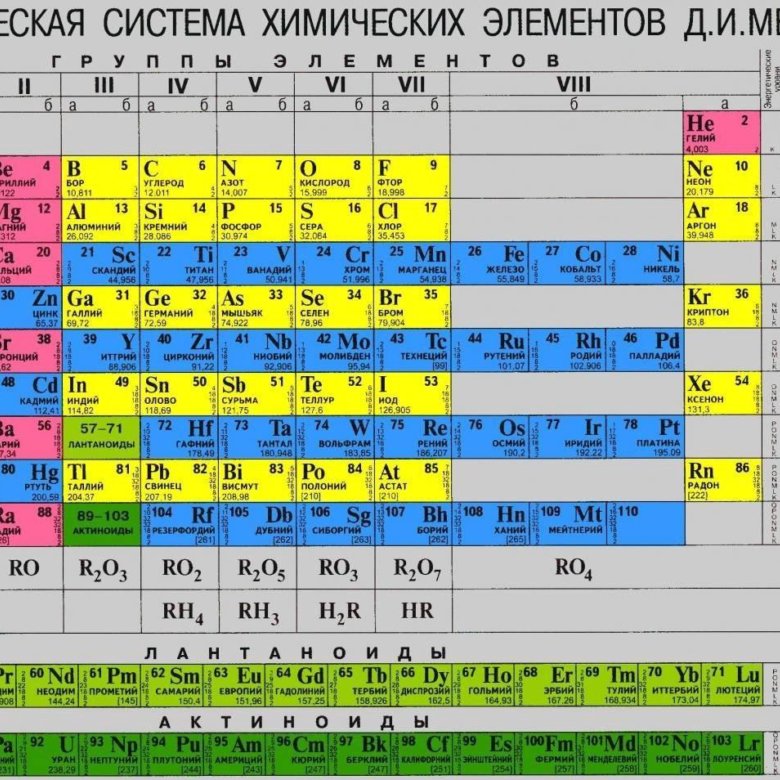
| Значение | |
|---|---|
| Тип элемента |
RefBy_Type |
| Пространство имен |
http://schemas.microsoft.com/office/visio/2012/main |
| Файл схемы |
VisioSchema15.xsd |
| Части документа |
document.xml, masters.xml, master#.xml, pages.xml, page#.xml |
Определение
< xs:element name="RefBy" type="RefBy_Type" minOccurs="0" maxOccurs="unbounded" > </xs:element >
Элементы и атрибуты
Если в схеме определяются конкретные требования, например sequence, minOccurs, maxOccurs и choice, см. раздел определений.
Родительские элементы
| Элемент | Тип | Описание |
|---|---|---|
| Элемент Cell (Action Tag Section) |
Cell_Type |
Определяет одно свойство для тега действия на фигуре или странице. |
| Элемент Cell (строка Actions) |
Cell_Type |
Указывает одно свойство действия, связанного с пользовательской командой, в контекстном меню или меню тегов действий. |
| Элемент Cell (строка ArcTo) |
Cell_Type |
Содержит координату x, координату y или смычок дуги. |
| Элемент Cell (Character Section) |
Cell_Type |
Задает атрибут форматирования для выполнения текста фигуры, например шрифт, цвет, стиль, регистр, положение относительно базового плана или размера точки. |
| Элемент Cell (строка Connection) |
Cell_Type |
Содержит координаты X или Y, горизонтальное или вертикальное направление или тип для одной точки соединения на фигуре. |
| Элемент Cell (строка Controls) |
Cell_Type |
Содержит свойство для определенного дескриптора элемента управления, определенного для фигуры. |
| Элемент Cell (строка Ellipse) |
Cell_Type |
Содержит координаты X или Y центральной точки эллипса и две точки эллипса. |
| Элемент Cell (строка EllipticalArcTo) |
Cell_Type |
Содержит координаты X или Y конечной точки эллиптической дуги, координаты X или Y контрольных точек на дуге, угол от оси X до основной оси эллипса или соотношение между основной и вспомогательной осями эллипса. |
| Элемент Cell (Field Section) |
Cell_Type |
Отображает функции и формулы, вставленные в текст фигуры с помощью диалогового окна «Поле». |
| Элемент Cell (Fill Gradient Section) |
Cell_Type |
Содержит цвет, прозрачность и положение градиентной остановки для градиента заливки. |
| Элемент Cell (Geometry Section) |
Cell_Type |
Определяет свойства, определяющие форматирование и свойства поведения по отношению к линиям и дугам, которые являются разделом Geometry. |
| Элемент Cell (строка Hyperlink) |
Cell_Type |
Содержит сведения для одной гиперссылки, связанной с фигурой. Фигура будет содержать одну строку гиперссылки для каждой гиперссылки. Фигура будет содержать одну строку гиперссылки для каждой гиперссылки. |
| Элемент Cell (строка InfiniteLine) |
Cell_Type |
Содержит координаты X или Y двух точек на бесконечной линии. |
| Элемент Cell (Layer Section) |
Cell_Type |
Задает одно свойство для слоя или его свойств для страницы. |
| Элемент Cell (Line Gradient Section) |
Cell_Type |
Содержит цвет, прозрачность или положение градиентной остановки для градиента линии. |
| Элемент Cell (строка LineTo) |
Cell_Type |
Содержит координаты X или Y конечной вершины сегмента прямой линии. |
| Элемент Cell (строка MoveTo) |
Cell_Type |
Содержит координаты X или Y первой вершины фигуры или представляет координаты X или Y первой вершины после разрыва пути. |
| Элемент Cell (строка NURBSTo) |
Cell_Type |
Содержит координаты по оси X или Y, положение второго по последнему ядру, положение последнего веса, положение первой узлы, положение первого веса или формулу для несоединимого рациона b-сплайна (NURBS). |
| Элемент Cell (Paragraph Section) |
Cell_Type |
Задает атрибут форматирования абзаца для текста фигуры, например отступы, междустрочные интервалы, маркеры или горизонтальное выравнивание абзацев. |
| Элемент Cell (строка PolyLineTo) |
Cell_Type |
Содержит координаты X или Y последней точки полилинейной или многострочного формулы. |
| Элемент Cell (строка RelCubBezTo) |
Cell_Type |
Содержит координаты X или Y конечной точки кубической кривой Безье относительно ширины и высоты фигуры, координаты X или Y контрольной точки начала относительной ширины и высоты кривой либо координаты X или Y точки управления относительной ширины и высоты кривой. |
| Элемент Cell (строка RelEllipticalArcTo) |
Cell_Type |
Содержит координаты X или Y конечной точки эллиптической дуги относительно ширины и высоты фигуры, координаты X или Y контрольных точек на дуге относительно ширины и высоты фигуры, угол от оси X до основной оси эллипса или соотношение между основной и вспомогательной осями эллипса. |
| Элемент Cell (RelLineTo Row)Cell |
Cell_Type |
Содержит координаты X или Y конечной вершины сегмента прямой линии относительно ширины и высоты фигуры. |
| Элемент Cell (строка RelMoveTo) |
Cell_Type |
Содержит координаты X или Y первой вершины фигуры, координаты X или Y первой вершины после разрыва пути относительно высоты и ширины фигуры. |
| Элемент Cell (RelQuadBezTo Section |
Cell_Type |
Содержит координаты X или Y конечной точки квадратической кривой Безье относительно ширины и высоты фигуры, а также координат x или y для точки управления относительной ширины и высоты кривой. |
| Элемент Cell (Scratch Section) |
Cell_Type |
Указывает рабочую область для ввода и тестирования формул, на которые могут ссылаться другие ячейки. |
| Элемент Cell (Shape Data Section |
Cell_Type |
Указывает одно свойство данных фигуры. |
| Элемент Cell (строка SplineKnot) |
Cell_Type |
Содержит координаты по оси X или Y для точки управления сплайна или сплайна. |
| Элемент Cell (Раздел SplineStart) |
Cell_Type |
Содержит координаты по оси X или Y для второй точки управления сплайна, ее второго вора, его первого почек, последнего почек или степени сплайна. |
| Элемент Cell (Tabs Section) |
Cell_Type |
Задает свойство, которое управляет положением или выравниванием позиции табуляции и табуляции стиля. |
| Элемент Cell (User-defined Cells Section) |
Cell_Type |
Одно свойство указанного пользователем фрагмента информации, на которое могут ссылаться другие ячейки и средства надстроек. |
Дочерние элементы
Нет.
Атрибуты
| Атрибут | Тип | Обязательный | Описание | Возможные значения |
|---|---|---|---|---|
| ID |
xsd:unsignedInt |
обязательно |
Указывает идентификатор страницы в документе. |
Значения типа xsd:unsignedInt. |
| T |
xsd:string |
обязательно |
Указывает ссылочный тип. | Значения типа xsd:string. |
Иттрий — информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к Цирконий >
| Группа | 3 | Температура плавления | 1522°С, 2772°F, 1795 К |
| Период | 5 | Температура кипения | 3345°С, 6053°F, 3618 К |
| Блок | д | Плотность (г см −3 ) | 4,47 |
| Атомный номер | 39 | Относительная атомная масса |
88. 906 906
|
| Состояние при 20°С | Твердый | Ключевые изотопы | 89 Д |
| Электронная конфигурация | [Кр] 4d 1 5s 2 | КАС номер | 7440-65-5 |
| ChemSpider ID | 22429 |
ChemSpider — бесплатная база данных химической структуры.
|
|
Радар отражает использование иттрия в радиолокационной технологии. Этот элемент также использовался для обеспечения красного цвета на ранних цветных телевизионных экранах, и это является причиной фона, который перекликается с заставкой мультфильма Warner Bros. «Это все, ребята!».
Мягкий серебристый металл.
Иттрий часто используется в качестве добавки к сплавам. Повышает прочность алюминиевых и магниевых сплавов. Он также используется при изготовлении микроволновых фильтров для радаров и используется в качестве катализатора при полимеризации этилена.
Иттрий-алюминиевый гранат (ИАГ) используется в лазерах, которые могут прорезать металлы. Он также используется в белых светодиодах.
Оксид иттрия добавляется в стекло, используемое для изготовления объективов фотоаппаратов, чтобы сделать их термостойкими и ударопрочными. Он также используется для изготовления сверхпроводников. Оксисульфид иттрия раньше широко использовался для производства красных люминофоров для цветных телевизионных трубок старого образца.
Оксисульфид иттрия раньше широко использовался для производства красных люминофоров для цветных телевизионных трубок старого образца.
Радиоактивный изотоп иттрий-90 используется в медицине. Его можно использовать для лечения некоторых видов рака, таких как рак печени.
Иттрий не играет известной биологической роли. Его растворимые соли слаботоксичны.
Ксенотим может содержать до 50% фосфата иттрия. Его добывают в Китае и Малайзии. Иттрий также встречается в других «редкоземельных» минералах, монаците и бастнезите. Металлический иттрий получают путем восстановления фторида иттрия металлическим кальцием.
Элементы и история периодической таблицы
В 1787 году Карл Аррениус наткнулся на необычный черный камень в старом карьере в Иттербю, недалеко от Стокгольма. Он подумал, что нашел новый минерал вольфрама, и передал образец Йохану Гадолину из Финляндии. В 1794 году Гадолин объявил, что он содержит новую «землю», составляющую 38 процентов его веса. Его назвали «землей», потому что это был оксид иттрия, Y 2 O 3 , который не мог быть дополнительно восстановлен путем нагревания с древесным углем.
Его назвали «землей», потому что это был оксид иттрия, Y 2 O 3 , который не мог быть дополнительно восстановлен путем нагревания с древесным углем.
Сам металл был впервые выделен в 1828 году Фридрихом Вёлером и получен путем взаимодействия хлорида иттрия с калием. Тем не менее, иттрий все еще скрывал другие элементы.
В 1843 году Карл Мосандер более тщательно исследовал оксид иттрия и обнаружил, что он состоит из трех оксидов: оксида иттрия белого цвета; оксид тербия желтого цвета; и оксид эрбия, окрашенный в розовый цвет.
| Атомный радиус, несвязанный (Å) | 2,32 | Ковалентный радиус (Å) | 1,76 |
| Сродство к электрону (кДж моль −1 ) |
29. 621 621
|
Электроотрицательность (шкала Полинга) |
1,22 |
|
Энергии ионизации (кДж моль −1 ) |
1 ст 599,878 2 -й 1179.437 3 рд 1979,88 4 -й
5846. 5 -й 7429 6 -й 8973 7 -й 11192 8 -й 12447 |
||
| Общие степени окисления | 3 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 89 Д |
88. 906 906
|
100 | — | — | |
|
|
|
Удельная теплоемкость (Дж кг -1 К -1 ) |
298 | Модуль Юнга (ГПа) | 63,5 | |||||||||||
| Модуль сдвига (ГПа) | 25,6 | Объемный модуль (ГПа) | 41,2 | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
|
|||||||||||||
| Давление (Па) |
|
|||||||||||||
| Слушайте подкаст Yttrium |
|
Стенограмма: (Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец рекламного ролика) Мира Сентилингам На этой неделе последний из элементов, обнаруженных в маленьком городке Иттерби и его соединениях, кажется, имеет множество применений. Саймон Коттон Y. Это не вопрос. Y — это символ элемента иттрия. Примерно 20 лет назад большинство ученых ничего о нем не слышали, разве что смутно указывали, где он находится в периодической таблице: ниже скандия и выше лантана. Некоторые люди могли просто знать, что это один из 4 химических элементов, названных в честь небольшого шведского городка Иттербю, наряду с иттербием, эрбием и тербием. Затем, в 1986 году, двое ученых, работавших в IBM в Цюрихе, Георг Беднорц и Карл Мюллер, обнаружили, что оксид лантана-бария-меди становится сверхпроводящим при тогдашней почти рекордно высокой температуре, 35 градусов выше абсолютного нуля. Другими словами, ниже минус 238°С электрическое сопротивление соединения исчезало. За это открытие Беднорц и Мюллер получили Нобелевскую премию по физике в 1987 году. Побуждение других ученых стряхнуть пыль со своих Периодических таблиц и попробовать заменить лантановую часть другими подобными металлами. Два американских профессора, Мау-Куен Ву и Пол Чу, вместе со своими исследовательскими группами в Университетах Алабамы и Хьюстона изучали оксид иттрия-бария-меди. Он имеет формулу YBa 2 Cu 3 O 7 и часто для краткости называется YBCO. Они обнаружили, что он стал сверхпроводящим 95 градусов ниже абсолютного нуля (-178 ºC). Может показаться, что разница температур невелика, но это означало, что YBCO можно было поддерживать в сверхпроводящем состоянии с помощью жидкого азота, а не гораздо более дорогого жидкого гелия. Это вдохновило множество исследований за последние 20 лет. Конечная цель, Святой Грааль, состоит в том, чтобы найти материал, который обладал бы сверхпроводимостью при комнатной температуре, но до этого еще никто не добрался. YBCO можно использовать во многих областях; например, сканеры МРТ можно сделать более дешевыми при более высокой температуре с использованием хладагента из жидкого азота. Однако в настоящее время существуют технические проблемы, препятствующие этим коммерческим приложениям. Во-первых, для сверхпроводимости на 95K, YBCO должен быть немного дефицитным по кислороду, чтобы иметь чуть меньше семи атомов кислорода на атом иттрия. Точное количество имеет решающее значение, и его сложно достичь. Другие проблемы включают приведение YBCO в нужное состояние; много исследований направлено на то, чтобы сделать из него тонкие пленки и найти способ превратить его в непрерывный провод, а не просто набор кристаллов, упакованных вместе, которые не могут проводить приличные токи. Исследователи изучают возможность нанесения YBCO на гибкую металлическую проволоку, и исследования в этом направлении продолжаются. Помимо этого, существует множество повседневных применений соединений иттрия. Наиболее известным применением является красный люминофор в электронно-лучевых трубках, используемых в традиционных цветных телевизорах. Он сделан из оксисульфида иттрия, Y2O2S, содержащего небольшое количество трехвалентных ионов европия. Точно так же иттриевые основы часто используются для размещения ионов тербия, которые представляют собой зеленые люминофоры. Такие материалы используются в люминесцентных лампах «холодного белого цвета». Иттрий-алюминиевый гранат, также известный как YAG, является очень важным синтетическим минералом. Он используется для изготовления твердых искусственных алмазов, которые сверкают так же, как настоящие. Иттрий также находит применение в топливных элементах для питания автомобилей и автобусов, компьютеров и цифровых телефонов и, возможно, в зданиях. Небольшое количество оксида иттрия добавляется к оксиду циркония для получения так называемого оксида циркония, стабилизированного оксидом иттрия (также называемого YSZ). Он обладает необычным свойством проводить ионы оксида, что делает его очень полезным в топливных элементах. YSZ также используется для изготовления лямбда-зондов, устанавливаемых на выхлопную систему вашего автомобиля. Они контролируют количество кислорода в выхлопных газах и посылают обратную связь, чтобы подавать в двигатель наилучшую топливно-воздушную смесь. Итак, это вам иттрий. Бесцветный, невзрачный, но, несомненно, исполняющий немало важных ролей второго плана. Мира Сентилингам Итак, Оскар за лучшую роль второго плана достается, как вы уже догадались, Иттриуму. Это был Саймон Коттон из Уппингемской школы с многочисленными ролями и использованием иттрия. На следующей неделе у нас есть элемент, который может перенести нас в другое измерение. Hayley Birch В 1949 году Милтон Смит опубликовал небольшой художественный труд, который он назвал «Тайна элемента 117». Настоящий элемент 117 еще предстоит открыть — это пустое место в периодической таблице сразу после галогенов. . Однако 117 Смита был странным материалом, который можно было использовать, чтобы открыть окно в другое измерение. Он назвал это вещество магнитным монополем — таким, которое вместо полюсов во множественном числе, подобно обычному магниту, имело полюс. Единственное число. Теперь, хотя ни один уважаемый ученый не стал бы утверждать, что магнитный монополь может открыть межпространственный портал, его существование не выходит за рамки возможного, и, если судить по недавним сообщениям, он может зависеть от обычного металлического элемента, который вы можете найти крадущийся в нижней части периодической таблицы — гольмий. Мира Сентилингам И Хейли Берч расскажет правду о таких мифических монополиях в выпуске «Химия в ее элементах» на следующей неделе. А пока я Мира Сентилингам, и спасибо, что выслушали. (Промо) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. (окончание акции) |
Нажмите здесь, чтобы посмотреть видео об иттриуме
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
W. M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г. Таблица
905 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd, New York, 2nd. Издание 2011 г.
Издание 2011 г.
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.
Периодическая таблица видео, по состоянию на декабрь 2014 г.
Частично получены из материалов, предоставленных Британской геологической службой © NERC.
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
, созданные The Nake Scients Scientists. .
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
Y Информация об элементе иттрия: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
Кристаллическая структура иттрия
Твердотельная структура иттрия Простая гексагональная .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | B | C |
|---|---|---|
| 364,74 PM | 364,74 PM | 573,06 PM |
и Angles между ними.
| alpha | beta | gamma |
|---|---|---|
| π/2 | π/2 | 2 π/3 |
The positions of the atoms inside the unit cell are described by the набор атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если киральные копии считаются различными).
иттрия Атомная атомная и общеобразная. 2] с символом атомного термина (квантовые числа)
2 D 3/2 .
| Атомный номер | 39 |
| Число электронов (бесплатно) | 39 |
| Number of Protons | 39 |
| Mass Number | 89 |
| Number of Neutrons | 50 |
| Shell structure (Electrons per energy level) | 2, 8, 18, 9, 2 |
| Electron Configuration | [Kr] 4d1 5s2 |
| Valence Electrons | 4d1 5s2 |
| Valence (Valency) | 3 |
| Main Oxidation States | 3 |
| Oxidation States | 0, 1, 2, 3 |
| Atomic Term Symbol (Quantum Numbers) | 2 D 3/2 |
Атомная модель иттрия Бора – количество электронов на энергетический уровень
Электронная конфигурация иттрия в основном состоянии – нейтральный атом иттрия
Сокращенная электронная конфигурация иттрия
Сокращенная электронная конфигурация основного состояния нейтрального атома иттрия: [Kr] 4d1 5s2. Часть конфигурации иттрия, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Kr]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4d1 5s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации иттрия, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Kr]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4d1 5s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального иттрия
Полная электронная конфигурация атома иттрия в основном состоянии. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d1 5s2
Электроны заполняют атомные орбитали в порядке, определяемом принципом Ауфбау, принципом исключения Паули и принципом исключения Хунда Правило.
 …
… Атомная структура иттрия
Атомный радиус иттрия составляет 212 пм, а его ковалентный радиус составляет 162 пм.
| Вычисленный атомный радиус | 212 пм (2,12 Å) |
| Радиус Эмпирический радиус | 180 вечера (1,8 Å) |
| Атом | 19,881 CM3/мол |
| COVER COVL Waals Radius | — |
| Neutron Cross Section | 1.28 |
| Neutron Mass Absorption | 0.0006 |
Atomic Spectrum of Yttrium
Химические свойства иттрия: Энергия ионизации иттрия и сродство к электрону
Сродство к электрону иттрия составляет 29,6 кДж/моль.
| Valence | 3 |
| Electronegativity | 1.22 |
| ElectronAffinity | 29.6 kJ/mol |
Ionization Energy of Yttrium
Refer to table below for Ionization energies of Yttrium
| Ionization energy number | Enthalpy — kJ/mol |
|---|---|
| 1st | 600 |
| 2nd | 1180 |
| 3rd | 1980 |
| 4th | 5847 |
| 5th | 7430 |
| 6th | 8970 |
| 7th | 11190 |
| 8th | 12450 |
| 9th | 14110 |
| 10th | 18400 |
| 11th | 19900 |
| 12th | 36090 |
Yttrium Physical Properties
Refer to below table for Yttrium Physical Properties
| Плотность | 4,472 г/см3 (для жидкости при т.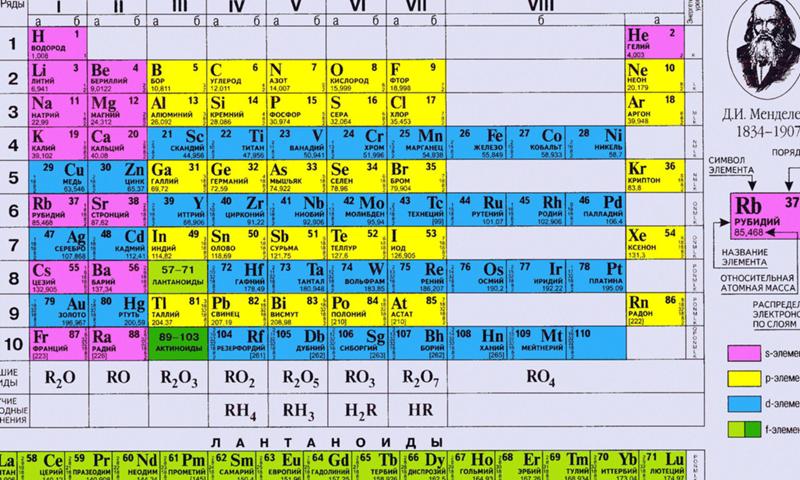 пл. плотности $4,24 г/см3) пл. плотности $4,24 г/см3) |
| Молярный объем | 19,881 см3/моль |
Elastic Properties
| Young Modulus | 64 |
| Shear Modulus | 26 GPa |
| Bulk Modulus | 41 GPa |
| Poisson Ratio | 0.24 |
Hardness Иттрия – тесты для измерения твердости элемента
| Твердость по Моосу | — |
| Твердость по Виккерсу | — |
| Твердость по Бринеллю | 589 МПа |
Электрические свойства иттрия
Иттрий является проводником электричества. См. Таблицу ниже для электрических свойств Ofyttrium
| Электрическая проводимость | 1800000 С/м | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| уделка | 5,59E-7 мм | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5,59E-7 мм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5,59E-7 ω | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
. Теплопроводность и теплопроводность Теплопроводность и теплопроводность
Yttrium Magnetic Properties
Optical Properties of Yttrium
Acoustic Properties of Yttrium
Тепловые свойства иттрия – энтальпии и термодинамика Тепловые свойства иттрия 9 см.
Enthalpies of Yttrium
Изотопы иттрия. Ядерные свойства иттрия У иттрия есть 1 стабильный природный изотоп.Изотопы иттрия — Встречающиеся в природе стабильные изотопы: 89Y.
Факты об иттрии | Живая наукаКусок иттрия. (Изображение предоставлено: Tomihahndorf/Creative Commons)
(Изображение предоставлено: Tomihahndorf/Creative Commons)
Иттрий был открыт в конце 18 века, но только в последние несколько десятилетий этот мягкий серебристый металл нашел широкое применение — в химии, физике, вычислительной технике, энергетике, медицине и других областях. В Периодической таблице элементов иттрий входит в число переходных металлов, к которым относятся некоторые более известные элементы, такие как серебро и железо. Переходные металлы имеют тенденцию быть прочными, но гибкими, поэтому некоторые из них, такие как медь и никель, широко используются для изготовления проводов. Иттриевые проволоки и стержни также используются в электронике и солнечной энергетике. Иттрий также используется в лазерах, керамике, объективах фотоаппаратов и десятках других предметов. Иттрий также является одним из редкоземельных элементов. Несмотря на свое название, редкоземельные элементы довольно распространены по всему миру. 17 редкоземельных элементов включают иттрий, скандий и 15 лантаноидов (металлические элементы с атомными номерами от 57 до 71). Однако иттрий редко используется сам по себе. Вместо этого исследователи используют его для образования соединений, таких как оксид иттрия-бария-меди (YBCO), что помогло открыть новую фазу исследований высокотемпературной сверхпроводимости. Иттрий также добавляют в металлические сплавы, чтобы повысить устойчивость к коррозии и окислению. «Как и многие другие элементы, вы не найдете иттрий как элемент или соединение общего назначения», — сказал Джозеф Гамбоги, специалист по сырьевым товарам из Национального информационного центра по минералам Геологической службы США. «Скорее всего, иттрий и его соединения добавляют к другим материалам для улучшения свойств других материалов». Мас Субраманиан, профессор материаловедения Орегонского государственного университета, согласился. «Во всех этих случаях иттрий используется для придания конструкции устойчивости». Субраманиан и его команда из OSU объединили иттрий с индием и марганцем, чтобы получить ярко-синий пигмент под названием YinMn Blue. Только факты
Электронная конфигурация и элементарные свойства иттрия. (Изображение предоставлено: Грег Робсон/Creative Commons, Андрей Маринкас (открывается в новой вкладке) Shutterstock (открывается в новой вкладке)) История В 1787 году лейтенант шведской армии и по совместительству химик по имени Карл Аксель Аррениус обнаружил необычный черный камень во время исследования карьера недалеко от Иттербю, небольшого городка недалеко от столицы Швеции Стокгольма. Гадолин выделил иттрий из минерала, который позже был назван в его честь гадолинитом. Иттрий был назван в честь Иттерби. В 1843 году шведский химик Карл Густав Мосандер исследовал образцы иттрия и обнаружил, что они содержат три оксида. В то время их называли иттрией, эрбией и тербией. Теперь они известны как белый оксид иттрия, желтый оксид тербия и розовый оксид эрбия соответственно. Четвертый оксид, оксид иттербия, был обнаружен в 1878 году. Источники иттрия Хотя иттрий был обнаружен в Скандинавии, в других странах его гораздо больше. Китай, Россия, Индия, Малайзия и Австралия являются ведущими производителями иттрия. В апреле 2018 года ученые обнаружили то, что они считают огромным месторождением редкоземельных металлов, в том числе иттрия, на небольшом японском острове под названием Остров Минамитори. Иттрий можно найти в большинстве редкоземельных минералов, но он никогда не был обнаружен в земной коре как самостоятельный элемент. Лунные камни, собранные во время лунных миссий Аполлона, содержат иттрий. Человеческое тело также содержит иттрий в небольших количествах, обычно концентрирующихся в печени, почках и костях. Использование иттрияДо эпохи телевизоров с плоским экраном телевизоры содержали большие электронно-лучевые трубки, которые представляли собой большие стеклянные трубки, проецирующие изображения на экран. Оксид иттрия, легированный элементом европием, обеспечил красный цвет миллионов цветных телевизоров. Оксид иттрия (иттрий) добавляют к оксиду циркония (оксиду циркония) для получения сплава, стабилизирующего кристаллическую структуру диоксида циркония, которая обычно изменяется при изменении температуры. «По сути, оксид иттрия фиксируется в кубической структуре диоксида циркония, создавая керамику с исключительно высокой прочностью, подходящую для использования при очень высоких температурах», — сказал Гамбоджи. Синтетические гранаты, изготовленные из иттрий-алюминиевого композита, обычно продавались в 1970-х годах как искусственные алмазы и другие драгоценные камни, но в конечном итоге они уступили место кубическому цирконию, сказал Гамбоджи. В наши дни иттрий-алюминиевые гранаты (YAG) используются в качестве кристаллов, которые усиливают свет в промышленных лазерах. Железо-иттриевые гранаты используются для микроволновых фильтров, а также в радиолокации и технике связи. «Несмотря на то, что иттрий используется во множестве приложений, наибольшее конечное применение — это керамика и люминофоры», — сказал Гамбоги в интервью Live Science. «Меньшее количество используется в металлургии, полировке стекла и добавках, а также в катализаторах… Существует также множество электронных приложений, но датчики кислорода являются особенно важным применением». Иттрий широко используется для производства люминофоров, используемых в сотовых телефонах и больших экранах дисплеев, а также в общем освещении. Иттрий в красных люминофорах в цветных телевизионных трубках получил широкое распространение в 1960-х и 1970-х годах. Люминесцентные лампы (линейные и компактные) используют значительно больше иттрия на ватт, чем светодиодные лампы. Радиоактивный изотоп иттрий-90 используется в лучевой терапии для лечения рака печени и некоторых других видов рака. Текущие исследования Субраманиан сказал, что с иттрием легче работать и он дешевле, чем многие другие элементы. Например, исследователи используют иттрий вместо гораздо более дорогой платины для разработки топливных элементов. Ученые из Технологического университета Чалмерса и Датского технического университета используют иттрий и другие редкоземельные металлы в форме наночастиц, которые однажды могут устранить потребность в ископаемом топливе и повысить эффективность автомобилей с батарейным питанием. Исследования сверхпроводимости на основе иттрия продолжаются во всем мире. Прорывы делаются в левитационных поездах и магнитно-резонансной томографии (МРТ) в здравоохранении. В 1987 году, когда исследователи из Хьюстонского университета искали металл, который способствовал бы сверхпроводимости при высоких температурах, они обратились к иттрию. Высокотемпературная сверхпроводимость была ограничена до минус 420 градусов по Фаренгейту (минус 251 по Цельсию). Физик Пол Чу и его команда из Хьюстонского университета обнаружили, что соединение иттрия, бария и оксида меди (известное как иттрий 123) может способствовать сверхпроводимости при температуре около минус 300 градусов по Фаренгейту (минус 184,4 градуса по Цельсию). Они создали материал, который можно охлаждать жидким азотом, что значительно снизит стоимость будущих применений сверхпроводимости. Subramanian работает с компаниями по производству красок и пластмасс, чтобы расширить возможности использования синего YinMn. Дополнительные ресурсы
Для любителей науки в каждом человеке Live Science предлагает захватывающее окно в мир природы и технологий, предоставляя исчерпывающие и убедительные новости и анализ всего: от открытий динозавров, археологических находок и удивительных животных до здоровья, инноваций и носимых технологий. Мы стремимся расширить возможности и вдохновить наших читателей инструментами, необходимыми для понимания мира и ценить его повседневное благоговение. Элемент «X» не может быть дочерним элементом элемента «Y» в этом контексте. (Подавление дальнейших ошибок из этого поддерева.) (Подавление дальнейших ошибок из этого поддерева.) Rocket Validator интегрирует средство проверки HTML W3C Validator. в автоматизированный поисковый робот. Бесплатная пробная версия Пробная версия Pro
Элемент X не может быть дочерним элементом Y. Например, элемент Элемент «div» не может быть дочерним элементом элемента «ul» в этом контексте. (Подавление дальнейших ошибок из этого поддерева.)
Тег Конечный тег «a» нарушает правила вложенности.
Было обнаружено, что конечный тег Конечный тег «код» нарушает правила вложенности.
Обнаружено, что конечный тег Конечный тег «strong» нарушает правила вложенности.
Конечный тег Начальный тег "a" виден, но элемент того же типа уже открыт.
Тег Элемент «метка» не должен быть потомком элемента «а».
Тег Элемент «метка» не должен являться потомком элемента «метка».
Элемент Элемент "table" не должен являться потомком элемента "caption".
Элемент 50 000 проверок доступности и HTML в месяц. Полностью автоматизирован. Позвольте нашему автоматизированному сканеру проверить ваши крупные сайты с помощью Axe Core и W3C Validator. Rocket Validator Pro Что общего у фианитов, телевизоров с ЭЛТ и методов лечения рака лимфомы? Элемент этой недели — иттрий, известный под атомным символом Y и атомным номером 39. Иттрий — редкоземельный металл, который никогда не встречается в чистом виде в дикой природе. Несмотря на то, что это «редкоземельный металл», он встречается на Земле в 400 раз чаще, чем серебро. Это также довольно распространено на Луне. Однако большая часть иттрия в Солнечной системе представляет собой «звездное вещество»; созданные в красных гигантах. Этот элемент имеет много общего с лантаноидами и часто встречается в ассоциации с ними и, таким образом, часто группируется с ними. Как и все элементы группы III, иттрий имеет нечетный атомный номер, поэтому у него есть только один стабильный природный изотоп, 9. Иттрий используется в различных предметах, с которыми вы можете соприкасаться. Среди прочего, он используется на электродах высокоэффективных свечей зажигания и в качестве датчика кислорода в автомобилях, он используется для придания красного цвета в телевизорах с ЭЛТ (особенно важно, если ваша команда носит красный цвет) и используется для укрепить кубический цирконий — «поддельные бриллианты» — в ювелирных изделиях. Биологи в толпе будут разочарованы, узнав, что иттрий не играет известной биологической роли, хотя различные формы этого элемента могут нанести непоправимый вред вашим легким или печени при вдыхании. Иттрий применяется в медицине, особенно при лечении рака. Радиоактивный изотоп иттрий-90, период полураспада которого составляет 64 часа, используется для специфического воздействия на различные лимфомы и лейкемии, клетки рака яичников, колоректального рака, поджелудочной железы и костей путем связывания этого изотопа с моноклональными антителами, которые затем связывают непосредственно к раковым клеткам. В этом видео мы посетим шведскую деревню Иттербю зимой, а также посетим светлую сторону Луны летом, чтобы рассказать историю иттрия: Посетите канал Periodicvideos на YouTube [ссылка на видео] .. .. .. .. .. .. .. .. .. .. .. .. Видеожурналист Брэди Харан — мужчина с камерой а Ноттингемский университет — это место с химиками. Вы можете следить за Брейди в твиттере @periodicvideos и за университетом Ноттингема в твиттере @UniNottingham Вы уже встречались с этими элементами: Стронций: Sr , атомный номер 38 Вот замечательная интерактивная Периодическая таблица элементов, с которой действительно весело играть! .. .. .. .. .. .. .. .. .. .. .. .. twitter: @GrrlScientist Мы отключили комментарии к этой старой версии сайта. Чтобы прокомментировать кроссворды, пожалуйста
переключитесь на новую версию, чтобы прокомментировать.
Подробнее... Название каждого элемента (выделено коричневым цветом) сопровождается его химическим символом (красным цветом) Z = атомный номер = количество протонов в ядре = количество электронов, вращающихся вокруг ядра; | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 722
722
 1
1



 В своих соединениях иттрий всегда присутствует в виде иона три плюс иттрий, что означает, что он бесцветен и не имеет неспаренных электронов; следовательно, у него нет собственных интересных магнитных или спектроскопических свойств. Положительным моментом этого является то, что соединения иттрия являются очень хорошими исходными материалами для других лантаноидов.
В своих соединениях иттрий всегда присутствует в виде иона три плюс иттрий, что означает, что он бесцветен и не имеет неспаренных электронов; следовательно, у него нет собственных интересных магнитных или спектроскопических свойств. Положительным моментом этого является то, что соединения иттрия являются очень хорошими исходными материалами для других лантаноидов.  Более того, вводя небольшие количества ионов лантанидов, можно получать материалы с рядом полезных свойств. Введите, например, небольшое количество церия, и вы получите хороший желтый люминофор. Или добавьте 1 % неодима к YAG, и вы получите наиболее широко используемый твердотельный лазерный материал. И эрбий дает вам инфракрасный лазер.
Более того, вводя небольшие количества ионов лантанидов, можно получать материалы с рядом полезных свойств. Введите, например, небольшое количество церия, и вы получите хороший желтый люминофор. Или добавьте 1 % неодима к YAG, и вы получите наиболее широко используемый твердотельный лазерный материал. И эрбий дает вам инфракрасный лазер. 

 в таблице ниже.0003
в таблице ниже.0003  Они стали незаменимыми в производстве сотовых телефонов и других технологий.
Они стали незаменимыми в производстве сотовых телефонов и других технологий.  «На самом деле марганец придал ему цвет, но иттрий помог скрепить структуру», — сказал он Live Science.
«На самом деле марганец придал ему цвет, но иттрий помог скрепить структуру», — сказал он Live Science.  Думая, что он открыл новый минерал, содержащий вольфрам, Аррениус отправил образец Йохану Гадолину, минералогу и химику из Финляндии, для анализа.
Думая, что он открыл новый минерал, содержащий вольфрам, Аррениус отправил образец Йохану Гадолину, минералогу и химику из Финляндии, для анализа. 
 «Этот тип керамики используется в самых разных областях: от электроники до термобарьерных покрытий реактивных двигателей и медицинских имплантатов».
«Этот тип керамики используется в самых разных областях: от электроники до термобарьерных покрытий реактивных двигателей и медицинских имплантатов». 

 Потенциальное использование во многом связано с уникальными свойствами иттрия. «Это более легкий элемент, поэтому вы можете получить больший объем без увеличения веса», — сказал он. «Это очень полезно для краски. Иттрий — удивительный элемент».
Потенциальное использование во многом связано с уникальными свойствами иттрия. «Это более легкий элемент, поэтому вы можете получить больший объем без увеличения веса», — сказал он. «Это очень полезно для краски. Иттрий — удивительный элемент». 
 Проверьте другие ошибки в том же документе, связанные с элементом
Проверьте другие ошибки в том же документе, связанные с элементом  Наиболее вероятной причиной является незакрытый тег
Наиболее вероятной причиной является незакрытый тег  Проверьте наличие вложенных элементов или закрывающих тегов, которые могли быть неверно истолкованы, например:
Проверьте наличие вложенных элементов или закрывающих тегов, которые могли быть неверно истолкованы, например:  Первоначально его атомный символ был Yt, но где-то в начале 1920-х годов его заменили на Y. Этот элемент приобретает свои странные черты. название от деревни Ytterby в Швеции, которая находится недалеко от того места, где был обнаружен этот элемент. Как вы можете видеть на изображении выше, иттрий похож на многие другие элементарные металлы; это серебристо-серый цвет. Он также мягкий, блестящий и очень кристаллический.
Первоначально его атомный символ был Yt, но где-то в начале 1920-х годов его заменили на Y. Этот элемент приобретает свои странные черты. название от деревни Ytterby в Швеции, которая находится недалеко от того места, где был обнаружен этот элемент. Как вы можете видеть на изображении выше, иттрий похож на многие другие элементарные металлы; это серебристо-серый цвет. Он также мягкий, блестящий и очень кристаллический.  0052 89 Y.
0052 89 Y.  Затем интенсивное излучение распадающегося иттрия-90 убивает связанные клетки.
Затем интенсивное излучение распадающегося иттрия-90 убивает связанные клетки.  0018
0018  9017 9017. SILICON: , , , , , , , , , , , , , , , , , , , , , , , , .0017 14
9017 9017. SILICON: , , , , , , , , , , , , , , , , , , , , , , , , .0017 14  0017 6
0017 6 
 5
5  5
5

