Из каких основных компонентов состоит автомобильный аккумулятор. Каков принцип работы свинцово-кислотного АКБ. Какие бывают типы автомобильных аккумуляторов. Как правильно заряжать и обслуживать АКБ.
Основные компоненты автомобильного аккумулятора
Автомобильный аккумулятор состоит из нескольких ключевых элементов:
- Корпус — пластиковый контейнер, в котором размещены все компоненты
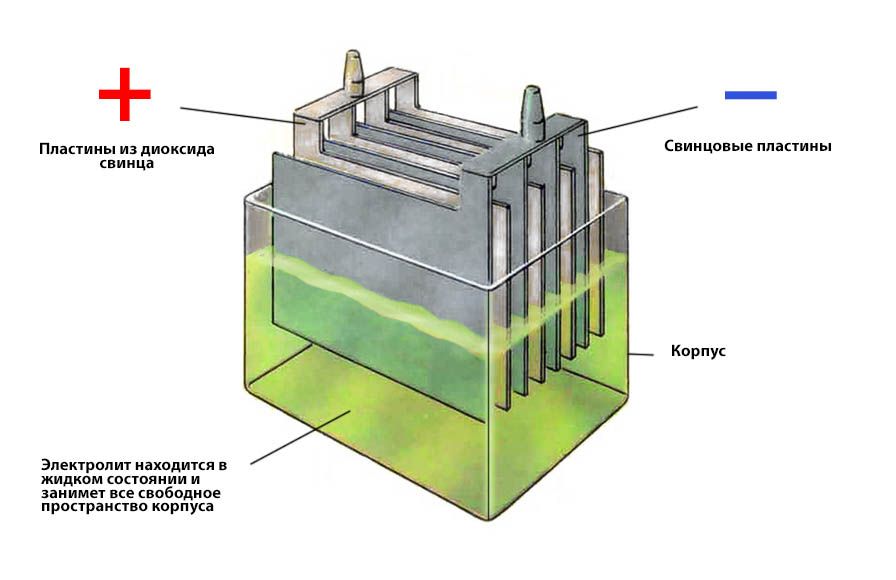
- Свинцовые пластины — положительные и отрицательные электроды
- Сепараторы — изолирующие прокладки между пластинами
- Электролит — раствор серной кислоты и дистиллированной воды
- Клеммы — выводы для подключения к бортовой сети автомобиля
Каково назначение каждого из этих компонентов? Корпус защищает внутренние части от повреждений и удерживает электролит. Свинцовые пластины участвуют в химических реакциях, генерирующих электрический ток. Сепараторы предотвращают короткое замыкание между пластинами. Электролит обеспечивает среду для протекания химических реакций. Клеммы служат для подключения аккумулятора к электросистеме автомобиля.
Принцип работы свинцово-кислотного аккумулятора
Как же работает автомобильный аккумулятор? Принцип его действия основан на электрохимических реакциях между свинцовыми пластинами и электролитом. При разрядке аккумулятора происходит следующее:
- На отрицательных пластинах свинец окисляется, образуя сульфат свинца
- На положительных пластинах диоксид свинца восстанавливается также до сульфата свинца
- Концентрация серной кислоты в электролите уменьшается
- В результате реакций генерируется электрический ток
При зарядке аккумулятора химические процессы идут в обратном направлении — сульфат свинца на пластинах преобразуется обратно в свинец и диоксид свинца, а концентрация кислоты в электролите повышается.
Основные характеристики автомобильных аккумуляторов
Какие ключевые параметры нужно учитывать при выборе аккумулятора? Основными характеристиками АКБ являются:
- Емкость — количество электричества, которое может отдать полностью заряженный аккумулятор
- Пусковой ток — максимальный ток, который способен обеспечить АКБ при запуске двигателя
- Габариты и полярность — физические размеры и расположение клемм
- Срок службы — время, в течение которого аккумулятор сохраняет свои характеристики
Емкость измеряется в ампер-часах (А·ч) и определяет, как долго аккумулятор сможет питать потребители. Пусковой ток характеризует способность АКБ запустить двигатель в холодную погоду. Габариты и полярность должны соответствовать посадочному месту в автомобиле. Срок службы зависит от конструкции и условий эксплуатации аккумулятора.
Типы автомобильных аккумуляторов
Какие виды АКБ применяются в современных автомобилях? Наиболее распространены следующие типы:
- Стандартные свинцово-кислотные — классическая технология, требующая обслуживания
- Необслуживаемые (Ca/Ca) — с добавлением кальция, не требуют долива воды
- AGM — с абсорбированным электролитом, более устойчивы к глубоким разрядам
- Гелевые — с загущенным электролитом, имеют увеличенный срок службы
В чем преимущества и недостатки разных типов АКБ? Стандартные аккумуляторы дешевле, но требуют регулярной проверки уровня электролита. Необслуживаемые более удобны в эксплуатации. AGM и гелевые отличаются повышенной надежностью и долговечностью, но стоят дороже.
Правила зарядки автомобильного аккумулятора
Как правильно заряжать автомобильный аккумулятор, чтобы продлить срок его службы? Следует придерживаться нескольких важных правил:
- Использовать зарядное устройство, соответствующее типу и емкости АКБ
- Заряжать при температуре от +10 до +30°C
- Не допускать перезаряда — контролировать напряжение и время зарядки
- Избегать глубоких разрядов аккумулятора
- Периодически проводить уравнительный заряд для выравнивания плотности электролита
Правильная зарядка позволяет восстановить емкость аккумулятора и предотвратить сульфатацию пластин. При этом важно не допускать перегрева батареи и чрезмерного газовыделения.
Обслуживание и уход за автомобильным аккумулятором
Какие меры нужно предпринимать для поддержания аккумулятора в рабочем состоянии? Основные правила обслуживания АКБ включают:
- Регулярную проверку уровня и плотности электролита (для обслуживаемых АКБ)
- Очистку клемм и корпуса от загрязнений и следов коррозии
- Контроль надежности крепления аккумулятора в автомобиле
- Проверку напряжения и подзарядку при длительных простоях
- Своевременную замену изношенного аккумулятора
Правильный уход позволяет значительно продлить срок службы АКБ и обеспечить его надежную работу. Особое внимание следует уделять аккумулятору в зимний период, когда нагрузка на батарею возрастает.
Диагностика неисправностей аккумулятора
Как определить, что аккумулятор нуждается в замене? Основные признаки неисправности АКБ:
- Затрудненный запуск двигателя, особенно в холодную погоду
- Быстрый разряд при небольшой нагрузке
- Вздутие корпуса аккумулятора
- Запах сероводорода из банок батареи
- Низкая плотность электролита, не поддающаяся корректировке
При обнаружении этих симптомов рекомендуется провести диагностику АКБ с помощью специального тестера. Он позволяет оценить емкость и пусковые характеристики аккумулятора. Если параметры существенно снижены, может потребоваться замена батареи.

Принцип работы и устройство аккумулятора
контакт-центр с 8:00 до 22:00
БлогПринцип работы и устройство аккумулятора
Стандартный автомобильный аккумулятор состоит из шести 2-вольтовых элементов, что дает на выходе 12 вольт. Каждый элемент состоит из свинцовых решетчатых пластин, покрытых активным веществом и погруженных в электролит. Отрицательные пластины покрыты мелкопористым свинцом, а положительные двуокисью свинца.
Когда к АКБ подключают нагрузку, активное вещество вступает в химическую реакцию с сернокислотным электролитом, вырабатывая электрический ток. На пластинах при этом осаждается сульфат свинца, и электролит, соответственно, истощается.
При зарядке эта реакция проходит в обратном направлении, и способность аккумулятора давать ток восстанавливается.
То есть принцип работы аккумуляторных батарей основывается на химических реакциях между свинцом и диоксидом свинца в сернокислотной среде, в результате которых вырабатывается электричество.
Показатели АКБ:
- Емкость, выраженная в ампер-часах. Она характеризует способность АКБ давать определенный ток в течение некоторого времени. Например, ёмкость 40 ампер-час означает, что аккумулятор может давать ток в 1 ампер в течение 40 часов (или в 2 ампера в течение 20 часов и т.д.).
- Характеристики стартовых токов, что наиболее востребовано у европейских марок автомобилей и позволяет завести машину при любых погодных условиях (высокие показатели тока холодной прокрутки).
- Резервная емкость. Этот параметр показывает интервал времени (в минутах), в течение которого аккумулятор способен давать ток 25 А (т.е. в течение какого времени он сможет подменять собой вышедший из строя генератор).
- Габаритные размеры, полярность. Для определения полярности на выводных клеммах аккумулятора проставляют знаки «+» и «-». При установке аккумуляторной батареи на автомобиль отрицательную клемму присоединяют к «массе», а положительную — в цепь.
Свинцово-кислотный аккумулятор, кроме видимой части, а это корпус аккумулятора, крышка, клеммы, индикатор заряда, имеет сложную внутреннюю конструкцию. Внутри аккумулятора находятся электроды (положительные и отрицательные), представляющие собой свинцовые решётки, и разделенные изоляторами (сепараторами), которые погружены в электролит.
Внутри аккумулятора находятся электроды (положительные и отрицательные), представляющие собой свинцовые решётки, и разделенные изоляторами (сепараторами), которые погружены в электролит.
Сепараторы предохраняют пластины (решётки) от соприкосновения друг с другом. Если будет соприкосновение разноименных пластин, произойдет короткое замыкание и аккумулятор не будет действовать. Сепараторы, не допуская короткого замыкания, в тоже время должны пропускать ток через электролит. Материалом для сепараторов служит, как правило, микропористая пластмасса.
Электроды погружены в химическое вещество электролит, состоящий из разбавленной дистиллированной водой серной кислоты (h3SO4). При разряжении аккумулятора активно расходуется серная кислота, в результате чего образуется вода. С образованием воды, общая плотность электролита снижается.
При зарядке аккумуляторной батареи, все происходит в обратном порядке. Вода «используется» на создание серной кислоты, соответственно общая плотность электролита повышается. Срок службы автомобильного аккумулятора и его характеристики напрямую зависят от качества серной кислоты и воды, входящих в состав электролита.
Вода «используется» на создание серной кислоты, соответственно общая плотность электролита повышается. Срок службы автомобильного аккумулятора и его характеристики напрямую зависят от качества серной кислоты и воды, входящих в состав электролита.
Электроды или решетки, изготавливаются из свинцовых сплавов. Эти сплавы содержат в себе такие компоненты, как сурьма, кальций, олово, наделяющие сплав определенными свойствами, и защищающие свинец от коррозии. Состав сплава свинца, а также форма решетки электрода, значительно влияют на характеристику батареи, например, мощность кислотно-свинцового аккумулятора или пусковой ток аккумулятора. Решетка заполнена активной пастой, которую изготавливают из свинцово-оксидного порошка. Состав свинцово-оксидного порошка и свойства пасты влияют на свойства аккумулятора
Корпус аккумулятора обычно изготавливают из ударопрочного, термостойкого пропилена.
Ждем Вас за покупками!
Сайт использует файлы Cookie (куки-файлы)
Продолжая использовать сайт Вы соглашаетесь на сбор данных о Вашем посещении сайта.
Как устроен аккумулятор автомобиля и как его заряжать
Запишись на первое бесплатное занятие в Москве Написать в чат WhatsАpp
Теория вождения не подразумевает просвещение в части технического оснащения автомобиля. Поэтому в этой статье мы расскажем вам о сердце авто.
Самым важнейшим элементом питания в автомобиле является аккумулятор, из которого исходит ток, который питает машину. Функций у него много, например: подача питания стартеру для запуска двигателя, либо же подача питания на неактивный двигатель. И в этой статье мы как раз обсудим устройство аккумулятора автомобиля.
На вопрос: «Сколько аккумуляторов в автомобиле ?» — ответом будет — 1. Но возможны случаи добавления дополнительной батареи.
Устройство автомобильного аккумулятора
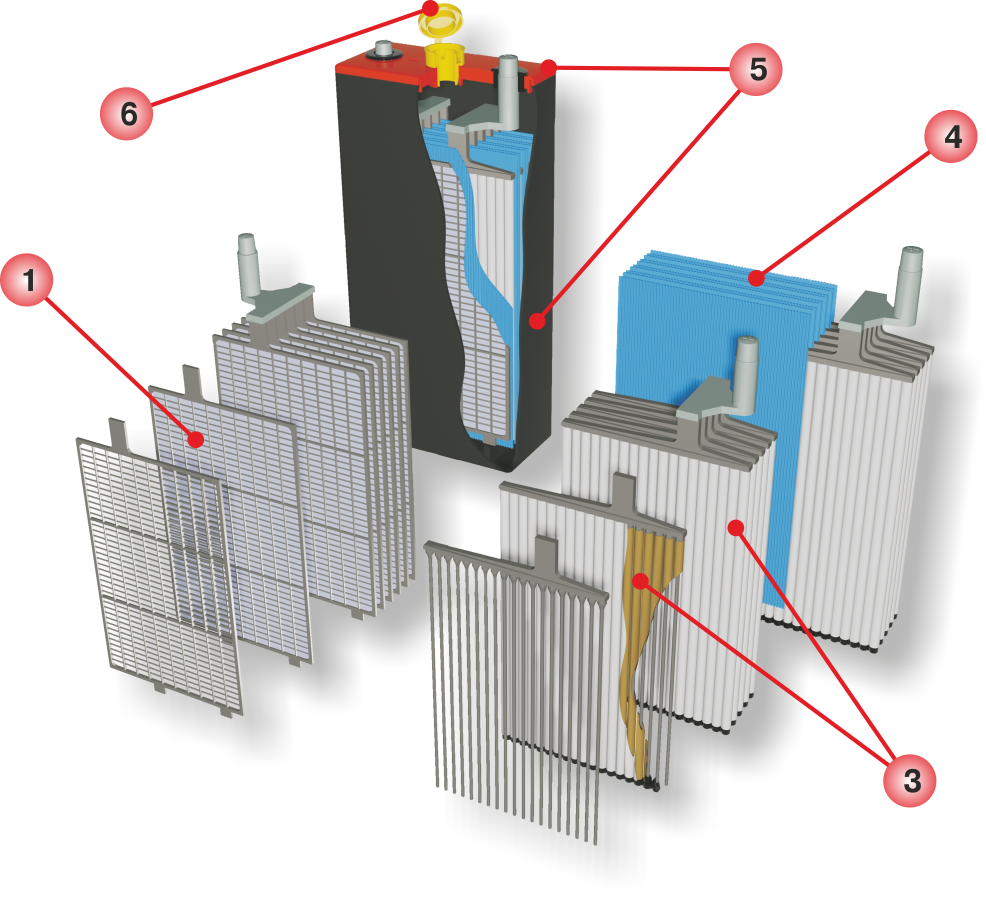
Батарея машины состоит из 9 различных частей, объединённых одной конструкцией: основной корпус и его крышка, полюсные выводы, сама батарея аккумулятора, токоотводящие борны, разделяющие перегородки, полюсные мосты, блок электродов и сепаратор.
Основной корпус и крышка. Материал изготовления — это эбонит или же пластик, наделенный устойчивостью к кислотам. Вверху, на крышке, находятся каналы, в которые заливаются электролит и дистиллированная вода. Закрываются эти каналы с помощью определенных затычек, имеющих вентиляционные отверстия для выхода газов и паров во время активного периода использования.
Полюсные выводы. Делятся на два типа: положительные и отрицательные. Для исключения путаницы между ними, сделали специальное отличие: положительный вывод имеет больший размер относительного отрицательного. Помимо прочего, присутствует гравировка со знаком плюса и минуса для исключения ситуации перепутывания выводов.
Батарея аккумулятора состоит из 6 раздельных меньших аккумуляторов, либо же «банок». Они помещены в специальный раствор, который на 35% состоит из серной кислоты и на 65% из дистиллированной воды. Называется — электролит, и требуется для непосредственной выработке тока при взаимодействии химических элементов электролита.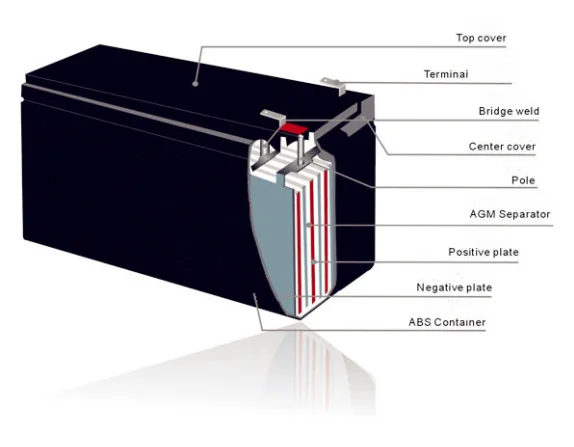
Токоотводящие борны. Они прикрепляются к отрицательным и положительным полюсам выводов, для того, чтобы выводить ток наружу.
Разделяющие перегородки. Они просто служат для разграничения всех аккумуляторов, с целью ограничения их взаимодействия.
Полюсные мосты. Главная их задача заключается в герметизации соединения всех блоков аккумуляторной батареи через перегородку основания, корпуса.
Сами «банки» аккумулятора автомобиля состоят также из нескольких частей:
Блок. Он состоит из :
- положительных электродов, которые, в свою очередь, созданы из свинцовых пластин в виде решетки, они покрыты специальной массой, состоящей из диоксидов свинца, также, все электроды подсоединены к самому полюсному мосту через специальное отверстие;
- отрицательных электродов, состоящих также из свинцовых пластин в виде решетки, но они уже пропитаны специальной массой, которая состоит из мелкопористого свинца. Также, через специальное отверстие все электроды проведены к полюсному мосту.
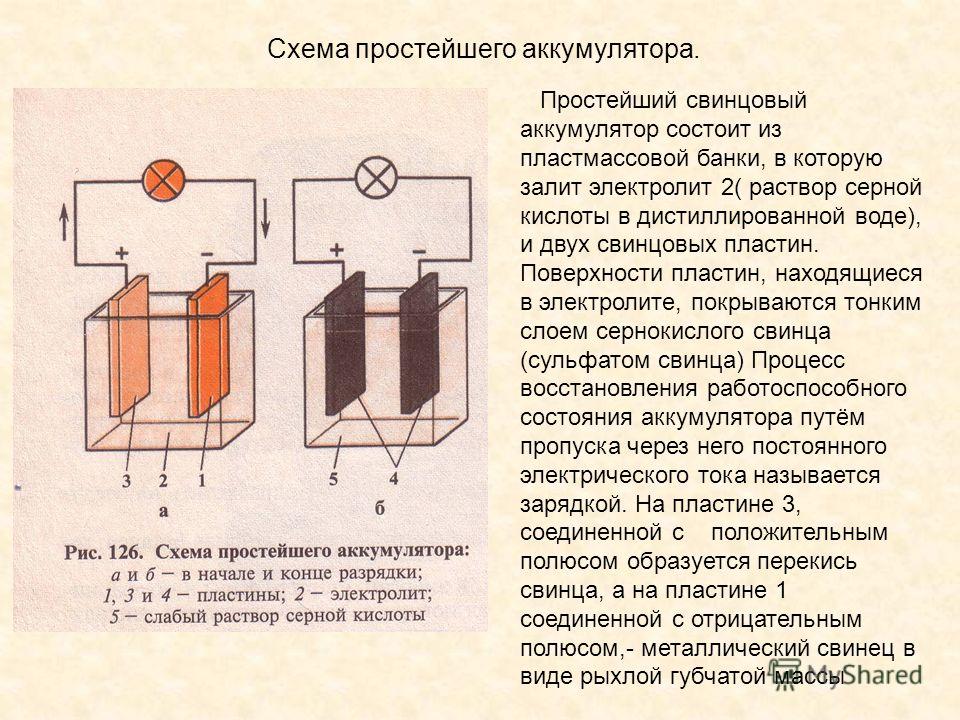
Важное уточнение: то самое количество специального реагента, которое нанесено на решетчатые платины этих электродов (положительных и отрицательных) определяет одну из важнейших характеристик автомобильного аккумулятора — ёмкость, а величина площади этих самих пластин определяют количество пускового тока.
Сепаратор. По стандарту он является неким конвертом, который состоит либо из полиэтилена, либо мипласта, либо же мипора. Его главной задачей является отделение реагентов, которые взаимодействуют друг с другом в электрохимических процессах, еще, помимо всего прочего, он даёт возможность совершения диффузии электролита от первого электрода ко второму.
Важно: амперы аккумулятора автомобиля определяют его возможность и количество отдаваемого тока в течение часа, усредненный показатель — это 50-65 Ампер/час.
Виды аккумуляторов
Теперь стоит обсудить какие аккумуляторы для автомобиля бывают:
Стандартный
Этот вид является самым старым среди всех аналогов, встретить где-либо его в настоящее время будет затруднительно. Он прославился своим параметром саморазрядки и возможностью потери электролитов, вследствие чего будет нуждаться в постоянном контроле, но плюсом выделяют возможность восстановления при полном разряде.
Он прославился своим параметром саморазрядки и возможностью потери электролитов, вследствие чего будет нуждаться в постоянном контроле, но плюсом выделяют возможность восстановления при полном разряде.
Кальциевые
Этот тип батарей является одним из самых знаменитых и использующихся на данный период времени. В отличие от первого представителя, у этого уровень саморазрядки очень низок, а потери электролитов сведены практически к нулю, что позволяет забыть об обслуживании данной батареи до самого конца ее эксплуатации, контроль также не требуется. Но этот тип нельзя разряжать до нуля.
Гибридные
Следуя из названия можно понять, что это объединение двух вышеперечисленных видов. Следовательно: этот аккумулятор обладает свойствами и стандартной, и кальциевой батареи, что позволяет ему пережить полный разряд, но это не позволяет иметь ему высокие характеристики.
EFB
Эта батарея является кислотной и имеет высокую степень устойчивости к саморазрядке и быструю зарядку. Главным минусом выступает дорогая цена на рынке.
Главным минусом выступает дорогая цена на рынке.
Определять, какие аккумуляторы лучше для автомобиля является личной задачей, так как это гибкое дело, какой-то тип подходит под определенную деятельность лучше другого.
Зарядка, способы, условия
Важно знать, как проверить аккумулятор автомобиля. Есть определенные параметры, по которым можно определить уровень заряда аккумулятора: 12.7 Ватт — 100%, 12.2 Ватт — 50%, 11.7 — 0%.
Теперь стоит обсудить, как заряжать аккумулятор автомобиля зарядным устройством. Если смотреть на зарядку батареи аккумулятора со стороны качества, то рекомендуется зарядить аккумулятор автомобиля с помощью зарядного устройства, так как им можно зарядить до 100% и настраивать определенные параметры. Но этот процесс достаточно трудоёмкий и щепетильный, поэтому многие предпочитают генераторы, ввиду автоматизации всего процесса. Вид зарядки батареи влияет на то, сколько заряжать аккумулятор автомобиля, примерное время — 9 часов.
Для зарядки стоит установить значения на устройстве в районе от 14. 3 до 14.6, затем подключить и ждать конца процесса.
3 до 14.6, затем подключить и ждать конца процесса.
Правильным решением будет заряжать батарею только в тёплом помещении или среде, так как на морозе электролит может частично замерзнуть, что по препятствует зарядке аккумулятора, а если электролит полностью замерзнет, то это приведет к ухудшению его ёмкости.
Если зима относительно тёплая, и температура не падает ниже -15 градусов, тогда можно просто отсоединить минусовую клемму от батареи, тем самым замедлив процесс ее саморазрядки. Если же температура уходит в сильный минус, тогда стоит разместить аккумулятор в помещении, желательно в тёмном уголку, без попадания прямых солнечных лучшей. Температура в этом месте не должна падать ниже минус 3-5 градусов, желательно выше. Влажность воздуха помещения должна быть на среднем уровне, ни в ком случае не на высоком, также рекомендуется регулярное проветривание.
Так же важно знать, как завести автомобиль, если сел аккумулятор. Выжимаем сцепление, переключившись на 3 передачу, когда вы наберете скорость примерно 15км/ч стоит медленно отпустить педаль.
Обслуживание
- Среди всех видов обслуживания аккумуляторных батарей выделяют несколько процедур:
- Проверка качества, состояния и уровня электролита батареи (как в вытянутом состоянии, так и в самом автомобиле)
- Осмотр внешней оболочки, выявление внешних повреждений
- Проверка напряжённости выводов аккумулятора автомобиля в отключённом от машины состоянии
- Проверка напряжения аккумулятора автомобиля при присоединённом и активированном состоянии
Аккумулятор автомобиля — важная часть во всём сложном механизме под названием «автомобиль». Без него не функционируют стандартные и необходимые для эксплуатации машины функции. И для того, чтобы продлить срок службы этой детали, соблюдайте требования, являющиеся обязательными к исполнению для нормальной жизнедеятельности.
Если вы запланировали обучение в автошколе, то данная статья вам будет полезна, так как основы устройства автомобиля необходимо знать каждому водителю.
Услуги Автошколы
Обучение вождению
Обучении теории и практики во всех районах Москвы
Курсы экстремального вождения
Практика вождения в экстремальных условиях
Обучение вождению автомобиляПолный курс категории Б: теория и практика
Обучение вождению мотоцикла
Полный курс категории А: теория и практика
Теория в автошколе
Полный курс теории по вождению категорий А и Б
Вождение для женщин
Обучение уверенному вождению для женщин
Что такое батарея? — SparkFun Узнать
Авторы: Шон Хаймел
Избранное Любимый 23
Введение
Батареи представляют собой набор из одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи. Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и электролита (вещество, которое химически реагирует с анодом и катодом).
Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция. Эта реакция заставляет электроны течь по цепи и возвращаться к катоду, где происходит другая химическая реакция. Когда материал в катоде или аноде расходуется или больше не может использоваться в реакции, батарея не может производить электричество. В этот момент ваша батарея «умерла».
Батарейки, которые необходимо выбрасывать после использования, известны как первичные батареи . Батареи, которые можно перезаряжать, называются вторичными батареями .
Литий-полимерные батареи, например, можно перезаряжать
Без батарей ваш квадрокоптер должен быть привязан к стене, вам придется вручную заводить машину, а ваш контроллер Xbox должен быть подключен ко всем времени (как в старые добрые времена). Батареи предлагают способ хранения электрической потенциальной энергии в портативном контейнере.
Батареи предлагают способ хранения электрической потенциальной энергии в портативном контейнере.
Батарейки бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительного происшествия, связанного с вскрытием лягушки.
Чему вы научитесь
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батареи
- Из каких частей состоит батарея
- Как работает батарея
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в цепях
Рекомендуемая литература
Есть несколько понятий, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
- Что такое электричество
- Напряжение, ток, сопротивление и закон Ома
- Что такое цепь
- Серийные и параллельные цепи
- Электроэнергия
- Переменный ток (AC) и постоянный ток (DC)
Хотите изучить различные аккумуляторы?
Мы вас прикроем!
Батарейка типа «таблетка» — 20 мм (CR2032)
В наличии ПРТ-00338
Избранное Любимый 32
Список желаний
Литий-ионный аккумулятор — 400 мАч
В наличии ПРТ-13851
10
Избранное Любимый 41
Список желаний
Литий-ионный аккумулятор — 18650 ячеек (2600 мАч)
В наличии ПРТ-12895
Избранное Любимый 20
Список желаний
Щелочная батарея 9В
В наличии ПРТ-10218
1
Избранное Любимый 6
Список желаний
Посмотреть все аккумуляторы
История
Термин «батарея»
Исторически слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в артиллерийской батарее. В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством. Позже этот термин будет использоваться для любых электрохимических элементов, соединенных вместе с целью обеспечения электроэнергии.
В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством. Позже этот термин будет использоваться для любых электрохимических элементов, соединенных вместе с целью обеспечения электроэнергии.
(Изображение предоставлено Alvinrune из Wikimedia Commons)
Изобретение батареи
В один судьбоносный день в 1780 году итальянский физик, врач, биолог и философ Луиджи Гальвани препарировал лягушку, прикрепленную к латунному крючку. Когда он коснулся лягушачьей лапки железным скальпелем, та дернулась. Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта предположил, что импульсы лапок лягушки на самом деле были вызваны различными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, смоченную в рассоле, вместо трупа лягушки, что привело к аналогичному напряжению.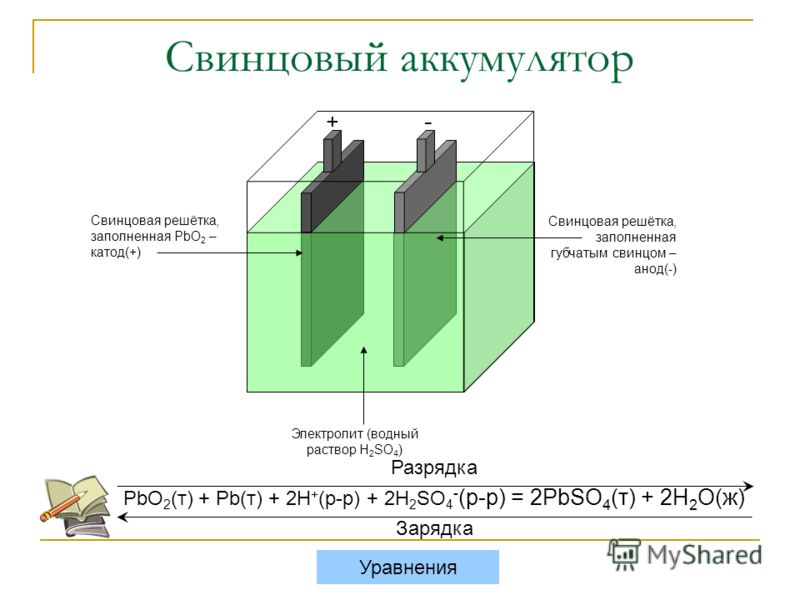 Вольта опубликовал свои выводы в 179 г.1, а затем в 1800 году создал первую батарею, вольтов столб.
Вольта опубликовал свои выводы в 179 г.1, а затем в 1800 году создал первую батарею, вольтов столб.
вольтов столб состоял из стопки цинковых и медных пластин, разделенных тканью, пропитанной рассолом
столб Вольта страдал от двух основных проблем: вес стека вызвало вытекание электролита из ткани, а особые химические свойства компонентов привели к очень короткому сроку службы (около часа). Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправление гальванической батареи
Уильям Круикшенк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».
Лотковая батарея решила проблему утечки гальванической батареи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и образованием пузырьков водорода на меди. В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвращает деградацию.
Британский химик Джон Фредерик Дэниелл использовал второй электролит, который реагировал с водородом, предотвращая отложения на медном катоде. Двухэлектролитная батарея Даниэля, известная как «ячейка Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция элементов Даниэля 1836 года
Первая перезаряжаемая батарея
В 1859 году французский физик Гастон Планте создал батарею из двух скрученных листов свинца, погруженных в серную кислоту. При реверсировании электрического тока через батарею химический состав вернется в исходное состояние, создав таким образом первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив свинцовые листы в пластины. Эта новая конструкция упростила производство аккумуляторов, и свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет. 1800-х годов электролит в батареях находился в жидком состоянии. Это делало транспортировку батарей очень осторожным делом, и большинство батарей никогда не предназначалось для перемещения после подключения к цепи.
1800-х годов электролит в батареях находился в жидком состоянии. Это делало транспортировку батарей очень осторожным делом, и большинство батарей никогда не предназначалось для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею, используя цинковый анод, катод из диоксида марганца и раствор хлорида аммония в качестве электролита. В то время как электролит в элементе Лекланше все еще был жидким, химический состав батареи оказался важным шагом на пути к изобретению сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса. Он запатентовал новую «сухую» батарею в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «цинково-угольными батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он выполняет важную роль электрического проводника в угольно-цинковой батарее.
-> 3-вольтовая угольно-цинковая батарея 1960-х годов
(Изображение предоставлено PhFabre из Wikimedia Commons) <-
известный как «Eveready», а затем «Energizer») заменил электролит хлорида аммония щелочным веществом на основе химии батареи, сформулированной Вальдемаром Юнгнером в 189 г. 9. Сухие щелочные батареи могут удерживать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
9. Сухие щелочные батареи могут удерживать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Популярность щелочных батарей возросла в 1960-х годах, они обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение предоставлено Aney~commonswiki из Викисклада) <-
Перезаряжаемые батареи 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи. Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлогидридной (NiMH) батареи. NiMH аккумуляторы были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой перезаряжаемым никель-водородным элементам.
Компания Asahi Chemical из Японии создала первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году. «литий-полимерный» или «LiPo» аккумулятор.
Химические реакции в литий-полимерном аккумуляторе в основном такие же, как и в литий-ионном аккумуляторе
Очевидно, что было изобретено, произведено и устарело намного больше химических элементов аккумуляторов. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Аккумуляторы состоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-нибудь кожух .
Хорошо, большинство батарей на самом деле не разделены на три равные секции, но вы поняли идею. Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.
Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.
Анод и катод относятся к типам электродов . Электроды — это проводники, по которым электричество входит или выходит из компонента в цепи.
Анод
Электроны вытекают из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод.
На батареях анод помечен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде. Эти электроны хотят двигаться к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут в катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На батареях катод отмечен как положительная (+) клемма
В батареях химическая реакция внутри или вокруг катода использует электроны, произведенные в аноде.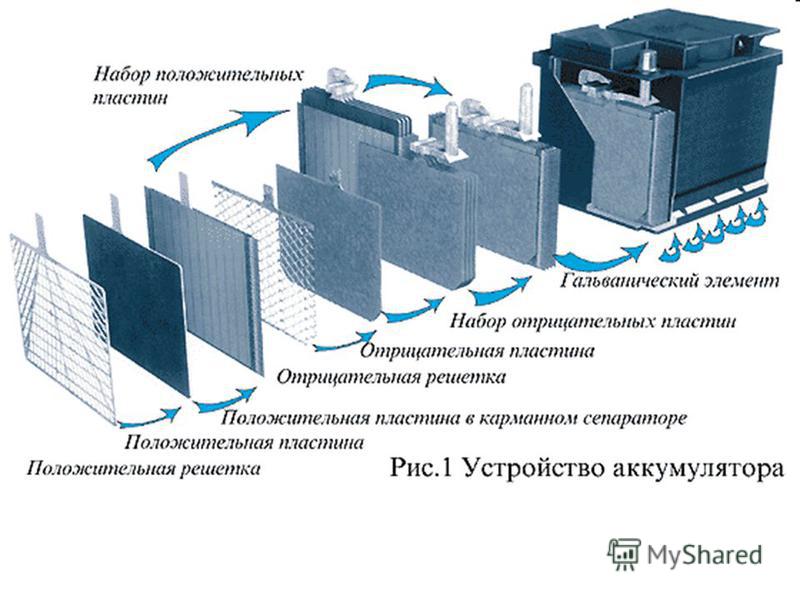 Единственный способ для электронов добраться до катода — через цепь, внешнюю по отношению к батарее.
Единственный способ для электронов добраться до катода — через цепь, внешнюю по отношению к батарее.
Электролит
Электролит – это вещество, часто жидкое или гелеобразное, способное переносить ионы между химическими реакциями, протекающими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, а не через электролит.
-> Щелочные батареи могут вытекать из электролита, гидроксида калия, при воздействии сильного нагрева или обратного напряжения
(Изображение предоставлено Вильямом Дэвисом из Wikimedia Commons) <-
Электролит играет решающую роль в работе аккумулятора. Поскольку электроны не могут пройти через него, они вынуждены путешествовать по электрическим проводникам в виде цепи, соединяющей анод с катодом.
Сепаратор
Сепараторы представляют собой пористые материалы, препятствующие соприкосновению анода и катода, которое могло бы вызвать короткое замыкание в батарее. Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы химически не реагируют ни с анодом, ни с катодом, ни с электролитом.
Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы химически не реагируют ни с анодом, ни с катодом, ни с электролитом.
В гальваническом столбе используется ткань или картон (сепаратор), пропитанные солевым раствором (электролитом), чтобы держать электроды друг от друга.
Ионы в электролите могут быть положительно заряжены, отрицательно заряжены и могут быть разных размеров. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Корпус
Большинству аккумуляторов требуется способ содержания их химических компонентов. Корпуса, также известные как «корпуса» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних частей батареи.
Этот свинцово-кислотный аккумулятор имеет пластиковый корпус
Корпуса аккумуляторов могут быть изготовлены практически из чего угодно: пластика, стали, пакетов из мягкого полимерного ламината и т. д. В некоторых батареях используется проводящий стальной корпус, электрически соединенный с одним из электродов. В случае обычного щелочного элемента АА стальной корпус соединен с катодом.
д. В некоторых батареях используется проводящий стальной корпус, электрически соединенный с одним из электродов. В случае обычного щелочного элемента АА стальной корпус соединен с катодом.
Эксплуатация
Для работы аккумуляторов обычно требуется несколько химических реакций. По крайней мере, одна реакция происходит на аноде или вокруг него, и одна или несколько реакций происходят на катоде или вокруг него. Во всех случаях реакция на аноде производит дополнительные электроны в процессе, называемом окисление , а реакция на катоде использует дополнительные электроны во время процесса, известного как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны обеспечивают химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию восстановления-окисления или окислительно-восстановительную реакцию, на две отдельные части. Окислительно-восстановительные реакции происходят, когда электроны переносятся между химическими веществами. Мы можем использовать движение электронов в этой реакции, чтобы течь за пределы батареи, чтобы питать нашу цепь.
Окислительно-восстановительные реакции происходят, когда электроны переносятся между химическими веществами. Мы можем использовать движение электронов в этой реакции, чтобы течь за пределы батареи, чтобы питать нашу цепь.
Окисление анода
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначены как e — ).
В некоторых реакциях окисления образуются ионы, например, в литий-ионном аккумуляторе. В других химических реакциях расходуются ионы, как в обычной щелочной батарее. В любом случае ионы могут свободно проходить через электролит, а электроны — нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит на катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются при восстановлении.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся в ходе реакции окисления, расходуются во время восстановления. В других случаях, например, в щелочных батареях, при восстановлении образуются отрицательно заряженные ионы.
В других случаях, например, в щелочных батареях, при восстановлении образуются отрицательно заряженные ионы.
Electron Flow
В большинстве батарей некоторые или все химические реакции могут происходить, даже если батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части реакции будут происходить в полную силу только тогда, когда между анодом и катодом замкнута электропроводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может протекать и тем быстрее происходят химические реакции.
Создание короткого замыкания в аккумуляторе (в данном случае даже случайного) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже дымят или загораются при наличии короткого замыкания.
Мы можем пропустить эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», чтобы сделать что-то полезное. На моушн-графике в начале этого раздела мы зажигаем виртуальную лампочку нашими движущимися электронами.
Разряженный аккумулятор
Химические вещества в аккумуляторе в конце концов достигнут состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате батарея больше не будет генерировать электрический ток. В этот момент аккумулятор считается «разряженным».
Первичные элементы должны быть утилизированы, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем подачи обратного электрического тока через батарею. Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, когда говорят о напряжении батареи, емкости, возможности источника тока и так далее.
Ячейка
Ячейка относится к одному аноду и катоду, разделенным электролитом, используемым для получения напряжения и тока. Аккумулятор может состоять из одной или нескольких ячеек. Например, одна батарея типа АА представляет собой одну ячейку. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В каждая.
Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В каждая.
Обычная 9-вольтовая батарея состоит из шести щелочных элементов 1,5 В, установленных друг над другом
Первичные
Первичные клетки содержат химию, которую нельзя обратить. В результате батарея должна быть выброшена после того, как она мертва.
Вторичные
Вторичные элементы можно перезарядить, и их химический состав вернется в исходное состояние. Эти элементы, также известные как «перезаряжаемые батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение батареи — это напряжение, указанное производителем.
Например, щелочные батареи AA указаны как имеющие напряжение 1,5 В. В этой статье от Mad Scientist Hut показано, что их протестированные щелочные батареи начинаются с напряжения около 1,55 В, а затем постепенно теряют напряжение по мере разрядки. В этом примере номинальное напряжение «1,5 В» относится к максимальному или начальному напряжению батареи.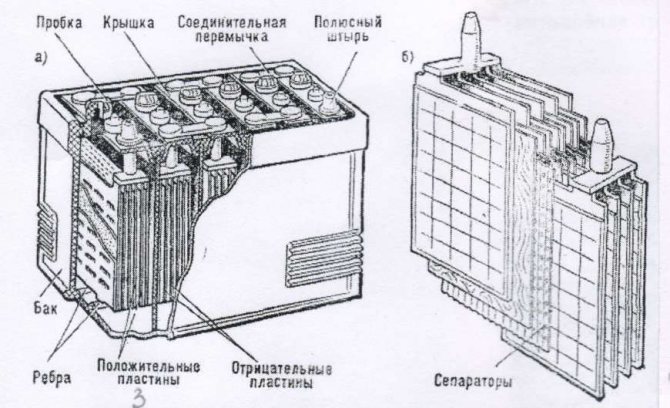
Этот аккумуляторный блок Storm для квадрокоптеров показывает кривую разрядки их LiPo элементов, начиная с 4,2 В и падая примерно до 2,8 В по мере разрядки. Номинальное напряжение, указанное для большинства литий-ионных и LiPo элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению батареи в течение цикла ее разрядки.
Емкость
Емкость батареи — это мера количества электрического заряда, который она может отдать при определенном напряжении. Большинство аккумуляторов рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот аккумулятор LiPo рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батареи показывают напряжение батареи в зависимости от емкости, например, эти тесты батареи AA от PowerStream. Чтобы выяснить, имеет ли батарея достаточную емкость для питания вашей схемы, найдите минимальное допустимое напряжение и найдите соответствующее значение в мАч или Ач.
C-Rate
Многие аккумуляторы, особенно мощные литий-ионные батареи, обозначают ток разряда как C-Rate, чтобы более четко определить атрибуты батареи. C-Rate — это скорость разряда относительно максимальной емкости аккумулятора.
1C — это величина тока, необходимая для разрядки аккумулятора за 1 час. Например, батарея емкостью 400 мАч, обеспечивающая ток 1С, будет обеспечивать 400 мА. 5C для той же батареи будет 2 A.
Большинство батарей теряют емкость при более высоком потреблении тока. Например, этот информационный график продукта от Chargery показывает, что их аккумулятор LiPo имеет меньшую емкость мАч при более высоких показателях C-Rate.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать аккумуляторы LiPo при температуре 1С или меньше.
Массачусетский технологический институт разработал фантастическое руководство по спецификациям аккумуляторов и терминологии, которое идет гораздо дальше этого обзора.
Использование
Одноэлементный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Этот фотонный аккумулятор питается от одного элемента LiPo
Если напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
9Серия 0032Чтобы увеличить напряжение между клеммами батареи, вы можете расположить элементы последовательно. Серия означает укладку элементов встык, соединяя анод одного с катодом следующего.
Соединяя аккумуляторы последовательно, вы увеличиваете общее напряжение. Добавьте напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере последовательно соединены четыре элемента по 1,5 В. Напряжение на нагрузке составляет 6 В, а общий комплект аккумуляторов имеет емкость 2000 мАч.
В большинстве устройств бытовой электроники, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель для двух батарей типа АА может повысить номинальное напряжение до 3 В для проекта.
ПРИМЕЧАНИЕ: Если вы заряжаете литий-ионные или LiPo аккумуляторы последовательно, вам необходимо обязательно использовать специальную схему, известную как «балансир», чтобы обеспечить постоянное напряжение между элементами. Некоторые зарядные устройства, такие как это, имеют балансиры для безопасной зарядки.
Параллельный
Если напряжения одного элемента достаточно для нагрузки, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном соединении батарей! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. Если есть какие-либо перепады напряжения, может произойти короткое замыкание, что приведет к перегреву и возгоранию.
В этом примере четыре элемента по 1,5 В соединены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.
Серийные и параллельные батареи
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать последовательные и параллельные батареи. Еще раз убедитесь, что уровень напряжения для батарей, включенных параллельно, одинаков, так как может произойти короткое замыкание.
В этом примере общее напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием букв «S» и «P» для последовательного и параллельного подключения. Конфигурация схемы выше — 2S2P. В качестве практического примера современные электромобили используют массивные батареи, соединенные последовательно и параллельно.
Ресурсы и дальнейшее развитие
К этому моменту вы уже должны понимать, как были изобретены батареи и как они работают. Батареи — это один из способов обеспечения электроэнергией вашего проекта, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Если вы хотите узнать больше об аккумуляторах, вот еще несколько руководств:
- Battery Technologies
- Как включить проект
- Что такое цепь?
Хотите увидеть батареи в действии? Взгляните на эти проекты, в которых используются разные батареи в разных конфигурациях:
Беспроводная связь Саймона Сплозиона
Это туториал, демонстрирующий одну из многих техник «взлома» Саймона Говорит. Мы расскажем, как взять ваш Simon Says Wireless.
Избранное Любимый 3
Базовая дифференциальная платформа Actobotics
Начните работу с Actobotics с помощью этого простого транспортного средства. Затем расширьте и настройте его для своей собственной империи злых роботов.
Избранное Любимый 7
Всплывающая плата со светодиодной бабочкой
Создайте светящуюся всплывающую карту бабочки с медной лентой, двумя светодиодами и батареей.
Избранное Любимый 8
Дистанционный фотонный датчик температуры
Узнайте, как построить собственную станцию для измерения температуры на солнечных батареях с подключением к Интернету, используя Photon from Particle.
Избранное Любимый 11
ESP8266 Пылесос на пропане
Узнайте, как Ник Пул построил огневую пушку, управляемую через WiFi, с помощью платы ESP8266 Thing Dev!
Избранное Любимый 4
Сигнализация стиральной/сушильной машины Blynk Board
Как настроить Blynk Board и приложение, чтобы уведомлять вас, когда ваша стиральная машина или сушилка перестали трястись.
Избранное Любимый 9
Из чего сделаны литиевые батареи и каковы их плюсы и минусы?
15 мая 2019 г.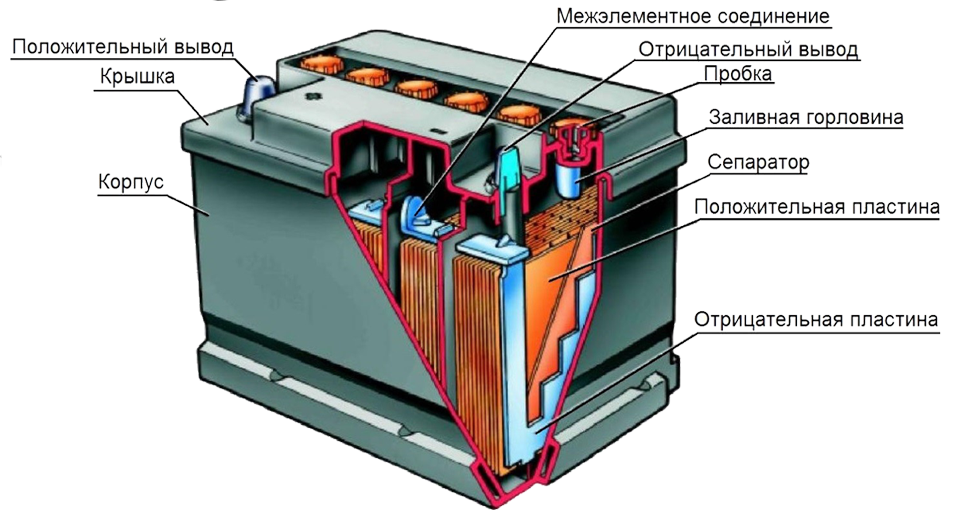 обновлено 06 фев 2020 г. 13:07
обновлено 06 фев 2020 г. 13:07
Что такое ионно-литиевые аккумуляторы, из чего они сделаны и каковы их преимущества по сравнению с другими технологиями хранения аккумуляторов?
По Джек Анвин
Литиевые аккумуляторы — из чего они сделаны и каковы их плюсы и минусы?Впервые предложенные в 1970-х годах и произведенные Sony в 1991 году, литиевые батареи теперь используются в мобильных телефонах, самолетах и автомобилях. Несмотря на ряд преимуществ, которые привели их к все большему успеху в энергетике, ионно-литиевые батареи имеют некоторые недостатки и являются темой, вызывающей много дискуссий.
Но что такое литиевые батареи и как они работают?
Из чего сделаны литиевые батареи?
Литиевая батарея состоит из четырех основных компонентов. Он имеет катод, который определяет емкость и напряжение батареи и является источником ионов лития. Анод позволяет электрическому току течь через внешнюю цепь, и когда батарея заряжена, ионы лития накапливаются в аноде.
Электролит состоит из солей, растворителей и добавок и служит проводником ионов лития между катодом и анодом. Наконец, есть сепаратор, физический барьер, разделяющий катод и анод.
Плюсы и минусы литиевых батарей
Литиевые батареи имеют гораздо более высокую плотность энергии, чем другие батареи. Они могут иметь до 150 ватт-часов (Втч) энергии на килограмм (кг), по сравнению с никель-металлгидридными батареями на 60-70Втч/кг и свинцово-кислотными на 25Втч/кг.
Они также имеют более низкую скорость разряда, чем другие, теряя около 5% своего заряда в месяц по сравнению с никель-кадмиевыми (NiMH) батареями, которые теряют 20% заряда в месяц.
Однако литиевые батареи также содержат легковоспламеняющийся электролит, который может вызвать небольшой пожар. Именно это стало причиной печально известных возгораний смартфонов Samsung Note 7, которые вынудили Samsung отказаться от производства и потерять 26 миллиардов долларов рыночной стоимости.

