Что такое оптическая микроскопия. Какие существуют основные методы световой микроскопии. Как устроен и работает оптический микроскоп. Где применяется оптическая микроскопия в науке и технике.
Что такое оптическая микроскопия
Оптическая микроскопия — это метод исследования микрообъектов с помощью оптических (световых) микроскопов. Данный метод позволяет изучать структуру образцов, невидимых невооруженным глазом, с увеличением до 2000-3000 раз.
Основные характеристики оптической микроскопии:
- Использование видимого света для освещения образца
- Применение системы оптических линз для увеличения изображения
- Максимальное разрешение около 200-400 нм
- Возможность исследования живых объектов
- Относительная простота и доступность оборудования
Оптическая микроскопия является одним из наиболее распространенных методов микроскопического анализа благодаря своей универсальности и простоте использования. Она находит широкое применение в биологии, медицине, материаловедении и других областях науки и техники.

Основные методы оптической микроскопии
Существует несколько основных методов оптической микроскопии, которые различаются способом формирования контраста изображения:
Метод светлого поля
Это классический метод, при котором объект освещается проходящим светом. Контраст формируется за счет поглощения света образцом. Неокрашенные прозрачные объекты дают слабый контраст.
Метод темного поля
При этом методе прямой свет не попадает в объектив, а образец освещается под большим углом. Контраст создается за счет рассеяния света образцом. Позволяет наблюдать мелкие детали структуры.
Фазово-контрастная микроскопия
Метод основан на преобразовании фазовых изменений света, проходящего через прозрачный объект, в амплитудные изменения. Позволяет получать контрастное изображение неокрашенных прозрачных объектов.
Поляризационная микроскопия
Использует поляризованный свет для исследования оптически анизотропных образцов. Применяется для изучения кристаллических и волокнистых структур.
Флуоресцентная микроскопия
Основана на регистрации флуоресцентного излучения образца после возбуждения светом определенной длины волны. Позволяет наблюдать специфически окрашенные структуры.

Каждый из этих методов имеет свои преимущества и ограничения. Выбор конкретного метода зависит от типа исследуемого образца и задач исследования.
Принцип работы оптического микроскопа
Оптический микроскоп увеличивает изображение объекта за счет системы линз. Основные компоненты микроскопа:
- Осветительная система
- Предметный столик для размещения образца
- Объектив — система линз, создающая увеличенное изображение
- Окуляр — система линз для наблюдения изображения
- Тубус — корпус, соединяющий объектив и окуляр
Принцип работы микроскопа можно описать следующим образом:
- Свет от источника освещения проходит через образец
- Объектив создает увеличенное действительное изображение объекта
- Окуляр еще раз увеличивает это изображение, формируя мнимое изображение
- Наблюдатель видит увеличенное мнимое изображение объекта
Общее увеличение микроскопа равно произведению увеличения объектива на увеличение окуляра. Современные микроскопы могут давать увеличение до 2000-3000 раз.
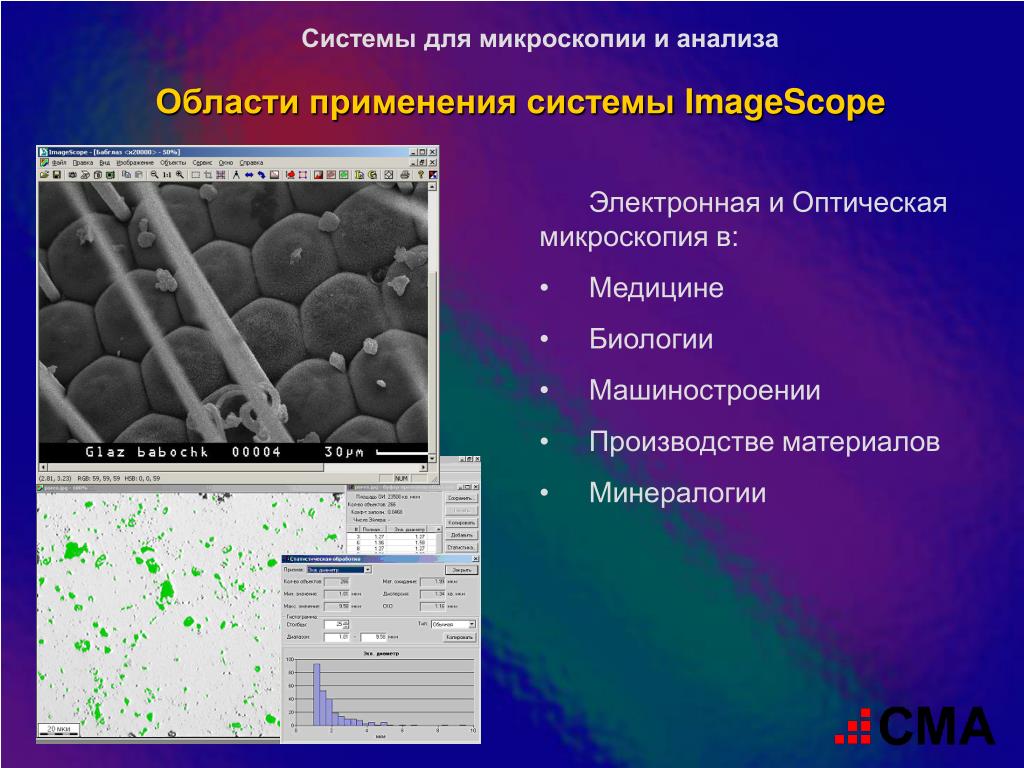
Области применения оптической микроскопии
Оптическая микроскопия находит широкое применение в различных областях науки и техники:

Биология и медицина
Изучение клеточных структур, микроорганизмов, тканей. Диагностика заболеваний, анализ крови и других биологических жидкостей.
Материаловедение
Исследование микроструктуры металлов, сплавов, керамики, полимеров. Анализ дефектов и включений в материалах.
Геология
Изучение минералов, горных пород, ископаемых остатков организмов.
Криминалистика
Анализ улик, волокон, частиц краски и других микроскопических объектов.
Электроника
Контроль качества микросхем и печатных плат, анализ дефектов.
Пищевая промышленность
Контроль качества продуктов питания, выявление загрязнений и примесей.
Таким образом, оптическая микроскопия является универсальным методом исследования микрообъектов, который находит применение в самых разных сферах.
Преимущества и ограничения оптической микроскопии
Основные преимущества оптической микроскопии:
- Относительная простота и доступность оборудования
- Возможность исследования живых объектов
- Получение цветных изображений
- Широкий выбор методов контрастирования
- Возможность наблюдения динамических процессов
Ограничения метода:
- Предел разрешения около 200 нм из-за дифракции света
- Невозможность наблюдения объектов меньше длины волны света
- Ограниченная глубина резкости
- Необходимость тонкой пробоподготовки для некоторых образцов
Несмотря на ограничения, оптическая микроскопия остается одним из важнейших методов исследования микромира благодаря своей универсальности и доступности. Развитие новых методов, таких как конфокальная и сверхразрешающая микроскопия, позволяет преодолевать классические ограничения световой микроскопии.
|
Главная » Статьи и полезные материалы » Микроскопы » Статьи о микроскопах, микропрепаратах и исследованиях микромира » Оптическая микроскопия (световая) Под оптической микроскопией (световой) понимается многообразие методов изучения микрообъектов при помощи оптических микроскопов разных конструкций. Кроме нее существует еще и электронная микроскопия, но в рамках этой статьи мы ее рассматривать не будем. Оптический микроскоп позволяет наблюдать объекты на увеличении до 2000–3000 крат, причем размер этих объектов не может быть меньше 200–400 нм (1 нм = 10−9 м = 10−6 мм). Эти ограничения накладывают физические законы – преодолеть эти границы можно лишь с применением неоптических (электронных) систем. Методы оптической микроскопии Метод микроскопии, который исследователь выбирает для изучения образца, зависит и от структуры самого образца, и от условий наблюдений, и от задач, которые решает наблюдатель. Сканирующая оптическая микроскопияЗдесь же мы осветим менее распространенный метод, который был разработан ирландским физиком Эдвардом Сингом в 1928 году. К сожалению, этот вид микроскопии не был встречен с энтузиазмом учеными того времени. Первые опыты с его использованием провели лишь в 1972 году. Этот метод называется «ближнепольная оптическая микроскопия», часто можно встретить и дополнение «сканирующая». На сегодняшний день это один из широко используемых в профессиональных кругах способов наблюдения микромира. Для исследований применяются специальные микроскопы со сканирующими оптическими зондами. Зонд позволяет регистрировать электромагнитное поле с расстояния меньшего, чем длина световой волны. Все микроскопы, которые представлены в нашем интернет-магазине, вы можете найти по ссылке. Наши консультанты всегда готовы помочь советом – звоните или пишите, если затрудняетесь с выбором подходящего микроскопа или аксессуаров.
4glaza.ru Использование материала полностью для общедоступной публикации на носителях информации и любых форматов запрещено. Разрешено упоминание статьи с активной ссылкой на сайт www.4glaza.ru. Производитель оставляет за собой право вносить любые изменения в стоимость, модельный ряд и технические характеристики или прекращать производство изделия без предварительного уведомления.
Другие обзоры и статьи о микроскопах, микропрепаратах и микромире:
|
Электронный микроскоп в гараже / Хабр
Позвонил мне как-то друг и говорит: нашёл интересную штуку, нужно привезти к тебе, весит полтонны.
 Так у меня появилась колонна от сканирующего электронного микроскопа JEOL JSM-50A. Её давно списали из какого-то НИИ и вывезли в металлолом. Электронику потеряли, а вот электронно-оптическую колонну вместе с вакуумной частью удалось спасти.
Так у меня появилась колонна от сканирующего электронного микроскопа JEOL JSM-50A. Её давно списали из какого-то НИИ и вывезли в металлолом. Электронику потеряли, а вот электронно-оптическую колонну вместе с вакуумной частью удалось спасти.До этого момента я не имел дела с подобным научным оборудованием, не говоря уже о том, чтобы уметь им пользоваться и представлять, как оно работает. Чтобы восстановить этот микроскоп хотя бы до состояния «рисуем электронным лучом на люминесцентном экране» потребуется:
- Понять основы работы электронных микроскопов
- Разобраться в том, что такое вакуум, какой он бывает
- Как измеряют вакуум, как его получают
- Как работают высоковакуумные насосы
- Минимально разобраться в химии (какие растворители использовать для очистки вакуумной камеры, какое масло использовать для смазки вакуумных деталей)
- Освоить металлообработку (токарные и фрезерные работы) для изготовления всевозможных переходников и инструментов
- Разобраться с микроконтроллерами, схемотехникой их подключения
Имея на вооружении научный метод я попробую освоить совершенно новые области, которыми никогда не занимался ранее.
 Приглашаю сделать это вместе со мной.
Приглашаю сделать это вместе со мной.Восстановление микроскопа после как минимум десятка лет — под катом.
DISCLAIMER: Помните, безопасность превыше всего! Я не несу никакой ответственности за то, что вы случайно нанесёте вред своему здоровью или создадите чёрную дыру, используя знания из этой статьи
Интересно не просто запустить старую железяку в рабочее состояние, но и проверить, возможно ли используя научный метод освоить совершенно новые области.
Поэтому прежде, чем что-то делать, всегда полезно понять, как оно работает.
Принципы работы электронных микроскопов
Есть два типа электронных микроскопов:
Просвечивающий электронный микроскоп
ПЭМ очень похож на обычный оптический, только исследуемый образец облучается не светом (фотонами), как в оптическом микроскопе, а электронами.
Длина волны электронного луча намного меньше, чем фотонного, поэтому можно получить существенно большее разрешение.
Фокусировка и управление электронным лучом осуществляется с помощью электромагнитных или электростатических линз. Им даже присущи те же искажения (хроматические аберрации), что и оптическим линзам, хотя природа физического взаимодействия совершенно иная. Она, кстати, добавляет ещё и новых искажений (закручивание электронов в линзе вдоль оси электронного пучка, чего не происходит с фотонами в оптическом микроскопе).
Им даже присущи те же искажения (хроматические аберрации), что и оптическим линзам, хотя природа физического взаимодействия совершенно иная. Она, кстати, добавляет ещё и новых искажений (закручивание электронов в линзе вдоль оси электронного пучка, чего не происходит с фотонами в оптическом микроскопе).
У ПЭМ есть недостатки: исследуемые образцы должны быть очень тонкие, тоньше 1 микрона, что не всегда удобно в домашних условиях. Например, чтобы посмотреть свой волос на просвет, его нужно разрезать вдоль хотя бы на 50 слоёв. Это связано с тем, что проникающая способность электронного луча гораздо хуже фотонного. К тому же, ПЭМ за редким исключением достаточно громоздки. Вот этот аппарат, изображённый ниже, вроде бы и не такой большой (хотя выше человеческого роста, и имеет цельную чугунную станину), но к нему идёт ещё блок питания размером с большой шкаф, итого занимая целую комнату.
Но разрешение ПЭМ — наивысшее. С помощью него (если сильно постараться) можно увидеть отдельные атомы вещества.
 (Фото отсюда).
(Фото отсюда).Особо полезно такое разрешение для идентификации возбудителя вирусного заболевания. Вся вирусная аналитика 20 века была построена на базе ПЭМ, и только с появлением более дешёвых методов диагностики популярных вирусов (напр. ПЦР), рутинное использование ПЭМов для этой цели уже не встречается.
Например, вот как выглядит грипп h2N1 «на просвет»: (фото отсюда)
Сканирующий электронный микроскоп
SEM применяется в основном для исследования поверхности образцов с очень высоким разрешением (увеличение в миллион крат, против 2 тысяч у оптических). А это уже гораздо полезнее в хозяйстве 🙂
К примеру, кто-то смотрит на новую зубную щётку:
В сканирующем микроскопе узко сфокусированный электронный луч «сканирует» поверхность образца точка-за-точкой, а всевозможные датчики улавливают то, что вылетает из образца после ударов электронами.
Вылетать могут:
— электроны с различными энергиями
— оптическое излучение видимого, инфракрасного, ультрафиолеотового диапазонов
— рентгеновское излучение
— неведомая хрень
Принцип работы сканирующего электронного микроскопа немного похож на работу электронно-лучевой трубки телевизора (в которой есть и глубокий вакуум, и электронная пушка, и система фокусирующих и отклоняющих линз). Вот, кстати, как он работает при съёмке 1000 кадр/с:
То же самое должно происходить и в электронно-оптической колонне микроскопа, только облучается образец, а не люминофор экрана, и изображение формируется на основе информации с датчиков (вторичных электронов, упруго-отражённых электронов, и прочих).
И кинескоп телевизора, и электронно-оптическая колонна микроскопа работают только под вакуумом.
Вдохновившись картинками, приступаем к работе.
Электронно-оптическая колонна
Электронно-оптическая колонна микроскопа — это вакуумная камера, в которой расположены:
- электронная пушка, испускающая электронный луч
- система электромагнитных линз, фокусирующих, сдвигающих, раскручивающих и перемещающих луч
- держатель для образца, с возможностью его перемещения и наклона по разным осям
- детекторы излучения различной природы — электронов, рентгеновского, светового диапазонов
- порты для подключения дополнительных устройств
- система управления вакуумом
Электронная пушка (со снятым цилиндром Венельта):
Управляемый предметный столик (расположен внутри колонны, доступ к нему через специальный шлюз, снаружи его расположение можно узнать по обилию ручек для перемещения и наклона)
I.
 Разборка, очистка, покраска
Разборка, очистка, покраска Самое первое, что захотелось сделать — это всё основательно отмыть и покрасить поржавевшие детали. Защитные кожухи сверху и сбоку были сняты, под ними оказалось ещё больше пыли, а сталь успела местами соржаветь от действия влаги и воздуха. Хорошо, что сама колонна сделана из нержавейки и так легко не окисляется.
Вакуумная часть (под колонной) в процессе разборки выглядела как-то так:
Снимаем снизу всю вакуумную арматуру, остатки блока управления вакуумом, диффузионный насос, зачищаем и красим дно полуматовой чёрной краской, чтобы было красиво. Сверху снимаем защитные кожухи, видим тридцатилетнюю пыль, всё моем, шкурим и красим. Вот было/стало для сравнения:
Разобравшись с железяками я разблокировал антивибрационную пружинную подвеску колонны и попробовал вывесить колонну в рабочее положение (двухсантиметровый стальной лист и несколько утяжелителей обеспечивают солидность покачивания).
Все части проекта:
А также смотрите видео на моём канале.
Жду ваших комментариев и вопросов, до встречи в следующих сериях!
Nikon N-SIM | Микроскоп для наноскопии сверхвысокого разрешения
Система N-SIM существенно повышает возможность решения задач в области наноскопии и придает уверенность в правильности выводов, которые можно сделать на основе полученных данных.
Новый микроскоп сверхвысокого разрешения Nikon N-SIM дает возможность исследовать структуру и функции живых клеток на наноуровне.
Разрешение традиционных оптических микроскопов, даже оснащенных объективами с высокой числовой апертурой, ограничено дифракцией и составляет не более 200 нм.
Используя высокочастотное структурированное освещение, микроскоп Nikon N-SIM может обеспечить разрешение до 85 нм (при возбуждении лазером 488 нм, в режиме TIRF-SIM), что ранее считалось невозможным для оптических микроскопов. Кроме того, при временной разрешающей способности до 0,6 сек/кадр (в режиме 2D-SIM/TIRF-SIM), микроскоп N-SIM обеспечивает съемку со сверхвысоким разрешением динамических процессов молекулярного взаимодействия в живых клетках.
Кроме того, при временной разрешающей способности до 0,6 сек/кадр (в режиме 2D-SIM/TIRF-SIM), микроскоп N-SIM обеспечивает съемку со сверхвысоким разрешением динамических процессов молекулярного взаимодействия в живых клетках.
Микроскоп N-SIM (режим 3D-SIM)
Микротрубочки в клетке меланомы B16, меченные YFP
Объектив: CFI Apo TIRF 100x oil (NA 1,49). Скорость захвата изображения: около 1,8 сек/кадр
В микроскопии структурированного освещения неизвестная клеточная наноструктура изучается путем анализа муарового рисунка, появляющегося при освещении образца высокочастотным структурированным излучением.
Сочетая технологию структурированного освещения с использованием высокоапертурного объектива Nikon CFI Apo TIRF 100x oil (числовая апертура 1,49), микроскоп N-SIM обеспечивает пространственное разрешение почти в два раза превышающее разрешение обычных оптических микроскопов (до приблизительно 85 нм при возбуждении лазером 488 нм, в режиме TIRF-SIM) и позволяет получить наглядное представление о мельчайших межклеточных структурах и их взаимодействии.
Микроскоп N-SIM также обеспечивает сверхбыстрое получение изображений. Временное разрешение составляет до 0,6 сек/кадр, что позволяет получать изображения живых клеток (в режиме TIRF-SIM/2D-SIM; получение изображений с временным разрешением до приблизительно 1 сек/кадр возможно в режиме 3D-SIM).
Традиционный световой микроскопМикроскоп N-SIM (режим 3D-SIM)
Эндоплазматический ретикулум (ЭР) в живой клетке HeLa, меченной GFP
Объектив: CFI Apo TIRF 100x oil (NA 1,49). Скорость захвата изображения: около 1,5 сек/кадр
Этот режим обеспечивает получение двумерных изображений сверхвысокого разрешения на высокой скорости и с невероятно высокой контрастностью. Режим TIRF-SIM использует преимущества наблюдения при флуоресценции полного внутреннего отражения с разрешением, в два раза превышающим разрешение обычных микроскопов TIRF, что позволяет лучше понять взаимодействие молекул на поверхности клетки.
Наблюдение с использованием микроскопа N-SIM при сверхвысоким аксиальном разрешении обеспечивает получение оптического среза образцов при разрешении 300 нм в клетках и тканях толщиной до 20 ?м. Кроме того, в режиме 3D SIM устраняется фоновая флуоресценция, что позволяет получить высококонтрастное изображение.
Возможна комбинация с системой N-STORM на одном инвертированном микроскопе Ti.
Возможность установки до 5 различных лазеровМодуль Nikon LU-5 — это система, предусматривающая установку до 5 различных лазеров, обеспечивающая естественное многоцветное изображение со сверхвысоким разрешением. Реальная цветопередача является существенной при исследовании динамического взаимодействия различных белков на молекулярном уровне.
Доступны лазерные модули LU-NV.
Обычный TIRFРежим TIRF-SIM
Цитоплазматическая мембрана клетки меланомы В16, меченая желтым флуоресцентным белком
Объектив: CFI Apo TIRF 100x oil (NА 1,49)
Аналитическая обработка записанных муаровых изображений с помощью математических методов позволяет восстановить структуру образца со сверхвысоким разрешением.
Использование лазерной интерференции высоких пространственных частот для освещения структуры внутри образца дает муаровые интерференционные полосы, которые фиксируются. Эти муаровые интерференционные полосы включают модулированную информацию о структуре образца с более высоким разрешением.
В процессе обработки изображения эта информация восстанавливается, что позволяет достичь разрешения, превышающего разрешение обычных оптических микроскопов.
Облучение светом полосатой структуры с известной пространственной частотой позволяет получать информацию от таких мельчайших структур, как муаровые интерференционные полосы.Муаровые изображения содержат информацию о мельчайших структурах внутри образца. Фиксируются многочисленные фазы и ориентации структурированного освещения, а информация «сверхвысокого разрешения» извлекается из муаровых интерференционных полос. Эта информация комбинируется математически в «Фурье-пространстве» или апертурном пространстве, затем трансформируется обратно в пространство изображения, что позволяет получить изображение с разрешением, в два раза превышающим обычный предел.
Извлечение информации о структуре образца осуществляется путем анализа изображений в трех ориентациях, что позволяет в результате математической обработки создать изображения сверхвысокого разрешения.
Захват информации высокого разрешения, высокой пространственной частоты ограничен числовой апертурой (NА) объективов, и пространственные частоты структуры за пределами апертуры оптической системы не фиксируются.
Освещение образца высокочастотным структурированным излучением позволяет получить изображение со сверхвысоким разрешением в пределах апертуры оптической системы.
Когда эта информация о «сверхвысоком разрешении» математически комбинируется со стандартной информацией, полученной посредством линз объектива, результатом становится удвоение значения NA и, соответственно, разрешения оптической системы.
Сравнение изображений: микроскоп в режиме TIRF-SIM и традиционный оптический микроскопНа рисунках показаны изображения флуоресцирующих точек диаметром 100 нм, зафиксированные обычным микроскопом и микроскопом сверхвысокого разрешения N-SIM. Профили интенсивности точечных изображений указывают, что разрешающая сила микроскопа сверхвысокого разрешения почти в два раза превышает разрешающую силу обычного флуоресцентного микроскопа.
Профили интенсивности точечных изображений указывают, что разрешающая сила микроскопа сверхвысокого разрешения почти в два раза превышает разрешающую силу обычного флуоресцентного микроскопа.
TIRF-SIM
за что дали Нобелевскую премию по химии :: Технологии и медиа :: РБК
Нобелевская премия по химии присуждена немцу Штефану Хеллю и американцам Эрику Бетцигу и Уильяму Мернеру, которые обошли ограничения световых микроскопов, десятилетиями казавшиеся непреодолимыми. Созданные ими методы позволяют ученым наблюдать за внутриклеточными процессами с точностью до нанометров.
Штефан Хелль позирует рядом с микроскопом (Фото: REUTERS 2014)
Нобелевские лауреаты совершили прорыв в технологии микроскопических исследований, перешагнув границы традиционной оптической микроскопии. Еще в 1873 году немецкий физик Эрнст Аббе сформулировал естественный предел разрешающей способности микроскопа, обусловленный волновой природой света. Этот предел равен примерно половине длины световой волны, или 0,2 микрометра (200 нанометров). На протяжении большей части XX века ученые были уверены, что никогда не смогут наблюдать через оптический микроскоп объекты меньше 0,2 мкм, например, отдельные молекулы в составе клетки. Правда, в 1930-х годах были разработаны электронные микроскопы, разрешение которых в тысячи раз больше, чем у традиционного светового микроскопа. Но для микробиологов они были мало пригодны: высокоэнергетический электронный пучок убивает все живое.
Этот предел равен примерно половине длины световой волны, или 0,2 микрометра (200 нанометров). На протяжении большей части XX века ученые были уверены, что никогда не смогут наблюдать через оптический микроскоп объекты меньше 0,2 мкм, например, отдельные молекулы в составе клетки. Правда, в 1930-х годах были разработаны электронные микроскопы, разрешение которых в тысячи раз больше, чем у традиционного светового микроскопа. Но для микробиологов они были мало пригодны: высокоэнергетический электронный пучок убивает все живое.
Бетциг, Хелль и Мернер не поколебали формулу дифракционного предела, но придумали, как его обойти. В этом будущим лауреатам помогли флуоресцентные («светящиеся») молекулы, или флуорофоры. Немец Штефан Хелль, с 1990 года искавший способы преодолеть ограничение Аббе, разработал так называемый метод подавления индуцированного излучения (STED). В 1994 году он опубликовал статью с изложением сути метода: нужно сначала использовать возбуждающий лазерный импульс, активирующий свечение молекул, а затем — гасящий импульс кольцевой формы, способный «вырезать» флуоресцентную область размером меньше пресловутого дифракционного барьера (см. картинку). Но реализовать свои идеи на практике Хеллю удалось только через несколько лет. В 2000 году, уже работая в Институте биофизической химии Макса Планка в Геттингене, куда он перешел из Университета Турку, Хелль сумел получить изображения бактерии E.coli (кишечная палочка) в недостижимом прежде разрешении.
картинку). Но реализовать свои идеи на практике Хеллю удалось только через несколько лет. В 2000 году, уже работая в Институте биофизической химии Макса Планка в Геттингене, куда он перешел из Университета Турку, Хелль сумел получить изображения бактерии E.coli (кишечная палочка) в недостижимом прежде разрешении.
Остальные лауреаты — американцы Эрик Бетциг и Уильям Мернер — независимо друг от друга создавали другой метод современной микроскопии — одномолекулярную микроскопию. Мернер в 1989 году стал первым в мире ученым, которому удалось задетектировать единичную флуоресцентную молекулу. В это время он работал в исследовательском центре IBM в Сан-Хосе. Спустя восемь лет Мернер, перешедший в Калифорнийский университет в Сан-Диего, сделал еще один важный шаг на пути к Нобелевской премии. Он работал над так называемым зеленым флуоресцентным белком (GFP), открытие и изучение которого уже было удостоено Нобелевской премии в 2008 году (одним из трех лауреатов тогда стал коллега Мернера по университету Сан-Диего Роджер Тсин). Мернер обнаружил, что у одного из вариантов GFP свечение может «включаться» и «выключаться» по воле исследователя. Для этого нужно было воздействовать на белок электромагнитными волнами определенной длины. Ученый сумел рассеять эти молекулы таким образом, что расстояния между ними превышали 0,2 мкм, то есть обычный световой микроскоп мог их различить и «увидеть» благодаря флуоресценции.
Он работал над так называемым зеленым флуоресцентным белком (GFP), открытие и изучение которого уже было удостоено Нобелевской премии в 2008 году (одним из трех лауреатов тогда стал коллега Мернера по университету Сан-Диего Роджер Тсин). Мернер обнаружил, что у одного из вариантов GFP свечение может «включаться» и «выключаться» по воле исследователя. Для этого нужно было воздействовать на белок электромагнитными волнами определенной длины. Ученый сумел рассеять эти молекулы таким образом, что расстояния между ними превышали 0,2 мкм, то есть обычный световой микроскоп мог их различить и «увидеть» благодаря флуоресценции.
Бетциг, как и Хелль, был одержим идеей преодоления дифракционного барьера в оптической микроскопии. В начале 90-х он безуспешно экспериментировал с так называемой ближнепольной микроскопией в лабораториях Белла (Bell Labs) в Нью-Джерси. В 1995 году он опубликовал в журнале Optics Letter теоретические принципы, как можно было бы обойти дифракционный барьер за счет манипуляций с молекулами разных цветов под микроскопом и наложения соответствующих изображений друг на друга. Но затем Бетциг почти на десять лет выпал из научной жизни и вернулся к активным исследованиям только в 2000-х годах, когда наткнулся на работы по флуоресцентным белкам, свечением которых можно управлять (как в экспериментах Мернера). В 2006 году Бетциг вместе с группой коллег использовал рассеянные группы отдельных молекул, расстояние между которыми превышало предел Аббе (это позволяло их точно локализовать), и за счет совмещения большого количества снимков добился изображения мембраны лизосомы сверхвысокого разрешения. Соответствующая статья, зафиксировавшая этот результат, была опубликована в журнале Science в 2006 году.
Но затем Бетциг почти на десять лет выпал из научной жизни и вернулся к активным исследованиям только в 2000-х годах, когда наткнулся на работы по флуоресцентным белкам, свечением которых можно управлять (как в экспериментах Мернера). В 2006 году Бетциг вместе с группой коллег использовал рассеянные группы отдельных молекул, расстояние между которыми превышало предел Аббе (это позволяло их точно локализовать), и за счет совмещения большого количества снимков добился изображения мембраны лизосомы сверхвысокого разрешения. Соответствующая статья, зафиксировавшая этот результат, была опубликована в журнале Science в 2006 году.
Как рассмотреть нанообъект в оптический микроскоп
А. Ежов
«Квант» №2, 2010
Как известно, основную долю информации об окружающем мире человек получает с помощью зрения. Глаз человека — сложный и совершенный прибор. Этот созданный природой прибор работает со светом — электромагнитным излучением, диапазон длин волн которого находится между 400 и 760 нанометрами. Цвет, который при этом воспринимает человек, изменяется от фиолетового до красного.
Цвет, который при этом воспринимает человек, изменяется от фиолетового до красного.
Электромагнитные волны, соответствующие видимому свету, взаимодействуют с электронными оболочками атомов и молекул глаза. Результат этого взаимодействия зависит от того, в каком состоянии находятся электроны этих оболочек. Свет может поглощаться, отражаться или рассеиваться. Что именно произошло со светом, может многое рассказать об атомах и молекулах, с которыми он взаимодействовал. Диапазон размеров атомов и молекул от 0,1 до десятков нанометров. Это во много раз меньше, чем длина волны света. Тем не менее, объекты именно таких размеров — назовем их нанообъектами — очень важно увидеть. Что же надо для этого сделать? Обсудим сначала, что может рассмотреть человеческий глаз.
Обычно, когда говорят о разрешающей способности того или иного оптического прибора, оперируют двумя понятиями. Одно из них — угловое разрешение, а второе — линейное разрешение. Эти понятия взаимосвязаны. К примеру, для человеческого глаза угловое разрешение составляет приблизительно 1 угловую минуту. При этом глаз может различить два точечных объекта, удаленных от него на 25–30 см, только тогда, когда расстояние между этими объектами больше чем 0,075 мм. Это вполне сравнимо с разрешением обычного компьютерного сканера. В самом деле, разрешение 600 точек на дюйм означает, что сканер может различить точки, расположенные на расстоянии 0,042 мм друг от друга.
При этом глаз может различить два точечных объекта, удаленных от него на 25–30 см, только тогда, когда расстояние между этими объектами больше чем 0,075 мм. Это вполне сравнимо с разрешением обычного компьютерного сканера. В самом деле, разрешение 600 точек на дюйм означает, что сканер может различить точки, расположенные на расстоянии 0,042 мм друг от друга.
Для того чтобы можно было различать объекты, расположенные на еще меньших расстояниях друг от друга, был придуман оптический микроскоп — прибор, увеличивающий разрешающую способность глаза. Выглядят эти приборы по-разному (что видно из рисунка 1), но принцип действия у них один тот же. Оптический микроскоп позволил отодвинуть предел разрешения до долей микрона. Уже 100 лет назад оптическая микроскопия сделала возможным изучать объекты микронных размеров. Однако тогда же стало ясно, что простым увеличением количества линз и улучшением их качества добиться дальнейшего увеличения разрешающей способности невозможно. Разрешение оптического микроскопа оказалось ограничено свойствами самого света, а именно его волновой природой.
Еще в конце позапрошлого века было установлено, что разрешение оптического микроскопа составляет . В этой формуле λ — длина волны света, а nsin u — числовая апертура объектива микроскопа, которая характеризует как микроскоп, так и то вещество, которое находится между объектом изучения и самой близкой к нему линзой микроскопа. И действительно, в выражение для числовой апертуры входят показатель преломления n среды, находящейся между объектом и объективом, и угол u между оптической осью объектива и самыми крайними лучами, которые выходят из объекта и могут попасть в этот объектив. Показатель преломления вакуума равен единице. У воздуха этот показатель очень близок к единице, у воды он составляет 1,33303, а у специальных жидкостей, используемых в микроскопии для получения максимального разрешения, n доходит до 1,78. Каким бы ни был угол u, величина sin u не может быть больше единицы. Таким образом, разрешение оптического микроскопа не превышает долей длины волны света.
Обычно считается, что разрешение составляет половину длины волны.
Интенсивность, разрешение и увеличение объекта — разные вещи. Можно сделать так, что расстояние между центрами изображений объектов, которые расположены в 10 нм друг от друга, будет 1 мм. Это будет соответствовать увеличению в 100 000 раз. Тем не менее, различить, один это объект или два, не получится. Дело в том, что изображения объектов, размеры которых очень малы по сравнению с длиной волны света, будут иметь одинаковые форму и размеры, не зависящие от формы самих объектов. Такие объекты называют точечными — их размерами можно пренебречь. Если такой точечный объект светится, то оптический микроскоп изобразит его в виде светлого кружка, окруженного светлыми и темными кольцами. Будем далее, для простоты, рассматривать именно источники света. Типичное изображение точечного источника света, полученное с помощью оптического микроскопа, показано на рисунке 2. Интенсивность светлых колец намного меньше, чем у кружочка, и убывает по мере удаления от центра изображения. Чаще всего видно только первое светлое кольцо. Диаметр первого темного кольца равен . Функция, которая описывает такое распределение интенсивности, называется функцией рассеяния точки. Эта функция не зависит от того, каково увеличение. Изображение нескольких точечных объектов будет представлять собой именно круги и кольца, как это видно из рисунка 3. Полученное изображение можно увеличивать, однако если изображения двух соседних точечных объектов сливаются, то они будут сливаться и дальше. Такое увеличение часто называют бесполезным — большие изображения просто будут более размытыми. Пример бесполезного увеличения показан на рисунке 4. Формула часто называется дифракционным пределом, и она настолько знаменита, что именно ее высекли на памятнике автору этой формулы — немецкому физику-оптику Эрнсту Аббе.
Конечно, со временем оптические микроскопы стали снабжать разнообразными устройствами, позволяющими запоминать изображения. Человеческий глаз дополнили сначала пленочные фото- и кинокамеры, а потом — камеры, в основе которых лежат цифровые устройства, преобразующие попадающий на них свет в электрические сигналы. Самыми распространенными из таких устройств являются ПЗС-матрицы (ПЗС расшифровывается как прибор с зарядовой связью). Количество пикселей в цифровых камерах продолжает расти, однако само по себе это не может улучшить разрешение оптических микроскопов.
Еще двадцать пять лет назад казалось, что дифракционный предел непреодолим и что, для того чтобы изучать объекты, размеры которых во много раз меньше, чем длина волны света, необходимо отказаться от света как такового. Именно таким путем пошли создатели электронных и рентгеновских микроскопов. Несмотря на многочисленные преимущества таких микроскопов, задача использования именно света для рассматривания нанообъектов оставалась. Причин для этого было много: удобство и простота работы с объектами, небольшое время, которое требуется для получения изображения, известные способы окрашивания образцов и многое другое. Наконец, после долгих лет напряженной работы стало возможным рассматривать нанообъекты с помощью оптического микроскопа. Наибольший прогресс в этом направлении достигнут в области люминесцентной микроскопии. Конечно, дифракционный предел никто не отменял, но его удалось обойти. В настоящее время существуют различные оптические микроскопы, позволяющие рассматривать объекты, размеры которых намного меньше длины волны того самого света, который создает изображения этих объектов. Все эти приборы объединяет один общий принцип. Попробуем пояснить, какой именно.
Из того, что уже говорилось о дифракционном пределе разрешения, ясно, что увидеть точечный источник не так уж сложно. Если этот источник обладает достаточной интенсивностью, его изображение будет отчетливо видно. Форма и размер этого изображения, как уже говорилось, будут определяться свойствами оптической системы. При этом, зная свойства оптической системы и будучи уверенными в том, что объект точечный, можно определить, где именно находится объект. Точность определения координат такого объекта достаточно высока. Иллюстрацией этого может служить рисунок 5. Координаты точечного объекта можно определить тем точнее, чем интенсивнее он светится. Еще в 80-х годах прошлого века с помощью оптического микроскопа умели определять положение отдельных светящихся молекул с точностью в 10–20 нанометров. Необходимым условием столь точного определения координат точечного источника является его одиночество. Ближайший к нему другой точечный источник должен находиться настолько далеко, чтобы исследователь точно знал, что обрабатываемое изображение соответствует одному источнику. Понятно, что это расстояние l должно удовлетворять условию . В этом случае анализ изображения может дать очень точные данные о положении самого источника.
Большинство объектов, размеры которых намного меньше разрешающей способности оптического микроскопа, можно представить как набор точечных источников. Источники света в таком наборе находятся друг от друга на расстояниях, намного меньших величины . Если эти источники будут светить одновременно, то сказать что-либо о том, где именно они расположены, будет невозможно. Тем не менее, если суметь заставить эти источники светить по очереди, то положение каждого них можно определить с высокой точностью. Если эта точность превышает расстояние между источниками, то, обладая знанием о положении каждого из них, можно узнать о том, каково их взаимное расположение. А это означает, что получена информация о форме и размерах объекта, который представлен как набор точечных источников. Другими словами, в таком случае можно рассмотреть в оптический микроскоп объект, размеры которого меньше, чем дифракционный предел!
Таким образом, ключевым моментом является получение информации о различных частях нанообъекта независимо друг от друга. Существуют три основные группы методов, позволяющие сделать это.
Первая группа методов целенаправленно заставляет светить ту или иную часть исследуемого объекта. Самый известный из этих методов — сканирующая оптическая микроскопия ближнего поля. Рассмотрим ее подробнее.
Если внимательно изучить те условия, которые подразумеваются, когда речь идет о дифракционном пределе, обнаружится, что расстояния от объектов до линз значительно больше длины волны света. На расстояниях, сравнимых и меньших этой длины волны, картина получается другой. Вблизи любого объекта, попавшего в электромагнитное поле световой волны, существует переменное электромагнитное поле, частота изменения которого такая же, как частота изменения поля в световой волне. В отличие от световой волны, это поле быстро затухает по мере удаления от нанообъекта. Расстояние, на котором происходит уменьшение интенсивности, например, в e раз, сравнимо с размерами объекта. Таким образом, электромагнитное поле оптической частоты оказывается сконцентрированным в объеме пространства, размер которого намного меньше, чем длина волны света. Любой нанообъект, попавший в эту область, будет так или иначе взаимодействовать со сконцентрированным полем. Если тот объект, с помощью которого осуществляется это концентрирование поля, последовательно перемещать по какой-либо траектории вдоль изучаемого нанообъекта и регистрировать свет, излучаемый этой системой, то можно построить изображение по отдельным точкам, лежащим на этой траектории. Конечно, в каждой точке изображение будет выглядеть так, как показано на рисунке 2, но разрешение при этом будет определяться тем, насколько удалось сконцентрировать поле. А это, в свою очередь, определяется размерами того объекта, с помощью которого это поле концентрируется.
Самым распространенным способом такой концентрации поля является изготовление очень маленького отверстия в металлическом экране. Обычно это отверстие находится на конце заостренного и покрытого тонкой пленкой металла световода (световод часто называется оптическим волокном и широко используется для передачи данных на большие расстояния). Сейчас удается изготавливать отверстия с диаметрами от 30 до 100 нм. Таким же по величине получается и разрешение. Приборы, работающие по этому принципу, и называются сканирующими оптическими микроскопами ближнего поля. Они появились 25 лет тому назад.
Суть второй группы методов сводится к следующему. Вместо того чтобы заставлять соседние нанообъекты светить по очереди, можно использовать объекты, которые светятся разными цветами. В этом случае с помощью светофильтров, пропускающих свет того или иного цвета, можно определять положение каждого из объектов, а потом — составлять единую картину. Это очень похоже на то, что изображено на рисунке 5, только цвета для трех изображений будут различными.
Последняя группа методов, позволяющих преодолеть дифракционный предел и рассмотреть нанообъекты, использует свойства самих светящихся объектов. Существуют такие источники, которые можно «включать» и «выключать» с помощью специально подобранного света. Такие переключения происходят статистически. Иначе говоря, если имеется много переключаемых нанообъектов, то, подобрав длину волны света и его интенсивность, можно заставить «выключиться» только часть из этих объектов. Остальные объекты будут продолжать светить, и можно получить от них изображение. После этого надо «включить» все источники и снова «выключить» часть из них. Набор оставшихся «включенными» источников будет отличаться от набора, который остался «включенным» в первый раз. Повторяя такую процедуру много раз, можно получить большой набор изображений, отличающихся друг от друга. Анализируя такой набор, можно установить местоположение большой доли всех источников с очень высокой точностью, значительно превышающей дифракционный предел. Пример сверхразрешения, полученного таким способом, приведен на рисунке 6.
В настоящее время оптическая микроскопия со сверхразрешением быстро развивается. Можно со всей уверенностью предполагать, что в грядущие годы эта область будет привлекать все большее число исследователей, и хочется верить, что среди них будут и читатели этой статьи.
Холодный электронный взгляд. Нобелевскую премию 2017 года по химии дали за криоэлектронную микроскопию
Что такое криоэлектронная микроскопия
С начала XX века ученые пытались понять, как устроены «кирпичики» жизни — белки, ДНК и РНК, и пытались найти подходящие инструменты для их изучения. Такими инструментами стали рентгеновская кристаллография и ЯМР-спектроскопия: с их помощью получили множество моделей биологических молекул для самых разных целей. Но у этих методов есть свои ограничения: к примеру, для кристаллографии, как видно из названия, нужны хорошо организованные кристаллы, которые далеко не всегда можно получить.
В 60-х годах XX века люди начали пытаться смотреть на биологические объекты с помощью электронного микроскопа (это такой микроскоп, в котором вместо светового потока, как в обычном оптическом микроскопе, используется пучок электронов). Причем смотрели и в Москве: первые работы такого рода в Москве публиковал член-корреспондент АН СССР Николай Киселев. Но получалось не очень: электронный микроскоп не справлялся с «живой» материей.
«Основная проблема в электронной микроскопии в чем? Чтобы электроны свободно летели в колонне электронного микроскопа, нужен вакуум. Без вакуума они далеко не улетят. В вакуум вы не можете поместить какой-то биологический объект без обработки, потому что он очень влажный, весь вакуум сразу же испортится», — объясняет профессор РАН, доцент кафедры биоинженерии биологического факультета МГУ имени М.В. Ломоносова Ольга Соколова.
По ее словам, сначала образцы пытались красить тяжелыми металлами, но это давало очень низкое разрешение по сравнению с рентгеноструктурным анализом. Жак Дюбоше добавил в процесс воду: в конце 80-х годов он научился очень быстро ее замораживать, чтобы она создавала вокруг образца пленку и тот сохранял бы свою форму в вакууме.
«Витрифицированный лед Дюбоше — это специальный лед, который не рассеивает электроны. Вы его не видите, вы видите только молекулы, которые заморожены в этом льду», — говорит Соколова.
Иллюстрация: Johan Jarnestad / The Royal Swedish Academy of Sciences / nobelprize.orgВ 1990 году Ричард Хендерсон первым сумел получить с помощью электронного микроскопа трехмерное изображение белка родопсина в разрешении до отдельных атомов. Мембранные белки очень трудно кристаллизовать, поэтому криоэлектронная микроскопия — едва ли не единственный способ изучить их структуру. Этот метод справляется и с очень крупными белками, которые тоже плохо кристаллизуются.
А Йоахим Франк занимался рибосомами. Рибосома, объясняет Соколова, это очень подвижная структура, «она собирается, туда приплывают тРНК (транспортные РНК), они перемещаются, в результате получается синтез белка. Это такая большая молекулярная машина». К сожалению для тех, кто хочет получить ее изображение, рибосома не имеет никакой симметрии, а чем больше степеней симметрии, тем меньше вам нужно нужно собрать отдельных изображений молекул. Франк разработал способ компьютерной обработки множества двумерных изображений для получения трехмерной структуры и в итоге создал модель поверхности рибосомы.
Нобелевский комитет пишет, что метод криоэлектронной микроскопии «перевел биохимию в новую эру». С 2013 года, когда ученые сделали первые изображения ионного канала с атомным разрешением, «сфотографировать» успели все что угодно — от поверхности вируса Зика до белков, из-за которых возникает устойчивость к антибиотикам.
Более того, метод криоэлектронной микроскопии уже засветился в других Нобелевских премиях. Тому Стайц, Венкатраман Рамакришнан и Ада Йонат в 2009 году получили награду за определение структур рибосомы, и они сделали это именно с помощью криоэлектронной микроскопии. Этим методом сегодня изучают и мембранный транспорт, за исследования которого премию по физиологии и медицине дали в 2013 году, и мембранные белки (награда 2003 года).
Иллюстрация: © Martin Högbom/The Royal Swedish Academy of Sciences / nobelprize.orgЗа что дали премию
«Это один из самых быстроразвивающихся методов, который позволяет много чего получить — структуры белков, вирусов, макромолекул. Этот метод сейчас находится на острие науки», — сказал «Чердаку» заведующий лабораторией электронной микроскопии НИЦ «Курчатовский институт» Александр Васильев.
Соколова говорит, что в этот раз была уверена, что премию дадут именно этим трем людям. «Конечно, премию должны были бы дать раньше», — говорит она. Дюбоше, Франк и Хендерсон создали основы метода, который развился в один из ключевых инструментов структурной биологии. «Этим методом можно изучать очень интересные вещи, которые невозможно изучать другими методами. В последние несколько лет он очень сильно рванул вперед», — говорит исследовательница.
Снимки, полученные при помощи криоэлектронной микроскопии: (А) белковый комплекс, регулирующий циркадные ритмы, (Б) вирус Зика. / (c)The Royal Swedish Academy of Sciences / nobelprize.orgА что у нас?
Заведующий отделом электронной микроскопии НИИ ФХБ имени А.Н. Белозерского МГУ Игорь Киреев в беседе с «Чердаком» посетовал, что в России популярный во всем мире метод криоэлектронной микроскопии пока не очень распространен: дело прежде всего в дорогостоящем оборудовании. «В стране, конечно, есть несколько таких приборов, например в Курчатовском институте есть два прибора, которые могут это делать. Но этого недостаточно: в Европе и Америке каждый уважающий себя университет обзаводится таким оборудованием, а у нас несколько штук на всю страну», — говорит ученый.
Интересно, что в июне нынешнего года в Москве прошла конференция по криоэлектронной микроскопии, организованная биофаком МГУ и НИИ ФХБ имени А.Н. Белозерского. «Мы хотели общество так настроить, чтобы все осознали, что нам нужны инвестиции в этом направлении. И вот очень удачно Нобелевскую премию присудили именно за это, это подтверждает правильность нашей стратегии», — радуется Киреев.
Ольга Соколова согласна с коллегой. «У нас некоторое количество людей есть, которые этим занимаются, но их, к сожалению, очень мало. Конечно, было бы очень здорово, если бы мы имели такой микроскоп в МГУ, потому что МГУ все-таки на переднем крае российской науки. Я очень надеюсь, что Нобелевская премия нам в этом поможет», — говорит Соколова.
Это — третий текст о лауреатах Нобелевской премии 2017 года. О том, за что вручали «нобелевки» по физике и физиологии и медицине, тоже можно прочесть на «Чердаке».
Ольга Добровидова
Электронный микроскоп. Электронная оптическая схема
https://www.microsystemy.ru/catalog/devices/item/8500-fe-sem/
Как известно, в основе нашего зрения лежит формирование изображения объекта на сетчатке глаза световыми волнами, отраженными от этого объекта. Если, прежде чем попасть в глаз, свет проходит сквозь оптическую систему микроскопа, мы видим увеличенное изображение. При этом ходом световых лучей умело управляют линзы, составляющие объектив и окуляр прибора.
Для подробного ознакомления с Сканирующий электронный микроскоп 8500 FESEM Agilent или свяжитесь с нашими специалистами и получите полную профессиональную консультацию по любым, имеющимся у Вас, вопросам.
Но как же можно получить изображение объекта, причём с гораздо более высокой разрешающей способностью, используя не световое излучение, а поток электронов? Другими словами, как возможно видение предметов на основе использования не волн, а частиц?
Ответ очень прост. Известно, что на траекторию и скорость электронов существенно влияют внешние электромагнитные поля, с помощью которых можно эффективно управлять движением электронов.
Наука о движении электронов в электромагнитных полях и о расчёте устройств, формирующих нужные поля, называется электронной оптикой. Электронное изображение формируется электрическими и магнитными полями примерно так же, как световое – оптическими линзами. Поэтому в электронном микроскопе устройства фоку-сировки и рассеивания электронного пучка называют “электронными линзами”. Магнитное поле катушки действует как собирающая или рассеивающая линза. Чтобы сконцентрировать магнитное поле, катушку закрывают магнитной «броней» из специального ни-кель-кобальтового сплава, оставляя лишь узкий зазор во внутренней части. Создаваемое таким образом магнитное поле может быть в 10–100 тыс. раз сильнее, чем магнитное поле Земли!
К сожалению, наш глаз не может непосредственно воспринимать электронные пучки. Поэтому они используются для “рисования” изображения на люминесцентных экранах (которые светятся при попадании электронов). Кстати, тот же принцип лежит в основе работы мониторов и осцил-лографов. Существует большое количество различных типов электронных микроскопов, среди которых наиболее популярен растровый электронный микроскоп (РЭМ). Мы получим его упрощенную схему, если поместим изучаемый объект внутрь электронно-лучевой трубки обыкновенного телевизора между экраном и источником электронов. В таком микроскопе тонкий луч электронов (диаметр пучка около 10 нм) обегает (как бы сканируя) образец по горизонтальным строчкам, точку за точкой, и синхронно передает сигнал на кинескоп. Весь процесс аналогичен работе телевизора в процессе развертки. Источником электронов служит металл (обычно вольфрам), из которого при нагревании в результате термоэлектронной эмиссии испускаются электроны.
Схема работы растрового электронного микроскопа
Термоэлектронная эмиссия – выход электронов с поверхности проводников. Число вышедших электронов мало при Т=300K и экспоненциально растет с повышением температуры.
При прохождении электронов через образец одни из них рассеиваются из-за столкновений с ядрами атомов образца, другие- изза столкновений с электронами атомов, а третьи проходят сквозь него. В некоторых случаях испускаются вторичные электроны, индуцируется рентгенов-ское излучение и т.п. Все эти процессы регистрируются специальными детекторами и в преобразованном виде выводятся на экран, создавая увеличенную картинку изучаемого объекта.
Увеличение в данном случае понимается как отношение размера изображения на экране к размеру области, обегаемой пучком на образце. В связи с тем, что длина волны электрона на порядки меньше, чем фотона, в современных РЭМ это увеличение может достигать 10 миллионов15, соответствуя разрешению в единицы нанометров, что позволяет визуализировать отдельные атомы.
Главный недостаток электронной микроскопии – необходимость работы в полном вакууме, ведь наличие какоголибо газа внутри камеры микроскопа может привести к ионизации его атомов и существенно исказить результаты. Кроме того, электроны оказывают разрушительное воздействие на биологические объекты, что делает их неприменимыми для исследования во многих областях биотехнологии.
История создания электронного микроскопа – замечательный пример достижения, основанного на междисциплинарном подходе, когда самостоятельно развивающиеся области науки и техники, объединившись, создали новый мощный инструмент научных исследований.
Вершиной классической физики была теория электромагнитного поля, которая объяснила распространение света, электричество и магнетизм как распространение электромагнитных волн. Волновая оптика объяснила явление дифракции, механизм формирования изображения и игру факторов, определяющих разрешение в световом микроскопе. Успехам квантовой физики мы обязаны открытием электрона с его специфическими корпускулярноволновыми свойствами. Эти отдельные и, казалось бы, независимые пути развития привели к созданию электронной оптики, одним из важнейших изобретений которой в 1930х годах стал электронный микроскоп.
Но и на этом ученые не успокоились. Длина волны электрона, ускоренного электрическим полем, составляет несколько нанометров. Это неплохо, если мы хотим увидеть молекулу или даже атомную решетку. Но как заглянуть внутрь атома? На что похожа химическая связь? Как выглядит процесс отдельной химической реакции? Для этого сегодня в разных странах ученые разрабатывают нейтронные микроскопы.
Нейтроны обычно входят в состав атомных ядер наряду с протонами и имеют почти в 2000 раз большую массу, чем электрон. Те, кто не забыл формулу де Бройля из квантовой главы,сразу сообразят, что и длина волны у нейтрона во столько же раз меньше, то есть составляет пикометры тысячные доли нанометра! Тогдато атом и предстанет исследователям не как расплывчатое пятнышко, а во всей своей красе.
Нейтронный микроскоп имеет много плюсов – в частности, нейтроны хорошо отображают атомы водорода и легко проникают в толстые слои образцов. Однако и построить его очень трудно: нейтроны не имеют электрического заряда, поэтому преспокойно игнорируют магнитные и электрические поля и так и норовят ускользнуть от датчиков. К тому же не так-то просто выгнать большие неповоротливые нейтроны из атомов. Поэтому сегодня первые прототипы нейтронного микроскопа еще весьма далеки от совершенства.
Существуют три основных вида электронных микроскопов
Обычный просвечивающий электронный микроскоп (появился в 1930-х годах), растровый (сканирующий) электронный микроскоп (1950-е годы), растровый туннельный микроскоп (1980-е годы).
Электронная оптика
Электронное изображение формируется электрическими и магнитными полями примерно так же, как световое – оптическими линзами. Принцип действия магнитной линзы поясняется схемой (рис. 1). Магнитное поле, создаваемое витками катушки, по которой проходит ток, действует как собирающая линза, фокусное расстояние которой можно изменять, изменяя ток. Поскольку оптическая сила такой линзы, т.е. способность фокусировать электроны, зависит от напряженности магнитного поля вблизи оси, для ее увеличения желательно сконцентрировать магнитное поле в минимально возможном объеме. Практически это достигается тем, что катушку почти полностью закрывают магнитной «броней» из специального никель-кобальтового сплава, оставляя лишь узкий зазор в ее внутренней части. Создаваемое таким образом магнитное поле может быть в 10–100 тыс. раз более сильным, чем магнитное поле Земли на земной поверхности.
Обычный просвечивающий электронный микроскоп
Обычный просвечивающий электронный микроскоп (ОПЭМ) во многом схож со световым микроскопом. Отличие между ними в том, что для освещения образцов в ОПЭМ используется не свет, а пучок электронов. В состав обычного просвечивающего электронного микроскопа входят: электронный прожектор, ряд конденсорных линз, объективная линза и проекционная система, которая соответствует окуляру, но проецирует действительное изображение на люминесцентный экран или фотографическую пластинку. Источником электронов обычно является нагреваемый катод из вольфрама или гексаборида лантана. Катод электрически изолирован от остальной части прибора, и электроны ускоряются сильным электрическим полем. Чтобы создавать такое поле, катод поддерживают под потенциалом порядка 100 000 В относительно других электродов, фокусирующих электроны в узкий пучок. Эта часть прибора носит название электронного прожектора. В колонне микроскопа, где движутся электроны, должен быть обеспечен вакуум, так как электроны сильно рассеиваются веществом. Здесь поддерживается давление не выше чем одна миллиардная атмосферного давления.
Рассмотрим схему работы обычного просвечивающего электронного микроскопа. Ряд конденсорных линз фокусирует электронный пучок на образце. Первая из них создает неувеличенное изображение источника электронов, а последняя контролирует размер освещаемого участка на образце. Диафрагмой последней конденсорной линзы определяется ширина пучка в плоскости объекта. Образец помещается в магнитном поле объективной линзы с большой оптической силой – самой важной линзы ОПЭМ, от которой зависит максимально возможное разрешение микроскопа. Аберрации объективной линзы ограничиваются ее диафрагмой аналогично тому, как это происходит в фотоаппарате или световом микроскопе. Объективная линза дает увеличенное изображение объекта (обычно с увеличением порядка 100). Дополнительное увеличение промежуточных и проекционных линз лежит в пределах величин от несколько меньшей 10 до несколько большей 1000. Соответственно, используя современные ОПЭМ, можно получить увеличение от менее 1000 до ~1 000 000. Любопытно будет узнать, что при увеличении в миллион раз грейпфрут вырастает до размеров Земли. Объект исследования, как правило, помещают на очень мелкую сетку, вкладываемую в специальный держатель. Держатель механическим или электрическим способом плавно перемещается вверх-вниз и вправо-влево.
Для изучения нанообъектов разрешения оптических микроскопов (даже использующих ультрафиолет) явно недостаточно. В связи с этим в 1930х гг. возникла идея использовать вместо света электроны, длина волны которых, как мы знаем из квантовой физики, в сотни раз меньше, чем у фотонов.
Схема работы растрового электронного микроскопа
Термоэлектронная эмиссия – выход электронов с поверхности проводников. Число вышедших электронов мало при Т=300K и экспоненциально растет с повышением температуры.
При прохождении электронов через образец одни из них рассеиваются из-за столкновений с ядрами атомов образца, другие- из-за столкновений с электронами атомов, а третьи проходят сквозь него. В некоторых случаях испускаются вторичные электроны, индуцируется рентгеновское излучение и т.п. Все эти процессы регистрируются специальными детекторами и в преобразованном виде выводятся на экран, создавая увеличенную картинку изучаемого объекта.
Увеличение в данном случае понимается как отношение размера изображения на экране к размеру области, обегаемой пучком на образце. В связи с тем, что длина волны электрона на порядки меньше, чем фотона, в современных РЭМ это увеличение может достигать 10 миллионов15, соответствуя разрешению в единицы нанометров, что позволяет визуализировать отдельные атомы.
Главный недостаток электронной микроскопии – необходимость работы в полном вакууме, ведь наличие какоголибо газа внутри камеры микроскопа может привести к ионизации его атомов и существенно исказить результаты. Кроме того, электроны оказывают разрушительное воздействие на биологические объекты, что делает их неприменимыми для исследования во многих областях биотехнологии.
История создания электронного микроскопа – замечательный пример достижения, основанного на междисциплинарном подходе, когда самостоятельно развивающиеся области науки и техники, объединившись, создали новый мощный инструмент научных исследований.
Вершиной классической физики была теория электромагнитного поля, которая объяснила распространение света, электричество и магнетизм как распространение электромагнитных волн. Волновая оптика объяснила явление дифракции, механизм формирования изображения и игру факторов, определяющих разрешение в световом микроскопе. Успехам квантовой физики мы обязаны открытием электрона с его специфическими корпускулярноволновыми свойствами. Эти отдельные и, казалось бы, независимые пути развития привели к созданию электронной оптики, одним из важнейших изобретений которой в 1930х годах стал электронный микроскоп.
Но и на этом ученые не успокоились. Длина волны электрона, ускоренного электрическим полем, составляет несколько нанометров. Это неплохо, если мы хотим увидеть молекулу или даже атомную решетку. Но как заглянуть внутрь атома? На что похожа химическая связь? Как выглядит процесс отдельной химической реакции? Для этого сегодня в разных странах ученые разрабатывают нейтронные микроскопы.
Нейтроны обычно входят в состав атомных ядер наряду с протонами и имеют почти в 2000 раз большую массу, чем электрон. Те, кто не забыл формулу де Бройля из квантовой главы,сразу сообразят, что и длина волны у нейтрона во столько же раз меньше, то есть составляет пикометры тысячные доли нанометра! Тогдато атом и предстанет исследователям не как расплывчатое пятнышко, а во всей своей красе.
Нейтронный микроскоп имеет много плюсов – в частности, нейтроны хорошо отображают атомы водорода и легко проникают в толстые слои образцов. Однако и построить его очень трудно: нейтроны не имеют электрического заряда, поэтому преспокойно игнорируют магнитные и электрические поля и так и норовят ускользнуть от датчиков. К тому же не так-то просто выгнать большие неповоротливые нейтроны из атомов. Поэтому сегодня первые прототипы нейтронного микроскопа еще весьма далеки от совершенства.
Просвечивающие микроскопы
Просвечивающая электронная микроскопия (ПЭМ) предполагает изучение тонких образцов с помощью пучка электронов, проходящих сквозь них и взаимодействующих с ними. Электроны, прошедшие сквозь образец, фокусируются на устройстве формирования изображения: флюоресцентном экране, фотопластинке или сенсоре ПЗС-камеры.
Благодаря меньшей чем у света длине волны электронов ПЭМ позволяет изучать образцы с разрешением в десятки тысяч раз превосходящим разрешение самого совершенного светооптического микроскопа. С помощью ПЭМ возможно изучение объектов даже на атомарном уровне. ПЭМ является одним из основных методов исследования в целом ряде прикладных областей: физике, биологии, материаловедении и т.д.
На относительно малых увеличениях контраст на ПЭМ возникает из-за поглощения электронов материалом исследуемого образца. На высоких увеличениях сложное взаимодействие волн формирует изображение, требующее более сложной интерпретации.
Современные ПЭМ имеют режимы работы, позволяющие изучать элементный состав образцов, ориентацию кристаллов, фазовый сдвиг электронов и т.п. Для исследований в области материаловедения, металлургии, кристаллографии, физики полупроводников созданы современные высоковольтные (до 300 кэВ) ПЭМ высокого разрешения, позволяющие в обычном режиме получать изображения атомов. С дополнительными аналитическими приставками (рентгеновские энергодисперсионные спектрометры, спектрометры потерь энергии электронов) они позволяют определять элементный состав областей менее 0.5 нм в диаметре.
Для подробного ознакомления с медицинской и исследовательской техникой основных мировых производителей оптических систем и сопутствующего оборудования посетите наш каталог или свяжитесь с нашими специалистами и получите полную профессиональную консультацию по любым, имеющимся у Вас, вопросам.
Сканирующий туннельный микроскоп
Сканирующий туннельный микроскоп (СТМ) — система образец + игла, к которым приложена разность потенциалов. Электроны из образца туннелируют на иглу, создавая туннельный ток. Величина этого тока экспоненциально зависит от расстояния образец-игла. Типичные значения 1-1000 пА при расстояниях около 1 Å.
В процессе сканирования игла движется вдоль образца, туннельный ток поддерживается стабильным за счёт действия обратной связи, и удлинение следящей системы меняется в зависимости от топографии поверхности. Такие изменения фиксируются, и на их основе строится карта высот.
Ограничения на использование метода накладываются:
Во-первых, условием проводимости образца (поверхностное сопротивление должно быть не больше 20 МОм/см²),
Во-вторых, условием «глубина канавки должна быть меньше её ширины», потому что в противном случае может наблюдаться туннелирование с боковых поверхностей.
Но это только основные ограничения. На самом деле их намного больше. Например, технология заточки иглы не может гарантировать одного острия на конце иглы, а это может приводить к параллельному сканированию двух разновысотных участков. Кроме ситуации глубокого вакуума, во всех остальных случаях всегда имеем на поверхности осаждённые из воздуха частицы, газы и т. д. Технология грубого сближения также оказывает колоссальное влияние на объективность полученных результатов. Если при подводе иглы к образцу мы не смогли избежать удара иглы о поверхность, то считать иглу состоящей из одного атома на кончике призмы будет большим преувеличением.
Сканирующий атомно-силовой микроскоп
Атомно-силовой микроскоп — сканирующий зондовый микроскоп высокого разрешения, основанный на взаимодействии иглы кантилевера (зонда) с поверхностью исследуемого образца. Обычно под взаимодействием понимается притяжение или отталкивание кантилевера от поверхности из-за сил Ван-дер Ваальса. Но при использовании специальных кантилеверов можно изучать электрические и магнитные свойства поверхности. В отличие от сканирующего туннельного микроскопа (СТМ) может исследовать как проводящие так и непроводящие поверхности даже через слой жидкости, что позволяет работать с органическими молекулами (ДНК). Пространственное разрешение атомно-силового микроскопа зависит от размера кантилевера и кривизны его острия. Разрешение достигает на атомарном уровне по горизонтали и существенно превышает его по вертикали.
Атомно-силовой микроскоп был изобретён в 1986 году Гердом Биннигом и Кристофом Гербером в США. Атомно-силовой микроскоп применяется для фотографированя профиля поверхности и для изменения её рельефа, а также для манипулирования: перемещения, добавления, удаления микроэлементов на поверхности объекта
Принцип работы
Атомно-силовой микроскоп (АСМ) представляет собой систему образец + игла. На малых расстояниях между двумя атомами, один на подложке, другой на острие, при расстоянии около одного ангстрема действуют силы отталкивания, а на больших — силы притяжения. Величина этого усилия экспоненциально зависит от расстояния образец-игла. Отклонения зонда при действии близко расположенных атомов регистрируются при помощи измерителя наноперемещений, в частности используют оптические, ёмкостные или туннельные сенсоры. Добавив к этой системе устройство развёртки по осям X и Y, получают сканирующий АСМ. Принимая, что электронные состояния (орбитали) локализованы на каждом атомном участке, то при сканировании поверхности образца в направлении X или Y с одновременным измерением выходного аналогового сигнала по направлению Z можно получить картину поверхностной структуры на атомном уровне в системе координат XYZ, т.е. 3D виде.
Основные технические сложности при создании микроскопа:
- Создание иглы, заострённой действительно до атомных размеров
- Обеспечение механической (в том числе тепловой и вибрационной) стабильности на уровне лучше 0,1 ангстрема
- Создание детектора, способного надёжно фиксировать столь малые перемещения
- Создание системы развёртки с шагом в доли ангстрема
- Обеспечение плавного сближения иглы с поверхностью
Преимущества и недостатки
В сравнении с растровым электронным микроскопом (РЭМ) атомно-силовой микроскоп обладает рядом преимуществ. Так, в отличие от РЭМ, который даёт псевдо трёхмерное изображение поверхности образца, АСМ позволяет получить истинно трёхмерный рельеф поверхности. Кроме того, непроводящая поверхность, рассматриваемая с помощью АСМ, не требует нанесения проводящего металлического покрытия, которое часто приводит к заметной деформации поверхности. Для нормальной работы РЭМ требуется вакуум, в то время как большинство режимов АСМ могут быть реализованы на воздухе или даже в жидкости. Данное обстоятельство открывает возможность изучения биомакромолекул и живых клеток. В принципе, АСМ способен дать более высокое разрешение чем РЭМ. Так было показано, что АСМ в состоянии обеспечить реальное атомное разрешение в условиях сверхвысокого вакуума. Сверхвысоковакуумный АСМ по разрешению сравним со сканирующим туннельным микроскопом и просвечивающим электронным микроскопом.
К недостатку АСМ при его сравнении с РЭМ также следует отнести небольшой размер поля сканирования. РЭМ в состоянии просканировать область поверхности размером в несколько миллиметров в латеральной плоскости с перепадом высот в несколько миллиметров в вертикальной плоскости. У АСМ максимальный перепад высот составляет несколько микрон, а максимальное поле сканирования в лучшем случае порядка 150×150 микрон. Другая проблема заключается в том, что при высоком разрешении качество изображения определяется радиусом кривизны кончика зонда, что при неправильном выборе зонда приводит к появлению артефактов на получаемом изображении.
Обычный АСМ не в состоянии сканировать изображения так же быстро, как это делает РЭМ. Для получения АСМ-скана, как правило, требуется несколько минут, в то время как РЭМ после откачки способен работать практически в реальном масштабе времени, хотя и с относительно невысоким качеством. Достаточно медленная скорость развёртки АСМ часто приводит к появлению на изображении искажений, вызываемых тепловым дрейфом, ограничивая тем самым возможности микроскопа при точном измерении элементов сканируемого рельефа. Однако было предложено несколько быстродействующих конструкций, чтобы увеличить производительность сканирования микроскопа, включая зондовый микроскоп, который был впоследствии назван видеоАСМ (удовлетворительного качества изображения были получены на видеоАСМ с частотой телевизионной развёртки, т.е. быстрее, чем на обычном РЭМ). Для коррекции искажений от термодрейфа было также предложено несколько методов.
Изображения, полученные на АСМ, могут быть искажены гистерезисом пьезокерамического материала сканера (Lapshin, 1995), а также перекрёстными паразитными связями, действующими между X, Y, Z элементами сканера, что может потребовать программной коррекции. Современные АСМ используют программное обеспечение, которое вносит исправления в реальном масштабе времени (например, особенность-ориентированное сканирование, особенность-ориентированное позиционирование, Lapshin, 2004, 2007), либо сканеры, снабжённые замкнутыми следящими системами, которые практически устраняют данные проблемы. Некоторые АСМ вместо пьезотрубки используют XY и Z элементы сканера механически несвязанные друг с другом, что также позволяет исключить часть паразитных связей.
АСМ можно использовать для определения типа атома в кристаллической решётке.
Сканирующий электронный микроскоп
Сканирующий электронный микроскоп — прибор, позволяющий получать изображения поверхности образца с большим разрешением (менее 1 микрометра). Применение дополнительных систем позволяет получать информацию о химическом составе приповерхностных слоёв.
Принцип работы
Исследуемый образец в условиях промышленного вакуума сканируется сфокусированным электронным пучком средних энергий. В зависимости от механизма регистрирования сигнала различают несколько режимов работы сканирующего электронного микроскопа: режим отражённых электронов, режим вторичных электронов, режим катодолюминесценции и т. д. Разработанные методики позволяют исследовать не только свойства поверхности образца, но и визуализировать и получать информацию о свойствах подповерхностных структур.
Разрешающая способность
Пространственное разрешение сканирующего электронного микроскопа зависит от поперечного размера электронного пучка, который в свою очередь зависит от электронно-оптической системы, фокусирующей пучок. Разрешение также ограничено размером области взаимодействия электронного зонда с образцом, т. е. от материала мишени. Размер электронного зонда и размер области взаимодействия зонда с образцом намного больше расстояния между атомами мишени, таким образом, разрешение сканирующего электронного микроскопа не настолько велико, чтобы отображать атомарные масштабы, как это возможно, например, в просвечивающем электронном микроскопе. Однако, сканирующий электронный микроскоп имеет свои преимущества, включая способность визуализировать сравнительно большую область образца, способность исследовать массивные мишени (а не только тонкие пленки), а также разнообразие аналитических методов, позволяющих измерять фундаментальные характеристики материала мишени. В зависимости от конкретного прибора и параметров эксперимента, может быть получено разрешение от десятков до единиц нанометров.
Применение
Сканирующие микроскопы применяются в первую очередь как исследовательский инструмент в физике, электронике, биологии. В основном это получение картинки исследуемого образца, которая может сильно меняться в зависимости от применяемого типа детектора. Эти различия позволяют делать вывод о физике поверхности, проводить исследование рельефа поверхности. Электронный микроскоп практически единственный прибор, который может дать изображение поверхности современной микросхемы или промежуточной стадии фотолитографического процесса.
Растровый просвечивающий электронный микроскоп
Растровый просвечивающий электронный микроскоп (РПЭМ) – это особый вид РЭМ. Он рассчитан на тонкие образцы, такие же, как и исследуемые в ОПЭМ. Схема РПЭМ отличается от схемы на рис. 3 только тем, что в ней нет детекторов, расположенных выше образца. Поскольку изображение формируется бегущим пучком (а не пучком, освещающим весь исследуемый участок образца), требуется высокоинтенсивный источник электронов, чтобы изображение можно было зарегистрировать за приемлемое время. В РПЭМ высокого разрешения используются автоэлектронные эмиттеры высокой яркости. В таком источнике электронов создается очень сильное электрическое поле (ок. В/см) вблизи поверхности заостренной травлением вольфрамовой проволочки очень малого диаметра. Это поле буквально вытягивает миллиарды электронов из проволочки без всякого нагрева. Яркость такого источника почти в 10 000 раз больше, чем источника с нагреваемой вольфрамовой проволокой (см. выше), а испускаемые им электроны могут быть сфокусированы в пучок диаметром менее 1 нм. Были даже получены пучки, диаметр которых близок к 0,2 нм.
Автоэлектронные источники могут работать только в условиях сверхвысокого вакуума (при давлениях ниже Па), в которых полностью отсутствуют такие загрязнения, как пары углеводородов и воды, и становится возможным получение изображений с высоким разрешением. Благодаря таким сверхчистым условиям можно исследовать процессы и явления, недоступные ЭМ с обычными вакуумными системами.
Исследования в РПЭМ проводятся на сверхтонких образцах. Электроны проходят сквозь такие образцы почти без рассеяния. Электроны, рассеянные на углы более нескольких градусов без замедления, регистрируются, попадая на кольцевой электрод, расположенный под образцом. Сигнал, снимаемый с этого электрода, сильно зависит от атомного номера атомов в той области, через которую проходят электроны, – более тяжелые атомы рассеивают больше электронов в направлении детектора, чем легкие. Если электронный пучок сфокусирован в точку диаметром менее 0,5 нм, то можно получить изображение отдельных атомов. Реально удается различать на изображении, полученном в РПЭМ, отдельные атомы с атомной массой железа (т.е. 26 и более).
Электроны, не претерпевшие рассеяния в образце, а также электроны, замедлившиеся в результате взаимодействия с образцом, проходят в отверстие кольцевого детектора. Энергетический анализатор, расположенный под этим детектором, позволяет отделить первые от вторых. Измеряя энергию, потерянную электронами при рассеянии, можно получить важную информацию об образце. Потери энергии, связанные с возбуждением рентгеновского излучения или выбиванием вторичных электронов из образца, позволяют судить о химических свойствах вещества в области, через которую проходит электронный пучок.
Для подробного ознакомления с медицинской и исследовательской техникой основных мировых производителей оптических систем и сопутствующего оборудования посетите наш каталог или свяжитесь с нашими специалистами и получите полную профессиональную консультацию по любым, имеющимся у Вас, вопросам.
Формирование изображений в оптическом микроскопе
Образцы для микроскопов можно рассматривать как сложные линейные или узорчатые решетки с деталями и отверстиями, охватывающими широкий диапазон размеров. Эта концепция формирования изображения была в значительной степени разработана Эрнстом Аббе, известным немецким микроскопистом и теоретиком оптики XIX века. Согласно Аббе (его теории все еще широко распространены в настоящее время), детали образца будут разрешены, если объектив улавливает 2 порядка света, такие как 0-й порядок света и по крайней мере 1-й порядок дифракции.Чем больше количество дифрагированных порядков, которые получают доступ к объективу, тем точнее изображение будет представлять исходный объект. Кроме того, если среда с более высоким показателем преломления, чем воздух (например, иммерсионное масло), используется в пространстве между передней линзой объектива и верхней частью покровного стекла (как показано для сухого объектива на Рисунке 5 (а)) , угол дифрагированных порядков уменьшается, а вееры дифрагированного света сжимаются. В результате масляный иммерсионный объектив может улавливать большее количество порядков дифракции и давать лучшее разрешение, чем сухой объектив (рис. 5 (b)).Сравните захваченные заказы на рис. 5 (а) и 5 (б). Более того, поскольку синий свет преломляется под меньшим углом, чем зеленый свет или красный свет, линза с заданной апертурой может улавливать больше порядков света, когда длины волн находятся в синей области спектра видимого света. Эти два принципа объясняют классическое уравнение Рэлея, которое часто используют в качестве основы для расчета разрешения точка-точка в микроскопе:
d (разрешение) = 1,22 • (λ / 2NA) (1)
, где d — расстояние между двумя соседними частицами (при этом частицы могут восприниматься как отдельные), λ — длина волны освещения, а NA — числовая апертура объектива.Предполагается, что микроскоп также оснащен конденсором с той же числовой апертурой, что и объектив (без конденсора разрешение было бы вдвое хуже, что приводило бы к увеличению разрешаемых деталей в два раза). Чем больше количество дифрагированных порядков более высокого порядка допущено к объективу, тем меньшие детали образца могут быть четко разделены или разрешены. В этом заключается ценность использования объективов с высокой числовой апертурой для исследования мельчайших деталей в различных образцах.Аналогичным образом, чем короче длина волны видимого света, тем лучше разрешение. Эти идеи объясняют, почему апохроматические линзы с высокой числовой диафрагмой могут разделять чрезвычайно мелкие детали в синем свете. Размещение непрозрачной маски на задней части объектива блокирует самые дальние дифрагированные порядки. Это либо снижает разрешение линий решетки или любых других деталей образца, либо полностью снижает разрешение, так что образец не виден. Отсюда обычное предостережение — не закрывать апертурную диафрагму конденсора ниже предполагаемых двух третей апертуры объектива.
Введение в микроскопическую фотографию
Этот кристалл льда имел размер примерно 1 мм. Снимок был сделан в 14:00 при температуре 14 F. Этот тип чешуек называется звездным дендритом. Майкл ПересМайкл Перес любит фотографировать мельчайшие детали нашего природного мира. Перес, профессор биомедицинских фотографических коммуникаций в Рочестерском технологическом институте, специализируется на запечатлении этих сложных деталей с помощью фотографирования с помощью микроскопа.Здесь он объясняет, как он это делает.
Я заинтересовался фотографированием крошечных вещей более 40 лет назад, когда учился в колледже перед медицинским факультетом. Я познакомился с этим увлекательным и невидимым миром, когда учился отличать мышечную ткань от соединительной с помощью светового микроскопа. Я увлекался каждым новым предметом, который меня просили изучить, и меня до сих пор поражает, как все организовано. Люблю фотографировать снежинки, цветы и другие природные объекты. Я начал делиться своей работой в Instagram в марте 2014 года и был очарован подписчиками со всего мира, которых привлекают мои изображения.
На этой микрофотографии изображен комар Anopheles. На этом снимке он увеличен примерно в четыре раза. Образец называется цельным держателем и представляет собой подготовленный слайд, который я купил. Размер комара на предметном стекле составлял примерно 2 мм. Майкл ПересПоиск объекта для микроскопической фотографии
Поиск хорошего предмета начинается с любопытства к миру. Я считаю, что очень важно относиться непредвзято к потенциальным образцам. На днях гуляя с моей собакой, он пришел домой с заусенцами.Удалив столько, сколько смог, я решил изучить одну под микроскопом. Это был просто сорняк, но под микроскопом он стал изящным и сложным.
Поиск и обращение с небольшими объектами — большая часть успеха процесса. Поврежденные образцы или образцы с артефактами будут иметь другое визуальное представление, чем отличные образцы, и важно не позволить повреждению стать фокусом фотографии. Поиск образца без дефектов — это первоочередная задача для того типа фотографий, которые я хочу сделать.Нельзя сказать, что объекты моей фотографии идеальны — это не так.
На этой микрофотографии изображена Pinus strobus или пять игл. Он был подготовлен в поперечном сечении и показывает различные структуры внутри листьев, включая сосудистые пучки, показанные в центральных областях пяти игл и окружающие зеленые линии, подобные клеткам. Это изображение увеличено примерно в пять раз. Майкл ПересКогда я готовлю образец к фотографии, я думаю о двух вещах — рассечение и изоляция, которые имеют прецедент, в зависимости от объекта и его увеличения.При фотографировании цветов я обычно использую ножницы для рассечения, чтобы удалить лепестки, чтобы улучшить видимость их структурных элементов. Когда я фотографирую водные организмы, я стараюсь изолировать их в капле воды под покровным стеклом. В этом случае меньше всегда лучше. Каждый объект создает уникальные проблемы и требует различных методов, чтобы сделать образец достаточно маленьким, достаточно плоским или достаточно тонким для фотографирования.
Я также покупаю готовые биологические препараты, такие как поперечные срезы растений или животных тканей — очень сложно приготовить такие препараты без точного оборудования.Wards Natural Science и Carolina Biological Supply Company продают тысячи предметов, подготовленных к микроскопическому исследованию.
Это изображение злокачественного минерала Северной Америки, сделанное с использованием поляризованного света, показывающего его двулучепреломление. Он был сфотографирован с приобретенного геологического слайда толщиной 0,25 мм. На этой микрофотографии он увеличен примерно в 25 раз. Майкл ПересОборудование, необходимое для получения микроскопического изображения
При съемке микроскопических изображений моим важнейшим оборудованием являются микроскопы, оптоволоконный свет, корпус камеры DSLR, макрообъектив, удлинительные трубки, сильфон и штатив.Когда я фотографирую снежинки, цветы или другие предметы, встречающиеся в природе, я часто бываю в своем гараже и держу готовый запас чистых предметных стекол для микроскопа и кусок черной бархатной ткани для использования в качестве фона. У меня также есть много игл, крошечных кисточек и ватных палок, которые я использую для перемещения образцов и уборки области вокруг них.
Обычно я использую составной световой микроскоп для своих фотографий. Световые микроскопы довольно распространены, и их легко найти. Они могут быть дорогими или относительно дешевыми, студенческий микроскоп может стоить всего 250 долларов, а высококачественный исследовательский микроскоп может стоить 200000 долларов.Довольно хороший б / у микроскоп бюджетного класса можно найти за 5000 долларов.
На этой микрофотографии изображен кальмар, неполовозрелый кальмар вида Loligo. На этом снимке он увеличен примерно в восемь раз. Этот тип образца называется цельным держателем и представляет собой подготовленный слайд, который я купил. Незрелый кальмар на слайде составлял приблизительно 1 мм. Майкл ПересМикроскопы позволяют увеличивать объекты с помощью двух линз. Первый этап увеличения производится линзой объектива, а второй этап увеличения — окуляром.Объектив имеет фокусное расстояние, как и традиционные фотографические линзы, которые используются в цифровых зеркальных фотокамерах. Для этого типа фотографии рабочие расстояния очень малы — типичный диапазон увеличения объектива для светового микроскопа может включать 2x, 4x, 10x, 20x, 40, 60x или 100x. Я выбираю объектив микроскопа в зависимости от требований к увеличению образца. Увеличение влияет на глубину резкости изображения, поэтому большой толстый образец (0,5 см) выигрывает от малого увеличения, в то время как очень плоские объекты нуждаются в большем увеличении.
При использовании светового микроскопа можно делать снимки с помощью смартфона или камеры с фиксированным объективом, и это отличная отправная точка. В этих камерах линза должна быть помещена в глазок микроскопа, который можно найти, удерживая лист бумаги примерно в 1 см от окуляра микроскопа. На бумаге будет видна очень маленькая светящаяся точка — это точка глаза, куда следует направить линзу. Небольшой штатив может помочь удерживать камеру на месте.Лента Гаффера часто является моим лучшим другом как техническому фотографу, потому что она позволяет мне обезопасить телефон от других элементов системы во время съемки.
Для освещения использовались цветок печени и оптоволокно. Микрофотография включает тычинки и пестик цветков и увеличена на этом снимке примерно в три раза. Майкл ПересХотя использование смартфона или камеры с фиксированным объективом работает, мне нравится использовать Nikon D300s или D800 со снятым объективом и подвешенным над окуляром микроскопа с помощью вертикальной копировальной стойки или штатива.Я также использую удлинительные трубки или сильфоны на своей камере для управления окружающим освещением, что может создать блики и снизить контраст. При использовании цифровой зеркальной фотокамеры вам необходимо навести сенсор камеры на маленькую светящуюся точку из точки глаза. Чтобы сделать микроскопическое изображение, я наведу датчик моей камеры над окуляром на расстоянии, на котором круг освещения, создаваемый микроскопом, достаточно велик, чтобы покрыть датчик, не видя круга. Убедитесь, что световая точка закрыла датчик, проверив ЖК-экран камеры.Однако будьте осторожны при настройке: очень важно помнить о расстоянии между окуляром и незащищенным датчиком.
Куриный эмбрион в возрасте от 18 до 24 часов. Развивающийся мозг, позвоночник и позвонки начинают формироваться и становятся видимыми внутри эмбриона. На этой микрофотографии цыпленок увеличен в пять раз. Майкл ПересОсвещение микроскопического объекта
Я в основном использую встроенный свет микроскопа и дополняю его оптоволоконным освещением.Когда я впервые смотрю на образец, я представляю, как я хочу, чтобы оно выглядело, и работаю над его достижением. Я вношу множество мелких корректировок в положение источника света, что сильно влияет на результат. Некоторые из объектов, которые я фотографирую, могут иметь размер один-два миллиметра или меньше. Перед съемкой я принимаю решения о том, сколько требуется заполняющего света или что делает угол освещения правильным. Моя стратегия во многом основана на том, как свет работает с самим образцом.Три стиля освещения, которые я использую наиболее часто, — это Kohler, Darkfield и Polarized, читайте дополнительную информацию о каждом из них.
Это изображение Bursaria truncatella. Организмы были живы и плавали. Бурсарии — это ресничные пресноводные организмы, обитающие во всем мире. Питаются в основном парамециями. На этой микрофотографии водные беспозвоночные увеличены примерно в 25 раз. Майкл ПересКак я использую освещение Колера при съемке микроскопических объектов
На этой микрофотографии изображен Taraxacum officinale или одуванчик обыкновенный.Он был подготовлен в продольном разрезе и включает семенной стакан и развивающиеся семена. Это изображение увеличено примерно в 15 раз. Майкл ПересКогда я фотографирую подготовленный «шлиф», я пытаюсь создать нейтральное и равномерное заднее освещение, называемое освещением Колера. Такой стиль освещения позволяет микроскописту максимально увеличить контраст и разрешение изображения, а также добиться равномерного и равномерного освещения за образцом. Я продолжаю использовать его, потому что он создает портретную обработку вещей, которые я фотографирую.
Как я использую освещение Darkfield при съемке микроскопических объектов
Это изображение было сделано со слайда, на котором изображена развивающаяся человеческая кость. Он был сфотографирован с использованием темнопольного освещения. Микрофотография показывает созревающие костные клетки и губчатую кость и увеличена примерно в 75 раз. Майкл ПересЯ также буду использовать темное поле, которое заставляет объект светиться на черном фоне, создавая вид астрономического типа. Освещение темного поля исходит из-за прозрачного объекта и проходит через образец под косыми углами.Такой стиль освещения создает очень эффектный вид, недостатком является то, что при использовании темного поля будет освещено все, включая вещи, которые вы не хотите освещать, например грязь, царапины или пузырьки воздуха.
Как я использую поляризованное освещение при съемке микроскопических объектов
Это изображение лекарственной фольги Merck, прописанной при астме. Микрофотография была сделана с использованием поляризованного света и показывает кристаллы, которые образовались при испарении и сушке химического вещества.На этой фотографии твердую таблетку растворили в горячей воде, а затем нанесли на предметное стекло, чтобы она испарилась. Цвета представляют различные компоненты химического вещества. Изображение увеличено примерно в 50 раз. Майкл ПересЯ использую поляризованный свет, когда фотографирую образцы с двойным лучепреломлением, это технический термин, который описывает, как образец может или не может «показывать» цвета радуги при помещении в микроскоп поляризованного света. Образцы, содержащие волосы, волокна, химические вещества, минералы, крылья некоторых насекомых и многие синтетические объекты, при исследовании с использованием поляризованного света будут выглядеть так, как будто они сделаны из радуги.Поляризованный свет используется для выявления внутренней информации в этих образцах, которая в противном случае может быть не видна.
На этой фотографии изображена лекарственная фольга Merck®, назначаемая при астме. Микрофотография была сделана с использованием поляризованного света и показывает кристаллы, которые образовались при испарении химического вещества и высушивались после растворения твердой таблетки в горячей воде. На этой фотографии также виден край покровного стекла, которое я использовал при препарировании, толщиной 0,15 мм. Цвета представляют различные компоненты химического вещества.Картинка увеличена примерно в 15 раз. Майкл ПересФокусировка при съемке микроскопических фотографий
Чтобы сфокусировать увеличенное изображение с помощью цифровой зеркальной камеры, я снимаю объектив камеры и проецирую изображение прямо на корпус камеры цифровой зеркальной камеры. Затем элементы управления фокусировкой микроскопа используются для фокусировки изображения в видоискателе камеры. Создание четкого изображения может быть сложной задачей. Видоискатель DSLR не улавливает столько мелких деталей, сколько может создать микроскоп, поэтому в видоискателе вещи часто выглядят немного грубее, чем в файлах RAW.Требуется некоторая практика, чтобы предсказать, как будет выглядеть изображение после записи.
Также можно сфокусироваться в режиме live view. В тускло освещенной комнате это может быть очень полезно для наблюдения за четкостью изображения в образце. Если вы используете смартфон, который был осторожно расположен над окуляром, вы все равно захотите сфокусировать изображение, отображаемое на дисплее телефона, манипулируя ручкой фокусировки микроскопа.
Обработка ваших микроскопических изображений
Одна из самых больших проблем в этом типе работы — создание контраста и структурных очертаний внутренних частей, и я стараюсь усердно работать во время съемок.Когда я фотографирую, я медленно работаю, чтобы добиться интересного результата с использованием линз и света.
Я очень осторожно отношусь к обработке слишком большого количества изображений. В постобработке меня больше всего интересует управление тоном, установка белых или черных точек и удаление ненужных загрязнений. Я снимаю в формате RAW, открываю файл RAW в Photoshop, а затем предварительно обрабатываю структурные детали, которые присутствуют в файле, но часто не очень заметны. На этом этапе я также выполняю небольшое уточнение или заточку.Внеся незначительные изменения тона в Photoshop, я увеличу резкость файла с помощью высокочастотного фильтра.
Кристалл льда имел размер примерно 1,5 мм. Температура была 21 F. Этот тип снежинки называется звездным дендритом. Майкл ПересЯ думаю, что важно, чтобы изображения не были полностью безупречными. В жизни нет ничего идеального, и я думаю, что если изображения слишком идеальны, они могут показаться сгенерированными компьютером. Моя цель в этой работе — делать научные фотографии, которые работают в ненаучной среде и позволяют людям узнать что-то новое о мире, в котором они живут.На моих фотографиях изображены реальные вещи, и в жизни также есть пятна и участки, которые не в фокусе.
На этой фотографии изображен химический оксибензон, входящий в состав солнцезащитного крема. Микрофотография была сделана с использованием поляризованного света и показывает кристаллы, которые образовались при испарении и сушке химического вещества. Цвета представляют различные компоненты химического вещества. Изображение увеличено примерно в 35 раз. Майкл ПересГалереи цифровых изображений и видео
Категории
Запись изображений, наблюдаемых в оптический микроскоп, имеет первостепенное значение для студентов, преподавателей, ученых и технических специалистов как в образовательной, так и в промышленной среде.Цифровые галереи изображений MicroscopyU содержат более 1500 неподвижных изображений и видео, которые представляют широкий спектр образцов, полученных с использованием классических методов освещения: светлого поля, дифференциального интерференционного контраста (ДИК), флуоресценции, Рейнберга, темного поля, отраженного света, модуляции контраста Хоффмана, фазового контраста. , и поляризованный свет.
Галерея техники
Конфокальная микроскопия
Наслаждайтесь красотой автофлуоресценции на толстых срезах тканей животных и растений.
Фильмы
Фазовый контраст
Поля обзора образца, исследованные с использованием положительного и отрицательного фазового контраста.
Сравнение изображений
Поляризованный свет
Покадровая видеосъемка химических веществ, переходящих из твердого в жидкое состояние.
Сравнение изображений
Стереомикроскопия
Флуоресцентные образцы, полученные с помощью стереомикроскопов Nikon.
Изображения
Галереи приложений
Подвижность клеток
Исследуйте подвижность клеток с помощью микроскопии дифференциального интерференционного контраста (ДИК).
Фильмы
Патология человека
Яркие изображения фиксированных и окрашенных срезов патологических тканей человека.
Изображения
Nikon’s Small World считается ведущим форумом, демонстрирующим красоту и сложность жизни, увиденной через световой микроскоп.Уже более сорока лет конкурс Nikon Small World Competition объединяет фотографов-микрографов всех уровней и дисциплин и объединил их в конкурсе, который по-настоящему отмечает и чтит пересечение науки и искусства.
Конкурс микрофотографий
Конкурс микрофотографии «Маленький мир» Nikon отмечает выдающиеся достижения в фотографии с помощью светового микроскопа.
Изображения
Советы по созданию лучших снимков с помощью микроскопа
Доктор.Роберт Бердан
6 июня 2018 г.
Коловратка Testudinella patina вид снизу (черепаха коловратка) — микроскопия 200X DIC
стопка из 4 изображений.
Посмотрите видео этого коловратки доктора Ральфа Вагнера на YouTube.
В этой статье я поделюсь некоторыми советами о том, как лучше делать микрофотографии с помощью светового микроскопа. Световой микроскоп может увеличивать образцы от 10 до 1500 раз, но сверх этого длина волны света ограничивает разрешение.Большинство микроскопов с хорошей оптикой способны различать объекты размером до 0,2 микрона или 0,0002 мм (примерно половина длины волны зеленого света). Этого достаточно, чтобы видеть и фотографировать клетки и бактерии, но не вирусы. Существуют новые световые микроскопы со сверхвысоким разрешением, которые могут разрешать объекты меньшего размера, но эти микроскопы доступны только в исследовательских учреждениях и стоят дороже, чем дом. Доступные световые микроскопы можно купить от 100 до 1500 долларов. Адаптеры для камер микроскопов начинаются с 20 долларов и доходят примерно до 1000 долларов, также есть адаптеры для сотовых телефонов.Amazon продает адаптер для iPhone за 20 долларов.
Выше представлены два адаптера микроскопа для присоединения вашей цифровой SLR-камеры к микроскопу — оба доступны в AM-микроскопах в Калифорнии. Адаптер слева работает без окуляра, но обычно дает некоторое виньетирование (затемнение) по краям изображения, особенно с полнокадровыми цифровыми камерами. Эти темные области можно обрезать с помощью редактора изображений. Адаптер справа обеспечивает полнокадровые изображения лучшего качества.
Я также использую адаптеры для камеры Olympus, которые вы можете увидеть и прочитать на веб-сайте Алана Вуда. Убедитесь, что диаметр трубки подходит для любого микроскопа, который у вас может быть, поскольку некоторые трубки микроскопа имеют больший диаметр, чем другие. Есть также много других поставщиков фотоэлементов.
Выше моя камера Nikon D300, прикрепленная к одному из моих стереомикроскопов с помощью системного адаптера AM. Обратите внимание на черную ленту электрика на трубке, которую я использую для прикрепления удлинительных трубок и других принадлежностей, когда это необходимо.
Вещи, которые нужно снимать или снимать с помощью микроскопа
1. Микроскоп
2. Цифровая камера — предпочтительно цифровая зеркальная камера с одним объективом (DSLR)
3. Способ крепления камеры к микроскопу — см. Адаптеры, показанные выше
.
4. Некоторые знания в области фотографии, микроскопии и исследуемых образцов
На этой фотографии показано, что раньше было моей фотолабораторией, но теперь она была преобразована в рабочую зону для микроскопии с несколькими микроскопами, каждый из которых имеет насадки для фототрубок.На моем ноутбуке установлено управляющее программное обеспечение Digicam для записи изображений напрямую через USB-соединение с камерами. У каждого микроскопа свой адаптер для фотоэлемента. Слева мой участок подготовки проб с кувшином, наполненным прудовой водой.
Выше представлена микрофотография собачьей блохи ( Ctenocephalides canis ), сделанная с помощью светлопольной микроскопии при 50-кратном увеличении — светлопольные микроскопы хороши для таких объектов с высоким контрастом. Также обратите внимание, что фоновое освещение ровное.Если у вас есть грязь и пятна на фотографии, их можно легко удалить с помощью редактора изображений, но не нарушайте биологическую целостность вашего образца.
Phylum Platyhelminthe, OrderTricladia (Planarians), также называемый плоскими червями 50X, с 5 парами глаз с правой стороны, возможно Polycelis coronata . Я нашла этот необычный вид, обитающий во мхе. ДИК-микроскопия, Zeiss Axioscope.
Для фотосъемки через микроскоп необходимо иметь базовые знания о том, как пользоваться микроскопом — основы легко усвоить.Вы также можете использовать несколько различных видов освещения. Самый распространенный метод называется светлым полем, когда белый свет используется для освещения образца. Микроскопы с ярким полем хорошо подходят для просмотра слайдов гистологии, пивных дрожжей, частей насекомых или блох (показано выше). Это не очень хорошо для большинства живых клеток или большинства прудовых организмов, потому что они (например, щечные клетки и простейшие) по сути являются мешками с водой и кажутся полупрозрачными. Вы можете окрасить клетки, но в конечном итоге большую часть времени вы будете смотреть на мертвые клетки.К счастью, есть методы, которые вы можете приобрести или добавить к своему микроскопу, чтобы сделать прозрачные объекты, такие как клетки, более заметными или красочными.
Простая техника — использовать два поляризационных фильтра, добавить микроскопию темного поля (специальные фильтры или вы можете просто положить монетку на источник света), наклонное освещение (вставьте поддон фильтра наполовину), фильтры Рейнберга, фазовый контраст, модуляцию Хоффмана , Флуоресцентное освещение и Дифференциальная интерференционная оптика (ДИК). Некоторые из этих методов просты и дешевы, другие, подобные двум последним, являются дорогостоящими.
Paramecium caudatum , сфотографировано с помощью микроскопии Darkfield 400X. Есть специальные конденсаторы микроскопов, которые производят этот тип света, но вы часто можете имитировать его, поместив монету или другой небольшой предмет на фильтр или источник света. Посмотрите это видео на YouTube о конденсаторах Darkfield и просмотрите ссылки ниже на статью о том, как создать свои собственные фильтры Darkfield.
Paramecium caudatum сфотографировано с помощью дифференциальной интерференционной микроскопии 400X DIC позволяет видеть невероятные детали в трехмерном виде, к сожалению, оптика DIC стоит дороже> 10 000 долларов.Один исследователь из Австралии утверждает, что может смоделировать DIC-эффект с помощью программного обеспечения, но до сих пор не ответил на мои электронные письма. В будущем возможно будет создавать изображения, подобные показанным выше, с помощью программного обеспечения. Другой простой метод — наклонное освещение, которое также может давать эффект, аналогичный ДИК-микроскопии (см. Ниже).
Косое освещение создается за счет того, что фильтрующий лоток под конденсатором частично блокирует источник света.Эффект аналогичен ДИК-микроскопии, его можно получить практически с помощью любого микроскопа — и это бесплатно. Бделлоидная коловратка и филамент водорослей — Spirogyra 400X.
Köhler Подсветка для равномерного освещения
Равномерное освещение — важный фактор в получении хороших микрофотографий. Если вы этого не сделаете, у вас будет неравномерное освещение по краям или на одной стороне изображения. Впоследствии это можно исправить в Photoshop (посмотрите, как исправить неравномерное освещение на изображениях с цифровой микроскопии, но проще и лучше просто правильно настроить свет (см. Ссылки ниже, чтобы узнать, как это сделать).В некоторых микроскопах используются встроенные источники света, в других есть зеркало, отражающее свет до образца. Оба могут быть эффективными при условии, что они предлагают источник яркого света и микроскоп имеет хороший конденсор. Использование синего матового фильтра также часто помогает сгладить освещение.
Многие новые микроскопы теперь используют светодиодную подсветку, потому что она яркая, экономичная и работает тысячи часов. На eBay вы можете купить один для своего старого микроскопа — он стоит от 150 до 500 долларов (см. Ссылку ниже), и это отличный способ возродить старый микроскоп.У меня был один, сделанный для моего микроскопа Nikon Optiphot, и он хорошо подходит для микрофотографии.
Вверху фотографии — один Paramecium caudatum, а ниже — два деления Paramecium — ДИК-микроскопия 400X. Обратите внимание, насколько четко вы видите реснички.
Источники света
Яркий свет не требуется для просмотра, но он нужен для использования высокой скорости затвора при фотосъемке. Высокая скорость затвора может остановить быстро движущихся простейших и уменьшить потерю резкости из-за вибраций, вызываемых движением зеркала камеры.Некоторые фотографы используют афокальный метод, чтобы прикрепить камеру к микроскопу. По сути, камера расположена над тринокулярным тубусом микроскопа, так что камера не касается микроскопа. Его можно использовать с компактными фотоаппаратами, телефонными камерами и даже цифровыми зеркальными фотокамерами. Фотографы иногда используют подставку для копий или другую опору, чтобы удерживать камеру неподвижно, например см. статью Чарльза Кребса о микрофотографии.
Я не использую афокальный метод, я предпочитаю прикреплять камеру непосредственно к микроскопу с помощью адаптера.Другой метод повышения резкости — использование высокоскоростной вспышки в качестве источника света. Некоторые фотографы встроили в свой источник света вспышку. Другие помещают плоскую вспышку под предметный столик или откладывают вспышку в сторону и используют светоделитель. См. Ссылки на статьи Дэвида Уокера ниже о том, как он прикрепляет вспышку к микроскопу. Дэвид описывает один метод с использованием покровного стекла или предметного стекла под углом 45 градусов над источником света, чтобы свет снизу проходил сквозь него, а также отражал свет электронной вспышки до образца.
В идеале вы хотите, чтобы вспышка была подключена к камере с помощью кабеля и у вас была возможность использовать TTL-замер (через объектив). Я попытался отразить вспышку с помощью предметного стекла микроскопа, и это сработало, но при отражении от обычного стекла немного света теряется, поэтому я заказал делитель луча 50/50 из Китая на E-bay, и как только он появится, я проверим очередной раз. Моя цель — использовать синхронизацию 1 \ 8000 секунды с моей камерой Nikon D500.
Освещение, создаваемое вольфрамовым источником света мощностью 100 Вт на моем микроскопе Zeiss Axioscope, очень яркое, и я могу достичь 1 \ 8000 секунды при ISO 800, но хотел бы иметь возможность достичь этого при ISO 100 или 200, если это возможно, чтобы я мог получить более мелкую зернистость цифровых изображений с помощью DIC.В другие мои микроскопы встроены источники света, подходящие для просмотра, но не допускающие высоких выдержек. Если вы добавите пару поляризационных фильтров и волновую пластину, это действительно уменьшит свет и уменьшит скорость затвора, которую можно использовать.
В течение многих лет я использовал старый слайд-проектор Kodak в качестве источника света и отражал свет от зеркала микроскопа на образец. Совсем недавно я нашел более яркий источник света, купив фонари Nite Core на 2800 люмен (обязательно используйте только их батареи — также обратите внимание, что они дешевле, если вы заказываете из США, а не из Канады).Эти новые вспышки высокой интенсивности позволяют мне изменять интенсивность света, и я также использую их со своими стереоскопами. Я устанавливаю вспышки на настольную микрофонную стойку за 15 долларов (см. Ниже).
Светодиодная вспышка Nitecore с яркостью до 2800 люмен и регулируемой световой мощностью. Когда фонарь прикреплен к портативной настольной микрофонной стойке, он маленький и портативный.
Короче говоря, важно настроить освещение микроскопа так, чтобы оно равномерно распределялось по образцу и было достаточно ярким для фотосъемки, позволяя короткую экспозицию движущихся образцов.На подготовленных или гистологических слайдах объект не двигается, поэтому не нужен источник яркого света, просто даже освещение — найдите время, чтобы настроить освещение, поскольку это один из самых важных компонентов для получения лучших микрофотографий.
Баланс белого
Для цветной пленки было важно использовать специальную пленку с вольфрамовой подсветкой или использовать фильтры коррекции цвета (синие), чтобы повысить температуру видимого света примерно до 6500 К.С помощью цифровых камер вы можете либо установить баланс белого на камере, либо снимать файлы RAW и настраивать баланс белого во время обработки. Обычно я фотографирую с файлами RAW и корректирую баланс белого во время обработки в Adobe Photoshop Camera RAW.
Фотографии вверху инфузорий, семейство Parameciidae, возможно, Uroncentrum turbo ДИК-микроскопия 400X. Эти инфузории передвигаются очень быстро. Они удлиненно-яйцевидные и закругленные с обоих концов, с одной большой ресничкой или усиками, отходящими снизу (не показаны — эти инфузории 75 микрон в высоту).
Уменьшение размытия, вызванного вибрацией
У тяжелого и прочного микроскопа будет меньше вибраций, чем у легкого прицела на хрупком основании. Чтобы проверить наличие вибрации, осторожно коснитесь прикрепленной камеры к микроскопу — легко ли она вибрирует? Я также использую ту же технику, чтобы определить, какие штативы устойчивы. Размытие из-за вибрации — распространенная проблема. Использование короткой выдержки или электронной вспышки поможет уменьшить размытость.
Еще одна простая вещь, которая может помочь уменьшить вибрацию, — это использование антивибрационных прокладок под микроскопом.Некоторые дилеры продают антивибрационные прокладки, есть также дорогие антивибрационные столы, плавающие в воздухе, но они стоят тысячи долларов. Я использовал воздушный стол в своем исследовании, когда делал электрические записи клеток мозга много лет назад, и они великолепны, но мои стоили около 7000 долларов! Вы также можете использовать прочное основание из мрамора под микроскопом и убедиться, что у вас есть прочный стол для поддержки микроскопа. Одно из лучших решений, которое я нашел, — это купить резиновые прокладки толщиной 1 \ 4 дюйма, используемые в спортзалах или полах тренажерных залов.Эти тяжелые резиновые подушечки стоят около 18 долларов за квадратную подушку размером 2 фута и могут быть обрезаны до нужного размера с помощью ножа X-acto. Они мне так понравились, что я сделал подушечки для всех своих микроскопов (см. Ниже). Они имеют большое значение и стоят меньше, чем любое другое решение, которое я нашел до сих пор.
Слева от моего старого микроскопа Olympus E, которым я владею 45 лет, а сверху — адаптер для подключения фотоаппарата Nikon D300. У камеры также есть спусковой тросик, чтобы еще больше уменьшить вибрацию затвора. Справа — стереоскоп Olympus Zoom, обеспечивающий до 50X, используемый в качестве микроскопа для препарирования.Обратите внимание на антивибрационные прокладки под каждым прицелом, вырезанные из резинового напольного покрытия толщиной 1 \ 4 дюйма. Это простая установка для получения снимков с помощью светового микроскопа. Резиновые прокладки можно приобрести в некоторых хозяйственных магазинах.
Paramecium caudatum в окружении более мелких эвгленоидов, 400-кратная ДИК-микроскопия.
Микроскоп
Самый важный фактор для получения хороших снимков, помимо навыков фотографа, — это оптика микроскопа.Окончательное изображение представляет собой комбинацию изображений, полученных с помощью объективов и окуляра. Из них наиболее важными являются цели. Объективы микроскопов бывают разных типов: ахромат, планахромат, флюорит (полуапохромат) и апохромат. Если ваша цель — фотография, я бы постарался приобрести объективы Plan Achromat или лучше. Планахроматы исправлены на сферическую аберрацию и предлагают плоское поле обзора. Объективы ахроматов резкие только в центре поля зрения, и это не может быть исправлено с помощью редактора изображений.Планахроматы обеспечивают поле плоского поля, резкое по краям — эти объективы могут демонстрировать некоторые хроматические аберрации (цветную окантовку), но это можно исправить в редакторе изображений, или вы можете использовать свет одного цвета (зеленый) или преобразовать ваши фотографии в черно-белые. Большинство моих фотографий сделано с помощью объективов Plan Achromat, которые относительно доступны. Если вам удастся достать объективы из флюорита или апохромата, они лучше скорректируются оптически, но могут стоить в 10-20 раз дороже, чем объективы из планахромата.У меня есть две цели Apochromats, но сейчас я не могу позволить себе покупать больше. (Обратите внимание, что старые объективы имели фиксированное фокусное расстояние обычно 160 мм, тогда как новые объективы корректируются на бесконечность — вы не можете поменять их местами без потери качества изображения — я использую оба типа на разных микроскопах).
Яркое поле и косое освещение инфузории Holotrich 400X Zeiss Axioscope.
Окуляры для микрофотографии
Окуляр, используемый для микрофотографии, важен.В течение многих лет я использовал фотоокуляры Olympus FK, которые обеспечивают плоскую проекцию для фотографии (доступны 2,5, 3,3 и 5X — есть 1,6X, но редко и очень дорого). Другие производители также предлагают специальные окуляры, предназначенные для микрофотографии. Если возможно, для получения наилучших результатов попробуйте использовать один из них, а не обычные окуляры, используемые для просмотра через микроскоп. Адаптер для микроскопа, который я купил у AM systems примерно за 100 долларов, работает достаточно хорошо. Также при прикреплении камеры к микроскопу, если адаптер микроскопа не подходит к креплению объектива камеры, я прикрепляю к адаптеру короткую удлинительную трубку с помощью черной электротехнической ленты, а затем прикрепляю ее к моей DSLR (цифровой однообъективной зеркальной камере). .Вы можете использовать адаптер удлинительной трубки Nikon для Nikon и адаптер Canon для зеркальной камеры Canon. Подробнее о фотоокулярах Olympus FK читайте в статье Чарльза Кребса. Моя фототрубка Zeiss Axioscope поставляется с линзой внутри, но одна трубка стоит около 1000 долларов, а адаптеры для Nikon или Canon стоят 75 долларов каждый.
Gastrotricha Обратите внимание на хвостовые зубцы и усы. Иногда их называют «кошками» микромира. Chaetonotus similis ДИК-микроскопия 400X.Внизу небольшой евгленод.
Бделлоидная коловратка встречает инфузорию. Обратите внимание на красные глаза на переднем конце коловратки и еще одну пару внутри, предположительно молодого животного в стадии развития. Микросопия 200X DIC.
В идеале, если вы планируете фотографировать с помощью микроскопа, я рекомендую вам приобрести тринокулярную насадку. Вы можете прикрепить камеры к монокулярному микроскопу или даже к бинокулярным головкам, но это одновременно затрудняет просмотр через микроскоп.Один из вариантов, который может быть полезным, — подключить цифровую зеркальную камеру через порт USB к компьютеру и просматривать изображение на экране во время фотосъемки. Есть несколько программ, которые это делают. Я использую Digicam control, программное обеспечение бесплатное и поддерживает все мои камеры Nikon и Canon. Вы даже можете подключить несколько камер и использовать их для создания видеороликов или для интервальной фотосъемки. Его также легко освоить, и в нем есть специальная функция, которая превращает экран в красный цвет для тех, кто хочет использовать его с астрофотографией.На данный момент он доступен только для компьютеров на базе Microsoft. Вы можете бесплатно загрузить программное обеспечение управления Digicam отсюда. Используя это программное обеспечение, вы можете просматривать изображение на ноутбуке, для чего требуется, чтобы камера находилась в режиме Live View, где зеркало заблокировано, и, следовательно, нет вибрации, вызванной «хлопком» зеркала при съемке. Любой, кто делает снимки с помощью микроскопа, должен взглянуть на это программное обеспечение. Программное обеспечение также позволяет увеличивать масштаб экрана, чтобы добиться лучшей фокусировки. Обратной стороной является то, что при использовании камеры в режиме Live View аккумулятор быстрее изнашивается, поэтому запасные аккумуляторы должны быть наготове.В режиме Live View я разряжаю батареи примерно на 1-2 часа. Другой заключается в том, что поле зрения часто меньше, чем при просмотре через бинокулярные окуляры, и следить за быстро движущимися образцами непросто.
Крупная сократительная инфузория длиной более нескольких сотен микрон. Имеет отчетливое многодольчатое макронуклеус и длинные реснички (оральные поликинетиды) на одной стороне переднего конца — возможно, Spirostomum minus. ДИК-микроскопия 200X.
Spirostomum минус 200-кратная ДИК-микроскопия.
Изображение, показывающее, как эта большая инфузория Spirostmum минус сравнивается с парамецием длиной 120 микрон.
Накопление фокуса
При макросъемке и микрофотографии с большим увеличением глубина резкости очень мала. Чем больше увеличение, тем меньше глубина резкости. При большом увеличении с использованием объективов 40X, 63X и 100X ваша глубина резкости может составлять микрон или меньше. Чтобы компенсировать это, я часто делаю серию фотографий в разных точках фокусировки, а затем объединяю изображения, складывая их в одно.Я видел, как некоторые фотографы используют до 160 изображений для наложения, в основном я использую от 3 до 40 большую часть времени. Техника проста в использовании в Photoshop, или вы можете использовать специальную программу наложения фокуса, например. Геликон Фокус. Недавно я рассмотрел три программы для суммирования фокуса для микрофотографии — прочтите об этом здесь, если хотите увидеть, на что оно способно. На мой взгляд, суммирование фокуса важно для многих образцов, просматриваемых с использованием объективов 20X или выше, и дает превосходные фотографии.
Amoeba Test или раковина, принадлежащая Arcella sp . (Отряд Arcellinida). Некоторые амебы живут внутри своих раковин, и только их ложноножки выходят за пределы дна. Вы можете увидеть круглое отверстие около середины, через которое амеба могла выходить наружу. Оболочка амебы была пуста. Я сложил 6 фотографий, чтобы создать это изображение в 200 раз.
Micrasterius — это десмидные одноклеточные водоросли, образующие узорчатые узоры. Чтобы сфокусировать это, я использовал 15 изображений и сложил их стопкой.ДИК-микроскопия 400X (диаметр 143 мкм).
Cosmarium sp Desmid — Я сложил 6 изображений, чтобы создать эту фотографию — DIC-микроскопия 400X (диаметр 50 микрон, не включая внешнюю оболочку слизистой оболочки Cosmarium contractum ?)
Cymbella видов диатомовых водорослей — Я сложил 12 изображений, чтобы создать эту фотографию, микроскопия 400X DIC (длина 85 микрон).
Правильная толщина покровного стекла (покровного стекла) критическая
Покровное стекло обычно представляет собой небольшой квадратный или круглый тонкий кусок стекла, который используется для покрытия образцов, установленных на предметных стеклах микроскопа.Большинство объективов микроскопов приспособлены для использования с покровными стеклами № 1.5, которые в среднем имеют толщину 0,17 мм. Некоторые объективы микроскопов имеют специальные манжеты, которые можно поворачивать для корректировки покровных стекол разной толщины, а некоторые объективы предназначены для работы без покровных стекол, например металлургические микроскопы. Интересно то, что некоторые микроскописты используют покровные стекла № 1, которые тоньше — они утверждают, что важна общая толщина образца и покровного стекла.Также следует отметить, что в любой коробке покровных стекол всегда есть некоторые различия в толщине, но для достижения наилучших результатов для большинства образцов я рекомендую использовать покровное стекло № 1.5 или № 1.0. См. Эту статью Nikon, в которой показано изображение с правильной и неправильной толщиной покровного стекла. Также может быть важна среда, используемая для просмотра образцов — чем больше разница в показателях преломления среды и образца, тем больше контраст, что важно при постоянной установке диатомовых водорослей.
Замедление простейших и других пресноводных беспозвоночных.
Еще один совет, который я использую для получения высококачественных изображений простейших, — это расплющить покровное стекло на образце, вытягивая воду бумажным полотенцем или куском фильтровальной бумаги. Это делает 2 вещи: он улавливает крупные микроорганизмы, чтобы они не могли перемещаться, и он несколько сглаживает их тела, позволяя мне сосредоточиться на одной части организма или сделать серию фотографий, а затем сфокусировать стопку изображений. Вначале микроскописты использовали специальные устройства, называемые компрессориями.Даже современные ученые используют вариации этих компрессоров для фотографирования и видеосъемки клеток — например, JA Zinskie et al 2015 . Я нахожусь в процессе изготовления и тестирования некоторых из этих устройств, но на данный момент техника фильтровальной бумаги, кажется, хорошо работает для большинства небольших предметов.
Включение камеры в режиме громкой связи
Еще одна полезная функция, которую я иногда использую, — это использование ножной педали USB для срабатывания затвора камеры. Благодаря этому обе мои руки остаются свободными, поэтому я могу следить за движущимися образцами с помощью перемещения предметного столика микроскопа и менять фокус.Эти триггеры доступны на Amazon.ca примерно за 20 долларов и подключаются к вашему ноутбуку, вы можете настроить их с помощью управляющего программного обеспечения Digicam и драйверов, которые они предоставляют.
Инфузории Hypotrich, прикрепленные встык с отчетливыми мембранами вокруг ротовой области. Общая длина этой пары инфузорий составляла 225 мкм.
Пелликул Paramecium 600X с использованием ДИК-микроскопии. Мне пришлось сгладить и захватить Парамеций, чтобы увидеть и сфотографировать этот тонкий узор на поверхности Парамециума.
Существует множество методов замедления и сохранения водных микроорганизмов — для хорошего обзора см. Статью Джона Делли.
Используя кусок бумажного полотенца или фильтровальную бумагу, я прикасаюсь краем бумаги к краю покровного стекла, чтобы высосать лишнюю воду, которая затем расплющивает покровное стекло на образцах. Это часто обездвиживает более крупные микроорганизмы, облегчая фотографирование — это легко, просто и работает. Также избегайте пластиковых покровных стекол, они не такие прозрачные, как стекло.
Чтобы получить хорошие снимки в фотографии и микрофотографии, часто нужно заботиться о мелких деталях. Важны такие мелочи, как толщина покровного стекла, гашение вибраций, использование Live view, использование высокой скорости затвора, использование чистой оптики и чистых стеклянных слайдов, высокая интенсивность света и даже толщина образца.
Инфузория, показывающая диатомовые водоросли внутри 400-кратной ДИК-микроскопии и фокусного стека Общая длина инфузорий 310 мкм. Неизвестный вид — Loxodes sp ?
Если вы не получаете резких изображений, вы должны систематически пытаться определить причины и внести коррективы.Я всегда пытаюсь настроить свое оборудование, чтобы делать фотографии чуть резче. В микроскопии имеет значение оборудование и техника. Способ обработки цифровых изображений также может иметь большое значение — я использую маску нерезкости и функцию четкости в Adobe Camera RAW, чтобы попытаться выжать из фотографии как можно больше резкости. Обратите внимание, что в прошлом микроскописты могли создавать потрясающие изображения с помощью пленочных фотоаппаратов и старых микроскопов — для вдохновения посмотрите микрофотографии диатомовых водорослей, сделанные Джоном Редмэйном в 1877 году.
Таким образом, получение хороших микрофотографий — это сочетание знаний и практики. Важны знания в области микроскопии, фотографии, редактирования изображений и подготовки образцов. К счастью, в Интернете можно найти множество информации и экспертов, готовых дать совет. Если вы хотите попробовать микрофотографию, я с радостью предоставлю вам бесплатную консультацию, а также предлагаю индивидуальное обучение в своей студии всем, кто заинтересован. РБ
Ссылки по теме
Оптическая микроскопия М.В. Дэвидсона и М.Абрамовиц — Превосходный обзор — бесплатный PDF
Микроскопия с самого начала — хороший обзор микроскопии от Zeiss — бесплатный PDF
UK microscopy — веб-сайт по всем аспектам световой микроскопии
Quality Microscopes в Калгари
Инструкции Zeiss по настройке освещения Колера.
Настройка подсветки Колера на исследовательском микроскопе Zeiss — видео
Быстрая микрофотография со вспышкой на микроскопе со встроенной лампой — Дэвид Уокер
Простая установка вспышки / вольфрамового освещения для микроскопа со встроенной базовой лампой — Дэвид Уокер
Наркотизирование, замедление роста и сохранение микроскопических и других водных животных — J.Делли.
Иммобилизация живых образцов для наблюдения под микроскопом — бесплатно PDF
AM микроскоп Адаптеры для прикрепления камер к микроскопу
Reviving и Old microscope
Легко сделать фильтры для повышения контрастности, включая фильтры темного поля
Как делать цифровые фотографии с помощью микроскопа без специальных линз
Как использовать микроскоп и сделать микрофотографию — Nikon PDF
Микроскопические методы фотографии прошлого, настоящего и будущего — PDF
Ссылка: Иллюстрированное руководство по простейшим, 2-е издание (2000 г.), Общество протозоологов.
Статьи Роберта Бердана по теме микроскопии на этом веб-сайте
1. Микроскопические прудовые организмы из Силвер-Спрингс, Калгари
2. Микроскопическая жизнь в прудах и дождевой воде — прудовая пена I
3. Фотосъемка микроскопических растений и животных — прудовая пена II
4. Микрофотография и видео простейших, вольвокса и коловраток
5 Лаборатория микрофотографии для домашней микроскопии
6. Искусство и наука микрофотографии в поляризованном свете
7.Фотосъемка через микроскоп Микрофотография — внутреннее пространство
8. Совмещение фокуса для сравнения Photoshop, Helicon Focus и Zerene
9. Фильтры Рейнберга для микрофотографии
10. Сканирующая электронная микроскопия — Фотография
11. Микрофотографии диатомовых водорослей 1877 года, сделанные Джоном Т. Редмэйном
Биография и контактная информация авторов
Роберт Бердан — профессиональный фотограф природы, живущий в Калгари, штат Алабама, специализирующийся на фотографии природы, дикой природы и научных исследований.Роберт ушел из исследований Cell \ Neurobiology, чтобы полностью посвятить себя фотографии несколько лет назад. Роберт предлагает фото-гида и частные инструкции по всем аспектам фотографии природы и обучение Adobe Photoshop.
Электронная почта: [email protected]
Веб-сайт: www.canadiannaturephotographer.com
Телефон: MST 9: 00-19: 00 (403) 247-2457.
Нажмите на кнопки ниже и поделитесь этим сайтом со своими друзьями
Цифровые изображения в оптической микроскопии
Обзор раздела:
Оцифровка видео или электронного изображения, снятого с помощью оптического микроскопа, приводит к значительному увеличению возможностей улучшения характеристик, извлечения информации или изменения изображения.По сравнению с традиционным механизмом захвата изображения, микрофотография на пленке, цифровое изображение и обработка после получения позволяют обратимую, практически бесшумную модификацию изображения в виде упорядоченной матрицы целых чисел, а не серии аналоговых вариаций цвета и интенсивности. . В этом разделе рассматриваются различные актуальные темы получения и обработки изображений для оптической микроскопии.
Обзорные статьи
-
Концепции в технологии цифровых изображений
В этом разделе рассматриваются такие темы, как работа ПЗС, биннинг, цветение, захват изображения, динамический диапазон, фотодиоды, фотоумножители и цифровая обработка изображений, а также многое другое.
-
Основные свойства цифровых изображений
Прочтите в этом разделе об основных свойствах цифровых изображений. Цифровое изображение состоит из прямоугольного (или квадратного) массива пикселей, представляющего серию значений интенсивности и упорядоченных в организованной системе координат ( x , y ).
-
Электронные детекторы изображения
Это обсуждение призвано помочь в понимании основ обнаружения света и предоставить руководство по выбору подходящего электронного детектора (системы CCD или видеокамеры) для конкретных приложений в оптической микроскопии.
-
Основы видеоизображения
Оптические изображения, полученные с помощью микроскопа, могут быть получены с использованием традиционных методов пленки, в цифровом виде с помощью электронных детекторов, таких как устройство с зарядовой связью (ПЗС), или с помощью видеокамеры трубчатого типа.
-
Введение в датчики изображения CMOS
Датчики изображенияCMOS разработаны с возможностью интеграции ряда функций обработки и управления, которые выходят за рамки основной задачи сбора фотонов, непосредственно в интегральную схему датчика.
-
Основные концепции цифровой обработки изображений
Цифровая обработка изображений позволяет практически без шума изменять изображение в виде матрицы целых чисел вместо классических манипуляций в темной комнате, необходимых для аналоговых изображений и видеосигналов.
-
Рекомендуемая стратегия обработки цифровых изображений
В зависимости от условий освещения, целостности образца и подготовки полученные изображения могут потребовать реабилитации для достижения баланса между научной точностью, косметическим равновесием и эстетической композицией.
-
Цифровая обработка изображений Интерактивные учебные пособия по Java
Изучите основные концепции цифровой обработки изображений, применяемые к образцам, снятым в микроскоп. Рассмотренные методы включают контраст, цветовой баланс, пространственное разрешение и многое другое.
-
Деконволюция в оптической микроскопии
Деконволюция — это вычислительно-интенсивный метод обработки изображений, который все чаще используется для улучшения контрастности и разрешения цифровых изображений, получаемых в микроскоп.
-
Набор инструментов для вычитания фона
В этом разделе обсуждаются подробности, касающиеся набора Olympus Background Subtraction Toolkit , который разработан для помощи приложениям обработки изображений, обеспечивая однородный фон для образцов, снятых в цифровом виде.
-
Набор инструментов для вычитания фона Загрузить
Изображение с цифрового микроскопа Olympus Набор инструментов для вычитания фона — это отдельная прикладная программа Java, которую можно использовать для создания однородного фона для захваченных цифровых изображений.
Цифровые камеры для оптической микроскопии
-
Система цифровых фотоаппаратов Olympus DP70
Olympus DP70 — это система цифровых цветных камер, в которой реализованы последние инновации в технологии формирования изображений, позволяющие получать превосходные изображения в самых требовательных современных микроскопах. Приложения.
-
Цифровая камера Olympus DP-10
Узнайте больше о последних инновационных функциях цифровой камеры Olympus DP-10, революционно новой цифровой камеры, специально разработанной для микрофотографии критических цветов.
Соавторы
Кеннет Р. Спринг — научный консультант, Ласби, Мэриленд, 20657.
Джон К. Расс — Отдел материаловедения и инженерии, Государственный университет Северной Каролины, Роли, Северная Каролина, 27695
Ренато Турчетта — Группа микроэлектроники, приборный отдел, лаборатория Резерфорда Эпплтона, Чилтон, Дидкот, OX11 0QX, Великобритания.
Мэтью Парри-Хилл , Джон К.Long , Thomas J. Fellers и Michael W. Davidson — Национальная лаборатория сильных магнитных полей, 1800 East Paul Dirac Dr., Университет штата Флорида, Таллахасси, Флорида, 32310.
»Анализ изображений при микроскопии«
Оптическая микроскопия стала одним из самых мощных методов в биомедицинские исследования, особенно в сочетании с цифровым изображением анализ. Поскольку в оптическом микроскопе используется видимый свет и система линзы для увеличения изображений, в отличие от электронов и электромагнитов присутствуют в электронных микроскопах, размер самых маленьких образцов и оптический микроскоп способен разрешать прямо пропорционально длина волны видимого света.Среди всех типов оптических микроскопов один разновидность флуоресцентного микроскопа, который использует флуоресценцию вместо отражение и поглощение как источник контрастности изображения.
Оптическая микроскопия сопряжена с множеством проблем при анализе цифровых изображений. В общем, объемы микроскопии по своей природе анизотропны, страдают от уменьшение контраста с глубиной ткани, отсутствие деталей на краях объекта и обычно имеют низкий уровень сигнала.
Анализ изображений мотивирован желанием количественно оценить биологические такие характеристики, как количество клеток и объем ткани.Этот проект предполагает разработку методов комплексного подхода к сегментация и регистрация наборов изображений прижизненной микроскопии. Изображение данные собираются с использованием одного из двух различных методов. Один набор данных Тип состоит из серии изображений, соответствующих фокальным плоскостям глядя глубже в ткани (трехмерные данные), и второй тип состоит из серии изображений, соответствующих последовательности времени экземпляры, отображающие одну фокальную плоскость (данные временного ряда). Анализ выполняется с помощью комбинации методов сегментации и регистрации, но осложняется такими факторами, как движение живого образца во время изображения получение.В частности, мы исследуем новые методы, которые использовать улучшение изображения, пространственную фильтрацию, жесткую и нежесткую регистрация, временная фильтрация и 2D и 3D сегментация.
Наша команда состоит из исследователей из Университета Пердью (Западный Лафайет). и IUPUI) и Центр усовершенствованных микроскопических исследований Индианы О’Брайен. Анализ , который является частью Медицинской школы Университета Индианы, Отделение нефрологии.
Наша команда разработала инструмент под названием Распределенный и сетевой анализ объемных данных изображения (DINAVID).
который может обрабатывать и визуализировать данные микроскопии через систему клиент-сервер.
Ссылка на описание DINAVID
Ссылка на систему DINAVID
Работа поддержана Премией Джорджа М. О’Брайена от Национального Институты здравоохранения NIH / NIDDK P50 DK 61594.
Эдвард Дж. Делп , профессор электротехники и вычислительной техники, Университет Пердью
Пол Салама , профессор электротехники и вычислительной техники, Университет Индианы — Университет Пердью
Кеннет В.Данн , профессор медицины, Университет Индианы
Ален Чен , Аспирант школы электротехники и вычислительной техники, Университет Пердью
Лиминг Ву , Аспирант, Школа электротехники и вычислительной техники, Университет Пердью
Фран Серрано , Бывший приглашенный студент
Кевин Лоренц , Лаборатория военно-морских исследований США
Нирадж Гадгил , Dolby Laboratories
Дэвид Джун Хо , Мемориальный онкологический центр им. Слоуна Кеттеринга
Чичен Фу , НИО
Сунам Ли , Qualcomm
Чанье Ян , Аспирант, Школа электротехники и вычислительной техники, Университет Пердью
Шо Хань , яблоко
Введение в микроскопическую фотографию
Лучшие фотографы внимательно относятся к деталям, даже к мельчайшим, самым простым деталям.Капли воды из крана, крошечные шипы красной розы и даже снежинки. Эти крошечные детали фиксируются объективом фотографа, и каждая из них рассказывает историю или цель.
Есть даже фотографы, которые сосредотачиваются на съемке этих крошечных объектов. Некоторые фотографы используют искусство микрографии или микроскопии для создания этих изображений.
Микроскопический снимок: стебель первогодка Pinus taiwanensis , поперечный разрез. Автор фото: 石川 Shihchuan
Микроскопия — это искусство создания фотографий с помощью микроскопа.Микроскоп создает изображение, называемое микрофотографией. Он производит художественную визуализацию предмета. Создание художественных изображений с помощью микроскопа практиковалось издавна, особенно в 70-е годы. В настоящее время микроскоп — это больше, чем просто прибор, используемый в научных и медицинских целях; он стал новым средством выражения художественных впечатлений на различных платформах.
Как создать микрофотографию
Обычно оптический микроскоп используется для создания микрофотографии или микрофотографии.Однако большинство фотографов просто подключают свою цифровую камеру к микроскопу, чтобы снимать фотографии с большим увеличением и небольших размеров. Для создания значимых, интересных и хороших изображений фотографу важно знать не только, как подключить микроскоп к цифровой камере, но также и то, что необходимо сделать с точки зрения техники, стиля и динамики камеры.
Таким образом, для фотографов-новичков очень важно следовать руководству.
Структура ячеек листа, 600x.Автор фото: small.pathological.ca
Руководство по микроскопии / микрографии
Прежде всего, вам нужно иметь подходящее оборудование, если вы хотите создавать хорошие микрофотографии. Ваше самое необходимое снаряжение должно включать:
Среди других важных предметов — дополнительные предметные стекла (чистые, конечно!), Ватные палочки или палочка с ватным наконечником для перемещения крошечных предметов, а также ткань, которую можно использовать в качестве фона (черный всегда лучший вариант).
Для цифровой зеркальной камеры рекомендуется камера с датчиком APS-C, поскольку она может увеличивать размер изображения до x 1.6 (по сравнению с полнокадровыми кузовами). Обязательно подвесьте корпус камеры над окуляром микроскопа с помощью штатива.
Чтобы получить хорошее окружающее освещение, используйте сильфоны и удлинительные трубки. В первую очередь используется встроенная подсветка микроскопа. Однако лучше добавить дополнительное освещение. Здесь на помощь приходит оптоволоконное освещение. Это поможет, если вы поэкспериментируете и сделаете несколько пробных снимков, прежде чем приступить к какой-либо серьезной работе.
Когда у вас есть все необходимое снаряжение, вы можете переходить к выбору хорошего предмета.Вы можете найти вдохновение практически во всем, что видите или не видите. Если, например, вы обнаружите, что на ковре в вашей гостиной скопилось несколько частиц « нежелательных », попробуйте выполнить небольшое действие Эйнштейна и собрать небольшое количество этих частиц с помощью щипца. Вы просто можете быть удивлены тем, что найдете! Крошечные брызги на стене или распустившийся цветок тоже могут быть действительно интересными объектами. Как всегда, позвольте себе остановиться на необычных нестандартных возможностях.
Микроскопия — крыло мухи. Фото BobMacInnes
Третий совет касается сосредоточенности. Увеличить крошечное изображение сложно, потому что нужно быть очень осторожным с элементами управления. Один из полезных приемов — сузить объектив камеры, чтобы изображение, которое вы пытаетесь захватить, проецировалось прямо на корпус камеры. Таким образом, вам не придется слишком беспокоиться о настройке фокуса камеры; вместо этого вы используете только элементы управления фокусировкой микроскопа. Однако для этого потребуется много практики, поскольку изображение в видоискателе камеры и под микроскопом будет выглядеть по-разному.
Совет номер четыре: сделайте объекты максимально естественными. Они не должны казаться идеальными, хореографическими или безупречными; в противном случае у людей может сложиться впечатление, что изображения были отредактированы в фотошопе, тщательно отредактированы или созданы на компьютере.
Дополнительная информация об освещении
При съемке крошечных объектов освещение решает все. Поэтому, даже если вы только начинаете, важно иметь хотя бы базовую информацию о различных стилях освещения, которые вы можете использовать для своих микроскопических снимков.
- Стиль освещения Darkfield : Если вы хотите добиться драматического эффекта, выберите стиль Darkfield. Расположив объект на черном фоне, вы создадите «блики , ».
- Kohler Style of Lighting : Если вы предпочитаете подсветку с нейтральным эффектом, освещение Kohler должно быть вашим стилем. Освещение ровное, что идеально, если вы хотите, чтобы ваши крошечные объекты достигли « портретного вида ».
- Поляризованное освещение : Если вы хотите, чтобы ваши крошечные объекты отображали цвета радуги, вам подойдет поляризованное освещение.Даже прядь волос окрасится радугой. Этот стиль освещения лучше всего подходит, если вы хотите раскрыть аспекты « невидимый » ваших объектов.
Эти советы для начинающих могут показаться вам довольно простыми, но они оказались действительно полезными. Лучше всего попрактиковаться, попрактиковаться и потренироваться, прежде чем выйти и сфокусировать камеру на мельчайших деталях.
Ресурсы для дополнительной информации
Искусство микроскопии или микрографии необходимо постоянно практиковать и изучать.Таким образом, важно позволить себе продолжать совершенствоваться. Вот некоторые онлайн-ресурсы (включая конкурсы), которые могут оказаться полезными:
Интернет-ресурсов:
Офлайн / Опубликованные ресурсы:
Со всеми этими советами и ресурсами вы готовы выйти из своей зоны комфорта и попробовать микроскопическую фотографию. Он уникальный, интересный и определенно может привлечь внимание зрителей. Как упоминалось ранее, важно практиковаться; даже мастера находят время для практики.Кроме того, не забывайте экспериментировать со своими кадрами.
Экспериментирование предоставит вам больше возможностей для создания самых творческих работ.

 Принято выделять следующие методы: светлого поля, темного поля, поляризационную микроскопию, люминесцентную (флуоресцентную) микроскопию, метод фазового контраста и некоторые другие. Большинство этих методов мы описывали в отдельных статьях, которые можно найти по ссылке.
Принято выделять следующие методы: светлого поля, темного поля, поляризационную микроскопию, люминесцентную (флуоресцентную) микроскопию, метод фазового контраста и некоторые другие. Большинство этих методов мы описывали в отдельных статьях, которые можно найти по ссылке. И, несмотря на то, что наблюдения ведутся в оптическом диапазоне, разрешение (четкость и контрастность) картинки при сканирующей оптической микроскопии во много раз превышают разрешение изображений, полученных с использованием классических микроскопов.
И, несмотря на то, что наблюдения ведутся в оптическом диапазоне, разрешение (четкость и контрастность) картинки при сканирующей оптической микроскопии во много раз превышают разрешение изображений, полученных с использованием классических микроскопов.
 ru
ru ru)
ru) ru)
ru)