Как устроена батарейка изнутри. Из каких компонентов состоит гальванический элемент. Какие химические процессы происходят внутри батарейки при ее работе. Какие бывают типы батареек и чем они отличаются. Как правильно выбрать и использовать батарейки.
Что такое батарейка и как она устроена
Батарейка — это химический источник тока, преобразующий энергию химической реакции в электрическую энергию. Основные компоненты батарейки:
- Анод (отрицательный электрод)
- Катод (положительный электрод)
- Электролит
- Сепаратор
- Корпус
- Токоотводы
Анод и катод погружены в электролит и разделены сепаратором. При замыкании внешней цепи между электродами начинает протекать электрический ток.
Принцип работы батарейки
Принцип действия батарейки основан на протекании окислительно-восстановительной реакции между веществами электродов. Как это происходит:
- На аноде идет реакция окисления, в результате которой образуются свободные электроны
- Электроны по внешней цепи перемещаются к катоду
- На катоде происходит реакция восстановления с поглощением электронов
- Ионы в электролите замыкают цепь внутри батарейки
В результате во внешней цепи возникает направленное движение электронов — электрический ток.

Основные типы батареек
Существует несколько основных типов батареек, различающихся по химическому составу:
- Солевые (угольно-цинковые)
- Щелочные (алкалиновые)
- Литиевые
- Серебряно-цинковые
- Ртутно-цинковые
Каждый тип имеет свои преимущества и недостатки по емкости, сроку службы, стоимости и другим параметрам.
Солевые батарейки: особенности и применение
Солевые (угольно-цинковые) батарейки являются самыми простыми и дешевыми. Их устройство:
- Анод — цинковый стакан
- Катод — угольный стержень
- Электролит — паста из хлорида аммония, хлорида цинка и крахмала
Преимущества солевых батареек:
- Низкая стоимость
- Широкий температурный диапазон работы
- Отсутствие вредных веществ
Недостатки:
- Небольшая емкость
- Короткий срок хранения
- Быстрая разрядка при больших токах
Применяются в устройствах с малым энергопотреблением — пультах, часах, игрушках.
Щелочные (алкалиновые) батарейки
Щелочные батарейки более совершенны по сравнению с солевыми. Их конструкция:
- Анод — порошок цинка
- Катод — диоксид марганца
- Электролит — гидроксид калия
Достоинства щелочных батареек:

- Высокая емкость
- Длительный срок хранения
- Хорошая работа при больших токах
- Широкий температурный диапазон
Недостатки:
- Более высокая цена
- Наличие вредных веществ
Щелочные батарейки подходят для энергоемких устройств — фотоаппаратов, плееров, фонарей.
Литиевые батарейки: особенности и применение
Литиевые батарейки обладают наилучшими характеристиками среди первичных источников тока. Их состав:
- Анод — металлический литий
- Катод — диоксид марганца, оксид серы или другие
- Электролит — неводный раствор соли лития
Преимущества литиевых батареек:
- Очень высокая емкость
- Низкий саморазряд
- Широкий температурный диапазон
- Длительный срок хранения (до 10 лет)
Недостатки:
- Высокая стоимость
- Опасность при неправильном обращении
Применяются в профессиональной аппаратуре, медицинских приборах, системах сигнализации.
Как выбрать подходящие батарейки
При выборе батареек следует учитывать несколько факторов:
- Тип устройства и его энергопотребление
- Требуемый размер батареек
- Условия эксплуатации (температура, влажность)
- Необходимый срок службы
- Стоимость
Для энергоемких устройств лучше выбирать щелочные или литиевые батарейки. Для редко используемых приборов подойдут солевые. При эксплуатации в экстремальных условиях оптимальны литиевые элементы.
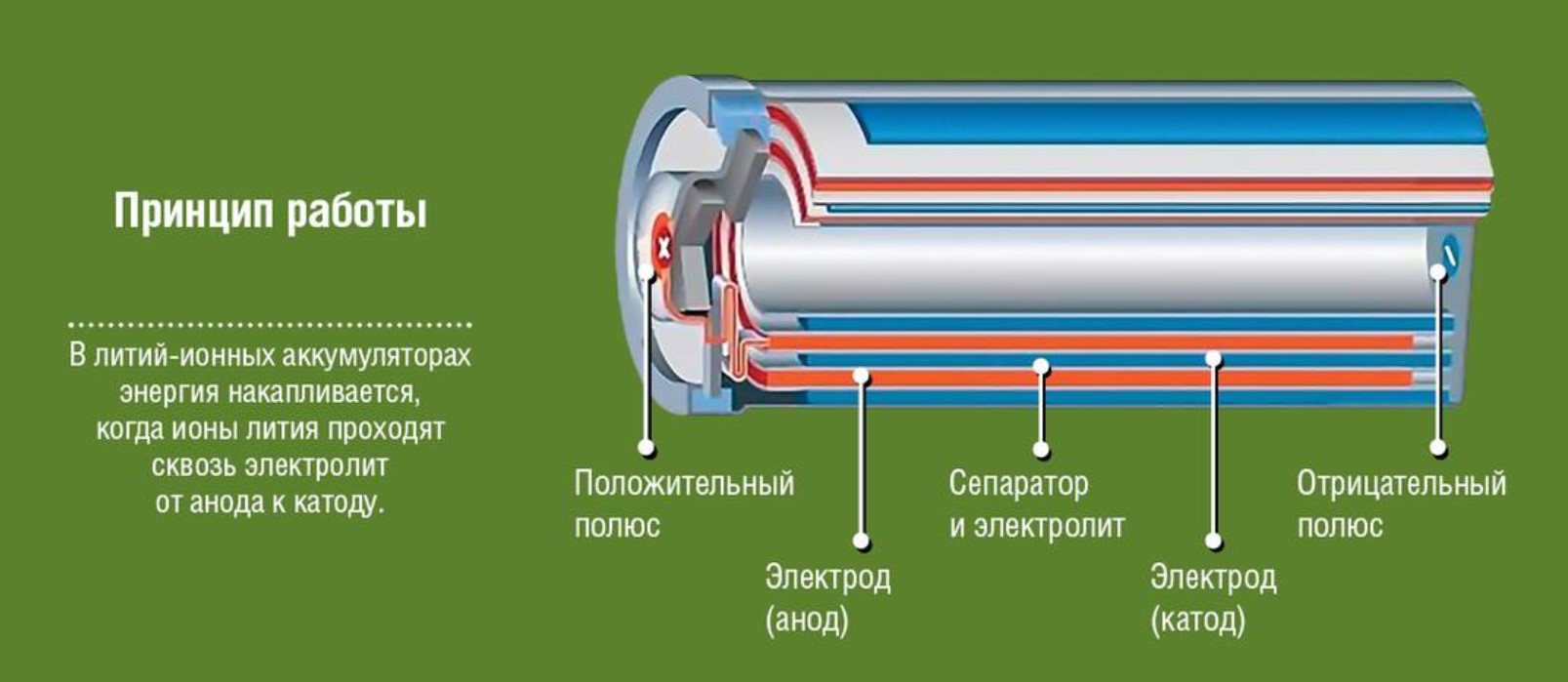
Правила использования и утилизации батареек
Для безопасного и эффективного использования батареек следует соблюдать несколько правил:
- Не смешивать батарейки разных типов и производителей
- Соблюдать полярность при установке
- Вынимать батарейки из неиспользуемых устройств
- Не пытаться заряжать обычные батарейки
- Хранить в сухом прохладном месте
- Утилизировать использованные батарейки в специальных пунктах приема
Правильная утилизация батареек очень важна для защиты окружающей среды, так как они содержат вредные вещества.
Перспективы развития батареек
Современные исследования направлены на создание более эффективных и экологичных источников тока. Основные направления развития:
- Увеличение удельной емкости
- Снижение саморазряда
- Расширение температурного диапазона
- Использование безопасных материалов
- Улучшение перезаряжаемости
Перспективными считаются литий-воздушные, натрий-ионные и другие новые типы аккумуляторов. Также ведутся разработки в области суперконденсаторов и твердотельных батарей.
какие процессы скрыты под оболочкой
Батарейки являются наиболее распространенным источником питания. Современный мир не представляет себя без различной электроники, для нее необходима электроэнергия. Не всегда получается применять обычные сетевые источники, для этого и нужны гальванические элементы. Глядя на них наверняка каждый задавался вопросом из чего состоит батарейка и как она работает?
Содержание
- Что такое батарейка
- Устройство батарейки
- Принцип работы батарейки
- Разновидности
- Солевые
- Щелочные
- Серебряные
- Ртутные
- Литиевые
- Применение
- Выбор источника питания
Что такое батарейка
Обыкновенная батарейка представляет собой некий источник электрического тока в котором несколько электрохимических элементов объединены между собой в пакет. Стоит обратить внимание, что батарея — это именно несколько объединенных между собой гальванических элементов. Электричество в батарейке вырабатывается вследствие протекающей химической реакции. Изобретателем батареек принято считать ученого Алессандро Вольта, который создал в 1800 г. «Вольтов столб» — первый в мире электрохимический источник тока, ставший прародителем современных батарей.
Электричество в батарейке вырабатывается вследствие протекающей химической реакции. Изобретателем батареек принято считать ученого Алессандро Вольта, который создал в 1800 г. «Вольтов столб» — первый в мире электрохимический источник тока, ставший прародителем современных батарей.
Устройство батарейки
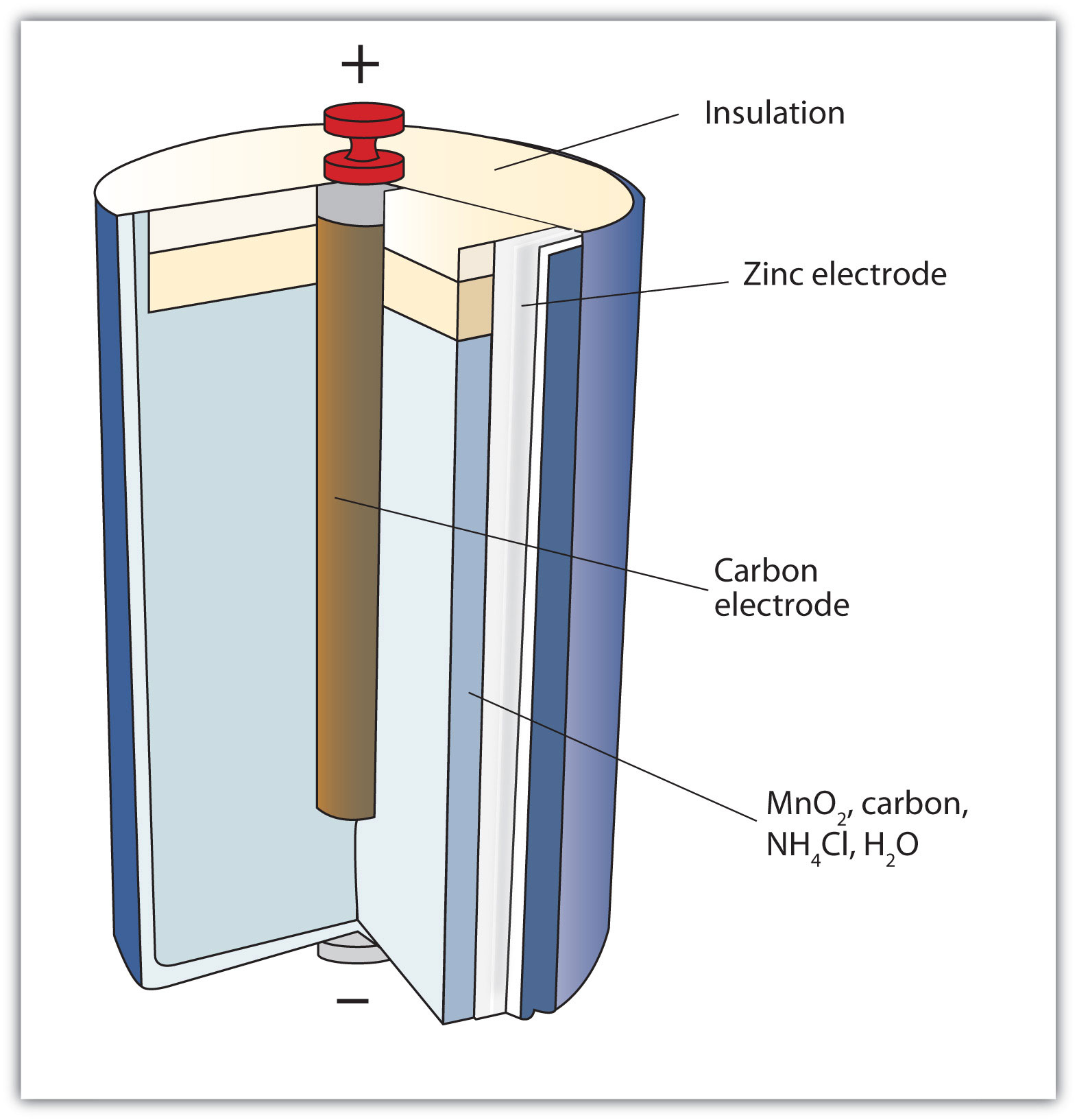
Рассмотрим, как устроена батарейка в разрезе на примере щелочного элемента как наиболее распространенного. Работа щелочной батарейки основана на окислительно-восстановительной реакции между цинком и диоксидом марганца. Корпусом элемента и по совместительству плюсовым контактом «+» является никелированный стальной стакан. Катодная паста представляет собой смесь диоксида марганца (MnO2) и графита. Анодная паста – это смесь цинкового порошка (Zn) и густого щелочного электролита (как правило, гидроксид калия, КОН). Анодная и катодная масса разделены сепаратором. Сепаратор разделяет реагенты, исключая их перемешивание и нейтрализацию заряда. Сепаратор также пропитан электролитом. Отрицательный потенциал снимается с латунного токосъемника, который окружён анодной пастой. Стальная тарелка контактирует с латунным стержнем – токосъёмником и является отрицательным контактом элемента «—». Прокладка изолирует никелированный стальной стакан от стальной тарелки, препятствуя тем самым короткому замыканию. Кроме этого прокладка сдерживает давление газа, который в незначительном количестве образуется при химической реакции. Предохранительная мембрана служит для того, чтобы при чрезмерном давлении газа предотвратить взрыв батареи выпустив газ наружу. Как правило, это приводит к разгерметизации элемента и течи электролита. Протекший электролит, по сути, обычная щелочь. При попадании на контакты вызывает их коррозию, на одежду — разъедает ее, на руки — вплоть до ожога. Именно поэтому на упаковке с батарейками можно найти предупреждение о том, что севшие элементы нужно вынимать из электроприборов, а длительное хранение электроприборов с батарейками внутри недопустимо.
Сепаратор также пропитан электролитом. Отрицательный потенциал снимается с латунного токосъемника, который окружён анодной пастой. Стальная тарелка контактирует с латунным стержнем – токосъёмником и является отрицательным контактом элемента «—». Прокладка изолирует никелированный стальной стакан от стальной тарелки, препятствуя тем самым короткому замыканию. Кроме этого прокладка сдерживает давление газа, который в незначительном количестве образуется при химической реакции. Предохранительная мембрана служит для того, чтобы при чрезмерном давлении газа предотвратить взрыв батареи выпустив газ наружу. Как правило, это приводит к разгерметизации элемента и течи электролита. Протекший электролит, по сути, обычная щелочь. При попадании на контакты вызывает их коррозию, на одежду — разъедает ее, на руки — вплоть до ожога. Именно поэтому на упаковке с батарейками можно найти предупреждение о том, что севшие элементы нужно вынимать из электроприборов, а длительное хранение электроприборов с батарейками внутри недопустимо.
Иногда, забыв вынуть уже подсевшие батарейки, через некоторое время можно обнаружить, что в батарейном отсеке появилась какая-то жидкость. Это и есть потёкший электролит. Поэтому на упаковке с батарейками можно найти предупреждение о том, что севшие элементы нужно вынимать из электроприборов. Теперь вы знаете, зачем это нужно делать.
Итак, с устройством разобрались, теперь поговорим о том, как работает щелочной элемент.
Принцип работы батарейки
На аноде проходит реакция окисления цинка. Вначале образуется гидроксид цинка
Zn + 2OH− → Zn(OH)2 + 2e−
Который разлагается
Zn(OH)2 → ZnO + H2O
На катоде проходит реакция восстановления оксида марганца IV в оксид марганца III
2MnO2 + H2O + 2e− → Mn2O3 + 2OH−
Общая картина следующая
Zn + 2KOH + 2MnO2 + 2e− → 2e− + ZnO + 2KOH + Mn2O3
Из первой формулы видно, что на аноде имеется избыток электронов. Но ведь анод это «+»? Дело в том, что в физике принято считать за направление тока движение положительных зарядов, т.е. от плюса (анода) к минусу (катоду). Но электрический ток это упорядоченное движение электронов, которые имеют отрицательный заряд. Поэтому, ток течёт оттуда, где есть избыток электронов, в направлении, где есть нехватка отрицательных зарядов (это и есть плюс – недостаток электронов). При этом получается, что ток течёт в реальности от отрицательного контакта к положительному. В электрохимии анодом принято считать тот электрод, на котором происходит процесс окисления, катодом же считается электрод, где происходит реакция восстановления.
Но ведь анод это «+»? Дело в том, что в физике принято считать за направление тока движение положительных зарядов, т.е. от плюса (анода) к минусу (катоду). Но электрический ток это упорядоченное движение электронов, которые имеют отрицательный заряд. Поэтому, ток течёт оттуда, где есть избыток электронов, в направлении, где есть нехватка отрицательных зарядов (это и есть плюс – недостаток электронов). При этом получается, что ток течёт в реальности от отрицательного контакта к положительному. В электрохимии анодом принято считать тот электрод, на котором происходит процесс окисления, катодом же считается электрод, где происходит реакция восстановления.
Интересно знать! В результате химических реакций внутри элемента питания происходит необратимое разрушение металлических элементов питания, батарейка теряет свою емкость.
Важно! Поскольку химические изменения в процессе разряда батарейки необратимы — они не подлежат восстановлению заряда.

Разновидности
По форме и размерам согласно мировым стандартам элементы питания разделяются на такие виды:
- АА- пальчиковая;
- ААА- мизинчиковая;
- АААА;
- С- дюймовочка;
- D- бочка;
- квадратная;
- РР3- крона;
- Источники питания миниатюрных размеров.
В настоящее время существует большое количество разнообразных источников питания. Между собой они отличаются материалами, применяемыми для изготовления электродов и электролита. Среди многочисленных батареек выделяют несколько основных видов:
- солевые;
- щелочные;
- ртутные;
- серебряные;
- литиевые.
Солевые
Такие гальванические элементы имеют низкую стоимость относительно аналогов, однако имеется один существенный недостаток это низкая внутренняя емкость таких батареек.
Щелочные
Состав батарейки такого вида отличается от своих аналогов применяемым электролитом, в них используется активная щелочь гидроксид калия KOH. Электрод выполнен из двуокиси таких металлов, как цинк и марганец. Нашли широкое применение в современной электронике, на корпусе элементов указывается маркировка «ALKALINE».
Электрод выполнен из двуокиси таких металлов, как цинк и марганец. Нашли широкое применение в современной электронике, на корпусе элементов указывается маркировка «ALKALINE».
Основным плюсом такой батарейки является продолжительный срок службы, в процессе эксплуатации номинальное напряжение понижается с меньшей скоростью. К минусам относят повышенную стоимость.
Серебряные
В качестве электролита применяют КОН, в состав электродов включено серебро. В таких элементах отмечают значительно увеличение срока службы, повышенную энергетическую плотность, постоянное номинальное напряжение, а также полную безвредность. Недостатками являются высокая цена.
Ртутные
В строении таких батареек используется цинк в качестве металла для анода, катод выполняется из ртутного оксида. Электроды разделяются сепаратором пропитанным электролитом. Такой элемент питания способен выполнять функции аккумулятора, однако емкость будет постепенно понижаться с каждым циклом восстановления заряда. При разряде происходит слипание ртути, а при заряде образуются дендриты цинка. Во время эксплуатации не допускается разгерметизация корпуса в связи с повышенной вредностью паров ртути. К преимуществам относят сохранение длительных значений плотности энергии, емкости и напряжения.
При разряде происходит слипание ртути, а при заряде образуются дендриты цинка. Во время эксплуатации не допускается разгерметизация корпуса в связи с повышенной вредностью паров ртути. К преимуществам относят сохранение длительных значений плотности энергии, емкости и напряжения.
Внимание! Ртутные источники питания являются потенциально опасными для здоровья человека и окружающей среды.
Литиевые
Данные элементы питания постепенно вытесняют все аналоги в своей области применения. Отрицательные электроды такой батарейки сделаны из лития. В них постоянно совершенствуются основные технические характеристики. К плюсам батареек с литиевым электродом относят увеличение срока хранения, широкий диапазон рабочих температур, повышенная внутренняя емкость. Основным минусом является повышенная стоимость.
Применение
Различные виды могут применяться по-разному, зависит это от их основных конструктивных свойств и характеристик:
- Элементы питания с твердым электролитом используют в устройствах с малым значением потребляемого тока.
 Например, часы фонарики с малой мощностью, а также пульты дистанционного управления.
Например, часы фонарики с малой мощностью, а также пульты дистанционного управления. - Щелочные батарейки применяют в электротехнике с повышенным значением тока, к ним можно отнести различные камеры и магнитофоны, а также игрушки с электродвигателем.
- Источники питания с серебряными электродами способны обеспечить электроэнергией в калькуляторах, переносных инструментах и аппаратах для улучшения слуха.
- Литиевые батарейки используют в портативной электронике, где необходимо стабильное значение емкости и потребляемого тока.
Выбор источника питания
Для правильного выбора элементов питания необходимо обратить внимание на следующие факторы:
- В аппаратах и оборудовании какого вида он будет применяться.
- Электролит какого состава используется в конструкции.
- Стоимость батарейки, иногда более выгодно приобрести несколько дешевых, чем один очень дорогой.
- Каждый элемент питания на корпусе имеет маркировку, по которой можно определить вид и состав источника питания.

- Необходимо ориентироваться по условиям окружающей среды в процессе эксплуатации.
- Рекомендуется приобретать источники питания, произведенные сравнительно недавно, так как с течением времени емкость может понижаться.
- Перед покупкой следует обратить внимание на целостность упаковки и самого корпуса элемента.
- Батарейка должна конструктивно соответствовать своему посадочному месту в электроприборе.
Правильный выбор и соблюдение требований к безопасной эксплуатации позволит продлить работу любого элемента питания. Для определенных видов техники необходим свой вид батарейки.
https://www.youtube.com/watch?v=M9QV62dypYEVideo can’t be loaded because JavaScript is disabled: Как сделана батарейка (https://www.youtube.com/watch?v=M9QV62dypYE)
Принцип работы и устройство батарейки
Батарейки являются незаменимыми источниками электроэнергии. Благодаря ним человек не зависит от проводов и становится более мобильным. В этой статье будет рассказано о том, из чего состоит элемент питания и в чем заключается принцип работы батареек.
Содрежание
- Из чего состоит
- Устройство батарейки
- Цилиндрической
- Круглой (миниатюрной)
- Крона
- Особенности химического состава
- Солевой
- Щелочной
- Литиевой
- Откуда берётся ток
- Принцип работы батарейки
Из чего состоит
Батарейка состоит из картонного, пластмассового или металлического корпуса. В портативных источниках напряжение внешняя оболочка, как правило, не участвует в электрохимической реакции.
Внутри батареи находится положительный стержень и электролит, который также принимает участие в передаче электрического тока. Конструкция элемента питания может быть различной, но практически у всех типов источников тока присутствуют перечисленные детали.
При необходимости, можно достать такие элементы, аккуратно разобрав батарейку и достав содержимое из её корпуса для изучения.
Устройство батарейки
Конструкционные особенности батареек связаны, прежде всего, с их размерами и формой.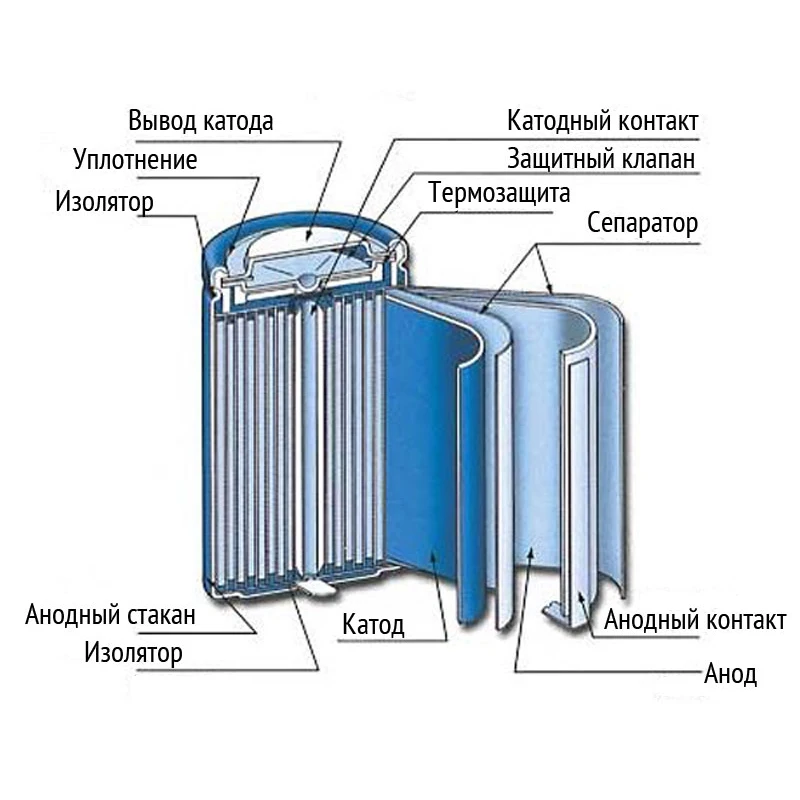
Цилиндрической
Цилиндрическая батарейка имеет вытянутый корпус. Оболочка в таких элементах чаще состоит из металла. Эта часть надёжно изолирована от внутренних деталей.
Сразу после диэлектрической оболочки следует тонкий стакан из токопроводящего металла (цинка в солевых батареях). Этот элемент соединяется с отрицательным выводом батарейки.
В середине цилиндрического элемента питания располагается графитовый стрежень, который является положительным выводом. В контактной части на эту деталь надевается металлический колпачок для защиты от механических повреждений.
В пространстве между центральным стержнем и отрицательной оболочкой находится электролит и деполяризующая смесь.
Круглой (миниатюрной)
Кнопочная батарея является незаменимым элементом питания в наручных часах и других миниатюрных электрических устройствах. Срок службы таких батареек, как правило, выше чем у пальчиковых, но причина длительной работы связана, прежде всего, с небольшим электропотреблением устройств, в которые устанавливается данный элемент.
Состоит такая батарейка из положительного и отрицательного полюсов, между которыми находятся вещества, вступающие в химическую реакцию при подключении к источнику тока потребителей.
Разноимённые контакты в таких изделиях надёжно изолированы друг от друга диэлектрическим материалом. Наиболее часто кнопочные батареи производят по воздушно-цинковой технологии.
Крона
Крона отличается от других батареек тем, что внутри элемента находится 6 небольших источников питания по 1,5 Вольт. Принцип работы каждого отдельного изделия не отличается от пальчиковых или кнопочных батарей.
Корпус батарейки «Крона» изготавливается из металла, но также может использоваться прочный пластик. Отдельные элементы располагаются сверху вниз и подключаются последовательно. Положительный и отрицательный выводы находятся на одной из плоскостей, которая изготавливается из диэлектрика.
Особенности химического состава
В зависимости от веществ, которые используют внутри батареи, такие изделия могут быть солевыми, щелочными или литиевыми. Каждая группа имеет свои особенности химического состава.
Каждая группа имеет свои особенности химического состава.
Солевой
В качестве катода в солевой батарее используется цинк, а анод представляет собой стержень, изготовленный из графита и MnO2. Электролит в элементе этого типа – это хлорид аммония или калия. Для придания необходимой консистенции в него также добавляют специальный загуститель.
Элементы питания этого типа, в которых в качестве анода используются серебро, обладают значительно большим сроком годности. Называются такие элементы серебряно-цинковыми и стоят значительно дороже простых солевых батареек.
Щелочной
Строение алкалиновой батарейки практически не отличается от солевой. Разница заключается только в том, что в щелочном элементе серединный стержень устанавливается на отрицательный вывод, а не на положительный.
Химический состав изделия этого типа следующий:
- Катод – диоксид марганца.
- Анод – порошкообразный цинк.
- Электролит – гидрооксид калия.
Основное преимущество марганцево-щелочных элементов перед солевыми батареями заключается в большей ёмкости.
Литиевой
Литиевые неперезаряжаемые элементы имеют следующий химический состав:
- Анод – литий или литиевые соединения.
- Катод – диоксид марганца, пирит и другие.
- Электролит – перхлорат лития, тионилхлорид.
Литиевые элементы питания работает в различных устройствах значительно дольше щелочных и солевых изделий, но и стоимость их на порядок выше.
Откуда берётся ток
В отличие от аккумуляторов, батарея сделана таким образом, что её невозможно перезарядить. Тем не менее, этот источник тока имеет на контактах необходимый ток для питания различных устройств. Физика такого явления очень проста:
- Металлический элемент помещается в окислитель, в который и переходят положительно заряженные частицы.
- При этом в металле будут накапливаться отрицательные ионы.
При подключении потребителя механизм этот будет поддерживаться до тех пор, пока металл практически полностью не расходуется.
Принцип работы батарейки
Принцип работы батареи довольно прост для понимания. Схема образования электричества выглядит следующим образом:
Схема образования электричества выглядит следующим образом:
- Цинковый стакан элемента питания в результате химической реакции приобретает отрицательный заряд.
- Графитовый стержень становится положительно заряженным.
Отрицательные ионы, которые поступают на соответствующий вывод, потекут к положительному полюсу при подключении какой-либо нагрузки, например, лампочки или моторчика.
В общем, устройство батарейки представляет собой очень простую схему, которую, при желании, можно повторить самостоятельно в домашних условиях, используя при этом вполне доступные химикаты и металлические изделия.
Остались вопросы или есть что добавить? Тогда напишите нам об этом в комментариях, это позволит сделает материал более полезным, полным и точным.
Как устроена батарейка? Принципы работы батарейки
Батарейка — это слово плотно вошло в нашу повседневную жизнь. Но, к сожалению, сегодня мало кого интересует её история, устройство, её виды. Давайте вместе разберёмся с этими и другими интересными вопросами о батарейке. А точнее «что такое батарейка», «как работает батарейка».
Давайте вместе разберёмся с этими и другими интересными вопросами о батарейке. А точнее «что такое батарейка», «как работает батарейка».
Повседневная жизнь не требует каких-то великих усилий для включения телевизора, калькулятора, для нормальной работы настенных часов, для работы компьютерной мыши и так далее. А все благодаря каким-то батарейкам, которые помогают упростить нашу жизнь, помогают сэкономить наше время. Это понимает каждый здравомыслящий человек, но не каждый задаёт себе вопрос: «как из таких маленьких батареек совершается такой объём работы», «как устроены батарейки»… А, между тем, это физика.
Самые первые прототипы батареек появились ещё в Месопотамии около 2000 лет назад. Состояла она в то время из глиняной вазы, медного и железного стержней, залитыми битумом. Кстати, если такой сосуд залить кислотой (уксусной, серной), то получим напряжение примерно в 1В. Назвали такой прототип «Багдадской батарейкой » в связи с местом, на котором были обнаружены.
Примерно в 1800 году итальянский физик Алессандро Вольта изобрёл батарейку, которой мы и по сей день продолжаем пользоваться. Кстати, кто не знает что такое батарейка, так это источник питания, который вырабатывает электричество под действием химического процесса. То есть батарейка это гальванический элемент, работающий на химической реакции. Так можно объяснить и детям.
Возможно, вам будет интересно: Почему батарейки кислые на вкус?
Как работает батарейка
Сегодня в магазинах можно увидеть большое количество батареек, они различны по некоторым принципам, но схема работы у них одна. У любой батарейки есть положительный полюс (анод–цинк Zn), отрицательный полюс (катод–марганец Mg) и электролит (может быть сухим, жидким). Именно эти составляющие и являются основными элементами батарейки. Электрический ток бежит от анода (+) к катоду (—), но между ними обязательно должна быть нагрузка (лампочка, диод, двигатель или что-то ещё). Если нагрузки не будет (соединить «–» с «+» напрямую), то произойдёт короткое замыкание (К.З.)
Если нагрузки не будет (соединить «–» с «+» напрямую), то произойдёт короткое замыкание (К.З.)
Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится.
Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит.
Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Батарейки или аккумуляторы?
Не вдаваясь в лишние подробности, отметим: аккумуляторы бывают тех же типоразмеров. Но напряжение у них, как правило, 1,2 В, а не 1,5.
Но напряжение у них, как правило, 1,2 В, а не 1,5.
По начинке аккумуляторы типоразмеров AA и AAA бывают никель-кадмиевые (NiCd) и никель-металл-гидридные (NiMh). Отдельно стоят серебряно-цинковые аккумуляторы номинальным напряжением 1,55 В.
Предпочтительнее использовать NiMh аккумуляторы — они не обладают «эффектом памяти», то есть, в отличие от никель-кадмиевых, их можно подзаряжать в любое время.
Чем аккумуляторы лучше батареек
1. Даже учитывая затраты на сами аккумуляторы и зарядное устройство для них, при длительной эксплуатации аккумуляторы дешевле. Можно посчитать момент окупаемости затрат — на какой по счёту зарядке стоимость аккумуляторов сравняется с условным комплектом батареек.
Например, для набора зарядное устройство Energizer Pro Charger + 4AA 2000mAh такой срок составит примерно 16 зарядок, если в качестве альтернативы использовать батарейки GP 15A.
2. Аккумуляторы экологичнее. Для производства батарейки или аккумулятора затрачивается примерно одинаковое количество ресурсов. А служат аккумуляторы в сотни и тысячи раз дольше — считая циклы зарядки, а не абсолютное время.
А служат аккумуляторы в сотни и тысячи раз дольше — считая циклы зарядки, а не абсолютное время.
Купив один раз нормальный комплект аккумуляторов с зарядным устройством, убережём планету от загрязнения сотнями комплектов одноразовых батарей.
3. Аккумуляторы заряжаются в среднем за 3 часа. Весь комплект из 4 штук. А за батарейками нужно идти в магазин.
Покупать и батарейки и аккумуляторы стоит у проверенных продавцов. На мелких торговых точках велика вероятность купить аналог или откровенную подделку. Торговые марки Panasoanic или Abibas всё ещё на слуху.
Как устроена батарейка
Внутри металлического корпуса щелочной ячейки находятся три основных химических вещества: цинк, диоксид марганца и гидроксид калия.
Щелочная батарейка. /Роджер Кларк
Это может показаться сложным, но способ производства электричества в батарейке на самом деле довольно прост: происходит химическая реакция, которая перемещает крошечные отрицательно заряженные частицы, называемые «электронами», вокруг, чтобы создать электрический ток.
Когда элемент подключен к цепи — например, к лампочке, — цинк внутри реагирует с диоксидом марганца и теряет электроны.
Электроны собираются с помощью металлического стержня внутри ячейки, что позволяет им течь из нижней части ячейки (отрицательный), через провода к лампе (чтобы она загорелась), а затем обратно в верхнюю часть ячейки. (положительный).
Эта реакция производит около 1,5 вольт электроэнергии. Поскольку не так много устройств могут работать при напряжении 1,5 В, очень часто два или четыре элемента используются вместе для увеличения мощности. Таким образом, четыре ячейки, соединенные вместе (конец в конец), дадут шесть вольт.
Когда большая часть цинка прореагировала с диоксидом марганца, мы говорим, что элемент «плоский», что означает, что он больше не может производить электричество. Поскольку химическая реакция, происходящая в щелочных элементах, не может быть легко изменена, это означает, что элемент не может быть перезаряжен.
Но помните, что большинство элементов и батарей можно утилизировать, поэтому убедитесь, что вы тщательно от них избавились.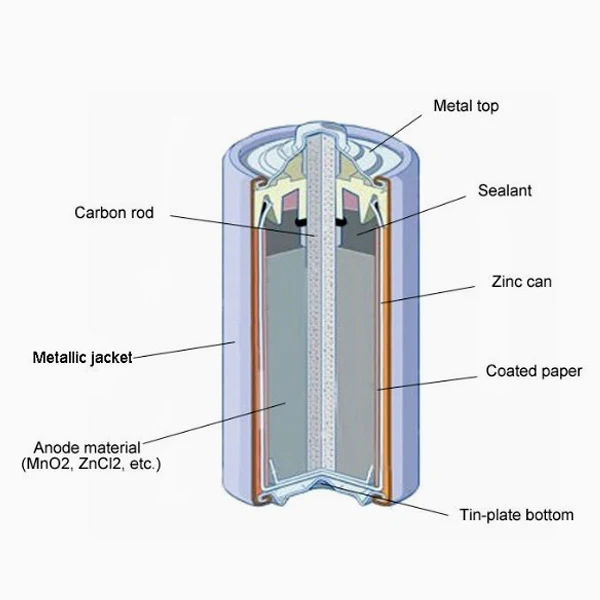
Размеры батареек
Самые распространённые батарейки для игрушек, карманных фонариков, настенных часов, беспроводных клавиатур и мышей — это то, что мы привыкли называть словами «пальчиковые» и «мизинчиковые».
Пальчиковые батарейки маркируются латинскими буквами AA или LR6. Имеют номинальное напряжение питания 1,5 В. Размеры: длина 50,5 мм, диаметр 14,5 мм.
Ёмкость, которая влияет на срок активной службы, зависит от начинки: солевые или алкалиновые. Разумеется, алкалиновые гораздо круче по всем параметрам, кроме цены.
Мизинчиковые батарейки маркируются как AAA. Часто их используют как замену большим элементам питания напряжением от 3,7 до 4,5 В, комбинируя по три штуки. Но применяют и по отдельности.
Кроме этих двух типоразмеров имеется масса других, менее распространённых. С разными характеристиками и разным напряжением.
Обратная реакция
Все типы батареек и элементов имеют сходный тип химической реакции, происходящей для выработки электроэнергии.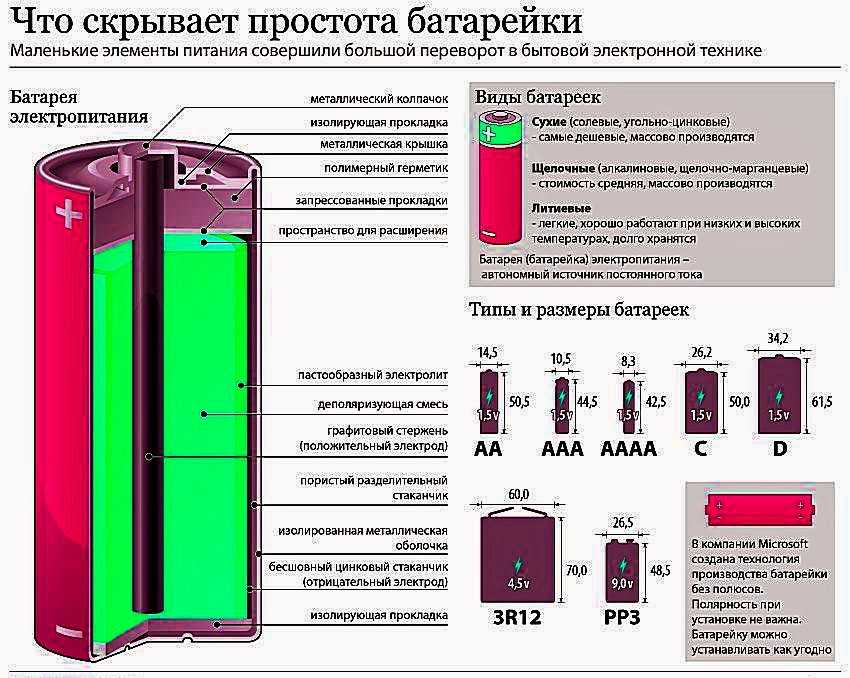
Но в некоторых типах элементов или батарей химические вещества различны, и реакция может быть обратной. Таким образом, элементы могут быть перезаряжены — так же, как литий-ионные аккумуляторы в автомобилях или смартфонах.
Раньше было гораздо дешевле производить неперезаряжаемые элементы, такие как щелочные элементы, поэтому они использовались очень широко.
Но теперь, когда люди осознали, насколько вредно для окружающей среды просто выбрасывать неперезаряжаемые элементы, а поскольку перезаряжаемые элементы становятся дешевле, мы, вероятно, будем использовать неперезаряжаемые элементы все меньше и меньше в будущем.
Виды батареек
Классификация батареек по типу химической реакции
| Тип | Описание | Достоинства | Недостатки |
| Первичные | Гальванические элементы. Реакции, происходящие в них, необратимы, поэтому их нельзя перезарядить. | Дешевле стоят, меньше саморазряд. | Одноразовые. |
| Вторичные | Аккумуляторы. Реакции в них обратимы, поэтому они способны не только отдавать энергию, но и накапливать её. | Многократность применения. Более экологичные. | Дороже. Сильнее саморазряд. |
Классификация батареек по типу электролита (список не полный, указаны только самые распространённые в быту)
| Тип | Достоинства | Недостатки | Фото |
| «Солевые» (угольно-цинковые) | Самый дешёвый. Рабочая температура: от −40 до +55 °C (данные Википедии). | Малая емкость, не позволяющая использовать изделия в мощных устройствах, малый срок хранения. | |
| «Щелочные» (алкалиновые, щёлочно-марганцевые) | Ёмкость в 1,5–10 раз больше, чем у солевых элементов, в зависимости от режима работы, при том же типоразмере элемента. Меньший саморазряд, длительный срок хранения.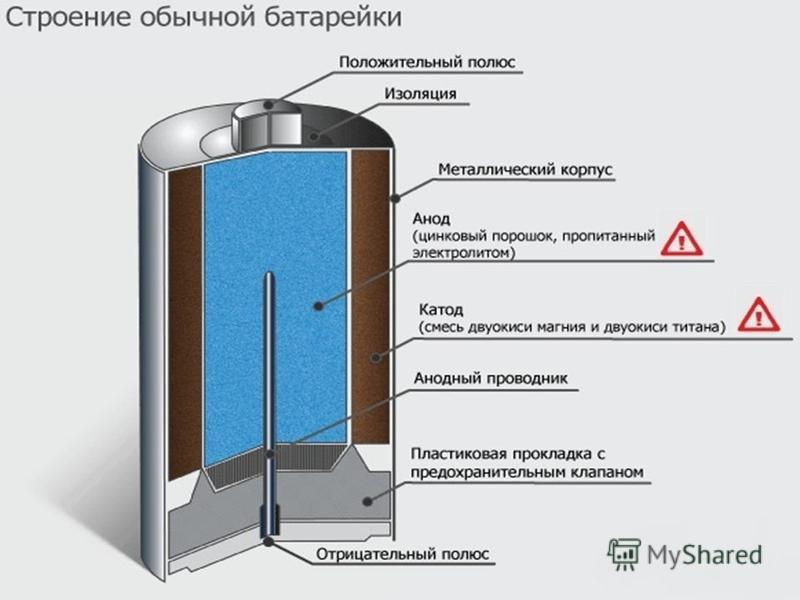 Лучше работают при больших токах нагрузки. Меньше падение напряжения по мере разряда. Меньше газовыделение, благодаря чему элемент можно делать полностью герметичным. Рабочая температура: от -30 до +55 °С. Лучше работают при больших токах нагрузки. Меньше падение напряжения по мере разряда. Меньше газовыделение, благодаря чему элемент можно делать полностью герметичным. Рабочая температура: от -30 до +55 °С. | Спадающая кривая разряда, большая масса. | |
| «Литиевые» | Наивысшая ёмкость на единицу массы. Пологая кривая разряда. Превосходен при низких и высоких температурах (лучше чем у предыдущих элементов). Длительное время хранения. Лёгкий вес. | Высокая цена |
Типы батареек по размеру и их обозначения
Здесь мы разместили таблицу в которой указаны, помимо размеров и характеристик, «название» и «маркировка». По сути это одно и то же, и даже, как правило, на всех элементах указывается одновременно. В США принято буквенное обозначение (в колонке «название»), и оно ориентированно на физический размер «батарейки».
| Название | Фото | Маркировка | Диаметр (мм) | Высота (мм) | Емкость (мАч) |
| A | Солевая (R23) Щелочная (LR23) | 17 | 50 | — | |
| AA | Солевая (R6) Щелочная (LR6) Литиевая (FR6) | 14,5 | 50,5 | 1100-3500 | |
| AAA | Солевая (R6) Щелочная (LR6) Литиевая (FR6) | 10,5 | 44,5 | 540-1300 | |
| AAAA | Щелочная (LR8D425) | 8.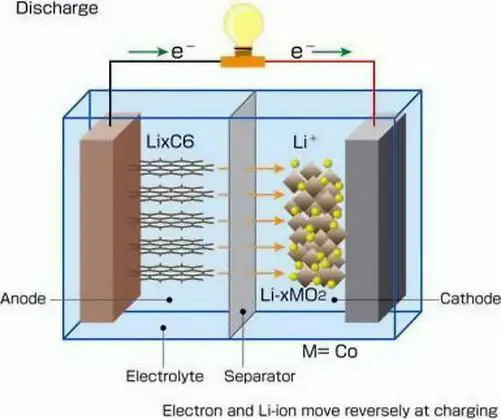 3 3 | 42.5 | 625 | |
| B | Щелочная (LR12 или 3R12) | 22 | 62 × 67 | 8350 | |
| C | Солевая(R14) Щелочная(LR14) | 26.2 | 50 | 3800-8000 | |
| D | Солевая(R20) Щелочная(LR20) | 34.2 | 61.5 | 8000-19500 | |
| F | Солевая(R25) Щелочная(LR25) | 33 | 91 | — | |
| N | Солевая(R1) Щелочная(LR1) | 12 | 30.2 | 1000 | |
| 1/2AA | Солевая (R14250) | 14.5 | 25 | 250 |
* Параметры ёмкости и тока в батарейке могут отличаться в зависимости от производителя.
Маркировки батареек
Маркировку гальванических источников тока делают исходя из состава электролита и активного металла в их конструкции. Регламентирует всё это IEC (Международная электротехническая комиссия). По этой классификации существует 5 самых распространенных типов круглых (цилиндрических) батареек:
солевые, щелочные, литиевые, серебряные и воздушно-цинковые.
Мы рассмотрим первые три, поскольку в предыдущей таблице не стали описывать стандарты для двух последних (серебряных и воздушно-цинковых батареек). Разнообразие этих элементов гораздо шире и мы не уместимся в рамки статьи.
Буква R в их маркировке означает круглую форму (от английского round).
Солевые батарейки (R).
Катод состоит из марганца (MnO2) в смеси с графитом (около 9,5 %), анод из цинка (Zn), и электролит из раствора хлорида аммония Nh5Cl. Они обеспечивают напряжение 1,5 вольта, имеют небольшую емкость, высокий саморазряд и низкий срок хранения (примерно 2 года). Солевые батарейки самые дешевые и имеют посредственные технические характеристики. В обиходе их также называют цинк-карбоновыми и угольно-цинковыми. Наиболее эффективной областью применения солевых батареек являются приборы со средним и низким энергопотреблением. Например, пульты ДУ и настенные часы.
Щелочные батарейки (LR).
Имеют катод из диоксида марганца, анод из цинка (порошок), и электролит из гидроксида щелочного металла (обычно гидроксид калия). Они имеют напряжение 1,5 вольта, увеличенную емкость, низкий саморазряд и большой срок хранения до 10 лет. Эти источники тока несколько дороже солевых, в обиходе их еще называют алкалиновыми и щелочно-марганцевыми.
Литиевые батарейки (CR).
Имеют анод из лития, катод чаще из диоксида марганца (но используются и другие составы для катода). Они имеют большую емкость, малый саморазряд и большой срок хранения до 10-12 лет. Они сохраняют работоспособность при низких температурах. Эти источники тока довольно дороги.
Надеемся, что вы нашли ответ на вопрос «что такое батарейка?».
Типы батареек
- Солевые (угольно-цинковые, марганцево-цинковые) батарейки.
Что это такое солевые батарейки
Солевая батарейка изготавливается из пассивного угля и двуокиси марганца, электролит из хлорида аммония и катод из цинка. В перерывах работы элементы питания могут восстанавливаться, т.е. выравнивать локальные неоднородности в композите электролита, вызванных разрядом. Такой процесс немного продлевает срок службы батарейки.
В перерывах работы элементы питания могут восстанавливаться, т.е. выравнивать локальные неоднородности в композите электролита, вызванных разрядом. Такой процесс немного продлевает срок службы батарейки.
- Алкалиновые (щёлочные) батарейки
Алкалиновые (щелочные) батарейки что это такое
В отличие от солевых батарей у алкалиновой батарейки химический элемент электролита — щелочной. Щёлочные батарейки (алкалин) имеют продолжительный срок хранения, а в процессе эксплуатации напряжение на электродах меняется гораздо меньше, чем у элементов с солевым раствором.
- Литиевые батарейки — li ion
Начинка батареек
Солевые
Солевые батарейки наиболее дёшевы, но не держат большую нагрузку, долго не хранятся и имеют свойство «вытекать» при каждом удобном случае.
Упрощённо, солевые батарейки состоят из двух электродов — из цинка и из диоксида марганца. Пространство между электродами заполнено электролитом (его в батарейках называют агломератом), в котором кроме собственно жидкости взвешена сажа и графит — токопроводящие частицы.
Солевые батарейки хранятся максимум 2-3 года, причём падение ёмкости к окончанию срока хранения составляет 30-40 %.
Алкалиновые
Алкалиновые или щелочные батарейки гораздо меньше проседают под высокой нагрузкой, почти не вытекают и практически не подвержены внезапным разогревам при перегрузке.
Химически алкалиновая батарейка состоит ровно из тех же компонентов, но как бы вывернута наизнанку. Агломерат специально загущен, в цинк добавлены висмут и алюминий для увеличения токоотдачи.
Кстати, раньше добавляли вредную ртуть, но все производители давно от неё отказались. До сих пор на многих батарейках можно встретить надпись 0 % Mercury .
Алкалиновая батарейка имеет изоляцию электродов, специальную камеру для газов, а также мембрану. В случае перегрузки и резкого выделения большого количества газов, батарейка не взорвётся, а просто порвётся мембрана. Да, электролит при этом вытечет, но это будет опасно только для устройства, но не для человека.
Как работает батарея?
Энергия не может быть создана или уничтожена, но ее можно сохранить в различных формах. Один из способов его хранения — в виде химической энергии в батарее. При подключении к цепи батарея может производить электричество.
Один из способов его хранения — в виде химической энергии в батарее. При подключении к цепи батарея может производить электричество.
| Батареи преобразуют химическую энергию в электрическую |
Батарея имеет два вывода: положительный (катод) и отрицательный (анод). Если вы соедините две клеммы проводом, образуется цепь. Электроны будут течь по проводу, и будет производиться электрический ток. Внутри батареи происходит реакция между химическими веществами. Но реакция происходит только при наличии потока электронов. Батареи могут храниться в течение длительного времени и продолжать работать, потому что химический процесс не начнется, пока электроны не перейдут от отрицательного к положительному выводу через цепь.
В батарее происходит химическая реакция
Простой пример. Батарея из лимонных элементов
Начнем с очень простой батареи, в которой используется лимон, в который, например, вставлены два разных металлических предмета. оцинкованный гвоздь и медная монета или проволока. Медь служит положительным электродом или катодом, а гальванизированный (оцинкованный) гвоздь — отрицательным электродом или анодом, производящим электроны. Эти два объекта работают как электроды, вызывая электрохимическую реакцию, которая создает небольшую разность потенциалов.
оцинкованный гвоздь и медная монета или проволока. Медь служит положительным электродом или катодом, а гальванизированный (оцинкованный) гвоздь — отрицательным электродом или анодом, производящим электроны. Эти два объекта работают как электроды, вызывая электрохимическую реакцию, которая создает небольшую разность потенциалов.
Поскольку атомы меди (Cu) притягивают электроны больше, чем атомы цинка (Zn), если вы поместите кусок меди и кусок цинка в контакт друг с другом, электроны перейдут от цинка к меди. Когда электроны концентрируются на меди, они будут отталкиваться друг от друга и останавливать поток электронов от цинка к меди. С другой стороны, если вы поместите полоски цинка и меди в проводящий раствор и соедините их снаружи проводом, реакции между электродами и раствором позволят электронам непрерывно течь по проводу.
| ЛИМОННАЯ БАТАРЕЯ
|
Как работает лимонная батарейка? Лимонная батарея состоит из лимона и двух металлических электродов из разных металлов, таких как медная монета или проволока, и оцинкованного (оцинкованного) гвоздя. Энергия для батареи исходит не от лимона, а от химического превращения цинка (или другого металла). Цинк окисляется внутри лимона, обменивая часть своих электронов, чтобы достичь более низкого энергетического состояния, а высвобождаемая энергия обеспечивает энергию. Лимон просто обеспечивает среду, в которой это может произойти, но они не расходуются в процессе. Если предположить, что используются цинковые и медные электроды (например, медная монета и оцинкованный гвоздь), то один лимон может генерировать примерно 0,9 Вольт. Слева последовательная цепь лимонов показывает, что вырабатывается 3,41 вольта. ПРИМЕЧАНИЕ: Можно использовать картофель, яблоки, квашеную капусту или любые другие фрукты или овощи, содержащие кислоту или другой электролит, но лимоны предпочтительнее из-за их более высокой кислотности. Например, в картофеле электролитом является фосфорная кислота, а в лимонах — лимонная кислота. |
В лимонной батарее происходит как окисление (потеря электронов), так и восстановление (приобретение электронов). Эта батарея похожа на оригинальные «простые гальванические элементы», изобретенные Алессандро Вольта (см. Ниже). На аноде металлический цинк окисляется и переходит в кислый раствор в виде ионов Zn2+:
Zn —> Zn2 + + 2 e-
На медном катоде ионы водорода (сольватированные протоны из кислого раствора в лимоне) восстанавливаются с образованием молекулярного водорода:
2H++ 2e- —> h3
Что заставляет электроны двигаться?
Когда вы отпускаете мяч, который держите в руках, он падает на землю, потому что гравитационное поле Земли тянет мяч вниз. Точно так же заряженные частицы, такие как электроны, должны совершить работу, чтобы переместиться из одной точки в другую. Количество работы на единицу заряда называется разностью электрических потенциалов между двумя точками. Единица разности потенциалов называется вольт.
Единица разности потенциалов называется вольт.
Разность потенциалов между катодом и анодом определяется химической реакцией. Внутри батареи электроны подталкиваются химической реакцией к положительному концу, создавая разность потенциалов.
Именно эта разность потенциалов заставляет электроны двигаться по проводу.
Разность потенциалов может быть положительной или отрицательной, подобно гравитационной энергии, движущейся вверх или вниз по склону. В батарее поток электронов направлен вниз… электроны могут течь вверх, как в случае с зарядным устройством.
Почему внутри батареи электроны не перемещаются от анода к катоду?
Электролит в батарее не дает одиноким электронам двигаться прямо от анода к катоду внутри батареи. Когда клеммы соединены токопроводящим проводом, электроны могут легко течь от анода к катоду.
В каком направлении движутся электроны в проводе?
Электроны заряжены отрицательно, поэтому они будут притягиваться к положительному концу батареи и отталкиваться от отрицательного конца. Когда батарея подключена к устройству, которое позволяет электронам течь через нее, они текут от отрицательного (анодного) к положительному (катодному) выводу.
Когда батарея подключена к устройству, которое позволяет электронам течь через нее, они текут от отрицательного (анодного) к положительному (катодному) выводу.
Кто изобрел гальванический элемент (батарейку)?
| ПЕРВАЯ БАТАРЕЯ VOLTA
|
Аккумулятор производства Volta считается первым гальваническим элементом. Он состоит из двух электродов: один из цинка, другой из меди. Электролит представляет собой серную кислоту или смесь солевого раствора соли и воды. Электролит существует в форме 2H+ и SO42-. Цинк, который в электрохимическом ряду выше меди и водорода, реагирует с отрицательно заряженным сульфатом SO42- . Положительно заряженные ионы водорода (протоны) захватывают электроны меди, образуя пузырьки газообразного водорода h3. Это делает цинковый стержень отрицательным электродом, а медный стержень — положительным электродом. Теперь у нас есть две клеммы, и ток будет течь, если мы их соединим. Реакции в этой ячейке следующие: цинк Zn —> Zn2+ + 2e- серная кислота 2H+ + 2e- —> h3 Медь не вступает в реакцию, действуя как электрод для химической реакции. |
Как работает современный аккумулятор (угольно-цинковый аккумулятор)?
| Сухой угольно-цинковый элемент или батарея упакованы в цинковую банку, которая служит как контейнером, так и отрицательной клеммой (анодом). Положительная клемма представляет собой угольный стержень, окруженный смесью диоксида марганца и угольного порошка. В качестве электролита используется паста из хлорида цинка и хлорида аммония, растворенных в воде. Цинк окисляется в соответствии со следующим полууравнением. Диоксид марганца смешивают с угольным порошком для увеличения электропроводности. Реакция выглядит следующим образом: 2MnO2(т) + 2 e- + 2Nh5Cl(водн.) —> , а CL сочетается с Zn2+. В этой полуреакции марганец восстанавливается из степени окисления (+4) в (+3). Возможны и другие побочные реакции, но общую реакцию в угольно-цинковом элементе можно представить как: Zn(тв) + 2MnO2(тв) + 2Nh5Cl(вод) —> Mn2O3(тв) + Zn(Nh4)2Cl2 (вод) + h3O(ж) Аккумулятор имеет Э. |
Какие существуют типы батарей?
В разных типах батарей используются разные типы химических веществ и химических реакций. Некоторые из наиболее распространенных типов батарей:
| Щелочные батареи |
Используется в батареях Duracell® и Energizer® и других щелочных батареях. Электроды цинково-марганцево-оксидные. Электролит представляет собой щелочную пасту.
|
| Свинцово-кислотный аккумулятор |
Используются в автомобилях. Электроды изготовлены из свинца и оксида свинца с сильной кислотой в качестве электролита.
|
| Литиевая батарея |
Эти батарейки используются в фотоаппаратах для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки.
|
| Литиевая батарея | Эти батарейки используются в фотоаппаратах для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки.
|
| Литий-ионный аккумулятор | Эти батареи используются в портативных компьютерах, сотовых телефонах и другом портативном оборудовании с интенсивным использованием.
|
| Никель-кадмиевая или никель-кадмиевая батарея | Электроды никель-гидроксидно-кадмиевые. Электролит – гидроксид калия.
|
| Цинк-угольная батарея или стандартная угольная батарея – | Цинк и углерод используются во всех обычных или стандартных сухих батареях AA, C и D. Электроды изготовлены из цинка и углерода, а паста из кислотных материалов между ними служит электролитом. Электроды изготовлены из цинка и углерода, а паста из кислотных материалов между ними служит электролитом.
|
ССЫЛКИ И ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Potato Power: Руководство для учителя
История батареи
Электрохимические реакции
Углеродно-цинковая батарея в батарее 9005?
Как работают батареи Анимированное руководство по науке о батареях
Оценка Вопросы:
M ultiple Выбор вопросов
1. В
батарея, положительная клемма называется:
а) анод
б) катод
в) электролит
г) провод
2.
Что заставляет электроны течь по проводу:
а) гравитационный потенциал выталкивает электроны через провод
б) кислоты проталкивают электроны по проводу
в) разность потенциалов между анодом и катодом толкает электроны
по проводу
г) электроны текут не по проводу, а по электролиту
3. Какое утверждение о лимонной батарейке верно?
Какое утверждение о лимонной батарейке верно?
а) Энергия для батареи исходит не от лимона, а
скорее химическое изменение цинка (или другого металла)
б) Батарея состоит из двух металлических электродов разной
металлы, такие как медная монета или проволока и оцинкованный гвоздь.
в) В лимонной батарейке происходит как окисление (потеря электронов), так и восстановление
(приобретение электронов).
г) все вышеперечисленное верно
4.
Какой тип батареи используется в ноутбуках и мобильных телефонах?
а) Щелочная батарея
б) Цинк-угольная батарея
в) Литий-ионный аккумулятор
г) свинцово-кислотный аккумулятор
5.
Каковы основные компоненты первой электрохимической ячейки Вольта?
а) Цинк, угольный стержень и серная кислота в качестве электролита
б) Цинк, медь и лимонный сок в качестве электролита
в) Медь, цинк и серная кислота в качестве электролита
г) Цинк, графит и серная кислота в качестве электролита
Как работают батареи? | Живая наука
Батарея работает, замыкая цепь внутри электрического устройства. (Изображение предоставлено: Mrs_ya | Shutterstock)
(Изображение предоставлено: Mrs_ya | Shutterstock)
Батарейки повсюду. Современный мир зависит от этих портативных источников энергии, которые можно найти во всем: от мобильных устройств до слуховых аппаратов и автомобилей.
Но, несмотря на широкое распространение в повседневной жизни людей, батареи часто остаются незамеченными. Подумайте об этом: вы действительно знаете, как работает батарея? Не могли бы вы объяснить это кому-то другому?
Вот краткое изложение научных данных об источниках энергии, питающих смартфоны, электромобили, кардиостимуляторы и многое другое. [Викторина: электрические и газовые транспортные средства]
Анатомия аккумулятора
Большинство аккумуляторов состоят из трех основных частей: электродов, электролита и сепаратора, по словам Энн Мари Састри, соучредителя и генерального директора компании Sakti3 из Мичигана. запуск аккумуляторной технологии.
В каждой батарее два электрода. Оба сделаны из проводящих материалов, но выполняют разные роли. Один электрод, известный как катод, соединяется с положительным полюсом батареи и находится там, где электрический ток покидает батарею (или электроны входят в нее) во время разряда, то есть когда батарея используется для питания чего-либо. Другой электрод, известный как анод, соединяется с отрицательным полюсом батареи и через него поступает электрический ток (или выходят электроны) из батареи во время разряда.
Один электрод, известный как катод, соединяется с положительным полюсом батареи и находится там, где электрический ток покидает батарею (или электроны входят в нее) во время разряда, то есть когда батарея используется для питания чего-либо. Другой электрод, известный как анод, соединяется с отрицательным полюсом батареи и через него поступает электрический ток (или выходят электроны) из батареи во время разряда.
Между этими электродами, а также внутри них находится электролит. Это жидкое или гелеобразное вещество, содержащее электрически заряженные частицы или ионы. Ионы соединяются с материалами, из которых состоят электроды, вызывая химические реакции, которые позволяют батарее генерировать электрический ток. [Взгляд изнутри на то, как работают батареи (инфографика)]
Типичные батареи питаются за счет химической реакции. [Посмотреть полную инфографику] (Изображение предоставлено Карлом Тейтом, художником по инфографике)
Последняя часть батареи, сепаратор, довольно проста. Роль сепаратора заключается в том, чтобы отделить анод и катод друг от друга внутри батареи. По словам Састри, без сепаратора два электрода соприкоснулись бы, что привело бы к короткому замыканию и препятствовало бы нормальной работе батареи.
Роль сепаратора заключается в том, чтобы отделить анод и катод друг от друга внутри батареи. По словам Састри, без сепаратора два электрода соприкоснулись бы, что привело бы к короткому замыканию и препятствовало бы нормальной работе батареи.
Как это работает
Чтобы представить себе, как работает батарейка, представьте, что вы вставляете щелочные батарейки типа двойных АА в фонарик. Когда вы вставляете эти батарейки в фонарик, а затем включаете его, на самом деле вы замыкаете цепь. Химическая энергия, хранящаяся в батарее, преобразуется в электрическую энергию, которая уходит из батареи в основание лампы фонарика, заставляя ее загораться. Затем электрический ток снова входит в батарею, но уже на противоположном конце от исходного.
Все части батареи работают вместе, чтобы фонарик загорелся. Электроды в батарее содержат атомы некоторых проводящих материалов. Например, в щелочной батарее анод обычно сделан из цинка, а диоксид марганца выступает в качестве катода. А электролит между и внутри этих электродов содержит ионы. Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
А электролит между и внутри этих электродов содержит ионы. Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
Серия химических реакций, происходящих в электродах, известна под общим названием окислительно-восстановительные (окислительно-восстановительные) реакции. В батарее катод известен как окислитель, потому что он принимает электроны от анода. Анод известен как восстановитель, потому что он теряет электроны.
В конечном итоге эти реакции приводят к потоку ионов между анодом и катодом, а также к высвобождению электронов из атомов электрода, сказал Састри.
Эти свободные электроны собираются внутри анода (нижняя плоская часть щелочной батареи). В результате два электрода имеют разные заряды: анод становится отрицательно заряженным, когда высвобождаются электроны, а катод становится положительно заряженным, когда расходуются электроны (которые отрицательно заряжены). Эта разница в заряде заставляет электроны двигаться к положительно заряженному катоду. Однако у них нет возможности проникнуть внутрь батареи, поскольку сепаратор не позволяет им это сделать.
Однако у них нет возможности проникнуть внутрь батареи, поскольку сепаратор не позволяет им это сделать.
Когда вы щелкаете выключателем фонарика, все меняется. Теперь у электронов есть путь к катоду. Но сначала они должны пройти через основание лампы вашего фонаря. Цепь замыкается, когда электрический ток снова входит в батарею через верхнюю часть батареи на катоде.
Перезаряжаемые по сравнению с неперезаряжаемыми
Для первичных батарей, таких как в фонарике, реакции, питающие батарею, в конечном итоге перестанут происходить, а это означает, что электроны, обеспечивающие заряд батареи, больше не будут создавать электрический ток. Когда это происходит, батарея разряжается или «разряжается», сказал Састри.
Вы должны выбросить такие батареи, потому что электрохимические процессы, которые заставляют батарею производить энергию, необратимы, объяснил Састри. Однако электрохимические процессы, происходящие во вторичных или перезаряжаемых батареях, можно обратить вспять, подав в батарею электрическую энергию. Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Одними из наиболее распространенных сегодня вторичных батарей являются литий-ионные (Li-ion) батареи, которые питают большинство бытовых электронных устройств. Эти батареи обычно содержат угольный анод, катод из диоксида лития-кобальта и электролит, содержащий соль лития в органическом растворителе. Другие перезаряжаемые батареи включают никель-кадмиевые (NiCd) и никель-металлогидридные (NiMH) батареи, которые можно использовать в таких вещах, как электромобили и беспроводные электроинструменты. Свинцово-кислотные (Pb-кислотные) батареи обычно используются для питания автомобилей и других транспортных средств для запуска, освещения и зажигания.
Все эти перезаряжаемые батареи работают по одному и тому же принципу, сказал Састри: когда вы подключаете батарею к источнику питания, поток электронов меняет направление, а анод и катод возвращаются в исходное состояние. [10 ведущих прорывных технологий]
[10 ведущих прорывных технологий]
Батарейный жаргон
Хотя все батареи работают более или менее одинаково, разные типы батарей имеют разные характеристики. Вот несколько терминов, которые часто встречаются при обсуждении аккумуляторов:
Напряжение : Когда речь идет о батареях, напряжение — также известное как номинальное напряжение элемента — описывает величину электрической силы или давления, при котором свободные электроны перемещаются от положительного полюса батареи к отрицательному, объяснил Састри. . В батареях с более низким напряжением ток выходит из батареи медленнее (с меньшей электрической силой), чем в батареях с более высоким напряжением (большая электрическая сила). Батарейки в фонарике обычно имеют напряжение 1,5 вольта. Однако, если фонарик использует две последовательно соединенные батареи, эти батареи или элементы имеют общее напряжение 3 вольта.
Свинцово-кислотные аккумуляторы, подобные тем, которые используются в большинстве неэлектрических автомобилей, обычно имеют напряжение 2,0 вольта. Но обычно в автомобильном аккумуляторе шесть таких элементов соединены последовательно, поэтому вы, вероятно, слышали, что такие батареи называют 12-вольтовыми.
Но обычно в автомобильном аккумуляторе шесть таких элементов соединены последовательно, поэтому вы, вероятно, слышали, что такие батареи называют 12-вольтовыми.
Литий-кобальт-оксидные батареи — наиболее распространенный тип литий-ионных батарей, используемых в бытовой электронике, — имеют номинальное напряжение около 3,7 вольт, сказал Састри.
Ампер : Ампер, или ампер, является мерой электрического тока или количества электронов, протекающих через цепь в течение определенного периода времени.
Емкость : Емкость или емкость элемента измеряется в ампер-часах, что представляет собой количество часов, в течение которых батарея может обеспечивать определенное количество электрического тока, прежде чем ее напряжение упадет ниже определенного порога, согласно сообщению Райс. Факультет электротехники и вычислительной техники университета.
9-вольтовая щелочная батарея, используемая в портативных радиоприемниках, рассчитана на 1 ампер-час, что означает, что эта батарея может непрерывно подавать один ампер тока в течение 1 часа, прежде чем она достигнет порогового значения напряжения и считается разряженной.
Плотность мощности : Плотность мощности описывает количество энергии, которое батарея может выдать на единицу веса, сказал Састри. По словам Састри, для электромобилей удельная мощность важна, потому что она говорит вам, как быстро автомобиль может разгоняться от 0 до 60 миль в час (97 км/ч). Инженеры постоянно пытаются придумать способы сделать батареи меньше, не уменьшая их плотность мощности.
Плотность энергии : Плотность энергии описывает, сколько энергии способна выдать батарея, деленное на объем или массу батареи, сказал Састри. Это число соответствует вещам, которые оказывают большое влияние на пользователей, например, сколько времени вам нужно, чтобы зарядить свой мобильный телефон, или как далеко вы можете проехать на своем электромобиле, прежде чем остановиться, чтобы включить его.
Подпишитесь на Элизабет Палермо @ techEpalermo . Подпишитесь на Live Science @livescience , Facebook & Google+ .
Дополнительные ресурсы
- Ассоциация стандартов IEEE: стандарты аккумуляторов
- Агентство по охране окружающей среды: ресурсосбережение — аккумуляторы
- All-Battery.com: Таблица размеров (открывается в новой вкладке)
Элизабет — заместитель редактора Live Science, пишет о науке и технологиях. Она получила степень бакалавра искусств в Университете Джорджа Вашингтона. Элизабет путешествовала по Америке, изучая политические системы и культуры коренных народов, а также обучая английскому языку учащихся всех возрастов.
Как устроена батарея. Инженерное мышление
Батареи, мы используем их каждый день по всему миру, но как они работают? Об этом мы расскажем в этой статье, спонсируемой Squarespace. Перейдите на сайт sqarespace.com, чтобы начать бесплатную пробную версию, или используйте инженерное мышление, чтобы сэкономить 10 % на веб-сайтах и доменах.
Аккумуляторы Прокрутите вниз, чтобы посмотреть видео на YouTube.
Что такое батарея?
Аккумулятор — это устройство, используемое для хранения энергии, когда она нам нужна. Мы используем их для питания небольших электрических устройств, таких как фонарики. Энергия хранится в виде химической энергии, и ее можно превратить в электрическую энергию, когда она нам понадобится. Мы увидим, как это работает чуть позже в статье.
Цепь батареи и лампыЕсли мы посмотрим на простую цепь батареи и лампы. Чтобы зажечь лампу, нам нужно, чтобы через нее протекали электроны. Батарея будет обеспечивать толкающую силу, позволяющую электронам течь через лампу. Нам просто нужно подключить лампу к положительной и отрицательной клеммам батареи, чтобы замкнуть цепь. Батарея может выталкивать электроны только в течение определенного времени, это время зависит от того, сколько энергии хранится внутри батареи и сколько требуется нагрузке.
Примеры нагрузки Когда мы говорим о нагрузке в электрической цепи, мы имеем в виду любые компоненты, для работы которых требуется электричество, например резисторы, светодиоды, двигатели постоянного тока или даже целые печатные платы. Некоторые батареи можно перезаряжать, и это будет четко указано сбоку, но типичная бытовая щелочная батарея не может, поэтому ее просто утилизируют, когда в ней заканчивается энергия. Они могут быть переработаны, поэтому убедитесь, что вы утилизируете их ответственно.
Некоторые батареи можно перезаряжать, и это будет четко указано сбоку, но типичная бытовая щелочная батарея не может, поэтому ее просто утилизируют, когда в ней заканчивается энергия. Они могут быть переработаны, поэтому убедитесь, что вы утилизируете их ответственно.
Между прочим, если вы хотите узнать, как работает двигатель постоянного тока, мы уже подробно рассказывали об этом ранее — посмотрите ЗДЕСЬ.
Что внутри батареи?
Типичная щелочная батарея на 1,5 В выглядит примерно так, но цвета зависят от производителя. Когда мы смотрим на батарею, у нас обычно есть пластиковая обертка, плотно прикрепленная к внешней стороне, она изолирует батарею, но также сообщает нам важную информацию, такую как емкость и напряжение, а также то, какой конец является положительным, а какой отрицательным.
Щелочная батареяПоложительный конец известен как катод и имеет расширенную поверхность, выступающую наружу.
Положительный конец Отрицательный конец будет плоским, отрицательный конец известен как анод.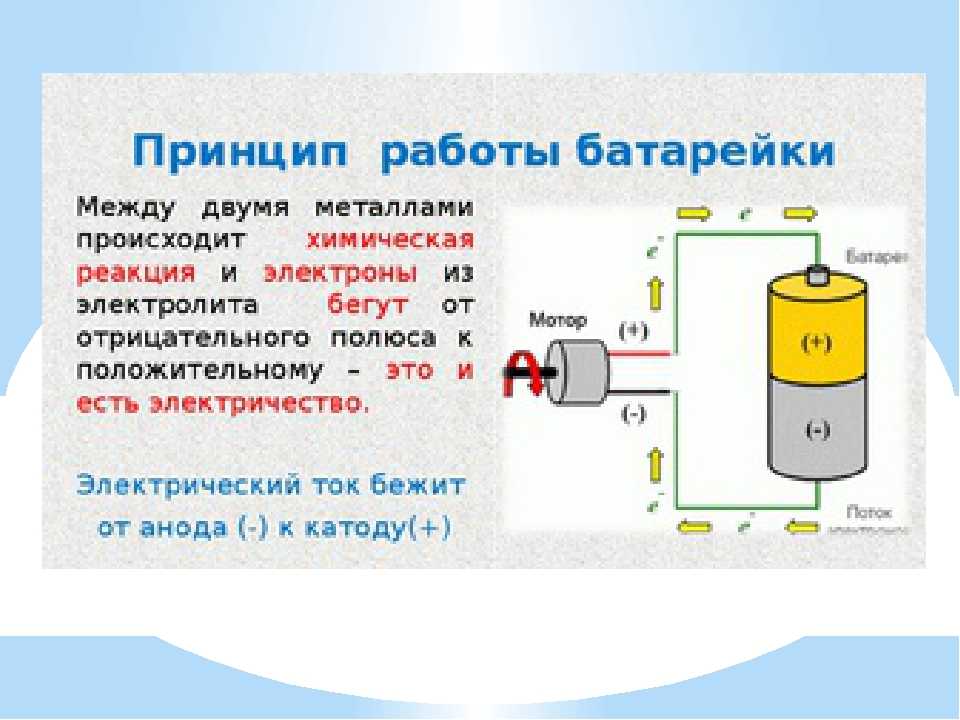 Эти две клеммы электрически изолированы друг от друга.
Эти две клеммы электрически изолированы друг от друга.
Под оберткой находится основной кожух, который обычно изготавливается из стали с никелированием. Это удерживает все внутренние компоненты на месте и предотвращает их взаимодействие с элементами атмосферы, такими как воздух и вода.
Under WrapperВнутри корпуса у нас есть несколько слоев различных материалов, эти материалы специально отобраны, потому что их химические реакции создают определенные уровни напряжения и тока. Первый слой — это катод, представляющий собой смесь оксида марганца (MnO2) и графита. Этот материал находится в контакте с металлом положительной клеммы. Графит добавляется для улучшения проводимости смеси и увеличения плотности энергии.
Первый слой Затем мы находим слой пористого материала, обычно волокнистой бумаги, который образует барьер. Барьер предотвращает прямой контакт материалов анода и катода друг с другом, что помогает батарее дольше работать, когда она не используется. Если бы барьера не было, то произошло бы короткое замыкание батареи. Микроскопические отверстия внутри материала позволяют атомам ионов проходить сквозь него. Мы рассмотрим это более подробно позже в этой статье.
Если бы барьера не было, то произошло бы короткое замыкание батареи. Микроскопические отверстия внутри материала позволяют атомам ионов проходить сквозь него. Мы рассмотрим это более подробно позже в этой статье.
Жидкий электролит из гидроксида калия затем распыляется на сепаратор во время производственного процесса, который пропитывает его и впитывается в материал анода. Используемый электролит является щелочным, поэтому мы называем этот тип батареи щелочной батареей.
Electrolyte Liquid SprayНа другой стороне барьера у нас есть анод, который представляет собой пасту, изготовленную из порошка цинка (Zn), а также гелеобразователя. Желирующий агент просто удерживает цинк во взвешенном состоянии, поэтому он не скапливается в одном месте. Цинк находится в форме порошка для увеличения площади поверхности материала, что снижает внутреннее сопротивление и, таким образом, улучшает перенос электронов.
Внутренняя батарея Стальная капсула закрыта нейлоновой пластиковой крышкой. Затем в цинк вставляется латунный штифт, на который надевается стальной колпачок. Это дает нам отрицательную клемму. Обратите внимание, что положительные и отрицательные клеммы разделены пластиковой крышкой. Это гарантирует, что они электрически изолированы друг от друга, в противном случае электроны могут пройти через корпус и достичь положительной клеммы, что приведет к короткому замыканию батареи.
Затем в цинк вставляется латунный штифт, на который надевается стальной колпачок. Это дает нам отрицательную клемму. Обратите внимание, что положительные и отрицательные клеммы разделены пластиковой крышкой. Это гарантирует, что они электрически изолированы друг от друга, в противном случае электроны могут пройти через корпус и достичь положительной клеммы, что приведет к короткому замыканию батареи.
Основы электричества
Нам нужно понять некоторые основы того, как работает электричество, прежде чем мы сможем понять аккумулятор.
Во-первых, электричество — это поток электронов в цепи. Батареи могут обеспечить толкающую силу, которая перемещает электроны по цепи. Электроны хотят вернуться к своему источнику, и они немедленно пойдут по любому пути, чтобы достичь этого. Помещая такие вещи, как лампы, на пути электронов, мы можем заставить их выполнять работу за нас, например, освещать лампу.
Основы электричества Батареи производят электричество постоянного или постоянного тока. Это означает, что электроны текут только в одном направлении от отрицательного к положительному. Осциллограф покажет постоянный ток в виде плоской линии в положительной области. Вы можете думать об электричестве постоянного тока как о реке, которая течет только в одном направлении.
Это означает, что электроны текут только в одном направлении от отрицательного к положительному. Осциллограф покажет постоянный ток в виде плоской линии в положительной области. Вы можете думать об электричестве постоянного тока как о реке, которая течет только в одном направлении.
В этих анимациях мы показываем поток электронов, который идет от отрицательного к положительному, но вы, возможно, привыкли видеть обычный ток, который идет от положительного к отрицательному. Электронный поток — это то, что происходит на самом деле, но обычный ток был исходной теорией, которая до сих пор широко используется и преподается по сей день. Просто знайте о двух и о том, какой из них мы используем.
Переменный ток Электричество, которое вы получаете от электрических розеток в своих домах, представляет собой электричество переменного или переменного тока, это отличается от электричества, обеспечиваемого аккумулятором. При переменном токе электроны непрерывно текут вперед и назад, подобно морскому приливу, который течет между приливом и отливом.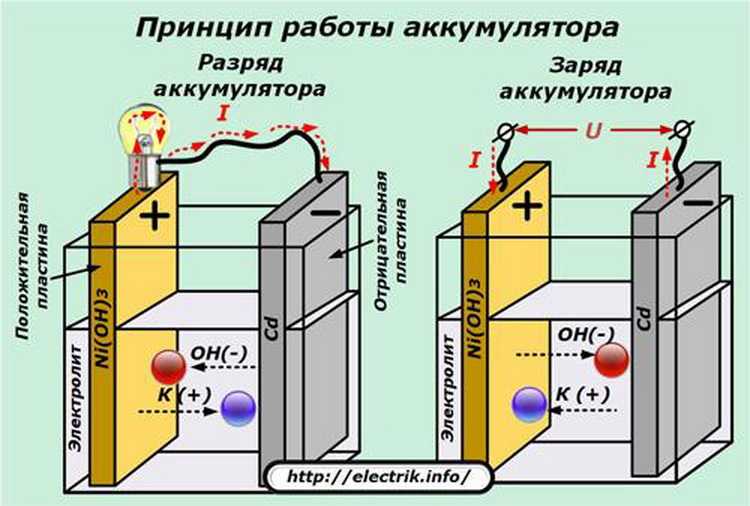 Осциллограф покажет переменный ток как волну, проходящую как через положительную, так и через отрицательную области, потому что она течет вперед, это положительно, и назад, это отрицательно.
Осциллограф покажет переменный ток как волну, проходящую как через положительную, так и через отрицательную области, потому что она течет вперед, это положительно, и назад, это отрицательно.
Если мы посмотрим на отрезок медного провода, внутри него мы обнаружим атомы меди. В центре атома у нас есть протоны и нейтроны, протоны заряжены положительно, а нейтроны считаются нейтральными, поэтому они не имеют заряда. Вокруг них вращаются электроны, электроны заряжены отрицательно.
Медная проволокаНекоторые из этих электронов могут свободно перемещаться к другим атомам. Они будут естественным образом перемещаться между другими атомами, но в случайных направлениях, что для нас бесполезно. Нам нужно, чтобы много электронов текло в одном направлении, и мы можем сделать это, обеспечив разность напряжений от источника питания, такого как батарея.
Когда мы говорим об атомах, вы часто будете слышать термин «ион». Ион — это просто атом, который имеет неравное количество электронов или протонов.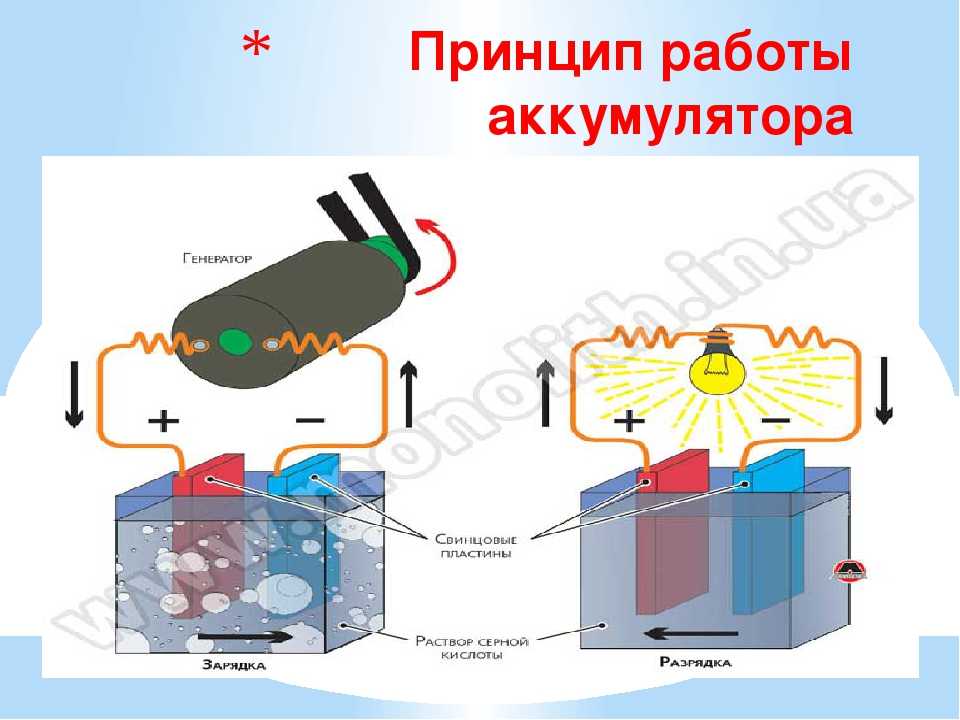 Атом имеет нейтральный заряд, когда в нем одинаковое количество протонов и электронов, потому что протоны заряжены положительно, а электроны отрицательно заряжены, поэтому они уравновешиваются. Если в атоме больше электронов, чем протонов, то это отрицательный ион. Если в атоме больше протонов, чем электронов, то это положительный ион.
Атом имеет нейтральный заряд, когда в нем одинаковое количество протонов и электронов, потому что протоны заряжены положительно, а электроны отрицательно заряжены, поэтому они уравновешиваются. Если в атоме больше электронов, чем протонов, то это отрицательный ион. Если в атоме больше протонов, чем электронов, то это положительный ион.
Напряжение похоже на давление в резервуаре с водой. Чтобы узнать, какое у нас давление, мы должны сравнить давление внутри трубы с давлением снаружи, и для этого мы используем манометр. Когда дело доходит до напряжения, мы используем вольтметр для измерения разницы напряжения между двумя разными точками. Если мы измерим разницу между батареями, мы получим 1,5 В, но если мы измерим тот же конец, мы получим 0 В, потому что это тот же конец, поэтому разницы нет.
Напряжение подобно давлению Некоторые материалы позволяют электронам легко проходить через них, они известны как проводники. Примерами этого являются медь и большинство металлов.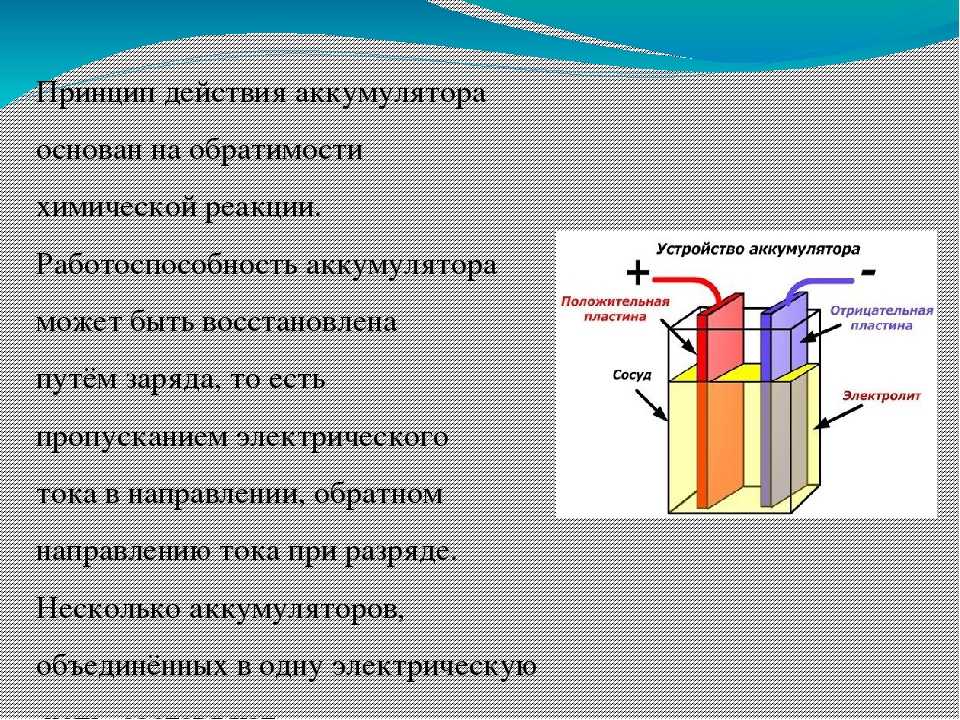 Другие материалы не пропускают электроны, они известны как изоляторы. Примерами этого являются резина и большинство пластмасс. Поэтому мы используем медные провода с резиновой изоляцией. Медь переносит электричество туда, где оно нам нужно, а резина защищает нас.
Другие материалы не пропускают электроны, они известны как изоляторы. Примерами этого являются резина и большинство пластмасс. Поэтому мы используем медные провода с резиновой изоляцией. Медь переносит электричество туда, где оно нам нужно, а резина защищает нас.
Смешивая определенные материалы, мы можем вызывать химические реакции. Это когда атомы одного материала взаимодействуют с атомами другого материала и во время этого взаимодействия атомы будут связываться или распадаться, электроны также могут быть захвачены или освобождены атомами в ходе химической реакции.
Хорошо, теперь, когда мы рассмотрели основы, давайте заглянем внутрь батареи и посмотрим, как она работает.
Как работает щелочная батарея?
Помните, мы кратко говорили об атомах. Ну, все эти материалы внутри батареи состоят из множества различных атомов, плотно упакованных вместе. Они представлены цветными шариками, каждый цвет которых соответствует разному материалу и, следовательно, разному атому для нашего очень упрощенного примера. Когда мы объединим все эти материалы вместе внутри капсулы, мы получим небольшую химическую реакцию, в которой атомы начнут взаимодействовать друг с другом.
Когда мы объединим все эти материалы вместе внутри капсулы, мы получим небольшую химическую реакцию, в которой атомы начнут взаимодействовать друг с другом.
Прежде всего, атом иона гидроксида в электролите соединяется с атомом цинка в анодной части. Эта химическая реакция известна как окисление и создаст гидроксид цинка, поскольку соединение цинка и гидроксида высвобождает электроны. Эти электроны теперь могут свободно двигаться и будут собираться на латунном штифте.
В то же время атом оксида марганца соединяется с молекулой воды из электролита, а также со свободным электроном в химической реакции, известной как восстановление. Во время химической реакции оксид марганца превращается в немного другую версию оксида марганца, этой версии больше не нужен атом иона гидроксида, поэтому он выбрасывает его в электролит. Атом воды замещается атомом, выброшенным из реакции окисления. Ион гидроксида теперь свободен и может пройти через сепаратор. Но пока не будет, потому что в анодной секции для него нет места.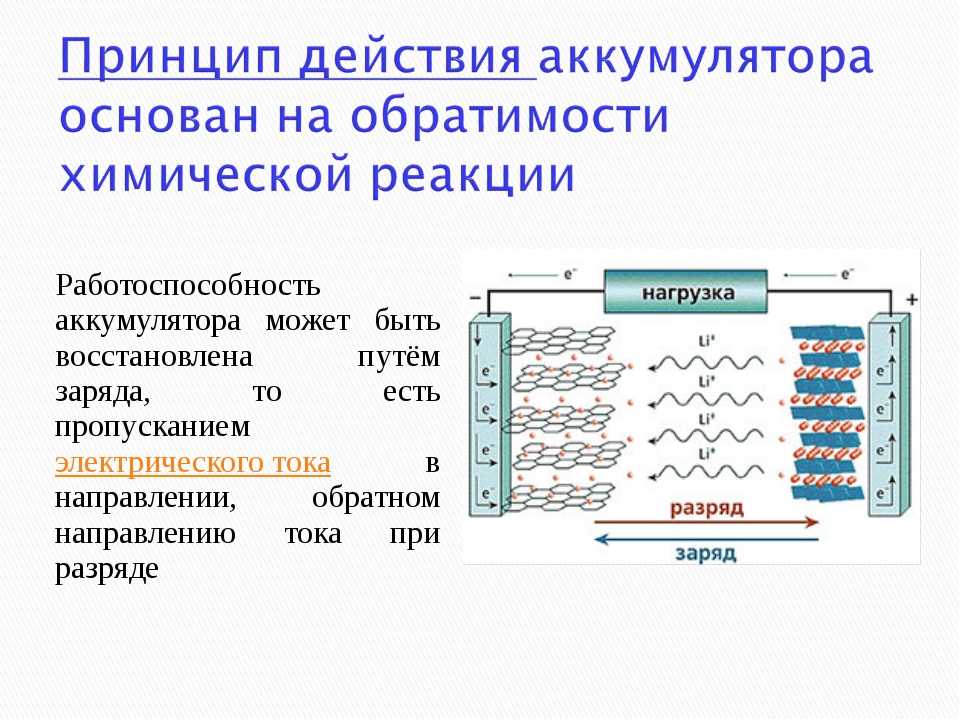
Итак, как вы можете видеть, у нас есть накопление электронов на отрицательном выводе. Поскольку электроны заряжены отрицательно, и теперь у нас больше электронов на отрицательной клемме, чем на положительной, это означает, что у нас есть разница в напряжении между двумя концами, и мы можем измерить эту разницу с помощью мультиметра.
Помните, что мы можем измерить только разницу в напряжении между двумя разными точками. Если мы измерим одну и ту же точку, мы получим ноль вольт, потому что разницы нет.
Электроны отталкиваются друг от друга и хотят переместиться в область с меньшим количеством электронов. В положительной области меньше электронов, поэтому они попытаются добраться до этой клеммы. Сепаратор не позволяет им течь внутрь аккумулятора и достигать положительной клеммы.
Следовательно, электронам нужен другой путь. Если мы предоставим электронам внешний путь, такой как провод, электроны будут течь по нему, чтобы добраться до положительной клеммы.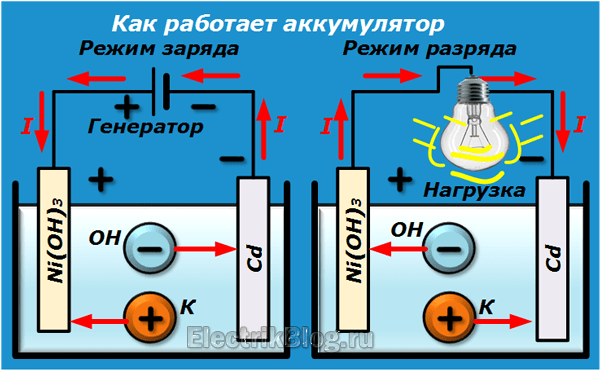 Помещая такие вещи, как лампа, на пути электронов, электроны должны будут пройти через нее, и поэтому мы заставляем их выполнять работу за нас, например, освещать лампу.
Помещая такие вещи, как лампа, на пути электронов, электроны должны будут пройти через нее, и поэтому мы заставляем их выполнять работу за нас, например, освещать лампу.
Пока у нас есть замкнутая цепь между клеммами, химическая реакция будет продолжаться, и электроны текут от отрицательной клеммы. Если мы удалим провод или разомкнем цепь, то химическая реакция прекратится.
Итак, давайте вспомним происходящую химическую реакцию. Свободные электроны попадают в батарею через положительный полюс. Это объединяется с оксидом марганца и молекулой воды на катоде, который высвобождает ион гидроксида в электролит.
Ион гидроксида проходит через сепаратор и соединяется с атомом цинка, образуя гидроксид цинка, при этом высвобождаются электроны и молекула воды. Электроны хотят добраться до области с меньшим количеством электронов, положительный полюс имеет меньше электронов, поэтому они будут течь по проводу, чтобы достичь этого, и поэтому химическая реакция повторяется снова и снова непрерывно.
Однако внутри батареи содержится лишь определенное количество материала, поэтому со временем химическая реакция будет продолжаться все труднее и труднее, и в конечном итоге электроны перестанут течь. Аккумулятор больше не будет использоваться, и его необходимо утилизировать.
Соединение батарей вместе
Мы можем использовать батарею для питания некоторых компонентов, но обычно одной батареи недостаточно для питания наших устройств, для этого нам нужно объединить батареи.
Аккумуляторы можно подключать двумя способами. Серийно или параллельно. Ранее мы подробно рассмотрели эти типы схем, ознакомьтесь с серией ЗДЕСЬ, и параллельной ЗДЕСЬ.
Серия Когда мы соединяем батареи последовательно, напряжение каждой батареи суммируется. Таким образом, две батареи по 1,5 В дают нам 3 В, а 3 батареи дают нам 4,5 В и т. д. Фактическое напряжение может немного отличаться в реальном мире. Напряжение увеличивается, потому что каждая батарея ускоряет входящие в нее электроны, поэтому мы получаем более высокое напряжение.
Если мы подключим батареи параллельно, то мы получим только 1,5 В, независимо от того, сколько мы подключим. Это потому, что путь сливается на подаче, но разделяется на обратном пути, поэтому электроны не будут ускоряться. Однако этот тип конфигурации сможет обеспечить больший ток, а также будет иметь большую емкость, поэтому мы сможем питать что-то дольше. Например, если батарея имела емкость 1200 мАч и мы поставили две параллельно, у нас будет емкость 2400 мАч, но напряжение 1,5 В. Если мы подключим их последовательно, у нас будет емкость 1200 мАч, но напряжение 3 В.
Серийные и параллельныеЕмкость
Мы используем батареи для питания наших цепей. Но как долго батарея может питать нашу схему? Когда мы смотрим на упаковку или лист данных для батареи, мы видим значение с буквами m.A.h рядом с ним. Это рейтинг в миллиампер-часах.
Пример батареи Например, этот имеет номинал 2500 мАч. Это означает, что теоретически он может обеспечить ток 2500 миллиампер в час, или 1250 мА в течение 2 часов, или 20 мА в течение 125 часов.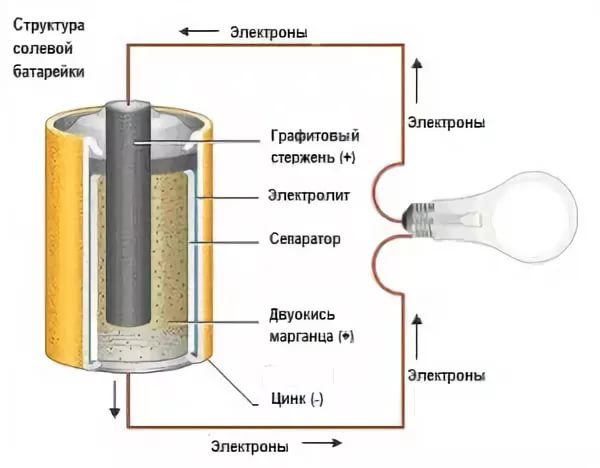 Однако в реальной жизни это, вероятно, не продлится так долго, потому что химическая реакция замедляется, поэтому внутреннее сопротивление батареи меняется по мере ее разрядки. Есть много других вещей, которые влияют на это, например, возраст и температура.
Однако в реальной жизни это, вероятно, не продлится так долго, потому что химическая реакция замедляется, поэтому внутреннее сопротивление батареи меняется по мере ее разрядки. Есть много других вещей, которые влияют на это, например, возраст и температура.
Нет реального способа точно рассчитать продолжительность жизни, лучше всего просто проверить ее. Однако мы можем оценить срок службы по следующей формуле:
Срок службы батареи = Емкость (мАч) / ток цепи (мА).
На нашем веб-сайте мы создали простой бесплатный калькулятор, с помощью которого вы можете рассчитать время работы аккумулятора, а также необходимую емкость. Проверьте это ЗДЕСЬ .
Так, например, в этой схеме мы вычисляем спрос 19мА, а батарея имеет емкость 3000 мАч. Итак, 3000/19 дает нам 157,9 часа. Это действительно лучший сценарий, и на самом деле он почти наверняка не достигнет этого.
Срок службы батареиКак измерить с помощью мультиметра
Чтобы измерить напряжение, мы просто выбираем функцию постоянного тока на нашем мультиметре, а затем подключаем красный провод к положительной клемме, а черный провод к отрицательной.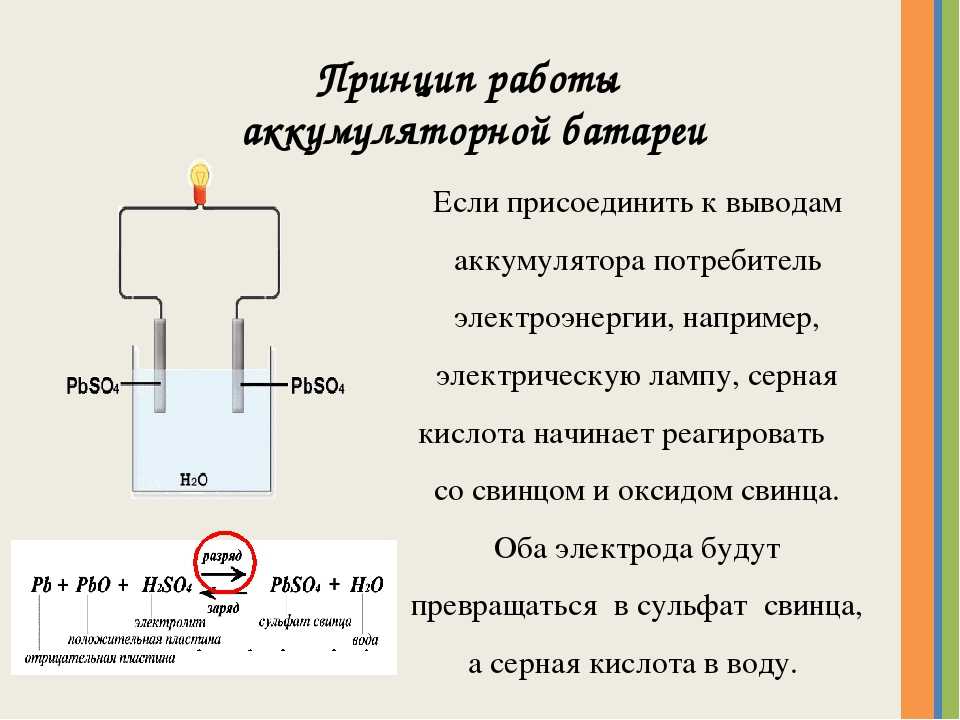 Это даст нам показания напряжения.
Это даст нам показания напряжения.
Вы можете видеть, что эта батарея рассчитана на 1,5 В, но когда мы протестировали ее, мы получили 1,593 В
Батарея разряженаКогда батарея разряжена, мы получаем более низкое напряжение, это показывает 1,07 В, поэтому она полностью разряжена.
Однако иногда мы могли получить напряжение около 1,5 В, даже если батарея разряжена.
Чтобы полностью протестировать батарею, нам нужно протестировать ее под нагрузкой, чтобы проверить, может ли она еще быть полезной. Для этого нам понадобится резистор.
Test BatteryИтак, мы берем резистор около 100 Ом, хотя он не обязательно должен быть именно таким, но мы подключаем резистор между нашими двумя щупами. В этом случае мы просто использовали несколько зажимов типа «крокодил», чтобы соединить резистор между щупами, вот так.
Таким образом, ток будет протекать через резистор, и мы сможем снять показания напряжения, когда это произойдет.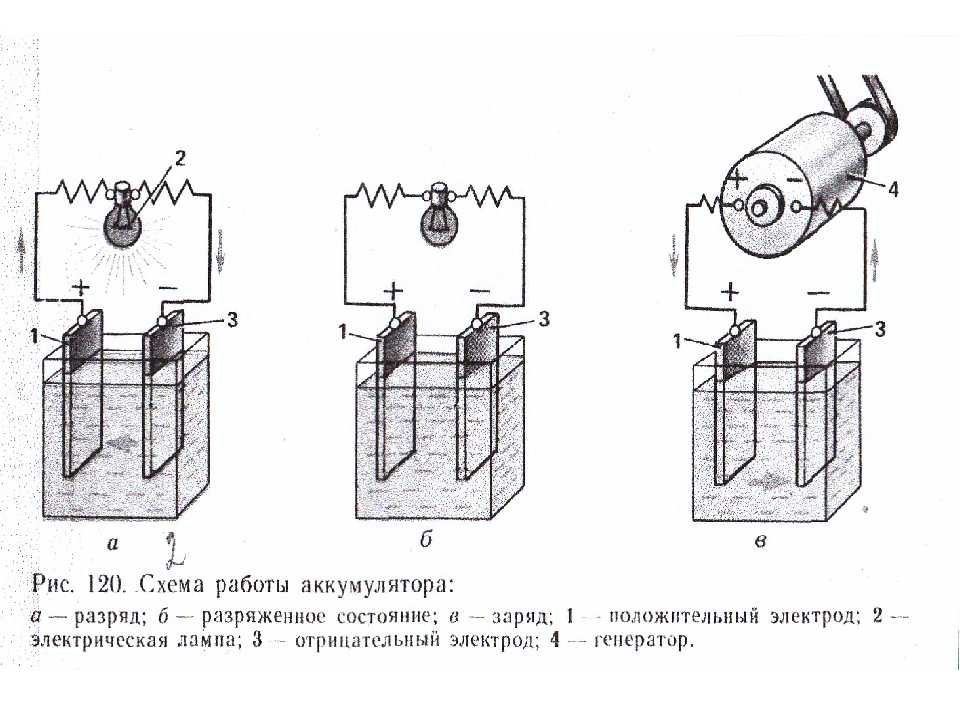 Если батарея еще в порядке, то уровень напряжения снизится лишь незначительно.
Если батарея еще в порядке, то уровень напряжения снизится лишь незначительно.
Например, эта батарея имеет номинальное напряжение 1,5 В, без нагрузки 1,593 В, с подключенным резистором 1,547 В, так что это все еще хорошо.
Пример батареиЭта батарея также рассчитана на 1,5 В, когда мы измеряем ее без нагрузки, она показывает точно 1,5 В, но когда мы подключаем резистор, она падает до 0,863 В, поэтому мы знаем, что она разрядилась.
Батарея разряженаНо теперь, когда вы полностью заряжены, оформите заказ Squarespace.com , чтобы создать свое собственное веб-присутствие в Интернете, которое содержит функции, позволяющие людям запускать, делиться и продвигать свои собственные проекты.
Существуют мощные инструменты для ведения блога, позволяющие демонстрировать фотографии, видео и обновления о ваших проектах.
Вы можете легко планировать встречи для занятий и сессий с членами команды и клиентами с помощью встроенного инструмента.



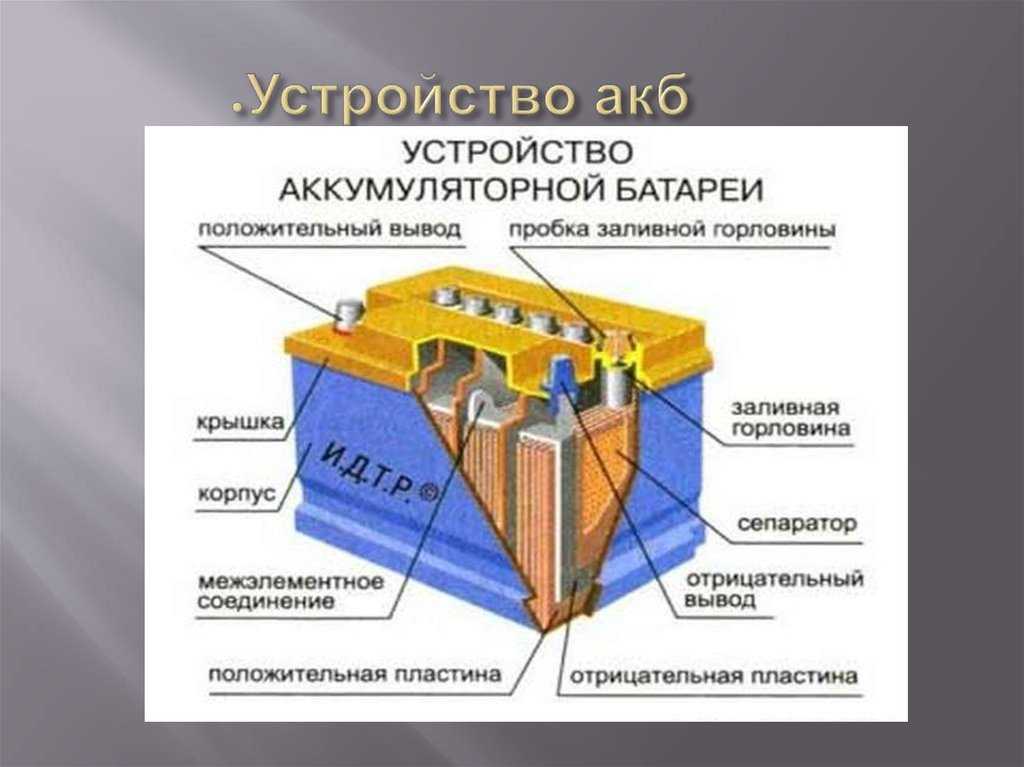
 Углеродный (графитовый) стержень собирает электроны, поступающие от анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным материалом проводника, потому что любой обычный металл быстро подвергается коррозии в положительном электроде в электролите на основе соли.
Углеродный (графитовый) стержень собирает электроны, поступающие от анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным материалом проводника, потому что любой обычный металл быстро подвергается коррозии в положительном электроде в электролите на основе соли. 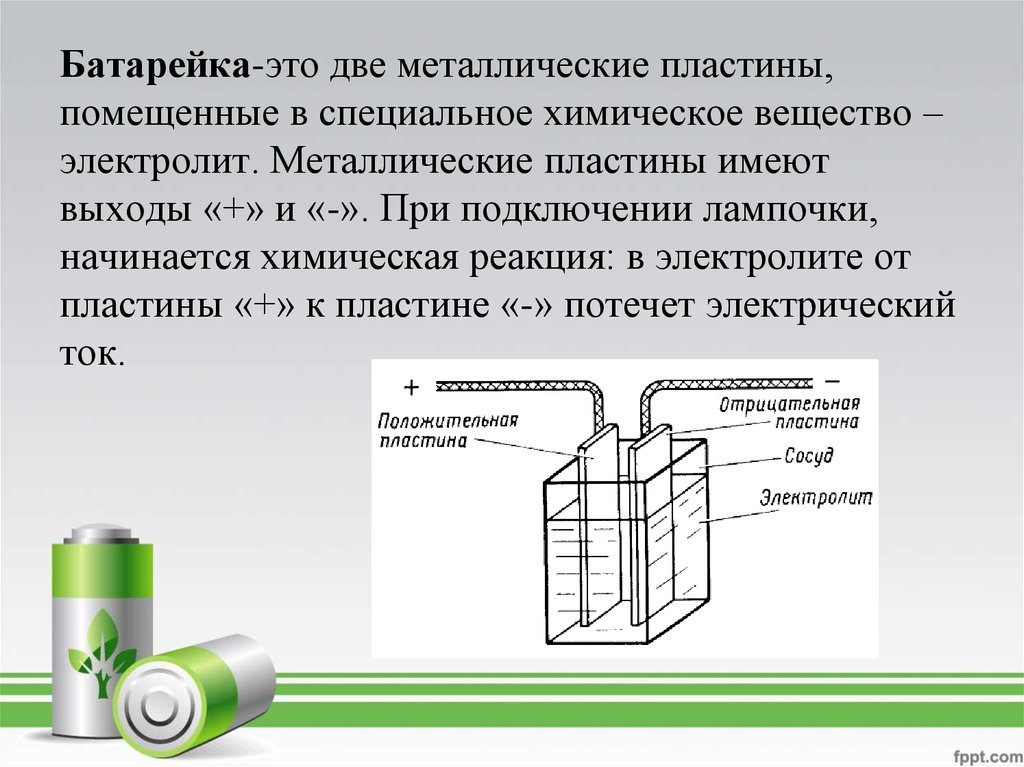 Д.С. около 1,5 В.
Д.С. около 1,5 В. 