Каковы основные свойства калия как химического элемента. Как калий взаимодействует с водой. Какие соединения образует калий. Где применяются соединения калия. Какова биологическая роль калия.
Основные свойства и характеристики калия
Калий — химический элемент с атомным номером 19, относящийся к группе щелочных металлов. Это мягкий серебристо-белый металл, обладающий высокой химической активностью. Основные характеристики калия:
- Атомная масса: 39,0983 а.е.м.
- Плотность: 0,856 г/см³
- Температура плавления: 63,5°C
- Температура кипения: 759°C
- Электронная конфигурация: [Ar] 4s¹
Калий очень активно взаимодействует с кислородом воздуха и водой, поэтому в природе встречается только в виде соединений. Как вступает калий в реакцию с водой?
Взаимодействие калия с водой
При контакте с водой калий вступает в бурную экзотермическую реакцию. Процесс протекает по следующему уравнению:
2K + 2H₂O → 2KOH + H₂↑
В результате образуется щелочь — гидроксид калия KOH и выделяется газообразный водород. Реакция сопровождается следующими явлениями:
- Выделением большого количества теплоты
- Воспламенением выделяющегося водорода
- Характерным шипением
- Появлением фиолетового пламени
Кусочек калия «бегает» по поверхности воды, оставляя за собой фиолетовый след пламени. Почему реакция калия с водой протекает так активно?
Причины высокой активности калия
Высокая химическая активность калия обусловлена особенностями его электронного строения:
- На внешнем энергетическом уровне находится всего 1 электрон
- Калий легко отдает этот электрон, превращаясь в положительно заряженный ион K⁺
- Ионный радиус K⁺ (138 пм) больше, чем у Na⁺ (102 пм), что обеспечивает меньшую энергию гидратации
- Низкий потенциал ионизации (4,34 эВ) способствует отрыву валентного электрона
Благодаря этим факторам калий даже более активен, чем натрий. Какие еще соединения может образовывать калий?
Основные соединения калия
Калий образует множество важных соединений, широко применяемых в различных отраслях:
- Гидроксид калия KOH — сильное основание, используется в производстве мыла и моющих средств
- Хлорид калия KCl — применяется как калийное удобрение
- Карбонат калия K₂CO₃ (поташ) — используется в производстве стекла и мыла
- Нитрат калия KNO₃ (селитра) — компонент черного пороха и удобрение
- Перманганат калия KMnO₄ — сильный окислитель, применяется как дезинфицирующее средство
Рассмотрим подробнее некоторые важные соединения калия и их свойства.

Гидроксид калия и его применение
Гидроксид калия KOH (едкое кали) — белое твердое вещество, хорошо растворимое в воде. Его водный раствор называется едким калием. Основные свойства и применение:
- Сильное основание, pH 1% раствора около 13
- Гигроскопичен, поглощает влагу из воздуха
- Используется в производстве жидкого мыла и шампуней
- Применяется для получения других соединений калия
- Входит в состав щелочных аккумуляторов
- Используется как осушитель газов
Гидроксид калия агрессивен по отношению к тканям организма, вызывает химические ожоги. При работе с ним необходимо соблюдать меры предосторожности.
Хлорид калия как удобрение
Хлорид калия KCl — бесцветные кристаллы, хорошо растворимые в воде. Это важнейшее калийное удобрение:
- Содержит до 60% K₂O в пересчете на оксид калия
- Улучшает качество сельскохозяйственной продукции
- Повышает устойчивость растений к засухе и заморозкам
- Увеличивает содержание крахмала в картофеле, сахара в свекле
- Применяется для всех типов почв под различные культуры
Хлорид калия также используется в нефтедобывающей промышленности, медицине, металлургии. Какова биологическая роль калия?

Биологическое значение калия
Калий играет важнейшую роль в жизнедеятельности живых организмов:
- Участвует в передаче нервных импульсов
- Регулирует водно-солевой баланс и кровяное давление
- Необходим для сокращения мышц, в том числе сердечной
- Влияет на кислотность желудочного сока
- Участвует в синтезе белков и углеводов
- Способствует выведению из организма лишней жидкости
Суточная потребность взрослого человека в калии составляет 2-3 г. Недостаток калия может приводить к мышечной слабости, аритмии, нарушениям пищеварения.
Применение соединений калия в промышленности
Соединения калия широко применяются в различных отраслях промышленности:
- Производство стекла (карбонат калия)
- Производство удобрений (хлорид и сульфат калия)
- Пиротехника (нитрат и перхлорат калия)
- Металлургия (цианид калия для извлечения золота)
- Производство мыла и моющих средств (гидроксид калия)
- Пищевая промышленность (карбонат калия Е501, сорбат калия Е202)
Калий и его соединения незаменимы во многих технологических процессах благодаря своим уникальным свойствам.

Изотопы калия и их применение
Природный калий состоит из трех изотопов:
- ⁴⁰K — радиоактивный изотоп (0,012%)
- ³⁹K — стабильный изотоп (93,3%)
- ⁴¹K — стабильный изотоп (6,7%)
Радиоактивный изотоп ⁴⁰K используется для определения возраста горных пород и археологических находок калий-аргоновым методом. Искусственный радиоактивный изотоп ⁴²K применяется как радиоактивный индикатор в медицине и биологии.
Меры предосторожности при работе с калием
При работе с металлическим калием и его активными соединениями необходимо соблюдать следующие меры безопасности:
- Хранить калий под слоем керосина или минерального масла
- Работать в защитных очках и перчатках
- Не допускать контакта калия с водой и кислотами
- Остатки калия уничтожать, растворяя в этиловом спирте
- Иметь средства пожаротушения (песок, углекислотный огнетушитель)
Соблюдение правил техники безопасности позволит избежать несчастных случаев при работе с этим активным металлом.
Калий
|
Калий |
|
|---|---|
| Атомный номер |
19 |
| Внешний вид простого вещества |
Серебристо-белый мягкий металл |
|
Атомная масса (молярная масса) |
39,0983 а. е. м. (г/моль) |
| Радиус атома |
235 пм |
|
Энергия ионизации (первый электрон) |
418,5 (4,34) кДж/моль (эВ) |
| Электронная конфигурация |
[Ar] 4s1 |
| Химические свойства | |
| Ковалентный радиус |
203 пм |
| Радиус иона |
133 пм |
|
Электроотрицательность (по Полингу) |
0,82 |
| Электродный потенциал |
−2,92 В |
| Степени окисления |
1 |
| Термодинамические свойства простого вещества | |
| Плотность |
0,856 г/см³ |
| Молярная теплоёмкость |
29,6 Дж/(K·моль) |
| Теплопроводность |
79,0 Вт/(м·K) |
| Температура плавления |
336,8 K |
| Теплота плавления |
102,5 кДж/моль |
| Температура кипения |
1047 K |
| Теплота испарения |
2,33 кДж/моль |
| Молярный объём |
45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая объёмноцентрированная |
| Параметры решётки |
5,332 Å |
| Отношение c/a | — |
| Температура Дебая |
100 K |
| K | 19 |
| 39,0983 | |
| 4s1 | |
| Калий | |
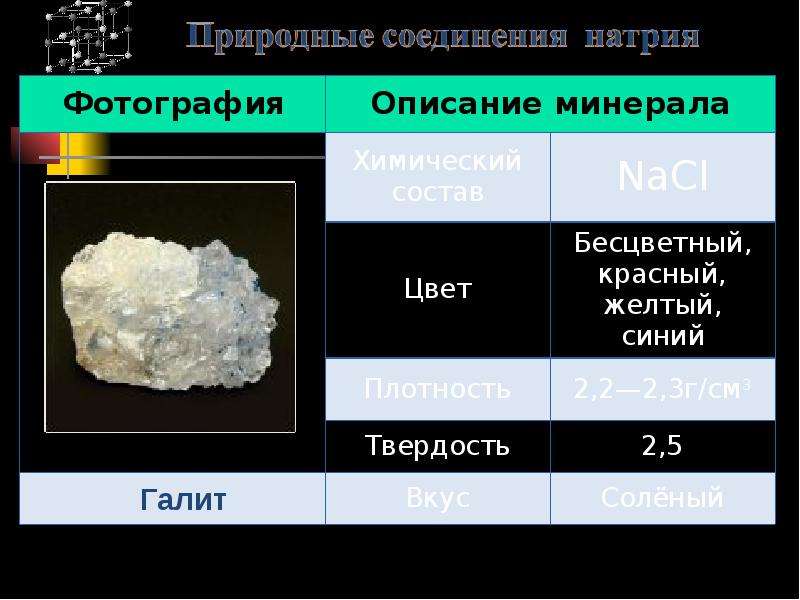
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K+ + e− → K
2Cl− − 2e− → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH− − 4e− → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Применение калия
-
Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.

- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Фиолетовый цвет пламени ионов калия в пламени горелки
- Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) — используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») — используется как удобрение.
-
Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.

- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
-
Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).

- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация различных ферментов.
- Нормализация ритма сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Электронная оболочка
Изотопы калия
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Дополнительная информация
Соединения калия
Щелочные металлы
Натрий, по химическим свойствам очень схожий с калием
— При помощи аналитического лабораторного оборудования, лабораторных и промышленных электродов, в частности: электродов сравнения ЭСр-10101 анализирующих содержание Cl— и К+.
Свойства калия и его взаимодействие с водой
[Deposit Photos]Калий — девятнадцатый элемент периодической таблицы Менделеева, относится к щелочным металлам. Это простое вещество, которое при нормальных условиях пребывает в твердом агрегатном состоянии. Закипает калий при температуре 761 °С. Температура плавления элемента — 63 °С. Калий имеет серебристо-белую окраску с металлическим блеском.
Это простое вещество, которое при нормальных условиях пребывает в твердом агрегатном состоянии. Закипает калий при температуре 761 °С. Температура плавления элемента — 63 °С. Калий имеет серебристо-белую окраску с металлическим блеском.
Химические свойства калия
Калий — элемент, обладающий высокой химической активностью, поэтому его нельзя хранить на открытом воздухе: щелочной металл моментально вступает в реакцию с окружающими веществами. Этот химический элемент относится к I группе и IV периоду таблицы Менделеева. Калий обладает всеми характерными для металлов свойствами.
Он взаимодействует с простыми веществами, к которым относятся галогены (бром, хлор, фтор, иод) и фосфор, сера, азот и кислород. Взаимодействие калия с кислородом называется окислением. В течение этой химической реакции кислород и калий расходуются в молярном соотношении 4:1, в результате чего образуется оксид калия в количестве двух частей. Такое взаимодействие можно выразить уравнением реакции:
4К + О₂ = 2К₂О
Во время горения калия наблюдается пламя ярко-фиолетового цвета.
Такое взаимодействие считается качественной реакцией на определение калия. Реакции калия с галогенами называются в соответствии с названиями химических элементов: это фторирование, иодирование, бромирование, хлорирование. Такие взаимодействия являются реакциями присоединения. Пример — реакция между калием и хлором, в результате которой образуется хлорид калия. Для проведения такого взаимодействия берут два моля калия и один моль хлора. В результате образуется два моля калия:
2К + СІ₂ = 2КСІ
Молекулярное строение хлорида калия [Wikimedia]При горении на открытом воздухе калий и азот расходуются в молярном соотношении 6:1. В результате такого взаимодействия образуется нитрид калия в количестве двух частей:
6К + N₂ = 2K₃N
Соединение представляет собой кристаллы зелено-черного цвета.
С фосфором калий реагирует по такому же принципу.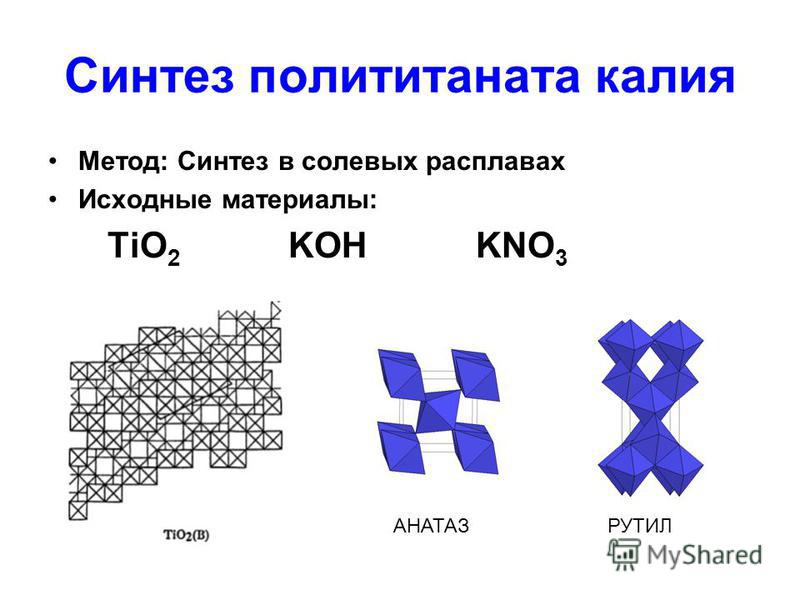 Если взять 3 моля калия и 1 моль фосфора, получится 1 моль фосфида:
Если взять 3 моля калия и 1 моль фосфора, получится 1 моль фосфида:
3К + Р = К₃Р
Калий реагирует с водородом, образуя гидрид:
2К + Н₂ = 2КН
Все реакции присоединения происходят при высоких температурах
Взаимодействие калия со сложными веществами
К сложным веществам, с которыми вступает в реакцию калий, относятся вода, соли, кислоты и оксиды. Так как калий — активный металл, он вытесняет атомы водорода из их соединений. Пример — реакция, происходящая между калием и соляной кислотой. Для ее проведения берется по 2 моля калия и кислоты. В результате реакции образуется 2 моля хлорида калия и 1 моль водорода:
2К + 2НСІ = 2КСІ + Н₂
Более детально стоит рассмотреть процесс взаимодействия калия с водой. Калий бурно взаимодействует с водой. Он движется по поверхности воды, его подталкивает выделяющийся водород:
2K + 2H₂O = 2KOH + H₂↑
В ходе реакции в единицу времени выделяется много тепла, что приводит к воспламенению калия и выделяющегося водорода. Это очень интересный процесс: при контакте с водой калий мгновенно воспламеняется, фиолетовое пламя потрескивает и быстро передвигается по поверхности воды. В конце реакции происходит вспышка с разбрызгиванием капель горящего калия и продуктов реакции.
Это очень интересный процесс: при контакте с водой калий мгновенно воспламеняется, фиолетовое пламя потрескивает и быстро передвигается по поверхности воды. В конце реакции происходит вспышка с разбрызгиванием капель горящего калия и продуктов реакции.
Основной конечный продукт реакции калия с водой — гидроксид калия (щелочь). Уравнение реакции калия с водой:
4K + 2H₂O + O₂ = 4KOH
Внимание! Не пытайтесь повторить этот опыт самостоятельно!
При неправильном проведении эксперимента можно получить ожог щелочью. Для реакции обычно используют кристаллизатор с водой, в который помещают кусочек калия. Как только водород прекращает горение, многие хотят заглянуть в кристаллизатор. В этот момент происходит завершающая стадия реакции калия с водой, сопровождающаяся слабым взрывом и разбрызгиванием образовавшейся горячей щелочи. Поэтому в целях безопасности стоит держаться на некотором расстоянии от лабораторного стола, пока реакция не завершится полностью. Здесь вы найдете самые зрелищные опыты, которые можно проводить с детьми дома.
Поэтому в целях безопасности стоит держаться на некотором расстоянии от лабораторного стола, пока реакция не завершится полностью. Здесь вы найдете самые зрелищные опыты, которые можно проводить с детьми дома.
Строение калия
[Deposit Photos]Атом калия состоит из ядра, в котором содержатся протоны и нейтроны, и электронов, вращающихся вокруг него. Количество электронов всегда равно количеству протонов, находящихся внутри ядра. При отсоединении электрона или при присоединении к атому он перестает быть нейтральным и превращается в ион. Ионы делятся на катионы и анионы. Катионы обладают положительным зарядом, анионы — отрицательным. При присоединении к атому электрона он превращается в анион; если же один из электронов покидает свою орбиту, нейтральный атом превращается в катион.
Порядковый номер калия в периодической таблице Менделеева — 19. Значит, протонов в ядре химического элемента находится тоже 19.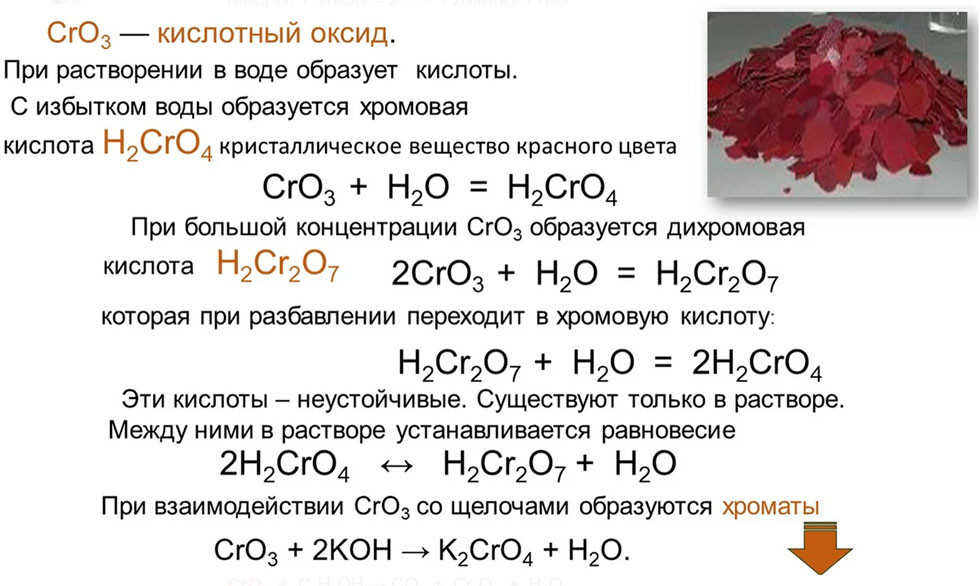 Вывод: электронов вокруг ядра расположено 19. Количество протонов в структуре атома определяется так: от атомной массы отнять порядковый номер химического элемента. Вывод: в ядре калия находится 20 протонов. Калий принадлежит к IV периоду, имеет 4 «орбиты», на которых равномерно располагаются электроны, пребывающие в постоянном движении. На первой «орбите» расположены 2 электрона, на второй — 8; на третьей и на последней, четвертой «орбите», вращается 1 электрон. Этим объясняется высокий уровень химической активности калия: его последняя «орбита» не заполнена полностью, поэтому элемент стремится соединиться с другими атомами. В результате электроны последних орбит двух элементов станут общими.
Вывод: электронов вокруг ядра расположено 19. Количество протонов в структуре атома определяется так: от атомной массы отнять порядковый номер химического элемента. Вывод: в ядре калия находится 20 протонов. Калий принадлежит к IV периоду, имеет 4 «орбиты», на которых равномерно располагаются электроны, пребывающие в постоянном движении. На первой «орбите» расположены 2 электрона, на второй — 8; на третьей и на последней, четвертой «орбите», вращается 1 электрон. Этим объясняется высокий уровень химической активности калия: его последняя «орбита» не заполнена полностью, поэтому элемент стремится соединиться с другими атомами. В результате электроны последних орбит двух элементов станут общими.
КАЛИЙ | Энциклопедия Кругосвет
Содержание статьи- Распространение калия в природе и его промышленное извлечение.
- Характеристика простого вещества и промышленное получение металлического калия.
- Соединения калия.
КАЛИЙ (Kalium) K, химический элемент 1 (Ia) группы Периодической системы, относится к щелочным элементам. Атомный номер 19, атомная масса 39,0983. Состоит из двух стабильных изотопов 39K (93,259%) и 41K (6,729%), а также радиоактивного изотопа 40K с периодом полураспада ~109 лет. Этот изотоп играет в природе особую роль. Его доля в смеси изотопов составляет всего 0,01%, однако именно он является источником практически всего содержащегося в земной атмосфере аргона 40Ar, который образуется при радиоактивном распаде 40K. Кроме того, 40K присутствует во всех живых организмах, что, возможно, оказывает определенное влияние на их развитие.
Атомный номер 19, атомная масса 39,0983. Состоит из двух стабильных изотопов 39K (93,259%) и 41K (6,729%), а также радиоактивного изотопа 40K с периодом полураспада ~109 лет. Этот изотоп играет в природе особую роль. Его доля в смеси изотопов составляет всего 0,01%, однако именно он является источником практически всего содержащегося в земной атмосфере аргона 40Ar, который образуется при радиоактивном распаде 40K. Кроме того, 40K присутствует во всех живых организмах, что, возможно, оказывает определенное влияние на их развитие.
Изотоп 40K служит для определения возраста горных пород калий-аргоновым методом. Искусственный изотоп 42K с периодом полураспада 15,52 года используется в качестве радиоактивного индикатора в медицине и биологии.
Степень окисления +1.
Соединения калия известны с древних времен. Поташ – карбонат калия K2CO3 – издавна выделяли из древесной золы.
Металлический калий был получен электролизом расплавленного едкого кали (KOH) в 1807 английским химиком и физиком Гемфри Дэви. Название «potassium», выбранное Дэви, отражает происхождение этого элемента из поташа. Латинское название элемента образовано от арабского названия поташа – «аль-кали». В русскую химическую номенклатуру слово «калий» введено в 1831 петербургским академиком Германом Гессом (1802–1850).
Распространение калия в природе и его промышленное извлечение.
Содержание калия в земной коре составляет 1,84%. Он – следующий по распространенности элемент после натрия. В литосфере калий находится, главным образом, в виде алюмосиликатов, например, полевого шпата ортоклаза K2O·Al2O3·6SiO2, на долю которого приходится почти 18% массы земной коры.
Большие отложения солей калия в сравнительно чистом виде образовались в результате испарения древних морей. Наиболее важными минералами калия для химической промышленности являются сильвин (KCl) и сильвинит (смешанная соль NaCl и KCl). Калий встречается также в виде двойного хлорида KCl·MgCl2·6H2O (карналлит) и сульфата K2Mg2(SO4)3 (лангбейнит). Массивные слои солей калия были впервые обнаружены в Стассфурте (Германия) в 1856. Из них с 1861 по 1972 в промышленных масштабах добывали поташ.
Калий встречается также в виде двойного хлорида KCl·MgCl2·6H2O (карналлит) и сульфата K2Mg2(SO4)3 (лангбейнит). Массивные слои солей калия были впервые обнаружены в Стассфурте (Германия) в 1856. Из них с 1861 по 1972 в промышленных масштабах добывали поташ.
Океанская вода содержит около 0,06% хлорида калия. В некоторых внутренних водоемах, таких как озеро Солт-Лейк или Мертвое море, его концентрация может достигать 1,5%, что делает экономически целесообразной добычу элемента. В Иордании построен огромный завод, способный добывать миллионы тонн солей калия из Мертвого моря.
Хотя натрий и калий почти одинаково распространены в горных породах, в океане калия примерно в 30 раз меньше, чем натрия. Это связано, в частности, с тем, что соли калия, содержащие больший катион, менее растворимы, чем соли натрия, и калий более прочно связывается в комплексных силикатах и алюмосиликатах в почве за счет ионного обмен в глинах. Кроме того, калий, который выщелачивается из горных пород, в большей степени поглощается растениями. Подсчитано, что из тысячи атомов калия, освобождающихся при химическом выветривании, только два достигают морских бассейнов, а 998 остаются в почве. «Почва поглощает калий, и в этом ее чудодейственная сила», – писал академик Александр Евгеньевич Ферсман (1883–1945).
Кроме того, калий, который выщелачивается из горных пород, в большей степени поглощается растениями. Подсчитано, что из тысячи атомов калия, освобождающихся при химическом выветривании, только два достигают морских бассейнов, а 998 остаются в почве. «Почва поглощает калий, и в этом ее чудодейственная сила», – писал академик Александр Евгеньевич Ферсман (1883–1945).
Калий является важным элементом жизни растений, и развитие диких растений часто ограничивается доступностью калия. При недостатке калия растения медленнее растут, их листья, особенно старые, желтеют и буреют по краям, стебель становится тонким и непрочным, а семена теряют всхожесть. Плоды такого растения – это особенно заметно на фруктах – будут менее сладкими, чем у растений, получивших нормальную дозу калия. Недостаток калия возмещают удобрениями.
Калийные удобрения являются основным видом калиесодержащей продукции (95%). Больше всего используется KCl, на его долю приходится более 90% калия, используемого в качестве удобрений.
Мировое производство калийных удобрений в 2003 оценено в 27,8 млн т (в пересчете на K2O, содержание калия в калийных удобрениях принято пересчитывать на K2O). Из них 33% было произведено в Канаде. По 13% мирового производства калийных удобрений приходится на производственные объединения «Уралкалий» и «Беларуськалий».
Характеристика простого вещества и промышленное получение металлического калия.
Калий – мягкий серебристо-белый металл с температурой плавления 63,51° С и температурой кипения 761° С. Придает пламени характерную красно-фиолетовую окраску, что связано с легкостью возбуждения его внешних электронов.
Химически очень активен, легко взаимодействует с кислородом, при нагревании на воздухе загорается. Основным продуктом этой реакции является надпероксид калия KO2.
С водой и разбавленными кислотами калий взаимодействует со взрывом и воспламенением. Серную кислоту восстанавливает до сероводорода, серы и диоксида серы, а азотную – до оксидов азота и N2.
При нагревании до 200–350° С калий реагирует с водородом с образованием гидрида KH. Металлический калий воспламеняется в атмосфере фтора, слабо взаимодействует с жидким хлором, но взрывается при соприкосновении с бромом и растирании с иодом. Калий реагирует с халькогенами и фосфором. С графитом при 250–500° С он образует слоистые соединения состава C8K–C60K.
Калий растворяется в жидком аммиаке (35,9 г в 100 мл при –70° С) с образованием ярко-голубых метастабильных растворов с необычными свойствами. Впервые это явление наблюдал, по-видимому, сэр Гемфри Дэви в 1808. Растворы калия в жидком аммиаке широко изучались с того момента, как они были получены Т.Вейлем в 1863.
Калий не растворяется в жидких литии, магнии, кадмии, цинке, алюминии и галлии и не реагирует с ними. С натрием образует интерметаллическое соединение KNa2, которое плавится с разложением при 7° С. С рубидием и цезием калий дает твердые растворы с минимальными температурами плавления около 35° С. С ртутью он образует амальгаму, содержащую два меркурида KHg2 и KHg с температурами плавления 270 и 180° С, соответственно.
С ртутью он образует амальгаму, содержащую два меркурида KHg2 и KHg с температурами плавления 270 и 180° С, соответственно.
Калий энергично взаимодействует со многими оксидами, восстанавливая их до простых веществ. Со спиртами он образует алкоголяты.
В отличие от натрия, калий не удается получать электролизом расплава хлорида, так как калий очень хорошо растворяется в расплавленном хлориде и не всплывает на поверхность. Дополнительную трудность создает образование надпероксида, который реагирует с металлическим калием с взрывом, поэтому способ промышленного производства металлического калия заключается в восстановлении расплавленного хлорида калия металлическим натрием при 850° С.
Восстановление хлорида калия натрием, на первый взгляд, противоречит обычному порядку реакционной способности (калий более реакционноспособен, чем натрий). Однако, при 850–880° С устанавливается равновесие:
Na(г) + K+(ж) Na+(ж) + K(г)
Так как калий более летуч, он испаряется раньше, это смещает равновесие и способствует протеканию реакции. Фракционной перегонкой в насадочной колонне можно получить калий 99,5%-ной чистоты, но обычно для перевозки используют смесь калия с натрием. Сплавы, содержащие 15–55% натрия, являются (при комнатной температуре) жидкими, поэтому их легче транспортировать.
Фракционной перегонкой в насадочной колонне можно получить калий 99,5%-ной чистоты, но обычно для перевозки используют смесь калия с натрием. Сплавы, содержащие 15–55% натрия, являются (при комнатной температуре) жидкими, поэтому их легче транспортировать.
Иногда калий восстанавливают из хлорида другими элементами, образующими устойчивые оксиды:
6KCl + 2Al + 4CaO = 3CaCl2 + CaO·Al2O3 + 6K
Металлический калий, производство которого является более трудным и дорогим, чем производство натрия, вырабатывается в гораздо меньших количествах (мировое производство составляет около 500 т в год). Одна из важнейших областей применения – получение надпероксида KO2 прямым сжиганием металла.
Металлический калий используют как катализатор в производстве некоторых видов синтетического каучука, а также в лабораторной практике. Сплав калия с натрием служит теплоносителем в атомных реакторах. Он же является восстановителем в производстве титана.
Калий вызывает сильные ожоги кожи. При попадании даже мельчайших его крошек в глаза возможна потеря зрения. Загоревшийся калий заливают минеральным маслом или засыпают смесью талька и хлорида натрия.
Хранят калий в герметически закрытых коробках под слоем обезвоженного керосина или минерального масла. Отходы калия утилизируют обработкой их сухим этанолом или пропанолом с последующим разложением образовавшихся алкоголятов водой.
Соединения калия.
Калий образует многочисленные бинарные соединения и соли. Почти все соли калия хорошо растворимы. Исключениями являются:
KHC4H4O6 – гидротартрат калия
KClO4 – перхлорат калия
K2Na[Co(NO2)6]·6H2O – гидрат гексанитрокобальтата(III) натрия-дикалия
K2[PtCl6] – гексахлороплатинат(IV) калия
Оксид калия K2O образует желтоватые кристаллы. Его получают при нагревании калия с гидроксидом, пероксидом, нитратом или нитритом калия:
2KNO2 + 6K = 4K2O + N2
Используют также нагревание смеси азида калия KN3 и нитрита калия или окисление калия, растворенного в жидком аммиаке, рассчитанным количеством кислорода.
Оксид калия – активатор губчатого железа, которое используется как катализатор в синтезе аммиака.
Пероксид калия K2O2 получить из простых веществ сложно, так как он легко окисляется до надпероксида KО2, оэтому используют окисление металла с помощью NO. Однако наилучшим методом его получения является количественное окисление металла, растворенного в жидком аммиаке.
Пероксид калия можно рассматривать как соль двухосновной кислоты Н2О2. Поэтому при его взаимодействии с кислотами или водой на холоде количественно образуется пероксид водорода.
Надпероксид калия KO2 (оранжевый) образуется при обычном сжигании металла на воздухе. Это соединение используется как запасной источник кислорода в дыхательных масках в шахтах, подводных лодках и космических кораблях.
При осторожном термическом разложении KO2 образуется полуторный оксид «K2О3» в виде темного парамагнитного порошка Его можно получить также окислением металла, растворенного в жидком аммиаке, или контролируемым окислением пероксида. Предполагается, что он является динадпероксид-пероксидом [(K+)4(O22–)(O2–)2].
Предполагается, что он является динадпероксид-пероксидом [(K+)4(O22–)(O2–)2].
Озонид калия KО3 можно получить при действии озона на безводный порошок гидроксида калия при низкой температуре с последующей экстракцией продукта (красного цвета) жидким аммиаком. Он используется в качестве компонента составов для регенерации воздуха в замкнутых системах.
Гидроксид калия KOH – сильное основание, относится к щелочам. Его традиционное название «едкое кали» отражает разъедающее действие этого вещества на живые ткани.
В промышленности гидроксид калия получают электролизом водных растворов хлорида или карбоната калия с железным или ртутным катодом (мировое производство составляет около 0,7 млн. т в год). Гидроксид калия можно выделить из фильтрата после отделения осадков, образующихся при взаимодействии карбоната калия с гидроксидом кальция или сульфата калия с гидроксидом бария.
Гидроксид калия применяют для получения жидкого мыла и различных соединений калия. Кроме того, он служит электролитом в щелочных аккумуляторах.
Фторид калия KF образует редкий минерал кароббиит. Получают фторид калия взаимодействием водных растворов фтороводорода или фторида аммония с гидроксидом калия или его солями.
Применяют фторид калия для синтеза различных фторсодержащих соединений калия, как фторирующий агент в органическом синтезе, а также как компонент кислотоупорных замазок и специальных стекол.
Хлорид калия KCl встречается в природе. Сырьем для его выделения служат сильвин, сильвинит, карналлит.
Из сильвинита хлористый калий получают методами галургии и флотации. Галургия (в переводе с греческого – «соляное дело») включает изучение состава и свойств природного солевого сырья и разработку способов промышленного получения из него минеральных солей. Галургический метод разделения основан на различной растворимости KCl и NaCl в воде при повышенных температурах. При нормальной температуре растворимость хлоридов калия и натрия почти одинакова. С повышением температуры растворимость хлорида натрия почти не меняется, а растворимость хлорида калия резко возрастает. На холоде готовят насыщенный раствор обеих солей, затем его нагревают и обрабатывают им сильвинит. При этом раствор дополнительно насыщается хлоридом калия, а часть хлорида натрия вытесняется из раствора, выпадает в осадок и отделяется фильтрованием. Раствор охлаждают, и из него выкристаллизовывается избыточный хлорид калия. Кристаллы отделяют на центрифугах и сушат, а маточный раствор идет на обработку новой порции сильвинита. Для выделения хлорида калия этот метод используется шире метода флотации, который базируется на разной смачиваемости веществ.
При нормальной температуре растворимость хлоридов калия и натрия почти одинакова. С повышением температуры растворимость хлорида натрия почти не меняется, а растворимость хлорида калия резко возрастает. На холоде готовят насыщенный раствор обеих солей, затем его нагревают и обрабатывают им сильвинит. При этом раствор дополнительно насыщается хлоридом калия, а часть хлорида натрия вытесняется из раствора, выпадает в осадок и отделяется фильтрованием. Раствор охлаждают, и из него выкристаллизовывается избыточный хлорид калия. Кристаллы отделяют на центрифугах и сушат, а маточный раствор идет на обработку новой порции сильвинита. Для выделения хлорида калия этот метод используется шире метода флотации, который базируется на разной смачиваемости веществ.
Хлорид калия является наиболее распространенным калийным удобрением. Кроме использования в качестве удобрений, он применяется, в основном, для производства гидроксида калия электролизом. Из него получают и другие соединения калия.
Бромид калия KBr получают взаимодействием брома с гидроксидом калия в присутствии аммиака, а также реакциями брома или бромидов с солями калия.
Бромид калия широко используется в фотографии. Он часто служит источником брома в органическом синтезе. Раньше бромид калия применялся как седативное средство в медицине («бром»). Монокристаллы бромида калия используют при изготовлении призм для ИК-спектрометров, а также в качестве матрицы при снятии ИК спектров твердых веществ.
Иодид калия KI образует бесцветные кристаллы, которые на свету приобретают желтоватую окраску за счет окисления кислородом воздуха и выделения иода. Поэтому иодид калия хранят в склянках из темного стекла.
Получают иодид калия взаимодействием иода с гидроксидом калия в присутствии муравьиной кислоты или пероксида водорода, а также обменными реакциями иодидов с солями калия. Он окисляется азотной кислотой до иодата калия KIO3. Иодид калия взаимодействует с иодом с образованием растворимого в воде комплекса K[I(I)2], а с хлором и бромом дает, соответственно, K[ICl2] и K[IBr2].
Иодид калия применяется в качестве лекарственного средства в медицине и ветеринарии. Он является реактивом в иодометрии. Иодид калия – противовуалирующее вещество в фотографии, компонент электролита в электрохимических преобразователях, добавка для повышения растворимости иода в воде и полярных растворителях, микроудобрение.
Он является реактивом в иодометрии. Иодид калия – противовуалирующее вещество в фотографии, компонент электролита в электрохимических преобразователях, добавка для повышения растворимости иода в воде и полярных растворителях, микроудобрение.
Сульфид калия K2S хорошо растворим в воде. При гидролизе создает в растворе щелочную среду:
K2S = 2K+ + S2–; S2– + H2O HS– + OH–
Сульфид калия легко окисляется на воздухе, при поджигании сгорает. Получают его взаимодействием калия или карбоната калия с серой без доступа воздуха, а также восстановлением сульфата калия углеродом.
Сульфид калия является компонентом светочувствительных эмульсий в фотографии. Его используют как аналитический реагент для разделения сульфидов металлов и как компонент составов для обработки шкур.
При насыщении водного раствора сероводородом образуется гидросульфид калия KHS, который можно выделить в виде бесцветных кристаллов. Его применяют в аналитической химии для разделения тяжелых металлов.
Его применяют в аналитической химии для разделения тяжелых металлов.
Нагреванием сульфида калия с серой получают желтые или красные полисульфиды калия KSn (n = 2–6). Водные растворы полисульфидов калия можно получить кипячением растворов гидроксида или сульфида калия с серой. При спекании карбоната калия с избытком серы на воздухе образуется так называемая серная печень – смесь KSn и K2S2O3.
Применяют полисульфиды для сульфидирования стали и чугуна. Серная печень используется как лекарственное средство для лечения кожных заболеваний и как пестицид.
Сульфат калия K2SO4 встречается в природе в месторождениях калийных солей и в водах соленых озер. Его можно получить обменной реакцией между хлоридом калия и серной кислотой или сульфатами других элементов.
Сульфат калия применяют как удобрение. Это вещество более дорогое, чем хлорид калия, но не гигроскопичное и не слеживающееся, в отличие от хлорида калия, сульфат калия можно применять на любых почвах, в том числе и засоленных.
Из сульфата калия получают квасцы и другие соединения калия. Он входит в состав шихты в производстве стекла.
Нитрат калия KNO3 – сильный окислитель. Его часто называют калийной селитрой. В природе образуется при разложении органических веществ в результате жизнедеятельности нитрифицирующих бактерий.
Получают нитрат калия обменной реакцией между хлоридом калия и нитратом натрия, а также действием азотной кислоты или нитрозных газов на карбонат или хлорид калия.
Нитрат калия – отличное удобрение, содержащее одновременно калий и азот, однако применяется меньше, чем хлорид калия, из-за высокой стоимости производства. Нитрат калия используется и для изготовления черного пороха и пиротехнических составов, в производстве спичек и стекла. Кроме того, он применяется при консервировании мясных продуктов.
Карбонат калия K2CO3 называют также поташом. Получают при действии диоксида углерода на растворы гидроксида калия или суспензии карбоната магния в присутствии хлорида калия. Является побочным продуктом при переработке нефелина в глинозем.
Является побочным продуктом при переработке нефелина в глинозем.
Значительное количество карбоната калия содержится в растительной золе. Больше всего калия в золе подсолнечника – 36,3%. В золе дров оксида калия значительно меньше – от 3,2% (еловые дрова) до 13,8% (березовые дрова). Еще меньше калия в золе торфа.
Карбонат калия используется, главным образом, для производства высококачественного стекла, используемого в оптических линзах, трубках цветных телевизоров и флуоресцентных лампах. Применяется и в производстве фарфора, красителей и пигментов.
Перманганат калия KMnO4 образует темно-фиолетовые кристаллы. Растворы этого вещества имеют красно-фиолетовый цвет. Перманганат калия получают анодным окислением марганца или ферромарганца в сильно щелочной среде.
Перманганат калия – сильный окислитель. Его используют как обесцвечивающее, отбеливающее и очищающее средство. Применяется и в органическом синтезе, например, при производстве сахарина.
Гидрид калия KH – белое твердое вещество, при нагревании разлагается на простые вещества. Гидрид калия является сильнейшим восстановителем. Он воспламеняется во влажном воздухе и в среде фтора или хлора. Гидрид калия может быть окислен даже такими слабыми окислителями, как вода и диоксид углерода:
Гидрид калия является сильнейшим восстановителем. Он воспламеняется во влажном воздухе и в среде фтора или хлора. Гидрид калия может быть окислен даже такими слабыми окислителями, как вода и диоксид углерода:
KH + H2O = KOH + H2
KH + CO2 = K(HCOO) (формиат калия)
Гидрид калия вступает также в реакции с кислотами и спиртами, при этом возможно воспламенение. Он восстанавливают сероводород, хлороводород и другие вещества, содержащие водород(I):
2KH + H2S = K2S + 2H2
KH + HCl = KCl + H2
Гидрид калия используется как восстановитель при проведении неорганических и органических синтезов.
Цианид калия KCN, известный под названием цианистый калий, образует бесцветные кристаллы, хорошо растворимые в воде и некоторых неводных растворителях. В водном растворе он постепенно гидролизуется с выделением циановодорода HCN, а при кипячении водных растворов разлагается на формиат калия и аммиак.
В присутствии цианида калия могут идти не совсем обычные реакции, например, медь реагирует с водой, выделяя из нее водород и образуя дицианокупрат(I) калия:
2Cu + 4KCN + 2H2O = 2K[Cu(CN)2] + H2
В подобных условиях идет взаимодействие и в случае золота. Правда, этот менее активный металл не способен окисляться водой, однако в присутствии кислорода переходит в раствор в виде цианокомплекса – дицианоаурата(I) калия:
4Au + 8KCN + 2H2O + O2 = 4K[Au(CN)2] + 4NaOH
Получают цианид калия взаимодействием циановодорода с избытком гидроксида калия. Он является реагентом для извлечения серебра и золота из бедных руд, компонентом электролитов для очистки платины от серебра и для гальванического золочения и серебрения. Цианид калия применяют как реактив в химическом анализе для определения серебра, никеля и ртути.
Цианид калия очень токсичен. Смертельная доза для человека 120 мг.
Комплексные соединения. Наиболее устойчивые комплексные соединения калий образует с полидентатными лигандами (молекулами или ионами, которые могут соединяться с атомом несколькими связями), например, с макроциклическими полиэфирами (краун-эфирами).
Наиболее устойчивые комплексные соединения калий образует с полидентатными лигандами (молекулами или ионами, которые могут соединяться с атомом несколькими связями), например, с макроциклическими полиэфирами (краун-эфирами).
Краун-эфиры (от английского crown – корона) содержат в цикле свыше 11 атомов, из которых не менее четырех –атомы кислорода. В тривиальных названиях краун-эфиров общее число атомов в цикле и число атомов кислорода обозначают цифрами, которые ставят, соответственно, до и после слова «краун». Такие названия намного короче систематических. Например, 12-краун-4 (рис. 1) по международной номенклатуре называется 1,4,7,10,13-тетраоксоциклододекан.
Рис. 1. ГРАФИЧЕСКАЯ ФОРМУЛА соединения 12-краун-4.
Краун-эфиры образуют устойчивые комплексы с катионами металлов. При этом катион включается во внутримолекулярную полость краун-эфира и удерживается там благодаря ион-дипольному взаимодействию с атомами кислорода. Наиболее устойчивы комплексы с катионами, геометрические параметры которых соответствуют полости краун-эфира. С катионом калия наиболее устойчивые комплексы образуют краун-эфиры, содержащие 6 атомов кислорода, например, 18-краун-6 (рис. 2).
С катионом калия наиболее устойчивые комплексы образуют краун-эфиры, содержащие 6 атомов кислорода, например, 18-краун-6 (рис. 2).
Рис. 2. ГРАФИЧЕСКАЯ ФОРМУЛА комплекса калия с 18-краун-6.
Биологическая роль калия (и натрия). Калий вместе с натрием регулируют процессы обмена веществ в живых организмах. В организме человека внутри клеток содержится большое количество ионов калия (0,12–0,16 моль/л), но относительно мало ионов натрия (0,01 моль/л). Содержание ионов натрия значительно выше во внеклеточной жидкости (около 0,12 моль/л), поэтому ионы калия контролируют внутриклеточную активность, а ионы натрия – межклеточную. Эти ионы не могут заменить друг друга.
Существование натрий-калиевого градиента с внутренней и внешней стороны клеточной мембраны приводит к возникновению разности потенциалов на противоположных сторонах мембраны. Нервные волокна способны передавать импульсы, а мышцы – сокращаться именно благодаря существованию внутреннего отрицательного заряда по отношению к внешней поверхности мембраны. Таким образом, в организме ионы натрия и калия осуществляют физиологический контроль и пусковые механизмы. Они способствуют передаче нервного импульса. Психика человека зависит от баланса ионов натрия и калия в организме. Концентрацию ионов натрия и калия, задерживаемых и выделяемых через почки, контролируют некоторые гормоны. Так, минералокортикоиды способствуют увеличению выброса ионов калия и уменьшению выброса ионов натрия.
Таким образом, в организме ионы натрия и калия осуществляют физиологический контроль и пусковые механизмы. Они способствуют передаче нервного импульса. Психика человека зависит от баланса ионов натрия и калия в организме. Концентрацию ионов натрия и калия, задерживаемых и выделяемых через почки, контролируют некоторые гормоны. Так, минералокортикоиды способствуют увеличению выброса ионов калия и уменьшению выброса ионов натрия.
Ионы калия входят в состав ферментов, катализирующих перенос (транспорт) ионов через биомембраны, окислительно-восстановительные и гидролитические процессы. Они служат и для поддержания структуры клеточных стенок и контролируют их состояние. Ион натрия активирует несколько ферментов, которые калий не может активировать, так же как ион натрия не может действовать на калиезависимые ферменты. Когда эти ионы попадают внутрь клетки, они связываются подходящими лигандами в соответствии с их химической активностью. Роль таких лигандов выполняют макроциклические соединения, модельными аналогами которых являются краун-эфиры. Некоторые антибиотики (подобные валиномицину) транспортируют ионы калия в митохондрии.
Некоторые антибиотики (подобные валиномицину) транспортируют ионы калия в митохондрии.
Установлено, что для работы (Na+–K+)–АТФ-азы (аденозинтрифосфатазы) – мембранного фермента, катализирующего гидролиз АТФ, нужны одновременно ионы натрия и калия. Транспортная АТФ-аза связывает и высвобождает ионы натрия и калия на определенных стадиях ферментативной реакции, поскольку сродство активных центров фермента к ионам натрия и калия изменяется по мере протекания реакции. При этом структурные изменения фермента этом приводят к тому, что катионы натрия и калия принимаются по одну сторону от мембраны, а высвобождаются по другую. Таким образом, одновременно с гидролизом АТФ происходит и селективное перемещение катионов щелочных элементов (работа так называемого Na–K-насоса).
Суточная потребность в калии у ребенка составляет 12–13 мг на 1 кг веса, а у взрослого – 2–3 мг, т.е. в 4–6 раз меньше. Большую часть необходимого ему калия человек получает из пищи растительного происхождения.
Елена Савинкина
Калий — информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к кальцию >
| Группа | 1 | Температура плавления | 63,5 ° С, 146,3 ° F, 336,7 К |
| Период | 4 | Температура кипения | 759°С, 1398°F, 1032 К |
| Блок | с | Плотность (г см −3 ) | 0,89 |
| Атомный номер | 19 | Относительная атомная масса |
39. 098 098
|
| Состояние при 20°С | Твердый | Ключевые изотопы | 39 К |
| Электронная конфигурация | [Ар] 4с 1 | КАС номер | 7440-09-7 |
| ChemSpider ID | 4575326 |
ChemSpider — бесплатная база данных химической структуры.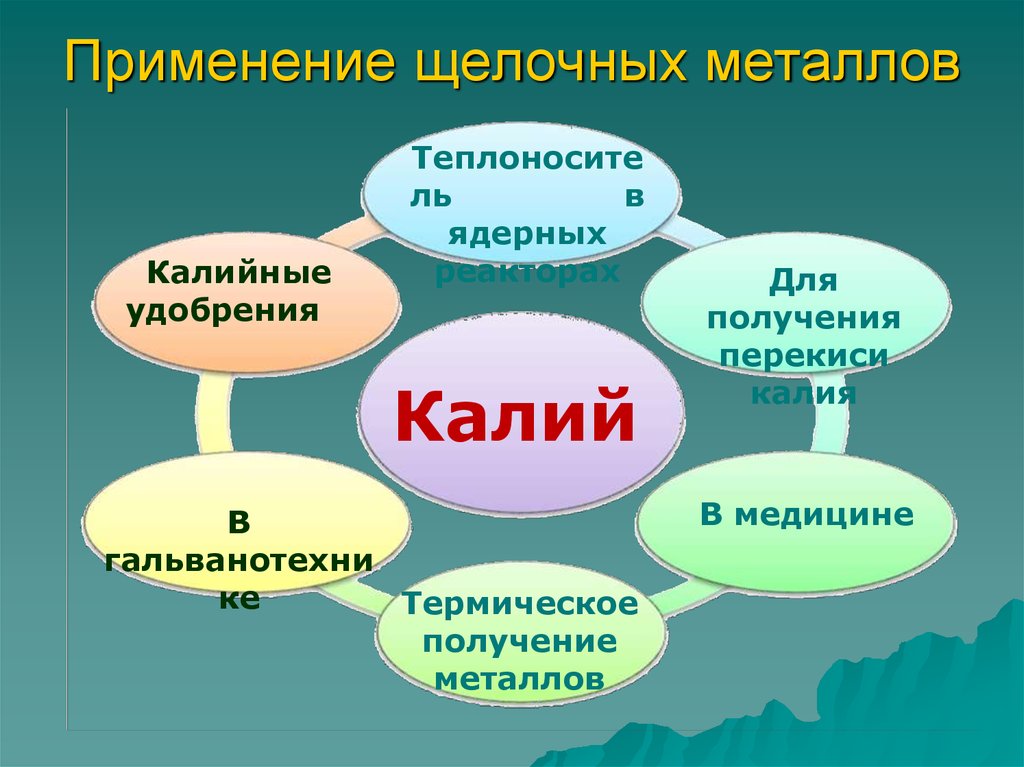
|
|
На изображении изображен алхимический символ поташа, из которого этот элемент был впервые выделен.
Мягкий серебристый металл, который тускнеет на воздухе в течение нескольких минут.
Наибольший спрос на калийные соединения приходится на удобрения. Большое значение имеют многие другие соли калия, включая нитрат, карбонат, хлорид, бромид, цианид и сульфат. Карбонат калия используется в производстве стекла. Гидроксид калия используется для изготовления моющих средств и жидкого мыла. Хлорид калия используется в фармацевтических препаратах и капельницах с физиологическим раствором.
Калий необходим для жизни. Ионы калия присутствуют во всех клетках. Это важно для поддержания водно-электролитного баланса.
Растительные клетки особенно богаты калием, который они получают из почвы. Сельскохозяйственные угодья, с которых каждый год собирают урожай, нуждаются в пополнении запасов калия за счет внесения удобрений на основе калия.
В среднем человек потребляет до 7 граммов калия в день и хранит около 140 граммов в клетках тела. Нормальная здоровая диета содержит достаточно калия, но некоторые продукты, такие как растворимый кофе, сардины, орехи, изюм, картофель и шоколад, содержат калий выше среднего.
Встречающийся в природе изотоп калия-40 является радиоактивным, и, хотя эта радиоактивность невелика, он может быть одной из естественных причин генетической мутации у людей.
Калий является седьмым по распространенности металлом в земной коре. Она составляет 2,4% по массе. По всему миру имеются залежи миллиардов тонн хлорида калия. Добыча полезных ископаемых составляет около 35 миллионов тонн в год.
Большинство минералов калия находятся в магматических породах и плохо растворимы. Металл трудно получить из этих минералов. Однако есть и другие минералы, такие как сильвит (хлорид калия), сильвинит (смесь хлорида калия и натрия) и карналлит (хлорид калия и магния), которые обнаруживаются в отложениях, образованных в результате испарения старых морей или озер. Из них можно легко извлечь соли калия. Соли калия также встречаются в океане, но в меньших количествах по сравнению с натрием.
Из них можно легко извлечь соли калия. Соли калия также встречаются в океане, но в меньших количествах по сравнению с натрием.
История элементов и периодической таблицы
Соли калия в виде селитры (нитрат калия, KNO 3 ), квасцов (сульфат алюминия калия, KAl(SO 4 ) 2 ) и калия (карбонат калия, K 2 CO 3 ) известны веками. Они использовались в производстве пороха, крашении и мыловарении. Их соскребали со стен туалетов, изготавливали из глины и серной кислоты и собирали соответственно в виде древесной золы. Превращение их в элемент победило первых химиков, и Антуан Лавуазье классифицировал калий как «землю». Затем в 1807 году Гемфри Дэви подверг влажный калий воздействию электрического тока и наблюдал образование металлических глобул нового металла, калия. Он заметил, что когда их бросали в воду, они скользили по поверхности, горя пламенем бледно-лилового цвета.
| Атомный радиус, несвязанный (Å) | 2,75 | Ковалентный радиус (Å) |
2. 00 00
|
| Сродство к электрону (кДж моль −1 ) | 48.385 |
Электроотрицательность (шкала Полинга) |
0,82 |
|
Энергии ионизации (кДж моль −1 ) |
1 ст 418,81 2 -й 3051,83 3 рд
4419. 4 -й 5876,92 5 -й 7975,48 6 -й 9590,6 7 -й 11342,82 8 -й 14943,65 |
||
| Общие степени окисления | 1 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 39 К | 38,964 |
93. 2581 2581
|
— | — | |
| 40 К | 39.964 | 0,0117 | 1,248 x 10 9 г | β- | |
|
|
β+ | ||||
| 41 К | 40,962 |
6. 7302 7302
|
— | — | |
|
|
|
Удельная теплоемкость (Дж кг −1 К −1 ) |
757 | Модуль Юнга (ГПа) | Неизвестный | |||||||||||
| Модуль сдвига (ГПа) | Неизвестный | Объемный модуль (ГПа) |
3. 1 1
|
|||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
|
|||||||||||||
| Давление (Па) |
|
|||||||||||||
| Слушайте подкаст о калии |
|
Стенограмма: (Promo) Вы слушаете химию в ее стихии, представленную вам Chemistry World , журнал Королевского химического общества. (Конец рекламного ролика) Крис Смит Здравствуйте, на этой неделе рассказ о первом выделенном щелочном металле, почему это вообще щелочной металл и почему его символ начинается с буквы K. Вот Питер Уотерс. Peter Wothers Калий — единственный элемент, названный в честь кухонной утвари. Он был назван в 1807 году Гемфри Дэви в честь соединения, из которого он выделил металл, поташ или гидроксид калия. Выдержка из 1730-х годов голландского химика Германа Бурхаве описывает, как поташ получил свое название: «Потас или поташ ежегодно привозят торговые корабли в большом количестве из Керланда (ныне часть Латвии и Литвы), Россия , и Польша.Он готовится там из древесины зеленой пихты, сосны, дуба и тому подобного, из которых они делают большие кучи в соответствующих траншеях и сжигают их, пока они не превратятся в пепел… Затем этот пепел растворяется в кипящей воде, и когда жидкость наверху, содержащая соль, очищается, т. Еще раньше, в 16-м веке, Конрад Геснер говорит нам, что «из хербы, называемой Кали, самка certayne приготавливает Соль». широко известный как солянка: » Kali имеет два локтя высоты, не имеет колючек или шипов, иногда бывает очень красным, соленым на вкус, с определенным неблагодарным запахом, найденным и собранным в соленых местах: из которых , Соль Щелочь можно купить» Его метод производства этой щелочной соли очень похож на описанный Бурхаве, причем оба процесса на самом деле дают нечистую смесь того, что мы сейчас называем карбонатом калия и натрия; метод древесной золы дает больше карбоната калия, поташ, соленые травы, дающие больше карбоната натрия, сода. Неочищенный калий можно сделать более едким или «чистым», обработав его раствор известковой водой, гидроксидом кальция. Растворы карбоната калия и гидроксида кальция реагируют с небольшой заменой химических партнеров: нерастворимый карбонат кальция или мел выпадают в осадок, оставляя раствор гидроксида калия. Именно из этого чистого гидроксида Дэви впервые выделил металлический калий. Для этого он использовал относительно новую силу электричества. После безуспешной попытки электролиза водных растворов поташа, в ходе которой ему удалось только разделить воду, он решил, что ему нужно покончить с водой и попытаться провести электролиз расплавленного гидроксида калия. Он сделал это шестого октября 1807 года, используя большой Вольтов котел, который он построил в Королевском институте в Лондоне. Его младший двоюродный брат, Эдмунд Дэви, помогал Хамфри в то время, и он рассказывает, как, когда Хамфри впервые увидел, что «мельчайшие шарики калия прорываются сквозь корку поташа и загораются, входя в атмосферу, он не мог сдержать свою радость». Дэви имел полное право быть в восторге от этого удивительного нового металла: он выглядел точно так же, как другие яркие, блестящие металлы, но его плотность была меньше плотности воды. Это означало, что металл будет плавать на воде — по крайней мере, если он не взорвется, как только соприкоснется с водой. Калий настолько реакционноспособен, что может даже прожечь дыру во льду. Это был первый выделенный щелочной металл, но Дэви продолжил выделение натрия, кальция, магния и бария. В то время как Дэви назвал свой новый металл калий в честь поташа, Берцелиус, шведский химик, который изобрел международную систему химических символов, используемую в настоящее время химиками всего мира, предпочел название калий для металла, лучше отражающее его истинное происхождение, как он думал. . Следовательно, из-за маленькой соленой травы мы теперь получаем символ К для элемента калий-пепел-ий, калий. Крис Смит Кембриджский химик Питер Уотерс. Bea Perks Мышьяк получил свое название от персидского слова, обозначающего желтый пигмент, ныне известный как аурипигмент. Для проницательных лексикографов очевидно, что рассматриваемое персидское слово зарних было впоследствии заимствовано греками для их слова арсеникон, что означает мужской или могущественный. Сообщается, что на передней части пигмента обои Наполеона незадолго до его смерти содержали так называемую зелень Шееле, которая выделяла пары мышьяка, когда становилась влажной. Крис Смит Так сильно или нет, но лизать обои в апартаментах Наполеона определенно нельзя. Это Беа Перкс, которая будет с нами в следующий раз, чтобы рассказать нам смертельную историю о мышьяке, я надеюсь, вы сможете присоединиться к нам. Я Крис Смит, спасибо за внимание и до свидания. (Промо) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists. (окончание акции) |
Нажмите здесь, чтобы посмотреть видео о калии
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
W. M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г. 7 906 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
7 906 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные массы и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd, New York, 2nd. Издание 2011 г.
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.
Периодическая таблица видео, по состоянию на декабрь 2014 г.
Частично получены из материалов, предоставленных Британской геологической службой © NERC.
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
, созданные The Nake Scients Scientists. .
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
Соединения калия, используемые в производстве калийных удобрений
Как один из трех макроэлементов, необходимых растениям для здорового роста, калий является ключевым компонентом для повышения урожайности, получения качественных культур и удовлетворения глобальных потребностей в области продовольственной безопасности.
По мере того, как максимальное повышение продуктивности сельского хозяйства становится необходимым для обеспечения будущего глобального снабжения продовольствием, питание сельскохозяйственных культур становится все более специализированным, а роль производства калийных удобрений из различных соединений калия растет.
Далее следует обзор этих соединений калия и роли, которую они играют в обеспечении сбалансированного питания сельскохозяйственных культур для повышения продуктивности сельского хозяйства.
Критическая природа производства калийных удобрений
В то время как макроэлементам азота и фосфора исторически уделялось наибольшее внимание, все больше внимания уделяется калийным удобрениям. По оценкам исследовательской фирмы Research and Markets, рынок калийных удобрений будет значительно расти в ближайшие годы, достигнув рыночной стоимости в 25,05 млрд долларов США в 2024 году по сравнению с 19,70 млрд долларов США только в 2018 году.
Растущий спрос на калийные удобрения может быть восходит к нескольким ключевым влияниям:
Необходимость повышения производительности сельского хозяйства
Ожидается, что к 2050 году в мире будет проживать более 9 миллиардов человек. до уровня 2007 года). Поскольку количество пахотных земель останется прежним (или уменьшится по мере прихода к власти большего населения), это потребует от производителей выращивать значительно больше продуктов питания на тех же участках, что требует значительного повышения производительности сельского хозяйства.
до уровня 2007 года). Поскольку количество пахотных земель останется прежним (или уменьшится по мере прихода к власти большего населения), это потребует от производителей выращивать значительно больше продуктов питания на тех же участках, что требует значительного повышения производительности сельского хозяйства.
По мере того, как развивается сельское хозяйство и ученые лучше понимают возделывание земли, они обнаруживают, что оптимальная сельскохозяйственная продуктивность в значительной степени является результатом обеспечения сбалансированной программы питания, специфичной для культуры, почвы и условий.
Это означает, что больше, чем когда-либо, производители должны адаптировать свои программы удобрений к уникальным потребностям своей культуры и почвы, обеспечивая нужные питательные вещества в точном количестве, в нужное время и в нужном месте, принцип, известный как 4Rs. В результате удобрения и почвенные добавки становятся все более специализированными, включая различные комбинации макро- и микроэлементов в различных количествах.
Культурам для нормального роста требуется большое количество калия. Если содержания калия недостаточно, растения ограничены как в росте, так и в урожайности.
Калий также играет роль в устойчивости растений к стрессу. Поскольку биотические и абиотические нагрузки на растения увеличиваются, обеспечение достаточного количества калия будет иметь решающее значение. Кроме того, калий признан за его жизненно важную роль в управлении водопользованием, что будет становиться все более важным по мере истощения водных ресурсов и эскалации случаев засухи.
Спрос на продукты более высокого качества
В дополнение к увеличению количества необходимых продуктов питания растет спрос на продукты более высокого качества; развивающиеся страны и более высокие доходы требуют более высококачественных продуктов питания, чем когда-либо прежде.
Калий известен как «качественное питательное вещество», поскольку он вносит существенный вклад в связанные с качеством аспекты сельскохозяйственных культур, такие как цвет, вкус, размер и многое другое.
Калий также играет важную роль в удовлетворении потребностей в питании животных в мясной и птицеводческой промышленности, а также при выращивании сельскохозяйственных культур для использования в качестве корма для животных.
Увеличение дефицита калия в почве
По мнению экспертов, дефицит калия в почве также растет, поскольку уровни природного калия в почве продолжают потребляться со скоростью, превышающей агротехнические затраты.
Недавнее исследование связало повышенную распространенность гипокалиемии (низкий уровень калия в сыворотке крови) в Соединенных Штатах с методами ведения сельского хозяйства, которые постоянно удаляют калий из почвы без адекватного его добавления.
Дефицит калия особенно распространен в регионах с песчаной почвой, а также в регионах с низким содержанием глины.
Соединения калия, используемые в производстве удобрений
Исторически термин поташ использовался для обозначения KCl или хлорида калия. Однако по мере того, как другие соединения калия находят все более широкое применение, значение этого термина становится более гибким. И хотя хлорид калия и сульфат калия по-прежнему занимают львиную долю рынка, другие соединения калия также играют большую роль в растениеводстве. К соединениям калия, наиболее часто используемым в производстве удобрений, относятся:
Однако по мере того, как другие соединения калия находят все более широкое применение, значение этого термина становится более гибким. И хотя хлорид калия и сульфат калия по-прежнему занимают львиную долю рынка, другие соединения калия также играют большую роль в растениеводстве. К соединениям калия, наиболее часто используемым в производстве удобрений, относятся:
Хлорид калия (KCl)
Хлорид калия (KCl), также известный как хлористый калий или MOP, в настоящее время является наиболее часто используемым соединением калия в производстве удобрений. KCl используется как простое удобрение, а также в составных тукосмесях и комплексных удобрениях.
Хлорид калия выбран из-за высокого содержания калия, а остальная часть состоит из хлоридов.
Производство хлорида калия
Хлорид калия получают из сильвинита, минерала, состоящего из сильвита и галита. Он добывается либо традиционными методами, либо с помощью майнинга раствором.
KCl, предназначенный для использования в качестве удобрения, обычно продается в виде порошка, кристаллов или прессованных гранул, но практика гранулирования калия в округлые гранулы растет.
Сульфат калия (K
2 SO 4 )Сульфат калия (K 2 SO 4 ) быстро становится популярной альтернативой удобрениям хлорида калия. Сульфат калия, также известный как Сульфат калия, или SOP, идеален для культур, чувствительных к хлоридам (или там, где в почве накопился избыток хлоридов), культур, которым требуется сера, или для почв с высоким содержанием солей.
Производство сульфата калия
Сульфат калия, как правило, не встречается в виде природного соединения, и поэтому его производят либо с помощью Мангеймского процесса, либо, чаще, путем переработки сложных солей. Соединение часто получают из сульфата калия-магния, который в природе встречается в нескольких местах по всему миру в виде минерала лангбейнита.
Как и в случае с хлоридом калия, удобрение на основе сульфата калия обычно имеет форму порошка, кристаллов, уплотненных гранул или округлых гранул.
Сульфат калия-магния (K
2 SO 4 ·2MgSO 4 ) Сульфат калия-магния также известен как сульфат калия-магнезии или SOPM.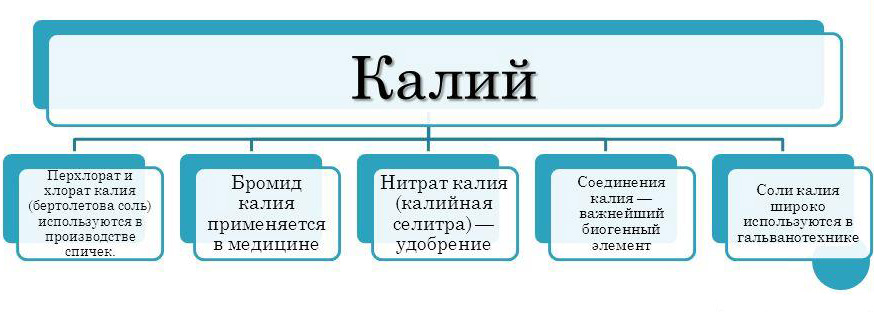 Подобно SOP, SOPM также является хорошим вариантом для культур, чувствительных к хлоридам, или для почв с высоким содержанием солей. Однако, помимо обеспечения калием и серой, SOPM также обеспечивает важным питательным веществом магнием.
Подобно SOP, SOPM также является хорошим вариантом для культур, чувствительных к хлоридам, или для почв с высоким содержанием солей. Однако, помимо обеспечения калием и серой, SOPM также обеспечивает важным питательным веществом магнием.
Производство сульфата калия-магния
Как уже упоминалось, сульфат калия-магния встречается в природе в виде минерального лангбейнита и может служить источником SOP при удалении магния. SOPM можно перерабатывать в порошок, кристаллы, прессованные гранулы или округлые гранулы.
Нитрат калия (KNO
3 )Нитрат калия, также известный как Нитрат калия или NOP, обеспечивает растения двумя из трех основных макроэлементов: азотом и калием. Нитрат калия также служит эффективным удобрением для культур, чувствительных к хлоридам.
Производство нитрата калия
Нитрат калия получают реакцией хлорида калия (KCl) с источником нитрата, таким как нитрат натрия или аммония. Нитрат калия обычно поставляется в виде кристаллов для легкого растворения, но он также может быть агломерирован/гранулирован в гранулы.
Другие соединения калия, используемые в питании сельскохозяйственных культур
Перечисленные выше соединения представляют собой наиболее часто используемые соединения калия, но иногда также используются и некоторые другие:
Разработка технологии производства калийных удобрений
По мере того, как рынки становятся все более специализированными, специальные удобрения, предназначенные для их предполагаемого применения, все чаще становятся нормой. Это привело к новой волне разработки специальных удобрений и продуктов для улучшения почвы, включающих калий и другие питательные вещества новыми способами и даже из нетрадиционных источников.
Инновационный центр FEECO был в авангарде этого развития, работая с производителями удобрений над разработкой новых продуктов, улучшением существующих и созданием производственных линий, необходимых для стабильного производства качественного продукта в промышленных масштабах.
Инновационный центр, служивший центром разработки процессов грануляции в промышленности удобрений, оборудован для тестирования всех видов инструментов и методов гранулирования удобрений, от сушки добытого калия до гранулирования нового источника калия в продукт удобрения премиум-класса. . Испытания сосредоточены вокруг методов влажной грануляции с программами, варьирующимися от отдельного оборудования до непрерывного пилотного цикла. Этот объект сыграл особую роль в содействии развитию в связи с растущим интересом к альтернативным источникам калия.
Результаты испытаний затем используются для проектирования и изготовления специального оборудования, необходимого для создания полной линии грануляции калия или другого промышленного оборудования.
Заключение
Роль калия в обеспечении продовольствием растущего населения мира за счет максимальной производительности сельского хозяйства важна как никогда. И по мере того, как производители будут проводить все более специализированные программы питания сельскохозяйственных культур, количество калия в его многочисленных формах будет продолжать расти.
Работаем на рынке удобрений с 19 лет51, FEECO является ведущим поставщиком оборудования для грануляции калия и удобрений, систем, разработки процессов, запасных частей и сервисной поддержки. Мы продолжаем помогать крупнейшим игрокам отрасли в разработке нестандартных продуктов калийных удобрений и систем, необходимых для их производства. Для получения дополнительной информации о нашем оборудовании или услугах по производству удобрений свяжитесь с нами сегодня!
Об авторе. . . Кэрри Карлсон — технический писатель и визуальный дизайнер. Подробнее о Кэрри
Калий (К) и вода
- Домашняя
- Таблица Менделеева
- Элементы и вода
- Калий в воде (К + Н3О)
 Реки обычно содержат около 2-3 частей на миллион калия. Это различие в основном обусловлено большой концентрацией калия в океанических базальтах. Богатый кальцием гранит содержит до 2,5% калия. В воде этот элемент в основном присутствует в виде К9.0052 + (водн.) ионы.
Реки обычно содержат около 2-3 частей на миллион калия. Это различие в основном обусловлено большой концентрацией калия в океанических базальтах. Богатый кальцием гранит содержит до 2,5% калия. В воде этот элемент в основном присутствует в виде К9.0052 + (водн.) ионы. 40 K — распространенный в природе радиоактивный изотоп калия. Морская вода содержит естественную концентрацию около 4,5 . 10 -5 г/л.
Как и в какой форме калий реагирует с водой?
Калий быстро и интенсивно реагирует с водой с образованием бесцветного основного раствора гидроксида калия и газообразного водорода по следующему механизму реакции:
2K (т) + 2H + Н 2 (g)
Это экзотермическая реакция, и калий нагревается до такой степени, что горит фиолетовым пламенем. Кроме того, выделяющийся в ходе реакции водород сильно реагирует с кислородом и воспламеняется. Калий реагирует с водой медленнее, чем рубидий, который в периодической таблице стоит под калием. Он реагирует с водой быстрее, чем натрий, который находится выше в периодической таблице.
Он реагирует с водой быстрее, чем натрий, который находится выше в периодической таблице.
Растворимость калия и соединений калия
Калий не растворяется в воде, но реагирует с водой, как было объяснено ранее. Соединения калия могут быть водорастворимыми. Примерами являются дихромат калия с растворимостью в воде 115 г/л, перманганат калия с растворимостью в воде 76 г/л, йодид калия с растворимостью в воде 92 г/л и йодид калия, из которых даже до 1480 г может растворить в одном литре воды.
Почему в воде присутствует калий?
Калий содержится в различных минералах, из которых он может быть растворен в результате процессов выветривания. Примерами являются полевые шпаты (ортоклаз и микроклин), которые, однако, не имеют большого значения для получения калийных соединений, и наиболее благоприятные для производственных целей хлорсодержащие минералы карналит и сильвит. Некоторые глинистые минералы содержат калий. Он попадает в морскую воду в результате естественных процессов, где в основном оседает в отложениях.
Элементарный калий извлекается из хлорида калия, но не используется во многих целях из-за его большой реактивной мощности. Применяется в сплавах и в органическом синтезе.
Ряд соединений калия, в основном нитрат калия, являются популярными синтетическими удобрениями. 95% применяемого в промышленных масштабах калия добавляется к синтетическим удобрениям. Также регулярно применяются соли калия и смеси соединений магния и кальция. При регенерации выделяются сточные воды, опасные при сбросе в поверхностные воды и трудно поддающиеся очистке.
Калий применяется в производстве стекла, чтобы сделать его более прочным и твердым. Это стекло в основном применяется в телевизионных экранах. Другие соединения калия применяются в производстве жидкого мыла, добавляются в лекарства или настои, применяются в фотографии или дублении. В большинстве случаев калий является не активным ингредиентом, а соседним анионом. Это также относится к применению хлората калия в спичках и фейерверках, а также к нитрату калия в виде порошка. Калиевые квасцы являются основой бумажного клея и применяются в качестве наполнителя синтетического каучука.
Калиевые квасцы являются основой бумажного клея и применяются в качестве наполнителя синтетического каучука.
Соединения калия являются наиболее реакционноспособными основными химическими соединениями, что, например, относится к гидроксидам и нитратам калия. Гидроксид калия образует едкий кали и применяется в моющих средствах, смягчителях, зеленом мыле, обессеривании масла и поглотителях углекислого газа.
Другие примеры применения соединения калия включают йодид калия для измерения окислительной способности образцов отходов, дихромат калия для измерения окислительной способности органических веществ в почвоведении и биологической очистке сточных вод, а также дицианоуреат калия, который представляет собой чрезвычайно токсичное водорастворимое соединение золота, которое применяется для технического золочения. Соединения калия могут попасть в сточные воды с мочой. Необычное применение — увеличение количества дождя в засушливых регионах с помощью хлорида калия. Он высвобождается из самолетов прямо под облаками, поднимается вверх и удваивает количество влаги в облаках, вызывая усиление дождя.
Поскольку выбросы калия со свалок бытовых отходов обычно исключительно высоки, это соединение может применяться в качестве индикатора других токсичных соединений в подземных водах.
Каково воздействие калия в воде на окружающую среду?
Калий необходим почти любому организму, кроме ряда бактерий, поскольку он играет важную роль в нервных функциях.
Калий играет центральную роль в росте растений и часто его ограничивает. Калий из мертвых растений и животных часто связывается с глинистыми минералами в почве, прежде чем он растворится в воде. Следовательно, он легко снова усваивается растениями. Вспашка может нарушить этот естественный процесс. Следовательно, калийные удобрения часто добавляют в сельскохозяйственные почвы. Растения содержат в среднем около 2% калия (сухая масса), но значения могут варьироваться от 0,1 до 6,8%. Личинки комаров содержат от 0,5 до 0,6 % калия, а жуки — от 0,6 до 0,9 %.% калия (сухая масса). Соли калия могут убивать растительные клетки из-за высокой осмотической активности.
Калий слабо опасен в воде, но довольно быстро распространяется из-за его относительно высокой подвижности и низкого потенциала трансформации. Токсичность калия обычно вызывается другими компонентами соединения, например, цианидом в цианиде калия.
Значение LD 50 для крыс составляет 5 мг/кг. Для бромата калия это 321 мг/кг, для фторида калия — 245 мг/кг. Примеры LD 50 значения для водных организмов включают 132 мг/л для рыб и 1,16 мг/л для дафний.
Один из трех встречающихся в природе изотопов калия — 40 К, который является радиоактивным. Предполагается, что это соединение вызывает модификации генов растений и животных. Однако он не имеет класса радиотоксичности из-за своего природного происхождения. Всего существует двенадцать нестабильных изотопов калия.
Как влияет на здоровье содержание калия в воде?
Калий является для нас диетической потребностью, и мы потребляем около 1-6 г в день при потребности 2-3,5 г в день.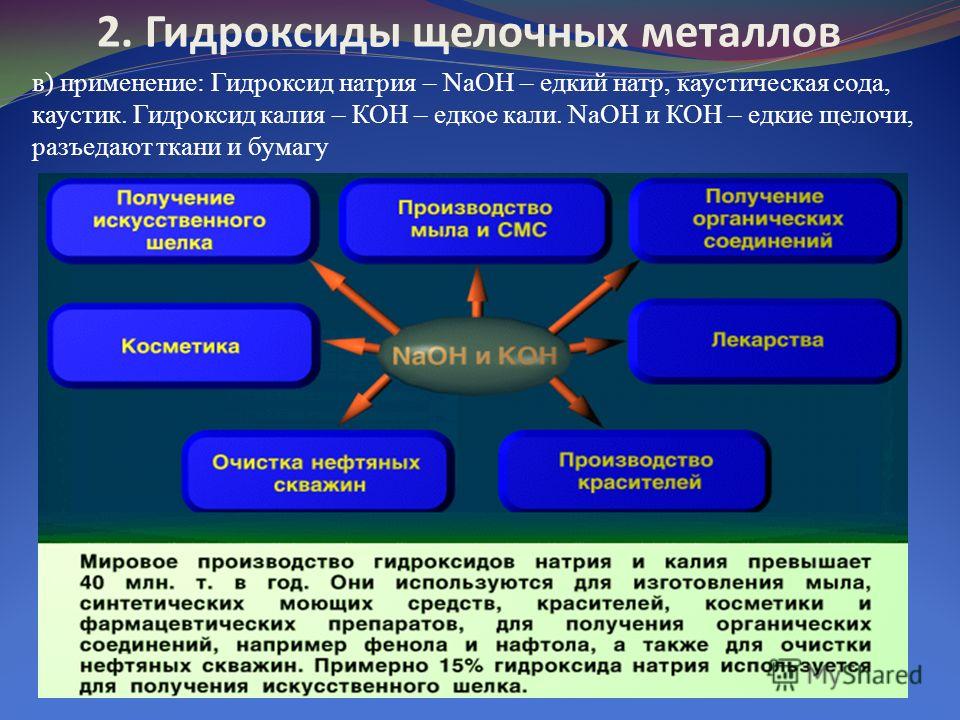 Общее количество калия в организме человека составляет от 110 до 140 г и в основном зависит от мышечной массы. Мышцы содержат больше всего калия после эритроцитов и ткани мозга.
Общее количество калия в организме человека составляет от 110 до 140 г и в основном зависит от мышечной массы. Мышцы содержат больше всего калия после эритроцитов и ткани мозга.
В то время как его противник натрий присутствует во внутриклеточных жидкостях, калий в основном присутствует в клетках. Сохраняет осмотическое давление. Отношение калия в клетках к калию в плазме составляет 27:1 и регулируется с помощью натрий-калиевых насосов.
Жизненно важные функции калия включают его роль в нервном возбуждении, мышечных сокращениях, регуляции артериального давления и растворении белков. Он защищает сердце и артерии и может даже предотвратить сердечно-сосудистые заболевания. Отношение натрия к калию раньше было 1:16, а теперь составляет около 3:1, что в основном предотвращает высокое поглощение натрия.
Дефицит калия встречается относительно редко, но может привести к депрессии, мышечной слабости, нарушению сердечного ритма и спутанности сознания. Потеря калия может быть следствием хронической диареи или заболевания почек, поскольку физический баланс калия регулируется почками. Когда почки работают недостаточно, необходимо ограничить потребление калия, чтобы предотвратить его большие потери.
Когда почки работают недостаточно, необходимо ограничить потребление калия, чтобы предотвратить его большие потери.
Контакт кожи с металлами калия приводит к коррозии едким калием. Это более опасно, чем кислотная коррозия, потому что продолжается неограниченно. Капли едкого калия очень вредны для глаз.
Потребление ряда соединений калия может быть особенно вредным. В высоких дозах хлористый калий препятствует проведению нервных импульсов, что прерывает практически все функции организма и в основном влияет на работу сердца. Калийные квасцы могут вызывать жалобы на желудок и тошноту при таких низких концентрациях, как 2 г, и могут вызывать коррозию и даже летальный исход при более высоких концентрациях. Карбонат калия смертелен для взрослых в дозах выше 15 г. То же самое касается тартрата калия в количестве 1 г и цианида калия в количестве всего 50 мг. Дихромат калия смертелен при дозе от 6 до 8 г, а 30 г нитрата калия вызывают сильную интоксикацию, которая может привести к смерти.

 607
607


 е. освобождается от примесей, путем выдерживания в покое, ее сливают чистой, затем немедленно помещают в большие медные котлы и кипятят там. в течение трех дней они добывают Соль, которую они называют Потас (что означает Горшечная зола), потому что она производится таким образом в горшках.0003
е. освобождается от примесей, путем выдерживания в покое, ее сливают чистой, затем немедленно помещают в большие медные котлы и кипятят там. в течение трех дней они добывают Соль, которую они называют Потас (что означает Горшечная зола), потому что она производится таким образом в горшках.0003  Однако именно от травы кали мы обязаны словом, которое описывает и то, и другое — ал-кали или щелочь; приставка «ал» просто является арабским определенным артиклем
Однако именно от травы кали мы обязаны словом, которое описывает и то, и другое — ал-кали или щелочь; приставка «ал» просто является арабским определенным артиклем  .
.  В следующий раз красиво, но смертельно — вот название игры.
В следующий раз красиво, но смертельно — вот название игры.  com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements.
com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. 