Как устроены химические источники тока. Какие бывают виды гальванических элементов и аккумуляторов. Где применяются химические источники тока в современном мире.
Принцип работы химических источников тока
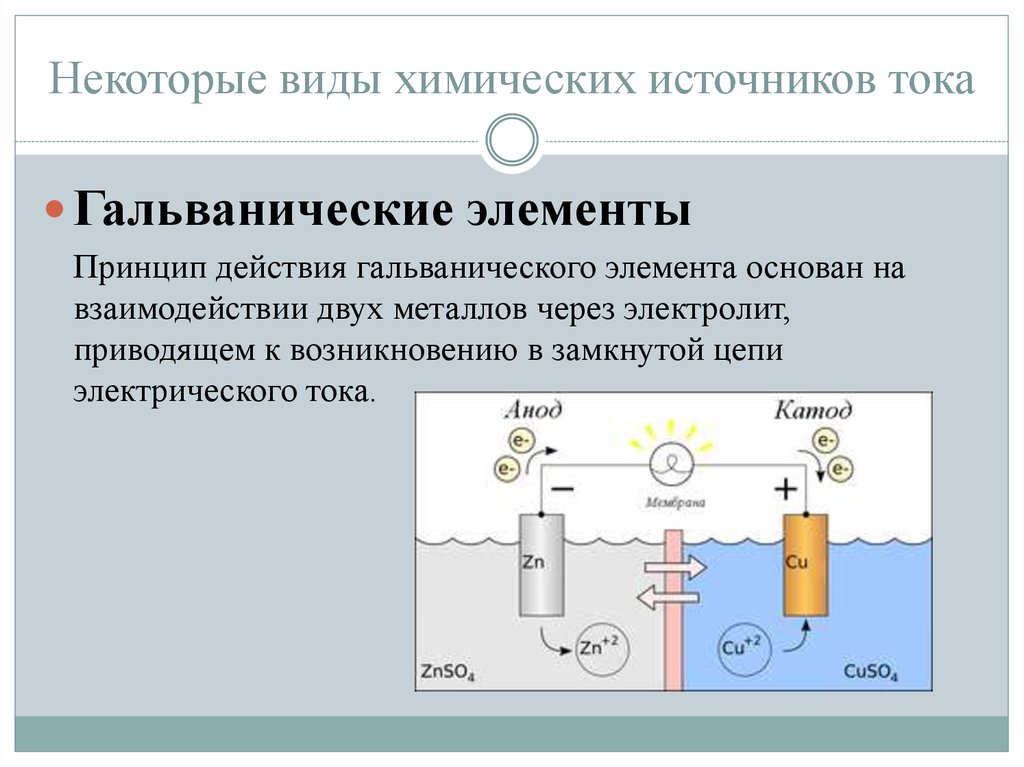
Химический источник тока (ХИТ) — это устройство, в котором химическая энергия преобразуется непосредственно в электрическую. Как работает такой источник тока?
Основными компонентами ХИТ являются:
- Анод — отрицательный электрод, содержащий восстановитель
- Катод — положительный электрод, содержащий окислитель
- Электролит — проводящая среда между электродами
При замыкании внешней цепи на аноде происходит реакция окисления, в результате которой образуются свободные электроны. Они по внешней цепи переходят к катоду, где участвуют в реакции восстановления. Движение электронов создает электрический ток.
Ионы в электролите также участвуют в реакциях, замыкая электрическую цепь внутри источника тока. Благодаря этому процессу химическая энергия преобразуется в электрическую.

Основные виды химических источников тока
Химические источники тока можно разделить на три основных типа:
1. Гальванические элементы (первичные ХИТ)
Это одноразовые источники тока, которые нельзя перезарядить из-за необратимости протекающих в них химических реакций. К ним относятся:
- Марганцево-цинковые элементы
- Литиевые элементы
- Серебряно-цинковые элементы
2. Аккумуляторы (вторичные ХИТ)
Это перезаряжаемые источники тока, которые можно использовать многократно. Основные типы аккумуляторов:
- Свинцово-кислотные
- Никель-кадмиевые
- Никель-металлогидридные
- Литий-ионные
3. Топливные элементы
В топливных элементах реагенты подаются извне непрерывно, что позволяет им работать длительное время. Наиболее распространены водородно-кислородные топливные элементы.
Преимущества и недостатки различных типов ХИТ
Каковы основные плюсы и минусы разных видов химических источников тока?
Гальванические элементы:
Преимущества:
- Низкая стоимость
- Простота конструкции
- Длительный срок хранения
Недостатки:

- Одноразовое использование
- Невозможность перезарядки
Аккумуляторы:
Преимущества:
- Возможность многократного использования
- Высокая удельная энергоемкость
Недостатки:
- Более высокая стоимость
- Ограниченное количество циклов заряда-разряда
Топливные элементы:
Преимущества:
- Длительное время работы
- Высокий КПД
- Экологичность
Недостатки:
- Сложность конструкции
- Высокая стоимость
Применение химических источников тока в современном мире
Где сегодня используются химические источники тока? Основные сферы применения:
Портативная электроника
Смартфоны, ноутбуки, планшеты и другие мобильные устройства работают от литий-ионных аккумуляторов. Они обеспечивают высокую емкость при компактных размерах.
Автомобильная промышленность
Свинцово-кислотные аккумуляторы используются в традиционных автомобилях для запуска двигателя. В электромобилях применяются литий-ионные батареи большой емкости.
Возобновляемая энергетика
Аккумуляторные системы накопления энергии позволяют сглаживать неравномерность выработки солнечных и ветровых электростанций.

Медицина
Миниатюрные источники тока питают кардиостимуляторы, слуховые аппараты и другие имплантируемые медицинские устройства.
Перспективы развития химических источников тока
Каковы основные направления совершенствования ХИТ в ближайшем будущем?
- Повышение удельной энергоемкости
- Увеличение срока службы и количества циклов заряда-разряда
- Сокращение времени зарядки
- Снижение стоимости производства
- Разработка более экологичных и безопасных технологий
Активно ведутся исследования в области твердотельных аккумуляторов, литий-воздушных и натрий-ионных батарей. Эти технологии могут значительно улучшить характеристики химических источников тока.
Экологические аспекты использования химических источников тока
Какое влияние оказывают ХИТ на окружающую среду? Основные экологические проблемы связаны с:
- Добычей редких металлов для производства батарей
- Утилизацией отработавших источников тока
- Возможностью утечек токсичных компонентов
Для решения этих проблем разрабатываются:
- Технологии безопасной утилизации и переработки батарей
- Более экологичные материалы для производства ХИТ
- Системы сбора и вторичного использования аккумуляторов
Важно помнить, что правильная утилизация отслуживших свой срок химических источников тока — обязанность каждого пользователя.

Безопасность при использовании химических источников тока
Какие меры предосторожности нужно соблюдать при работе с ХИТ?
- Не допускать короткого замыкания контактов
- Избегать перегрева батарей
- Не разбирать и не повреждать корпус
- Использовать только совместимые зарядные устройства
- Не оставлять на длительной зарядке
- Хранить вдали от легковоспламеняющихся предметов
При соблюдении этих простых правил химические источники тока безопасны в использовании и могут служить долгое время.
химический источник тока
химический источник тока сокр., ХИТ (англ. chemical current source или electrochemical cell) — устройство для прямого преобразования химической энергии окислительно-восстановительной реакции в электрическую энергию.
Описание
В зависимости от эксплуатационных особенностей и от используемой электрохимической системы (совокупности электродов и электролита), химические источники тока делятся на первичные (не перезаряжаемые; гальванические элементы; «батарейки»), которые, как правило, после полного разряда становятся неработоспособными, и вторичные (перезаряжаемые; аккумуляторы), в которых реагенты регенерируются при зарядке — пропускании тока от внешнего источника. Такое деление достаточно условно, так как некоторые гальванические элементы могут быть частично заряжены.
Химические источники тока состоят из двух электродов: катода, содержащего окислитель, и анода, содержащего восстановитель, которые контактируют с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделенных процессов: на катоде восстановитель окисляется, а образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделенных процессов: на катоде восстановитель окисляется, а образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
В настоящее время существует большое количество типов аккумуляторов: литий-ионные (Li–ion), литий-полимерные (Li–pol), никель-металлогидридные (Ni–MH), никель-кадмиевые (Ni–Cd), свинцово-кислотные, металловоздушные и т. д., — а также первичных источников тока — «батареек», наиболее популярными среди которых являются солевые, щелочные и литиевые. К важным и перспективным химическим источникам тока относятся топливные элементы (электрохимические генераторы), способные к длительному непрерывному функционированию при постоянном подводе к электродам новых порций реагентов и удалении продуктов реакции.
Иллюстрации
|
Схема литий-ионного химического источника тока, в котором в качестве материала положительного электрода выступает LiMO2 (M = Co, Ni, Mn), а в качестве материала отрицательного электрода — графит. Во время процесса заряда ионы лития извлекаются из структуры LiMO2 и, проходя через электролит, внедряются в межслоевое пространство графита; в процессе разряда перенос ионов лития идет в обратном направлении. Количество сохраняемой энергии ограничено в основном свойствами материала положительного электрода. Так, например, для LiCoO2 характерны величины удельной электроемкости 130–150 мАч/г. |
Авторы
- Толкачев Николай Николаевич
- Гольдт Анастасия Евгеньевна
Источники
- Химический источник тока // Большая Советская энциклопедия. 3-е изд., 1969–1978.
- Дасоян М. А. Химические источники тока: справочное издание.
 2-е изд. — Л.: Энергия, 1969. — 587 с.
2-е изд. — Л.: Энергия, 1969. — 587 с. - Lithium batteries: science and technology. Edited by Gholam-Abbas Nazri, Gianfranco Pistoia. Boston- Kluwer Academic Publishers, 2004. — 708 p.
- Мощь альтернативы: литий—воздушные аккумуляторы—новое слово в хранении энергии // Нанометр. —www.nanometer.ru/2009/05/28/12434858982414_155668.html (дата обращения: 02.08.2010).
Напишите нам
- А
- Б
- В
- Г
- Д
- Ж
- З
- И
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Э
- Я
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Z
Химические источники тока | это.
 .. Что такое Химические источники тока?
.. Что такое Химические источники тока?Химические источники тока
Хими́ческие исто́чники то́ка (аббр. ХИТ) — устройства, в которых энергия протекающих в них химических реакций непосредственно превращается в электрическую энергию.
|
Содержание
|
История создания
Вольтов столб
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом. Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля».
Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Принцип действия
Основу химических источников тока составляют два электрода (катод, содержащий окислитель и анод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
В современных химических источниках тока используются:
- в качестве восстановителя (на аноде) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (на катоде) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.

Классификация
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций, невозможно перезарядить;
- электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и

Некоторые виды химических источников тока
Гальванические элементы
- Смотри также Категория:Гальванические элементы.
| Тип | Катод | Электролит | Анод | Напряжение, В |
|---|---|---|---|---|
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1.56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1.65 |
| Марганцево-магниевый элемент | MnO2 | MgBr | Mg | 2.00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2.55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2.42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1.92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1. 36 36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1.92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1.30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1.8—1.9 |
Другие типы:
- Свинцово-плавиковый элемент
- Медно-окисный гальванический элемент
- Висмутисто-магниевый элемент
- Ртутно-висмутисто-индиевый элемент
- Литий-хромсеребряный элемент
- Литий-висмутатный элемент
- Литий-окисномедный элемент
- Литий-йодсвинцовый элемент
- Литий-йодный элемент
- Литий-тионилхлоридный элемент
- Литий-оксидванадиевый элемент
- Литий-фторомедный элемент
- Литий-двуокисносерный элемент
- Диоксисульфатно-ртутный элемент
- Серно-магниевый элемент
- Хлористосвинцово-магниевый элемент
- Хлорсеребряно-магниевый элемент
- Хлористомедно-магниевый элемент
- Йодатно-цинковый элемент
- Магний-перхлоратный элемент
- Магний-м-ДНБ элемент
- Цинк-хлоросеребряный элемент
- Хлор-серебряный элемент
- Бром-серебряный элемент
- Йод-серебряный элемент
- Магний-ванадиевый элемент
- Кальций-хроматный элемент
Аккумуляторы
- Смотри также Категория:Аккумуляторы.

- Лантан-фторидный аккумулятор
- Литий-ионный аккумулятор
- Литий-полимерный аккумулятор
- Марганцево-оловянный элемент
- Никель-цинковый аккумулятор
- Никель-кадмиевый аккумулятор
- Никель-металл-гидридный аккумулятор
- Свинцово-кислотный аккумулятор
- Свинцово-оловянный аккумулятор
- Серебряно-цинковый аккумулятор
- Серебряно-кадмиевый аккумулятор
- Железо-никелевый аккумулятор
- Железо-воздушный аккумулятор
- Цинк-воздушный аккумулятор
- Цинк-хлорный аккумулятор
- Натрий-серный аккумулятор
- Литий-хлорный аккумулятор
- Свинцово-водородный аккумулятор
- Цинк-бромный аккумулятор
- Натрий-Никель-Хлоридный аккумулятор
- Литий-железо-сульфидный аккумулятор
- Литий-фторный аккумулятор
Топливные элементы
- Смотри также Категория:Топливные элементы.
- Прямой метанольный топливный элемент
- Твердооксидный топливный элемент
- Щелочной топливный элемент
Ссылки
- О химических источниках тока
Как сделать химический источник тока
Как зажечь рождественскую гирлянду с помощью химии
Как сделать химический источник тока? Узнайте с помощью нашего эксперимента.
Меры предосторожности
Внимание! Проводите эксперимент только под присмотром взрослых.
Реагенты и оборудование
- раствор сульфата меди(II);
- раствор сульфата цинка; 9медные и цинковые электроды 0015; зажимы типа «крокодил»
- ;
- пластиковых флаконов;
- держатель для флаконов;
- Рождественские гирлянды;
- светодиод;
- шприцев;
- прямоугольных кусков ткани.
Пошаговые инструкции
Вставьте медный и цинковый электроды в пластиковые флаконы и расположите их так, чтобы металлы чередовались. Соедините электроды зажимами типа «крокодил» так, чтобы электроды с обеих сторон имели свободный зажим. Соедините флаконы с медным и цинковым электродами кусочками ткани. Во флаконы с медными электродами налейте раствор сульфата меди(II), а во флаконы с цинковыми электродами – раствор сульфата цинка. Мы создали две соединенные ячейки Даниэля. Подсоедините свободные концы зажимов к светодиоду — он светится! Если вы подключите больше ячеек Daniell, вы сможете даже зажечь рождественские гирлянды!
Мы создали две соединенные ячейки Даниэля. Подсоедините свободные концы зажимов к светодиоду — он светится! Если вы подключите больше ячеек Daniell, вы сможете даже зажечь рождественские гирлянды!
Описание процесса
Принцип работы ячейки Даниэля основан на разнице между реакционной способностью меди и цинка. Его напряжение составляет примерно 1,1 вольта. Цинк — более активный металл. И каждый атом цинка легко отдает два электрона, образуя ионы цинка Zn²⁺, которые высвобождаются в раствор:
Zn — 2e → Zn²⁺
Эти электроны мигрируют к медному электроду, который приобретает отрицательный заряд и начинает притягивать положительно заряженные ионы меди Cu²⁺ в растворе сульфата меди(II). Эти ионы принимают доступные электроны с образованием металлической меди, которая осаждается на поверхности медного электрода:
Cu²⁺ + 2e → Cu⁰
Двигаясь по проводам от цинка к меди, электроны создают электрический ток, который заставляет светодиод светиться.
Аналогичный эксперимент входит в набор «Химия и электричество» подписки MEL Chemistry.
У нас есть для вас еще статьи по химии:
- Эксперимент «Аскорбиновая кислота: сильный антиоксидант» Как витамин С предотвращает окисление
- Взрывное серебро Как сделать взрыв из серебра
Вы можете провести десятки химических опытов дома!
Трансмутация
Учить больше
Самоустанавливающиеся источники тока, изготовленные из пищевых материалов
Янг Джо Ким,‡ и Сан Ын Чун, ‡ и Джей Whitacre аб и Кристофер Дж. Беттингер* ак
Принадлежности автора
* Соответствующие авторы
и
Департамент материаловедения и инженерии, Университет Карнеги-Меллона, Питтсбург, Пенсильвания, 15213, США
Электронная почта:
cbetting@andrew. cmu.edu
cmu.edu
Факс: +1-412-268-7596
Тел.: +1-412-268-7677
б
Департамент инженерии и государственной политики, Университет Карнеги-Меллона, Питтсбург, Пенсильвания, 15213, США
Электронная почта:
[email protected]
Факс: +1-412-268-7596
Тел.: +1-412-268-7677
с Кафедра биомедицинской инженерии, Университет Карнеги-Меллона, Питтсбург, Пенсильвания, 15213, США
Аннотация
rsc.org/schema/rscart38″> Гибкая биоразлагаемая электроника может стать основой для временных электронно-активных медицинских имплантатов. Биоразлагаемая электроника может иметь много преимуществ по сравнению с традиционными хроническими имплантатами. Две важные долгосрочные цели для биоразлагаемой электроники: (1) обеспечение достаточной мощности и (2) снижение инвазивности развертывания устройств. Съедобные электронные устройства способны решить обе проблемы. Здесь мы представляем электрохимические электронные источники питания, совместимые со стратегиями неинвазивного развертывания и полностью состоящие из съедобных материалов и встречающихся в природе прекурсоров, которые потребляются в обычном рационе. Разработанные здесь источники тока питаются от бортовых электрохимических элементов с ионами натрия. Потенциалы до 0,6 В и токи в диапазоне 5–20 мкА могут генерироваться обычным образом. Эти устройства могут служить технологической платформой для съедобной электроники, используемой для неинвазивного зондирования и стимуляции тканей человеческого тела.