Как устроены литиевые батарейки. Какие преимущества у литиевых батареек по сравнению с другими типами. Где применяются литиевые батарейки. Какие бывают разновидности литиевых батареек. Как правильно использовать и утилизировать литиевые батарейки.
Принцип работы литиевых батареек
Литиевые батарейки относятся к первичным химическим источникам тока, то есть они не перезаряжаемые. Их принцип работы основан на электрохимических реакциях с участием металлического лития.
Основные компоненты литиевой батарейки:
- Анод — металлический литий
- Катод — различные соединения (диоксид марганца, оксид серы, тионилхлорид и др.)
- Электролит — раствор соли лития в органическом растворителе
- Сепаратор — пористая пленка, разделяющая анод и катод
При разряде батарейки на аноде происходит окисление лития:
Li → Li+ + e-
На катоде идет восстановление активного вещества, например:
MnO2 + Li+ + e- → MnOOLi
В результате этих реакций вырабатывается электрический ток.

Преимущества литиевых батареек
Литиевые батарейки обладают рядом существенных преимуществ по сравнению с другими типами химических источников тока:
- Высокая удельная энергоемкость — до 350 Вт·ч/кг
- Большой срок хранения — до 10-15 лет
- Широкий диапазон рабочих температур — от -40°C до +60°C
- Стабильное напряжение в процессе разряда
- Низкий саморазряд — не более 2% в год
- Отсутствие эффекта памяти
- Экологичность — не содержат тяжелых металлов
Эти характеристики делают литиевые батарейки оптимальным выбором для многих применений.
Области применения литиевых батареек
Благодаря своим преимуществам, литиевые батарейки широко используются в следующих сферах:
- Портативная электроника (смартфоны, ноутбуки, фотоаппараты)
- Медицинское оборудование (кардиостимуляторы, слуховые аппараты)
- Автомобильная электроника
- Системы безопасности и сигнализации
- Военная и аэрокосмическая техника
- Часы, калькуляторы, пульты ДУ
- Автономные датчики и измерительные приборы
Литиевые батарейки незаменимы везде, где требуется длительная автономная работа при небольших габаритах источника питания.

Разновидности литиевых батареек
Существует несколько основных типов литиевых батареек, различающихся по составу катода:
- Li-MnO2 — литий-диоксид марганцевые
- Li-SO2 — литий-диоксид серные
- Li-SOCl2 — литий-тионилхлоридные
- Li-CFx — литий-фторуглеродные
- Li-FeS2 — литий-железодисульфидные
Каждый тип имеет свои особенности и оптимальные области применения. Например, Li-MnO2 батарейки наиболее распространены в бытовой электронике, а Li-SOCl2 используются в промышленных приборах.
Правила использования и утилизации литиевых батареек
При эксплуатации литиевых батареек необходимо соблюдать следующие правила безопасности:
- Не допускать короткого замыкания контактов
- Не разбирать и не нагревать батарейки
- Не пытаться перезаряжать одноразовые литиевые батарейки
- Не использовать батарейки разных типов или степени разряженности вместе
- Хранить в сухом прохладном месте
Отработанные литиевые батарейки нельзя выбрасывать вместе с бытовым мусором. Их необходимо сдавать в специальные пункты приема для последующей переработки. Это позволяет извлечь ценные компоненты и предотвратить загрязнение окружающей среды.

Перспективы развития литиевых источников тока
Литиевые технологии продолжают активно развиваться. Основные направления исследований:
- Повышение удельной энергоемкости
- Увеличение срока службы и числа циклов заряда-разряда
- Улучшение безопасности и стабильности
- Снижение стоимости производства
- Разработка новых материалов электродов и электролитов
Одно из перспективных направлений — создание твердотельных литиевых аккумуляторов, которые могут обеспечить более высокую плотность энергии и безопасность по сравнению с жидкостными системами.
Сравнение литиевых батареек с другими типами
Рассмотрим основные преимущества и недостатки литиевых батареек в сравнении с другими распространенными типами:
| Тип батарейки | Преимущества | Недостатки |
|---|---|---|
| Литиевые |
— Высокая энергоемкость — Длительный срок хранения — Широкий температурный диапазон |
— Высокая стоимость — Риск возгорания при повреждении |
| Алкалиновые |
— Низкая цена — Доступность |
— Меньшая энергоемкость — Чувствительность к низким температурам |
| Никель-металлгидридные |
— Перезаряжаемые — Экологичность |
— Эффект памяти — Высокий саморазряд |
Как видно из сравнения, литиевые батарейки обладают наилучшим сочетанием характеристик для многих применений, особенно где критичны вес и габариты.

Химия и ток
В современной жизни химические источники тока окружают нас повсюду: это батарейки в фонариках, аккумуляторы в мобильных телефонах, водородные топливные элементы, которые уже используются в некоторых автомобилях. Бурное развитие электрохимических технологий может привести к тому, что уже в ближайшее время вместо машин на бензиновых двигателях нас будут окружать только электромобили, телефоны перестанут быстро разряжаться, а в каждом доме будет свой собственный электрогенератор на топливных элементах. Повышению эффективности электрохимических накопителей и генераторов электроэнергии посвящена одна из совместных программ Уральского федерального университета с Институтом высокотемпературной электрохимии УрО РАН, в партнерстве с которыми мы публикуем эту статью.
На сегодняшний день существует
множество разных типов батареек, среди
которых все сложнее ориентироваться.
Далеко не каждому очевидно, чем аккумулятор
отличается от суперконденсатора и почему
водородный топливный элемент можно
использовать, не опасаясь нанести
вред окружающей среде. В этой статье
мы расскажем о том, как для получения
электроэнергии используются химические
реакции, в чем разница между основными
типами современных химических источников
тока и какие перспективы открываются
перед электрохимической энергетикой.
В этой статье
мы расскажем о том, как для получения
электроэнергии используются химические
реакции, в чем разница между основными
типами современных химических источников
тока и какие перспективы открываются
перед электрохимической энергетикой.
Химия как источник электричества
Сначала разберемся, почему химическую энергию вообще можно использовать для получения электричества. Все дело в том, что при окислительно-восстановительных реакциях происходит перенос электронов между двумя разными ионами. Если две половины химической реакции разнести в пространстве, чтобы окисление и восстановление проходили отдельно друг от друга, то можно сделать так, чтобы электрон, который отрывается от одного иона, не сразу попадал на второй, а сначала прошел по заранее заданному для него пути. Такую реакцию можно использовать как источник электрического тока.
Впервые эта концепция была реализована еще в XVIII
веке итальянским физиологом Луиджи
Гальвани. Действие традиционного
гальванического элемента основано на реакциях восстановления и окисления металлов с
разной активностью.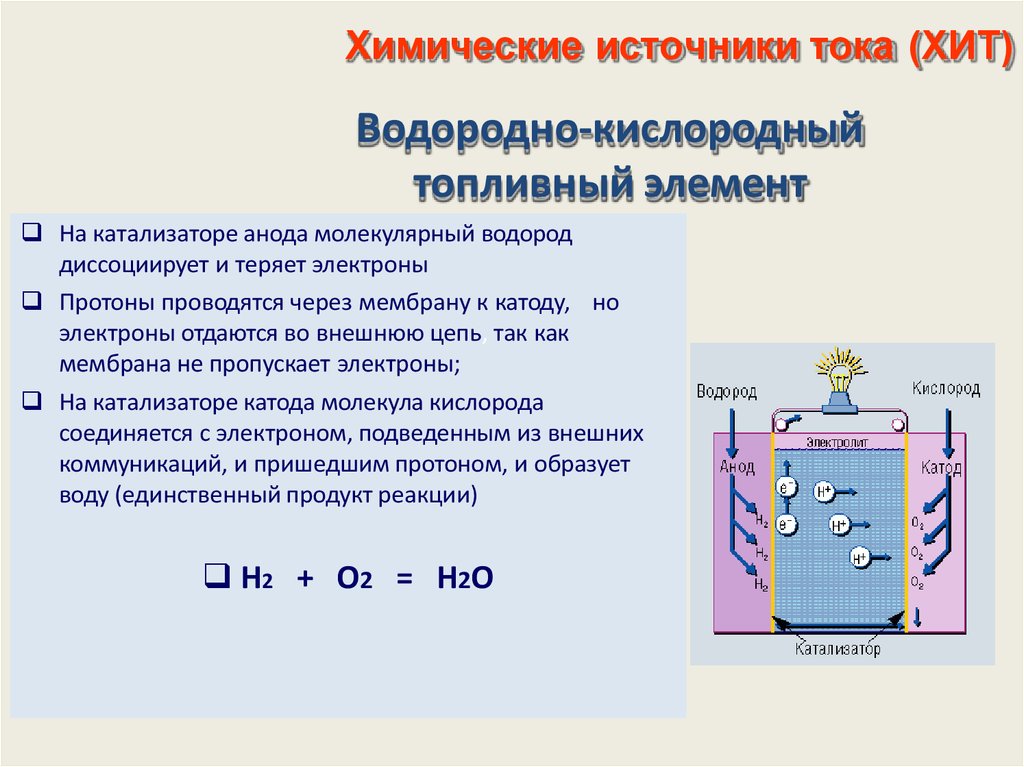 Например, классической ячейкой является
гальванический элемент, в котором
происходит окисление цинка и восстановление
меди. Реакции восстановления и окисления
проходят, соответственно, на катоде
и аноде. А чтобы ионы меди и цинка
не попадали на «чужую территорию»,
где они могут прореагировать друг
с другом непосредственно, между
анодом и катодом обычно помещают
специальную мембрану. В результате
между электродами возникает разность
потенциалов. Если соединить электроды,
например, с лампочкой, то в получившейся
электрической цепи начинает течь ток
и лампочка загорается.
Например, классической ячейкой является
гальванический элемент, в котором
происходит окисление цинка и восстановление
меди. Реакции восстановления и окисления
проходят, соответственно, на катоде
и аноде. А чтобы ионы меди и цинка
не попадали на «чужую территорию»,
где они могут прореагировать друг
с другом непосредственно, между
анодом и катодом обычно помещают
специальную мембрану. В результате
между электродами возникает разность
потенциалов. Если соединить электроды,
например, с лампочкой, то в получившейся
электрической цепи начинает течь ток
и лампочка загорается.
Помимо материалов анода и катода, важной составляющей химического источника тока является электролит, внутри которого движутся ионы и на границе которого с электродами протекают все электрохимические реакции. При этом электролит не обязательно должен быть жидким — это может быть и полимерный, и керамический материал.
Основным недостатком гальванического
элемента является ограниченное время
его работы. Как только реакция пройдет
до конца (то есть будет полностью
израсходован весь постепенно растворяющийся
анод), такой элемент просто перестанет
работать.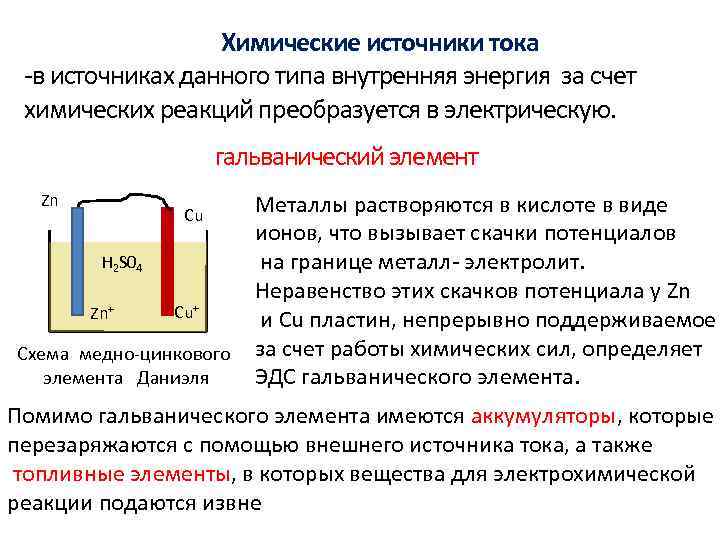
Возможность перезарядки
Первым шагом к расширению возможностей химических источников тока стало создание аккумулятора — источника тока, который можно перезаряжать и поэтому использовать многократно. Для этого ученые просто предложили использовать обратимые химические реакции. Полностью разрядив аккумулятор в первый раз, с помощью внешнего источника тока прошедшую в нем реакцию можно запустить в обратном направлении. Это восстановит исходное состояние, так что после перезарядки батарею можно будет использовать заново.
На сегодня создано много различных типов аккумуляторов, которые отличаются типом происходящей в них химической реакции. Наиболее распространенными типами аккумуляторов являются свинцово-кислотные (или просто свинцовые) аккумуляторы, в основе которых лежит реакция окисления-восстановления свинца. Такие устройства обладают довольно длительным сроком службы, а их энергоемкость составляет до 60 ватт-часов на килограмм. Еще более популярными в последнее время являются литий-ионные аккумуляторы, основанные на реакции окисления-восстановления лития.
Основными проблемами литий-ионных аккумуляторов являются их небольшая эффективность при отрицательных температурах, быстрое старение и повышенная взрывоопасность. А из-за того, что металлический литий очень активно реагирует с водой с образованием газообразного водорода и при горении аккумулятора выделяется кислород, самовозгорание литий-ионного аккумулятора очень тяжело поддается традиционным способам пожаротушения. Для того чтобы повысить безопасность такого аккумулятора и ускорить время его зарядки, ученые предлагают модифицировать материал катода, воспрепятствовав образованию дендритных литиевых структур, а в электролит добавить вещества, которые блокируют образование взрывоопасных структур, и компоненты, подавляющие возгорание на ранних стадиях.
Твердый электролит
В качестве другого менее очевидного способа повышения эффективности и безопасности батарей, химики предложили не ограничиваться в химических источниках тока жидкими электролитами, а создать полностью твердотельный
источник тока. В таких устройствах
вообще нет жидких
компонентов, а есть слоистая структура
из твердого анода, твердого катода и
твердого же электролита между ними. Электролит при этом одновременно выполняет и функцию
мембраны. Носителями заряда в
твердом электролите могут быть
различные ионы — в зависимости от его
состава и тех реакций, которые проходят
на аноде и катоде. Но всегда ими являются достаточно маленькие ионы, которые
могут относительно свободно перемещаться
по кристаллу, например протоны H+, ионы лития Li+
или ионы кислорода O2-.
В таких устройствах
вообще нет жидких
компонентов, а есть слоистая структура
из твердого анода, твердого катода и
твердого же электролита между ними. Электролит при этом одновременно выполняет и функцию
мембраны. Носителями заряда в
твердом электролите могут быть
различные ионы — в зависимости от его
состава и тех реакций, которые проходят
на аноде и катоде. Но всегда ими являются достаточно маленькие ионы, которые
могут относительно свободно перемещаться
по кристаллу, например протоны H+, ионы лития Li+
или ионы кислорода O2-.
Водородные топливные элементы
Возможность перезарядки и специальные меры безопасности делают аккумуляторы значительно более перспективными источниками тока, чем обычные батарейки, но все равно каждый аккумулятор содержит внутри себя ограниченное количество реагентов, а значит, и ограниченный запас энергии, и каждый раз аккумулятор необходимо заново заряжать для возобновления его работоспособности.
Чтобы сделать батарейку «бесконечной», в качестве источника энергии можно использовать не те вещества, которые находятся внутри ячейки, а специально прокачиваемое через нее топливо. Лучше всего в качестве такого топлива подойдет вещество, максимально простое по составу, экологически чистое и имеющееся в достатке на Земле.
Лучше всего в качестве такого топлива подойдет вещество, максимально простое по составу, экологически чистое и имеющееся в достатке на Земле.
Наиболее подходящее вещество такого типа — газообразный водород. Его окисление кислородом воздуха с образованием воды (по реакции 2H2 + O2 → 2H2O) является простой окислительно-восстановительной реакцией, а транспорт электронов между ионами тоже можно использовать в качестве источника тока. Протекающая при этом реакция является своего рода обратной реакцией к реакции электролиза воды (при котором под действием электрического тока вода разлагается на кислород и водород), и впервые такая схема была предложена еще в середине XIX века.
Но несмотря на то, что схема выглядит
довольно простой, создать основанное
на этом принципе эффективно работающее
устройство — совсем не тривиальная задача. Для этого надо развести в пространстве потоки кислорода и водорода, обеспечить транспорт нужных ионов через электролит и снизить возможные потери энергии на всех этапах работы.
Схема работающего водородного топливного элемента очень похожа на схему химического источника тока, но содержит в себе дополнительные каналы для подачи топлива и окислителя и отвода продуктов реакции и избытка поданных газов. Электродами в таком элементе являются пористые проводящие катализаторы. К аноду подается газообразное топливо (водород), а к катоду — окислитель (кислород из воздуха), и на границе каждого из электродов с электролитом проходит своя полуреакция (окисление водорода и восстановление кислорода соответственно). При этом, в зависимости от типа топливного элемента и типа электролита, само образование воды может протекать или в анодном, или в катодном пространстве.
Если электролит является протонпроводящей
полимерной или керамической мембраной,
раствором кислоты или щелочи, то носителем
заряда в электролите являются ионы
водорода. В таком случае на аноде
молекулярный водород окисляется до ионов
водорода, которые проходят через
электролит и там реагируют с кислородом. Если же носителем заряда является
ион кислорода O2–, как в случае
твердооксидного электролита, то на катоде
происходит восстановление кислорода
до иона, этот ион проходит через
электролит и окисляет на аноде
водород с образованием воды и свободных
электронов.
Если же носителем заряда является
ион кислорода O2–, как в случае
твердооксидного электролита, то на катоде
происходит восстановление кислорода
до иона, этот ион проходит через
электролит и окисляет на аноде
водород с образованием воды и свободных
электронов.
Кроме реакции окисления водорода для топливных элементов предложено использовать и другие типы реакций. Например, вместо водорода восстановительным топливом может быть метанол, который кислородом окисляется до углекислого газа и воды.
Эффективность топливных элементов
Несмотря на все преимущества водородных топливных элементов (такие как экологичность, практически неограниченный КПД, компактность размеров и высокая энергоемкость), они обладают и рядом недостатков. К ним относятся, в первую очередь, постепенное старение компонентов и сложности при хранении водорода. Именно над тем, как устранить эти недостатки, и работают сегодня ученые.
Повысить эффективность топливных
элементов в настоящее время предлагается
за счет изменения состава электролита,
свойств электрода-катализатора,
и геометрии системы (которая
обеспечивает подачу топливных газов
в нужную точку и снижает побочные
эффекты).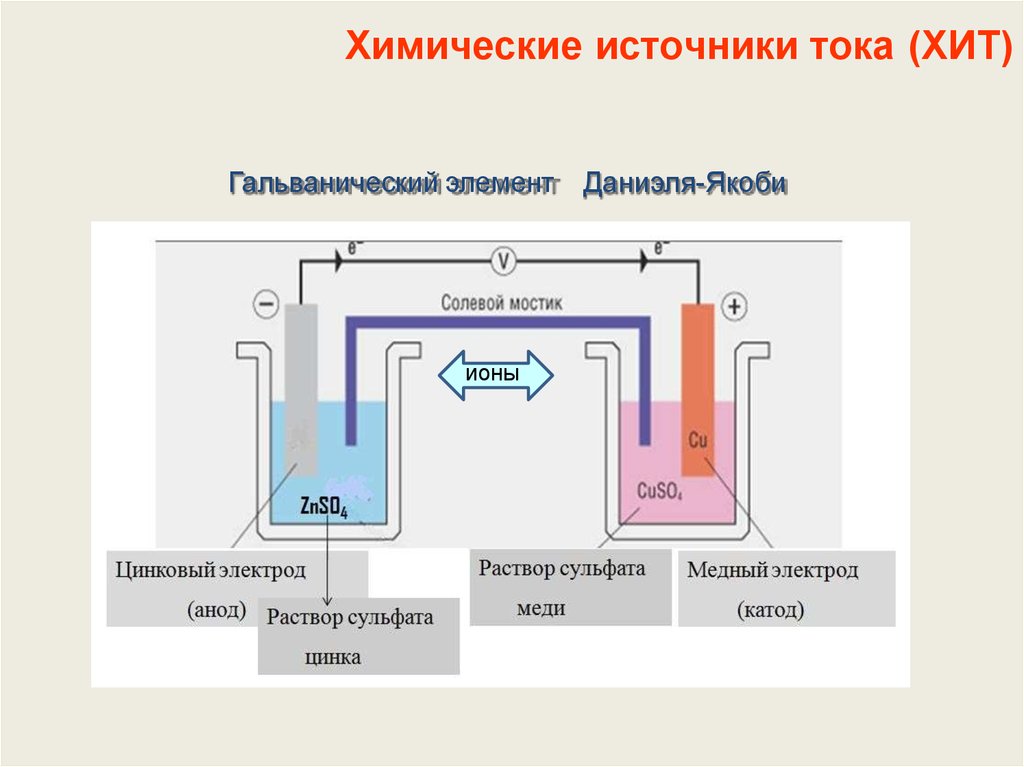 Для решения проблемы хранения газообразного водорода используют материалы, содержащие платину, для насыщения которых предлагают использовать, например, графеновые мембраны.
Для решения проблемы хранения газообразного водорода используют материалы, содержащие платину, для насыщения которых предлагают использовать, например, графеновые мембраны.
В результате удается добиться повышения стабильности работы топливного элемента и времени жизни его отдельных компонентов. Сейчас коэффициент преобразования химической энергии в электрическую в таких элементах достигает 80 процентов, а при определенных условиях может быть и еще выше.
Огромные перспективы водородной энергетики связывают с возможностью объединения топливных элементов в целые батареи, превращая их в электрогенераторы с большой мощностью. Уже сейчас электрогенераторы, работающие на водородных топливных элементах, имеют мощность до нескольких сотен киловатт и используются как источники питания транспортных средств.
Альтернативные электрохимические накопители
Помимо
классических электрохимических
источников тока, в качестве накопителей
электроэнергии используют и более необычные системы. Одной из
таких систем является суперконденсатор
(или ионистор) — устройство, в котором
разделение и накопление заряда происходит за счет
образования двойного слоя вблизи
заряженной поверхности. На
границе электрод-электролит в таком
устройстве в два слоя выстраиваются
ионы разных знаков, так называемый
«двойной электрический слой», образуя
своеобразный очень тонкий конденсатор.
Емкость такого конденсатора, то есть
количество накопленного заряда, будет
определяться удельной площадью
поверхности электродного материала,
поэтому в качестве материала для
суперконденсаторов выгодно брать
пористые материалы с максимальной
удельной площадью поверхности.
Одной из
таких систем является суперконденсатор
(или ионистор) — устройство, в котором
разделение и накопление заряда происходит за счет
образования двойного слоя вблизи
заряженной поверхности. На
границе электрод-электролит в таком
устройстве в два слоя выстраиваются
ионы разных знаков, так называемый
«двойной электрический слой», образуя
своеобразный очень тонкий конденсатор.
Емкость такого конденсатора, то есть
количество накопленного заряда, будет
определяться удельной площадью
поверхности электродного материала,
поэтому в качестве материала для
суперконденсаторов выгодно брать
пористые материалы с максимальной
удельной площадью поверхности.
Ионисторы являются рекордсменами
среди зарядно-разрядных химических
источников тока по скорости заряда, что
является несомненным преимуществом
данного типа устройств. К сожалению,
они также являются рекордсменами
и по скорости разряда. Энергоплотность
ионисторов в восемь раз меньше по сравнению
со свинцовыми аккумуляторами и в 25 раз
меньше по сравнению с литий-ионными. Классические «двойнослойные» ионисторы
не используют электрохимическую реакцию
в своей основе, и к ним наиболее точно
применим термин «конденсатор». Однако
в тех вариантах исполнения ионисторов,
в основе которых используется
электрохимическая реакция и накопление
заряда распространяется в глубину
электрода, удается достичь более высоких
времен разрядки при сохранении быстрой
скорости заряда. Усилия разработчиков
суперконденсаторов направлены на
создание гибридных с аккумуляторами
устройств, сочетающих в себе плюсы
суперконденсаторов, в первую очередь
высокую скорость заряда, и достоинства
аккумуляторов — высокую энергоемкость
и длительное время разряда. Представьте
себе в ближайшем будущем аккумулятор-ионистор,
который будет заряжаться за пару минут
и обеспечивать работу ноутбука или
смартфона в течение суток или более!
Классические «двойнослойные» ионисторы
не используют электрохимическую реакцию
в своей основе, и к ним наиболее точно
применим термин «конденсатор». Однако
в тех вариантах исполнения ионисторов,
в основе которых используется
электрохимическая реакция и накопление
заряда распространяется в глубину
электрода, удается достичь более высоких
времен разрядки при сохранении быстрой
скорости заряда. Усилия разработчиков
суперконденсаторов направлены на
создание гибридных с аккумуляторами
устройств, сочетающих в себе плюсы
суперконденсаторов, в первую очередь
высокую скорость заряда, и достоинства
аккумуляторов — высокую энергоемкость
и длительное время разряда. Представьте
себе в ближайшем будущем аккумулятор-ионистор,
который будет заряжаться за пару минут
и обеспечивать работу ноутбука или
смартфона в течение суток или более!
Несмотря на то, что сейчас плотность энергии суперконденсаторов пока в несколько раз меньше плотности энергии аккумуляторов, их используют в бытовой электронике и для двигателей различных транспортных средств, в том числе и в самых современных разработках.
* * *
Таким образом, на сегодня существует большое количество электрохимических устройств, каждое из которых перспективно для своих конкретных приложений. Для повышения эффективности работы этих устройств ученым необходимо решить ряд задач как фундаментального, так и технологического характера. Большинством этих задач в рамках одного из прорывных проектов занимаются в Уральском федеральном университете, поэтому о ближайших планах и перспективах по разработке современных топливных элементов мы попросили рассказать директора Института высокотемпературной электрохимии УрО РАН, профессора кафедры технологии электрохимических производств химико-технологического института Уральского федерального университета Максима Ананьева.
N + 1: Ожидается ли в ближайшем будущем какая-то альтернатива наиболее популярным сейчас литий-ионным аккумуляторам?
Максим Ананьев: Современные усилия разработчиков
аккумуляторов направлены на замену
типа носителя заряда в электролите
с лития на натрий, калий, алюминий. В результате замены лития можно будет
снизить стоимость аккумулятора, правда
при этом пропорционально возрастут
массо-габаритные характеристики. Иными
словами, при одинаковых электрических
характеристиках натрий-ионный аккумулятор
будет больше и тяжелее по сравнению
с литий-ионным.
В результате замены лития можно будет
снизить стоимость аккумулятора, правда
при этом пропорционально возрастут
массо-габаритные характеристики. Иными
словами, при одинаковых электрических
характеристиках натрий-ионный аккумулятор
будет больше и тяжелее по сравнению
с литий-ионным.
Кроме того, одним из перспективных развивающихся направлений совершенствования аккумуляторов является создание гибридных химических источников энергии, основанных на совмещении металл-ионных аккумуляторов с воздушным электродом, как в топливных элементах. В целом, направление создания гибридных систем, как уже было показано на примере суперконденсаторов, по-видимому, в ближайшей перспективе позволит увидеть на рынке химические источники энергии, обладающие высокими потребительскими характеристиками.
Уральский федеральный университет совместно с академическими и индустриальными партнерами России и мира сегодня реализует шесть мегапроектов, которые сфокусированы на прорывных направлениях научных исследований. Один из таких проектов — «Перспективные технологии электрохимической энергетики от химического дизайна новых материалов к электрохимическим устройствам нового поколения для сохранения и преобразования энергии».
Один из таких проектов — «Перспективные технологии электрохимической энергетики от химического дизайна новых материалов к электрохимическим устройствам нового поколения для сохранения и преобразования энергии».
Группа ученых стратегической академической единицы (САЕ) Школа естественных наук и математики УрФУ, в которую входит Максим Ананьев, занимается проектированием и разработкой новых материалов и технологий, среди которых — топливные элементы, электролитические ячейки, металлграфеновые аккумуляторы, электрохимические системы аккумулирования электроэнергии и суперконденсаторы.
Исследования и научная работа ведутся в постоянном взаимодействии с Институтом высокотемпературной электрохимии УрО РАН и при поддержке партнеров.
Какие топливные элементы разрабатываются сейчас и имеют наибольший потенциал?
Одними из наиболее перспективных
типов топливных элементов являются
протонно-керамические элементы. Они
обладают преимуществами перед полимерными
топливными элементами с протонно-обменной
мембраной и твердооксидными элементами,
так как могут работать при прямой подаче
углеводородного топлива. Это существенно
упрощает конструкцию энергоустановки
на основе протонно-керамических
топливных элементов и систему
управления, а следовательно, увеличивает
надежность работы. Правда, такой тип
топливных элементов на данный момент
является исторически менее проработанным,
но современные научные исследования
позволяют надеяться на высокий
потенциал данной технологии в будущем.
Это существенно
упрощает конструкцию энергоустановки
на основе протонно-керамических
топливных элементов и систему
управления, а следовательно, увеличивает
надежность работы. Правда, такой тип
топливных элементов на данный момент
является исторически менее проработанным,
но современные научные исследования
позволяют надеяться на высокий
потенциал данной технологии в будущем.
Какими проблемами, связанными с топливными элементами, занимаются сейчас в Уральском федеральном университете?
Сейчас ученые УрФУ совместно с Институтом
высокотемпературной электрохимии
(ИВТЭ) Уральского отделения Российской
академии наук работают над созданием
высокоэффективных электрохимических
устройств и автономных генераторов
электроэнергии для применений в
распределенной энергетике.
Создание энергоустановок для распределенной
энергетики изначально подразумевает
разработку гибридных систем на основе
генератора электроэнергии и накопителя,
в качестве которых выступают аккумуляторы.
При этом топливный элемент работает
постоянно, обеспечивая нагрузку в
пиковые часы, а в холостом режиме заряжает
аккумулятор, который может сам выступать
резервом как в случае высокого
энергопотребления, так и в случае
внештатных ситуаций.
Наибольших успехов химики УрФУ и ИВТЭ достигли в области разработки твердо-оксидных и протонно-керамических топливных элементов. Начиная с 2016 года на Урале вместе с ГК «Росатом» создается первое в России производство энергоустановок на основе твердо-оксидных топливных элементов. Разработка уральских ученых уже прошла «натурные» испытания на станции катодной защиты газотрубопроводов на экспериментальной площадке ООО «Уралтрансгаз». Энергоустановка с номинальной мощностью 1,5 киловатта отработала более 10 тысяч часов и показала высокий потенциал применения таких устройств.
В рамках совместной лаборатории
УрФУ и ИВТЭ ведутся разработки
электрохимических устройств на основе
протонпроводящей керамической мембраны.
Это позволит в ближайшем будущем снизить
рабочие температуры для твердо-оксидных
топливных элементов с 900 до 500
градусов Цельсия и отказаться
от предварительного риформинга
углеводородного топлива, создав, таким
образом, экономически эффективные
электрохимические генераторы, способные
работать в условиях развитой в России
инфраструктуры газоснабжения.
Александр Дубов
Лекция по теме «Химические источники тока»
Учебные вопросы
Виды химических источников тока
Классификация гальванических элементов
Принцип действия аккумулятора
Топливные элементы
Виды химических источников тока
Химическими источниками тока
(ХИТ) называются электрохимические
устройства, в результате работы которых
химическая энергия окислительно-восстановительных
процессов превращается в электрическую
энергию постоянного тока. К ним относятся
гальванические элементы, аккумуляторы,
топливные элементы. Во всех видах
химических источниках тока используются
электролиты – водные, неводные, твердые.
К достоинствам современных ХИТ относятся
относительно высокие КПД (до 0,8) и высокая
удельная мощность (количество энергии,
отдаваемое в единицу времени единицей
массы ХИТ), что позволяет им конкурировать
с другими источниками тока. Основным
их недостатком является ограниченный
срок службы.
Основным
их недостатком является ограниченный
срок службы.
Классификация гальванических элементов
Среди большого разнообразия гальванических элементов можно выделить три основных типа.
Первый тип . Пластины из двух различных металлов находятся в растворах солей, содержащих собственные ионы. К этому типу относится медно-цинковый гальванический элемент (элемент Даниэля – Якоби ).
Второй тип. Пластины из двух различных металлов находятся в растворе одного электролита. Примером может служить элемент Вольта, состоящий из двух пластин (Zn и Cu), погруженных в раствор серной кислоты. При его работе происходят следующие процессы:
(-) А: Zn Zn2+ + 2- окисление (анодный процесс)
(+) К: 2Н+ + 2 Н2 — восстановление (катодный процесс)
Выделяющийся
водород насыщает поверхность катода
(меди), в результате чего получается
электрод другого состава (не медный, а
водородный).
Схема гальванического элемента Вольта:
2
(-) Zn / Zn2+ H2SO4 2H+ / H2 (Cu) (+)
В скобках справа указывается (Сu) — место выделения водорода.
Третий тип. Гальванические элементы составлены из двух совершенно одинаковых по природе электродов (например, медных), погруженных в растворы одного и того же электролита, но различной концентрации. Такие элементы называются концентрационными.
Схема медного концентрационного гальванического элемента:
2
(-) Cu / CuSO4 CuSO4 / Cu (+) ,
C1 < С2
где
C1
и С2
— концентрация раствора электролита,
моль/л.
Роль анода выполняет электрод, находящийся в более разбавленном растворе, так как его электродный потенциал имеет более низкое значение по сравнению со вторым электродом. ЭДС такого гальванического элемента зависит только от соотношения концентраций потенциалопределяющих ионов (в данном случае от концентрации CuSO4).
Практического значения как источники электрической энергии концентрационные гальванические элементы не имеют.
Принцип действия аккумулятора
Аккумуляторы – гальванические элементы, которые на основе обратимых электрохимических реакций могут многократно накапливать химическую энергию и отдавать ее для потребления в виде электрической энергии постоянного тока.
Аккумуляторы
— устройства многоразового действия,
сочетающие в себе гальванический элемент
и электролизер. Под воздействием
внешнего постоянного тока в них
аккумулируется (накапливается) химическая
энергия, которая затем превращается в
электрическую в результате
окислительно-восстановительной реакции. Процесс накопления химической энергии
называют зарядом
аккумулятора,
процесс ее превращения в электрическую
— разрядом
аккумулятора.
В первом случае аккумулятор работает
как электролизер, во втором – как
гальванический элемент.
Процесс накопления химической энергии
называют зарядом
аккумулятора,
процесс ее превращения в электрическую
— разрядом
аккумулятора.
В первом случае аккумулятор работает
как электролизер, во втором – как
гальванический элемент.
Устройство и принцип действия всех аккумуляторов одинаков. Основное отличие состоит в материале электродов и типе электролита. На аноде как при разряде, так и при заряде протекает процесс окисления, на катоде – процесс восстановления.
Наиболее распространенными являются кислотные и щелочные аккумуляторы.
Кислотный
аккумулятор (свинцовый
аккумулятор)
представляет собой пластины в виде
отливок из хартблея (твердого свинца с
примесью сурьмы) ячеистой структуры,
собранные в батареи и помещенные в баки
из эбонита или полипропилена с
электролитом. В ячейки пластин
предварительно запрессовывается смесь
оксида свинца (PbO)
с глицерином, обладающая способностью
затвердевать в виде глицерата свинца. Электролитом служит раствор серной
кислоты (35 — 40 % раствор H2SO4).
При взаимодействии оксида свинца с
H2SO4
образуется
PbSO4.
Электролитом служит раствор серной
кислоты (35 — 40 % раствор H2SO4).
При взаимодействии оксида свинца с
H2SO4
образуется
PbSO4.
PbOтв. + H2SO4(р-р)PbSO4тв. + H2O
При первичной и последующих зарядах аккумулятора, когда он работает как электрохимическая ячейка, PbSO4 на катоде превращается в свинец (Pb), а аноде — в диоксид свинца (PbO2), которые и являются электродами:
(-) К : PbSO4(тв) + 2Pb(тв) + SO(р-р)
(+) А : PbSO4(тв) +2 Н2О PbО2(тв) + 2+ 4 Н+ + SO(р-р)
2PbSO4(тв) + 2H2O Pb(тв) + PbO2(тв) + 2 H2SO4(р-р)
ЭДС
заряженного аккумулятора приблизительно
равна 2 В (если 6 таких аккумуляторов
последовательно соединить, получается
обычный автомобильный аккумулятор с
ЭДС = 12В).
При работе аккумулятора – его разрядке, когда он работает как химический источник тока, на электродах протекают электродные процессы в обратном направлении.
По мере его разрядки расходуются материалы катода (PbО2) , анода (Pb) и электролит — серная кислота. Напряжение на зажимах аккумулятора падает и его необходимо заряжать. Для зарядки аккумулятор подключают к внешнему источнику тока, направление тока противоположно разрядному.
Токообразующие и электродные реакции в свинцовом аккумуляторе можно представить в виде:
Pb(тв) + SO(р-р) PbSO4(тв) + 2
PbО2(тв) + 2+ 4 Н+(р-р)+ SO(р-р) PbSO4(тв) + 2 Н2О
«разрядка»
Pb(тв) + PbO2(тв) + 2 H2SO4 (р-р) 2 PbSO 4(тв) + 2H2O
«зарядка»
Cхема кислотного аккумулятора:
( — ) Pb / Pb2+ │H2SO4 │Pb2+ / PbO2 ( + )
Стандартные
величины потенциалов для электродов
свинцового аккумулятора имеют следующие
значения:
,.
ЭДС аккумулятора, как химического источника тока, рассчитывается по уравнению:
— +
Из данного уравнения видно, что ЭДС аккумулятора зависит от концентрации (активности) серной кислоты, которая возрастает при заряде аккумулятора и уменьшается при его разояде. О степени разряда аккумулятора судят по концентрации электролита, т.е. концентрации H2SO4. Используя концентрированные растворы H2SO4, можно было бы увеличить ЭДС аккумулятора, однако при концентрации H2SO4 больше 39% резко уменьшается электропроводность растворов и увеличивается растворимость свинца, поэтому оптимальными являются 32 — 39 % — ные растворы H2SO4.
Во время заряда аккумулятора растет напряжение на его полюсах. В конце оно достигает такого значения, что начинается электролиз воды, сопровождающийся выделением водорода на катоде и кислорода – на аноде:
(-) К : 2 Н2О + 2 Н2+2 ОН—
(+) А : 4 ОН— О2+ 2 Н2О + 4
2 Н2О 2 Н2+ О2
Так
называемое «кипение» электролита
является признаком окончания заряда
свинцового аккумулятора. Заряженный
аккумулятор может быть сразу использован
по назначению. При хранении же из него
выливают электролит и промывают водой.
В таком виде он может находиться до 2
лет и для его использования достаточно
лишь залить электролит. При хранении
незаряженного аккумулятора с раствором
серной кислоты происходит его
«сульфатирование» – образование на
пластинках большого количества PSO4.
Когда кислотный аккумулятор работает,
давая ток, PSO4
осаждается в очень мелкозернистой форме
на поверхности электродов. Когда же
аккумулятор выключен, мелкозернистый
слой рекристаллизуется и образуются
более крупные кристаллы, которые могут
закупорить поры электрода, уменьшая
его поверхность или отрываться от
электрода и оседать на дно аккумулятора.
Процесс сульфатации является основной
причиной выхода аккумулятора из строя,
поэтому нужно следить, чтобы аккумулятор
не простаивал частично в разряженном
состоянии.
Заряженный
аккумулятор может быть сразу использован
по назначению. При хранении же из него
выливают электролит и промывают водой.
В таком виде он может находиться до 2
лет и для его использования достаточно
лишь залить электролит. При хранении
незаряженного аккумулятора с раствором
серной кислоты происходит его
«сульфатирование» – образование на
пластинках большого количества PSO4.
Когда кислотный аккумулятор работает,
давая ток, PSO4
осаждается в очень мелкозернистой форме
на поверхности электродов. Когда же
аккумулятор выключен, мелкозернистый
слой рекристаллизуется и образуются
более крупные кристаллы, которые могут
закупорить поры электрода, уменьшая
его поверхность или отрываться от
электрода и оседать на дно аккумулятора.
Процесс сульфатации является основной
причиной выхода аккумулятора из строя,
поэтому нужно следить, чтобы аккумулятор
не простаивал частично в разряженном
состоянии.
Преимущества
свинцового аккумулятора – высокий КПД
(около 80 %), высокая ЭДС и относительно
малое ее изменение при разряде, большая
электрическая емкость, устойчивость в
работе. Недостатки – большая масса и,
следовательно, малая удельная емкость,
саморазряд аккумулятора при хранении,
малый срок службы (2 – 5 лет), а также
токсичность свинца и сильные окислительные
свойства H2SO4.
Недостатки – большая масса и,
следовательно, малая удельная емкость,
саморазряд аккумулятора при хранении,
малый срок службы (2 – 5 лет), а также
токсичность свинца и сильные окислительные
свойства H2SO4.
Щелочные аккумуляторы различаются по материалу пластин отрицательно заряженного электрода. Наиболее распространенные из них кадмий — никелевые (Cd — Ni) и железо — никелевые ( Fe – Ni ) аккумуляторы. Активная масса положительных пластин состоит, в основном, из гидратированного оксида никеля (III), кроме того в ней содержится графит, добавляемый для увеличения электропроводности. Электролитом служит раствор КОН (20 %), содержащий небольшое количество LiOH. ЭДС заряженного аккумулятора (Cd — Ni) приблизительно равна 1,3 В.
Виды энергии – Управление энергетической информации США (EIA)
Виды энергии
- Потенциальная энергия
- Кинетическая энергия
Потенциальная энергия
Потенциальная энергия – это накопленная энергия и энергия положения.
Химическая энергия – это энергия, запасенная в связях атомов и молекул. Батареи, биомасса, нефть, природный газ и уголь являются примерами химической энергии. Например, химическая энергия преобразуется в тепловую, когда люди сжигают дрова в камине или сжигают бензин в двигателе автомобиля.
Механическая энергия — это энергия, накапливаемая в объектах за счет напряжения. Сжатые пружины и растянутые резиновые ленты являются примерами накопленной механической энергии.
Ядерная энергия — это энергия, запасенная в ядре атома, — энергия, которая удерживает ядро вместе. Большое количество энергии может быть высвобождено, когда ядра объединяются или разделяются.
Гравитационная энергия — это энергия, запасенная в высоте объекта. Чем выше и тяжелее объект, тем больше запасается гравитационной энергии. Когда человек едет на велосипеде с крутого холма и набирает скорость, энергия гравитации преобразуется в энергию движения. Гидроэнергетика — еще один пример гравитационной энергии, когда под действием силы тяжести вода пропускается через гидроэлектрическую турбину для производства электроэнергии.
Гидроэнергетика — еще один пример гравитационной энергии, когда под действием силы тяжести вода пропускается через гидроэлектрическую турбину для производства электроэнергии.
Кинетическая энергия
Кинетическая энергия — это движение волн, электронов, атомов, молекул, веществ и объектов.
Лучистая энергия — это электромагнитная энергия, которая распространяется поперечными волнами. К лучистой энергии относятся видимый свет, рентгеновские лучи, гамма-лучи и радиоволны. Свет – это один из видов лучистой энергии. Солнечный свет — это лучистая энергия, дающая топливо и тепло, которые делают возможной жизнь на Земле.
Тепловая энергия , или тепло, — это энергия, возникающая в результате движения атомов и молекул в веществе. Тепло увеличивается, когда эти частицы движутся быстрее. Геотермальная энергия – это тепловая энергия земли.
Энергия движения — это энергия, хранящаяся в движущихся объектах. Чем быстрее они двигаются, тем больше запасается энергии. Чтобы заставить объект двигаться, требуется энергия, и энергия высвобождается, когда объект замедляется. Ветер является примером энергии движения. Ярким примером энергии движения является автомобильная авария: автомобиль полностью останавливается и высвобождает всю свою энергию движения одновременно в неконтролируемое мгновение.
Чем быстрее они двигаются, тем больше запасается энергии. Чтобы заставить объект двигаться, требуется энергия, и энергия высвобождается, когда объект замедляется. Ветер является примером энергии движения. Ярким примером энергии движения является автомобильная авария: автомобиль полностью останавливается и высвобождает всю свою энергию движения одновременно в неконтролируемое мгновение.
Звук – это энергия, движущаяся сквозь вещества в виде продольных волн (сжатия/разрежения). Звук возникает, когда сила заставляет объект или вещество вибрировать. Энергия передается через вещество волной. Как правило, энергия звука меньше, чем в других формах энергии.
Электрическая энергия доставляется крошечными заряженными частицами, называемыми электронами, обычно движущимися по проводу. Молния является примером электрической энергии в природе.
Последнее обновление: 27 декабря 2022 г.
Химическая энергия | Определение и факты
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- В этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica.
- #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.

