Как работают биологические сигнальные пути на молекулярном уровне. Какие подходы используются для проектирования искусственных сигнальных систем. Каковы перспективы применения синтетических биологических цепей в медицине и биотехнологии.
Молекулярные основы биологической сигнализации
Биологические сигнальные пути представляют собой сложные молекулярные системы, обеспечивающие передачу информации внутри клеток и между ними. Ключевыми компонентами таких систем являются:
- Рецепторы — белки, способные распознавать и связывать специфические молекулы-лиганды
- Сигнальные белки — ферменты и адаптеры, передающие сигнал внутри клетки
- Вторичные мессенджеры — небольшие молекулы, усиливающие и распространяющие сигнал
- Факторы транскрипции — белки, регулирующие экспрессию генов в ответ на сигнал
Передача сигнала обычно включает несколько этапов:
- Связывание лиганда с рецептором
- Активация рецептора и передача сигнала внутрь клетки
- Каскад биохимических реакций с участием сигнальных белков
- Изменение активности факторов транскрипции
- Изменение экспрессии генов и клеточного ответа
Специфичность и эффективность передачи сигнала обеспечивается за счет высокой избирательности белок-белковых взаимодействий и наличия механизмов усиления сигнала.

Принципы проектирования искусственных сигнальных систем
При создании синтетических биологических цепей используются следующие ключевые подходы:
- Модульность — использование стандартных функциональных блоков
- Ортогональность — независимость работы разных компонентов системы
- Настраиваемость — возможность точной регулировки параметров
- Предсказуемость — математическое моделирование поведения системы
Основные этапы проектирования включают:
- Определение желаемой функции системы
- Выбор подходящих биологических компонентов
- Сборка компонентов в единую цепь
- Оптимизация работы системы
- Тестирование в модельных организмах
Ключевую роль играет использование хорошо охарактеризованных биологических «деталей» — промоторов, кодирующих последовательностей, сайтов связывания и т.д.
Методы конструирования искусственных сигнальных путей
Для создания синтетических биологических цепей применяются различные молекулярно-биологические и биоинженерные подходы:
- Направленная эволюция белков для изменения их свойств
- Конструирование химерных белков с новыми функциями
- Создание искусственных промоторов и регуляторных элементов
- Оптогенетические методы для управления активностью белков светом
- Использование РНК-переключателей для регуляции экспрессии генов
Ключевые инструменты синтетической биологии включают:

- Методы синтеза и сборки ДНК
- Системы редактирования генома (CRISPR/Cas9)
- Высокопроизводительный скрининг вариантов
- Компьютерное моделирование биологических систем
Комбинация этих подходов позволяет создавать сложные многокомпонентные цепи с заданными свойствами.
Примеры успешно реализованных искусственных сигнальных систем
К настоящему времени разработан ряд синтетических биологических цепей, демонстрирующих возможности инженерного подхода:
- Осцилляторы — системы с циклическим изменением активности генов
- Переключатели — цепи с двумя устойчивыми состояниями
- Логические вентили — системы, реализующие булеву логику
- Сенсоры — цепи, детектирующие химические или физические сигналы
- Синтетические сигнальные каскады с усилением сигнала
Примеры конкретных реализаций:
- Репрессилятор — осциллирующая система из трех генов
- Синтетическая система коммуникации бактерий на основе кворум-сенсинга
- Оптогенетическая система активации экспрессии генов светом
- Искусственные сигнальные пути на основе химерных рецепторов
Эти примеры демонстрируют принципиальную возможность создания сложных искусственных биологических систем с заданными свойствами.

Перспективы применения синтетических биологических цепей
Разработка искусственных сигнальных систем открывает широкие возможности для их практического применения в различных областях:
Биомедицина:
- Направленная доставка лекарств в определенные типы клеток
- Генная терапия с контролируемой экспрессией терапевтических генов
- Иммунотерапия рака на основе генетически модифицированных Т-клеток
- Биосенсоры для неинвазивной диагностики заболеваний
Биотехнология:
- Оптимизация биосинтеза целевых продуктов микроорганизмами
- Создание искусственных метаболических путей
- Биоремедиация с помощью программируемых микроорганизмов
- Биосенсоры для мониторинга окружающей среды
Фундаментальные исследования:
- Изучение принципов работы природных регуляторных систем
- Исследование эволюции сложных биологических сетей
- Создание минимальных искусственных клеток
Однако для реализации этого потенциала необходимо решить ряд проблем, включая повышение надежности и предсказуемости работы искусственных систем в реальных биологических условиях.

Этические аспекты и потенциальные риски
Развитие технологий синтетической биологии поднимает ряд этических вопросов и потенциальных рисков:
- Биобезопасность — возможность случайного или намеренного создания опасных организмов
- Биозащита — защита от биотерроризма с использованием синтетических организмов
- Этические проблемы модификации человеческого генома
- Потенциальное негативное влияние на экосистемы при высвобождении синтетических организмов
- Социально-экономические последствия широкого внедрения технологий синтетической биологии
Для решения этих проблем необходимо:
- Разработка надежных систем биобезопасности
- Создание эффективной нормативно-правовой базы
- Широкое обсуждение этических аспектов с участием общественности
- Международное сотрудничество в области регулирования
Только при соблюдении этих условий технологии синтетической биологии смогут реализовать свой позитивный потенциал без неоправданных рисков.
Заключение и перспективы
Проектирование искусственных биологических цепей — быстро развивающаяся междисциплинарная область на стыке молекулярной биологии, биоинженерии и системной биологии. Основные достижения включают:

- Разработку принципов и методов конструирования синтетических биологических систем
- Создание библиотек стандартных биологических «деталей»
- Реализацию ряда прототипов искусственных регуляторных цепей
- Демонстрацию возможности применения в биомедицине и биотехнологии
Ключевые направления дальнейшего развития:
- Повышение сложности и надежности искусственных биологических систем
- Разработка методов интеграции синтетических цепей в геномы организмов
- Создание искусственных органоидов и минимальных клеток
- Расширение спектра практических применений
Прогресс в этой области может привести к революционным изменениям в биомедицине, биотехнологии и фундаментальной биологии в ближайшие десятилетия. Однако для реализации этого потенциала необходимо решить ряд технических проблем и этических вопросов.
Простые сигнализации своими руками | all-he
В этой статье приведены схемы простейших электронных сигнализаций, сделать которые может каждый, кто хоть в минимальной степени знаком с электроникой или просто умеет держать в руке паяльник. Пригодятся такие сигнализации во многих случаях. Их можно поставить на окнах, если в доме есть маленький ребенок, который может их открыть. На дверях квартиры или гаража охраняемой стоянки. И при срабатывании сторож вызовет милицию. Можно поставить такую сигнализацию и в квартире, если вы дружите с соседями. Даже если вы идете в поход, но не грех раскинуть на ночь охранный шлейф и вокруг лагеря на случай появления диких животных или посторонних.
Первая схема электронной сигнализации проста до крайности, проще уже некуда. Это всего один транзистор, резистор и исполнительно реле. Если предполагается звуковая сигнализация, то вместо реле включают звуковую сирену или ревун.
Принцип работы: Охранный шлейф представляет собой тонкий провод, или замкнутый контакт. Когда провод цел (или контакт замкнут), база транзистора заземлена и транзистор закрыт. Ток между коллектором и эмиттером не протекает.
Когда провод цел (или контакт замкнут), база транзистора заземлена и транзистор закрыт. Ток между коллектором и эмиттером не протекает.
Если же порвать охранный провод, или разомкнуть контакт, база окажется подключенной к источнику питания через резистор R1, транзистор откроется и сработает реле (или сирена). Выключить ее можно только либо отключив питание, либо восстановив охранный шлейф.
Такую сигнализацию можно использовать для охраны своих вещей, например. В качестве охранного контакта применяют геркон, сигнализацию прячут в боковой карман сумки или рюкзака, а рядом располагают магнит. Если магнит удалить от самой сигнализации (переместить вещь), сирена заверещит на все голоса.
Вторая схема с более продвинутыми пользовательскими функциями
Как и в первом случае, в качестве датчика служит охранный шлейф, нормально замкнутый (в режиме охраны) контакт или геркон, замкнутый магнитным полем. При нарушении шлейфа происходит срабатывание сигнализации и работа ее продолжается до отключения питания. Восстановления шлейфа не приводит к выключению сигнализации, она все равно будет продолжать работать некоторое время. Сигнализация имеет кнопку временной блокировки, необходимой для покидания охраняемой зоны сами владельцем. Сигнализация так же имеет и задержку срабатывания, необходимую для ее выключения владельцем при его входе в охраняемую зону.
Восстановления шлейфа не приводит к выключению сигнализации, она все равно будет продолжать работать некоторое время. Сигнализация имеет кнопку временной блокировки, необходимой для покидания охраняемой зоны сами владельцем. Сигнализация так же имеет и задержку срабатывания, необходимую для ее выключения владельцем при его входе в охраняемую зону.
Разберем работу схемы. Прежде чем поставить сигнализацию на охрану, Необходимо выключить (разомкнуть) выключатель S1. Его надо установить в потайном месте недалеко от входа. Можно использовать, например, скрытый геркон, который замыкается – размыкается перестановкой какого либо предмета с встроенным в нем магнитом и т.п. Этот выключатель блокирует работу системы и она перестает реагировать на обрыв шлейфа. При уходе, выключатель S1 размыкается и конденсатор С2 начинает заряжаться через резистор R2. Пока конденсатор не зарядится до определенной величины, система «слепая». И у вас есть время покинуть объект, восстановив охранный шлейф или замкнув контакты. Подбирая значения резистора R2 и конденсатора С2 добейтесь приемлемой для себя задержки при выходе.
Подбирая значения резистора R2 и конденсатора С2 добейтесь приемлемой для себя задержки при выходе.
Если охранный шлейф будет нарушен, то через резистор R1 начнет заряжаться конденсатор С1. Эта пара создает небольшую задержку срабатывания сигнализации, и у хозяина есть время ее нейтрализовать, включив выключатель S1. Необходимо подобрать номиналы резистора и конденсатора для комфортного времени задержки срабатывания.
Если же шлейф нарушен злоумышленником, который не знает как выключить сигнализацию, то через некоторое время после разрыва шлейфа, сигнализация сработает (на обеих входах элемента D1.1 будут по логической «1», соответственно, на выходе «0». Пройдя через инвертор D1.2 он снова станет «1» и откроет транзистор VT1. Транзистор разрядит конденсатор С3 и через инвертор откроет транзистор VT2, который и заставит сработать исполнительное реле или включит сирену.
Даже если злоумышленник быстро восстановит шлейф, то сирена будет продолжать работать, так как конденсатор С3 будет достаточное время заряжаться через резистор R3.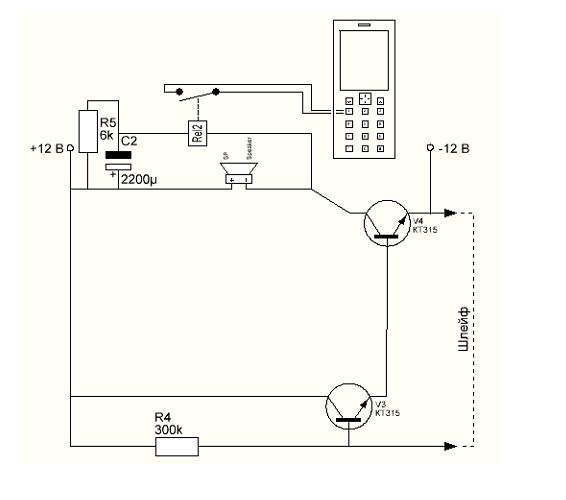 Именно номиналы этой пары и определяют время работы сигнализации после восстановлении шлейфа. Если же шлейф не восстановлен, сигнализация будет работать постоянно.
Именно номиналы этой пары и определяют время работы сигнализации после восстановлении шлейфа. Если же шлейф не восстановлен, сигнализация будет работать постоянно.
Микросхема — К561ЛА7, транзисторы — любые n-p-n (КТ315, КТ815 и т.д.) Источник питания — любой с напряжением +5 — +15 Вольт. Исполнительное реле или сирена может быть подключена к более мощному источнику питания, нежели сама схема. В режиме ожидания схема тока практически не потребляет (на уровне саморазряда батарей).
Схема простой сигнализации
Сигнализация предназначена для охраны складского помещения. Схема очень проста как в сборке и налаживании, так и в эксплуатации. Работает на сирену для автомобильной сигнализации.
Датчик – контактный, на размыкание (при открывании двери контакты датчика расходятся или отходит постоянный магнит от замыкающего геркона). Постановка и снятие с охраны производится снаружи помещения. Здесь могут быть два варианта. В первом случае роль выключателя сигнализации выполняет тройка болтиков или гвоздиков на наружной поверхности двери, которые нужно замкнуть металлическим предметом, во втором случае это могут быть герконы, замаскированные в обивку двери, деревянную обшивку. В этом случае установка на охрану и снятие с охраны выполняется поднесением к определённому месту ключа – постоянного магнита.
В этом случае установка на охрану и снятие с охраны выполняется поднесением к определённому месту ключа – постоянного магнита.
Индикация «включено – выключено» при помощи двух светодиодов разных цветов.
Питается система от источника постоянного тока напряжением 9 … 15V, это может быть сетевой адаптер, аккумулятор или бесперебойная комбинация из адаптера и аккумулятора. Важно, чтобы источник питания был рассчитан на ток, потребляемый сиреной (обычно 0,3 … 1 А)
Принципиальная схема показана на Рис.1. Как видно, это два RS-триггера. Первый из них на элементах D1.1 и D1.2 предназначен для выполнения функции выключателя, а второй – на элементах D1.3 и D1.4 несёт функции «охранной защёлки». При размыкании контакта S1 он принимает нулевое состояние, что приводит к открыванию транзисторов VT1 и VT2 и включению сирены НА1.
Звучать будет до тех пор, пока её не выключат.
Включение и выключение производится замыканием точек Х1, Х2, Х3. Для того, чтобы поставить объект на охрану нужно замкнуть точки Х2 и Х3. При этом на вывод 6 D1.2 подаётся логический ноль. Триггер D1.2-D1.2 переключается в единичное состояние и позволяет второму триггеру (D1.3-D1.4) быть установленным в нулевое состояние при подаче уровня логического нуля на вывод 13 D1.4. При постановке на охрану зажигается светодиод HL1 красного цвета. Чтобы выключить сигнализацию или снять объект с охраны нужно замкнуть точки Х1 и Х2, при этом зажигается светодиод HL2 зелёного цвета. Логический ноль подаётся на вывод 8 D1.3 и триггер D1.3-D1.4 принудительно устанавливается в единичное положение и удерживается в нём.
Вся схема (кроме источника питания и сирены) собрана на одной печатной плате с односторонним размещением печатных дорожек.
Микросхему К561ЛА7 можно заменить аналогом серии К1561ЛА7 или импортным. Если используется микросхема К176ЛА7, то напряжение источника питания не должно быть больше 10-11V.
Светодиоды – импортные, их можно заменить любыми светодиодами общего применения, видимого спектра и разного цвета. Можно один из светодиодов убрать, например HL2, тогда HL1 будет индицировать включение на охрану.
Транзистор KT361 можно заменить аналогичным КТ3107. Транзистор КТ817 – на КТ815, КТ819, КТ805, КТ807.
автор Борисов П. А.
источник: ” РАДИОКОНСТРУКТОР “, 01 – 2004, стр.36-37.
Проектирование заказных цепей сигнализации ячеек
1. Прицяк П.М. Разработка новых клеточных сигнальных путей. хим. биол. 2009; 16: 249–54. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Kiel C, Yus E, Serrano L. Разработка путей передачи сигналов. Клетка. 2010;140(1):33–47. [PubMed] [Google Scholar]
3. Sprinzak D, Elowitz MB. Реконструкция генетических цепей. Природа. 2005; 438:443–8. [PubMed] [Google Scholar]
4. Мукерджи С., ван Ауденарден А. Синтетическая биология: понимание биологического дизайна на основе синтетических цепей. Нат Рев Жене. 2009 г.;10:859–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Bashor CJ, Horwitz AA, Peisajovich SG, Lim WA. Перепрограммирование клеток: синтетическая биология как инструмент для изучения принципов организации живых систем. Анну Рев Биофиз. 2010 16 февраля; [Epub перед печатью] [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Yeh BJ, Lim WA. Синтетическая биология: уроки истории синтетической органической химии. Nat Chem Biol. 2007; 3: 521–5. [PubMed] [Google Scholar]
Yeh BJ, Lim WA. Синтетическая биология: уроки истории синтетической органической химии. Nat Chem Biol. 2007; 3: 521–5. [PubMed] [Google Scholar]
7. Вайнберг Р. Биология рака. Гарланд Наука; 2006. [Google Академия]
8. Галан Ю.Э. Общие темы в конструкции и функции бактериальных эффекторов. Клеточный микроб-хозяин. 2009; 5: 571–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Münter S, Way M, Frischknecht F. Передача сигналов при заражении патогенами. наук СТКЭ. 2006; 2006: re5. [PubMed] [Google Scholar]
10. Shan L, He P, Sheen J. Перехват сигнальных каскадов MAPK хозяина бактериальными эффекторами типа III. Клеточный микроб-хозяин. 2007; 1: 167–74. [PubMed] [Google Scholar]
11. Кискинис Э., Эгган К. Прогресс в клиническом применении плюрипотентных стволовых клеток, специфичных для пациента. Джей Клин Инвест. 2010; 120:51–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Линдвалл О., Кокая З. Стволовые клетки при нейродегенеративных расстройствах человека — время для клинического применения? Джей Клин Инвест.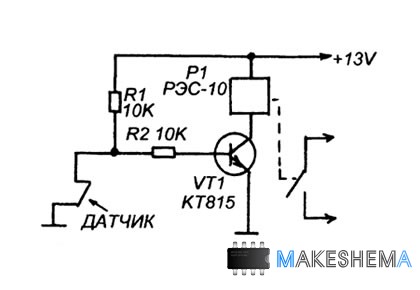 2010;120:29–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2010;120:29–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Июнь CH. Адоптивная Т-клеточная терапия рака в клинике. Джей Клин Инвест. 2007; 117:1466–76. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Варела-Рохена А., Карпенито С., Перес Э.Е., Ричардсон М., Парри Р.В., Милон М., Шоллер Дж., Хао Х, Мексас А., Кэрролл Р.Г., Джун Ч. , Райли Дж.Л. Генная инженерия Т-клеток для адоптивной иммунотерапии. Иммунол Рез. 2008; 42:166–81. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Ли С.К., Чоу Х., Хэм Т.С., Ли Т.С., Кислинг Д.Д. Метаболическая инженерия микроорганизмов для производства биотоплива: от жуков до синтетической биологии и топлива. Курр Опин Биотехнолог. 2008; 19: 556–63. [PubMed] [Google Scholar]
16. Sadelain M, Brentjens R, Rivière I. Перспективы и потенциальные ловушки химерных антигенных рецепторов. Курр Опин Иммунол. 2009; 21: 215–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17 июня CH, Blazar BR, Riley JL. Инженерные подмножества лимфоцитов: инструменты, испытания и невзгоды. Нат Рев Иммунол. 2009 г.;9:704–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Инженерные подмножества лимфоцитов: инструменты, испытания и невзгоды. Нат Рев Иммунол. 2009 г.;9:704–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Tlsty TD, Coussens LM. Строма опухоли и регуляция развития рака. Анну Рев Патол. 2006; 1:119–50. [PubMed] [Google Scholar]
19. Поусон Т., Нэш П. Сборка регуляторных систем клетки через домены взаимодействия белков. Наука. 2003; 300:445–52. [PubMed] [Google Scholar]
20. Бхаттачарья Р.П., Ременьи А., Йе Б.Дж., Лим В.А. Домены, мотивы и каркасы: роль модульных взаимодействий в эволюции и проводке клеточных сигнальных цепей. Анну Рев Биохим. 2006; 75: 655–80. [PubMed] [Академия Google]
21. Герхарт Дж., Киршнер М. Теория облегченной вариации. Proc Natl Acad Sci USA. 2007;104 (Suppl 1):8582–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Каштан Н., Алон У. Спонтанная эволюция модульности и сетевых мотивов. Proc Natl Acad Sci U S A. 2005; 102:13773–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Кэрролл С.Б. Эво-дево и расширяющийся эволюционный синтез: генетическая теория морфологической эволюции. Клетка. 2008; 134:25–36. [PubMed] [Академия Google]
Кэрролл С.Б. Эво-дево и расширяющийся эволюционный синтез: генетическая теория морфологической эволюции. Клетка. 2008; 134:25–36. [PubMed] [Академия Google]
24. Скотт Дж. Д., Поусон Т. Передача сигналов клетками в пространстве и времени: где белки собираются вместе и когда они расходятся. Наука. 2009;326:1220–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Peisajovich S, Garbarino J, Wei P, Lim WA. Быстрая диверсификация фенотипов передачи сигналов клеток путем рекомбинации модульных доменов. Наука. под давлением. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Струль Г., Адачи А. Ядерный доступ и действие выреза in vivo. Клетка. 1998;93:649–60. [PubMed] [Google Scholar]
27. Sprinzak D, Lakhanpal A, LeBon L, Santat LA, Fontes ME, Anderson GA, Garcia-Ojalvo J, Elowitz MB. Цис-взаимодействия между Notch и Delta генерируют взаимоисключающие состояния сигнализации. Природа. под давлением. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Barnea G, Strapps W, Herrada G, Berman Y, Ong J, Kloss B, Axel R, Lee KJ. Генетический дизайн сигнальных каскадов для регистрации активации рецепторов. Proc Natl Acad Sci USA. 2008; 105: 64–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Barnea G, Strapps W, Herrada G, Berman Y, Ong J, Kloss B, Axel R, Lee KJ. Генетический дизайн сигнальных каскадов для регистрации активации рецепторов. Proc Natl Acad Sci USA. 2008; 105: 64–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Howard PL, Chia MC, Del Rizzo S, Liu FF, Pawson T. Перенаправление передачи сигналов тирозинкиназы на путь апоптотической каспазы через химерные адаптерные белки. Proc Natl Acad Sci U S A. 2003;100:11267–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Conklin BR, Hsiao EC, Claeysen S, Dumuis A, Srinivasan S, Forsayeth JR, Guettier JM, Chang WC, Pei Y, McCarthy KD, Nissenson RA, Wess Дж., Бокарт Дж., Рот Б.Л. Разработка сигнальных путей GPCR с помощью RASSL. Нат Методы. 2008; 5: 673–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Armbruster BN, Li X, Pausch MH, Herlitze S, Roth BL. Эволюция замка, чтобы он соответствовал ключу, для создания семейства рецепторов, связанных с G-белком, мощно активируемых инертным лигандом. Proc Natl Acad Sci U S A. 2007; 104:5163–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci U S A. 2007; 104:5163–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Coward P, Wada HG, Falk MS, Chan SD, Meng F, Akil H, Conklin BR. Контроль передачи сигналов с помощью специально разработанного Gi-связанного рецептора. Proc Natl Acad Sci U S A. 1998; 95:352–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Чжао Г.К., Чжан Ю., Хун М.А., Чандрашекар Дж., Эрленбах И., Рыба Н.Дж., Цукер К.С. Рецепторы сладкого вкуса и вкуса умами у млекопитающих. Клетка. 2003; 115: 255–66. [PubMed] [Google Scholar]
34. Redfern CH, Coward P, Degtyarev MY, Lee EK, Kwa AT, Hennighausen L, Bujard H, Fishman GI, Conklin BR. Условная экспрессия и передача сигналов специально разработанного Gi-связанного рецептора у трансгенных мышей. Нац биотехнолог. 1999; 17: 165–9. [PubMed] [Google Scholar]
35. Corson TW, Aberle N, Crews CM. Дизайн и применение бифункциональных малых молекул: почему две головы лучше, чем одна. ACS Chem Biol. 2008; 3: 677–69.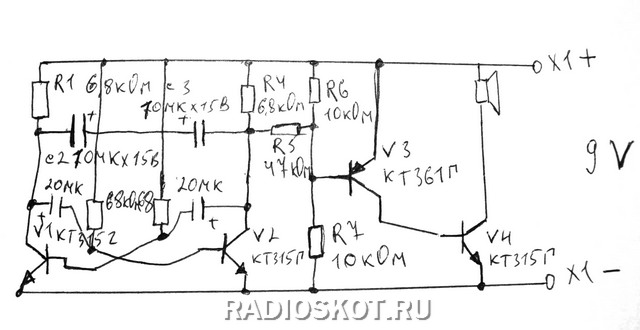 2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Поллок Р., Клаксон Т. Экспрессия генов, регулируемая димеризатором. Курр Опин Биотехнолог. 2002; 13: 459–67. [PubMed] [Google Scholar]
37. Ирвинг Б.А., Вайс А. Цитоплазматический домен дзета-цепи Т-клеточного рецептора достаточен для соединения с путями передачи сигнала, связанными с рецептором. Клетка. 1991; 64: 891–901. [PubMed] [Google Scholar]
38. Гросс Г., Горохов Г., Вакс Т., Эшхар З. Создание эффекторных Т-клеток, экспрессирующих химерный Т-клеточный рецептор с типоспецифичностью антител. Пересадка Proc. 1989;21:127–30. [PubMed] [Google Scholar]
39. Эшхар З., Вакс Т., Бендавид А., Шиндлер Д.Г. Функциональная экспрессия генов химерных рецепторов в Т-клетках человека. Дж Иммунол Методы. 2001; 248: 67–76. [PubMed] [Google Scholar]
40. Maher J, Brentjens RJ, Gunset G, Rivière I, Sadelain M. Цитотоксичность и пролиферация Т-лимфоцитов человека, управляемая одним химерным рецептором TCRzeta/CD28. Нац биотехнолог. 2002; 20:70–5. [PubMed] [Google Scholar]
Нац биотехнолог. 2002; 20:70–5. [PubMed] [Google Scholar]
41. Карпенито С., Милоне М.С., Хассан Р., Симонет Дж.С., Лахал М., Сухоски М.М., Варела-Роэна А., Хейнс К.М., Хейтян Д.Ф., Альбельда С.М., Кэрролл Р.Г., Райли Д.Л., Пастан I, июнь Ч. Контроль больших укоренившихся опухолевых ксенотрансплантатов с помощью генетически ретаргетированных Т-клеток человека, содержащих домены CD28 и CD137. Proc Natl Acad Sci U S A. 2009;106:3360–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Zhang F, Aravanis AM, Adamantidis A, de Lecea L, Deisseroth K. Автоматические выключатели: оптические технологии для исследования нейронных сигналов и систем. Нат Рев Нейроски. 2007; 8: 577–81. [PubMed] [Google Scholar]
43. Airan RD, Thompson KR, Fenno LE, Bernstein H, Deisseroth K. Временно точный контроль внутриклеточной передачи сигналов in vivo. Природа. 2009; 458:1025–9. [PubMed] [Google Scholar]
44. Левская А., Вайнер О.Д., Лим В.А., Фойгт К.А. Пространственно-временной контроль клеточной передачи сигналов с помощью взаимодействия белков с переключаемым светом. Природа. 2009 г.;461:997–1001. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Природа. 2009 г.;461:997–1001. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Ву Й.И., Фрей Д., Лунгу О.И., Йериг А., Шлихтинг И., Кульман Б., Хан К.М. Генетически кодируемый фотоактивируемый Rac контролирует подвижность живых клеток. Природа. 2009; 461:104–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Lim WA. Модульная логика сигнальных белков: построение аллостерических переключателей из простых связывающих доменов. Curr Opin Struct Biol. 2002; 12: 61–8. [PubMed] [Google Scholar]
47. Prehoda KE, Scott JA, Mullins RD, Lim WA. Интеграция нескольких сигналов посредством совместной регуляции комплекса N-WASP-Arp2/3. Наука. 2000;290: 801–6. [PubMed] [Google Scholar]
48. Ю. Б., Мартинс И. Р., Ли П., Амарасингхе Г. К., Уметани Дж., Фернандес-Запико М. Е., Билладо Д. Д., Мачиус М., Томчик Д. Р., Розен М. К.. Структурно-энергетические механизмы кооперативного аутоингибирования и активации Vav1. Клетка. 2010; 140: 246–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Dueber JE, Yeh BJ, Chak K, Lim WA. Перепрограммирование управления аллостерическим сигнальным переключателем посредством модульной рекомбинации. Наука. 2003; 301:1904–8. [PubMed] [Академия Google]
Dueber JE, Yeh BJ, Chak K, Lim WA. Перепрограммирование управления аллостерическим сигнальным переключателем посредством модульной рекомбинации. Наука. 2003; 301:1904–8. [PubMed] [Академия Google]
50. Йе Б.Дж., Рутильяно Р.Дж., Деб А., Бар-Саги Д., Лим В.А. Изменение путей клеточной морфологии с помощью синтетических факторов обмена гуаниновых нуклеотидов. Природа. 2007; 447: 596–600. [PubMed] [Google Scholar]
51. Dueber JE, Mirsky EA, Lim WA. Разработка синтетических сигнальных белков со сверхчувствительным контролем ввода/вывода. Нац биотехнолог. 2007; 25:660–2. [PubMed] [Google Scholar]
52. Yadav SS, Yeh BJ, Craddock BP, Lim WA, Miller WT. Реинжиниринг сигнальных свойств киназ семейства Src. Биохимия. 2009 г.;48:10956–62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Garrington TP, Johnson GL. Организация и регуляция сигнальных путей митоген-активируемых протеинкиназ. Curr Opin Cell Biol. 1999; 11: 211–8. [PubMed] [Google Scholar]
54. Шварц М.А., Мадхани HD. Принципы специфичности передачи сигналов киназы MAP у Saccharomyces cerevisiae. Анну Рев Жене. 2004; 38: 725–48. [PubMed] [Google Scholar]
Шварц М.А., Мадхани HD. Принципы специфичности передачи сигналов киназы MAP у Saccharomyces cerevisiae. Анну Рев Жене. 2004; 38: 725–48. [PubMed] [Google Scholar]
55. Чой К.Ю., Саттерберг Б., Лайонс Д.М., Элион Э.А. Ste5 связывает множественные протеинкиназы в каскаде киназ MAP, необходимом для спаривания у S. cerevisiae. Клетка. 1994;78(3):499–512. [PubMed] [Google Scholar]
56. Printen JA, Sprague GF., Jr Белково-белковые взаимодействия в пути ответа феромонов дрожжей: Ste5p взаимодействует со всеми членами каскада киназ MAP. Генетика. 1994;138(3):609–19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Posas F, Saito H. Осмотическая активация пути HOG MAPK через Ste11p MAPKKK: роль каркаса Pbs2p MAPKK. Наука. 1997; 276 (5319): 1702–1705. [PubMed] [Google Scholar]
58. Park SH, Zarrinpar A, Lim WA. Изменение путей киназы MAP с использованием альтернативных механизмов сборки каркаса. Наука. 2003;299:1061–4. [PubMed] [Google Scholar]
59. Harris K, Lamson RE, Nelson B, Hughes TR, Marton MJ, Roberts CJ, Boone C, Pryciak PM. Роль каркасов в специфичности пути киназы MAP выявляется с помощью индивидуального дизайна сигнальных белков, предназначенных для пути. Карр Биол. 2001; 11 (23): 1815–24. [PubMed] [Google Scholar]
Роль каркасов в специфичности пути киназы MAP выявляется с помощью индивидуального дизайна сигнальных белков, предназначенных для пути. Карр Биол. 2001; 11 (23): 1815–24. [PubMed] [Google Scholar]
60. Dodge-Kafka KL, Soughayer J, Pare GC, Carlisle Michel JJ, Langeberg LK, Kapiloff MS, Scott JD. Заякоривающий белок протеинкиназы А mAKAP координирует два интегрированных эффекторных пути цАМФ. Природа. 2005; 437 (7058): 574–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Мишра П., Соколич М., Уолл М.А., Грейвс Дж., Ван З., Ранганатан Р. Динамические каркасы в сигнальной системе, связанной с G-белком. Клетка. 2007;131(1):80–92. [PubMed] [Google Scholar]
62. Bashor CJ, Helman NC, Yan S, Lim WA. Использование сконструированных каркасных взаимодействий для изменения динамики передачи сигналов киназного пути MAP. Наука. 2008;319(5869):1539–43. [PubMed] [Google Scholar]
63. Чант Дж. Полярность клеток у дрожжей. Annu Rev Cell Dev Biol. 1999; 15: 365–91. [PubMed] [Академия Google]
[PubMed] [Академия Google]
64. Козубовски Л., Сайто К., Джонсон Дж.М., Хауэлл А.С., Зила Т.Р., Лью Д.Дж. Поляризация с нарушением симметрии, управляемая комплексом Cdc42p GEF-PAK. Карр Биол. 2008;18(22):1719–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Хауэлл А.С., Сэвидж Н.С., Джонсон С.А., Бозе И., Вагнер А.В., Зила Т.Р., Нейхаут Х.Ф., Рид М.С., Горячев А.Б., Лью Д.Дж. Сингулярность в поляризации: перепрограммирование дрожжевых клеток для образования двух почек. Клетка. 2009;139(4):731–43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Zarrinpar A, Park SH, Lim WA. Оптимизация специфичности в сети взаимодействия клеточных белков с помощью отрицательного отбора. Природа. 2003;426(6967): 676–80. [PubMed] [Google Scholar]
67. Stiffler MA, Chen JR, Grantcharova VP, Lei Y, Fuchs D, Allen JE, Zaslavskaia LA, MacBeath G. Селективность связывания домена PDZ оптимизирована для протеома мыши. Наука. 2007;317(5836):364–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Эрнст А., Сазинский С.Л., Хуэй С., Каррелл Б., Дарси М., Сешагири С., Бадер Г.Д., Сидху С.С. Быстрая эволюция функциональной сложности в семействе доменов. Научный сигнал. 2009;2(87):ra50. [PubMed] [Академия Google]
Эрнст А., Сазинский С.Л., Хуэй С., Каррелл Б., Дарси М., Сешагири С., Бадер Г.Д., Сидху С.С. Быстрая эволюция функциональной сложности в семействе доменов. Научный сигнал. 2009;2(87):ra50. [PubMed] [Академия Google]
69. Григорян Г., Рейнке А.В., Китинг А.Е. Дизайн специфичности взаимодействия с белками дает селективные bZIP-связывающие пептиды. Природа. 2009;458(7240):859–64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Хуанг Дж., Койде А., Макабе К., Койде С. Дизайн белковых функций скачков за счет направленной эволюции интерфейса домена. Proc Natl Acad Sci U S A. 2008;105(18):6578–83. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Зауэр Б. Нацеливание на индуцируемые гены у мышей с использованием системы Cre/lox. Методы. 1998;14(4):381–92. [PubMed] [Google Scholar]
72. Yokobayashi Y, Weiss R, Arnold FH. Направленная эволюция генетической цепи. Proc Natl Acad Sci U S A. 2002;99(26):16587–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]
1.
 Введение в проектирование биологической схемы — документация по проектированию биологической схемы
Введение в проектирование биологической схемы — документация по проектированию биологической схемы Что такое биологическая схема?
В рамках этого курса мы рассмотрим как минимум два уровня биологических цепей:
Молекулярные цепи , действующие в клетках, состоят из молекулярных частиц (генов, белков и т. д.), которые определенным образом взаимодействуют друг с другом. Например, данный ген может быть транскрибирован для получения соответствующей мРНК, которая, в свою очередь, может быть транслирована для получения определенного белка. Точно так же киназа может специфически фосфорилировать целевой белок по определенным остаткам. Специфичность этих взаимодействий является ключевым свойством, которое делает возможными молекулярные цепи. Примеры молекулярных цепей
включают те, которые контролируют клеточный цикл и циркадные часы, сигнальные пути, которые обрабатывают сигналы от других клеток, и цепи, которые контролируют гибель клеток, среди бесчисленного множества других.
На один уровень выше мы также рассмотрим схемы ячеек . В этом случае мы можем думать о клетках в разных состояниях, разных типах или даже разных видах, которые сигнализируют друг другу о контроле друг друга за ростом, гибелью, пролиферацией и дифференцировкой. Ключевыми переменными в этих цепях являются концентрации и расположение клеток каждого типа. Прекрасным примером клеточной цепи является иммунная система, в которой разные типы клеток влияют на пролиферацию и дифференцировку друг друга. через цитокины и другие сигналы.
Конечно, эти два уровня не являются независимыми. Поведение данного типа клеток внутри клеточного контура контролируется его молекулярными контурами.
На любом уровне мы также можем различать естественные цепи, которые мы обнаруживаем у микробов, растений и животных, и синтетических цепей, которые мы проектируем и строим в клетках из хорошо охарактеризованных или реконструированных генов, белков и другие молекулярные компоненты.
Что такое разработка биологических цепей?
Проблема дизайна возникает всякий раз, когда можно построить множество различных продуктов из одних и тех же элементов. Например, электронные схемы состоят из нескольких элементов разного типа: транзисторов, резисторов и т. д., которые можно соединять самыми разными способами, чтобы получить огромное количество схем с разными свойствами. Какая схема будет работать лучше всего? Какие компромиссы, например, между мощностью и производительностью или между скоростью и точностью, существуют для альтернативные проекты, которые выполняют аналогичные функции? Проблемы проектирования также распространены за пределами науки и техники. Например, чтобы сделать постер к фильму, нужно выбрать и расположить графические элементы по отношению друг к другу.
Биологические науки накопили информацию о молекулярных компонентах клеток (генах, РНК, белках, метаболитах и многих других молекулах) и их взаимодействиях. Мы знаем, где факторы транскрипции связываются по всему геному, какие белки химически модифицируют какие другие и какие белки функционируют вместе в комплексах. В то же время подходы синтетической биологии теперь позволяют нам создавать новые генетические цепи внутри клеток, которые могут программировать совершенно новое поведение. Так что, наивно, может
кажется, что мы должны разобраться в проектировании биологических цепей. Мы должны быть в состоянии понимать, предсказывать и контролировать клеточные цепи с большой точностью. Однако на практике наши возможности еще более ограничены, потому что мы только начинаем открывать ответы на некоторые фундаментальные вопросы о конструкции этих схем.
В то же время подходы синтетической биологии теперь позволяют нам создавать новые генетические цепи внутри клеток, которые могут программировать совершенно новое поведение. Так что, наивно, может
кажется, что мы должны разобраться в проектировании биологических цепей. Мы должны быть в состоянии понимать, предсказывать и контролировать клеточные цепи с большой точностью. Однако на практике наши возможности еще более ограничены, потому что мы только начинаем открывать ответы на некоторые фундаментальные вопросы о конструкции этих схем.
Вот примеры типов проблем, которые может помочь решить проектирование биологических схем:
-
Какие возможности каждая схема предоставляет клетке? (функции, принцип конструкции)
-
Как эти возможности проявляются в схемной архитектуре? (механизм)
-
Как мы можем управлять клетками предсказуемым образом, используя эти схемы? (биомедицинские приложения)
-
Как мы можем использовать принципы проектирования схем для программирования предсказуемого нового поведения в живых клетках? (синтетическая биология и биоинженерия)
В этом курсе мы подойдем к этим вопросам с точки зрения как естественных , так и синтетических контуров, с идеей, что фундаментальные принципы, которые позволяют контуру эффективно функционировать внутри или между клетками, не обязательно зависят от независимо от того, возникла ли эта схема естественным путем или была создана в лаборатории. Сказав это, мы также признаем, что эволюция может создавать конструкции, которые являются более сложными или отличными от тех, которые мы можем создать в настоящее время, или даже
зачать На самом деле, главная цель курса — увидеть, в какой степени мы можем изучить принципы естественных схем, которые позволят нам более эффективно проектировать синтетические схемы.
Сказав это, мы также признаем, что эволюция может создавать конструкции, которые являются более сложными или отличными от тех, которые мы можем создать в настоящее время, или даже
зачать На самом деле, главная цель курса — увидеть, в какой степени мы можем изучить принципы естественных схем, которые позволят нам более эффективно проектировать синтетические схемы.
Биологические цепи отличаются от многих других типов цепей или систем, подобных цепям
Является ли проектирование биологических цепей решенной проблемой? Электроника, программное обеспечение, сантехника, строительство и другие системы, разработанные человеком, основаны на связях между модульными компонентами (см. рисунок). Можем ли мы просто применить известные принципы этих систем биологических цепей? Обычно ответ отрицательный по многим причинам.
-
Естественные цепи не были созданы людьми. Они эволюционировали. Это означает, что они не «хорошо задокументированы», и их функции часто совершенно неясны.

-
Даже синтетические цепи, разработанные людьми, часто используют развитые компоненты (например, факторы транскрипции), для которых у нас нет полного понимания.
-
В биологических схемах используются принципиально иные конструкции, чем в аналогах, созданных человеком. Например, в клетках молекулярные компоненты демонстрируют обширные взаимодействия «многие ко многим» («перекрестные помехи») между своими компонентами. Этого свойства обычно избегают в электронике, но оно может предоставить клеткам уникальные возможности.
-
Шум: В то время как электронные схемы могут функционировать детерминистически, биологические схемы функционируют с высоким уровнем стохастических (случайных) колебаний в своих компонентах. Эти колебания часто называют «шумом». И шум — это не просто неприятность: некоторые биологические схемы используют его, чтобы обеспечить поведение, которое без него было бы невозможно.
-
Биологические цепи могут быть очень параллельными в том смысле, что одна и та же цепь может работать во многих различных генетически идентичных индивидуальных клетках, будь то в бактериальной популяции или в многоклеточном организме, таком как вы.

-
Электрические системы используют положительные или отрицательные напряжения и токи, что позволяет создавать положительные или отрицательные эффекты. Напротив, биологические цепи построены из молекул (или клеток), концентрация которых не может быть отрицательной. Это означает, что они должны использовать другие механизмы для «инвертирования» действий.
-
С более практической точки зрения у нас очень ограниченные возможности для создания, тестирования и сравнения проектов. Даже с недавними разработками, такими как CRISPR, наша способность быстро и точно производить клетки с четко определенным геномом остается ограниченной по сравнению с тем, что возможно в более продвинутых дисциплинах. (При этом ситуация быстро улучшается!)
-
Какие еще фундаментальные различия между биологическими контурами и системами, созданными человеком, вы можете назвать?
Электроника, программное обеспечение и сантехника — прекрасные примеры созданных человеком систем, обладающих многими свойствами, аналогичными биологическим схемам.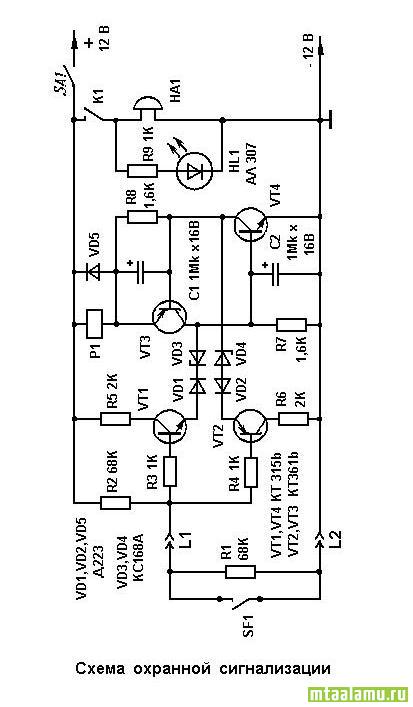 Эти системы основаны на известных принципах проектирования, которые иногда совпадают с принципами биологических цепей, а иногда отличаются от них.
Эти системы основаны на известных принципах проектирования, которые иногда совпадают с принципами биологических цепей, а иногда отличаются от них.
Вдохновение от электроники
В своей классической книге «Искусство электроники» Горовиц и Хилл объясняют нечто похожее на волнение, которое многие сейчас испытывают по поводу биологии:
Пол Горовиц и Уинфилд Хилл, «Искусство электроники», 3-е издание, издательство Кембриджского университета, 2015.
Предпосылки и цели
Определение принципов построения генетических цепей в конечном итоге позволит нам
-
Понимать, предсказывать и контролировать живые системы с большей точностью (системная биология)
-
Разработка новых генетических цепей, которые эффективно функционируют в клетках и организмах (синтетическая биология).
Для достижения этих целей в рамках этого курса будут разработаны количественные методы и подходы к анализу различных схемных решений (инструменты), а также определены принципы схемотехнического проектирования, которые обеспечивают понимание и интуицию в отношении того, как работают различные схемы и почему они были выбраны путем эволюции или синтетического анализа. биологи.
биологи.
Первые шаги: развить интуицию для простейших цепей регуляции генов
Мы начнем с рассмотрения одного гена, кодирующего один соответствующий белок. Этот минимальный пример позволит нам развить интуицию в динамике простейших систем регуляции генов и изложить процедуру, которую мы можем расширить для анализа более сложных цепей.
Какая концентрация белка будет производиться геном x ? Мы предполагаем, что ген будет транскрибирован в мРНК, а эти молекулы мРНК, в свою очередь, будут транслироваться с образованием белков, так что новые белки будут производиться с общей скоростью \(\бета\) молекул в единицу времени. Белок \(x\) не просто накапливается с течением времени. Он также удаляется как путем активной деградации, так и путем разбавления по мере роста и деления клеток. Для простоты будем считать, что оба процесса имеют тенденцию к уменьшению концентрации белка с помощью простого процесса первого порядка с константой скорости \(\gamma\).
Используемый нами подход можно описать как «феноменологическое моделирование». Мы не представляем явно каждый лежащий в основе молекулярный шаг. Вместо этого мы предполагаем, что эти шаги порождают «крупнозернистые» взаимосвязи, которые мы можем моделировать таким образом, который не зависит от многих лежащих в их основе молекулярных деталей. Проверка этого подхода заключается в том, позволяет ли он нам понять и экспериментально предсказать поведение реальных биологических систем. См. статью в Википедии о феноменологическом
моделей и эта статья Джереми Гунавардены.
Мы не представляем явно каждый лежащий в основе молекулярный шаг. Вместо этого мы предполагаем, что эти шаги порождают «крупнозернистые» взаимосвязи, которые мы можем моделировать таким образом, который не зависит от многих лежащих в их основе молекулярных деталей. Проверка этого подхода заключается в том, позволяет ли он нам понять и экспериментально предсказать поведение реальных биологических систем. См. статью в Википедии о феноменологическом
моделей и эта статья Джереми Гунавардены.
Таким образом, мы можем начертить диаграмму нашего простого гена x, где его белок вырабатывается и удаляется (штриховая окружность):
скорость \(\гамма х\). Затем мы можем записать простое обыкновенное дифференциальное уравнение, описывающее эту динамику:
\begin{align} &\frac{dx}{dt} = \mathrm{производство — (деградация+разбавление)} \\[1em] &\frac{dx}{dt} = \beta — \gamma x \end{выравнивание}
, где
\begin{выравнивание} \gamma = \gamma_\mathrm{разбавление} + \gamma_\mathrm{разложение} \end{align}
Примечание об эффективной скорости деградации : Когда клетки растут, белок удаляется как путем деградации, так и разбавления. Для стабильных белков преобладает разбавление. Для очень нестабильных белков, время полужизни которых намного меньше, чем период клеточного цикла, разбавлением можно пренебречь. У бактерий период полураспада мРНК (обычно 1-10 минут) намного короче, чем период полураспада белка. В эукариотических клетках это не всегда верно (период полураспада мРНК может составлять несколько часов в клетках млекопитающих).
Для стабильных белков преобладает разбавление. Для очень нестабильных белков, время полужизни которых намного меньше, чем период клеточного цикла, разбавлением можно пренебречь. У бактерий период полураспада мРНК (обычно 1-10 минут) намного короче, чем период полураспада белка. В эукариотических клетках это не всегда верно (период полураспада мРНК может составлять несколько часов в клетках млекопитающих).
Включая транскрипцию и трансляцию как отдельные этапы
В этом описании не проводится различие между транскрипцией и трансляцией. Однако рассмотрение обоих процессов по отдельности может оказаться важным в более динамичных и стохастических контекстах, с которыми мы столкнемся позже в ходе курса. Для этого мы можем просто добавить дополнительную переменную для представления концентрации мРНК, которая теперь транскрибируется, транслируется в белок и расщепляется (и разбавляется), как схематически показано здесь:
Эти реакции можно описать двумя связанными дифференциальными уравнениями для мРНК (m) и белка (x):
\begin{align}
&\frac{dm}{dt} = \beta_m — \gamma_m m, \\[1em]
&\frac{dx}{dt} = \beta_p m — \gamma_p x.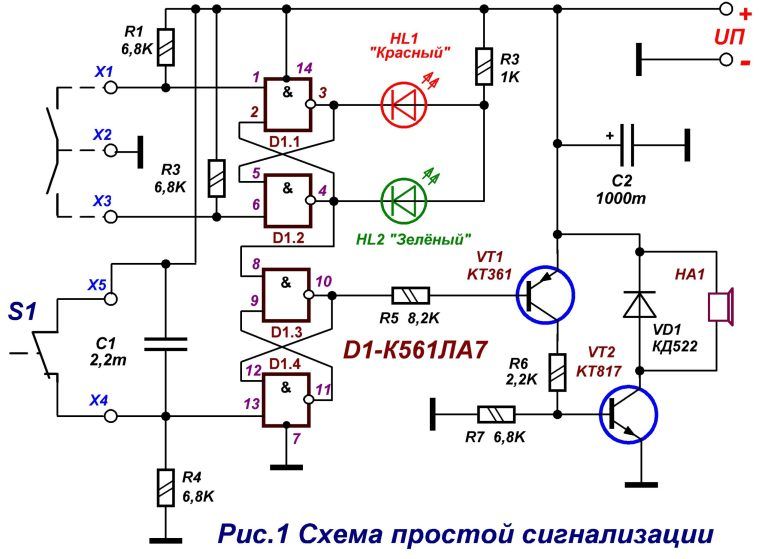 \end{align}
\end{align}
Теперь мы можем напрямую определить стационарные концентрации мРНК и белка, установив обе производные по времени равными 0 и решив. Находим:
\begin{align} &m_\mathrm{st} = \beta_m / \gamma_m, \\[1em] &x_\mathrm{st} = \frac{\beta_p m_\mathrm{st}}{\gamma_p} = \frac{\beta_p \beta_m}{\gamma_p \gamma_m}. \end{выравнивание}
Из этого мы видим, что концентрация белка в стационарном состоянии пропорциональна произведению двух скоростей синтеза и обратно пропорциональна произведению двух скоростей деградации.
И это дает нам первую загадку дизайна : клетка может контролировать уровень экспрессии белка по крайней мере четырьмя различными способами: Она может модулировать (1) транскрипцию, (2) трансляцию, (3) деградацию мРНК или (4 ) скорости деградации белка (или их комбинации). Существуют ли компромиссы между этими различными вариантами? Все ли они используются без разбора или предпочтение отдается одному из них в естественном контексте?
От экспрессии генов к регуляции генов — добавление репрессора
Жизнь была бы простой — возможно, слишком простой — если бы гены постоянно оставались включенными. Чтобы сделать вещи интересными, клетка должна регулировать их, снижая или повышая уровень их экспрессии в зависимости от условий окружающей среды и других факторов. Один из самых простых способов сделать это — использовать репрессоры. Репрессоры представляют собой белки, которые могут связываться со специфическими сайтами связывания на промоторе или рядом с ним, чтобы изменить его активность. Часто сила их привязки зависит от внешних воздействий. Например,
репрессор LacI обычно выключает гены утилизации лактозы в Кишечная палочка . Однако в присутствии лактозы в среде модифицированная форма лактозы связывается с LacI, подавляя его способность подавлять гены-мишени. Таким образом, питательное вещество (лактоза) может регулировать экспрессию генов, которые позволяют клетке его использовать. (Для научно-исторической саги об этой, казалось бы, простой системе рекомендуем увлекательную, замечательную книгу «Лак
оперон» Б. Мюллер-Хилла.)
Чтобы сделать вещи интересными, клетка должна регулировать их, снижая или повышая уровень их экспрессии в зависимости от условий окружающей среды и других факторов. Один из самых простых способов сделать это — использовать репрессоры. Репрессоры представляют собой белки, которые могут связываться со специфическими сайтами связывания на промоторе или рядом с ним, чтобы изменить его активность. Часто сила их привязки зависит от внешних воздействий. Например,
репрессор LacI обычно выключает гены утилизации лактозы в Кишечная палочка . Однако в присутствии лактозы в среде модифицированная форма лактозы связывается с LacI, подавляя его способность подавлять гены-мишени. Таким образом, питательное вещество (лактоза) может регулировать экспрессию генов, которые позволяют клетке его использовать. (Для научно-исторической саги об этой, казалось бы, простой системе рекомендуем увлекательную, замечательную книгу «Лак
оперон» Б. Мюллер-Хилла.)
На следующей диаграмме мы обозначаем репрессор R.
\begin{align} D + R \rightleftharpoons D_{occ} \end{выравнивание}
Внутри клетки репрессор связывает и разъединяет свой целевой сайт. Мы предполагаем, что уровень экспрессии гена ниже, когда репрессор связан, и выше, когда он несвязан. Тогда средний уровень экспрессии гена пропорционален доле времени, в течение которого репрессор не связан.
Таким образом, мы вычисляем «концентрацию» участков ДНК в занятых или незанятых состояниях. (В пределах одной клетки отдельный участок ДНК либо связан, либо несвязан, но, усреднив по популяции клеток, можно говорить о средней занятости участка). Пусть \(D\) — концентрация незанятого промотора, \(D_\mathrm{occ}\) — концентрация занятого промотора, а \(D_\mathrm{tot}\) — общая концентрация промотора, причем \(D_\mathrm{tot} = D + D_\mathrm{occ}\), как того требует закон сохранения массы.
Мы также можем предположить разделение временных масштабов между скоростями связывания и несвязывания репрессора с сайтом связывания ДНК, которые часто бывают быстрыми по сравнению с временными масштабами, в течение которых изменяются концентрации мРНК и белка. (Однако будьте осторожны, в некоторых контекстах, таких как клетки млекопитающих, это неверно.)
(Однако будьте осторожны, в некоторых контекстах, таких как клетки млекопитающих, это неверно.)
Все, что нам нужно знать, это средняя концентрация незанятых сайтов связывания, \(D/D_\mathrm{tot}\).
\начать{выравнивание} &k_+ D R = k_- D_\mathrm{occ} \\[1em] &D_\mathrm{occ} = D_\mathrm{tot} — D \\[1em] &\frac{D}{D_\mathrm{tot}} = \frac{1}{1+R/K_\mathrm{d}}, \end{выравнивание}
где \(K_\mathrm{d} = k_- / k_+\). Исходя из этого, мы можем записать скорость производства как функцию концентрации репрессора,
\begin{align} \beta(R) = \beta_0 \frac{D}{D_\mathrm{tot}} = \frac{\beta_0}{1+R/K_\mathrm{d}}. \end{align}
Свойства простой кривой привязки
Это наша первая встреча с функцией, которая скоро станет знакомой. Обратите внимание, что эта функция имеет два параметра: \(K_\mathrm{d}\) задает концентрацию репрессора, при которой ответ снижается до половины своего максимального значения. Коэффициент \(\beta_0\) — это просто максимальный уровень выражения и параметр, который умножает остальную часть функции.
# Построить теоретические кривые
R = np.linspace (0, 10, 200)
б0 = 1
Кд = 1
бета = b0 / (1 + R / Kd)
init_slope = -R + 1
# Построить сюжет
p = боке.зарисовка.фигура(
рост=275,
ширина=400,
x_axis_label="R",
y_axis_label="β(R)",
x_range=[R[0], R[-1]],
у_диапазон = [0, 1],
)
p.line(R, бета, line_width=2, color="tomato", legend_label="β(R)")
стр.строка(
R, init_slope, line_width=2, color="orange", legend_label="начальный уклон"
)
p.legend.click_policy = "скрыть"
p.title.text = "Kd = 1, β₀ = 1"
боке.ио.шоу(п)
Экспрессия генов может быть «дырявой»
В качестве отступления отметим, что в реальной жизни многие гены никогда не репрессируются до нулевой экспрессии, даже если вы добавляете много репрессора. Вместо этого существует базовый или «базовый» уровень экспрессии, который все еще имеет место. Простой способ смоделировать это — добавить дополнительный постоянный член \(\alpha_0\) к выражению
\begin{align}
\beta(R) = \alpha_0 + \beta_0 \frac{D}{D_\mathrm{tot}} = \alpha_0 + \frac{\beta_0}{1+R/K_\mathrm{d}}.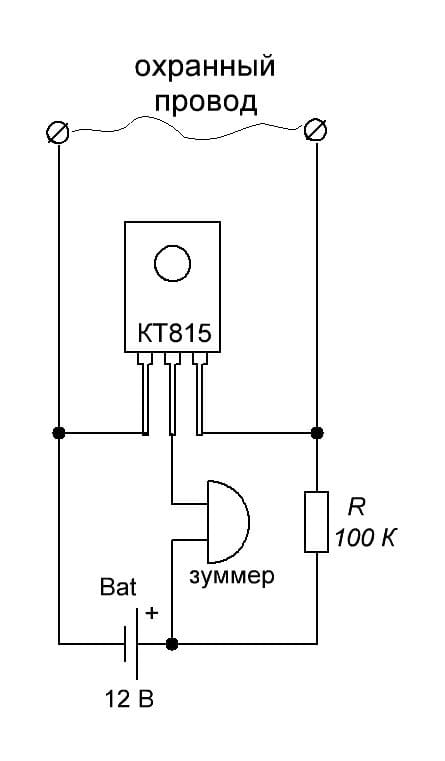 \end{выравнивание}
\end{выравнивание}
Учитывая повсеместное распространение утечки, важно убедиться, что поведение схемы не зависит от отсутствия утечки.
# Построить теоретические кривые
R = np.linspace (0, 20, 200)
б0 = 1
Кд = 1
а0 = 0,25
бета = а0 + b0 / (1 + R / Kd)
# Построить сюжет
p = боке.зарисовка.фигура(
рост=275,
ширина=400,
x_axis_label="R",
y_axis_label="β(R)",
x_range=[R[0], R[-1]],
y_range=[0, бета.макс()],
)
p.line(R, бета, line_width=2, color="tomato", legend_label="β(R)")
стр.строка(
[R[0], R[-1]],
[а0, а0],
ширина_линии=2,
цвет = "оранжевый",
legend_label="базовое выражение",
)
p.title.text = "Kd = 1, β₀ = 1, a₀ = 0,25"
боке.ио.шоу(п)
Активация
Гены могут регулироваться как активаторами, так и репрессорами. Лечение случая активации просто включает в себя переключение состояния, которое активно экспрессируется, с несвязанного состояния на состояние, связанное с белком (теперь называемое активатором). И точно так же, как связывание репрессора с ДНК можно модулировать с помощью малых молекул, так и связывание активатора можно модулировать путем связывания с малыми молекулами.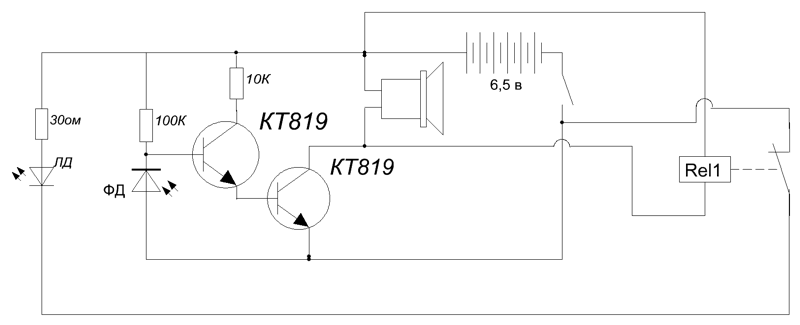 У бактерий одним из многих примеров является регуляция арабинозы.
система.
У бактерий одним из многих примеров является регуляция арабинозы.
система.
\begin{align} \beta(A) = \beta_0 \frac{D_\mathrm{occ}}{D_\mathrm{tot}} = \frac{\beta_0 A/K_\mathrm{d}}{1+A/K_\mathrm{ г}}. \end{align}
Это приводит к противоположному, зеркальному отображению реакции по сравнению с подавлением, как показано ниже, без утечки.
А = np.linspace (0, 20, 200)
бета_А = А / (1 + А)
бета_R = 1 / (1 + R)
# Построить сюжет
p = боке.зарисовка.фигура(
рост=275,
ширина=400,
x_axis_label="А/Кд, Р/Кд",
y_axis_label="β/β₀",
x_range=[R[0], R[-1]],
у_диапазон = [0, 1],
)
p.line(A, beta_A, line_width=2, legend_label="β(A)")
p.line(R, beta_R, line_width=2, color="tomato", legend_label="β(R)")
p.legend.location = "центр_справа"
боке.ио.шоу(п)
Активатор или репрессор — что выбрать?
И вот, наконец, мы подошли к нашему первому истинному вопросу о «дизайне»: У клетки есть как минимум два разных способа регулировать ген: с помощью активатора или с помощью репрессора.

