Что представляет собой микробиологический микроскоп. Как устроен и работает микроскоп для микробиологических исследований. Какие основные компоненты входят в его состав. Каковы преимущества и недостатки различных типов микроскопов в микробиологии.
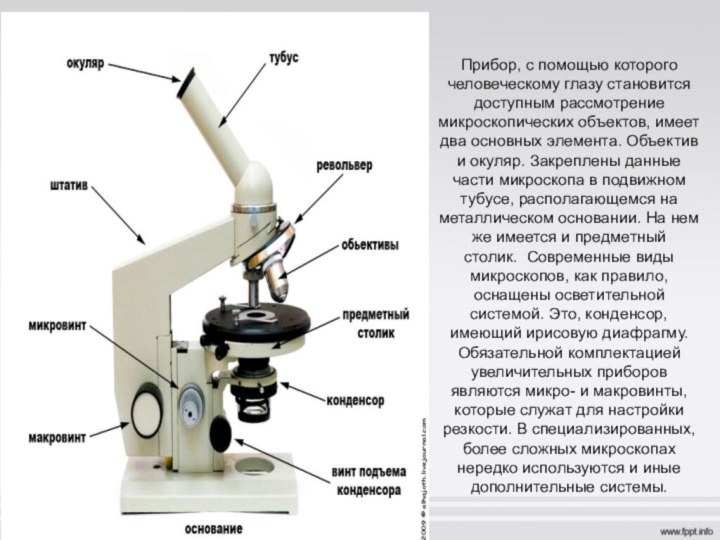
Основные компоненты микробиологического микроскопа
Микробиологический микроскоп является важнейшим инструментом для изучения микроорганизмов. Он позволяет увеличивать изображение объектов в сотни и тысячи раз, делая видимыми мельчайшие детали строения бактерий, грибов и других микроорганизмов. Основными компонентами такого микроскопа являются:
- Объектив — система линз, обеспечивающая первичное увеличение изображения
- Окуляр — система линз для дополнительного увеличения изображения
- Конденсор — устройство для фокусировки света на препарате
- Предметный столик — площадка для размещения исследуемого препарата
- Тубус — корпус микроскопа, соединяющий объектив и окуляр
- Осветительная система — источник света для освещения препарата
- Штатив — основание микроскопа
Принцип работы микробиологического микроскопа
Принцип работы микробиологического микроскопа основан на многократном увеличении изображения исследуемого объекта с помощью системы линз. Рассмотрим основные этапы формирования изображения:
- Освещение препарата светом от осветительной системы
- Прохождение света через препарат
- Первичное увеличение изображения объективом
- Дополнительное увеличение изображения окуляром
- Проецирование увеличенного изображения на сетчатку глаза исследователя
Общее увеличение микроскопа определяется как произведение увеличений объектива и окуляра. Современные микробиологические микроскопы позволяют достигать увеличения до 1000-1500 раз.
Преимущества микробиологических микроскопов
Использование микроскопов в микробиологии обеспечивает ряд важных преимуществ:
- Возможность визуализации микроорганизмов, невидимых невооруженным глазом
- Изучение морфологических особенностей бактерий, грибов и других микроорганизмов
- Наблюдение за подвижностью микроорганизмов
- Исследование внутриклеточных структур микробов
- Проведение количественного анализа микробных популяций
Все это делает микроскопию незаменимым методом в микробиологических исследованиях и диагностике.
Недостатки и ограничения микробиологических микроскопов
Несмотря на широкие возможности, микроскопический метод имеет ряд ограничений:

- Невозможность наблюдения объектов меньше 0.2 мкм (вирусы, некоторые органеллы)
- Необходимость специальной подготовки препаратов
- Субъективность оценки при визуальном анализе
- Невозможность наблюдения живых клеток при электронной микроскопии
- Высокая стоимость современных исследовательских микроскопов
Тем не менее, преимущества микроскопии значительно перевешивают ее недостатки в микробиологических исследованиях.
Основные типы микроскопов в микробиологии
В микробиологической практике используются различные типы микроскопов:
Световые микроскопы
Наиболее распространенный тип, использующий видимый свет для формирования изображения. Позволяет наблюдать живые клетки. Существует несколько разновидностей:
- Светлопольный микроскоп — классический вариант
- Фазово-контрастный микроскоп — улучшает контрастность неокрашенных препаратов
- Темнопольный микроскоп — используется для наблюдения мелких подвижных объектов
- Люминесцентный микроскоп — позволяет наблюдать флуоресцирующие объекты
Электронные микроскопы
Используют пучок электронов вместо света, что обеспечивает гораздо большее увеличение и разрешение. Различают:

- Просвечивающий электронный микроскоп — для изучения ультратонких срезов
- Сканирующий электронный микроскоп — для исследования поверхности объектов
Выбор типа микроскопа зависит от конкретных задач исследования и изучаемых объектов.
Современные тенденции в развитии микробиологических микроскопов
Развитие микроскопической техники продолжается, основные направления включают:
- Повышение разрешающей способности микроскопов
- Разработку новых методов контрастирования препаратов
- Создание цифровых микроскопов с компьютерной обработкой изображений
- Развитие методов прижизненной микроскопии клеток
- Совмещение микроскопии с другими методами анализа
Эти инновации открывают новые возможности для микробиологических исследований и диагностики.
Заключение
Микробиологический микроскоп является незаменимым инструментом для изучения микроорганизмов. Понимание принципов его работы, преимуществ и ограничений различных типов микроскопов позволяет эффективно применять микроскопию в микробиологической практике. Дальнейшее развитие микроскопической техники будет способствовать новым открытиям в области микробиологии.

|
Главная » Статьи и полезные материалы » Микроскопы » Статьи о микроскопах, микропрепаратах и исследованиях микромира » Объектив и окуляр микроскопа В одной из наших предыдущих статьей мы рассказывали о механической системе микроскопа. Пришло время поговорить и об оптической. Самые важные и незаменимые ее элементы – объектив и окуляр микроскопа. Иногда этих аксессуаров бывает несколько – все зависит от модели оптического прибора. В детских микроскопах редко встретишь больше одного объектива и одного окуляра. А вот комплектация профессиональной модели может включать, например, шесть объективов и четыре окуляра. Зачем такое разнообразие – давайте разбираться! Окуляр устанавливается сверху, в него мы смотрим. Вместе с монокулярным микроскопом поставляется как минимум один окуляр, а вот для бинокулярных моделей нужна уже хотя бы пара. У каждого окуляра и объектива есть свое увеличение. А увеличение микроскопа высчитывается по формуле: кратность окуляра умножить на кратность объектива. Поэтому чем больше в комплекте поставки окуляров и объективов, тем больше в микроскопе вариантов увеличений. Рассмотрим на примере. Есть два окуляра кратностью 10х и 12,5х и три объектива с кратностью 10х, 40х и 100х. На какое увеличение микроскопа можно рассчитывать? Ответ в табличке ниже.
Например, мы видим, что взяв окуляр 10х и объектив 40х микроскопа, мы получили увеличение в 400 крат. В нашем интернет-магазине вы можете найти микроскопы с разной комплектацией и возможностями. Раздел представлен по ссылке.
4glaza.ru Использование материала полностью для общедоступной публикации на носителях информации и любых форматов запрещено. Разрешено упоминание статьи с активной ссылкой на сайт www.4glaza.ru. Производитель оставляет за собой право вносить любые изменения в стоимость, модельный ряд и технические характеристики или прекращать производство изделия без предварительного уведомления.
Другие обзоры и статьи о микроскопах, микропрепаратах и микромире:
|
принцип работы, преимущества, недостатки, виды микробиологических микроскопов
Если говорить о биологических исследованиях и изобретениях, то невозможно даже представить, что когда-то было время, когда не было микроскопов. Сегодня микробиологический микроскоп является неотъемлемой частью биологических наук, ведь даже невозможно представить, что было бы, если бы не был изобретен микроскоп. Что он из себя представляет и на чем основана его работа – мы с Вами сейчас и поговорим.
Сегодня микробиологический микроскоп является неотъемлемой частью биологических наук, ведь даже невозможно представить, что было бы, если бы не был изобретен микроскоп. Что он из себя представляет и на чем основана его работа – мы с Вами сейчас и поговорим.
Прибор с оптической системой, позволяющий получить изображение в увеличенном размере и детально рассмотреть все детали и особенности строения, которые увидеть невооруженным глазом человека вообще не является возможным, является биологический микроскоп. В зависимости от того, для чего микроскоп необходим и какая основная его цель, необходимо правильно выбрать его (бывают микроскопы, которые увеличивают предмет от 56 до 1350 раз).
Микроскоп световой биологический на сегодня является самым популярным и распространенным в учебных заведениях и активно применяется и используется не только в лабораториях медицинского назначения, но и лабораториях, занимающихся изучением биологических предметов.
Микроскоп для биологических исследований, независимо от модели и фирмы производителя, состоит из механической части и оптической. Что касается его оптической части, то она включает объектив, окуляр и осветитель. Объектив в микроскопе является одной из основных и важных деталей, ведь именно с его помощью можно рассмотреть и изучить любой объект в увеличенном размере. Количество линз в каждой модели отличается, что изменяет степень увеличения в каждом микроскопе, ведь если в микроскопе имеется объектив с большим увеличением, то в нем будет не менее 10 линз. Узнать и понять, сколько и какие объективы находятся в микроскопе, можно смело по названию (Х 40, Х 90 или Х 8).
Что касается его оптической части, то она включает объектив, окуляр и осветитель. Объектив в микроскопе является одной из основных и важных деталей, ведь именно с его помощью можно рассмотреть и изучить любой объект в увеличенном размере. Количество линз в каждой модели отличается, что изменяет степень увеличения в каждом микроскопе, ведь если в микроскопе имеется объектив с большим увеличением, то в нем будет не менее 10 линз. Узнать и понять, сколько и какие объективы находятся в микроскопе, можно смело по названию (Х 40, Х 90 или Х 8).
Микроскоп лабораторный биологический состоит из тубуса, окуляра, держателя тубуса, винт грубой наводки и микрометренный, зеркало, подставка, конденсор, диафрагма, предметный стол и револьвер с набором объективов. Если говорить о качестве объектива, то в таком случае стоит судить о его разрешающей способности. Человеческий глаз способен увидеть ту картинку, на которой две точки находятся на расстоянии не более 0.15 мм, иначе увидеть их будет невооруженным глазом невозможно. В микроскопе есть объективы, на которых указана разрешающая способность, то есть, то расстояние, которое можно увидеть между двумя точками: чем фронтальная линза тоньше, тем выше разрешающая способность микроскопа. С помощью окуляра и линзами с диафрагмой, которые в нем расположены, удается увидеть изображение объекта в увеличенном размере в десятки или сотни раз. Чтобы узнать, какое в общем увеличение дает тот или иной микроскоп, достаточно всего-навсего умножить показатель увеличения объектива на увеличение окуляра.
В микроскопе есть объективы, на которых указана разрешающая способность, то есть, то расстояние, которое можно увидеть между двумя точками: чем фронтальная линза тоньше, тем выше разрешающая способность микроскопа. С помощью окуляра и линзами с диафрагмой, которые в нем расположены, удается увидеть изображение объекта в увеличенном размере в десятки или сотни раз. Чтобы узнать, какое в общем увеличение дает тот или иной микроскоп, достаточно всего-навсего умножить показатель увеличения объектива на увеличение окуляра.
Для того, что объектив освещался пучком света, в микроскопе есть зеркало и конденсор с ирисовой диафрагмой, которая находится выше предметного столика. С помощью зеркала (прикреплено на штативе), которое с одной стороны плоское, а с другой вогнутое, удается направить пучок света через конденсор на объектив. Конденсор в микроскопе состоит из нескольких линз (2 — 3), заключенных в металлический тубус, движение которого с помощью винта способствует фокусировке или рассеиванию света, попадающего на объект от зеркала.
В медицинских микроскопах можно также изменять диаметр светового потока с помощью ирисовой диафрагмы, представленной тонкими металлическими пластинками, которая находится между зеркалом и конденсором. Под диафрагмой имеется кольцо со светофильтром, позволяющее путем передвижения его в горизонтальном положении уменьшать освещенность.
Микроскоп инвертированный биологический сегодня активно используется в биологии и применяется для изучения объекта с нижней стороны. Такого микроскоп имеет оптическую «перевернутую» конструкцию. В отличие от других микроскопов, в нем мнет покровного стекла, так как его роль отводится дну лабораторной посуды, с помощью которой проводится исследование. В данной модели микроскопа есть свои нюансы: объектив расположен под объектом исследования или наблюдения, а осветительная часть расположена выше него.
В зависимости от того, как инвертированный микроскоп работает, их делят на:
- микроскоп с ручным управлением
- микроскоп с моторизованным управлением
- смешанный микроскоп, в котором есть и ручное, и моторизированное управление.

Учитывая то, что исследовать зачастую приходится предметы разных размеров и формы, предметный столик имеет большие размеры, в отличие от стандартных классических биологических микроскопов. Для того, чтоб провести какое – либо действие с предметом, размещенном на нем, создается большое рабочее расстояние. В таких микроскопах очень большое значение имеет наличие микроманипулятора, который открывает широкие возможности для исследователя с образцом наблюдения.
Если сравнивать увеличение в инвертированном и обычном микроскопе, то инвертированные отличаются меньшим увеличением за счет того, что лабораторная посуда, в которой осуществляются исследования, имеет более толстые стенки, в отличие от покровного стекла.
Микроскопы для микробиологии сегодня в достаточном количестве и весьма разнообразны, поэтому выбрать их не так уж и просто. Их используют не только для изучения микроскопических биологических существ, но и для изучения всех процессов, происходящих в них.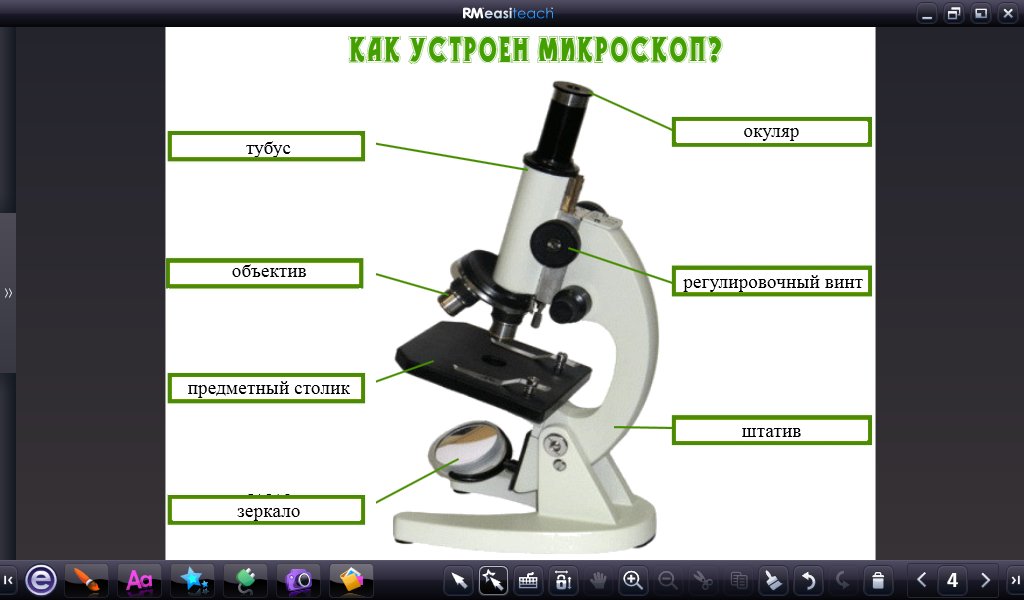 С помощью микроскопов для микробиологии сегодня становится доступным изучать, проводить исследования и анализ микробов с использованием проходящего света и с увеличением в 1000 крат. На сегодня есть возможность не только рассматривать в окуляр микробы, но и с помощью специального кабеля осуществлять это на экране монитора с сохранением для анализа.
С помощью микроскопов для микробиологии сегодня становится доступным изучать, проводить исследования и анализ микробов с использованием проходящего света и с увеличением в 1000 крат. На сегодня есть возможность не только рассматривать в окуляр микробы, но и с помощью специального кабеля осуществлять это на экране монитора с сохранением для анализа.
Теперь Вы знаете, на что нужно обращать внимание при работе с микробиологическим микроскопом, в чем его отличия от других и какие особенности. Надеемся, что наша статья была для Вас полезной и информативной.
Сводка недавних усовершенствований конструкции микроскопа
Пожалуй, не найдется ни одного из научных приборов, усовершенствованию которого было посвящено столько мыслей и усилий, сколько оптическому микроскопу. Источником развития оптических микроскопов в течение прошедших столетий всегда было стремление ученых наблюдать и исследовать все меньшие, трудно различимые явления, скрытые в тканях еще глубже,
чем когда-либо ранее (рисунок 1).
Рис. 1. Эпителиальные клетки легочной артерии быка
Пример изображений, формируемых современными усовершенствованными микроскопами, иллюстрирует рисунок 1. Представленное цветное флуоресцентное изображение клеток культуры ткани получено при помощи микроскопа Eclipse E600 с флюоритовым объективом CFI60 40X и новой цифровой камеры Nikon DXM 1200.
Столетие назад микроскоп достиг предела разрешающей способности, определяемой классической теорией природы света. Однако, для исследования внутриклеточных процессов в реальном времени, микроскопу требовалась не только разрешающая способность. Методики, которыми ранее владели высококлассные специалисты единичных лабораторий, сегодня превратились в простые, рутинные клинические процедуры. Внимательно прислушиваясь к мнениям микроскопистов, разработчики микроскопов осуществили гигантские нововведения. Настоящая статья предлагает краткую сводку недавних усовершенствований конструкции микроскопа, акцентируя внимание читателя на том, как новейшая оптическая система может способствовать научному прогрессу.
Конечные и бесконечные оптические системы
В те времена, когда биологические микроскопы были сравнительно простыми, до разработки эпифлуоресцентного и конфокального методов, не было необходимости устанавливать между объективом и окулярами микроскопа (в межлинзовом пространстве) мощные (и соответственно массивные) оптические компоненты. Для этой цели прекрасно подходил стандартный тубус длиной 160 мм или 170 мм, между установочным фланцем объектива и установочным отверстием окуляра. Световой поток такого микроскопа сходится в межлинзовом пространстве. Металлургам и геологам нужен поляризованный свет. Поэтому, до изобретения очень тонких пластинчатых поляризаторов, в упомянутом межлинзовом пространстве приходилось устанавливать массивные призмы и другие элементы. В 1930-х годах, один из производителей, пытаясь выйти за пределы стандартного тубуса, и измученный проблемами коррекции аберраций, вносимых призмами, создал первый вариант бесконечной оптической системы.
Термин «бесконечная» означает, что каждая линза объектива проецирует изображение в бесконечность, а не на некотором, конечном, расстоянии. Такая бесконечная оптическая система формирует между объективом и окулярами параллельный световой пучок. В этот параллельный световой пучок можно устанавливать сложные оптические элементы, не создавая оптические аберрации и не уменьшая рабочие расстояния объективов. Кроме того, такая система сохраняет парфокальность при смене объективов (рисунок 2). На рисунке 2 представлена принципиальная схема оптического пути CFI60. Бесконечная оптическая система состоит из объектива, собирающей тубусной линзы и линзы окуляра. В параллельный оптический путь между объективом и тубусной линзой можно устанавливать модули и компоненты, образующие полностью универсальную систему без дополнительных оптических элементов переноса. Аксиальное и латеральное местоположения точки изображения, равно как и юстировка объектива и тубусной линзы, остаются неизменными.
Рис. 2. Оптический путь CF1
60Разумеется, чтобы получить изображение, которое можно увидеть или зарегистрировать, световой пучок, вышедший из объектива «бесконечного» типа, необходимо снова сделать сходящимся при помощи тубусной линзы (или второго объектива), установленной между параллельным пучком и окулярами. Обычно, без ухудшения характеристик микроскопа, в этом пространстве можно установить два, и только в одном случае — три, основных компонента.
Сегодня стали возможными создание и установка компонентов, позволяющих достичь точно 1-кратного увеличения, что очень удобно при сравнении нескольких оптических методов, применительно к одному и тому же образцу. Например, в случае установки оптики для эпифлуоресценции и дифференциально-интерференционного контраста (ДИК), остается свободное пространство для третьего элемента — устройства изменения увеличения, обучающего модуля, многоканального узла для подключения двух видеокамер или промежуточного тубуса для использования с графическим планшетом при трассировке нейронов.
Годы тому назад конструкторы классических микроскопов могли позволить себе роскошь рассматривать объектив и окуляр, как одно целое в отношении коррекции аберраций линз, сферической и хроматической аберраций (продольных и поперечных), комы, астигматизма и кривизны поля изображения. Поперечная хроматическая аберрация (LCA), известная также как хроматическая разность (хроматизм) увеличения, представляет собой формирование в одной фокальной плоскости красного, зеленого и синего изображений разных (для каждого цвета) размеров.
Обычно, хроматическая аберрация очень трудно поддается исправлению, поэтому ее часто оставляли без исправления в объективе, с целью компенсации в окуляре. Выбор оптических стекол и компьютерных методов, имевших место еще несколько лет назад, был недостаточен для исправления хроматичекой аберрации непосредственно в объективе. Установка мощных компонентов в нескорректированный межлинзовый пучок могла только дополнительно нарушить оптическую компенсацию.
Даже сегодня не все производители достигли полной коррекции хроматической аберрации непосредственно в объективе. Новейшие стекла, разработанные компанией Nikon Inc. (Мелвилл, штат Нью-Йорк), обладают чрезвычайно низкой дисперсией, благодаря чему все аберрации корректируются непосредственно в объективе. Компания Nikon представила первые, полностью скорректированные объективы CF (без хроматической аберрации), в 1976 году. Эта новая технология получила дальнейшее развитие в объективах CFI60 (сфокусированный на бесконечность ахромат, с 60-мм парфокальной высотой плеча), тубусных линзах и окулярах (Nikon). Среди всех микроскопических элементов с тубусом «бесконечной» длины, только этот объединил в себе другие конструктивные изменения, необходимые для максимального использования преимуществ рассматриваемой концепции.
Новые линзы
Поскольку выходной пучок объектива необходимо сфокусировать в бесконечности, конструкция идеального объектива для бесконечной оптической системы микроскопа требует чего-то большего, чем обычный набор линз. Добавьте к этому требования флуоресцентных методов исследований, например, M-FISH (многоцветная флуоресцентная гибридизация in situ) (рисунок 3), которые основаны на получении максимально возможного количества фотоснимков и требуют объективов с высокой числовой апертурой (NA). Добавьте, также, требования конфокальных методик в отношении объективов с высокими значениями числовой апертуры и большими рабочими расстояниями, позволяющих проникать глубоко в толщу ткани. Чтобы удовлетворять всем перечисленным требованиям, современные объективы должны содержать линзы большого физического диаметра. Вместе взятые, эти требования делают прежние стандарты, регламентирующие размеры объективов, устаревшими. В качестве примера на рисунке 3 представлено цветное флуоресцентное изображение фибробласта, снятое на пленку через микроскоп Eclipse E800 с масляно-иммерсионным объективом CFI60 60X, NA = 1,4.
Добавьте к этому требования флуоресцентных методов исследований, например, M-FISH (многоцветная флуоресцентная гибридизация in situ) (рисунок 3), которые основаны на получении максимально возможного количества фотоснимков и требуют объективов с высокой числовой апертурой (NA). Добавьте, также, требования конфокальных методик в отношении объективов с высокими значениями числовой апертуры и большими рабочими расстояниями, позволяющих проникать глубоко в толщу ткани. Чтобы удовлетворять всем перечисленным требованиям, современные объективы должны содержать линзы большого физического диаметра. Вместе взятые, эти требования делают прежние стандарты, регламентирующие размеры объективов, устаревшими. В качестве примера на рисунке 3 представлено цветное флуоресцентное изображение фибробласта, снятое на пленку через микроскоп Eclipse E800 с масляно-иммерсионным объективом CFI60 60X, NA = 1,4.
Рис. 3. Флуоресцентная гибридизация in-situ
Стандарт, устанавливающий размер резьбовых соединений объективов, был принят Королевским микроскопическим обществом Великобритании в 1800-е годы. Принятый размер, будучи вполне приемлемым для латунных микроскопов того времени, стал серьезным ограничением в разработке и проектировании оптических систем. Кроме того, прежние промышленные стандарты парфокальной высоты плеча (расстояние от образца до установочного фланца объектива), перестали соответствовать сложности современных конструкций. Новый стандарт (компании Nikon) — 25-миллиметровый диаметр резьбового соединения и 60-миллиметровая парфокальная высота плеча позволяет применять новые линзы и предоставляет достаточное пространство для модификаций. Тубусная линза с фокусным расстоянием 200 мм позволяет использовать объективы с очень большим рабочим расстоянием в сочетании с высокой числовой апертурой (NA). Новые стандарты и тубусные линзы делают возможным получать произвольные рабочие расстояния для таких объективов.
Принятый размер, будучи вполне приемлемым для латунных микроскопов того времени, стал серьезным ограничением в разработке и проектировании оптических систем. Кроме того, прежние промышленные стандарты парфокальной высоты плеча (расстояние от образца до установочного фланца объектива), перестали соответствовать сложности современных конструкций. Новый стандарт (компании Nikon) — 25-миллиметровый диаметр резьбового соединения и 60-миллиметровая парфокальная высота плеча позволяет применять новые линзы и предоставляет достаточное пространство для модификаций. Тубусная линза с фокусным расстоянием 200 мм позволяет использовать объективы с очень большим рабочим расстоянием в сочетании с высокой числовой апертурой (NA). Новые стандарты и тубусные линзы делают возможным получать произвольные рабочие расстояния для таких объективов.
Объективы CFI60 обладают большей числовой апертурой, чем это доступно при стандартных увеличениях, что обеспечивает улучшенное разрешение деталей, а также повышенной светосилой и высокой производительностью в конфокальных микроскопах. Практически все объективы для микроскопов серии Eclipse имеют увеличенное рабочее расстояние. Это позволяет осуществлять фокусировку по всей толщине толстых образцов, без повреждения покровного стекла или объектива. Облегчается использование иммерсионного масла и смена образцов. Становится возможным использование камер с толстым дном, а также микроманипуляции с объективами более высокого увеличения.
Практически все объективы для микроскопов серии Eclipse имеют увеличенное рабочее расстояние. Это позволяет осуществлять фокусировку по всей толщине толстых образцов, без повреждения покровного стекла или объектива. Облегчается использование иммерсионного масла и смена образцов. Становится возможным использование камер с толстым дном, а также микроманипуляции с объективами более высокого увеличения.
В современных исследованиях внутриклеточных механизмов и динамической активности на счету каждый фотон флуоресцентного излучения. Для максимально эффективной регистрации таких фотонов требуются объективы с максимально возможной числовой апертурой. Масляно-иммерсионный объектив Plan Fluor наряду с 40-кратным увеличением и высокой числовой апертурой (1,30) формирует плоское поле, обеспечивает большое рабочее расстояние и обладает высоким пропусканием в ультрафиолетовой области спектра, оптимизированным для эффективного использования во флуоресцентных приложениях. Яркость изображения в эпископическом освещении для объективов с одинаковым увеличением пропорциональна четвертой степени числовой апертуры. Простой расчет показывает, что в сравнении со стандартным сухим объективом с числовой апертурой 0,65 и увеличением 40X, иммерсионный объектив с таким же увеличением и апертурой 1,30 дает в 16 раз более яркое изображение.
Простой расчет показывает, что в сравнении со стандартным сухим объективом с числовой апертурой 0,65 и увеличением 40X, иммерсионный объектив с таким же увеличением и апертурой 1,30 дает в 16 раз более яркое изображение.
Улучшение качества изображений, получаемых через сухие объективы с большими коэффициентами увеличения
Многие наблюдения ведутся при помощи стандартных неиммерсионных объективов с увеличением 40X, так называемых, объективов для сухой иммерсии. При таком увеличении объектив должен иметь достаточно высокую числовую апертуру, чтобы выявить все разнообразие деталей, которое должно выявлять 40-кратное увеличение. Наименьшая числовая апертура современных 40-кратных объективов равна 0,65. Даже при такой числовой апертуре оптические характеристики микроскопа начинают зависеть от одного оптического компонента, неподвластного контролю конструкторов и изготовителей объективов — покровного стекла на образце. Изготовители микроскопов рекомендуют использовать покровное стекло толщиной 0,17 мм.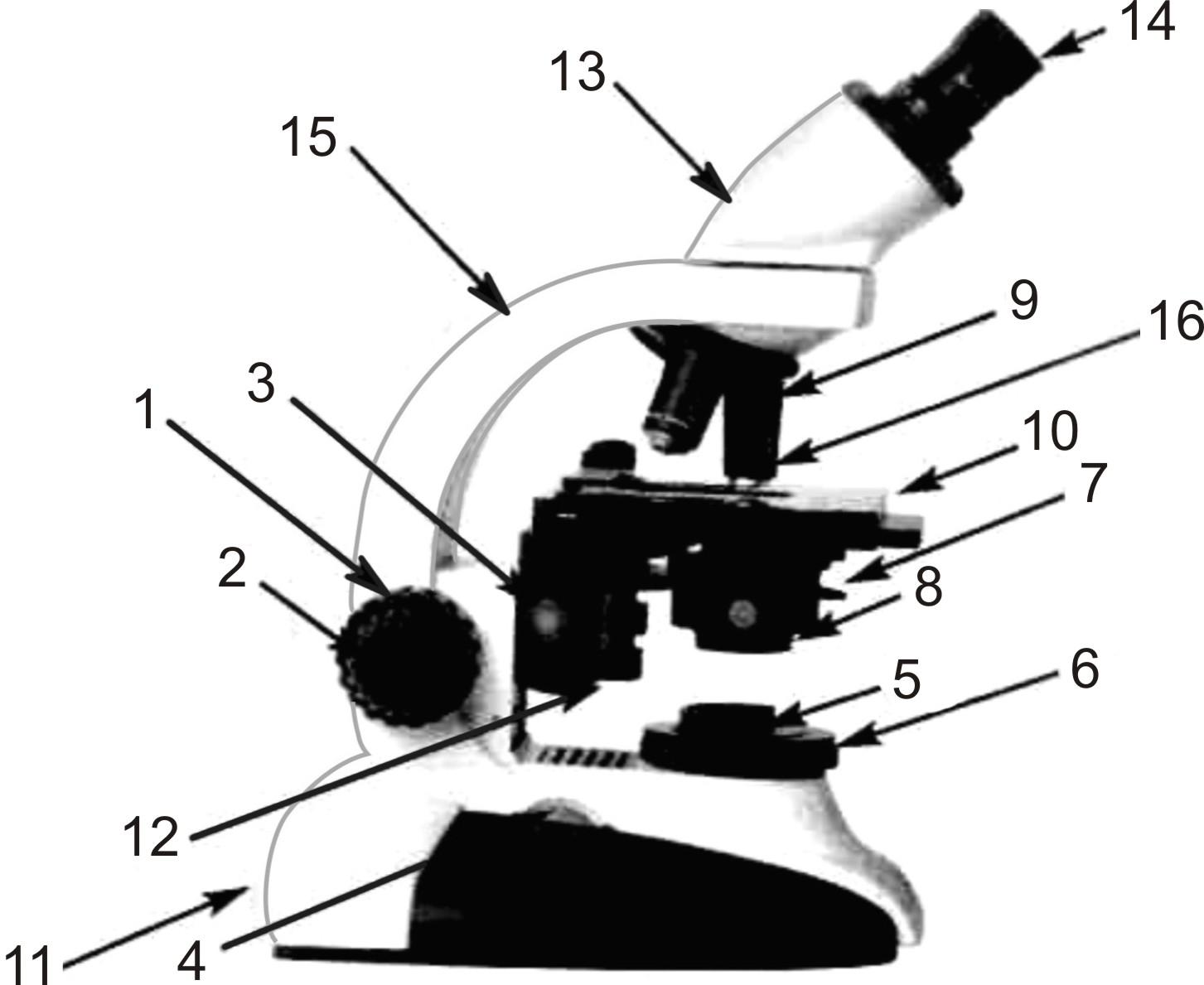 На корпусе объектива делается специальная гравировка (в терминологии поставщиков лабораторного оборудования эта толщина соответствует покровному стеклу № 1 и ½).
На корпусе объектива делается специальная гравировка (в терминологии поставщиков лабораторного оборудования эта толщина соответствует покровному стеклу № 1 и ½).
Многие образцы приготавливаются с покровными стеклами иной (и различной) толщины. Это несущественно для наблюдений при малых увеличениях, но при 40-кратном и большем увеличениях оказывает сильное влияние на изображение. С точки зрения изготовителей объективов, нестандартные покровные стекла нарушают коррекцию сферической аберрации объектива; с точки зрения пользователей, — изображение теряет контрастность и выглядит мутным.
Числовая апертура, равная 0,65 является обычной для стандартных объективов с увеличением 40X; высококачественные сухие объективы могут иметь апертуру, равную 0,95. Толщина покровного стекла негативно влияет и на этот показатель, поскольку на объектив необходимо устанавливать коррекционное кольцо. Для оптимизации качества изображения коррекционное кольцо необходимо поворачивать, одновременно наблюдая за изображением. Вращение коррекционного кольца изменяет расстояние между некоторыми внутренними компонентами объектива, а это, к сожалению, изменяет его эффективное фокусное расстояние. На практике, оператор должен одной рукой вращать кольцо, а второй — рукоятку тонкой фокусировки, настраивая микроскоп на максимально резкое изображение. Многие пользователи так никогда и не овладевают такой техникой. В патентованной конструкции высокоапертурных сухих объективов Nikon с высоким коэффициентом усиления минимизирован сдвиг фокусировки, что позволяет легче оптимизировать качество изображения. Для числовых апертур больше 0,95 предлагаются иммерсионные объективы.
Вращение коррекционного кольца изменяет расстояние между некоторыми внутренними компонентами объектива, а это, к сожалению, изменяет его эффективное фокусное расстояние. На практике, оператор должен одной рукой вращать кольцо, а второй — рукоятку тонкой фокусировки, настраивая микроскоп на максимально резкое изображение. Многие пользователи так никогда и не овладевают такой техникой. В патентованной конструкции высокоапертурных сухих объективов Nikon с высоким коэффициентом усиления минимизирован сдвиг фокусировки, что позволяет легче оптимизировать качество изображения. Для числовых апертур больше 0,95 предлагаются иммерсионные объективы.
Универсальные объективы
В перечне продукции каждого изготовителя объективов имеются объективы для наблюдений не только в обычном светлом поле, но и с использованием иных методов, например, фазового контраста, ДИК и флуоресценции. Для однократного использования нескольких методик исследователи вынуждены покупать по нескольку таких объективов с соответствующим увеличением. До настоящего времени было невозможно создать единый объектив для всех методик, без существенного ухудшения его характеристик. Объективы Plan Fluor DLL компании Nikon работают во всех четырех упомянутых режимах без ухудшения качества изображения. Эти объективы удобны, а также экономят деньги и место в револьверном держателе объективов.
До настоящего времени было невозможно создать единый объектив для всех методик, без существенного ухудшения его характеристик. Объективы Plan Fluor DLL компании Nikon работают во всех четырех упомянутых режимах без ухудшения качества изображения. Эти объективы удобны, а также экономят деньги и место в револьверном держателе объективов.
Объективы с минимальным увеличением
В повседневной жизни мы, обычно, сначала осматриваем объект вообще, и лишь затем концентрируемся на заинтересовавших нас деталях. В микроскопии начинают с малых увеличений, постепенно переходя к большим. Патологоанатомы, невропатологи и ботаники — одни из многих специалистов, которые часто используют малое увеличение для ориентации и буквально для «получения большой картинки». Однако, минимальное увеличение в микроскопах с объективами 10X и окулярами 10X составляет 100X — существенное отличие от натурального размера. Поскольку многие исследователи не хотят переходить на менее мощные окуляры, — наилучшим решением являются объективы с малым увеличением.
Рис. 4. Поле зрения при малых увеличениях
Объектив CFI60 0,5X позволяет вести наблюдение и съемку в широком поле зрения. Обладая полем зрения диаметром 50 мм, этот объектив удобен для макро-наблюдений больших образцов, например, тонкого среза ствола американской липы (см. рисунок 4). Площадь области изображения, формируемого этим объективом, более чем в пять раз превышает аналогичный параметр традиционной бесконечной оптической системой. Возможна съемка с истинным размером на 35 мм фотопленку.
Ведущие производители выпускают объективы с номинальным увеличением 4X, 2X и даже 1X. Объектив CFI Macroplan с увеличением 0,5X, со специальными приспособлениями дает в окулярах изображение с увеличением 5X, что позволяет получать на 35-миллиметровой фотопленке изображение в натуральную величину (с увеличением 1X) (см. рисунок 4). Этот объектив обеспечивает чрезвычайно высокий уровень детализации и хроматической коррекции, и до предела расширяет диапазон увеличения микроскопа.
Эргономичная конструкция
Микроскоп — это больше, чем просто оптическая система. Это лабораторный прибор, с которым ученый имеет самый тесный физический контакт. Приобретая прибор, за которым исследователь может проводить многие часы кряду, жизненно необходимо учитывать фактор физического комфорта. Это тот аспект, который невозможно просто взять и указать в листе технических параметров. Его необходимо прочувствовать на себе.
Во многих микроскопах предыдущих поколений (и даже в моделях совсем недавних лет), различные органы управления располагаются в местах, удобных изготовителю. Иногда это приводит к затруднениям и неудобствам. Сегодня ведущие производители учитывают эргономические аспекты в конструкции штативов, однако, в приборах серии Eclipse вопросы эргономики подняты на еще более высокий уровень. В конструкциях учтены результаты обширных исследований поз, в которых пользователи сидят за своими приборами, измерений удобных манипуляционных расстояний и определения удобных положений рук и головы. Рисунок 5(a) иллюстрирует расположение рукояток перемещения предметного столика и фокусировки микроскопа E800 в сравнении с традиционными микроскопами. Естественная поза и одинаковое расстояние кистей обеих рук от туловища снижают напряжение. Кроме того, рукоятки перемещения предметного столика и рукоятки фокусировки расположены таким образом, что ими можно управлять одной рукой, что повышает комфортность работы. Микроскопы многих моделей компании Nikon оснащаются прямыми и наклоняемыми окулярными тубусами, с изменяемым углом наклона (рисунок 5(b)), что повышает эффективность и комфортность работы за счет естественной позы оператора.
Рисунок 5(a) иллюстрирует расположение рукояток перемещения предметного столика и фокусировки микроскопа E800 в сравнении с традиционными микроскопами. Естественная поза и одинаковое расстояние кистей обеих рук от туловища снижают напряжение. Кроме того, рукоятки перемещения предметного столика и рукоятки фокусировки расположены таким образом, что ими можно управлять одной рукой, что повышает комфортность работы. Микроскопы многих моделей компании Nikon оснащаются прямыми и наклоняемыми окулярными тубусами, с изменяемым углом наклона (рисунок 5(b)), что повышает эффективность и комфортность работы за счет естественной позы оператора.
Рис. 5. Эргономическая конструкция микроскопа
Более того, в межлинзовом пространстве прежних конструкций не всегда удобно устанавливать дополнительные компоненты. В том случае, когда компоненты просто устанавливаются в ряд, как это делает большинство производителей, поверх которого располагается бинокулярная насадка, пользователь вынужден вытягивать шею, чтобы заглянуть в окуляры.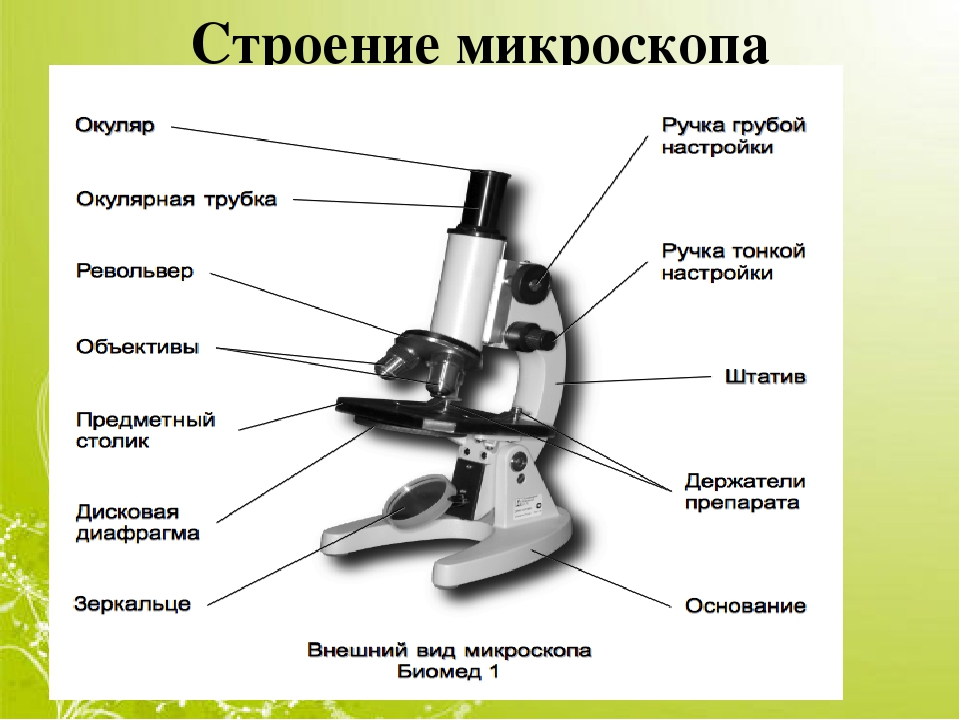 В межлинзовое пространство микроскопа Eclipse можно установить до трех компонентов, не изменяя постоянную и удобную для наблюдения позу оператора (высоту расположения глаз).
В межлинзовое пространство микроскопа Eclipse можно установить до трех компонентов, не изменяя постоянную и удобную для наблюдения позу оператора (высоту расположения глаз).
В штативах новых моделей наиболее часто использующиеся органы управления располагаются в местах, максимально удобных для оператора, независимо от сложности изготовления. Совместно использующиеся органы управления, например, рукоятки перемещения столика и тонкой фокусировки, располагаются так, чтобы ими можно было управлять пальцами одной руки. При комфортно опирающихся на стол предплечьях, наиболее часто использующиеся органы управления естественным образом попадают под кончики пальцев рук. Низкое расположение предметного столика делает удобной смену предметных стекол. Органы управления предметным столиком можно устанавливать как с правой, так и с левой стороны.
Среди других новшеств в конструкциях штативов следует отметить существенно улучшенную временнýю и температурную стабильность, что очень важно для продолжительных, например, митотических и эмбриологических исследований. Кроме того, улучшено демпфирование вибраций, что повышает качество получаемых изображений.
Кроме того, улучшено демпфирование вибраций, что повышает качество получаемых изображений.
Заключение
Означает ли все сказанное, что создан окончательный вариант оптического микроскопа? Несмотря на то, что современные измерительные приборы подняли микроскопию на весьма высокий уровень развития, мы, вероятно, никогда не будем удовлетворены результатами, достигнутыми в ходе научных исследований. Будущие задачи потребуют инноваций, которых мы сегодня не можем даже предвидеть. Однако, лучшие современные измерительные приборы обеспечивают несравнимо большую эффективность и универсальность, чем можно было себе представить еще несколько лет назад.
Введение в поляризационную микроскопию
Несмотря на довольно пренебрежительное отношение и недооценку в качестве исследовательского инструмента, поляризационная микроскопия не только обладает всеми преимуществами светлопольной микроскопии, но и предоставляет возможности для получения дополнительной информации, недоступной для других методов оптической микроскопии.
Рис. 1. Конфигурация поляризационного микроскопа
Помимо предоставления информации о цвете поглощения и границах раздела между минералами с различными показателями преломления, что доступно и в светлопольной микроскопии, поляризационная микроскопия позволяет различать изотропные и анизотропные материалы. В этой методике используются оптические свойства анизотропных сред, благодаря чему удается получить подробные сведения о структуре и составе материалов, что трудно переоценить в идентификационных и диагностических задачах.
Оптические свойства изотропных материалов, в состав которых входят газы, жидкости, ненапряженные стекла и кубические кристаллы, одинаковы по всем направлениям. Коэффициент преломления в каждом из них одинаков по всем направлениям, благодаря чему для них отсутствуют ограничения на направление распространения колебаний волн проходящего света. Напротив, оптические свойства анизотропных материалов, каковыми являются 90% всех твердых веществ, зависят от взаимной ориентации падающего света и кристаллографических осей. Такие вещества характеризуются рядом показателей преломления, в зависимости от направления распространения света в них и от координат плоскости колебаний. Но, что еще более важно, анизотропные материалы работают, как светоделители и расщепляют световой луч на две составляющие (см. рисунок 1). Для получения информации об этих материалах, в поляризационной микроскопии используется интерференция упомянутых составляющих расщепленного светового потока при их воссоединении в той же оптической системе.
Такие вещества характеризуются рядом показателей преломления, в зависимости от направления распространения света в них и от координат плоскости колебаний. Но, что еще более важно, анизотропные материалы работают, как светоделители и расщепляют световой луч на две составляющие (см. рисунок 1). Для получения информации об этих материалах, в поляризационной микроскопии используется интерференция упомянутых составляющих расщепленного светового потока при их воссоединении в той же оптической системе.
Наибольшую известность микроскопия в поляризованном свете получила благодаря своему применению в геологии, главным образом, для изучения минералов в тонких шлифах горных пород. Тем не менее, она с успехом может применяться и для изучения многих других материалов. К таким материалам можно отнести очищенные, извлеченные или изготовленные природные и промышленные минералы, композиты, например, цемент, керамику, минеральные волокна и полимеры, а также кристаллические структуры или высокоупорядоченные биологические молекулы, например, ДНК, крахмала, древесины и мочевины. Поляризационную микроскопию можно использовать в качественных и количественных исследованиях, благодаря чему она является прекрасным инструментом в сфере материаловедения, геологии, химии, биологии, металлургии и даже медицины.
Поляризационную микроскопию можно использовать в качественных и количественных исследованиях, благодаря чему она является прекрасным инструментом в сфере материаловедения, геологии, химии, биологии, металлургии и даже медицины.
Рис. 2. Коноскопические интерференционные картины
Несмотря на то, что понимание аналитических методов поляризационной микроскопии, возможно, более требовательно, чем для других видов, ее следует использовать хотя бы для получения более точной информации, чем это можно сделать по методу светлого поля. Кроме того, знание принципов поляризационной микроскопии абсолютно необходимо для правильного понимания микроскопии по методу дифференциально-интерференционного контраста (ДИК).
Поляризованный свет
Согласно волновой модели света колебания его электрической и магнитной составляющей происходят под прямыми углами к направлению распространения и равновероятно по всем направлениям. Это «обычный» свет. В случае плоскополяризованного света существует только одно направление колебаний (рисунок 1). Система «глаза — мозг» человека нечувствительна к направлению световых колебаний. Поэтому, плоская поляризация света может восприниматься человеком в виде неких изменений интенсивности или цвета, например, как уменьшение яркости (блеска) при наблюдении через поляризованные солнцезащитные очки.
В случае плоскополяризованного света существует только одно направление колебаний (рисунок 1). Система «глаза — мозг» человека нечувствительна к направлению световых колебаний. Поэтому, плоская поляризация света может восприниматься человеком в виде неких изменений интенсивности или цвета, например, как уменьшение яркости (блеска) при наблюдении через поляризованные солнцезащитные очки.
Наиболее распространенным поляризатором является пленка PolaroidTM. Изобретенная Лэндом (Land) в 1932 году, эта пленка состоит из длинных полимерных цепей. Пленка обрабатывается светопоглощающими красителями и растягивается так, что ее полимерные цепи выстраиваются в одном направлении. Световые волны с колебаниями, параллельными полимерным цепям, поглощаются, а с перпендикулярными — пропускаются.
В поляризационном микроскопе имеются два поляризационных фильтра — поляризатор и анализатор (см. рисунок 1). Поляризатор располагается под столиком с образцом. Как правило, разрешенное направление колебаний в поляризаторе фиксировано в направлении слева направо (восток-запад), хотя, обычно, поляризатор можно поворачивать на 360 градусов.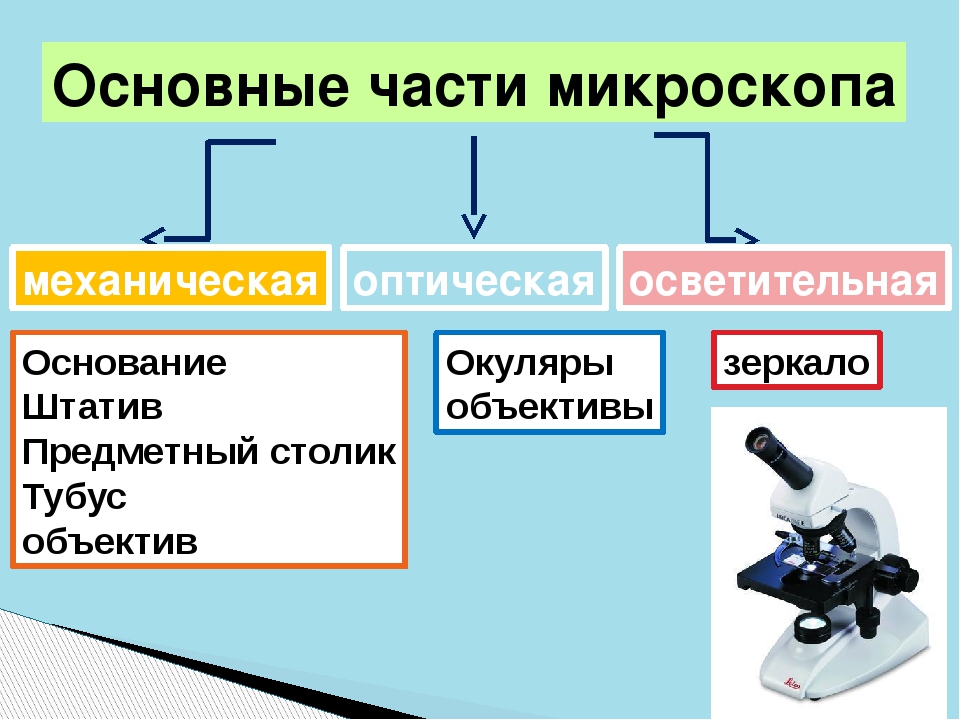 В анализаторе, который располагается над объективами и, при необходимости, может извлекаться из оптической системы, ось разрешенных колебаний проходит обычно, в направлении «север-юг», но в некоторых микроскопах также может поворачиваться. В оптической системе микроскопа анализатор и поляризатор устанавливаются так, что их разрешенные направления колебаний перпендикулярны друг другу. При таком взаимном расположении поляризатора и анализатора свет не проходит через систему, и в окулярах микроскопа наблюдается темное поле зрения.
В анализаторе, который располагается над объективами и, при необходимости, может извлекаться из оптической системы, ось разрешенных колебаний проходит обычно, в направлении «север-юг», но в некоторых микроскопах также может поворачиваться. В оптической системе микроскопа анализатор и поляризатор устанавливаются так, что их разрешенные направления колебаний перпендикулярны друг другу. При таком взаимном расположении поляризатора и анализатора свет не проходит через систему, и в окулярах микроскопа наблюдается темное поле зрения.
Поляризатор и анализатор являются неотъемлемыми элементами поляризационного микроскопа, однако, вдобавок к ним желательно иметь следующие компоненты:
- Поворотный предметный столик — для облегчения ориентации и центрирования объективов и предметного столика относительно оптической оси микроскопа, с тем, чтобы центр вращения совпадал с полем зрения.
- Ненапряженные объективы — в поляризованном свете напряжение может вызывать оптические эффекты, усложняющие наблюдение.

Линза Бертрана — для облегчения контроля задней фокальной плоскости объектива, с целью точной регулировки апертурной диафрагмы осветителя и наблюдения интерференционных фигур (см. рисунок 2).
Гнездо для установки компенсаторов/компенсационных пластин между поляризатором и анализатором, для увеличения разности оптических путей в образце. В большинстве современных микроскопов это гнездо находится в револьверном держателе объективов микроскопа или в промежуточном тубусе, расположенном между корпусом и окулярными тубусами. Таким образом, установленные в это гнездо компенсационные пластины располагаются между образцом и анализатором.
Для поляризационной микроскопии используется как отраженный, так и проходящий свет. Отраженный свет удобен для изучения непрозрачных материалов, таких, как оксиды и сульфиды минералов, металлы и кремниевые пластины (рисунок 3). Техника отраженного света требует специального набора объективов, нескорректированных для наблюдения через покровное стекло, а объективы, предназначенные для работы в поляризованном свете, должны быть, к тому же, свободны от напряжений.
Отраженный свет удобен для изучения непрозрачных материалов, таких, как оксиды и сульфиды минералов, металлы и кремниевые пластины (рисунок 3). Техника отраженного света требует специального набора объективов, нескорректированных для наблюдения через покровное стекло, а объективы, предназначенные для работы в поляризованном свете, должны быть, к тому же, свободны от напряжений.
Рис. 3. Поляризационная микроскопия в отраженном свете
На рисунке 3 представлен ряд микрофотографий типичных образцов, полученных с использованием описываемой методики в отраженном поляризованном свете. Слева (рисунок 3(a)) представлено цифровое изображение поверхностных деталей микропроцессорной ИС. На снимке, представляющем фрагмент АЛУ микропроцессора, ясно видны элементы двойного лучепреломления, использованные при изготовлении кристалла. Представленная на рисунке 3(b) полированная поверхность керамической сверхпроводящей ленты (иттрий-1,2,3) демонстрирует кристаллические области двойного лучепреломления с интерференционными цветами, разбросанными в кристаллической решетке изотропного связующего слоя. В отраженном поляризованном свете видны, также, тонкие металлические пленки. Рисунок 3© иллюстрирует пузыри, образующие дефекты в сплошной (в других отношениях) тонкой медной пленке (толщиной около 0,1 мкм), лежащей между слоями подложки из хлорида никеля/натрия, и образующей вместе с этими слоями металлическую сверхструктуру.
В отраженном поляризованном свете видны, также, тонкие металлические пленки. Рисунок 3© иллюстрирует пузыри, образующие дефекты в сплошной (в других отношениях) тонкой медной пленке (толщиной около 0,1 мкм), лежащей между слоями подложки из хлорида никеля/натрия, и образующей вместе с этими слоями металлическую сверхструктуру.
Для получения хороших результатов необходимо тщательно подготовить образец. Выбранный метод зависит от типа исследуемого материала. В геологических исследованиях стандартная толщина тонких шлифов горных пород составляет 25–30 микрометров. Образцы должны быть отшлифованы на шаржированном алмазом шлифовальном круге, а затем вручную доведены до нужной толщины с использованием абразивных порошков, при постепенном уменьшении их зернистости. Образцы из более мягких материалов можно готовить аналогично биологическим образцам, используя микротом. Для наблюдений в проходящем свете используются срезы толщиной от одного до 40 микрометров. Срезы должны быть ненапряженными и не иметь следов режущего инструмента. Образец помещается между предметным и покровным стеклом, с использованием заливочной среды, состав которой определяется химической и физической природой образца. Последнее особенно важно при изучении синтетических полимеров, поскольку некоторые среды могут вступать в реакцию с исследуемым материалом, вызывая в нем структурные изменения.
Образец помещается между предметным и покровным стеклом, с использованием заливочной среды, состав которой определяется химической и физической природой образца. Последнее особенно важно при изучении синтетических полимеров, поскольку некоторые среды могут вступать в реакцию с исследуемым материалом, вызывая в нем структурные изменения.
Использование анизотропии
Плоскополяризованный свет позволяет получать информацию различных уровней (без анализатора в оптической системе) или с перекрестными поляризаторами (с анализатором в оптической системе). Наблюдения в плоскополяризованном свете позволяют выявить детали оптического рельефа образца, проявляющиеся в виде «различимости» границ; эта «различимость» возрастает при увеличении показателя преломления вокруг упомянутых деталей. Степень рассеяния света, при выходе из неровной поверхности образца, определяется разностью в показателях преломления монтажного клея и образца. Горельефные образцы, которые выглядят выступающими из изображения, обладают показателями преломления, существенно отличающимися от показателя преломления клея (гистологической среды). Показатели преломления материалов, (для которых эти показатели неизвестны), определяются с помощью иммерсионной рефрактометрии, путем сравнения с известными показателями преломления масел.
Показатели преломления материалов, (для которых эти показатели неизвестны), определяются с помощью иммерсионной рефрактометрии, путем сравнения с известными показателями преломления масел.
Исследование прозрачных или полупрозрачных материалов в плоскополяризованном свете аналогично наблюдению при естественном освещении, пока образец не поворачивается вокруг оптической оси микроскопа. При вращении можно видеть изменения яркости и/или цвета исследуемого материала. Такой плеохроизм, т. е., изменение цвета поглощения с изменением направления колебаний световых волн, зависит от ориентации материала на пути прохождения света и свойствен только анизотропным материалам. Примером материала, проявляющего плеохроизм, является крокидолит, более известный, как голубой (синий) асбест. Эффект плеохроизма помогает выявлять упомянутый материал.
Рис. 4. Цветовая шкала интерференционных цветов Майкла-Леви
Поляризационные цвета возникают в результате интерференции двух составляющих, на которые свет разделяется анизотропным образцом. Эти составляющие могут рассматриваться, как белый свет за вычетом деструктивно интерферировавших (уничтоженных) цветов. Рисунок 2 иллюстрирует коноскопические изображения одноосного и двуосного кристаллов, наблюдаемые в задней фокальной плоскости объектива. Интерференционные картины формируются лучами света, проходящими вдоль разных осей наблюдаемого кристалла. Одноосные кристаллы (рисунки 2(a) и 2(b)) демонстрируют интерференционную картину, состоящую из двух пересекающихся черных полос (изогир) в виде мальтийского креста. При освещении образцов двойного лучепреломления белым (поляризованным) светом формируется круговое распределение интерференционных цветов (рисунок 2). Внутренние круги (изохромы) состоят из расположенных в порядке возрастания цветов низшего порядка (см. цветовую шкалу интерференционных цветов Майкла-Леви, рисунок 4). Общий центр черного креста и изохром называется «мелатоп», и обозначает источник световых лучей, проходящих вдоль оптической оси кристалла. Двуосные кристаллы демонстрируют два мелатопа (рисунок 2©) и намного более сложную картину интерференционных колец.
Эти составляющие могут рассматриваться, как белый свет за вычетом деструктивно интерферировавших (уничтоженных) цветов. Рисунок 2 иллюстрирует коноскопические изображения одноосного и двуосного кристаллов, наблюдаемые в задней фокальной плоскости объектива. Интерференционные картины формируются лучами света, проходящими вдоль разных осей наблюдаемого кристалла. Одноосные кристаллы (рисунки 2(a) и 2(b)) демонстрируют интерференционную картину, состоящую из двух пересекающихся черных полос (изогир) в виде мальтийского креста. При освещении образцов двойного лучепреломления белым (поляризованным) светом формируется круговое распределение интерференционных цветов (рисунок 2). Внутренние круги (изохромы) состоят из расположенных в порядке возрастания цветов низшего порядка (см. цветовую шкалу интерференционных цветов Майкла-Леви, рисунок 4). Общий центр черного креста и изохром называется «мелатоп», и обозначает источник световых лучей, проходящих вдоль оптической оси кристалла. Двуосные кристаллы демонстрируют два мелатопа (рисунок 2©) и намного более сложную картину интерференционных колец.
Две составляющие светового потока проходят через образец с разными скоростями и испытывают различные степени преломления. Двойное лучепреломление — это численная разница между упомянутыми степенями (углами) преломления. Более быстрый луч первым выходит из образца, вследствие разности оптических путей (OPD), которую можно рассматривать в качестве «выигрышной разницы» в отношении более медленного луча. Анализатор воссоединяет только те компоненты двух лучей, которые распространяются в одном и том же направлении и с волновыми колебаниями в одной и той же плоскости. Для достижения максимального контраста, конструкция поляризатора обеспечивает одинаковую амплитуду двух лучей на момент их воссоединения.
В зависимости от разности оптических путей в образце и от длины волны света, в анализаторе возникает усиливающая и ослабляющая интерференция, что можно определить по порядку поляризационного цвета (цветов). Это явление обусловлено свойствами образца, включая толщину, разность показателей преломления и двойное лучепреломление для двух лучей, максимальное значение которого зависит от образца и от направления распространения света в нем. Разность оптических путей можно использовать для извлечения из образца полезной информации о «наклоне».
Разность оптических путей можно использовать для извлечения из образца полезной информации о «наклоне».
Информация, наложенная на цвет поляризации представляет собой элемент интенсивности. При повороте образца относительно поляризаторов интенсивность поляризационных цветов изменяется циклически — от нуля (гашение) до максимума после поворота на 45 градусов, и снова до нуля — после поворота на 90 градусов. Именно поэтому вращающийся предметный столик и центрирование являются критичными факторами для поляризационного микроскопа. Центрирование объектива и предметного столика обеспечивает совпадение оси вращения последнего с центром поля наблюдения — серьезный аспект обеспечения нормальной работы, что хорошо известно тем, кто пытался обходиться без такого центрирования.
Всякий раз, когда образец находится в положении ослабления (гашения), разрешенные направления колебаний проходящих световых волн параллельны разрешенным направлениям колебаний в поляризаторе или анализаторе. Эти направления связаны с геометрическими свойствами образца, такими, как длина волокон, направление экструзии пленки и грани кристаллов. Использование скрещенных поляризаторов позволяет легко отличать изотропные материалы от анизотропных, поскольку при повороте предметного столика на 360 градусов они постоянно находятся в положении интерференционного ослабления (остаются темными).
Эти направления связаны с геометрическими свойствами образца, такими, как длина волокон, направление экструзии пленки и грани кристаллов. Использование скрещенных поляризаторов позволяет легко отличать изотропные материалы от анизотропных, поскольку при повороте предметного столика на 360 градусов они постоянно находятся в положении интерференционного ослабления (остаются темными).
Для облегчения идентификации быстрых и медленных лучей, или для повышения контрастности, — в случае поляризационных цветов низшего порядка, например, темно-серого, в оптическую систему можно устанавливать вспомогательные пластины. Такие пластины изменяют цвета образца, интерпретировать которые позволяет шкала поляризационных цветов (таблица Майкла-Леви, рисунок 4). Такие таблицы показывают поляризационные цвета для значений разности оптических путей в диапазоне от 0 нм до 1800–3100 нм, наряду со значениями двойного лучепреломления и толщины. Волновая пластина создает собственную разность оптических путей. Когда свет проходит сначала через образец, а затем — через вспомогательную пластину, разности оптических путей пластины и образца либо складываются, либо вычитаются одна из другой, и вычисляются значения «выигрышной разницы» двух последовательных проходов. В том случае, когда направление колебаний медленного луча в образце и вспомогательной пластине совпадают, разности оптических путей складываются, когда же направление колебаний быстрого луча в образце совпадает с направлением колебаний медленного луча во вспомогательной пластине — вычитаются. Если направления колебаний медленного и быстрого лучей во вспомогательной пластине известны (обычно, указываются на оправах пластин промышленного изготовления), то можно определить соответствующие направления и в образце. Поскольку эти направления являются характеристическими для различных сред, их стоит определить, чтобы использовать для изучения ориентации и напряжения.
Когда свет проходит сначала через образец, а затем — через вспомогательную пластину, разности оптических путей пластины и образца либо складываются, либо вычитаются одна из другой, и вычисляются значения «выигрышной разницы» двух последовательных проходов. В том случае, когда направление колебаний медленного луча в образце и вспомогательной пластине совпадают, разности оптических путей складываются, когда же направление колебаний быстрого луча в образце совпадает с направлением колебаний медленного луча во вспомогательной пластине — вычитаются. Если направления колебаний медленного и быстрого лучей во вспомогательной пластине известны (обычно, указываются на оправах пластин промышленного изготовления), то можно определить соответствующие направления и в образце. Поскольку эти направления являются характеристическими для различных сред, их стоит определить, чтобы использовать для изучения ориентации и напряжения.
Рис. 5. Волокна хризотилового асбеста в поляризованном свете
Сильные стороны поляризационной микроскопии лучше всего проиллюстрировать на примере конкретных исследований и сопутствующих снимков. Все, приведенные в настоящем разделе изображения были получены с помощью сконструированного специально для научно-аналитических исследований микроскопа Nikon Eclipse E600, оборудованного для поляризационной микроскопии.
Все, приведенные в настоящем разделе изображения были получены с помощью сконструированного специально для научно-аналитических исследований микроскопа Nikon Eclipse E600, оборудованного для поляризационной микроскопии.
Идентификация асбестовых волокон
Асбест — это видовое обозначение группы природных минеральных волокон, широко использующихся, например, для изготовления изоляционных материалов, тормозных колодок и армирования бетона. При вдыхании асбестовые волокна опасны для здоровья, поэтому, важно уметь легко обнаруживать их в окружающей среде. Обычно, образцы исследуются при помощи сканирующей электронной микроскопии и рентгеновского микроанализа, однако, поляризационная микроскопия представляет более быструю и простую альтернативу, которую можно использовать для отличия асбестовых волокон от прочих, а также для определения типа асбеста — хризотила, крокидолита и амозита. С точки зрения охраны здоровья, считается, что разновидности амфибольного асбеста (крокидолит и амозит) более опасны, чем серпентин и хризотил.
Плоскополяризованный свет предоставляет информацию об общей морфологии волокна, о его цвете, плеохроизме (многоцветности) и показателе преломления. Вращение в плоскополяризованном свете не влияет на вид стеклянных волокон, тогда как волокна асбеста проявляют некоторый плеохроизм. В плоскополяризованном свете элементарные волокна хризотилового асбеста могут выглядеть изогнутыми, как завитые или поврежденные волосы, а волокна крокидолита и амозита выглядят прямыми или слегка изогнутыми. Хризотил имеет показатель преломления около 1,550, амозит — 1,692 и крокидолит — 1,695.
Используя скрещенные поляризаторы можно дедуктивным методом определить разрешенное направление колебаний световых волн при прохождении через образец, а при помощи полноволновой пластины — направления колебаний быстрой и медленной составляющей светового луча (рисунок 5). При скрещенных поляризаторах хризотил проявляет бледные интерференционные цвета — белые низшего порядка (рисунок 5(a)). При добавлении полноволновой пластины (530–560 нанометров) цвета изменяются. При ориентации в направлении «северо-восток — юго-запад», полноволновая пластина является аддитивной, и окрашивает волокна в синий и желтый цвета (рисунок 5(b)). В ориентации «северо-запад — юго-восток» (рисунок 5©) пластина является вычитающей, и дает светло-желтую окраску волокон, без синего цвета. Исходя из вышесказанного, можно определить, что направление колебаний медленного луча параллельно продольной (длинной) оси волокна. Амозит в этом отношении аналогичен хризотилу.
При добавлении полноволновой пластины (530–560 нанометров) цвета изменяются. При ориентации в направлении «северо-восток — юго-запад», полноволновая пластина является аддитивной, и окрашивает волокна в синий и желтый цвета (рисунок 5(b)). В ориентации «северо-запад — юго-восток» (рисунок 5©) пластина является вычитающей, и дает светло-желтую окраску волокон, без синего цвета. Исходя из вышесказанного, можно определить, что направление колебаний медленного луча параллельно продольной (длинной) оси волокна. Амозит в этом отношении аналогичен хризотилу.
Рис. 6. Тонкий шлиф филлита в поляризованном свете
Крокидолит демонстрирует синие тона, плеохроизм и густые коричневые поляризационные цвета. Направление колебаний быстрого луча параллельно продольной оси. Итак, идентификация трех типов асбестовых волокон зависит от их формы, показателей преломления, плеохроизма, двойного лучепреломления, а также от направлений колебаний быстрого и медленного лучей.
Биологический микроскоп это
Дата публикации: 20.03.2018 09:35
Биологический микроскоп − это оптический прибор, с помощью которого можно получить увеличенное обратное изображение изучаемого объекта и рассмотреть мелкие детали его строения, размеры которых лежат далеко за пределами разрешающей способности глаза. Устройство и эксплуатация оптического микроскопа довольно просты. Однако неумелое или невнимательное пользование этим прибором влечет за собой его порчу. Поэтому необходимо хорошо усвоить, из каких частей состоит микроскоп и их назначение. Следует строго соблюдать правила работы с микроскопом.
Возьмите микроскоп, найдите все перечисленные ниже части и запомните их название, назначение и устройство.
В микроскопе выделяют две системы: оптическую и механическую. К оптической системе относят объективы, окуляры и осветительное устройство.
Объектив − одна их важнейших частей микроскопа, поскольку он определяет полезное увеличение объекта. Объектив состоит из металлического цилиндра с вмонтированными в него линзами, число которых может быть различным. В верхней части объектива имеется винтовая нарезка, с помощью которой его ввинчивают в гнездо револьвера. Увеличение объектива обозначено на нем цифрами. В учебных целях используются обычно объективы ×8 и ×40. Следует всегда помнить о необходимости бережного отношения с объективами. Особой аккуратности требует работа с объективами большого увеличения, поскольку у них рабочее расстояние, т. е. расстояние от покровного стекла до фронтальной линзы, измеряется десятыми долями миллиметра.
Объектив состоит из металлического цилиндра с вмонтированными в него линзами, число которых может быть различным. В верхней части объектива имеется винтовая нарезка, с помощью которой его ввинчивают в гнездо револьвера. Увеличение объектива обозначено на нем цифрами. В учебных целях используются обычно объективы ×8 и ×40. Следует всегда помнить о необходимости бережного отношения с объективами. Особой аккуратности требует работа с объективами большого увеличения, поскольку у них рабочее расстояние, т. е. расстояние от покровного стекла до фронтальной линзы, измеряется десятыми долями миллиметра.
Качество изображения, особенно при объективах большого увеличения, зависит также от толщины предметного и покровного стекол.
Окуляр состоит из 2 – 3 линз, вмонтированных в металлический цилиндр. Увеличение окуляров обозначено на них цифрами: ×7, ×10, ×15. Для определения общего увеличения микроскопа следует умножить увеличение объектива на увеличение окуляра.
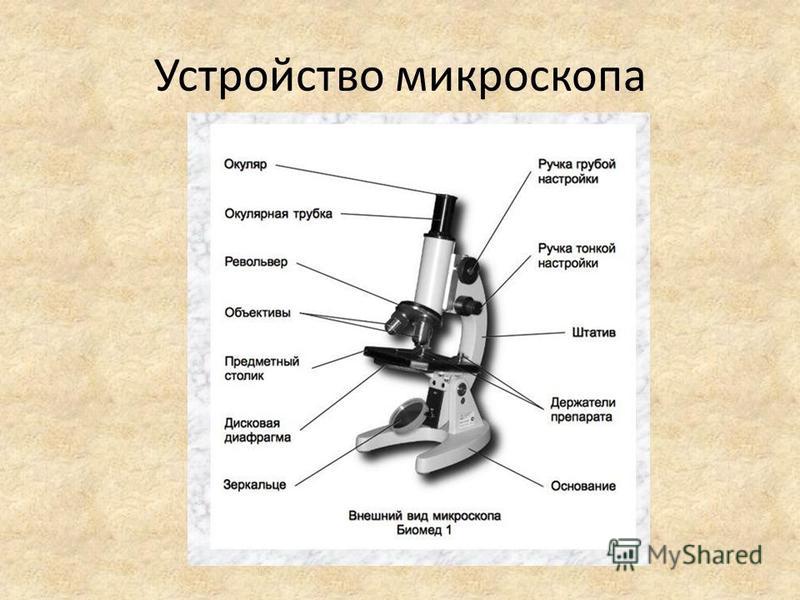
Осветительное устройство состоит из зеркала и конденсора с ирисовой диафрагмой, расположенных под предметным столиком. Оно предназначено для освещения объекта пучком света. Зеркало служит для направления света через конденсор и отверстие предметного столика. Оно имеет две поверхности: плоскую и вогнутую. При работе с рассеянным светом обычно используют вогнутое зеркало. Конденсор состоит из 2 – 3 линз, вставленных в металлическую оправу. При подъеме или опускании его с помощью специального винта соответственно конденсируется или рассеивается свет, падающий от зеркала на объект. Ирисовая диафрагма расположена между зеркалом и конденсором. Она служит для изменения диаметра светового потока, направляемого зеркалом через конденсор на объект в соответствии с диаметром фронтальной линзы объектива, и состоит из тонких металлических пластинок. С помощью рычажка их можно то соединить, полностью закрывая нижнюю линзу конденсора, то развести, увеличивая поток света. Кольцо с матовым стеклом или светофильтром уменьшает освещенность объекта. Оно расположено под диафрагмой и передвигается в горизонтальной плоскости.
Оно предназначено для освещения объекта пучком света. Зеркало служит для направления света через конденсор и отверстие предметного столика. Оно имеет две поверхности: плоскую и вогнутую. При работе с рассеянным светом обычно используют вогнутое зеркало. Конденсор состоит из 2 – 3 линз, вставленных в металлическую оправу. При подъеме или опускании его с помощью специального винта соответственно конденсируется или рассеивается свет, падающий от зеркала на объект. Ирисовая диафрагма расположена между зеркалом и конденсором. Она служит для изменения диаметра светового потока, направляемого зеркалом через конденсор на объект в соответствии с диаметром фронтальной линзы объектива, и состоит из тонких металлических пластинок. С помощью рычажка их можно то соединить, полностью закрывая нижнюю линзу конденсора, то развести, увеличивая поток света. Кольцо с матовым стеклом или светофильтром уменьшает освещенность объекта. Оно расположено под диафрагмой и передвигается в горизонтальной плоскости.
Механическая система микроскопа состоит из подставки, коробки с микрометренным механизмом и микрометренным винтом, тубусодержателя, винта грубой наводки, кронштейна конденсора, револьвера, предметного столика.
Микрометренный винт (или микровинт) служит для незначительного перемещения тубусодержателя, а, следовательно, и объектива на расстояния, измеряемые микрометрами. Полный оборот микрометренного винта передвигает тубусодержатель на 100 мкм, а поворот на одно деление опускает или поднимает тубусодержатель на 2 мкм. Во избежание порчи микрометренного механизма микровинт разрешается вращать в одну сторону не более чем на пол-оборота.
Тубус − цилиндр, в который сверху вставляют окуляры. Тубус подвижно соединен с головкой тубусодержателя, его фиксируют стопорным винтом в определенном положении; ослабив стопорный винт, тубус можно повернуть или снять.
Револьвер предназначен для смены объективов, которые ввинчены в его гнезда. Центрированное положение объектива обеспечивает защелка, расположенная внутри револьвера.
Винт грубой наводки (или макровинт) используют для значительного перемещения тубусодержателя, а, следовательно, и объектива с целью фокусировки объекта при малом увеличении.
Предметный столик предназначен для расположения на нем препарата. В середине столика имеется круглое отверстие, в которое входит фронтальная линза конденсора. У МБР-1 предметный столик круглый, на нем лежит подвижный диск. По сторонам столика расположены два винта, с помощью которых производят центрирование диска вращением его вокруг оси и передвижением по двум взаимно перпендикулярным направлениям. Если столик отцентрирован, диск закрепляется стопорным винтом.
Правила работы. При работе с микроскопом соблюдаются следующие правила и последовательность операций.
- Ставят микроскоп у края стола так, чтобы окуляр находился против левого глаза, и в течение работы его не передвигают. Тетрадь и все предметы, необходимые для работы, располагают слева от микроскопа.
- Открывают полностью диафрагму, поднимают конденсор в крайнее верхнее положение, чтобы его фронтальная линза была расположена вровень с предметным столиком.
 Если столик не отцентрирован, его передвигают с помощью винтов так, чтобы линза конденсора находилась в центре отверстия столика. (У микроскопов с квадратным неподвижным столиком эта операция не проводится − у них столик отцентрирован фабрично и постоянно находится в центральном положении).
Если столик не отцентрирован, его передвигают с помощью винтов так, чтобы линза конденсора находилась в центре отверстия столика. (У микроскопов с квадратным неподвижным столиком эта операция не проводится − у них столик отцентрирован фабрично и постоянно находится в центральном положении). - Ставят объектив ×8 в рабочее положение − на расстояние примерно 1 см от предметного столика. Работу с микроскопом всегданачинают с малого увеличения.
- Глядя левым глазом в окуляр и пользуясь вогнутым зеркалом, направляют свет от окна (но не прямой солнечный) или электрической лампы в объектив и максимально и равномерно освещают поле зрения. Правый глаз оставляют открытым, так как при закрытом правом глазе вся нагрузка приходится на левый глаз, и это может быстро вызвать переутомление глазных мышц.
- Кладут препарат на предметный столик (изучаемый объект должен находиться под объективом) и, глядя сбоку, опускают объектив при помощи макровинта так, чтобы между фронтальной линзой объектива и препаратом было расстояние 4 – 5 мм.

- Глядя левым глазом в окуляр и вращая макровинт на себя (!) плавно поднимают объектив до положения, при котором хорошо видно изображение объекта. Передвигая препарат рукой, находят нужное место объекта, располагают его в центре поля зрения. Нельзя смотреть в окуляр и опускать объектив, вращая макровинт от себя, так как при этом фронтальная линза может раздавить препарат и на ней появятся царапины.
- Добиваются большей четкости изображения, приведя в соответствие диаметры пучка света, попадающего в объектив, и фронтальной линзы объектива. Для этого вынимают окуляр и, глядя в тубус, медленно закрывают отверстие диафрагмы до тех пор, пока ее края появятся на границе выходного зрачка объектива. При слишком сильном освещении увеличивают контрастность изображения опусканием конденсора.
- Для изучения какого-либо участка объекта при большом увеличении ставят этот участок в центре поля зрения, передвигая препарат рукой. После этого, не поднимая тубуса (!), поворачивают револьвер так, чтобы объектив ×40 занял рабочее положение.
 Смотрят в окуляр, изображение будет нечетким. С помощью микровинта добиваются хорошей видимости изображения объекта. Следует помнить, что микровинт можно вращать в одну сторону не более чем на пол-оборота. На коробке микрометренного механизма имеются две риски, а на микровинте − точка, которая должна все время находится между рисками. Если она выходит за их пределы, ее необходимо возвратить в нормальное положение. При несоблюдении этого правила микровинт может перестать действовать. Тогда его возвращают в нормальное положение, вращая в противоположную сторону.
Смотрят в окуляр, изображение будет нечетким. С помощью микровинта добиваются хорошей видимости изображения объекта. Следует помнить, что микровинт можно вращать в одну сторону не более чем на пол-оборота. На коробке микрометренного механизма имеются две риски, а на микровинте − точка, которая должна все время находится между рисками. Если она выходит за их пределы, ее необходимо возвратить в нормальное положение. При несоблюдении этого правила микровинт может перестать действовать. Тогда его возвращают в нормальное положение, вращая в противоположную сторону.
Если же при установке объектива ×40 изображение отсутствует, добиваются его осторожным вращением макровинта на себя. И лишь после этого производят фокусировку объекта с помощью микровинта.
- После окончания работы с большим увеличением поворачивают револьвер, устанавливая малое увеличение, и снимают препарат. Нельзя (!) вынимать препарат из-под объектива ×40, так как рабочее расстояние его равно 0,6 мм и легко можно испортить фронтальную линзу.

После окончания работы с микроскопом его приводят в транспортное положение. Для этого поворачивают револьвер, устанавливая его на пустое гнездо, и опускают тубус вниз до упора.
Упрощенный микроскоп МУ — SCOPICA
Конструкция микроскопа МУ показана на рис. 2. Основными частями его являются: основание, тубусодержатель, тубус, механизмы для быстрого и медленного движений тубуса, предметный столик, гильза для диафрагм, зеркало с вилкообразным держателем на качающемся рычаге.
Рис. 2. Упрощенный микроскоп без револьвера
1 — основание штатива, 2 — тубусодержатель, 3 — микрометренный механизм, 4 — кремальера (трибка и рейка), 5 — окуляр, 6 — тубус, 7 — объектив, 8 — предметный столик, 9 — зеркало.
Основание штатива (поз. 1) — ножка подковообразной формы (башмак) — имеет три опорных площадки для соприкосновения со столом и два выступа, предохраняющие штатив от падения при боковых толчках; тяжесть ножки удерживает микроскоп от опрокидывания даже в случае горизонтального положения тубусодержателя.
Тубусодержатель (поз. 2), соединяющийся шарнирно с основанием, имеет форму сегмента; выемка в средней части сегмента позволяет удобно переносить микроскоп и ставить на его предметный столик объекты большого размера. «Тугость» движения шарнирного соединения, обеспечивающая желательное положение тубуса, мажет регулироваться с помощью прилагаемого к микроскопу ключа; упорные винты в нижней части тубусодержателя обеспечивают установку тубуса в горизонтальное положение. В расширенной верхней части сегмента находится микромеханизм для точной фокусировки тубуса в направлении оптической оси микроскопа.
Тубус микроскопа (поз. 6) — составной: в нижнюю часть ввернута втулка, служащая для ввертывания объективов; верхняя часть — трубка — служит для вкладывания в нее сменных окуляров.
Для установки тубуса микроскопа на необходимом расстоянии от рассматриваемого предмета, т.е. для фокусировки микроскопа на резкость, последний снабжен двумя механизмами, из которых каждый обеспечивает точное перемещение тубуса в направлении оптической оси микроскопа, но с различной скоростью.
Механизм для быстрого, или, как принято говорить, «грубого» движения тубуса (поз. 4) состоит из закрепленной на тубусе рейки,и сцепляющегося с ней зубчатого колеса (трибки). На обоих концах оси трибки имеются маховички, вращением которых можно быстро опускать или поднимать тубус. Конструкция маховичков позволяет регулировку легкости хода поворотом одного маховичка по отношению к другому. Косое направление зуба рейки сообщает движению необходимую плавность, однако недостаточную при фокусировке объектива с большим увеличением. Для последней цели служит второй механизм движения тубуса, так называемый, механизм для микрометренного (медленного — «тонкого») опускания и подъема (поз. 3). После 24—25 оборотов стопорный механизм ограничивает возможность дальнейшего движения; два штриха на направляющей показывают предельный ход тубуса с помощью микрометренного механизма.
Необходимо помнить, что работать микрометренным механизмом следует на определенном участке от среднего положения тубуса (т. е. точка на тубусодержателе должна находиться в среднем положении между штрихами на направляющей), т.к. при работе в крайних положениях, от неосторожного нажима на стопорный механизм, может произойти его поломка, вследствие чего микроскоп будет выведен из строя.
е. точка на тубусодержателе должна находиться в среднем положении между штрихами на направляющей), т.к. при работе в крайних положениях, от неосторожного нажима на стопорный механизм, может произойти его поломка, вследствие чего микроскоп будет выведен из строя.
Опускание тубуса осуществляется вращением маховичков механизма по направлению часовой стрелки. С помощью этого механизма можно в ряде случаев определять также толщину исследуемого под микроскопом объекта путем двух последовательных фокусировок на верхнюю и нижнюю его плоскости и отсчетов показаний на барабанчике.
Предметный столик (поз. 8) микроскопа скреплен с его несущим кронштейном, а последний — с тубусодержателем. Удобная круглая форма столика и достаточный его размер удовлетворяют в значительной степени основным требованиям микроскописта;
Столик имеет семь отверстий: четыре крайних — для зажимающих препарат пружинящих клемм и три средних — для крепления накладного препаратоводителя СТ-5.
Кронштейн под столиком микроскопа несет цилиндрическую пружинящую гильзу для диафрагм. К микроскопу прикладывается набор сменных диафрагм, состоящий из 3 шт. Диафрагму с отверстием 1 мм следует применять с объективом 40х, а 3 мм — с объективом 8х. Для освещения объекта имеется зеркало (поз. 9), закрепленное на качающемся рычаге.
К микроскопу прикладывается набор сменных диафрагм, состоящий из 3 шт. Диафрагму с отверстием 1 мм следует применять с объективом 40х, а 3 мм — с объективом 8х. Для освещения объекта имеется зеркало (поз. 9), закрепленное на качающемся рычаге.
Предусмотренная возможность вращения зеркала вокруг двух горизонтальных осей позволяет наилучшим образом направить свет от источника освещения на наблюдаемый объект.
Ахроматические объективы (поз. 7) микроскопа рассчитаны на нормальную работу, при механической длине тубуса 160 мм и при толщине покровного стекла 0,17 мм; в этом случае при надлежащем правильном освещении указанные в таблице основные показатели их (апертура) используются полностью.
Каждый объектив снабжен специальным футляром (из пластической массы) с завинчивающейся крышкой, предохраняющей объектив от запыления; собственное увеличение и апертура объектива выгравированы на оправе объектива и на дне футляра.
Окуляры (поз. 5) типа Гюйгенса (входящие в нормальный набор оптики микроскопа) построены так, что при замене одного из них другим, изображение остается в той же плоскости; они плавно входят в окулярную трубку микроскопа. Каждый окуляр снабжен маркой, указывающей его собственное увеличение.
Каждый окуляр снабжен маркой, указывающей его собственное увеличение.
Микроскоп МУ упакован в металлический футляр. Футляр микроскопа состоит из массивного основания и колпака, с ручкой для переноски. Футляр запирается на замок.
Оптическое и геометрическое увеличение микроскопа
Увеличение системы – важный фактор, в основе которого лежит выбор того или другого микроскопа в зависимости от решения необходимых задач. Все мы привыкли к тому, что проводить контроль полупроводниковых элементов необходимо на инспекционном микроскопе с увеличением 1000 и более крат, изучать насекомых можно, работая с 50 кратным стереомикроскопом, а луковые чешуйки, окрашенные йодом или зеленкой, мы изучали в школе на монокулярном микроскопе, когда понятие увеличения еще не было нам знакомо.
Но как интерпретировать понятие увеличения, когда перед нами находится цифровой или конфокальный микроскоп, а на объективах стоят значения 2000х, 5000х? Что это означает, будет ли 1000 кратное увеличение на оптическом микроскопе давать изображение, аналогичное цифровому 1000 кратному микроскопу? Об этом вы узнаете в этой статье.
Оптическое увеличение системы
Когда мы работаем с лабораторным или стереоскопическим микроскопом, подсчет текущего увеличения системы не составляет труда. Необходимо перемножить увеличение всех оптических компонентов системы. Обычно, в случае стереомикроскопа это объектив, трансфокатор или увеличительный барабан и окуляры.
В случае обычного лабораторного микроскопа дело обстоит еще проще – общее увеличение системы = кратность окуляров умноженная на кратность объектива, установленного в рабочую позицию. Важно помнить, что иногда встречаются специфические модели тубусов микроскопа, имеющие увеличивающий или уменьшающий фактор (особенно распространено для старых моделей микроскопов Leitz). Также, дополнительные оптические компоненты, будь то источник коаксиального освещения в стереомикроскопе или промежуточный адаптер для камеры, располагающийся под тубусом, могут иметь дополнительный фактор увеличения.
 В данном случае, коаксиальный осветитель (поз. 2) стереомикроскопа Olympus SZX16 имеет дополнительный увеличивающий фактор 1,5х.
В данном случае, коаксиальный осветитель (поз. 2) стереомикроскопа Olympus SZX16 имеет дополнительный увеличивающий фактор 1,5х.К примеру, стереомикроскоп Olympus SZX-16 с окулярами 10х, объективом 2х, трансфокатором в позиции 8х и блоком коаксиального освещения с фактором 1,5х будет обладать общим оптическим увеличением 10х2х8х1,5 = 240 крат.
Принципиальная схема получения изображения на световом микроскопе. Окуляр увеличивает изображение, построенное объективом и формирует мнимое изображение.Под оптическим увеличением (Г) в таком случае следует понимать отношение тангенса угла наклона луча, вышедшего из оптической системы в пространство изображений, к тангенсу угла сопряженного ему луча в пространстве предметов. Либо отношение длины, сформированного оптической системой изображения отрезка, перпендикулярного оси оптической системы, к длине самого отрезка
Геометрическое увеличение системы
В случае, когда у системы нет окуляров, а увеличенное изображение формируется камерой на экране монитора, к примеру, как на микроскопе Keyence VHX-5000, следует переходить к термину геометрического увеличения оптической системы.
Геометрическое увеличение микроскопа – отношение линейного размера изображения объекта на мониторе к реальному размеру изучаемого объекта.
Получить значение геометрического увеличения можно перемножив следующие величины: оптическое увеличение объектива, оптическое увеличение адаптера камеры, отношение диагонали монитора к диагонали матрицы камеры.
К примеру, при работе на лабораторном микроскопе с объективом 50х, адаптером камеры 0,5х, камерой 1/2.5” и, выводя изображение на монитор ноутбука 14”, мы получим геометрическое увеличение системы = 50х0,5х(14/0,4) = 875х.
Хотя оптическое увеличение при этом будет равно 500х в случае 10х окуляров.
Цифровые микроскопы, конфокальные профилометры, электронные микроскопы и другие системы, формирующие цифровое изображение объекта на экране монитора оперируют понятием геометрического увеличения. Не стоит путать это понятие с оптическим увеличением.
Разрешение микроскопа
Широко распространено заблуждение, что разрешение микроскопа и его увеличение связаны между собой жесткой связью – чем больше увеличение, тем более мелкие объекты мы сможем в него увидеть. Это не верно. Самым важным фактором всегда остается разрешение оптической системы. Ведь увеличение неразрешенного изображения не даст нам о нем новой информации.
Это не верно. Самым важным фактором всегда остается разрешение оптической системы. Ведь увеличение неразрешенного изображения не даст нам о нем новой информации.
Разрешение микроскопа зависит от числового значения апертуры объектива, а также от длины волны источника освещения. Как вы видите, параметра увеличения системы в этой формуле нет.
где λ – усредненная длина волны источника света, NA – числовая апертура объектива, R – разрешение оптической системы.
При использовании объектива с NA 0,95 на лабораторном микроскопе с галогенным источником (средняя длина волны порядка 500 нм) мы получаем разрешение около 300 нм.
Как видно из принципиальной схемы светового микроскопа, окуляры увеличивают действительное изображение объекта. Если, к примеру, повысить кратность увеличения окуляров в 2 раза (вставить в микроскоп окуляры 20х) – то общее увеличение системы удвоится, но разрешение при этом останется прежним.
Важное замечание
Предположим, что у нас есть два варианта построения простого лабораторного микроскопа. Первый построим, используя объектив 40х NA 0,65 и окуляры 10х. Второй же будет использовать объектив 20х NA 0,4 окуляры 20x.
Первый построим, используя объектив 40х NA 0,65 и окуляры 10х. Второй же будет использовать объектив 20х NA 0,4 окуляры 20x.
Увеличение микроскопов в обоих вариантах будет одинаковое = 400х (простое перемножение увеличения объектива и окуляров). А вот разрешение в первом варианте будет выше, чем во втором, так как числовая апертура объектива 40х больше. К тому же не стоит забывать о поле зрения окуляров, у 20х этот параметр на 20-25% ниже.
Устройство светового микроскопа
☰
Световой микроскоп по-другому называется оптический микроскоп. Оптика — это раздел физики, изучающий поведение световых лучей. В световом микроскопе для увеличения предметов используются особенности распространения света. Поэтому световой микроскоп относится к оптическим приборам.
Световые микроскопы позволяют рассматривать мелкие объекты (например, многие клетки), которые без увеличения нам не видны. Однако очень мелкие объекты в них увидеть нельзя (например, вирусы, молекулы).
Световые микроскопы бывают разные. Одни более простые, другие имеют более сложное совершенное устройство и позволяют рассматривать более мелкие объекты (но всё-равно имеют ограничения увеличения). Вот так может выглядеть школьный микроскоп:
А вот так более современный:
В световом микроскопе можно выделить 7 основных частей:
- Окуляр
- Объективы (обычно их несколько штук)
- Зеркало
- Тубус
- Предметный столик
- Штатив
- Винты
Окуляр, объектив и зеркало как раз и являются оптической системой светового микроскопа. Именно их совместное действие позволяет использовать световые лучи и увеличивать предметы. Остальные части светового микроскопа можно считать «техническими». Они «держат» оптическую систему и рассматриваемый предмет.
Остальные части светового микроскопа можно считать «техническими». Они «держат» оптическую систему и рассматриваемый предмет.
Окуляр — это самая верхняя часть микроскопа. Именно около него находится глаз, когда человек рассматривает объект с помощью микроскопа. Обычно окуляр состоит из пары увеличительных линз и оправы.
Окуляр прикрепляется к тубусу, представляющему собой просто трубку. Тубус определяет расстояние между окуляром и объективами. Тубус прикреплен к штативу, по отношению к которому может двигаться вверх-вниз с помощью винтов. Это позволяет регулировать расстояние от объектива до предметного столика.
Снизу к тубусу прикреплены объективы. Они также состоят из увеличительных стекол. Обычно микроскоп имеет несколько объективов с разной увеличительной способностью. Это позволяет рассматривать объекты при разном увеличении.
Ниже к штативу прикреплен предметный столик. На него кладут рассматриваемый препарат (объект) на стеклышке.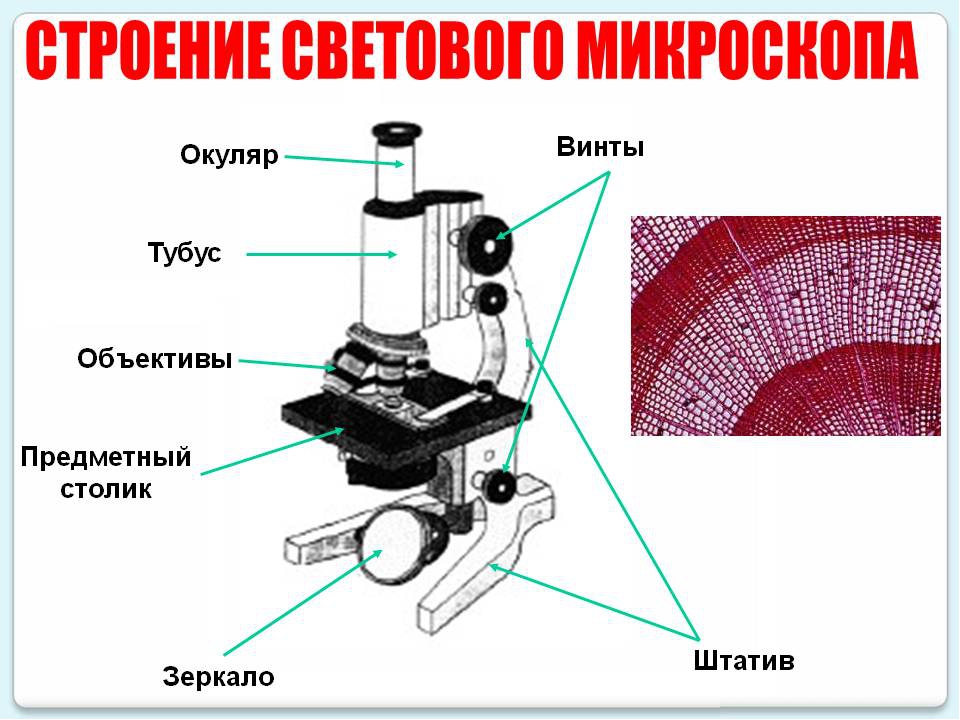 В центре предметного столика находится отверстие, через которое проходят световые лучи от зеркала.
В центре предметного столика находится отверстие, через которое проходят световые лучи от зеркала.
Под предметным столиком крепится зеркало. Его можно поворачивать, более точно направляя лучи в отверстие предметного столика.
Кроме того при необходимости весь штатив можно наклонять с помощью нижнего винта. Благодаря этому обеспечивается лучший поток лучей через отверстие предметного столика.
Световой микроскоп работает следующим образом. Объект размещают на стеклышке («готовят препарат»). Далее это стеклышко помещают на предметный столик микроскопа так, чтобы рассматриваемый объект находился прямо над отверстием в столике. Стеклышко закрепляется зажимами. Лучи света, направляемые зеркалом, проходят через отверстие столика и рассматриваемый объект (его делают тонким и, следовательно, достаточно прозрачным). Далее отраженный от предмета исследования свет проходит через линзы объектива и окуляра и попадает в глаз человека. В результате человек видит увеличенные части исследуемого объекта.
Максимальная увеличительная способность световых микроскопов оценивается примерно в 3500 раз. Школьные микроскопы увеличивают куда меньше. Например, если окуляр увеличивает в 10 раз, а объектив в 20 раз, то увеличение происходит всего в 200 раз.
Какой тип линзы используется для микроскопа?
Типичный микроскоп, составной микроскоп, использует несколько линз и источник света для значительного улучшения изображения просматриваемого объекта. В составном микроскопе используется система линз, которые работают вместе для увеличения размера изображения. Эти линзы сделаны из стекла, называемого оптическим стеклом, которое намного прозрачнее и чище, чем обычное обычное стекло.
Линза объектива
Линза объектива — это линза, ближайшая к слайду или объекту, который вы просматриваете.Цель линзы объектива — собирать свет и увеличивать увеличение. Типичный составной микроскоп будет иметь четыре линзы объектива: одну сканирующую линзу, линзу с малым увеличением, линзу с большим увеличением и линзу с масляной иммерсией. Эти линзы имеют кратность увеличения четыре, 10, 40 и 100 соответственно. Чем короче линза, тем меньше у нее увеличение. Эти четыре линзы взаимозаменяемы и обычно парфокальны, что означает, что вы никогда не теряете фокус изображения даже при переходе с одного объектива на другой.
Эти линзы имеют кратность увеличения четыре, 10, 40 и 100 соответственно. Чем короче линза, тем меньше у нее увеличение. Эти четыре линзы взаимозаменяемы и обычно парфокальны, что означает, что вы никогда не теряете фокус изображения даже при переходе с одного объектива на другой.
Линза окуляра
Линза окуляра — это линза, через которую вы смотрите через верхнюю часть микроскопа. Назначение окулярной линзы — обеспечить увеличенное изображение, чтобы вы могли видеть, когда свет проходит через линзу объектива. Окулярная линза обычно увеличивается в 10 или 15 раз. Сила линзы окуляра в сочетании с линзой объектива позволяет получить гораздо большее и четкое изображение с общим увеличением (при условии, что линза окуляра имеет 10-кратное увеличение) в 40, 100, 400 и 1000 раз.
Конденсорная линза
Конденсорная линза фокусирует свет от источника света на предметное стекло или объект, который попадает в линзу объектива. Конденсорная линза находится под подвижной платформой и над источником света. Количество света, попадающего в линзу конденсора, можно изменить с помощью диафрагмы. Количество света необходимо регулировать всякий раз, когда вы используете другую линзу объектива, чтобы увидеть объект. Конденсорные линзы более полезны при увеличении в 400 или более раз и лучше всего при использовании иммерсионных линз.
Конденсорная линза находится под подвижной платформой и над источником света. Количество света, попадающего в линзу конденсора, можно изменить с помощью диафрагмы. Количество света необходимо регулировать всякий раз, когда вы используете другую линзу объектива, чтобы увидеть объект. Конденсорные линзы более полезны при увеличении в 400 или более раз и лучше всего при использовании иммерсионных линз.
Масло-иммерсионная линза
Масляно-иммерсионная линза отличается от других линз тем, что между линзой и стеклянным предметным стеклом имеется иммерсионное масло. Поскольку линза очень узкая, это масло необходимо для выпрямления световых лучей, которые исходят от источника света и попадают в линзу. Масло обладает той же способностью изгибать свет, что и предметное стекло, и в результате в линзу попадает больше света, и разрешение объекта увеличивается. С помощью масляной иммерсионной линзы вы можете увидеть что-то вроде мелких бактерий.
Анатомия микроскопа
Введение
По своей сути типичный микроскоп
по сути, это коробка, предназначенная для размещения двух
линзы в точных положениях, так что свет может быть точно увеличен от
образец на детектор . Первая из этих двух линз
линза объектива , —
расположен рядом с образцом, перемещается при повороте шкалы фокусировки и имеет полезную информацию, такую как увеличение , написанное на его стороне.В
второй обычно называют трубкой / коллектором
линза , которая находится глубоко внутри микроскопа и редко
видимый.
Первая из этих двух линз
линза объектива , —
расположен рядом с образцом, перемещается при повороте шкалы фокусировки и имеет полезную информацию, такую как увеличение , написанное на его стороне.В
второй обычно называют трубкой / коллектором
линза , которая находится глубоко внутри микроскопа и редко
видимый.
Как и эти линзы, состоит из:
микроскопов- Источники света , такие как лампа или лазер
- Детектор , как правило, научная камера
- Окуляр , бинокулярное устройство, позволяющее человеку-пользователю непосредственно наблюдать образец
- Столик для образца для установки / установки на
- Механические элементы управления , такие как диафрагмы, фильтры, шкалы, для управления световым путем или положением линз
- Цифровые элементы управления , такие как программное обеспечение микроскопа, где такие факторы, как экспозиция или полем зрения можно управлять
- Дополнительные линзы / зеркала для дальнейшего управления световым путем
Эти компоненты отвечают за увеличение , разрешение , поле зрения и , присущие микроскопу. В этой статье подробно описаны компоненты микроскопа и анатомия в связи с тем, как они способствуют получению наилучшего возможного изображения. Чтобы увидеть расположение этих компонентов, см. Рис.1 .
В этой статье подробно описаны компоненты микроскопа и анатомия в связи с тем, как они способствуют получению наилучшего возможного изображения. Чтобы увидеть расположение этих компонентов, см. Рис.1 .
Линзы
Линза — это оптическое устройство , которое может отражать свет. Отражение зависит от формы линзы, которая обычно бывает выпуклой или вогнутой . Для целей микроскопии используются выпуклые линзы из-за их способности фокусировать световых лучей в одной точке.Так устроен человеческий глаз: выпуклая биологическая линза фокусирует свет на задней части глаза, где палочки и колбочки могут его обнаружить. Микроскопы заимствовали эту идею, используя выпуклые линзы для фокусировки света в точку, находящуюся на расстоянии f от линзы. Это расстояние известно как фокусное расстояние линзы и зависит от формы. Формы линз можно увидеть на Рис.2 . Следует отметить, что эти линзы симметричны и будут одинаково влиять на свет с любого направления.
Для целей микроскопии используются выпуклые линзы из-за их способности фокусировать световых лучей в одной точке.Так устроен человеческий глаз: выпуклая биологическая линза фокусирует свет на задней части глаза, где палочки и колбочки могут его обнаружить. Микроскопы заимствовали эту идею, используя выпуклые линзы для фокусировки света в точку, находящуюся на расстоянии f от линзы. Это расстояние известно как фокусное расстояние линзы и зависит от формы. Формы линз можно увидеть на Рис.2 . Следует отметить, что эти линзы симметричны и будут одинаково влиять на свет с любого направления.
Фокусное расстояние микроскопа линза объектива должна быть очень маленькой, так как объектив часто находится очень близко к пример. Как правило, чем больше увеличение, тем ближе объектив должно быть.
Рисунок 2: Выпуклые и вогнутые линзы. Выпуклая линза толще в центре, чем по краю, и фокусирует луч света в точку на определенном расстоянии перед линзой (фокусное расстояние). Вогнутая линза — наоборот, она толще по краю, чем в центре, и рассеивает луч света.В микроскопах используются выпуклые линзы для фокусировки света. Изображение с http://clubsciencekrl.blogspot.com/.
Вогнутая линза — наоборот, она толще по краю, чем в центре, и рассеивает луч света.В микроскопах используются выпуклые линзы для фокусировки света. Изображение с http://clubsciencekrl.blogspot.com/.
Объективы микроскопа содержат линзы, но не такие простые, как линзы, показанные на Рис.2 , что делает их сложными линзами ( Рис. 3A, ). Хотя общий эффект может заключаться в увеличении, эти линзы тщательно спроектированы для управления различными аспектами линз, такими как рабочее расстояние , и способность исправлять такие проблемы, как аберрации , .Объективы характеризуются двумя факторами: увеличением и числовой апертурой (NA) . Увеличение объектива варьируется от 2x до 100x (в сочетании с увеличением окуляра), увеличивая образец в 2–100 раз соответственно ( Рис. 3B, ). ЧА связана с фокусным расстоянием объектива, а именно с тем, под каким углом свет выходит / входит в объектив, так как это влияет на разрешение ( Рис. 3C , подробнее читайте в примечании к приложению о разрешении и ЧА). См. Рис.3 для получения дополнительной информации.
3C , подробнее читайте в примечании к приложению о разрешении и ЧА). См. Рис.3 для получения дополнительной информации.
Ограничители поля и диафрагмы
Всегда есть ограничения для
область, которую необходимо отобразить, и подробную информацию, предоставляемую микроскопом. Там
физических блоков в свете
путь, обычно называемый стопов , диафрагмы или апертуры . Здесь будет использоваться термин «стоп». Для пути изображения
они могут или не могут регулироваться пользователем, но, как обсуждается позже,
концепции применимы к осветительной оптике.
Там
физических блоков в свете
путь, обычно называемый стопов , диафрагмы или апертуры . Здесь будет использоваться термин «стоп». Для пути изображения
они могут или не могут регулироваться пользователем, но, как обсуждается позже,
концепции применимы к осветительной оптике.
Ограничитель диафрагмы — это часть системы формирования изображения, которая ограничивает диапазон углов света, которые линза может собирать с образца.Этот диапазон углов определяет числовую апертуру линзы и, следовательно, разрешение системы, способность определять два объекта как разные. Большинство объективов микроскопов сконструированы таким образом, что диафрагмой является задняя апертура объектива , как показано на рис. 3A . Это гарантирует, что цель определяет разрешение системы и что разрешение будет одинаковым по всему полю обзора.
Полевой упор ограничивает область изображения. Это не может быть больше диаметра линзы трубки .В лучшем случае отображаемая область представляет собой диаметр этой линзы, деленный на увеличение. Если внутренняя линза имеет диаметр 25 мм, и увеличение 100x , то должен быть виден круг диаметром 250 мкм образца. Такие вещи, как элементы, изменяющие свет, или сам детектор, могут легко уменьшить собираемое поле обзора.
Это не может быть больше диаметра линзы трубки .В лучшем случае отображаемая область представляет собой диаметр этой линзы, деленный на увеличение. Если внутренняя линза имеет диаметр 25 мм, и увеличение 100x , то должен быть виден круг диаметром 250 мкм образца. Такие вещи, как элементы, изменяющие свет, или сам детектор, могут легко уменьшить собираемое поле обзора.
Детекторы
Окуляры
На выходе большинства микроскопов получается изображение размером около 2 см в поперечнике, поэтому обычно его снова увеличивают на и , чтобы заполнить поле зрения глаз. Окуляры , еще одна система увеличения, дает 10-30-кратное увеличение сверх того, которое обеспечивается объективом и микроскопом. В сочетании с линзой в глазу это увеличивает изображение до сетчатки в удобном масштабе, так что человеческий глаз может различать и наблюдать объекты даже размером с клетки (~ 10 мкм).
Камеры для научных исследований
Есть все виды фотоаппаратов который можно использовать с микроскопом. Ключевыми экспериментальными соображениями являются чувствительность , разрешение , поле зрения и скорость камеры.Подробное объяснение см. наши статьи по этой тематике.
Пиксель камеры — отдельный блок измерения света в камере, а сенсор камеры имеет массив пикселей для измерения света через поле зрения. Камера может иметь всего 128 × 128 пикселей или столько же 5000 × 3000 (15 миллионов пикселей или 15 мегапикселей) или более. Поскольку микроскоп порты камеры обычно имеют одинаковый приблизительный размер, камеры с большим пикселем массивы обычно имеют отдельные пиксели меньшего размера.
Размер пикселя является ключом к возможности изображения с полной информацией
контент, предоставляемый оптикой. Пиксели камеры квадратные и обычно 3-24 мкм. по краю. Вообще говоря, камеры с меньшими пикселями на , позволяют на пикселей выше.
разрешение изображений, тогда как камеры с более крупными пикселями имеют большую площадь поверхности для сбора фотонов
делая их более чувствительными .
по краю. Вообще говоря, камеры с меньшими пикселями на , позволяют на пикселей выше.
разрешение изображений, тогда как камеры с более крупными пикселями имеют большую площадь поверхности для сбора фотонов
делая их более чувствительными .
Большинство микроскопов имеют оптические выходные порты диаметром около 18-25 мм.Таким образом, без увеличения (объектив 1x) изображение будет охватывать 18-25 мм образца. Учитывая фиксированный размер изображения, датчики камеры с диагональными размерами, превышающими размер порта камеры микроскопа, будут иметь пиксели, на которые не будет падать свет. Следовательно, важно согласовать поле зрения камеры с максимальным полем зрения микроскопа.
Более крупные пиксели улучшают чувствительность. Косвенно они также имеют преимущество в отношении общего времени, необходимого для передачи информации на компьютер.Общее время считывания зависит от архитектуры камеры, причем CMOS быстрее, чем CCD, а также от общего количества пикселей в камере. В общем, камера с большим, но меньшим количеством пикселей будет готова к следующей экспозиции быстрее, чем камера с большим количеством меньших пикселей.
В общем, камера с большим, но меньшим количеством пикселей будет готова к следующей экспозиции быстрее, чем камера с большим количеством меньших пикселей.
Подсветка
Различные методы микроскопии обнаруживают специфические взаимодействия между светом и образцом. Методы, при которых изображение рассеивается или поглощается света фокус освещение образца с помощью отдельной осветительной линзы и объектив для визуализации.Линза фокусирующего освещения обозначается как конденсатор , со своими собственными свойствами: рабочее расстояние, NA и т. д.
Флуоресцентная микроскопия использует отражательную или эпифлуоресцентную геометрию , где объектив служит как конденсатором освещения, так и линзой формирования изображения. Осветительный свет проходит через объектив, а обнаруженный свет проходит обратно через объектив и разделяется на камеру или окуляр. Одним из преимуществ этого подхода является то, что свет, который не взаимодействует с образцом, уходит от детектора, максимально увеличивая разделение света подсветки от флуоресцентного излучения.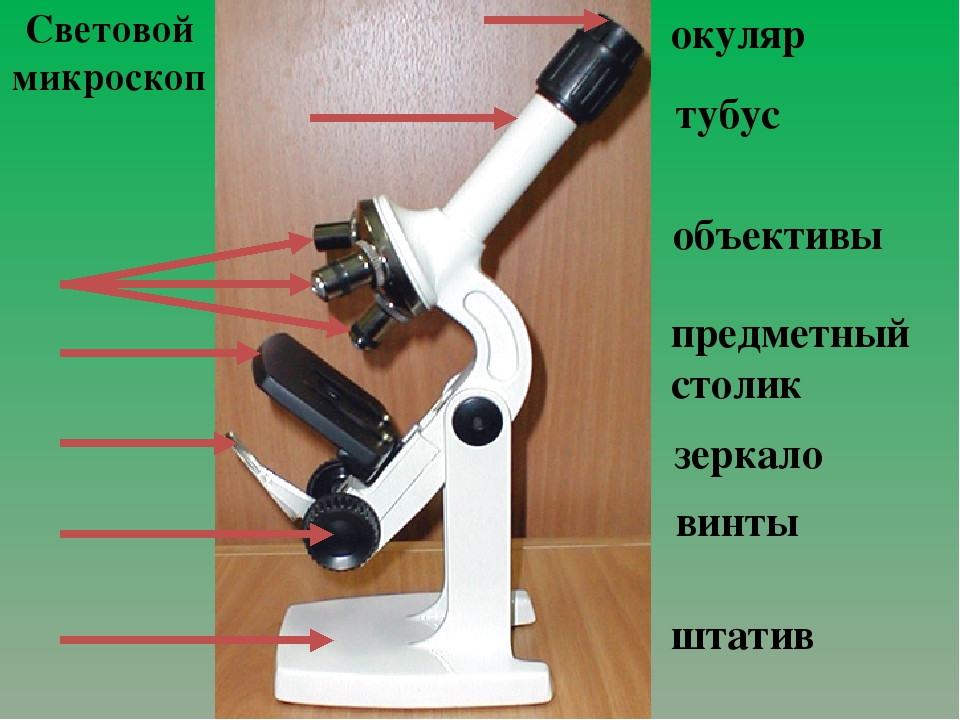 Пути пропускания и эпифлуоресценции показаны на Рисунке 4.
Пути пропускания и эпифлуоресценции показаны на Рисунке 4.
Два метода освещения, критический или Кёлер , обычно используются для освещения образца в микроскопии.Основное различие заключается в том, копируют ли они структуру ( критическое значение ) или шифруют структуру ( Köhler ) источника освещения на образце. Освещение по Кёлеру используется чаще, он будет рассмотрен в этой статье.
Кёлер изобрел систему фокусируемого освещения, которая позволяла контролировать размер поля, мощность и угол освещения, одновременно изменяя структуру источника света, проецируемого на образец. Для этого он воспользовался свойством линзы преобразовывать боковую структуру в параллельные лучи. Размещение источника освещения в фокусе линзы преобразует выходной сигнал в однородные световые лучи на другой стороне, скремблируя любую структуру, присущую источнику. Несколько точек, излучаемых источником света, в конечном итоге искажаются и перемещаются в параллельных лучах после выхода из линзы
Размещение источника освещения в фокусе линзы преобразует выходной сигнал в однородные световые лучи на другой стороне, скремблируя любую структуру, присущую источнику. Несколько точек, излучаемых источником света, в конечном итоге искажаются и перемещаются в параллельных лучах после выхода из линзы
Размещение источника освещения близко к образцу ограничивает контроль силы света и поля зрения освещенности. Келер визуализировал источник света на фокусном расстоянии от конденсорной линзы, как показано на рис.5 . Это обеспечивает управление полем освещения с помощью упора поля , в середине компонента формирования изображения и упора диафрагмы , 1f от конденсора. Ограничение диафрагмы — очень важный аспект дизайна; что позволяет легко контролировать мощность света, подаваемую на образец. Эти упоры обычно имеют рычаги, позволяющие пользователю вручную регулировать область освещения (ограничитель поля) и мощность (ограничитель диафрагмы), подаваемую на образец.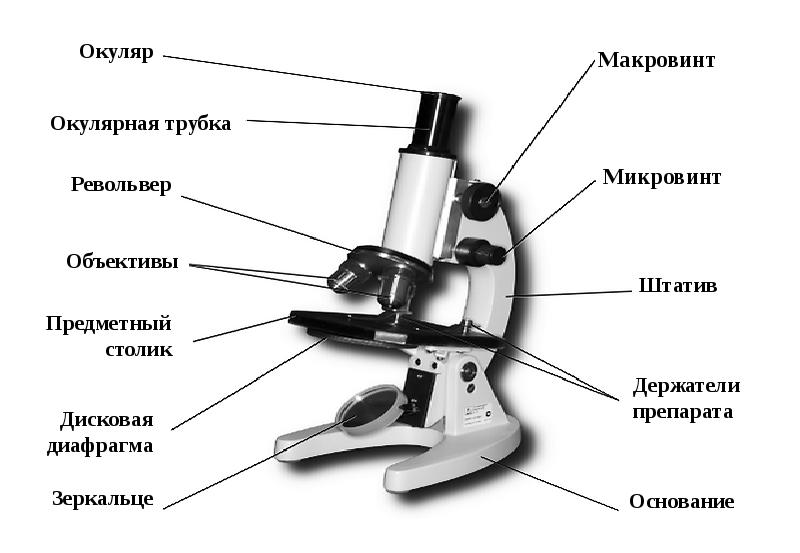
Источники света
Существует множество ламп , светодиодов , и лазеров , которые можно использовать для освещения образца в микроскопе. Типичные лампы, используемые для освещения, включают:
- Галогенная лампа . Они обеспечивают освещение широкого спектра, а их выходная мощность зависит от напряжения на нити накала.
 Часто используется для передачи изображений.
Часто используется для передачи изображений. - Ксеноновая дуговая лампа . Имеет одинаковую мощность на широко используемых длинах волн. В лампе электрическая дуга проходит через две металлические точки в атмосфере ксенона под высоким давлением, создавая плазму около металлических точек. Иногда используется для флуоресцентной визуализации.
- Ртутно-металлогалогенная дуговая лампа . Имеет в целом большую мощность на широко используемых длинах волн, чем ксеноновые лампы. Также генерирует плазму с помощью электрического разряда между двумя металлическими столбами. Хотя мощность на разных длинах волн может резко меняться, ртутные лампы часто используются для получения изображений флуоресценции.Между использованиями необходимо охлаждаться.
Срок полезного использования каждого из этих
источников варьируется от до нескольких сотен
часов для ртутных дуговых ламп, до 1000-2000
часы для ртутных / металлогалогенных и галогенных ламп.
Светодиодные источники света достаточно мощны, чтобы конкурировать с ксеноновыми лампами и ртутными / металлогалогенными лампами в качестве источников освещения для получения флуоресцентных изображений. Каждый светодиод имеет уникальный цвет, поэтому широкополосные светодиодные источники получают из массивов нескольких отдельных диодов с относительно узким спектром.Светодиодные источники имеют срок службы более 10 000 часов и обладают высокой энергоэффективностью, что делает их очень экономичными при длительном использовании. Их можно быстро включать и выключать за наносекунды, что делает их полезными для экспериментов, требующих жесткого контроля освещения. Спектральное распределение примера светодиодного источника света проиллюстрировано на Рис.6 .
Лазеры излучают свет с очень специфической длиной волны. Например, свет, генерируемый гелий-неоновым (HeNe) лазером (HeNe) , имеет цвет 632.8 нм. В отличие от других обсуждаемых здесь источников света, лазеры излучают когерентных световых лучей. Когерентность указывает на то, что свет сильно структурирован, и все пики и впадины световой волны происходят в одно и то же время и в одном месте. Когерентность необходима при фокусировке света на точку с ограничением дифракции, но она также усложняет широкопольное освещение из-за его склонности к положительным и отрицательным помехам. Эту самоинтерференцию часто можно обнаружить в виде спекл-структуры в расширенном лазерном луче.
Фильтры
Фильтры — это оптические компоненты, которые могут пропускать свет определенных длин волн и отражать другие. Выбор цвета имеет решающее значение для флуоресцентной визуализации. Пример оптической фильтрации показан на Рис.7 .
Фильтры обычно обозначаются характером передачи и длиной волны, с которой они переключаются передача на отражение, как показано на Рис.8 . Короткий проход 500 нм (SP) фильтр будет пропускать свет синее, чем 500 нм, и отражать свет более красным чем 500 нм.В отличие от этого, длиннопроходный 500-нм (LP) фильтр будет пропускать свет длиной более 500 нм, отражая свет более короткие длины волн.
Автор объединив свойства фильтров SP и LP, были созданы полосовые (BP) фильтры (BP) . Фильтр SP 550 нм в сочетании с фильтром LP 500 нм будет пропускать свет только между 500-550 нм . Фильтры БП обычно описывается их центральной длиной волны и допустимыми длинами волн либо боковая сторона. Гипотетическую комбинацию фильтров SP550, LP500 обычно называют BP 525d25 , BP с центром 525 нм с разрешенной передачей 25 нм в любую сторону (Reichman, 2017).
В флуоресцентном микроскопе комбинация из возбуждающего ВР-фильтра , дихроичного фильтра LP и эмиссионного ВР-фильтра организована в держатель куба, чтобы обеспечить образец возбуждающим светом высокой интенсивности и эффективно изолировать испускаемый свет перед направляя его к камере.
Рисунок 8: Зависимость коэффициента пропускания от длины волны для различных типов фильтров. В примере LP красный свет будет проходить, а синий свет отражаться.В примере SP синий свет проходит, а красный свет отражается. В примере BP и синий, и красный свет отражаются, а зеленый свет передается. Взято из основных аспектов светофильтров. Молекулярные выражения. Праймер для оптической микроскопии. Https://micro.magnet.fsu.edu/primer/lightandcolor/filtersintro.html.Сводка
Обсуждаемые здесь части микроскопа работают согласованно, направляя свет на образец и забирая свет от образца и увеличивая его до детектора для сбора.Ограничения диафрагмы, обычно в объективе, ограничивают разрешение микроскопа. Ограничители поля ограничивают освещенную или обнаруженную область. Для получения наилучшего изображения необходимо учитывать такие компоненты, как объективы, источники света, фильтры и камеры.
Список литературы
Abramowitz, M. 2003 Основы микроскопов и не только, Olympus Америка, научный отдел.
Davidson, M.W. Koehler Освещение в Zeiss Basic Веб-сайт ресурсов (https://www.zeiss.com/microscopy/us/solutions/reference/basic-microscopy/koehler-illumination.html)
Парри-Хилл, М.Дж., Фогт, К.М., Гриффин Д.Д. и Дэвидсон, M.W. Согласование камеры с разрешением микроскопа на веб-сайте MicroscopyU (https://www.microscopyu.com/tutorials/matching-camera-to-microscope-resolution)
Reichman, J. Справочник по оптическим фильтрам для Флуоресцентная микроскопия. Компания Chroma Technology Company Беллоус-Фолс, Вермонт 05101-3119 (https://www.chroma.com/sites/default/files/HandbookofOpticalFilters.pdf)
Спринг, К.Р., Парри-Хилл, М.И Дэвидсон, М. Геометрическое построение лучевых диаграмм в программе Olympus Microscopy Primer веб-сайт (https://www.olympus-lifescience.com/en/microscope-resource/primer/java/components/characteristicrays/)
Спринг, К. Р., Парри-Хилл, М., Бёрдетт, К. А., Саттон, Р. Т., Феллерс, Т. Дж. и Дэвидсон, M.W. Laser Fundamentals на веб-сайте Olympus Microscopy Primer (https://www.olympus-lifescience.com/en/microscope-resource/primer/lightandcolor/laserhome/)
Микроскопия
МикроскопияСоставной микроскоп — полезный инструмент для увеличения объектов. до 1000 раз больше их нормального размера.Использование микроскопа требует много практики. Следуйте приведенным ниже процедурам, чтобы получить наилучшие результаты и избежать повреждения оборудования.
Детали составного микроскопа
- Окуляр, также называемый окулярной линзой, представляет собой линзу с малым увеличением.
- Линзы объективов составных микроскопов парфокальный . Вам не нужно перефокусировать (кроме точной настройки) при переключении на более высокая мощность, если объект находится в фокусе, на более низкой мощности.
- Поле зрения самое широкое у объектива с самым низким увеличением. Когда вы переключаетесь на более высокое увеличение, поле зрения закрывается. Вы увидите больше объекта при малой мощности.
- Глубина резкости максимальная при минимальном увеличении цель. Каждый раз, когда вы переключаетесь на более высокую мощность, глубина фокус снижен. Поэтому меньшая часть образца находится в сосредоточьтесь на более высокой мощности.
- Количество света, попадающего в ваш глаз, является максимальным при малая мощность.Когда вы переключаетесь на более высокую мощность, свет (и, следовательно, разрешающая способность , или способность различать два рядом объекты как отдельные) сокращается. Компенсация с контролем света (иногда называется ирисовой диафрагмой ).
Поле зрения
Поле зрения наибольшее у объектива с наименьшим увеличением. Когда вы переключаетесь на более высокое увеличение, поле зрения сужается к центру. Ты сможешь увидеть больше объекта на малом увеличении.Поэтому лучше всего найти объект на малом увеличении, отцентрируйте его, затем переключитесь на более высокую мощность и повторите.
Поле зрения закрывается при большем увеличении
Глубина резкости
Глубина резкости максимальна для объектива с наименьшим увеличением. Каждый при переключении на более высокое увеличение глубина резкости уменьшается. Поэтому меньшая часть образца находится в фокусе при более высоком увеличении. Опять же, это упрощает поиск объекта при малом увеличении, а затем переключитесь на более высокую мощность после того, как он окажется в фокусе.Обычное упражнение для демонстрации глубины резкости включает наложение трех ниток разного цвета друг на друга. Когда наблюдатель фокусируется вниз, сначала в фокус попадает верхняя нить, затем средняя и, наконец, нижняя. При использовании более мощных объективов один может расфокусироваться, когда другой окажется в фокусе.
Глубина резкости уменьшается при увеличении
Поиск и устранение неисправностей микроскопа
Проблема №1: Изображение перевернуто и / или перевернуто.
- Слайд находится правой стороной вверх?
- Инверсия изображения является нормальным явлением для некоторых микроскопов.
- Обычная демонстрация предполагает просмотр буквы «е» на слайде.
- Когда вы перемещаете слайд влево, изображение перемещается влево или вправо?
Проблема № 2: Все темно.
- Микроскоп подключен к розетке?
- Включен ли выключатель питания?
- Линза объектива защелкнулась?
- Правильно ли настроено управление освещением?
- Если вы находитесь на максимальной мощности, вы забыли иммерсионное масло?
Проблема № 3: Я ничего не могу найти на малой мощности!
- Отцентрируйте покровное стекло предметного стекла под линзой объектива.
- Сфокусируйтесь вверх и вниз с помощью ручки грубой настройки.
Проблема №4: Когда я перешел на более высокую мощность, все исчезнувший!
- Вернитесь к предыдущей (более низкой степени) цели.
- Отцентрируйте объект в поле зрения.
- Перейдите к объективу с большим увеличением и используйте только точную фокусировку.
Проблема № 5: Изображение размытое при всех увеличениях.
- Очистите линзу окуляра микроскопа.(Используйте только бумагу для линз!)
- Если вы поворачиваете окуляр и пятнышки перемещаются, значит на линзе окуляра есть грязь, и ее следует очистить.
Проблема № 6: Изображение размытое только на определенном мощность.
- Очистите линзу объектива микроскопа. (Используйте только объектив бумага!)
Чертежи микроскопа
При рисовании того, что вы видите под микроскопом, следуйте формату показано ниже.Важно указать метку рисунка и тему. заголовок над изображением. Название вида (и общепринятое название, если есть один) и увеличение, при котором вы рассматривали объект должно быть написано под изображением. Все соответствующие части рисунка должны быть помечены с правой стороны изображения прямыми линий. Линии не должны пересекаться. Рисунки выполнять карандашом, в то время как этикетки должны быть написаны ручкой или напечатаны. Помните эту сумму Увеличение определяется путем умножения окуляра x цель .
Правильно помеченный чертеж микроскопа.
Просмотр подготовленных слайдов
*** Не копите слайды! Вы можете просматривать только по одному, поэтому это все, что вам следует держать. Верни его, прежде чем получить другой, и если вы сломаете его, сообщите своему инструктору, чтобы он мог правильно почистил и заменил! ***
- Начните с поворота линзы объектива до минимального увеличения.
- Поместите предметное стекло на предметный столик этикеткой вверх покровным стеклом. по центру.
- На ТОЛЬКО НИЗКАЯ МОЩНОСТЬ , используйте ручку грубой фокусировки, чтобы объект в фокусе.
- Если вы ничего не видите, слегка сдвиньте слайд, пока просмотр и фокусировка.
- Если ничего не появляется, уменьшите свет и повторите шаг 4.
- После фокусировки на малом энергопотреблении отцентрируйте интересующий объект с помощью перемещение слайда.
- Поверните объектив на среднее увеличение и отрегулируйте точную только фокус.
- При необходимости поверните объектив на большую мощность и отрегулируйте только точный фокус.
Изготовление мокрого крепления (Live Подготовка) Слайд
- По возможности используйте понижающий слайд — он будет иметь небольшой углубление, удерживающее жидкость.
- Выдавите воздух из капельницы перед тем, как положите его внутрь контейнер для образца. (Это предотвращает взбалтывание пузырьками содержимое флакона для образца.)
- Решите, куда положить кончик пипетки — часто лучший материал оседает на дно!
- Продолжая сжимать грушу капельницы, вставить капельницу в контейнер для образца и частично сбросить давление на лампочке.Жидкость должна подниматься вверх медленно . Осторожно удалите капельница из контейнера для образца.
- Увеличьте давление на грушу капельницы, чтобы добавить каплю (или две максимум) до депрессии ползуна. Жидкость не должна переливание по поверхности.
- Если вы собираетесь наблюдать быстро движущиеся организмы, возможно, вы захотите добавьте каплю загустителя, такого как метилцеллюлоза или «ProtoSlo» в замедлить их, сделав жидкость более вязкой.
- Медленно положите покровное стекло, начиная под углом 45 градусов. с одним краем, касающимся слайда.Это помогает предотвратить образование пузырьков воздуха. от образования под покровным стеклом.
- Помните, что свет микроскопа очень интенсивный и организмы будут дольше жить на слайде, если вы выключите его, когда не наблюдая.
Дальнейшее расследование
Цифровой микроскоп для Macintosh или Windows
Изучение организмов в воде пруда
Powers of 10 (версия 1977 года)
Сделайте свой собственный микроскоп
Каковы разные увеличения объективов? / Новости и события ACCU-SCOPE
Эта запись была опубликована 16 марта 2020 г. компанией Accu-Scope.
Большинство составных микроскопов поставляются со сменными линзами, известными как линзы объектива . Объективы бывают разной кратности увеличения, наиболее распространенными из которых являются 4x, 10x, 40x и 100x, также известные как сканирование, малое увеличение, высокое увеличение, и (обычно) масляные иммерсионные объективы соответственно. Давайте подробнее рассмотрим каждый из вариантов увеличения линз объектива и когда вы будете их использовать.
Линза сканирующего объектива (4x)
Сканирующая линза объектива обеспечивает наименьшее увеличение из всех линз объектива.4-кратное увеличение — это обычное увеличение для сканирующих объективов, а в сочетании с увеличением линзы окуляра 10-кратное увеличение линза 4-кратного сканирующего объектива дает общее увеличение в 40 раз. Название «сканирующая» линза объектива происходит от того факта, что она обеспечивает наблюдателям достаточное увеличение для хорошего обзора слайда, по сути, «сканирования» слайда. Некоторые задачи с еще меньшей мощностью обсуждаются ниже в разделе «Специальные задачи».
Объектив малой мощности (10x)
Линза объектива с низким увеличением имеет большее увеличение, чем линза сканирующего объектива, и это одна из самых полезных линз, когда дело доходит до наблюдения и анализа образцов стеклянных предметных стекол.Общее увеличение линзы объектива с низким увеличением в сочетании с линзой окуляра 10x составляет 100-кратное увеличение, что позволяет вам видеть слайд ближе, чем линза сканирующего объектива, не приближаясь слишком близко для общих целей просмотра.
Рис. 1. Примерные увеличения объектива.Объектив с большим увеличением (40x)
Мощная линза объектива (также называемая линзой с высоким содержанием сухого вещества) идеальна для наблюдения мелких деталей в образце. Общее увеличение мощного объектива в сочетании с 10-кратным окуляром равно 400-кратному увеличению, что дает вам очень подробное изображение образца на вашем слайде.
Объектив с масляной иммерсией (100x)
Объектив с масляной иммерсией обеспечивает самое мощное увеличение с колоссальным увеличением в 1000 раз в сочетании с 10-кратным окуляром. Но показатели преломления воздуха и вашего предметного стекла немного различаются, поэтому необходимо использовать специальное иммерсионное масло, чтобы сократить разрыв. Без добавления капли иммерсионного масла линза объектива с масляной иммерсией не будет работать правильно, образец будет выглядеть размытым, и вы не сможете достичь идеального увеличения или разрешения.Некоторые производители также выпускают масляные иммерсионные линзы с меньшим увеличением и обеспечивают более высокое разрешение, чем их «высокосухие» аналоги.
Специальные линзы для объективов (2x, 50x масляные, 60x и 100x сухие)
Есть несколько других увеличений объектива, доступных с полезностью для определенных приложений. Объектив с 2-кратным увеличением, широко используемый в патологии, имеет лишь 1/2 увеличения сканирующей линзы с 4-кратным увеличением, что обеспечивает лучший обзор образца на слайде.Масляный иммерсионный объектив с 50-кратным увеличением, который часто используется вместо 40-кратного объектива, используется в качестве золотого стандарта для наблюдения за мазками крови. Объектив с 60-кратным увеличением, часто выпускаемый как в сухой, так и в масляной иммерсии, обеспечивает на 50% большее увеличение, чем объектив с 40-кратным увеличением. 60-кратное сухое изображение иногда выбирают вместо 100-кратного масляного иммерсионного объектива для большего увеличения без необходимости использования иммерсионного масла. Наконец, 100-кратный сухой объектив не требует иммерсионного масла для обеспечения высокого увеличения (все еще 1000-кратный в сочетании с 10-кратными окулярами).Однако числовая апертура (показатель разрешающей способности объектива) 100-кратного сухого объектива намного ниже, чем у 100-кратного масляного иммерсионного объектива, и, как результат, способность объектива разрешать мелкие детали в образце снижается. намного ниже тоже.
Важно всегда использовать правильную иммерсионную среду (например, воздух, воду, масло и т. Д.), Которая соответствует характеристикам линзы вашего объектива.
- Изображение, созданное неправильным иммерсионным носителем, будет размытым.Как правило, объективы предназначены для «просмотра» иммерсионной среды с определенным показателем преломления (тема для другой статьи). Например, воздух имеет показатель преломления, близкий к 1,0, тогда как стандартное иммерсионное масло имеет показатель преломления ~ 1,51.
- Вы можете повредить объектив, если используете неподходящее иммерсионное масло.
Если вы заинтересованы в покупке различных типов линз для вашего микроскопа в классе, лаборатории, исследовательском центре или для любых других целей, ACCU-SCOPE может предоставить вам товары, которые вы ищете.Свяжитесь с нами сегодня, чтобы узнать больше о наших линзах объектива и других принадлежностях для микроскопов.
Практические вопросы — Увеличение и линзы
Почему масляные иммерсионные объективы имеют более высокую числовую апертуру, чем сухие (не масляные) линзы?- Их используют ближе к образцу, поэтому их линзы улавливают свет под углами, которые не хватало бы линзам вагонетки.
- Масло, используемое с линзами, предотвращает преломление света от объективов, как это происходит с сухими линзами.
- Масло, используемое с линзами, увеличивает разницу между показателями преломления предметного стекла и среды между предметным стеклом и линзой объектива.
- А и В
- B и C
- Уменьшает числовую апертуру.
- Это увеличивает количество света, падающего на образец.
- Он блокирует все, кроме самых длинных волн видимого света.
- Он поглощает свет.
- Он передает только самые короткие волны видимого света.
- красный
- зеленый
- желтый
- апельсин
- синий
- Используйте масло для иммерсионных линз.
- Сфокусируйте первую линзу объектива на образце.
- Сфокусируйте линзу объектива после переключения.
- А и В
- B и C
- вирусы
- грибы
- водоросли
- простейшие
- бактерии
- магнитная линза
- окулярная линза
- объектив
- конденсаторная линза
- ни один из вышеперечисленных
- В 10 раз
- 100x
- 1,000x
- 10,000x
- 100,000x
- В 10 раз
- 20X
- 200X
- 2000X
- 20,000X
- грамположительная бактерия
- грамотрицательная бактерия
- капсула
- колония
- антитело
- 15x
- 45x
- 150x
- 450x
RP Photonics Encyclopedia — объективы микроскопа, увеличение, фокусное расстояние, числовая апертура, разрешение изображения
Энциклопедия> буква M> объективы микроскопа
можно найти в Руководстве покупателя RP Photonics.Среди них:
Найдите более подробную информацию о поставщиках в конце этой статьи энциклопедии или посетите наш
Вас еще нет в списке? Получите свою запись!
Определение: оптический компонент микроскопа, который находится рядом с наблюдаемым объектом
Более общие термины: цели
Немецкий язык: Mikroskopobjektive
Категории: зрение, дисплеи и изображения, оптическая метрология
Как цитировать статью; предложить дополнительную литературу
Автор: Dr.Rüdiger Paschotta
Объектив микроскопа — ключевой компонент для достижения высоких характеристик микроскопа. Это та часть, которая находится рядом с наблюдаемым объектом, обычно на довольно небольшом расстоянии в несколько миллиметров. Обычно объектив микроскопа создает промежуточное изображение в микроскопе, которое затем дополнительно увеличивается с помощью окуляра (окулярной линзы). В частности, в случаях с большим увеличением большая часть увеличения обеспечивается объективом.
Большинство объективов микроскопов основаны на преломляющей оптике, содержащей несколько линз.Например, простой объектив с низкой числовой апертурой может содержать менисковую линзу и ахромат. Объектив с высокой числовой апертурой обычно содержит более сложную комбинацию линз различных типов: полусферических, менисковых, ахроматических дуплетов и триплетов.
Есть также отражающие объективы, содержащие изогнутые зеркала и без линз. Они естественно ахроматические и могут быть полезны для работы в областях с экстремальными длинами волн. Кроме того, они могут иметь меньшие потери оптической мощности.
Увеличение
Микроскопы часто содержат несколько объективов на вращающейся револьверной головке, например сканирующую линзу только с 4-кратным увеличением, промежуточную линзу (маленькая линза) с 10-кратным увеличением и большой объектив высокого разрешения с 40-кратным или 100-кратным увеличением.Например, окуляр может вносить еще один фактор увеличения в 5 или 10 раз.
Обратите внимание, что большое увеличение само по себе бесполезно, если оно только увеличивает изображение без увеличения уровня детализации; см. ниже раздел о числовой апертуре.
Также часто встречаются кольца с цветовой кодировкой, указывающие на разные значения увеличения, например черный для 1 ×, желтый для 4 ×, зеленый для 10 × и т. д.
Фокусное расстояние
Фокусное расстояние объектива микроскопа обычно составляет от 2 мм до 40 мм.Однако этот параметр часто считается менее важным, поскольку увеличения и числовой апертуры достаточно для количественной оценки основных характеристик микроскопа.
Числовая апертура
Чем больше увеличение, тем выше также требуется числовая апертура, потому что это фактор, который в конечном итоге ограничивает достижимое разрешение изображения. Существуют разные способы расчета разрешения изображения и несколько разные обстоятельства, но они приводят к аналогичным значениям разрешения, которые составляют примерно λ / (2 NA), где λ — длина оптической волны (примерно от 400 до 700 нм), а NA — это длина волны. числовая апертура.Например, числовая апертура, равная 1, обеспечивает разрешение изображения примерно 250 нм для зеленого света. Для небольшого увеличения числовая апертура 0,1 может быть вполне достаточной.
Наивысшие числовые апертуры, достижимые с сухими объективами, работающими с воздухом между объективом и объектом, составляют примерно 0,95. Значительно более высокие значения, например, 1,5 или даже больше может быть достигнуто с помощью иммерсионных объективов , где зазор между объектом и объективом заполнен жидкостью — водой или иммерсионным маслом с более высоким показателем преломления, часто несколько выше 1.5. Оптимизированные иммерсионные масла обладают не только высоким показателем преломления, но также подходящей вязкостью и низкой склонностью к образованию пятен на поверхностях. Их можно оставить на цели более длительное время, не повредив ее.
Обратите внимание, что погружение в масло может работать неправильно, например, при наблюдении за биологическим образцом в водном растворе масло находится только между покровным стеклом и объективом. Для таких случаев, возможно, придется использовать специальные водно-иммерсионные объективы.
Для оптимального освещения может также потребоваться погружение в масло с этой стороны.
Коррекция изображения
В частности, для объективов с большой числовой апертурой высокое качество изображения может быть достигнуто только при значительных усилиях по коррекции различных видов оптических аберраций, таких как сферические, астигматизм, кома, кривизна поля, искажение изображения и хроматические аберрации. Например, планапохроматические объективы, имеющие особенно сложную конструкцию, обеспечивают оптимальную коррекцию плоского поля в сочетании с хорошими ахроматическими свойствами.
Хроматические аберрации в основном возникают из-за зависимости фокусного расстояния от длины волны.Они приводят к искажению цветного изображения. Для обычной микроскопии они могут быть весьма актуальными, в отличие от других типов оптической микроскопии, например некоторые виды лазерной микроскопии. Наилучшее подавление хроматических аберраций достигается с помощью апохроматических объективов.
Не забывайте о влиянии покровного стекла!По крайней мере, при большом увеличении влияние покровного стекла с точки зрения хроматических и сферических аберраций может быть весьма значительным. Поэтому объективы для использования в таких областях, как биология, где часто требуются покровные стекла, разработаны с интегрированной коррекцией покровных стекол.Корректировка часто выполняется для стандартной толщины скольжения 170 мкм. Отклонение всего в 10 мкм уже может быть довольно проблематичным для объектива с высокой числовой апертурой, например, 0,95. Некоторые объективы позволяют регулировать откорректированную толщину покровного стекла.
Обратите внимание, что некоторые конструкции микроскопов рассчитаны на коррекцию некоторых остаточных аберраций объектива линзой окуляра.
К сожалению, идеальных решений не существует; поэтому приходится идти на определенные компромиссы, которые приводят к различным оптимизированным решениям для разных приложений.Например, для измерительных микроскопов наиболее важны оптимальные свойства плоского поля; тогда можно допустить несколько более крупные хроматические аберрации.
Объективы микроскопов с конечной и бесконечной коррекцией
Для старых микроскопов обычно требуется объективов с конечной коррекцией . Здесь предполагается, что объект расположен немного ниже передней фокальной плоскости объектива, а промежуточное изображение появляется на конечном расстоянии, например 160 мм от объектива.Такой объектив предназначен для минимальных искажений изображения в данной конфигурации.
Объективы с конечной коррекцией всегда рассчитаны на определенную длину трубы, например по стандарту DIN или JIS (длина трубок различается на 10 мм). Использование объектива неправильного стандарта может значительно ухудшить качество получаемого изображения.
Современные микроскопы в основном требуют объективов с коррекцией на бесконечность , где только промежуточное изображение объектива находится на бесконечном расстоянии.Здесь требуется дополнительная линза трубки в микроскопе для создания промежуточного изображения на диафрагме окуляра.
В статье о микроскопах объясняются преимущества конструкций микроскопов, основанных на объективах с коррекцией на бесконечность.
Диапазон длин волн
Оптические микроскопы обычно работают на основе визуализации в видимом свете, то есть в диапазоне длин волн от 400 до 700 нм. Поэтому большинство объективов микроскопов оптимизированы для этого диапазона длин волн, с наибольшим упором на область от 480 до 640 нм.Однако есть цели с расширенным диапазоном, например: От 400 до 950 нм и другие, которые работают дальше в инфракрасном диапазоне. Например, это требуется для лазерных микроскопов, где необходимо передавать инфракрасные лазерные лучи.
Обратите внимание, что важно не только иметь хороший коэффициент пропускания во всем диапазоне длин волн, но и ахроматические характеристики. В обычных световых микроскопах это необходимо, чтобы избежать искажения цветного изображения. В конфокальных многофотонных флуоресцентных микроскопах важно иметь те же положения фокусировки для инфракрасного лазерного света и для флуоресцентного света.
Наклейки на объективы
Ключевые параметры часто легко найти на этикетках с лазерной гравировкой на внешнем корпусе объектива. Некоторые примеры:
- Метка «50 × / 0,8» указывает на увеличение 50 × и числовую апертуру 0,8, вероятно, для сухого объектива.
- «Масло 100 × / 1,30» означает 100-кратное увеличение и числовую апертуру 1,30, достигаемую с иммерсионным маслом.
- «∞ / 0,17» указывает на объектив с коррекцией на бесконечность и компенсацией сферических аберраций для толщины покровного стекла 0.17 мм, а «160 / 0,17» означает объектив с конечной коррекцией для микроскопов с длиной трубки 160 мм и такой же толщиной покровного стекла.
- «WD 0,21» означает рабочее расстояние 0,21 мм.
- «DIC» обозначает конструкцию для визуализации с дифференциальным индексом контраста.
- «плоский флюор» указывает на планапохроматический объектив, то есть с коррекцией плоского поля и свойствами апохромата.
- «DIN» означает, что объектив изготовлен в соответствии со стандартом для микроскопов DIN (Deutsche Industrie Norm) относительно длины трубки, а «JIS» указывает на японский стандарт с несколько более длинной трубкой.
Резьба для объективов микроскопов
В большинстве случаев объектив микроскопа крепится к револьверной головке микроскопа с помощью резьбы. К сожалению, разные производители и для разных целей используют резьбы разных размеров.В некоторых случаях можно использовать специальные переходники для наложения объектива на микроскоп с разной резьбой.
Объективы для темнопольного освещения ориентировочно больше, что дает дополнительное пространство для осветительного света; поэтому они обычно используются с большей резьбой.
Объективы микроскопов прочие качества
Еще одним практически важным фактором является рабочее расстояние , то есть расстояние между объективом и объектом. Небольшие рабочие расстояния обычно требуются для объективов с высокой числовой апертурой, но также могут быть в некоторой степени оптимизированы в качестве цели проекта (возможно, несколько снижая числовую апертуру или поправку).Для объективов с масляной иммерсией относительно небольшое рабочее расстояние действительно хорошо, поскольку в противном случае потребовалось бы больше иммерсионной жидкости, и ее было бы труднее удерживать на месте.
Некоторые микроскопы позволяют подавать свет через объектив на образец. В этом случае важно, чтобы в объективе не происходило значительного рассеяния света.
Конструкция объективов микроскопов
Хотя объектив микроскопа иногда называют линзой объектива , обычно он содержит несколько линз.Чем выше числовая апертура и чем выше требуемое качество изображения, тем более сложные конструкции необходимы. Объективы микроскопов высокого класса могут также включать асферические линзы.
Разработка высококачественного объектива микроскопа — довольно сложная задача, для которой требуются значительный опыт в области оптики и мощное программное обеспечение для проектирования оптики. Такие конструкции предполагают сложные компромиссы, которые следует должным образом решать в зависимости от важности различных аспектов для конкретного приложения.
Фокусировка луча и оптоволоконная связь с объективами микроскопов
Объективыдля микроскопов иногда используются не только в микроскопии. Например, их можно использовать для точной фокусировки лазерных лучей с размером пятна несколько микрометров или даже менее 1 мкм. Если входной луч является коллимированным лучом, лучше всего подойдет объектив с коррекцией на бесконечность. Объектив должен иметь числовую апертуру, которая хорошо соответствует расходимости луча, связанной с требуемым размером пятна. Радиус входного луча также должен быть выбран соответствующим образом, т.е.е., рассчитывается исходя из необходимого размера пятна и фокусного расстояния. Трудность может заключаться в определении фокусного расстояния, поскольку тубус объектива часто показывает только увеличение, а преобразование в фокусное расстояние зависит от конструкции микроскопа.
Другое применение — запуск света в одномодовое волокно или коллимация света из такого волокна. Опять же, объектив должен иметь соответствующую числовую апертуру порядка световода. Подробнее читайте в статье о системах запуска волокна.
Для таких применений хроматические аберрации часто не представляют проблемы, поэтому хроматическая коррекция объектива не используется. Кроме того, не потребуется широкое поле зрения. С другой стороны, объектив микроскопа для видимого света может не иметь идеальных свойств, например для излучения ближнего инфракрасного света в оптоволокно, и его возможности управления мощностью ограничены (но обычно не указываются). Поэтому объектив микроскопа не может быть идеальным решением для такого применения.Однако его, возможно, придется использовать, например если нет других линз для достижения требуемого маленького размера пятна.
Поставщики
Справочник покупателя RP Photonics содержит информацию о 29 поставщиках объективов для микроскопов. Среди них:
Shanghai Optics
Специализированные объективы для микроскопов Shanghai Optics разработаны с помощью программ CAD, Solidworks и Zemax с использованием высококачественного стекла с высокими показателями преломления. Это позволяет нам изготавливать объективы микроскопов с очень низкой дисперсией и корректировкой большинства распространенных оптических артефактов, таких как кома, астигматизм, геометрические искажения, кривизна поля, сферическая и хроматическая аберрация.
Edmund Optics
Edmund Optics предлагает широкий спектр компонентов микроскопии, включая объективы микроскопов, инвертированные и стереомикроскопы, а также оптические фильтры, которые идеально подходят для использования в установках микроскопии. Объективы микроскопов доступны с различным увеличением и включают объективы с коррекцией на бесконечность, конечные сопряженные и отражающие объективы ведущих мировых брендов, таких как Mitutoyo или Olympus. Объективы микроскопов идеально подходят для различных исследовательских, промышленных, медико-биологических или общих лабораторных применений.Фильтры для микроскопии идеальны для выделения определенных длин волн в приложениях флуоресцентной визуализации.
Вопросы и комментарии пользователей
Здесь вы можете оставлять вопросы и комментарии. Если они будут приняты автором, они появятся над этим абзацем вместе с ответом автора. Автор принимает решение о приеме на основании определенных критериев. По сути, вопрос должен представлять достаточно широкий интерес.
Пожалуйста, не вводите здесь личные данные; в противном случае мы бы скоро удалили его.(См. Также нашу декларацию о конфиденциальности.) Если вы хотите получить личный отзыв или консультацию от автора, пожалуйста, свяжитесь с ним, например по электронной почте.
Отправляя информацию, вы даете свое согласие на возможную публикацию ваших материалов на нашем веб-сайте в соответствии с нашими правилами. (Если вы позже откажетесь от своего согласия, мы удалим эти данные.) Поскольку ваши материалы сначала рассматриваются автором, они могут быть опубликованы с некоторой задержкой.
См. Также: микроскопы, объективы, числовая апертура
и другие статьи в категориях зрение, дисплеи и визуализация, оптическая метрология
|
Если вам понравилась эта страница, поделитесь ссылкой со своими друзьями и коллегами, e.грамм. через соцсети: Эти кнопки общего доступа реализованы с учетом конфиденциальности! |
Код для ссылок на других сайтах
Если вы хотите разместить ссылку на эту статью на каком-либо другом ресурсе (например, на своем веб-сайте, в социальных сетях, дискуссионном форуме, Википедии), вы можете получить здесь требуемый код.
HTML-ссылка на эту статью:
Статья об объективах микроскопов
в
Энциклопедия фотоники RP
С изображением для предварительного просмотра (см. Рамку чуть выше):
 alt = "article">
alt = "article">
Для Википедии, например в разделе «== Внешние ссылки ==»:
* [https://www.rp-photonics.com/microscope_objectives.html
статья «Объективы микроскопов» в энциклопедии RP Photonics]
Новый оптический микроскоп для визуализации крупных эмбрионов и объемов тканей с субклеточным разрешением по всей области
Существенные изменения:
1) Есть несколько других методов визуализации, о которых следует упомянуть авторам, которые могут решить многие из проблем, которые они по праву поднимают. Птихографическая микроскопия Фурье решает многие из тех же проблем, что и мезолены (см. Следующую статью: Гоань Чжэн, Рорк Хорстмейер и Чанхуэй Ян, «Широкопольная фурье-психологическая микроскопия с высоким разрешением;» Nature Photonics, DOI: 10.1038 / nphoton.2013.187). Как их техника соотносится с флуоресцентной микроскопией Тальбота (см. Следующую статью: Шуо Панг, Чао Хан, Михоко Като, Пол В. Стернберг и Чанхуэй Ян; «Флюоресцентная микроскопия с широким и масштабируемым полем зрения на основе сетки Тальбота; «Optics Letters 37 (23): 5018-5020 (2012))?» Существуют и другие подходы к визуализации мозга с высоким разрешением и широким полем зрения, такие как серийная двухфотонная томография с высокой пропускной способностью, опубликованная в журнале Nature (Oh, S.W., Harris, J.A., et al. 2014. Мезомасштабный коннектом мозга мыши. Nature 508, 207-214).
Птихографическая микроскопия Фурье (FPM) дает изображение с очень широким полем обзора с субмикронным разрешением, а Zheng et al. Статья, опубликованная в Nature Photonics, является красивой демонстрацией этого метода 2D-изображения с очень широким полем зрения. Однако глубина резкости их инструмента намеренно велика (~ 0,3 мм), чтобы обеспечить большую устойчивость к ошибкам размещения предметных стекол микроскопа.Такая очень большая глубина фокуса не подходит для конфокальной лазерной сканирующей микроскопии, где небольшая глубина фокуса необходима для оптического сечения визуализируемого образца. Таким образом, наш инструмент был разработан таким образом, чтобы обеспечить глубину резкости примерно на два порядка меньше, чем у системы Zheng et al. Кроме того, в этой демонстрации FPM с широким полем зрения использовался объектив с малым значением N.A. только в воздухе. Хотя это приемлемо для тонких срезов тканей, ограничение погружением в воздух приведет к резкому снижению аксиального разрешения на глубине при визуализации толстых тканей из-за сферической аберрации, для которой в настоящее время нет корректирующих воротников или каких-либо других средств компенсации.Кроме того, как отмечает Zheng et al. в своей опубликованной работе они заявляют, что «текущий метод FPM не является флуоресцентным, поскольку профили флуоресцентного излучения останутся неизменными при освещении под разными углами». Поэтому, хотя FPM дает цветные изображения с высоким разрешением тонких образцов, таких как патологические слайды, он не подходит для флуоресцентной визуализации тонких или толстых образцов в 2D или 3D.
Редактор-рецензент спрашивает от имени рецензентов, как наш метод сравнивается с флуоресцентной микроскопией Талбота, и особо упоминает статью Pang et al.Как сообщается в работе Панга и др., Микроскопия Талбота обычно включает помещение образца в прямой контакт с датчиком изображения. Как мягко объясняют авторы, это «не стандартная процедура подготовки лаборатории», и из-за необходимости погружения и установки образцов в материал с высоким показателем преломления было бы непрактично для визуализации толстых тканей. Работа Pang et al. преодолевает это ограничение и делает возможным визуализацию образцов, пространственно отделенных от датчика, с флуоресцентным контрастом и исключительно широким полем обзора.Однако, хотя боковые характеристики довольно хороши (разрешение xy 1,2 микрона по сравнению с нашим субмикронным поперечным разрешением), заявленный предел глубины фокуса 60: м слишком велик, чтобы его можно было использовать для оптического сечения толстых объемов ткани. . Скорость визуализации 23 секунды прибора, описанного Pang et al. является привлекательным, но сообщаемая неравномерность пятен Талбота на площади 1 мм на 1 мм, составляющая 4,73%, очень высока по сравнению как со стандартными изображениями с широким полем, так и с нашими изображениями с широким полем с помощью Mesolens.
Работа Oh et al. на серийной двухфотонной томографии дает изображения флуоресцентного мозга мыши с очень высоким латеральным разрешением. Однако эти изображения требуют разрушения ткани из-за необходимости деления микротома, что делает невозможным повторное получение изображений. Что еще более важно, требуется сшивание и разбиение нескольких наборов данных из-за большого диаметра мозга мыши.
Рисунок 2 из Oh, S.W., et al. 2014. Мезомасштабный коннектом мозга мыши.Nature 508, 207-214 (частично воспроизведен из этой статьи слева, помечен как VISp), показывает коронарный разрез с центром места инъекции (вверху), а также пример аксонов, меченных EGFP, в типичном случае. подкорковые области (внизу). Однако сшивание и мозаика данных привели к лоскутному стеганому рисунку. Это особенно остро стоит на нижнем изображении, где наборы данных смещены по горизонтали от строки к строке, а между наборами данных есть темные линии, где информация не так четко видна.Как показано на вставке к нижнему изображению, также существуют значительные различия в интенсивности сигнала от одного набора данных к другому. Из-за непрерывного сканирования лазерного пятна, которое мы используем с Mesolens, мы не наблюдаем различий в сигнале флуоресценции от одной области изображения к другой, если она не присутствует в образце.
Мы внесли поправки во Введение, чтобы явно упомянуть эти другие методы:
«Фурье-птихографическая микроскопия (FPM) может дать изображение с очень широким полем обзора с субмикронным разрешением (см. Zheng et al.). […] Что еще более важно, требуется сшивание и разбивка нескольких наборов данных из-за большого диаметра ткани, а это может привести к плохой регистрации изображения и различиям в сигнале флуоресценции от одного набора данных к другому ».
Наконец, отметим, что некоторые коммерческие микроскопы описаны как способные отображать один и тот же образец от макромасштаба до микромасштаба (например, AZ100 Multizoom, Nikon), но при небольшом увеличении, которое позволяет получать изображения больших образцов, N.А у этих микроскопов низкая, и, следовательно, характеристики такие же, как у объектива с низкой АА. В этой статье мы представляем решение этой проблемы. Мы описываем мульти-иммерсионный объектив для широкопольной эпифлуоресцентной и лазерной сканирующей конфокальной микроскопии с рабочим расстоянием более 3 мм и полем обзора 6 мм, который корректируется для широкого диапазона длин волн, и демонстрируем его преимущества на больших биологических образцах.
2). Отказ автора от использования компьютерного тайлинга для создания больших изображений с более высоким разрешением кажется необоснованным.Коррекция неоднородности освещения намного лучше с тайлингом (и это больше проблема для светлого поля, а не для флуоресцентных изображений), а также с поправками на различную высоту фокуса в большом поле. Кроме того, как они отмечают, их мезолины не быстрее, чем укладка плитки. Им нужно лучше объяснить преимущества своих мезолей перед плиточным покрытием.
Набор данных, воспроизведенный выше из статьи Oh et al. предполагает, что разбиение наборов данных флуоресценции может привести к значительной неоднородности освещения.Хотя исправление возможно, артефакты все же остаются, особенно на больших неоднородностях. Некоторые из последних лучших показателей сшивания и мозаичного размещения наборов данных сообщаются как «бесшовные» (Legesse et al., Бесшовное сшивание изображений мозаичного сканирующего микроскопа, J. Microscopy 2015), но это не без ограничений. В этой работе Legesse et al. использовали изображения CARS, полученные при большой биопсии плоскоклеточного рака головы и шеи.
Однако, как свидетельствует оригинальное мозаичное изображение CARS ниже их образца (A), даже после базовой коррекции границы изображения все еще видны.Их метод, кажется, дает очень хорошее объединение и регистрацию изображений в большом масштабе (например, через ~ 6 мм изображения), как показано на (C), но не представлено масштабирование небольшой области, поэтому неясно, насколько точно могут быть мелкие детали. быть зарегистрированным. Мы также отмечаем, что общий уровень сигнала в (C) уменьшается примерно на 25% от уровня, полученного в (A) при применении их метода, что может оказаться ограничивающим при использовании слабо флуоресцентных образцов.
Помимо собственного алгоритма, работа Legesse et al.также представлено параллельное сравнение широко доступных алгоритмов сшивания и разбиения одного и того же набора данных. Изображение (D) представляет изображение после использования плагина сшивания ImageJ Grid / Collection, (E) показывает результаты использования плагина MosaicJ, а (F) показывает результат применения Microscoft ICE. Во всех случаях регистрация изображения плохая, и неоднородности четко видны.
Мы пришли к выводу, что объединение изображений и регистрация мозаичных наборов данных может дать некоторое преимущество перед нескорректированными данными, но непрерывное сканирование одного пятна по одному и тому же полю полностью устраняет эту неопределенность.Мы внесли поправки в Введение:
«В ходе экспериментов с лазерными сканирующими конфокальными микроскопами в середине 1980-х годов стало очевидно, что оптическое сечение, которое является основным преимуществом конфокального метода, не работает с доступными объективами с малым увеличением из-за их малой числовой апертуры (NA) ( 1). В образцах, таких как эмбрионы мышей на стадии 10–12,5 дня, когда основные органы развиваются (2), было невозможно увидеть отдельные клетки внутри, несмотря на достаточное латеральное (XY) разрешение.С тех пор сшивание и разбиение больших наборов данных стало возможным с использованием управляемых компьютером столиков для образцов, но это приводит к рисунку в шахматном порядке на конечном изображении из-за неоднородности освещения и ошибок высоты фокуса, которые часто не могут быть исправлены программным обеспечением. Доступны коммерческие программные алгоритмы и алгоритмы с открытым исходным кодом для выполнения сшивания и мозаичного выполнения, но неоднородности и проблемы с регистрацией набора данных четко видны (см. Legesse et al.) Из-за непрерывного сканирования лазерного пятна, которое мы используем с Mesolens, мы не наблюдаем различий в сигнале флуоресценции от одной области изображения к другой, если она не присутствует в образце.”
С Mesolens у нас также есть возможность переключения из режима медленного сканирования в режим быстрой камеры с большим полем обзора в той же фокальной плоскости. Это невозможно с объективами с большим увеличением. Это имеет значение как при поиске редких деталей изображения, так и при настройке компенсационных колец линзы объектива. Мы внесли изменения в Обсуждение:
«С Mesolens у нас также есть возможность переключения из режима относительно медленного лазерного сканирования в режим быстрой камеры с большим полем обзора в той же фокальной плоскости.Это невозможно с объективами с большим увеличением. Это важно как при поиске редких деталей изображения, так и при настройке компенсационных колец объектива ».
3) Оптическая пропускная способность в конфокальном режиме составила 11%. Как это соотносится с другими объективами? Мне это кажется низким.
По нашим данным, оптическая пропускная способность составляет 11% — это оптическая пропускная способность мезолин, сканирующих линз и сканирующих систем. Чтобы измерить оптическую пропускную способность, мы сравнили мощность лазера сразу после светоделителя в перископе (см. Рис. 1 в рукописи) с мощностью лазера в плоскости образца.Значительные потери возникают из-за переполнения верхнего зеркала перископа, что необходимо для достижения максимально плоского волнового фронта. Тогда возникают дополнительные потери в сканирующих зеркалах и в сканирующей линзе.
Хотя оптическая пропускная способность стандартного объектива микроскопа может составлять несколько десятков процентов, пропускание всей системы больше похоже на то, что мы измеряем здесь. Мы также отмечаем, что значение пропускания всей системы редко указывается в явном виде производителями микроскопов, но оно основано на заявленной мощности лазерной системы (например,грамм. 50 мВт для лазера KryptonArgon, работающего на длине волны 488 нм) и измерения максимальной средней мощности в плоскости образца (например, 3 мВт после линзы объектива), мы измеряем аналогичную величину оптических потерь с коммерческими конфокальными микроскопами по сравнению с Mesolens . Хорошее пропускание самой Mesolens также подтверждается нашим сравнением пропускания Mesolens с объективом 4x / 0,1 N.A. в режиме камеры. Мы также отмечаем, что заявленное значение 11% — это пропускание лазерного луча внутрь, а обратное изображение не обрезается на зеркале перископа.Мы внесли изменения в раздел
.Измерения оптических характеристик:
«Для измерения относительной оптической пропускной способности мезолин по сравнению с коммерческими линзами с малым увеличением и малой числовой апертурой (4x / 0,1, план, Nikon), светодиоды (HLMP2855,
Broadcom) использовался в качестве образца стандартной светимости (10). […] Хорошая передача самой Mesolens также подтверждается нашим сравнением передачи Mesolens с передачей 4x / 0.1 объектив N.A. в режиме камеры ».
4) Мезоленс не дает никаких улучшений по сравнению с другими целями с точки зрения рассеивания, поэтому он все еще требует очистки. Они говорят, что ни один из существующих микросопов не имеет всех характеристик целых зародышей, отображаемых с помощью мезолин, но не думают ли они, что световой микроскоп может подойти довольно близко с большей скоростью? Особенно при более низком разрешении по оси Z, что позволит получить более толстый световой лист с большим полем обзора.
Работа Jaehrling et al., 3DVisualization пучков нервных волокон с помощью ультрамикроскопии, Medical Laser Application, 2008, представляет световое изображение флуоресцентно меченых эмбрионов мыши E12.5, которые были очищены с использованием того же метода BABB, который использовался в нашей работе. Отметим, что авторы использовали объектив с 4-кратным увеличением и необычно высокой числовой апертурой (N.A. = 0,28), который больше не продается в Великобритании, и нам не удалось получить данные о характеристиках этого объектива. В рамках своего исследования авторы смоделировали пространственные профили интенсивности световых листов для различных полей зрения.
Однако, как утверждают авторы, невозможно изготовить световой лист, достаточно широкий для таких образцов толщиной менее 50 микрон. Это на порядок меньше, чем осевое разрешение мезолин. Световой щит с толщиной, сравнимой с осевым разрешением мезолин, может покрывать только поле, намного меньшее, чем 6 мм. Однако, как правильно предполагают рецензент и рецензенты, значительно снизив осевое разрешение до значения в несколько десятков микрон, можно будет получить изображение светового листа.
Тем не менее, мы ожидаем, что Mesolens, используемые в качестве собирающих линз объектива для микроскопии световых листов, будут полезным способом расширения микроскопии световых листов, а не просто эквивалентной технологией. Например, высокая эффективность сбора (примерно в 4 раза выше, чем у объектива с числовой апертурой x4 / 0,28, используемого Джерлингом и др.) Будет иметь большое преимущество при изучении образцов со слабой маркировкой, обеспечивая при этом преимущество уменьшения фотообесцвечивания и фототоксичности, обеспечиваемое стандартной микроскопией светового листа. .
5) Как они защищают линзы от коррозионных иммерсионных сред, таких как BABB?
Поскольку эмбрионы можно исследовать в различных оптически непохожих жидкостях, таких как вода, глицерин, масло и бензилбензоат (например, для очищающей жидкости BABB), необходимо было сделать линзу пригодной для использования с различными иммерсионными жидкостями и монтажными средами. . Mesolens был разработан для погружения в некоррозионные иммерсионные среды, такие как масло (тип DF), вода и глицерин.Мы используем BABB только в качестве монтажной среды, а образец и BABB отделяются от иммерсионной жидкости покровным стеклом типа 1.5.
6) На рис. 4а и б было взято одинаковое количество оптических срезов? Как программная деконволюция улучшает ситуацию? Я действительно впечатлен тем, насколько глубже освещение в образце. Это только из-за просвета, или это было увеличение мощности лазера или экспозиции / усиления по мере того, как они делали более глубокие секции? Единственным исключением из этого правила было окрашивание акридиновым оранжевым, которое, казалось, не проникало в центр эмбриона.
Мы внесли поправки в рукопись в разделе «Визуализация биологических образцов» и «Обсуждение»:
«Чтобы продемонстрировать превосходную способность Mesolens к сечению по сравнению со стандартной линзой объектива с сопоставимым увеличением, мы визуализировали тот же 10-дневный эмбрион мышей, очищенный и окрашенный акридиновым оранжевым, с помощью Mesolens и сухой линзы объектива с аналогичным увеличением (5x / 0,15 NA HCX PL Fluotar, Leica Microsystems), установленный на вертикальном лазерном сканирующем микроскопе.Эмбрион лежал на боку, так что XY-сканирование давало анатомически сагиттальный оптический срез. Изображения XZ показаны на рис. 4 (а) и (б). […] Мы не регулировали мощность лазера или усиление детектора при визуализации более глубоких тканей ».
Рецензент № 1:
Эта рукопись описывает мотивацию, разработку, создание и тестирование линзы, способной захватывать изображения с широким полем зрения и высоким разрешением, которую авторы называют мезолинз.Эта линза является очень необходимым дополнением к новым инструментам визуализации с полным креплением, чему способствовала популяризация очистки тканей (BABB, Scale, Clarity), а в последнее время и методов экспансионной микроскопии. Независимо от предвзятости читателя в пользу или против любого из этих методов, необходимость в объективе с высокими характеристиками и большим полем зрения не может быть оспорена.
Авторы создали рукопись, в которой четко и ясно представлены детали и особенности мезолин.Это гораздо больше, чем просто «реклама», которую могут соблазнить другие авторы.
Производительность отличная, хотя сложности и точность реализации мезонов могут ограничить ее широкое распространение.
У меня есть только одна проблема: пропускная способность мезолей сообщается как удивительно малое число, без комментариев. Авторы, с которыми встретились, подробнее расскажут о том, как это было измерено, и поместили это в контекст других объективов. Мое первое впечатление, когда я увидел это число, было то, что это, должно быть, ошибка в исполнении или в письменной форме.
Мы ответили на этот комментарий выше в нашем ответе на сводку, предоставленную редактором-рецензентом.
Рецензент № 3:
Есть еще пара других методов визуализации, о которых я бы хотел, чтобы они упомянули, которые могут решить многие из проблем, которые они по праву поднимают. Птихографическая микроскопия Фурье решает многие из тех же проблем, что и мезолены (см. Следующую статью: Гоань Чжэн, Рорк Хорстмейер и Чанхуэй Ян, «Широкопольная фурье-психологическая микроскопия с высоким разрешением;» Nature Photonics, DOI: 10.1038 / nphoton.2013.187). Как их техника соотносится с флуоресцентной микроскопией Тальбота (см. Следующую статью: Шуо Панг, Чао Хан, Михоко Като, Пол В. Стернберг и Чанхуэй Ян; «Флюоресцентная микроскопия с широким и масштабируемым полем зрения на основе сетки Тальбота; «Optics Letters 37 (23): 5018-5020 (2012))?» Существуют и другие подходы к визуализации мозга с высоким разрешением и широким полем зрения, такие как серийная двухфотонная томография с высокой пропускной способностью, опубликованная в журнале Nature (Oh, S.W., Harris, J.A., et al. 2014. Мезомасштабный коннектом мозга мыши. Nature 508, 207-214).
Мы ответили на этот комментарий выше в нашем ответе на резюме, предоставленное рецензирующим редактором.
Вот некоторые технические моменты, которые я хотел бы увидеть, адрес авторов:
1) Я действительно не согласен с их отказом от компьютерного тайлинга для создания больших изображений с более высоким разрешением, поскольку поправки на неоднородность освещения намного лучше (и это больше проблема для светлого поля, а не для флуоресцентных изображений). как те, которые могут корректировать различную высоту фокусировки на большом поле.Кроме того, как они отмечают, их мезолины не быстрее, чем укладка плитки. Им нужно лучше объяснить преимущества своих мезолей перед плиточным покрытием.
2) Оптическая пропускная способность в конфокальном режиме составила 11%. Как это соотносится с другими объективами? Мне это кажется низким.
Мы ответили на этот комментарий выше в нашем ответе на резюме, предоставленное рецензирующим редактором.
3) Мезоленс не дает никаких улучшений по сравнению с другими целями с точки зрения рассеивания, поэтому он все еще требует очистки.Они говорят, что ни один из существующих микросопов не имеет всех характеристик целых зародышей, отображаемых с помощью мезолин, но не думают ли они, что световой микроскоп может подойти довольно близко с большей скоростью? Особенно при более низком разрешении по оси Z, что позволит получить более толстый световой лист с большим полем обзора.
Мы ответили на этот комментарий выше в нашем ответе на резюме, предоставленное рецензирующим редактором.
4) Как они защищают линзы от коррозионных иммерсионных сред, таких как BABB?
Мы ответили на этот комментарий выше в нашем ответе на резюме, предоставленное рецензирующим редактором.
5) На рис. 4а и б было взято одинаковое количество оптических срезов? Как программная деконволюция улучшает ситуацию? Я действительно впечатлен тем, насколько глубже освещение в образце.


 com)
com) ru)
ru) ru)
ru) ru)
ru)