Как устроен гальванический элемент. Какие бывают типы гальванических элементов. Как работают различные виды гальванических элементов. Где применяются гальванические элементы.
Устройство и принцип действия гальванического элемента
Гальванический элемент представляет собой химический источник тока, в котором химическая энергия окислительно-восстановительной реакции преобразуется в электрическую энергию. Основными частями гальванического элемента являются:
- Два электрода (анод и катод), изготовленные из разных металлов
- Электролит — раствор, содержащий ионы
- Солевой мостик, соединяющий два полуэлемента
Принцип действия гальванического элемента основан на протекании окислительно-восстановительной реакции между веществами электродов. При этом:
- На аноде происходит процесс окисления — отдача электронов
- На катоде идет процесс восстановления — присоединение электронов
- Электроны движутся во внешней цепи от анода к катоду, создавая электрический ток
- Ионы в растворе замыкают электрическую цепь
Основные типы гальванических элементов
По устройству и принципу действия выделяют следующие основные типы гальванических элементов:
1. Химические гальванические элементы
В них электрическая энергия вырабатывается за счет химических реакций между электродами и электролитом. Примеры:
- Элемент Даниэля (медно-цинковый)
- Элемент Вольта (цинково-медный)
- Сухие гальванические элементы (угольно-цинковые, щелочные)
2. Концентрационные гальванические элементы
Состоят из одинаковых электродов, погруженных в растворы одного и того же электролита разной концентрации. ЭДС возникает из-за разности концентраций.
3. Топливные элементы
В них электрическая энергия вырабатывается за счет окисления топлива (например, водорода). Преимущество — высокий КПД и экологичность.
4. Аккумуляторы
Обратимые гальванические элементы, которые можно многократно заряжать и разряжать. Основные виды:
- Свинцовые (кислотные)
- Никель-кадмиевые
- Литий-ионные
Применение гальванических элементов
Основные области применения различных типов гальванических элементов включают:
- Портативные источники питания (батарейки, аккумуляторы)
- Автомобильные аккумуляторы
- Резервные источники питания
- Космические аппараты (топливные элементы)
- Медицинские имплантаты
- Измерительные приборы
Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов (ряд стандартных электродных потенциалов) играет важную роль при создании гальванических элементов. Он позволяет определить:
- Какой металл будет анодом, а какой катодом
- Направление движения электронов во внешней цепи
- Возможность протекания окислительно-восстановительной реакции
Чем левее расположен металл в ряду напряжений, тем легче он отдает электроны и тем более сильным восстановителем является.
ЭДС гальванического элемента
Электродвижущая сила (ЭДС) гальванического элемента — это разность потенциалов катода и анода в стандартных условиях. ЭДС можно рассчитать по формуле:
E = φкатода — φанода
где φкатода и φанода — стандартные электродные потенциалы катода и анода соответственно.
Факторы, влияющие на величину ЭДС:
- Природа электродов
- Концентрация растворов электролитов
- Температура
Электроды сравнения в электрохимии
Электроды сравнения используются для измерения электродных потенциалов других электрохимических систем. Основные виды электродов сравнения:
1. Стандартный водородный электрод
Состоит из платиновой пластинки, погруженной в раствор с активностью ионов водорода 1 моль/л, через который пропускается газообразный водород под давлением 1 атм. Его потенциал принимается за нуль.

2. Хлорсеребряный электрод
Представляет собой серебряную проволоку, покрытую слоем хлорида серебра и погруженную в насыщенный раствор хлорида калия. Отличается простотой конструкции и стабильностью потенциала.
3. Каломельный электрод
Состоит из ртути, покрытой слоем каломели (Hg2Cl2), в контакте с раствором хлорида калия известной концентрации. Широко применяется благодаря воспроизводимости потенциала.
Перспективы развития гальванических элементов
Основные направления совершенствования гальванических элементов включают:
- Повышение удельной энергоемкости
- Увеличение срока службы и числа циклов заряда-разряда
- Улучшение экологичности и безопасности
- Разработка новых электродных материалов и электролитов
- Создание гибких и тонкопленочных источников тока
- Развитие быстрозаряжаемых аккумуляторов
Перспективными направлениями являются литий-воздушные, натрий-ионные аккумуляторы, а также твердотельные источники тока.
Устройство и принцип действия гальванических элементов
⇐ ПредыдущаяСтр 7 из 20Следующая ⇒
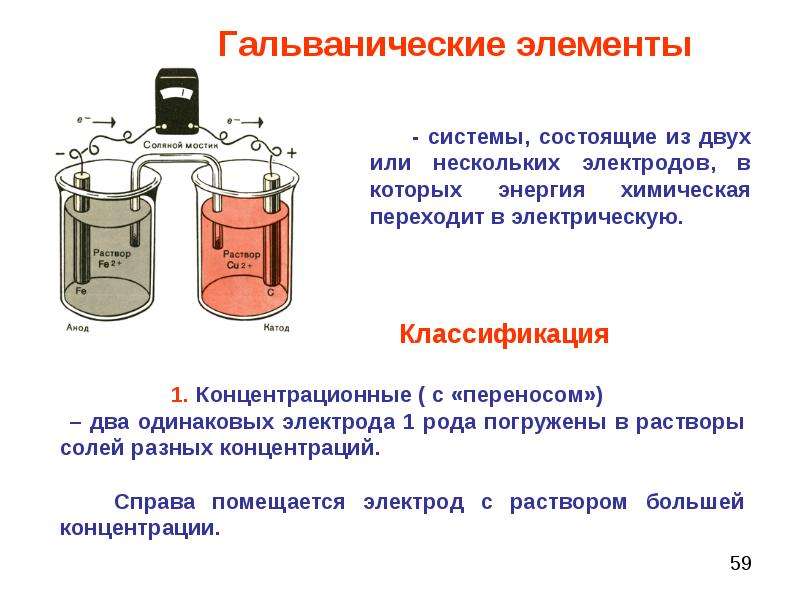
Гальванический элемент (ГЭ) — это устройство для превращения химической энергии в электрическую. ГЭ состоит из двух электродов (полуэлементов). Простейший полуэлемент состоит из металлической пластинки, опущенной в раствор своей соли. Более активный металл называется анодом. На его поверхности протекает процесс окисления. При работе ГЭ анод заряжается отрицательно. На менее активном металле, называемом катодом, протекает процесс восстановления. При работе гальванического элемента катод заряжается положительно. На рис.15 представлена схема медно-цинкового гальванического элемента Якоби-Даниеля.
Рисунок 15. — Медно-цинковый элемент Якоби-Даниеля
Медный и цинковый электроды соединены металлическим проводником, образующим внешнюю цепь гальванического элемента. Растворы солей CuSO 4 и ZnSO4 соединены между собой солевым мостиком, образующим внутреннюю цепь гальванического элемента. Солевой мо стик (электролитический ключ) — это стеклянная трубка, заполненная раствором электролита.
Цинковый электрод является анодом; на нем протекает процесс окисления:
Zn0 – 2e— Zn2+.
Катионы Zn2+ переходят в раствор, вследствие чего раствор приобретает положительный заряд, а электрод – отрицательный.
Электроны, отданные цинком, поступают во внешнюю цепь и мигрируют к меди.
Медный электрод является катодом; на нем протекает процесс восстановления:
Cu 2+ + 2e— Cu0.
Катионы Cu2+ принимают электроны, поступающие из внешней цепи, восстанавливаются и осаждаются на медном электроде. В результате раствор приобретает отрицательный заряд, а электрод – положительный.
Схема медно-цинкового гальванического элемента записывается следующим образом:
(-) Zn / Zn2+ // Cu2+/ Cu (+),
где / обозначает поверхность раздела металл-раствор, а также ОВ потенциал (электродный потенциал), возникающий на поверхности электрода вследствие того, что металл и раствор имеют разноименные заряды;
// обозначают границу раздела двух растворов, а так же диффузионный потенциал, возникающий из-за их разноименных зарядов.
Суммируя уравнения окислительно-восстановительных полуреакций, получаем уравнение суммарной токообразующей реакции:
Катод: Zn0 – 2e— Zn2+ 1
Анод: Cu 2+ + 2e— Cu0 1
Zn0 + Cu2+ Zn2+ + Cu0
Эдс гальванического элемента рассчитывают как разность окислительно-восстановительных потенциалов катода и анода:
Е=φ(катод) – φ(анод).
Помимо окислительно-восстановительных и диффузионных потенциалов, возникновение электрического тока в гальваническом элементе происходит за счет мембранных потенциалов, возникновение которых обусловлено неравномерным распределением заряженных частиц (например, ионов) по обе стороны мембраны. Именно такое распределение ионов характерно для клеток человека (таблица 6).
Таблица 6 — Ионный состав нервной клетки
| Ионы | Внутренняя среда | Внешняя среда |
| К+ | 400 ммоль/л | 20 ммоль/л |
| Na+ | 50 ммоль/л | 440 ммоль/л |
| Cl‾ | 120 ммоль/л | 550 ммоль/л |
Для каждого проникающего иона мембранный потенциал рассчитывается по уравнению Нернста:
где [X] внешн. среда и [x] внутр. среда — это концентрации иона во внешней и внутренней средах соответственно, моль/л;
n — заряд иона.
Мембранные потенциалы клеток называют биопотенциалами. Метод регистрации биопотенциалов используется при исследовании деятельности различных органов, например, при диагностике сердечных заболеваний (электрокардиография). Регистрация биопотенциалов мозга (электроэнцефалограмма) в ряде случаев позволяет судить о патологических нарушениях центральной нервной системы.
Классификация гальванических элементов по устройству
Различают три типа гальванических элементов: химические, концентрационные и топливные.
Химические гальванические элементы состоят из различных электродов. Примером является медно-цинковый элемент Якоби-Даниеля. Концентрационные элементы состоят из одинаковых электродов и отличаются только концентрацией электролитов них:
(–) Zn / ZnSO4 aq // ZnSO4 aq / Zn (+)
СМ(1) СМ(2)
В топливных элементах энергия, выделяющаяся при горении топлива, превращается в электрическую энергию:
С3Н8 + 5 О2 → 3 СО2 + 4 Н2О.
Классификация гальванических элементов по назначению
Различают элементы, используемые как химические источники тока, и элементы, применяемые для потенциометрических методов анализа.
Читайте также:
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ. СХЕМА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА. ТОКООБРАЗУЮЩАЯ РЕАКЦИЯ. ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
Самопроизвольно идущий окислительно-восстановительный процесс в определенных условиях может создавать электрическую энергию. Процессы превращения химической энергии в электрическую можно использовать для создания химических источников тока (ХИТ), простейший из которых гальванический элемент.
Гальванический элемент состоит из двух электродов, погруженных в электролиты, которые замыкаются электролитическим ключом.
КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
Металлический электрод — это металл, погруженный в раствор собственной соли, не является инертным, а участвует в электродной реакции. Cхематично такой электрод записывают в виде Ме|Меn+, где вертикальная черта обозначает границу между металлом и раствором. Уравнение Нернста для металлических электродов имеет вид
, (4)
где — концентрация ионов металла в растворе, моль/л.
Окислительно-восстановительный (редокс-) электрод – это инертный металл (токоподвод), погруженный в электролит, содержащий одновременно окисленную и восстановленную формы потенциалопределяющих частиц. В качестве инертного металла чаще всего используют платину Pt. Схематично такой электрод можно записать в виде Pt│Men+, Mem+. На поверхности инертного металла протекает окислительно-восстановительная реакция. Например, для окислительно-восстановительного электрода Pt│Sn4+, Sn2+ такими реакциями могут быть: Sn2+ — 2 ē → Sn4+; Sn4+ + 2 ē → Sn2+
Уравнение Нернста для редокс- систем включает концентрацию обоих катионов и имеет вид
(5)
где [окисл], [восст] – концентрации окисленной и восстановленной форм потенциалопределяющих частиц в полуреакции.
Газовыеэлектроды состоят из инертного металла, который находится в одновременном контакте с газом и раствором, содержащим ионы этого газа. Представителями газовых электродов являются водородный, кислородный, хлорный и другие электроды.
Водородный электрод состоит из платиновой пластинки, покрытой слоем мелкодисперсной платины («платиновой черни») и погруженной в раствор кислоты, содержащий ионы водорода. Через раствор непрерывно пропускается поток водорода, водород адсорбируется на поверхности платины, и на границе электрод/раствор устанавливается равновесие:
H+(раствор) + ē ↔ ½ H2(г) .
При давлении водорода, равном 101,3кПа (1 атм), активности (концентрации) ионов водорода 1 моль/л и Т=298К водородный электрод называется стандартным водородным электродом. Потенциал такого электрода принимается за ноль.
Уравнение Нернста для водородного электрода имеет вид
, (6)
где — стандартный электродный потенциал,
— концентрация ионов водорода в растворе, моль/л
-парциальное давление водорода над раствором, атм. равно 1 атм.
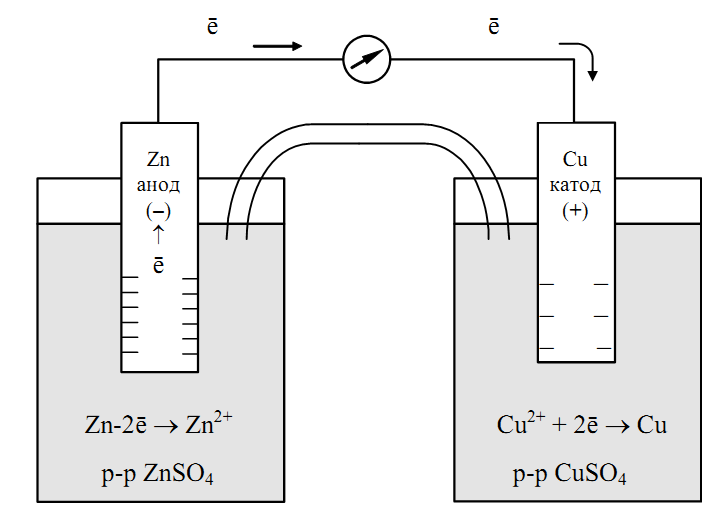
Рассмотрим работу гальванического элемента на примере элемента Даниэля-Якоби. Он представляет собой два сосуда с 1М растворами CuSO4 и ZnSO4, в которые погружены соответственно медная и цинковая пластинки, соединенные проводом. Сосуды соединены между собой трубкой, которая называется солевым мостиком, заполненной раствором электролита (например, KCl). Солевой мостик является электролитическим ключом.
Электрод с меньшим значением потенциала заряжается отрицательно, является анодом. Электрод с большим значением потенциала заряжается положительно, является катодом. На аноде протекает процесс окисления
(отдача электронов), на катоде – процесс восстановления (присоединение электронов).
Гальванические элементы принято записывать в виде схем. Анод со знаком (-) записывают слева, катод со знаком (+) записывают справа. Например, схема медно-цинкового гальванического элемента Даниэля-Якоби может быть представлена таким образом:
ē ē
(-) Zn|ZnSO4||CuSO4|Cu (+) или (-) Zn|Zn2+||Cu2+|Cu (+)
Одна вертикальная черта на схеме обозначает границу между металлом и раствором электролита, две черты – границу между растворами (солевой мостик).
При замыкании цепи электроны по внешней цепи пойдут от анода к катоду – от цинка к меди. При этом на электродах протекают следующие реакции:
(-) Анод: Zn – 2 ē → Zn2+ реакция окисления
(+) Катод: Cu2+ + 2 ē →Cu реакция восстановления
Суммируя процессы на катоде и аноде, получаем уравнение окислительно-восстановительной реакции, за счет которой в гальваническом элементе возникает электрический ток:
Zn + Cu2+ = Zn2+ + Cu
Такое уравнение называется уравнением токообразующей реакции.
ЭДС гальванического элемента рассчитывают как разность потенциалов катода и анода: Е = Ек– Еа.
Если концентрация ионов в растворе составляет 1 моль/л, то ЭДС называется стандартной. Стандартная ЭДС медно-цинкового элемента при —
Пример 7. Рассчитайте ЭДС свинцово-цинкового гальванического элемента при Т = 298К, в котором [Zn2+]=0,1моль/л и [Pb2+]=0,01моль/л. Укажите знаки полюсов, напишите уравнения электродных процессов, составьте схему гальванического элемента. Укажите направление движения электронов при замыкании цепи.
Решение: ЭДС гальванического элемента рассчитывают как разность
равновесных потенциалов катода и анода: Е= Ек – Еа.
Поскольку концентрации потенциалопределяющих ионов отличаются от 1 моль/л, рассчитаем по уравнению Нернста (ур. 4) значения электродных потенциалов цинка и свинца:
Электрод с меньшим значением потенциала является анодом (цинковый электрод). На нем протекает реакция окисления:
(-) А: Zn – 2 ē → Zn2+
Электрод с большим значением потенциала является катодом (свинцовый электрод), на нем протекает реакция восстановления:
(+) К: Pb2+ + 2 ē → Pb
Уравнение токообразующей реакции: Zn + Pb2+ → Zn2+ + Pb.
Схема гальванического элемента: (-) Zn│Zn2+(0,1M)║Pb2+(0,01M)│Pb (+).
Рассчитываем ЭДС гальванического элемента:
Е= Ек – Еа =
При замыкании цепи, электроны во внешней цепи пойдут от отрицательно заряженного электрода к положительно заряженному электроду, то есть — от цинка к свинцу.
Пример 8. Для гальванического элемента
Pt│Cr3+ (0,1 моль/л), Cr2+(0,01 моль/л)║Н+(рН=2)│Н2, Pt
рассчитать ЭДС, написать уравнения электродных процессов, составить уравнение токообразующей реакции, указать знаки полюсов. Определить направление движения электронов во внешней цепи.
Решение: данный гальванический элемент составлен из окислительно-
восстановительного и водородного электродов.
Потенциал окислительно-восстановительного электрода рассчитываем по уравнению Нернста:
Стандартный потенциал пары Сr3+/Cr2+ . Подставив данные условия задачи, рассчитаем потенциал окислительно-восстановительного электрода:
.
Второй электрод данного гальванического элемента является водородным электродом. Потенциал его, согласно уравнению Нернста:
Определяем катод и анод. Поскольку окислительно-восстановительный электрод имеет меньший потенциал, то в гальваническом элементе он будет играть роль анода (отрицательный полюс), а водородный электрод – катода (положительный полюс). После замыкания цепи на первом электроде будет протекать анодный процесс окисления, на втором – катодный процесс восстановления:
(-) А : Cr2+ — ē → Cr3+ 2
(+) К: 2 Н+ + 2 ē → Н2
Суммарная токообразующая реакция описывается уравнением
2 Cr2+ + 2 Н+ → 2 Cr3+ + Н2
Электроны при замыкании внешней цепи будут двигаться от отрицательного полюса к положительному: от хромового окислительно-восстановительного электрода к водородному.
ЭДС данного элемента
Пример 9. Какие процессы протекают на электродах в концентрационном гальваническом элементе, имеющем цинковые электроды, если у одного из электродов концентрация ионов цинка Zn2+ равна 1 моль/л, а у другого –
0,0001 моль/л? Какова ЭДС этого элемента? Напишите схему данного ГЭ.
Решение: Концентрационный гальванический элемент состоит из одинаковых электродов, погруженных в растворы своих солей различной концентрации. Определим потенциалы обоих электродов. Так как концентрация ионов цинка
у первого электрода равна 1 моль/л, то потенциал его будет равен стандартному потенциалу цинкового электрода: .
Потенциал второго электрода рассчитаем по уравнению Нернста:
Первый электрод является катодом, на нем после замыкания цепи протекает реакция восстановления (+) К: Zn2+ + 2 ē →Zn
Второй электрод, имеющий меньший потенциал, будет анодом, на нем протекает реакция окисления: (-) А: Zn — 2 ē →Zn2+
Токообразующая реакция в гальваническом элементе будет иметь вид:
Zn + Zn2+→ Zn + Zn2+
Рассчитываем ЭДС элемента: Е = Ек — Еа = — 0,763 –(-0,881) = 0,122 В.
Данный гальванический элемент можно отобразить схемой:
(-) Zn│Zn2+(0,0001 моль/л)║Zn2+(1 моль/л)│Zn (+)
Задания
4.Написать катодный и анодный процессы, уравнение токообразующей реакции и вычислить ЭДС гальванического элемента. Указать полярность электродов.
1. Fe| Fe+2 (1моль/л) || Ag+(0,1моль/л) |Ag
2. Cr| Cr+3 (2 моль/л ) || Cd+2 (1 моль/л )|Cd
3. Be| Be+2 (0,1моль/л) || Ni+2 (0,01моль/л) |Ni
4. Mn| Mn+2 (0,1 моль/л ) || Sn+2 (0,01 моль/л )|Sn
5. Al| Al+3 (2 моль/л ) || Cd+2 (0,1 моль/л )|Cd
6. Ni| Ni+2 (0,1 моль/л ) || Cu+2 (0,01 моль/л )|Cu
7. Mg| Mg+2 (1 моль/л ) || Zn+2 (0,01 моль/л )|Zn
8. Cd| Cd+2 (0,1 моль/л ) || Pb+2 (0,01 моль/л )|Pb
9. Fe| Fe+2 (0,01 моль/л ) || Fe+2 (1 моль/л )|Fe
10. Co|Co+2 (0,5 моль/л ) || Ni+2 (0,5 моль/л )|Ni
11. Zn| Zn+2 (1 моль/л ) || Cu+2 (0,01 моль/л )|Cu
12. Pt,H2|H+ (pH=4) || H+ (pH=2)|H2,Pt
13. Al|Al+3 (1 моль/л ) ||Al+3 (2 моль/л )|Al
14. Mn|Mn+2 (1 моль/л ) || Ni+2 (0,01 моль/л )|Ni
15. Ca|Ca+2 (0,1 моль/л) || Fe+2 (0,01 моль/л )|Fe
16. Pb|Pb+2 (1 моль/л ) || Ag+ (0,1 моль/л )|Ag
17. Be|Be+2 (0,001 моль/л ) || Fe+2 (0,001 моль/л )|Fe
18. Pt|Cr+3 (0,1 моль/л ),Cr+2 (0,1 моль/л) || Fe+3 (0,1 моль/л ), Fe+2 (0,1 моль/л)|Pt
19. Zn|Zn+2(1 моль/л ) || Fe+2 (0,01 моль/л)|Fe
20. Al|Al+3 (2 моль/л ) || Cu+2 (0,01 моль/л)|Cu
21. Be|Be+2 (1 моль/л ) || Cd+2 (0,01 моль/л )|Cd
22. Mn|Mn+2 (0,01 моль/л ) || Fe+2 (0,01 моль/л )|Fe
23. Fe|Fe+2 (1 моль/л ) || Sn+2 (0,01 моль/л)|Sn
24. Mg|Mg+2 (0,1 моль/л ) || Ni+2 (0,01 моль/л )|Ni
25. Ag|Ag+ (0,001 моль/л) || Ag+ (0,1 моль/л )|Ag
26. Fe| Fe+2 (0,005 моль/л ) || Pb+2 (0,005 моль/л )|Pb
27. Ca|Ca+2 (1 моль/л ) || Mg+2 (0,01 моль/л)|Mg
28. Mn|Mn+2 (0,01 моль/л ) || Zn+2 (0,01 моль/л )|Zn
29. Pb|Pb+2 (0,1 моль/л ) ||Cu+2 (0,01 моль/л)|Cu
30. Zn|Zn+2 (10-4 моль/л ) || Sn+2 (10-2 моль/л )|Sn
31. Cd| Cd+2 (10-4 моль/л ) || Cu+2 (10-2 моль/л )|Cu
32. Ni| Ni+2 (0,01 моль/л ) || Ag+ (1 моль/л )|Ag
33. Mg| Mg+2 (0,001 моль/л ) || Mg+2 (1 моль/л )|Mg
34. Ca| Ca+2 (1 моль/л )|| Cr+2 (0,01 моль/л )|Cr
35. Mn|Mn+2 (0,01 моль/л ) || Pb+2 (0,01 моль/л )|Pb
36. Al| Al+3 (2 моль/л ) || Cr+2 (0,01 моль/л )|Cr
37. Be| Be+2 (1 моль/л ) || Sn+2 (0,01 моль/л )|Sn
38. Ni| Ni+2 (1 моль/л )|| Fe+3(2 моль/л )|Fe
39. Pt , H2|H+ (pH=4) || Ag+ (1 моль/л )|Ag
40. Mg| Mg+2 (10-2 моль/л ) || Cu+2 (10-2 моль/л )|Cu
41. Cu| Cu+2 (0,01 моль/л ) || Ag+ (0,1 моль/л )|Ag
42. Ca| Ca+2 (0,01 моль/л ) || Be+2 (1 моль/л )|Be
43. Zn| Zn+2 (0,01 моль/л ) || Ni+2 (1 моль/л )|Ni
44. Al| Al+3 (2 моль/л ) || Fe+2 (0,01 моль/л )|Fe
45. Ca| Ca+2 (1 моль/л ) || Al+3 (0,5 моль/л )|Al
46. Fe| Fe+3 (2 моль/л ) || Cu+2 (0,01 моль/л )|Cu
47. Zn| Zn+2 (1 моль/л ) || Pb+2 (0,01 моль/л )|Pb
48. Sn| Sn+2 (0,01 моль/л ) || Ag+(0,1 моль/л )|Ag
49. Zn| Zn+2 (10-2 моль/л ) || H+(pH=2)|H2,Pt
50. Pt| Sn+4 (0,1 моль/л ),Sn+2 (0,1 моль/л ) || Hg+2 (1 моль/л )|Hg
51. Al| Al+3 (2 моль/л ) || Cd+2 (0,01 моль/л )|Cd
52. Pt|Cr+3(10-2 моль/л ),Cr+2(0,1 моль/л ) || Sn+4 (10-3 моль/л ),Sn+2(0,1 моль/л )|Pt
53. Ni| Ni+2 (0,01 моль/л ) || Pb+2 (0,01 моль/л )|Pb
54. Mg| Mg+2 (10-4 моль/л ) || H+(pH=2)|H2,Pt
55. Cd| Cd+2 (10-2 моль/л ) || Cd+2 (1 моль/л )|Cd
56. Be| Be+2 (10-4 моль/л ) || Zn+2 (10-2 моль/л )|Zn
57. Mn| Mn+2 (1 моль/л ) || Cu+2 (0,1 моль/л)|Cu
58. Ca| Ca+2 (0,01 моль/л ) || Pb+2 (0,01 моль/л )|Pb
59. Sn| Sn+2 (0,01 моль/л ) || Cu+2 (1 моль/л )|Cu
60. Cd| Cd+2 (10-1 моль/л ) || Sn+2 (10-1 моль/л )|Sn
61.Pt|Fe+3(10-2 моль/л ),Fe+2(0,1 моль/л ) || Sn+4(10-2 моль/л ),Sn+2(0,1 моль/л )|Pt
62.Pt|Co+3(10-2 моль/л ), Co+2 (0,1 моль/л ) ||Sn+4 (0,1 моль/л ),Sn+2 (10-2 моль/л )|Pt
63. Pt|Fe+3(0,1 моль/л ), Fe+2(10-2 моль/л ) ||Au+ (10-2 моль/л ), Au+3 (0,1 моль/л )|Pt
Основные типы электродов и гальванических элементов. — МегаЛекции
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Сейчас широко распространены следующие гальванические элементы:
| Тип | ЭДС (В) | Достоинства |
| угольно-цинковые (солевые) | 1,5 | дешёвые |
| щелочные (жаргонное название — алкалиновые) | 1,6 | высокий ток, ёмкие |
| никельоксигидроксидные (NiOOH) | 1,6 | высокий ток,очень ёмкие |
| литиевые | 3,0 | очень высокий ток, очень ёмкие |
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
Zn | ZnSO4 || CuSO4 | Cu,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || — солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu2+ + 2e = Cu
Левый электрод: Zn2+ + 2e = Zn
Общая реакция: Cu2+ + Zn = Cu + Zn2+
Типы гальванических элементов window.top.document.title = «7.4.1. Типы гальванических элементов»;
Концентрационные элементы состоят из одинаковых электродов, отличающихся активностями потенциалопределяющего иона ЭДС этих элементов обычно очень мала. Концентрационные элементы используются при определении pH и концентраций труднорастворимых солей.
В топливных гальванических элементах (электрохимических генераторах) процесс окисления некоторых видов топлива используется для непосредственного получения электрической энергии. Основным их преимуществом является принципиальная возможность достижения очень высоких КПД использования топлив.
В щелочном водородно-кислородном топливном элементе
где M1 и M2 – проводники первого рода, в основном серебро, металлы платиновой группы и некоторые другие, играющие роль катализаторов электродных процессов и токоотводов, на аноде идет реакция
а на катоде –
Суммарный процесс соответствует реакции горения водорода:
Батарея топливных элементов с устройствами для подвода топлива и окислителя, вывода продуктов реакции, поддержания и регулирования температуры, называется электрохимическим генератором. Кислородно-водородные генераторы применяются на космических кораблях. Они обеспечивают космический корабль и космонавтов не только энергией, но и водой, которая является продуктом реакции в топливном элементе.
Аккумуляторами называются обратимые гальванические элементы многоразового действия. При пропускании через них электрического тока (зарядке) они накапливают химическую энергию, которую потом при их работе (разрядке) отдают потребителю в виде электрической энергии. Наиболее распространены два вида аккумуляторов: кислотный (свинцовый) и щелочные.
Анод заряженного свинцового аккумулятора состоит из свинца, катод – из диоксида свинца. Металлический тип проводимости PbO2 делает его пригодным для работы в качестве электрода. Электролитом служит раствор H2SO4 (32–39 %), в котором PbSO4 и PbO2 малорастворимы.
Схему аккумулятора можно изобразить так:
|
|
Анодный процесс работающего аккумулятора
катодный процесс –
Таким образом, в свинцовом аккумуляторе осуществляется реакция
При зарядке протекает обратная реакция и электроды меняют свои функции: катод становится анодом, а анод – катодом. ЭДС свинцового аккумулятора зависит от отношения активности кислоты и воды:
В процессе работы аккумулятора концентрация кислоты падает, а следовательно, падает и ЭДС. Когда ЭДС достигает 1,85 В, аккумулятор считается разрядившимся. При более низкой ЭДС пластины покрываются тонким слоем PbSO4 и и аккумулятор разряжается необратимо. Во избежание этого аккумулятор периодически подзаряжают.
В заряженном щелочном железо-никелевом аккумуляторе анодом служит железо, катодом – гидроксид никеля (III), электролит – 20%-й раствор KOH:
|
|
При работе аккумулятора на аноде происходит окисление железа:
на катоде – восстановление гидроксида никеля (III):
Суммарная активность процесса:
В уравнении Нернста для данного аккумулятора под знаком логарифма стоят не концентрации, а произведения растворимости ПР участвующих в этой реакции труднорастворимых веществ:
ЭДС щелочного аккумулятора не зависит от концентрации щелочи, поскольку в выражение под знаком логарифма входят постоянные величины.
Аналогично работают щелочные кадмий-никелевый и серебряно-цинковый аккумуляторы:
Водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал платины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н+ + 2e− = H2
то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.
ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
Схема стандартного водородного электрода:
1. Платиновый электрод.
2. Подводимый газообразный водород.
3. Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.
4. Водяной затвор, препятствующий попаданию кислорода воздуха.
5. Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
Хлорсеребряный электрод (ХСЭ) благодаря стабильности потенциала и простоте конструкции является одним из наиболее часто употребляемых в лабораторной практике электродов сравнения. Представляет собой серебряную пластинку или проволочку, покрытую слоем малорастворимой соли серебра (обычно — хлорида) и опущенной в насыщенный раствор хлорида калия. Схематически записывается как: Ag|AgCl|KCl|Cl−.
Потенциалоопределяющим для такого электрода является анион хлорида в равновесии: AgCl(s) ↔ Ag+ + Cl−
При 25 °С потенциал насыщенного ХСЭ составляет 0,222 В[1].
ЭЛЕКТРОДЫ СРАВНЕНИЯ, электрохим. системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью измерения абс. величины потенциала отдельного электрода. В принципе в качестве электрода сравнения может служить любой электрод в термодинамически равновесном состоянии, удовлетворяющий требованиям воспроизводимости, постоянства во времени всех характеристик и относит, простоты изготовления. Для водных электролитов наиб, часто применяют в качестве электродов сравнения водородный, каломельный, галогеносеребряные, оксидно-ртутный и хингидронный электроды.
Водородный электрод сравнения представляет собой кусочек платиновой фольги или сетки, покрытый слоем электролитич. Pt и погруженный частично в р-р, через к-рый пропускают Н2. При адсорбции на электроде образуются адсорбир. атомы Надс. Электродные р-ции на водородном электроде сравнения описываются ур-ниями: Н2 2Надс 2Н+ + 2е (е — электрон). Водородный электрод при давлении водорода рН2 равном 1 атм (1,01 х 105 Па), термодинамич. активности ионов водорода в р-ре аН+, равной 1, наз. стандартным водородным электродом, а его потенциал условно принимают равным нулю. Потенциалы других электродов, отнесенные к стандартному водородному электроду, составляют шкалу стандартных электродных потенциалов (см. Стандартный потенциал). Для водородного электрода сравнения Нернста уравнение записывается в виде:
где Т — абс. т-ра; F — постоянная Фарадея; R — газовая постоянная. При рН2 = 1 атм электродный потенциал
Используется в широком диапазоне рН — от значений, соответствующим конц. к-там, до значений, соответствующим конц. щелочам. Однако в нейтральных р-рах водородный электрод сравнения может нормально функционировать лишь при условии, что р-р обладает достаточно хорошими буферными св-вами (см. Буферный раствор). Это связано с тем, что при установлении равновесного потенциала на платинированной платине, а также при пропускании тока через водородный электрод сравнения появляется (или исчезает) нек-рое кол-во ионов Н+, т. е. изменяется рН р-ра, что особенно заметно в нейтральных средах. Водородный электрод применяют в широком интервале т-р, отвечающем существованию водных р-ров. Следует, однако, учитывать, что при повышении т-ры парциальное давление водорода падает вследствие роста давления паров р-рителя и обусловленное этим изменение потенциала электрода сравнения соответствует ур-нию
, где р — барометрич. давление (в кПа), a ps — суммарное давление насыщ. паров над р-ром (кПа). Возможность использования водородного электрода в орг. средах требует спец. проверки, т. к. Pt может катализировать процессы с участием орг. соед., вследствие чего нарушается равновесие электродной р-ции и электрод приобретает стационарный потенциал, отличный от равновесного.
Каломельный электрод сравнения изготавливают, используя ртуть и р-ры каломели в хлориде калия. Электродная р-ция на этом электроде отвечает ур-нию: 2Hg + 2Сl— Hg2Cl2, а соответствующее ур-ние Нернста имеет вид:
где E0 — стандартный потенциал. В зависимости от концентрации КС1 различают насыщенный, нормальный и децинормальный каломельные электроды сравнения. Эти электроды сравнения хорошо воспроизводимы, устойчивы и пригодны для работы при т-рах до 80 °С. При более высоких т-рах начинается разложение хлорида ртути. Часто каломельный электрод сравнения подсоединяют через солевой мостик, состоящий из концентриров. р-ра КС1 для снижения диффузионного потенциала. Потенциал Е каломельного электрода сравнения зависит от т-ры, причем температурный коэф. минимален для децинормального электрода, для к-рого Е =0,3365 — 6 х 10-5(t-25), где t — т-ра (°С).
Галогеносеребряные электроды сравнения представляют собой серебряную проволоку, покрытую галогенидом серебра, к-рый наносится путем термич. или электрохим. разложения соли серебра. Электродная р-ция отвечает ур-нию: Ag + Hal— AgHal + е (Hal — галоген), а ур-ние Нернста имеет вид: .
Удобны при работе с электрохим. ячейками без жидкостного мостика, применимы как в водных, так и во мн. неводных средах, устойчивы при повышенных т-рах. В области т-р 0-95 °С потенциал хлорсеребряного электрода сравнения описывается ур-нием: E=0,23655— 4,8564 x 10-4t — 3,4205 x 10-6t2 + 5,869 x 10-9t3.
Оксидно-ртутный электрод сравнения приготавливают из ртути и насыщенных р-ров оксида ртути в водном р-ре щелочи. Электродная р-ция: Hg2O + 2e + H2O 2Hg + 2OH ;
ур-ние Нернста:
Удобен при работе в щелочных р-рах, т. к. при этом легко реализовать цепи без жидкостного соединения.
Хингидронный электрод сравнения представляет собой платиновую проволочку, опущенную в насыщ. р-р хингидрона. Электродная р-ция: С6Н4(ОН)2 С6Н4О2 + 2Н+ + 2е. Стандартный потенциал E° = 0,6992 В. Используется в интервале рН 0-6, а в буферных р-рах в отсутствие сильных окислителей — до рН 8,5. В интервале т-р 0-50 °С потенциал хингидронного электрода сравнения выражается ур-нием: Е = 0,6992 — 7,4 x 10-4(t -25) + [0,0591 + 2 x 10-4(t -25)] lgaН+ .
При измерениях в неводных средах в принципе можно применять водные электроды сравнения, если создать воспроизводимую границу водного и неводного р-ров и учитывать возникающий на этой границе диффузионный потенциал. Часто в неводных средах используют электроды сравнения на основе серебра в р-ре его соли.
В расплавленных солевых системах наиболее часто используются электроды сравнения, основанные на паре AgI/Ag, к-рая стабильна в разл. расплавах.
Потенциалы водных электродов сравнения по отношению к стандартному водородному электроду при 25 °С приведены в табл.:
| Электрод | Потенциал, В |
| Насыщенный каломельный: Hg | Hg2Cl2, насыщенный КС1 | 0,2412 |
| Нормальный каломельный: Hg| Hg2Cl2, 1M КС1 | 0,2801 |
| Децинормальный каломельный: Hg| Hg2Cl2, 0,1M KC1 | 0,3337 |
| Хлорсеребряный: Ag | AgCl, насыщенный КС1 | 0,197 |
| Оксидно-ртутный: Hg| HgO, 0.1M NaOH | 0,926 |
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Гальванический элемент вторичный — Справочник химика 21
Процессы, протекающие на цинковом электроде при разряде солевых марганцево-цинковых гальванических элементов. Вторичные процессы при разряде [c.48]Вторичный элемент — гальванический элемент с обратимой реакцией ячейки. [c.93]
По характеру работы все известные разновидности ХИТ делятся на две группы гальванические элементы, или первичные источники тока, и электрические аккумуляторы, или вторичные источники тока. [c.865]
Химические цепи имеют большое практическое значение. Разнообразные химические источники тока — первичные (гальванические элементы) и вторичные (аккумуляторы) — представляют собой химические цепи. Рассмотренная водородно-кислородная, цепь является одним из видов так называемых топливных элементов. Такие элементы представляют собой электрохимические системы, которых протекает реакция окисления топлива или продуктов его переработки (водорода, оксида углерода, водяного газа и др.). Элементы характеризуются высоким коэффициентом использования топлива (70—80%) по сравнению с 30—40% теплосиловых установок, производящих электроэнергию. Несмотря на то что при создании топ- [c.488]
ХИТ состоят из одного или нескольких гальванических элементов, соединенных параллельно или последовательно, ХИТ генерируют постоянный ток. Химические источники тока, применяемые на практике, можно разделить на три основных типа первичные, вторичные и топливные элементы. [c.274]
В отличие от простых (первичных) гальванических элементов (см. 8.4) аккумуляторы являются вторичными химическими источниками тока. [c.219]
Если в этом гальваническом элементе вместо соляной кислоты взять раствор хлорида натрия, то в общем течение процесса не изменилось бы. Отличием его были бы только вторичные реакции. На катоде, помимо водорода, образуется гидроксид натрия [c.298]
Аккумуляторами называются гальванические элементы, химическая реакция в которых обратима. Мы имеем здесь в виду не термодинамическую обратимость протекания реакции при работе аккумулятора, а возможность регенерирования электродов и электролита пропусканием тока в обратном направлении. В абсолютном большинстве гальванических элементов регенерация продуктов работы элемента и вторичное использование его оказываются практически невозможными такие элементы перестают быть источниками тока, когда реакция достигает состояния равновесия. [c.32]
По характеру работы химические источники электрической энергии делятся на первичные, или собственно гальванические элементы в узком смысле слова, и вторичные, или электрические аккумуляторы. [c.13]
Над изысканием мощных и дешевых химических источников электрической энергии долгое время работал академик Б. С. Якоби (1801—1874). Он разработал ряд новых гальванических элементов, среди которых особый интерес представляет предложенный им в 1836 г. медно-цинковый элемент с нейтральным электролитом. Элемент, предложенный Якоби, более ста лет находил практическое применение. Б. С. Якоби принадлежит также идея использования вторичного тока элементов для практических целей. [c.14]
Аккумуляторами или вторичными элементами называются гальванические элементы, в которых вещества, израсходованные при разряде, регенерируются при обратном пропускании электрического тока. В соответствии с этим, очевидно, все обратимые гальванические элементы могут принципиально служить электрическими аккумуляторами. Однако практическое применение в качестве аккумуляторов имеют немногие из них. Техническую ценность имеют лишь те элементы, электролит которых состоит из одной жидкости, а в результате токообразующей реакции на электродах образуются твердые, практически нерастворимые вещества. В настоящее время большое практическое значение имеют только аккумуляторы двух типов — свинцовые и щелочные. [c.81]
Гальванические элементы, применяемые на практике для получения электрической энергии, делятся на первичные и вторичные. [c.200]
Пленка продуктов коррозии образуется только при im + + / > 0. Электрическое сопротивление ее незначительно и при образовании пленки не изменяется ток гальванических элементов, действующих вдоль трасс подземных трубопроводов. Для скорости коррозии на внешней поверхности трубы при наличии вторичных явлений получаем следующее выражение [c.46]
Источниками малого на пряжения могут быть специальные понижающие трансформаторы с вторичным напряжением 12— 36 В, батареи гальванических элементов, аккумуляторы, выпрямительные установки и преобразователи. В
Схема гальванического элемента. 145 — 146
Схема кобальто-хромового гальванического элемента
Задача 8.
Составить схему гальванического элемента, в котором электродами являются два металла Co/Cr, опущенные в растворы их солей с концентрацией ионов 1 моль/л. Описать процессы, которые протекают на катоде и аноде, и вычислить ЭДС гальванического элемента.
Решение:
Электродные потенциалы металлов:
E(Cr3+/Cr) = -0,74 B; E(Co2+/Co) = -0,28 B.
Следовательно, в гальваническом элементе, в котором электродами являются два металла Co/Cr, опущенные в растворы их солей с концентрацией ионов 1 моль/л, электроны будут перемещаться от электрода с более положительным значением стандартного потенциала к электроду с более отрицательным значением стандартного потенциала. Так как электродный потенциал собальта (-0,28 B) более электроположителен чем у хрома (-0,74 B), то электроны будут перемещаться от кобальтового электрода к хромовому, т.е. кобальтовый электрод будет катодом, хромовый — анодом.
Тогда схема гальванического элемента будет иметь вид:
(-)Со|Co2+(1M)||Cr3+(1M)|Cr(+)
На катоде протекает реакция восстановления:
Co2+ + 2 = Со0
На аноде будет протекать процесс окисления:
Cr0 — 3 = Cr3+
Если электроды опущены в растворы их солей с концентрацией ионов 1 моль/л, то значения потенциалов их при этой концентрации будут равны их стандартным электродным потенциалам.
Теперь рассчитаем ЭДС, получим:
ЭДС = Е(катод) — Е(анод) = -0,28 — (-0,74) = +0,46 В.
Схема гальванического элемента составленного из кобальта и железа
Задача 146.
Дать схему гальванического элемента составленного из кобальтовой и железной пластинок, опущенных в 1М растворы их сульфатов. Указать направление движения электронов в сети и ионов в растворе. Написать уравнения катодного и анодного процессов во время работы элемента и вычислить ЭДС элемента.
Решение:
Электродные потенциалы металлов:
E(Fe2+/Fe) = -0,44 B; E(Co2+/Co) = -0,28 B.
Следовательно, в гальваническом элементе, в котором электродами являются два металла Co/Fe, опущенные в растворы их сульфатов с концентрацией ионов 1 моль/л, электроны будут перемещаться от электрода с более положительным значением стандартного потенциала к электроду с более отрицательным значением стандартного потенциала. Так как электродный потенциал собальта (-0,28 B) более электроположителен чем у хрома (-0,74 B), то электроны будут перемещаться от кобальтового электрода к железной пластинки, т.е. кобальтовая пластинка будет катодом, железная пластинка — анодом.
Тогда схема гальванического элемента будет иметь вид:
(-)Со|CoSO4(1M)||FeSO4(1M)|Fe(+)
На катоде протекает реакция восстановления:
Co2+ + 2 = Со0
На аноде будет протекать процесс окисления:
Fe0 — 2 = Fe2+
Если электроды опущены в растворы их солей с концентрацией ионов 1 моль/л, то значения потенциалов их при этой концентрации будут равны их стандартным электродным потенциалам. К катоду будут двигаться ионы Со2+ и там разряжаться, а к аноду будут двигаться ион SO42- которые соединяются с ионами Fe2+, образуя FeSO4:
Fe2+ + SO42- = FeSO4.
Теперь рассчитаем ЭДС, получим:
ЭДС = Е(катод) — Е(анод) = -0,28 — (-0,44) = +0,16 В.
Гальванический элемент — определение гальванического элемента по The Free Dictionary
Два электрических электрода (проводника), поглощенные электролитом, называются гальваническим элементом в честь Луиджи Гальвани, врача, физика, биолога и философа, бывшего студента (и до сих пор одного из старейших и действующих международных образовательных институтов). в Европе), Болонский университет, Италия. Гальваническая коррозия может возникать, когда два металла, имеющие разный статус в электрохимической среде, находятся во взаимном взаимодействии в структуре гальванического элемента и подвергаются воздействию ионопроводящего электролита.Заголовок: Рисунок 1: Схема экспериментальной установки для (а) мониторинга гальванических элементов и (б) измерения LPR. Работа, описанная здесь, была предпринята для изучения жизнеспособности нескольких возможных электрохимических методов для характеристики эффективности выбранного покрытия для стальных SPR и их влияние на последующее поведение заклепки как катода гальванического элемента, включая соседний магниевый сплав. Другие темы включают гальванический элемент, сделанный из обрезков кожуры ананаса, метод подавления TA для кодированных PR-каналов, базовые алгоритмы коррекции выталкивания для перпендикулярной магнитной записи систем, отработанного карбида кремния в качестве наполнителя для смесей натурального каучука, тонких пленок оксида тантала и поверхностного критического магнитного поля слоистых магнитных сверхпроводников.Процесс, используемый при гальванике, называется электроосаждением; этот процесс аналогичен действию гальванического элемента в обратном направлении. Мохаммад Абу Аль Джду, менеджер программы Intel в Министерстве образования, объяснил, что студенты также преуспели в категории химии и биохимии, как Абдалла Бани Исса из Центра предпринимательства Аль-Кура, который занял второе место за свой проект, в котором в качестве батареи используется малогабаритный гальванический элемент Mg / Cu. Он был получен разными методами: нерегулярные агрегаты частиц и микродиски с помощью электрохимического процесса [1], пленки микрозерен с помощью метода необратимого гальванического элемента [ 2], иерархические кристаллиты путем простого осаждения [3], круглые наночастицы с однородными размерами путем соосаждения при комнатной температуре [4], сферы и гантели путем простой водной минерализации [5], нанокристаллы путем синтеза с помощью микроволн [6], наноструктурированный материал путем микроэмульсии, опосредованные сольвотермической обработкой [7], и порошки, полученные путем соосаждения и сочетания микроволнового и гидротермального воздействия [8].Два металла и лазанья действуют как гальванический элемент, и часть алюминия может мигрировать из фольги и оседать на поверхности лазаньи. Эта локальная пустота на защитной поверхности может образовывать гальванический элемент. локальный гальванический элемент, недостаток кислорода вокруг небольшой площади создает анод.Аннотация: В статье представлены результаты, достигнутые по корреляции количества веществ, разделенных на двух электродах гальванического элемента, с выходом по току, силой и временем, принимая учитывать исходный состав ванны электроосаждения сплава Ni-Fe при различных технологических параметрах.Кроме того, «частичная замена медных трубопроводов может привести к созданию гальванического элемента», — говорится в отчете Великобритании.Гальванический элемент с транспортом — Большая химическая энциклопедия
До сих пор рассматривался элемент, содержащий один раствор электролита (гальванический элемент без транспорта). Когда два электрода ячейки погружены в разные растворы электролита в одном и том же растворителе, разделенные жидкостным переходом (см. Раздел 2.5.3), эта система называется гальваническим элементом с транспортом. Взаимосвязь для ЭДС этого типа ячейки основана на балансе разностей потенциалов Гальвани. Этот подход дает результат, аналогичный результату, полученному при вычислении ЭДС ячейки без транспорта, плюс значение потенциала жидкого перехода A0L. Таким образом, уравнение. (3.1.66) принимает форму … [Pg.178]Другой способ определения переноса растворителя с помощью измерений ЭДС был предложен К. Вагнером. Две полуячейки содержат две смеси растворителей аналогичного состава, которые оба насыщены труднорастворимая соль, e.г. серебряная соль AgX. Хотя химический потенциал одинаков во всем гальваническом элементе с переносом, ЭДС отличается от нуля, так как химический потенциал растворителя отличается в двух полуячейках, и A моль неводного компонента растворителя переносится в катод. купе по Фарадею. [Стр.143]
Неоднократно подчеркивалось, что индивидуальные коэффициенты активности не могут быть измерены экспериментально. Однако эти значения требуются для ряда целей, например.г. для калибровки ионоселективных электродов. Таким образом, общепринятая шкала ионной активности должна быть определена на основе надлежащим образом выбранных стандартов. Кроме того, это определение должно соответствовать определению общепринятой шкалы активности для иона оксония, то есть определению практической шкалы pH. Точно так же индивидуальные масштабы для различных ионов должны быть взаимно согласованными, то есть они должны удовлетворять соотношению между экспериментально измеряемой средней активностью электролита и определенными активностями катиона и аниона с учетом уравнения.(1.1.11). Таким образом, используя гальванические элементы без транспорта, например Стеклянный электрод с селективным натрий-ионосфером и селективный по хлору электрод в растворе NaCl получают серию (NaCl), из которой определяется индивидуальная ионная активность aNa + на основе соглашения Бейтса-Гуггенхайма для acr (стр. ). В таблице 6.1 перечислены три таких стандартных раствора, где pNa = -logflNa + и т. Д. [Pg.442]
Гальванические элементы, которые включают по крайней мере одну поверхность раздела электролит-электролит (которая может быть границей раздела с мембраной), через которую ионы могут переноситься. путем диффузии называются клетками с переносом.Для границ раздела электролит-электролит, рассмотренных в предыдущих разделах, ячейки с переносом могут быть сформулированы, например, как … [Pg.77]
Твердотельный гальванический элемент состоит из электродов и электролита. Твердые электролиты доступны для многих различных мобильных ионов (см. Раздел 15.3). Их ионная проводимость сопоставима с ионной проводимостью жидких электролитов (см. Рис. 15-8). Под нагрузкой гальванические элементы переносят известное количество компонента от одного электрода к другому. Следовательно, мы можем заранее определить кинетическое граничное условие для переноса в твердое тело (т.э., электрод). Используя электрод сравнения, мы можем одновременно определять активность компонентов. Комбинация переноса компонентов и определения потенциала называется кулонометрическим титрованием. Это наиболее полезный метод термодинамического и кинетического исследования соединений с узкими диапазонами гомогенности. Например, можно было проводить измерения в … [Pg.399]
ячейке Chemelec — электролитической ячейке с электродами (анодом и катодом), сделанными из просечно-вытяжного металла или простых металлических пластин.Ячейка заполнена инертными частицами, которые всплывают, когда раствор электролита попадает в ячейку снизу. Это эффективно вызывает турбулентность при увеличении массы транспорта. Эта ячейка используется для очистки сточных вод, особенно от гальванических операций. [Стр.91]
В гальванических элементах можно проводить полуреакции окисления и восстановления в разных местах, если предусмотрены подходящие условия для транспортировки электронов по проводу от одной полуреакции к другой и для переноса ионов из каждая полуреакция друг на друга, чтобы сохранить электрическую нейтральность.В результате химической реакции образуется электрический ток. Гальванические элементы, также называемые гальваническими элементами, представлены в разделе 17.1. Склонность окислителей и восстановителей реагировать друг с другом измеряется их стандартными потенциалами ячеек, представленными в разделе 17.2. В разделе 17.3 вводится уравнение Нернста, позволяющее рассчитывать потенциалы ячеек, которые не находятся в своих стандартных состояниях. [Pg.465]
На рисунке 18-3 показано движение различных носителей заряда в гальваническом элементе во время разряда.Электроды соединены проволокой, так что происходит спонтанная реакция клетки. Заряд переносится через такую электрохимическую ячейку с помощью трех механизмов … [Pg.499]
Гальваническая коррозия имеет особое значение при проектировании и выборе материала. Выбор материала важен, потому что разные металлы контактируют друг с другом и могут образовывать гальванические элементы. Конструкция важна для сведения к минимуму различных условий потока и возникающих в результате областей накопления коррозии. Незакрепленные продукты коррозии важны, потому что они могут быть доставлены в активную зону реактора и облучены.[Стр.85]
В уравнениях. (122) и (123), M (Hg) представляет собой электрод из амальгамы щелочного металла, MX — сольватированный галогенид щелочного металла M с концентрацией c в растворителе S, а AgX (s) / Ag (s) — галогенид серебра серебряный электрод. Уравнение (124) представляет собой общее выражение для электродвижущей силы гальванического элемента без жидкостного перехода, в котором происходит произвольная реакция ячейки 0) 1 Yi + 0) 2Y2 + coiYi + между k компонентами в v-фазах. (124) n — число молей электронов, перенесенных во время этого процесса от анода к катоду через внешнюю цепь, F — число Фарадея и химический потенциал компонента Yi в фазе p.Ячейки с жидкостными контактами требуют электродвижущей силы E в формуле. (124) заменить величиной E — Ej), где Ey> — диффузионный потенциал, обусловленный жидкостным переходом. Стандартный потенциал E ° для ячейки, исследованной по формуле. (122) задается соотношением … [Pg.98]
Кинетические свойства гальванического элемента I с легированным диоксидом циркония в качестве твердого электролита возникают из того факта, что поток тока через элемент, такой как элемент I, является мерой скорости реакции, с которой кислород проходит от одной стороны ячейки к другой.Только ионы кислорода могут проходить через электролит, когда электрическая цепь замкнута. Для скорости переноса частиц 0 в молях в единицу времени J через электролит мы можем записать … [Pg.285]
Перенос массы в форме ионов через электролит часто можно отнести к химическим веществам. реакция или транспортный процесс на электроде. Таким образом, скорость реакции может быть измерена электрически. Часто можно детально проанализировать механизмы реакции, комбинируя измерения скорости с помощью электрического тока с измерениями термодинамических величин, в частности, химических потенциалов, с помощью ЭДС гальванического элемента.Более подробная информация о кинетических исследованиях с использованием гальванических элементов будет дана в разделе V.B. [Pg.285]
Стандартные гальванические элементы герметичны независимо, тогда как ячейка Eloflux полностью отличается. Основное отличие состоит в том, что один электрод используется для транспортировки и газа, и электролита. Следовательно, такая конструкция ячейки снижает затраты за счет упрощения компонентов CEU. Меньше деталей с меньшим износом и коррозией. Элофлюкс был описан в 1965 г. Винзелем и Вендтландом [17-20].[Pg.100]
То есть мы полагаем AG j (H +, aq) = 0. Тогда термодинамические свойства анионов можно определить путем измерения химических потенциалов ионных растворов, содержащих H (как, например, по методике электродвижущих сил гальванического элемента (ЭДС), описанных ниже) в сочетании с различными анионами, а затем с помощью уравнения. (4.1.3b). Определенные таким образом анионные химические потенциалы можно использовать в качестве вторичных стандартов в растворах, содержащих различные катионы, и этот процесс сопоставления продолжают по мере необходимости.Доступны обширные таблицы, построенные таким образом. Однако это соглашение становится неприменимым для процессов, в которых ионы H переносятся через межфазные границы водных растворов. [Pg.235]
Как уже объяснялось, в клеточных мембранах есть эндоэлектрогенные участки. Однако вполне вероятно, что некоторые макроскопические мембраны вокруг органов также являются местом расположения источников электричества. Норденстрём (1983) предположил, что в организме существуют замкнутые цепи постоянного тока с хорошо проводящими кровеносными сосудами, служащими кабелями (например,г., сосудисто-интерстициальный замкнутый контур). Эти постоянные токи могут вызывать электроосмотический перенос через капилляры. Стоматологический гальванизм — это производство электричества металлами в зубах. [Pg.115]
В предыдущих исследованиях, связанных с транспортом кислорода, использовались двухэлектродные амперометрические датчики, такие как ячейки Кларка и Маккерета (Clark, 1959). Эти датчики недорогие, точные и небольшие, но они требуют частой калибровки, потребляют кислород и страдают от длительного дрейфа.Другие варианты включают циклические вольтамперометрические датчики с удаленными трехэлектродными ячейками и варианты гальванических методов для контроля предельных токов в установившемся состоянии (Fan et al., 1991 Haug and White, 2000 Utaka et al., 2009). [Стр.129]

