Как работает гальванический элемент. Из чего состоит гальванический элемент. Какие бывают виды гальванических элементов. Каковы преимущества и недостатки разных типов батарей.
Что такое гальванический элемент и как он работает
Гальванический элемент — это устройство, преобразующее химическую энергию в электрическую. Его принцип работы основан на протекании окислительно-восстановительной реакции между двумя разными металлами, погруженными в раствор электролита.
Основные компоненты гальванического элемента:
- Анод — отрицательный электрод, на котором происходит окисление
- Катод — положительный электрод, на котором идет восстановление
- Электролит — проводящий раствор, в который погружены электроды
- Токоотводы — металлические пластины или стержни для снятия тока
При работе гальванического элемента электроны перемещаются от анода к катоду по внешней цепи, создавая электрический ток. Внутри элемента ионы движутся через электролит, замыкая цепь.
История создания гальванических элементов
Первый гальванический элемент был создан итальянским физиком Алессандро Вольта в 1800 году. Он состоял из чередующихся дисков цинка и меди, разделенных прокладками, смоченными в соленом растворе. Это изобретение положило начало развитию электротехники.
Основные вехи в истории гальванических элементов:
- 1836 г. — Джон Даниэль создал медно-цинковый элемент
- 1859 г. — Гастон Планте изобрел свинцово-кислотный аккумулятор
- 1866 г. — Жорж Лекланше разработал марганцево-цинковый элемент
- 1887 г. — Карл Гасснер представил первую сухую батарею
- 1899 г. — Вальдемар Юнгнер создал никель-кадмиевый аккумулятор
- 1955 г. — Льюис Урри изобрел щелочную батарейку
Основные виды гальванических элементов
Гальванические элементы классифицируют по типу используемого электролита:
Солевые (марганцево-цинковые) элементы
Самый распространенный и дешевый тип батареек. Электролит — паста хлорида аммония и хлорида цинка.
Преимущества солевых элементов:
- Низкая стоимость
- Простота производства
- Доступность компонентов
Недостатки:
- Небольшая емкость
- Короткий срок хранения
- Плохая работа при низких температурах
Щелочные (алкалиновые) элементы
Используют щелочной электролит на основе гидроксида калия. Более эффективны, чем солевые.
Достоинства щелочных батареек:
- Высокая емкость
- Длительный срок хранения
- Стабильная работа при низких температурах
Недостатки:
- Более высокая цена
- Сложность утилизации
Литиевые элементы
Самый современный тип гальванических элементов. Используют металлический литий или его соединения.
Преимущества литиевых батарей:
- Очень высокая емкость
- Длительный срок службы
- Широкий температурный диапазон
- Малые габариты и вес
Недостатки:
- Высокая стоимость
- Пожароопасность при неправильной эксплуатации
Устройство современных гальванических элементов
Рассмотрим конструкцию типичной цилиндрической батарейки:
- Стальной корпус — служит катодом
- Изоляционная прокладка — отделяет анод от катода
- Анодный электрод из цинкового порошка
- Сепаратор, пропитанный электролитом
- Катодная масса из диоксида марганца
- Графитовый стержень — токоотвод катода
- Изолирующая крышка с контактом «+»
Такая конструкция обеспечивает компактность и герметичность элемента при достаточной емкости и стабильных характеристиках.
Области применения гальванических элементов
Современные гальванические элементы широко используются в различных сферах:
- Портативная электроника (смартфоны, ноутбуки, фотоаппараты)
- Бытовая техника (пульты ДУ, часы, игрушки)
- Медицинское оборудование (слуховые аппараты, кардиостимуляторы)
- Автомобильная электроника
- Системы автономного электропитания
- Военная и космическая техника
Выбор типа гальванического элемента зависит от конкретного применения и требований к емкости, габаритам, сроку службы и стоимости.
Перспективы развития гальванических элементов
Основные направления совершенствования гальванических элементов:
- Увеличение удельной емкости и плотности энергии
- Повышение безопасности и экологичности
- Разработка новых электрохимических систем
- Создание гибких и тонкопленочных батарей
- Интеграция с устройствами беспроводной зарядки
Развитие технологий гальванических элементов играет ключевую роль в прогрессе портативной электроники и электротранспорта. Исследования в этой области продолжаются, открывая новые перспективы для автономных источников энергии.
Впервые в мире гальванический элемент был разработан Луиджи Гальвани. Об его истории читайте в этой статье. По сути это временный источник электрического тока, который формируется за счет протекания химической реакции. Поток электронов формируется за счет взаимодействия между двумя разноименными металлами. В результате этого химическая энергия преобразуется в электрическую, которую уже можно использовать в повседневной жизни.
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Кроме Гальвани созданием эффективной батареи занимался Даниэль Якоби. Он немного видоизменил свой источник энергии. В его состав входит пластина, выполненная из меди, помещенная в CuSO4 и пластина из цинка погруженная в ZnSO4. Чтобы не дать им воздействовать прямо друг на друга между ними установлена пористая стенка. Ниже представлена схема гальванического элемента Даниэля Якоби.

Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Схема гальванического элемента
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.

Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы
| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Типы гальванических элементов
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов
| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элемента
Он предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Гальванический элемент в домашних условиях
Простой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
- Пластиковый стакан.
- Электролит. В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде.
- Пластинки двух разных металлов. К примеру алюминий и медь.
- Провода
Процесс изготовления
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Более детально создание батареи своими руками описано в этой статье.
Таким образом изготавливается самодельный гальванический элемент.
Batareykaa.ru
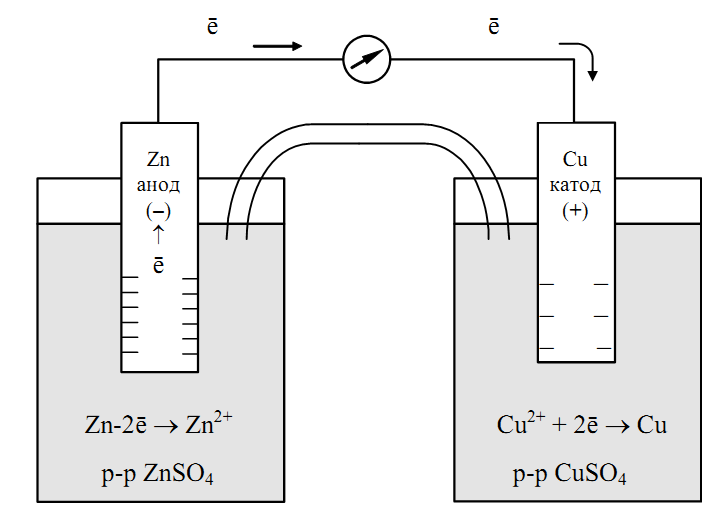
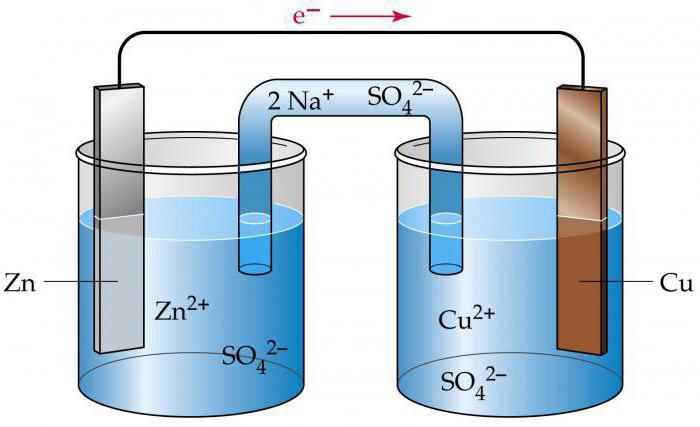
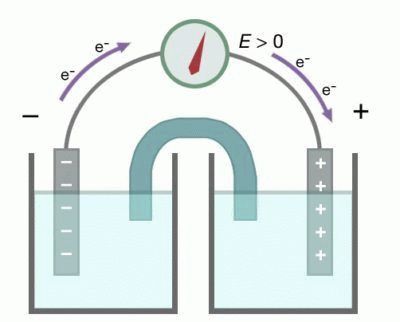
Металл, погруженный в раствор электролита, называется электродом. Электроды — это система двух токопроводящих тел — проводников первого и второго рода. К проводникам первого рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда — электроны. К проводникам второго рода относятся расплавы и растворы электролитов; носители заряда — ионы. Устройство, состоящее из двух электродов, называется гальваническим элементом.

|
| Рис. 2. Схема медно-цинкового гальванического элемента |
Рассмотрим гальванический элемент Якоби—Даниэля (схема приведена на рис. 2). Он состоит из цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
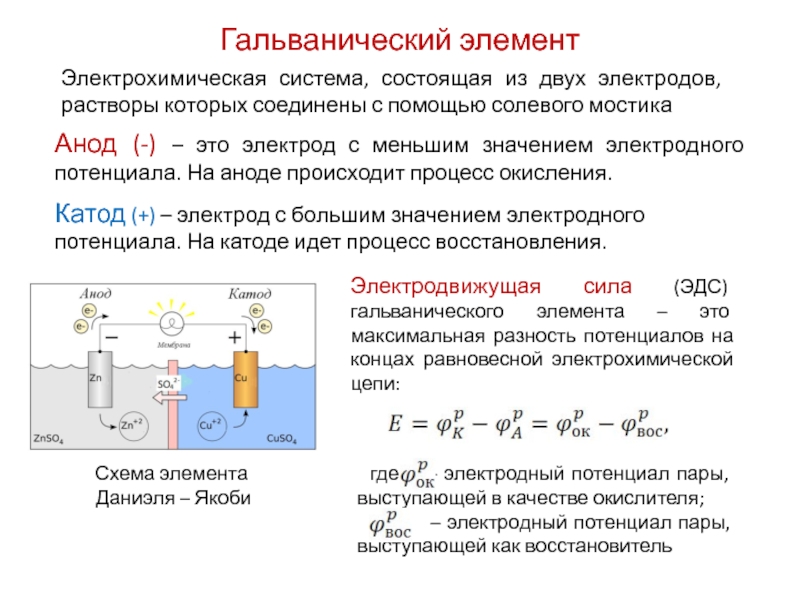
В гальваническом элементе электрод, сделанный из более активного металла, т.е. металла, расположенного левее в ряду напряжений, называют анодом, а электрод, сделанный из менее активного металла — катодом.
На поверхности цинкового электрода (анода) возникает двойной электрический слой и устанавливается равновесие:
Zn0 – 2ē ←→ Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медного электрода (катода) также возникает двойной электрический слой и устанавливается равновесие:
Cu2+ + 2ē ←→ Cu0.
В результате возникает электродный потенциал меди.
Так как потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, то при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате этого процесса равновесие на цинковом электроде смещается вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы или не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе гальванического элемента Якоби—Даниэля протекают следующие процессы:
1. Анодный процесс, процесс окисления:
Zn0 – 2ē → Zn2+.
2. Катодный процесс, процесс восстановления:
Cu2+ + 2ē → Cu0.
3. Движение электронов во внешней цепи.
4. Движение ионов в растворе: анионов SO42– к аноду, катионов Cu2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получим:
Zn + Cu2+ = Zn2+ + Cu.
В результате протекании данной реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. Поэтому суммарную химическую реакцию, протекающую в гальваническом элементе, называют токообразующей реакцией.
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделенными: на отрицательном электроде (аноде) происходит процесс окисления, на положительном электроде (катоде) — процесс восстановления.
Необходимым условием работы гальванического элемента является разность потенциалов электродов. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности между потенциалом катода и потенциалом анода элемента:
ЭДС = Eк – Ea . (1)
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определенный порядок в записи схемы элемента: записанный слева электрод должен быть отрицательным. Например, схема элемента Якоби—Даниэля записывается в виде:
Zn │ ZnSO4 ║ CuSO4 │ Cu .
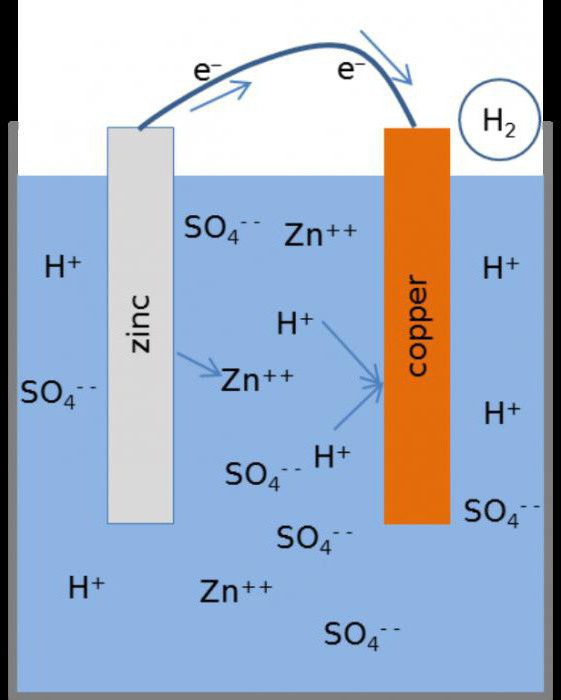
В первых опытах ученых в емкость с кислотой опускали две металлические пластины: медную и цинковую. Пластины соединяли проводником, после чего на медной пластине появлялись газовые пузырьки, а цинковая пластина стала растворяться. Было доказано, что по проводнику проходит электрический ток. Это исследование начинал итальянский ученый Гальвани, от него и получили название гальванические элементы.
После этого ученый Вольта разработал цилиндрическую форму этого элемента в виде вертикального столбика, включающего в себя набор колец меди, цинка и сукна, соединенных друг с другом, и пропитанных кислотой. Разработанный Вольтом вертикальный элемент полуметровой высоты вырабатывал напряжение, которое мог почувствовать человек.
Гальванические элементы — это источники электрической энергии, вырабатывающие электрический ток методом химического взаимодействия двух металлов в электролите. Химическая энергия в гальванических элементах преобразуется в электрический ток.
Виды и особенности устройства
Батарейки широко используются для питания разных электронных устройств, приборов, цифровой техники и делятся на три основных вида:
- Солевые.
- Щелочные.
- Литиевые.
Солевые гальванические элементы
Такие батарейки относятся к марганцево-цинковым элементам питания, и являются наиболее применяемыми в настоящее время.
Достоинствами солевых батареек являются:
- Приемлемые электрические параметры для многих областей использования.
- Удобство применения.
- Малая цена ввиду небольших расходов на изготовление.
- Простая технология изготовления.
- Дешевое и доступное сырье.
Длительное время этот вид батареек является наиболее популярным, благодаря соотношению качества и цены. Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси. Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония. Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция. Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.
В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите. Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3. Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Щелочные батарейки
Щелочные элементы питания появились в середине прошлого века. В них в качестве окислителя выступает диоксид марганца, а в качестве восстановителя порошковый цинк. Это дает возможность увеличить поверхность. Для предохранения от коррозии раньше применялось амальгамирование. Но после запрета на ртуть используют очищенные цинковые порошки с добавлением других металлов и ингибиторов коррозии.
Активным веществом анода щелочной (алкалиновой) батарейки стал очищенный цинк в виде порошка с добавлением алюминия, индия или свинца. Активная смесь катода включает в себя диоксид марганца, ацетиленовую сажу или графит. Электролит алкалиновых батареек состоит из едкого натра или калия с добавлением оксида цинка.
Порошковый анод позволяет значительно повысить использование активной смеси, в отличие от солевых батареек. Алкалиновые батарейки обладают значительно большей емкостью, чем солевые, при равных габаритных размерах. Они хорошо себя показали в работе на морозе.
Особенностью устройства алкалиновых элементов является порошковый цинк, поэтому вместо цинкового стакана используют стальной корпус для положительного вывода. Активная смесь положительного электрода находится возле внутренней стенки стального корпуса. В алкалиновой батарейке есть возможность разместить больше активной смеси положительного электрода, в отличие от солевой.
В активную смесь вставляется целлофановый сепаратор, смоченный электролитом. По центру батарейки проходит латунный отрицательный электрод. Остальной объем между сепаратором и отрицательным токоотводом заполняется анодной пастой в виде порошкового цинка, пропитанного густым электролитом. Обычно в качестве электролита используют щелочь, насыщенную специальными соединениями цинка. Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
По многим основным параметрам алкалиновые гальванические элементы превосходят солевые элементы. Поэтому в настоящее время увеличивается объем производства щелочных батареек.
Литиевые элементы питания
Литиевые гальванические элементы применяются в различных современных устройствах. Они выпускаются различных типоразмеров и видов.
Существуют литиевые батарейки и литиевые аккумуляторы, имеющие между собой большие отличия. Батарейки имеют в составе твердый органический электролит, в отличие от других видов элементов. Литиевые элементы используются в местах, где требуются средние и малые токи разряда, стабильное рабочее напряжение. Литиевый аккумулятор можно перезаряжать определенное количество раз, а батарейки не предназначены для этого, и используются только один раз. Их запрещается вскрывать или перезаряжать.
Основные требования к производству
- Надежная герметизация корпуса. Нельзя допускать утечки электролита и проникновения внутрь других веществ из внешней среды. Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
- Изготовление должно проходить в герметичных помещениях с аргоновой атмосферой и контролем влажности.
Форма литиевых аккумуляторов бывает цилиндрической, дисковой или призматической. Габариты практически не отличаются от других видов батареек.
Область использования
Литиевые гальванические элементы обладают более длительным сроком работы, по сравнению с другими элементами. Область применения очень широка:
- Космическая промышленность.
- Авиационное производство.
- Оборонная промышленность.
- Детские игрушки.
- Медицинская техника.
- Компьютеры.
- Фото- и видеокамеры.
Преимущества
- Широкий интервал рабочих температур.
- Компактные размеры и масса.
- Длительная эксплуатация.
- Стабильные параметры в различных условиях.
- Большая емкость.
Недостатки
- Возможность внезапного возгорания при несоблюдении правил пользования.
- Высокая цена, по сравнению с другими видами батареек.
Принцип работы
Действие гальванических элементов основано на том, что два разных металла в среде электролита взаимодействуют между собой, в результате чего во внешней цепи образуется электрический ток.
Такие химические элементы сегодня называют батарейками. Величина напряжения батарейки зависит от применяемых видов металлов и от числа элементов, находящихся в ней. Все устройство батарейки расположено в металлическом цилиндре. Электроды представляют собой металлические сетки с напылением восстановителя и окислителя.
Батарейки не могут восстанавливать утраченные свойства, так как в них осуществляется прямое преобразование химической энергии окислителя и восстановителя в электрическую. Химические реагенты при функционировании батарейки постепенно расходуются, а электрический ток уменьшается.
Отрицательный вывод батарейки выполнен из цинка или лития, он теряет электроны и является восстановителем. Другой положительный вывод играет роль окислителя, его изготавливают из оксида магния или солей металлов. Состав электролита в обычных условиях не пропускает через себя электрический ток. При замыкании электрической цепи начинается распад электролита на ионы, что обуславливает появление его электрической проводимости. Электролит состоит чаще всего из раствора кислоты или солей натрия и калия.
Похожие темы:
Люди довольно часто сталкиваются с электрохимическими элементами в повседневной жизни: от одноразовых батареек АА в пультах дистанционного управления ТВ до литий-ионных батарей в смартфонах. Существует два типа таких ячеек: гальванические и электролитические. Первые получают свою энергию от самопроизвольных окислительно-восстановительных реакций (ОВР), в то время как вторые требуют внешний источник электронов, например, блока питания переменного тока. Оба элемента состоят из анода (А) и катода (К), изготавливаемых из разнородных металлов и электролитов.
Что это такое
В любом электрохимическом процессе электроны переходят из одного вещества в другое, что обусловлено ОВР. Восстановитель представляет собой вещество, которое теряет электроны и в процессе окисляется. Связанная энергия определяется разностью потенциалов между валентными электронами в атомах различных элементов.
 Принцип работы
Принцип работыГальванический элемент — это устройство, которое преобразует химическую энергию в электрическую, используя электрохимию, а в быту называется батареей.
В такой ячейке есть контейнер, в котором содержится раствор концентрированного сульфата меди (CuSO4), а внутри раствора вставлен медный стержень — катод. Внутри контейнера находится пористый сосуд, заполненный концентрированной серной кислота (h3SO4), в нее вставлен цинковый стержень — анод. Таким образом, когда провод соединяет медный и цинковый стержни, по нему начинает протекать электрический ток.
Дополнительная информация. Реакции окисления и восстановления разделяются на части, называемые полуреакциями. Внешняя цепь используется для проведения потока электронов между электродами гальванического элемента. Электроды изготавливают из любых проводящих материалов, таких как металлы, полупроводники, графит и даже полимеры.
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.
 Два типа ячеек
Два типа ячеекГальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».
 Александро Вольт
Александро ВольтВ 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник компании «Energizer», представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее.
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Виды
Гальванические элементы классифицируются, как щелочные и нещелочные. Стандартная щелочная сухая батарея имеет цинковый А и К из диоксида марганца. Электролит выполнен в виде некислотной пасты. Обычно электролитом, используемым в щелочных батарейках — есть гидроксид калия. Она выполнена в форме стальной банки, заполненной диоксидом марганца в самой внутренней области К, и заполнена цинком и электролитом в центральной области А. Электролит, окружающий А, запускает химреакцию между ними.
 График окислительно-восстановительной реакции
График окислительно-восстановительной реакцииТипичная нещелочная батарея с сухими элементами имеет цинковый А и К из углеродного стержня/ диоксида марганца. Электролит обычно представляет собой кислое пастообразное вещество из смеси хлорида аммония и хлорида цинка. Физически она имеет обратную щелочной батареи конструкцию. Цинковый контейнер служит внешним анодом, тогда как углеродный стержень/ диоксид марганца занимает внутреннюю область в качестве К. Электролит смешивается с К и обеспечивает химическую реакцию между К и А.
Общее мнение специалистов говорит о том, что химически щелочная батарея имеет преимущества по отношению к нещелочной. Хотя последние более надежные и дешевые, тем не менее, щелочные, нужны, когда требуется быстрое, сильнотоковое потребление, например, вспышка на камере с быстрой перезарядкой.
Щелочные батареи
Эта конструкция ячейки получила свое название благодаря использованию щелочных водных растворов в качестве электролитов. Химия щелочных устройств была впервые введена в начале 60-х годов. И сразу стала крупнейшим конкурентом цинк-углеродной ячейки. Эти элементы обладают многими признанными преимуществами по сравнению с цинк-углеродом, включая более высокую плотность энергии, длительный срок хранения, превосходное сопротивление утечке, лучшие характеристики, как в непрерывном, так и в прерывистых рабочих циклах, и более низкое внутреннее сопротивление, что позволяет им работать при высоких скоростях разряда.
 Щелочные батареи
Щелочные батареиЦинк в порошкообразной форме увеличивает площадь поверхности анода, что обеспечивает большее взаимодействие частиц. Это снижает внутреннее сопротивление и увеличивает плотность мощности. Катод, MnO2, произведен синтетически из-за его превосходства над природным MnO2, что дает рост плотности энергии. Как и в цинковой в углеродной ячейке, графит добавляется к катоду для увеличения проводимости.
Электролит КОН, обеспечивает высокую ионную проводимость. Оксид цинка часто включают для замедления коррозии цинкового анода. Производное от целлюлозы и гелеобразующего агента делают щелочной элемент более дорогим, чем цинк-углерод, но более экономичным, особенно в ситуациях с высоким расходом, когда плотность энергии щелочного элемента намного выше.
Половинные реакции:
- Zn + 2OH — -> ZnO + h3O + 2 e —
- 2MnO2 + h3O + 2 e — -> Mn2O 3 + 2OH —
Общая реакция:
- Zn + 2MnO2 -> ZnO + Mn2O3 E = 1,5 В
Существуют и другие конструкции ячеек, которые относятся к категории щелочных, в том числе оксиды ртути, серебра и цинка. Ртуть и серебро дают еще более высокую плотность энергии, но стоят намного дороже и постепенно исключаются требованиями международных организаций из-за их высокой токсичности.
Солевые ячейки
Аккумуляторы с сухими элементами — это устройства, в которых используется электролит с очень низким содержанием влаги. Они контрастируют с батареями с мокрыми элементами, такими как свинцово-кислотные, в которых используется жидкий электролит. Электролит, используемый в большинстве устройств с сухими элементами, является пастой, которая, хотя и содержит влагу, тем не менее остается относительно сухой. Наиболее часто используемые формы сухих элементов — это батареи типа «С», «А», 9 вольт батарейки и для электронных часов.
 Сухой элемент
Сухой элементВажно! Сухих элементы вырабатывают электроэнергию путем преобразования химической энергии в электричество. Выходные данные зависят от типа батареи с сухими элементами. Более популярными являются конструкции с использованием цинка и углерода или цинка и диоксида марганца.
Эти материалы помещаются в пасту электролита внутри батареи. Они реагируют друг с другом посредством химического процесса, в котором электролит, диоксид углерода или марганца реагирует с цинком, создавая электричество.
Литиевые аккумуляторы
Литий-ионная технология включает в себя несколько химических процессов: ионы лития хранятся в аноде или отрицательном электроде, и транспортируются во время разряда к катоду или положительному электроду в органическом электролите.
Наиболее популярными материалами являются графит для анода и оксид металла для катода на основе никеля, марганца и кобальта. Все эти материалы обладают хорошими свойствами интеркалирования лития, что позволяет хранить большое количество энергии.
 Литий-ионный элемент
Литий-ионный элементВыбор аккумуляторной технологии зависит от требований эксплуатации по производительности, сроку службы, безопасности и стоимости, причем каждый тип аккумулятора обеспечивает определенные функциональные возможности.
Преимущества литий-ионных аккумуляторов:
- Высокая плотность энергии. Высокая плотность энергии является одним из главных преимуществ технологии литиевых батарей, для того чтобы работать дольше.
- Саморазряд. Одной из проблем многих аккумуляторов является скорость саморазряда. Литий-ионные элементы в том, что скорость их саморазряда намного ниже, чем у Ni-Cad и NiMH. Обычно составляет около 5% в первые 4 часа после зарядки, но затем падает до 1 или 2% в месяц.
- Низкие эксплуатационные расходы, поскольку требуют технического обслуживания для обеспечения их производительности.
- Разнообразие типов: для бытовой электроники, для электроинструментов и электромобилей.
У таких батарей есть один существенный недостаток — им требуется встроенная схема защиты. Кроме того они страдают от старения и могут выдержать 500–1000 циклов зарядки-разрядки.
Устройство гальванического элемента
Гальваническая ячейка представляет собой простое устройство, с помощью которого химическая энергия преобразуется в электрическую энергию.
Строение гальванического элемента для литиевых батарей:
- Анод, при разряде отдает электроны во внешнюю цепь и окисляется во время электрохимической реакции. Большинство коммерческих элементов в настоящее время используют электрод на основе углерода/графита, однако можно использовать металл или сплав.
- Катод, на разряде принимает электроны из внешней цепи и восстанавливается во время электрохимической реакции. Обычно это переходный металлический оксид или фосфат.
- Электролит.
Обратите внимание! Строение электролита ионный проводник, при этом электронный изолятор, разделяет два электрода и обеспечивает среду для переноса заряда внутри ячейки между анодом и катодом. Электролитом обычно является неводный неорганический растворитель, содержащий растворенную соль лития, например LiPF6 в пропиленкарбонате.
Принцип работы
Литиевая батарея известна как «электронный насос» из-за носителей заряда, перемещающихся между двумя электродами во время зарядки и разрядки. Электрическое (насосное) давление или разность потенциалов между положительной и отрицательной клеммами называется напряжением или электродвижущей силой (ЭДС). Свободная энергия, связанная с переносом электронов вокруг внешней цепи и ионов лития между двумя интеркалирующими электродами, связана с разницей в химическом потенциале лития в двух электродах.
Элементы батареи накапливают энергию химически в своих электроактивных материалах. Эта химическая энергия преобразуется в электрическую энергию по требованию, посредством электрохимической реакции окисления-восстановления.
 Аккумуляторная батарейка
Аккумуляторная батарейкаКлетки построены в разряженном состоянии. При зарядке положительный электрод, катод, материал окисляется, ионы Li + де-интеркалируются из слоистого интеркалирующего литиевого источника, например LiCoO2, проходят через электролит.
Когда элемент разряжается, на отрицательном электроде происходит реакция окисления, ионы Li + де-интеркалируются из анода и мигрируют через электролит, чтобы быть повторно интеркалированными в материал катода. Одновременная реакция электрохимического восстановления протекает на положительном электроде и принимает электроны из внешнего контура, ионы Li + из электролита, чтобы преобразовать исходный материал. Переход от электронного тока к ионному току происходит на границе раздела электрод/электролит.
- Реакция восстановления положительного электрода (катода): Li 1 -xCoO 2 + xLi + + xe- → LiCoO2
- Реакция окисления отрицательного электрода (анода): LiC 6 → xLi + + xC6 + e-
- Общая обратимая, окислительно-восстановительная, клеточная реакция: LiC 6 + CoO 2 C6 + LiCoO 2
 Применение ячеек
Применение ячеекОбласть использования
Электрохимия имеет множество важных применений, особенно в промышленности. Ее процессы используются для изготовления электрических батарей. Они имеют множество применений, включая:
- Топливный элемент преобразует химическую потенциальную энергию, получаемую при окислении топлива, например, газа, водорода, углеводородов, спиртов в электрическую энергию.
- Различные виды пьезозажигалок для газа.
- Электрические приборы, такие как мобильные телефоны.
- Цифровые камеры-литиевые.
- Слуховые аппараты (оксидно-серебряные).
- Электронные часы (ртутные/оксидно-серебряные).
- Военные источники тока (тепловые).
- Батарейки A, AA, AAA, D, C и другие.
Использование химических реакций для производства электричества в настоящее время является приоритетом для многих исследователей. Возможность адекватно использовать химические реакции в качестве источника энергии в значительной степени поможет решить проблемы загрязнения окружающей среды.
Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.

Химические источники тока
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора. Кроме того, схема двух гальванических элементов предполагает наличие катода и анода. Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.
Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде – восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Пример гальванического элемента
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля. Он включает в себя медную пластинку, которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод). Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.
Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Zn = Zn2+ + 2e-
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Cu2+ + 2e- = Cu
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Заключение
Принцип работы любого гальванического элемента основывается на окислительно-восстановительных процессах, протекающих на катоде и аноде. В зависимости от используемого металла, выбранного раствора электролита, меняется срок службы элемента, а также величина номинального напряжения. В настоящее время востребованы литиевые, кадмиевые гальванические элементы, имеющие достаточно продолжительный срок своей службы.
 Разные виды гальванических элементов преобразовывают свою химическую энергию в электрический ток. Своё название они получили в честь итальянского учёного Гальвани, который проводил первые подобные эксперименты и исследования. Электричество вырабатывается благодаря химическому взаимодействию двух металлов (обычно цинка и меди) в электролите.
Разные виды гальванических элементов преобразовывают свою химическую энергию в электрический ток. Своё название они получили в честь итальянского учёного Гальвани, который проводил первые подобные эксперименты и исследования. Электричество вырабатывается благодаря химическому взаимодействию двух металлов (обычно цинка и меди) в электролите.
Принцип действия
Учёные помещали в ёмкости с кислотой медную и цинковую пластинку. Их соединяли проводником, на первой образовывались пузырьки газа, вторая начинала растворяться. Это доказывало то, что по проводнику протекает электрический ток. После Гальвани опытами занялся Вольт. Он создал элемент цилиндрической формы, похожий на вертикальный столбец. В его составе были цинковые, медные и суконные кольца, предварительно пропитанные кислотой. Первый элемент имел высоту в 50 см, и выработанное им напряжение чувствовалось человеком.
Принцип работы заключается в том, что два вида металла в электролитической среде вступают во взаимодействие, в результате которого по внешней цепи начинает проходить ток. Современные гальванические элементы и аккумуляторы называют батарейками. Их напряжение зависит от используемого металла. Устройство помещено в цилиндр из мягкой жести. В качестве электродов выступают сетки с окислительным и восстановительным напылением.
 Преобразование химической энергии в электричество исключает возможность восстановления свойств батареек. Ведь при работе элемента реагенты расходуются, из-за чего уменьшается ток. Восстановителем обычно служит отрицательный вывод из лития или цинка. Во время функционирования он теряет электроны. Положительную часть изготавливают из металлических солей или оксида магния, она выполняет работу окислителя.
Преобразование химической энергии в электричество исключает возможность восстановления свойств батареек. Ведь при работе элемента реагенты расходуются, из-за чего уменьшается ток. Восстановителем обычно служит отрицательный вывод из лития или цинка. Во время функционирования он теряет электроны. Положительную часть изготавливают из металлических солей или оксида магния, она выполняет работу окислителя.
В обычных условиях электролит не пропускает ток, он распадается на ионы только во время замыкания цепи. Именно это обуславливает появление проводимости. В качестве электролита используют раствор кислоты, натриевые или калиевые соли.
Разновидности элементов
Батарейки используют для питания приборов, устройств, техники, игрушек. Все гальванические элементы по схеме делят на несколько видов:
- солевые;
- щелочные;
- литиевые.
Наиболее популярные — солевые батарейки, изготовленные из цинка и марганца. Элемент сочетает в себе надёжность, качество и приемлемую цену. Но в последнее время производители снижают или полностью прекращают их изготовление, так как со стороны фирм, выпускающих бытовую технику, к ним постепенно повышают требования. Основные преимущества гальванических батарей этого типа:
- универсальные параметры, позволяющие использовать их в разных областях;
- лёгкая эксплуатация;
- невысокая стоимость;
- простые условия производства;
- доступное и недорогое сырье.
 Среди недостатков выделяют небольшой срок службы (не более двух лет), уменьшение свойств из-за низких температур, уменьшение ёмкости при повышении тока и снижение напряжения во время работы. Когда солевые батарейки разряжаются, они могут потечь, так как положительный объем электрода выталкивает электролит. Проводимость повышают графит и сажа, активная смесь состоит из диоксида марганца. Срок эксплуатации напрямую зависит от объёма электролита.
Среди недостатков выделяют небольшой срок службы (не более двух лет), уменьшение свойств из-за низких температур, уменьшение ёмкости при повышении тока и снижение напряжения во время работы. Когда солевые батарейки разряжаются, они могут потечь, так как положительный объем электрода выталкивает электролит. Проводимость повышают графит и сажа, активная смесь состоит из диоксида марганца. Срок эксплуатации напрямую зависит от объёма электролита.
В прошлом столетии появились первые щелочные элементы. Роль окислителя в них играет марганец, а восстановителя — цинковый порошок. Корпус батарейки амальгамируют во избежание появления коррозии. Но использование ртути запретили, поэтому их покрывали смесями из цинкового порошка с ингибиторами ржавчины.
Активное вещество в устройстве гальванического элемента — это цинк, индий, свинец и алюминий. В активную массу входят сажа, марганец и графит. Электролит изготавливают из калия и натрия. Сухой порошок значительно повышает функционирование батарейки. При таких же габаритах, как у солевых видов, щелочные имеют большую ёмкость. Они продолжают хорошо работать даже при сильном морозе.
Литиевые элементы используют для питания современной техники. Их выпускают в виде батареек и аккумуляторов разных размеров. В составе первых находится твёрдый электролит, в других устройствах — жидкий. Такой вариант подходит для приборов, требующих стабильного напряжения и средних зарядов тока. Литиевые аккумуляторы можно заряжать несколько раз, батарейки используют только однажды, их не вскрывают.
Сфера применения
 К производству гальванических элементов выдвигают ряд требований. Корпус батареек должен быть надёжным и герметичным. Электролит не должен вытекать, а также нельзя допускать попадания внутрь устройства посторонних веществ. В некоторых случаях при вытекании жидкости она загорается. Повреждённый элемент нельзя использовать. Габариты у всех батареек практически одинаковы, отличаются только размеры аккумуляторов. Элементы могут иметь разную форму: цилиндрическую, призматическую или дисковую.
К производству гальванических элементов выдвигают ряд требований. Корпус батареек должен быть надёжным и герметичным. Электролит не должен вытекать, а также нельзя допускать попадания внутрь устройства посторонних веществ. В некоторых случаях при вытекании жидкости она загорается. Повреждённый элемент нельзя использовать. Габариты у всех батареек практически одинаковы, отличаются только размеры аккумуляторов. Элементы могут иметь разную форму: цилиндрическую, призматическую или дисковую.
У всех типов устройств есть общие достоинства: они компактны и имеют незначительный вес, приспособлены к разным диапазонам рабочей температуры, обладают большой ёмкостью и стабильно работают в разных условиях. Есть также и некоторые недостатки, но они касаются определённых типов элементов. Солевые служат недолго, литиевые устроенные так, что могут воспламеняться при разгерметизации.
Сферы применения батареек многочисленны:
- цифровая техника;
- детские игрушки;
- медицинские приборы;
- оборонная и авиационная промышленность;
- космическое производство.
Гальванические элементы легко использовать, они доступны по стоимости. Но с некоторыми видами нужно обращаться аккуратно и не использовать их в случае повреждения. Перед приобретением батареек нужно внимательно изучить инструкцию прибора, который они будут питать.
Гальванический элемент – это источник электрической энергии, принцип действия основан на химических реакциях. Большинство современных батареек и аккумуляторов подпадает под определение и относится к рассматриваемой категории. Физически гальванический элемент состоит из проводящих электродов, погруженных в одну или две жидкости (электролиты).
Общая информация
Гальванические элементы делятся на первичные и вторичные в соответствии со способностью вырабатывать электрический ток. Оба вида считаются источниками и служат для различных целей. Первые вырабатывают ток в ходе химической реакции, вторые функционируют исключительно после зарядки. Ниже обсудим обе разновидности. По количеству жидкостей различают две группы гальванических элементов:
- Ярким примером приборов с единственной жидкостью считаются вольтов столб (1800 год) и элемент Волластона, которым пользовался первоначально Георг Ом в собственных исследованиях. Он состоял из медных пластин, свёрнутых в полые цилиндрической форму поверхности: первая вставлена во вторую. Обе ограждены от соприкосновения при помощи деревянных распорок. Электролитом служит разбавленная серная кислота. В результате происходит удвоение рабочих поверхностей. В ходе реакции образуется сульфат меди с выделением водорода, а цинк окисляется. В батарейках один электрод обычно угольный.
Источник электрической энергии
- В элементах с двумя жидкостями используется электролит с избытком кислорода для погружения электрода, где образуется водород. В результате происходит химическая реакция образования воды, нестабильность тока компенсируется и сглаживается. Первым идею использования источников выдвинул в 1829 году Беккерель. Первоначально для разделения ёмкостей использовался сосуд из слабо обожжённой глины, обладавший хорошей пористостью. Для компенсации выделения водорода на медном электроде допустимо использовать синий купорос.
Непостоянство источников питания с единственной жидкостью заметил Ом, открыв неприемлемость гальванического элемента Волластона для экспериментов по исследованию электричества. Динамика процесса такова, что в начальный момент времени ток велик и вначале растёт, потом за несколько часов падает до среднего значения. Современные аккумуляторы капризны.
История открытия химического электричества
Мало известен факт, что в 1752 году гальваническое электричество упоминалось Иоганном Георгом. Издание Исследование происхождения приятных и неприятных ощущений, выпущенное Берлинской академией наук, даже придавало явлению вполне правильное толкование. Опыт: серебряную и свинцовую пластины соединяли с одного конца, а противоположные с разных сторон прикладывались к языку. На рецепторах наблюдается вкус железного купороса. Читатели уже догадались, описанный способ проверки батареек часто использовали в СССР.

Химическое электричество
Объяснение явления: видимо, имеются некие частицы металла, раздражающие рецепторы языка. Частицы испускаются одной пластиной при соприкосновении. Причём один металл при этом растворяется. Собственно, налицо принцип действия гальванического элемента, где цинковая пластина постепенно исчезает, отдавая энергию химических связей электрическому току. Объяснение сделано за полвека до официального доклада Королевскому обществу Лондона Алессандро Вольта об открытии первого источника питания. Но, как происходит часто с открытиями, к примеру, электромагнитным взаимодействием, опыт остался незамечен широкой научной общественностью и не исследован должным образом.
Добавим, это оказалось связано с недавней отменой преследования за колдовство: немногие решались после печального опыта «ведьм» на изучение непонятных явлений. Иначе обстояло дело с Луиджи Гальвани, с 1775 года работающим на кафедре анатомии в Болонье. Его специализаций считались раздражители нервной системы, но светило оставил значимый след не в области физиологии. Ученик Беккарии активно занимался электричеством. Во второй половине 1780 года, как следует из воспоминаний учёного (1791, De Viribus Electricitatis in Motu Muscylary: Commentarii Bononiensi, том 7, стр. 363), в очередной раз производилось препарирование лягушки (опыты и потом длились долгие годы).
Примечательно, что необычное явление подмечено ассистентом, в точности, как с отклонением стрелки компаса проводом с электрическим током: открытие сделали лишь косвенно связанные с научными исследованиями люди. Наблюдение касалось подергиваний нижних конечностей лягушки. В ходе опыта ассистент задел внутренний бедренный нерв препарируемого животного, ножки дёрнулись. Рядом, на столе стоял электростатический генератор, на приборе проскочила искра. Луиджи Гальвани немедленно загорелся идеей повторить опыт. Что удалось. И опять на машине проскочила искра.

Опыты Луиджи Гальвани
Образовалась параллель связи с электричеством, и Гальвани возжелал узнать, станет ли на лягушку действовать подобным образом гроза. Оказалось, что природные катаклизмы не оказывают заметного воздействия. Лягушки, прикреплённые медными крючками за спинной мозг к железной ограде, дёргались вне зависимости от погодных условий. Опыты не удавалось реализовать со 100-процентной повторяемостью, атмосфера воздействия не оказывала. В итоге Гальвани нашёл сонм пар, составленных из разных металлов, которые при соприкосновении между собой и нервом вызывали подёргивание лапок у лягушки. Сегодня явление объясняют различной степенью электроотрицательности материалов. К примеру, известно, что нельзя алюминиевые пластины клепать медью, металлы составляют гальваническую пару с ярко выраженными свойствами.
Гальвани справедливо заметил, что образуется замкнутая электрическая цепь, предположил, что лягушка содержит животное электричество, разряжаемое подобно лейденской банке. Алессандро Вольта не принял объяснения. Внимательно изучив описание экспериментов, Вольта выдвинул объяснение, что ток возникает при объединении двух металлов, непосредственно или через электролит тела биологического существа. Причина возникновения тока кроется в материалах, а лягушка служит простым индикатором явления. Цитата Вольты из письма, адресованного редактору научного журнала:
Проводники первого рода (твёрдые тела) и второго рода (жидкости) при соприкосновении в некоторой комбинации рождают импульс электричества, сегодня нельзя объяснить причины возникновения явления. Ток течёт по замкнутому контуру и исчезает, если целостность цепи нарушена.
Вольтов столб
Лепту в череду открытий внёс Джованни Фаброни, сообщивший, что при размещении двух пластинок гальванической пары в воду, одна начинает разрушаться. Следовательно, явление имеет отношение к химическим процессам. А Вольта тем временем изобрёл первый источник питания, долгое время служивший для исследования электричества. Учёный постоянно искал способы усиления действия гальванических пар, но не находил. В ходе опытов создана конструкция вольтова столба:
- Попарно брались цинковые и медные кружки в плотном соприкосновении друг с другом.
- Полученные пары разделялись мокрыми кружками картона и ставились друг над другом.
Легко догадаться, получилось последовательное соединение источников тока, которые суммируясь, усиливали эффект (разность потенциалов). Новый прибор вызывал при прикосновении ощутимый для руки человека удар. Подобно опытам Мушенбрука с лейденской банкой. Однако для повторения эффекта требовалось время. Стало очевидно, что источник энергии имеет химическое происхождение и постепенно возобновляется. Но привыкнуть к понятию нового электричества оказалось непросто. Вольтов столб вёл себя подобно заряженной лейденской банке, но…

Эксперимент Вольта
Вольта организует дополнительный эксперимент. Снабжает каждый из кружков изолирующей ручкой, приводит в соприкосновение на некоторое время, потом размыкает и проводит исследование электроскопом. К тому времени уже стал известен закон Кулона, выясняется, что цинк зарядился положительно, а медь – отрицательно. Первый материал отдал электроны второму. По указанной причине цинковая пластина вольтова столба постепенно разрушается. Для изучение работы назначили комиссию, которой представили доводы Алессандро. Уже тогда путём умозаключений исследователь установил, что напряжение отдельных пар складывается.
Вольта объяснил, что без мокрых кружков, прокладываемых между металлами, конструкция ведёт себя как две пластинки: медная и цинковая. Усиления не происходит. Вольта нашёл первый ряд электроотрицательности: цинк, свинец, олово, железо, медь, серебро. И если исключить промежуточные металлы между крайними, «движущая сила» не изменяется. Вольта установил, что электричество существует, пока соприкасаются пластины: сила не видна, но легко чувствуется, следовательно, она истинна. Учёный 20 марта 1800 года пишет президенту Королевского общества Лондона сэру Джозефу Бэнксу, к которому обращался впервые и Майкл Фарадей.
Английские исследователи быстро обнаружили: если на верхнюю пластину (медь) капнуть воды, в указанной точке в районе контакта выделяется газ. Они проделали опыт с обоих сторон: провода подходящей цепи заключили в колбы с водой. Газ исследовали. Оказалось, что газ горючий, выделяется лишь с единственной стороны. С противоположной заметно окислилась проволока. Установлено, что первое является водородом, а второе явление происходит вследствие избытка кислорода. Установлено (2 мая 1800 года), что наблюдаемый процесс – разложение воды под действием электрического тока.
Уильям Крукшенк немедленно показал, что аналогичное допустимо проделать с растворами солей металлов, а Волластон окончательно доказал идентичность вольтова столба статическому электричеству. Как выразился учёный: действие слабее, но обладает большей продолжительностью. Мартин Ван Марум и Христиан Генрих Пфафф зарядили от элемента лейденскую банку. А профессор Хампфри Дэви установил, что чистая вода не может служить в этом случае электролитом. Напротив, чем сильнее жидкость способна окислять цинк, тем лучше действует вольтов столб, что вполне согласовывалось с наблюдениями Фаброни.
Кислота намного улучшает работоспособность, ускоряя процесс выработки электричества. В конце концов Дэви создал стройную теорию вольтова столба. Он пояснил, что металлы изначально обладают неким зарядом, при замыкании контактов вызывающим действие элемента. Если электролит способен окислять поверхность донора электронов, слой истощённых атомов постепенно удаляется, открывая новые слои, способные давать электричество.
В 1803 году Риттер собрал столб из чередующихся кружков серебра и мокрого сукна, прообраз первого аккумулятора. Риттер зарядил его от вольтова столба и наблюдал процесс разрядки. Правильное толкование явлению дал Алессандро Вольта. И лишь в 1825 году Огюст де ла Рив доказал, что перенос электричества в растворе осуществляется ионами вещества, наблюдая образование оксида цинка в камере с чистой водой, отделённой от соседней мембраной. Заявление помогло Берцелиусу создать физическую модель, в которой атому электролита представлялись составленными из двух противоположно заряженных полюсов (ионов), способных диссоциировать. В результате получилась стройная картина переноса электричества на расстояние.
1.1: гальванические элементы — химия LibreTexts
Цели обучения
- Чтобы понять основы гальванических элементов
- Для подключения напряжения от гальванического элемента к соответствующему химическому составу REDOX
В любом электрохимическом процессе электроны перетекают из одного химического вещества в другое, вызванное окислительно-восстановительной (окислительно-восстановительной) реакцией. Окислительно-восстановительная реакция происходит, когда электроны переносятся из вещества, которое окисляется, в вещество, которое восстанавливается.Восстановитель — это вещество, которое теряет электроны и окисляется в процессе; окислитель — это разновидность, которая получает электроны и восстанавливается в процессе. Связанная потенциальная энергия определяется разностью потенциалов между валентными электронами в атомах разных элементов.
Поскольку восстановление невозможно без окисления, и наоборот, окислительно-восстановительную реакцию можно описать как две полуреакции , одна из которых представляет процесс окисления, а другая — процесс восстановления.{-}} \ label {20.3.3} \]
Каждая половина реакции написана, чтобы показать, что на самом деле происходит в системе; \ (\ ce {Zn} \) — это восстановитель в этой реакции (он теряет электроны), а \ (\ ce {Br2} \) — окислитель (он получает электроны). Добавление двух полуреакций дает общую химическую реакцию (уравнение \ (\ PageIndex {1} \)). Окислительно-восстановительная реакция уравновешивается, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Как и любое сбалансированное химическое уравнение, весь процесс электрически нейтрален; то есть чистый заряд одинаков с обеих сторон уравнения.
В любой окислительно-восстановительной реакции количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем.
В большинстве наших обсуждений химических реакций мы предполагали, что реагенты находятся в тесном физическом контакте друг с другом. Кислотно-основные реакции, например, обычно проводятся с кислотой и основанием, диспергированными в одной фазе, такой как жидкий раствор. Однако в случае окислительно-восстановительных реакций можно физически разделить полуреакции окисления и восстановления в пространстве, если между двумя полуреакциями существует полная цепь, включая внешнее электрическое соединение, такое как провод,.По мере прохождения реакции электроны перетекают из восстановителя в окислитель по этому электрическому соединению, производя электрический ток, который можно использовать для работы. Устройство, которое используется для выработки электричества в результате самопроизвольной окислительно-восстановительной реакции или, наоборот, которое использует электричество для возбуждения непонтанной окислительно-восстановительной реакции, называется электрохимической ячейкой .
Существует два типа электрохимических элементов: гальванические элементы и электролитические элементы. Гальванические элементы названы в честь итальянского физика и врача Луиджи Гальвани (1737–1798), который заметил, что рассеченные мышцы ног лягушки подергивались при нанесении небольшого электрического удара, демонстрируя электрическую природу нервных импульсов.Гальванический (гальванический) элемент использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции (\ (ΔG <0 \)), для выработки электроэнергии. Этот тип электрохимического элемента часто называют гальваническим элементом в честь его изобретателя, итальянского физика Алессандро Вольта (1745–1827). Напротив, электролитическая ячейка потребляет электрическую энергию от внешнего источника, используя ее для того, чтобы вызвать непредвиденную окислительно-восстановительную реакцию (ΔG> 0). Оба типа содержат два электрода , которые представляют собой твердые металлы, соединенные с внешней цепью, которая обеспечивает электрическое соединение между двумя частями системы (Рисунок \ (\ PageIndex {1} \)).Полуреакция окисления происходит на одном электроде (анод ), а полуреакция восстановления происходит на другом (катод ). Когда цепь замкнута, электроны текут от анода к катоду. Электроды также соединены электролитом, ионным веществом или раствором, который позволяет ионам переноситься между отсеками электродов, тем самым поддерживая электрическую нейтральность системы. В этом разделе мы сосредоточимся на реакциях, которые происходят в гальванических элементах.
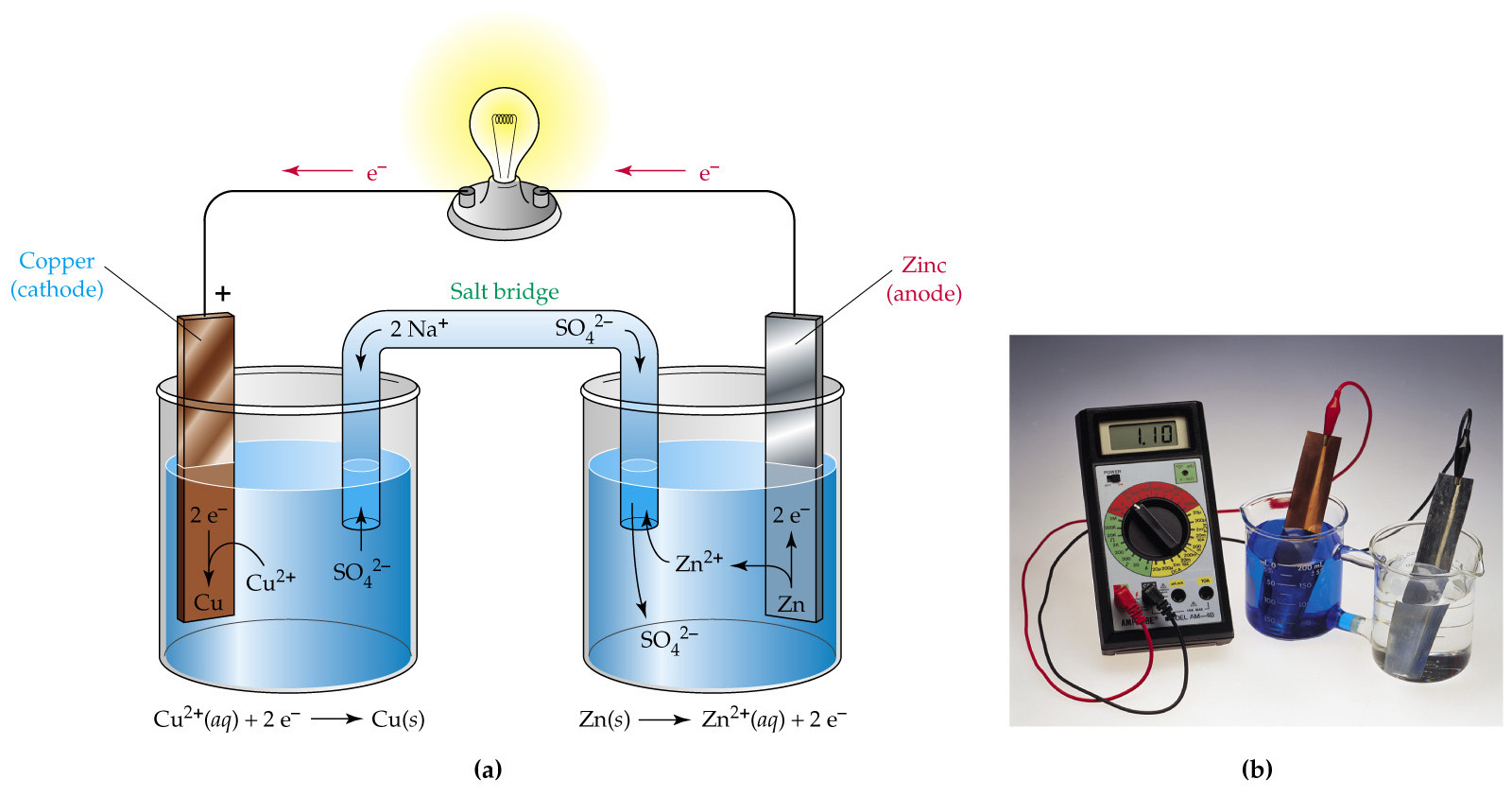
Рисунок \ (\ PageIndex {1} \): электрохимические элементы. Гальваническая ячейка (слева) преобразует энергию, выделяемую спонтанной окислительно-восстановительной реакцией, в электрическую энергию, которую можно использовать для выполнения работы. Окислительные и восстановительные полуреакции обычно происходят в отдельных отсеках, которые связаны внешней электрической цепью; кроме того, для поддержания электрической нейтральности необходимо второе соединение, которое позволяет ионам течь между отсеками (показано здесь как вертикальная пунктирная линия для представления пористого барьера).Разница потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток. В электролитической ячейке (справа) внешний источник электрической энергии используется для генерации разности потенциалов между электродами, которая заставляет электроны течь, вызывая непредвиденную окислительно-восстановительную реакцию; в большинстве случаев используется только один отсек. В обоих типах электрохимических ячеек анод является электродом, на котором происходит полуреакция окисления, а катод является электродом, на котором происходит полуреакция восстановления.{2+} (aq) + Cu (s)} \ label {20.3.4} \]Мы можем вызвать эту реакцию, вставив цинковый стержень в водный раствор сульфата меди (II). По мере протекания реакции цинковый стержень растворяется и образуется масса металлической меди. Эти изменения происходят спонтанно, но вся высвобождаемая энергия находится в форме тепла, а не в форме, которую можно использовать для работы.
Рисунок \ (\ PageIndex {2} \): реакция металлического цинка с водными ионами меди (II) в одном отсеке.Когда цинковый стержень вставлен в химический стакан, содержащий водный раствор сульфата меди (II), происходит самопроизвольная окислительно-восстановительная реакция: цинковый электрод растворяется с образованием ионов Zn 2 + (aq), а Cu 2 Ионы + (aq) одновременно восстанавливаются до металлической меди. Реакция происходит настолько быстро, что медь осаждается в виде очень мелких частиц, которые кажутся черными, а не обычного красноватого цвета меди. (Https://youtu.be/2gPRK0HmYu4)Эту же реакцию можно провести, используя гальванический элемент, показанный на рисунке \ (\ PageIndex {3a} \).Для сборки ячейки медная полоса вставляется в стакан, который содержит 1 М раствор ионов Cu 2 + , а цинковая полоса вставляется в другой стакан, который содержит 1 М раствор Zn 2 + ионов. Две металлические полоски, которые служат электродами, соединены проводом, а отсеки соединены солевым мостиком , U-образной трубкой, вставленной в оба раствора, которая содержит концентрированную жидкость или гелеобразный электролит.Ионы в солевом мостике выбираются таким образом, чтобы они не мешали электрохимической реакции, будучи самим окисленными или восстановленными или образуя осадок или комплекс; обычно используемыми катионами и анионами являются Na + или K + и NO 3 — или SO 4 2 — соответственно. (Ионы в солевом мостике не обязательно должны быть такими же, как ионы в окислительно-восстановительной паре в обоих отсеках.) Когда цепь замкнута, происходит спонтанная реакция: металлический цинк окисляется до Zn 2 + ионов в цинковый электрод (анод) и Cu 2 + ионы восстанавливаются до металла Cu на медном электроде (катоде).По мере прохождения реакции цинковая полоса растворяется, и концентрация ионов Zn 2 + в растворе Zn 2 + увеличивается; одновременно медная полоса набирает массу, и концентрация ионов Cu 2 + в растворе Cu 2 + уменьшается (рис. \ (\ PageIndex {3b} \)). Таким образом, мы провели ту же реакцию, что и с использованием одного стакана, но на этот раз окислительная и восстановительная полуреакции физически отделены друг от друга.Электроны, которые выделяются на аноде, протекают через провод, создавая электрический ток. Поэтому гальванические элементы преобразуют химическую энергию в электрическую энергию, которая затем может быть использована для работы.
Рисунок \ (\ PageIndex {3} \): реакция металлического цинка с водными ионами меди (II) в гальваническом элементе. (a) Гальванический элемент можно сконструировать, вставив медную полоску в стакан, который содержит 1 М водный раствор Cu 2 + ионов, и полосу цинка в другой стакан, который содержит водный раствор 1 М Zn 2 + ионов.Две металлические полоски соединены проводом, по которому течет электричество, а мензурки соединены соляным мостиком. Когда переключатель замыкается для замыкания цепи, цинковый электрод (анод) самопроизвольно окисляется до левого отсека Zn 2 + , в то время как ионы Cu 2 + одновременно восстанавливаются до металлического меди в медный электрод (катод). (b) По мере протекания реакции анод Zn теряет массу по мере растворения с образованием ионов Zn 2 + (aq), в то время как катод Cu набирает массу по мере уменьшения ионов Cu 2 + (aq) к металлическому меди, который осаждается на катоде.Электролит в солевом мостике служит двум целям: он замыкает цепь, перенося электрический заряд, и поддерживает электрическую нейтральность в обоих растворах, позволяя ионам мигрировать между ними. Идентичность соли в солевом мостике не имеет значения, пока компоненты-ионы не реагируют или не подвергаются окислительно-восстановительной реакции в рабочих условиях клетки. Без такой связи общий положительный заряд в растворе Zn 2 + будет увеличиваться по мере растворения металлического цинка, а общий положительный заряд в растворе Cu 2 + будет уменьшаться.Солевой мостик позволяет нейтрализовать заряды потоком анионов в раствор Zn 2 + и потоком катионов в раствор Cu 2 + . В отсутствие солевого мостика или какого-либо другого подобного соединения реакция быстро прекратилась бы, потому что электрическая нейтральность не могла быть сохранена.
Вольтметр может использоваться для измерения разности электрических потенциалов между двумя отсеками. Размыкание переключателя, соединяющего провода с анодом и катодом, предотвращает протекание тока, поэтому химическая реакция не происходит.Однако, когда переключатель замкнут, внешняя цепь замкнута, и электрический ток может течь от анода к катоду. Потенциал (\ (E_ {cell} \)) ячейки, измеренный в вольтах, представляет собой разницу в электрическом потенциале между двумя полуреакциями и связан с энергией, необходимой для перемещения заряженной частицы в электрическом поле. , В ячейке, которую мы описали, вольтметр показывает потенциал 1,10 В (рис. \ (\ PageIndex {3a} \)). Поскольку электроны из полуреакции окисления высвобождаются на аноде, анод в гальваническом элементе заряжен отрицательно.Катод, который притягивает электроны, заряжен положительно.
Не все электроды подвергаются химическому превращению во время окислительно-восстановительной реакции. Электрод может быть изготовлен из инертного высокопроводящего металла, такого как платина, для предотвращения его реакции во время окислительно-восстановительного процесса, когда он не появляется в общей электрохимической реакции. Это явление показано в примере \ (\ PageIndex {1} \).
Гальванический (гальванический) элемент преобразует энергию, выделяемую в результате спонтанной химической реакции , в электрическую энергию.Электролизер потребляет электрическую энергию от внешнего источника, чтобы инициировать непрямую химическую реакцию .
Пример \ (\ PageIndex {1} \)
Химик построил гальваническую ячейку, состоящую из двух мензурок. Один стакан содержит полосу олова, погруженную в водную серную кислоту, а другой содержит платиновый электрод, погруженный в водную азотную кислоту. Два раствора соединены солевым мостиком, а электроды соединены проводом.{2+} (aq) + 2NO (г) + 4h3O (л)} \ nonumber \]
Для этой гальванической ячейки,
- записать половинную реакцию, которая происходит на каждом электроде.
- указывают, какой электрод является катодом, а какой — анодом.
- указывают, какой электрод является положительным электродом, а какой отрицательным.
Дано: гальванический элемент и окислительно-восстановительная реакция
Запрошено: полуреакций, идентичность анода и катода и назначение электродов как положительное или отрицательное
Стратегия:
- . Определите полуреакцию окисления и полуреакцию восстановления.Затем идентифицируйте анод и катод по полуреакции, которая происходит на каждом электроде.
- Со стороны потока электронов назначьте каждый электрод положительным или отрицательным.
Решение
A В полуреакции восстановления нитрат восстанавливается до оксида азота. (Оксид азота затем вступит в реакцию с кислородом в воздухе с образованием NO 2 с его характерным красно-коричневым цветом.) В полуреакции окисления металлическое олово окисляется.{-}} \ nonumber \]
Таким образом, нитрат восстанавливается до NO, а оловянный электрод окисляется до Sn 2 + .
Поскольку реакция восстановления происходит на Pt-электроде, это катод. И наоборот, реакция окисления происходит на оловянном электроде, поэтому это анод.
B Электроны текут от оловянного электрода через проволоку к платиновому электроду, где они переходят в нитрат. Электрическая цепь замыкается солевым мостиком, который обеспечивает диффузию катионов в направлении катода и анионов в направлении анода.{-}} \ end {align *} \]
Pt-электрод в перманганатном растворе является катодом; один в растворе олова является анодом.
Катод (электрод в стакане, содержащий раствор перманганата) положительный, а анод (электрод в стакане, содержащий раствор олова) отрицательный.
Построение диаграмм ячейки (обозначение ячейки)
Поскольку описывать любую данную гальваническую ячейку словами довольно сложно, была разработана более удобная запись.В этой линейной записи, называемой диаграммой ячеек, идентичность электродов и химическое содержимое отсеков указывается их химическими формулами с анодом, написанным в крайнем левом углу, и катодом в крайнем правом. Фазовые границы показаны одиночными вертикальными линиями, а солевой мост с двумя фазовыми границами — двойной вертикальной линией. Таким образом, диаграмма ячейки для ячейки \ (\ ce {Zn / Cu} \), показанной на рисунке \ (\ PageIndex {3a} \), записывается следующим образом:
Рисунок \ (\ PageIndex {4} \): Диаграмма ячейки включает концентрации раствора, когда они предоставляются.Гальванические элементы могут иметь расположение, отличное от примеров, которые мы видели до сих пор. Например, напряжение, создаваемое окислительно-восстановительной реакцией, можно измерить более точно, используя два электрода, погруженных в один химический стакан, содержащий электролит, который завершает цепь. Такое расположение уменьшает ошибки, вызванные сопротивлением потоку заряда на границе, называемой потенциал перехода . Один пример гальванического элемента такого типа:
\ [\ ce {Pt (s) \, | \, h3 (г) | HCl (aq) \, | \, AgCl (s) \, Ag (s)} \ label {20.+ _ {(aq)}} \ label {20.3.8} \]
Гальванический элемент с одним отсеком первоначально будет иметь то же напряжение, что и гальванический элемент, сконструированный с использованием отдельных отсеков, но он будет быстро разряжаться из-за прямой реакции реагента на аноде с окисленным элементом катодной окислительно-восстановительной пары. Следовательно, ячейки этого типа не особенно полезны для производства электроэнергии.
Пример \ (\ PageIndex {2} \)
Нарисуйте диаграмму ячейки для гальванической ячейки, описанной в Примере \ (\ PageIndex {1} \).{2 +} (aq) + 2NO (g) + 4h3O (l)} \ nonumber \]
Дано: гальванический элемент и окислительно-восстановительная реакция
Запрошено: сотовая диаграмма
Стратегия:
Используя описанные символы, напишите клеточную диаграмму, начиная с полуреакции окисления слева.
Решение
Анод — это оловянная полоса, а катод — это \ (\ ce {Pt} \) электрод. Начиная слева с анодом, мы обозначаем фазовую границу между электродом и раствором олова вертикальной чертой.{-}} \)) не участвует в общей реакции, поэтому указывать ее не нужно. Катодное отделение содержит водную азотную кислоту, которая участвует в общей реакции, вместе с продуктом реакции (\ (\ ce {NO} \)) и электродом \ (\ ce {Pt} \). Они записываются как \ (\ ce {HNO3 (aq) ∣NO (g) ∣Pt (s)} \), с одиночными вертикальными полосами, обозначающими границы фаз. Объединяя два отсека и используя двойную вертикальную черту, чтобы указать солевой мост,
\ [\ ce {Sn (s) \, | \, Sn ^ {2 +} (aq) \, || \, HNO3 (aq) \, | \, NO (g) \, | \, Pt_ ( s)} \ nonumber \]
Концентрации раствора не были указаны, поэтому они не включены в эту диаграмму ячейки.+ (aq, \; 1 \; M) \, | \, Ag (s)} \ nonumber \]
Резюме
Гальванический (гальванический) элемент использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции, для выработки электричества, тогда как электролитический элемент потребляет электрическую энергию от внешнего источника, чтобы вызвать реакцию. Электрохимия — это изучение связи между электричеством и химическими реакциями. Реакция окисления-восстановления, которая происходит во время электрохимического процесса, состоит из двух полуреакций, одна представляет процесс окисления, а другая — процесс восстановления.Сумма полуреакций дает общую химическую реакцию. Общая окислительно-восстановительная реакция сбалансирована, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Электрический ток вырабатывается из потока электронов от восстановителя к окислителю. Электрохимическая ячейка может либо вырабатывать электроэнергию из спонтанной окислительно-восстановительной реакции, либо потреблять электроэнергию, чтобы инициировать непредвиденную реакцию. В гальванической (гальванической) ячейке энергия от спонтанной реакции генерирует электричество, тогда как в электролитической ячейке электрическая энергия потребляется, чтобы привести в неосновную окислительно-восстановительную реакцию.Оба типа ячеек используют два электрода, которые обеспечивают электрическое соединение между системами, которые разделены в пространстве. Окислительная полуреакция происходит на аноде, а восстановительная полуреакция происходит на катоде. Солевой мостик соединяет разделенные растворы, позволяя ионам мигрировать в любой раствор, чтобы обеспечить электрическую нейтральность системы. Вольтметр — это устройство, которое измеряет поток электрического тока между двумя половинными реакциями. Потенциал ячейки, измеряемый в вольтах, представляет собой энергию, необходимую для перемещения заряженной частицы в электрическом поле.Электрохимическая ячейка может быть описана с использованием линейной записи, называемой диаграммой ячейки, на которой вертикальные линии обозначают фазовые границы и местоположение солевого мостика. Сопротивление потоку заряда на границе называется потенциалом перехода.
,16,2: гальванические элементы и электроды
Физически невозможно измерить разность потенциалов между куском металла и раствором, в который он погружен. Однако мы можем измерить разницу между потенциалами двух электродов, которые погружаются в одно и то же решение или, что более полезно, находятся в двух разных решениях. В последнем случае каждая пара электрод-раствор составляет половину ячейки окисления-восстановления , и мы измеряем сумму двух потенциалов половинной ячейки .
Это устройство называется гальваническим элементом . Типичная ячейка может состоять из двух кусков металла, одного цинка и другой меди, каждый погруженный в раствор, содержащий растворенную соль соответствующего металла. Два раствора разделены пористым барьером, который препятствует их быстрому смешиванию, но позволяет ионам проходить сквозь них.
Если мы соединим цинк и медь с помощью металлического проводника, избыточные электроны, которые остаются, когда ионы Zn 2 + выходят из цинка в левой ячейке, могли бы течь через внешнюю цепь и в правую Электрод, где они могли бы быть доставлены к Cu 2 + ионы, которые становятся «разряженными», то есть превращаются в атомы Cu на поверхности медного электрода.{2+} + Cu _ {(s)} \]
, но на этот раз стадии окисления и восстановления (полуреакции) происходят в разных местах:
левый электрод: | Zn (s) → Zn 2 + + 2 e — | окисления |
правый электрод: | Cu 2 + + 2 e — → Cu (s) | сокращение |
Электрохимические элементы позволяют измерять и контролировать окислительно-восстановительную реакцию
Реакцию можно запустить и остановить, подключив или отключив два электрода.Если мы поместим переменное сопротивление в цепь, мы даже сможем контролировать скорость реакции чистой ячейки, просто поворачивая ручку. Подключив батарею или другой источник тока к двум электродам, мы можем заставить реакцию протекать в ее самопроизвольном или обратном направлении. Поместив амперметр во внешнюю цепь, мы можем измерить количество электрического заряда, который проходит через электроды, и, таким образом, количество молей реагентов, которые превращаются в продукты в реакции клетки.
Электрический заряд q измеряется в кулонах. Количество заряда, переносимого одним молем электронов, известно как Фарадея , который мы обозначаем как F . Тщательные эксперименты определили, что 1 F = 96467 C. Для большинства целей вы можете просто использовать 96 500 Кулонов в качестве значения Фарадея. Когда мы измеряем электрический ток, мы измеряем скорость, с которой электрический заряд передается по цепи. Ток в один ампер соответствует потоку в один кулон в секунду.
Транспорт заряда в ячейке
Для работы элемента не только должна быть внешняя электрическая цепь между двумя электродами, но и два электролита (растворы) должны находиться в контакте. Необходимость в этом можно понять, рассмотрев, что произойдет, если два решения будут физически разделены. Положительный заряд (в виде Zn 2 + ) добавляется к электролиту в левом отсеке и удаляется (как Cu 2 + ) с правой стороны, вызывая контакт раствора с цинком получить чистый положительный заряд, в то время как чистый раствор будет накапливаться в растворе на медной стороне ячейки.Эти нарушения электронейтральности усложнили бы (потребовали больше работы) введение дополнительных ионов Zn 2 + в положительно заряженный электролит или для потока электронов в правый отсек, где они необходимы для уменьшения Cu 2 + ионов, таким образом, эффективно останавливая реакцию только после того, как химически незначительное количество имело место.
Чтобы поддерживать клеточную реакцию, заряд, переносимый электронами через внешнюю цепь, должен сопровождаться компенсирующим переносом ионов между двумя ячейками.Это означает, что мы должны обеспечить путь для перемещения ионов непосредственно из одной клетки в другую. Этот ионный транспорт включает не только электроактивные частицы Cu 2 + и Zn 2 + , но также противоионы , которые в этом примере являются нитратами, NO 3 — . Таким образом, избыток Cu 2 + в левом отсеке может быть уменьшен за счет дрейфа этих ионов в правую сторону или в равной степени за счет диффузии нитрат-ионов влево.Более подробные исследования показывают, что оба процесса происходят, и что относительные количества заряда, переносимого через раствор положительными и отрицательными ионами, зависят от их относительной подвижности , которая выражает скорость, с которой ионы способны пробиваться через раствор , Поскольку отрицательные ионы имеют тенденцию быть больше, чем положительные ионы, последние, как правило, имеют более высокие подвижности и несут большую долю заряда.
В простейших ячейках барьер между двумя растворами может представлять собой пористую мембрану, но для точных измерений используется более сложное устройство, известное как солевой мостик .Солевой мостик состоит из промежуточного отсека, заполненного концентрированным раствором KCl и снабженного пористыми барьерами на каждом конце. Цель солевого моста — минимизировать естественную разность потенциалов, известную как потенциал соединения , которая развивается (как упомянуто в предыдущем разделе), когда любые две фазы (такие как два раствора) находятся в контакте. Эта разность потенциалов будет сочетаться с двумя полуэлементными потенциалами, что приведет к некоторой неопределенности при любом измерении потенциала ячейки.С солевой мостик у нас есть два потенциала жидкого перехода вместо одного, но они имеют тенденцию взаимно компенсировать друг друга.
Условные обозначения соты
Чтобы упростить описание данной электрохимической ячейки, была принята специальная символическая запись. В этой записи ячейка, которую мы описали выше, будет
Zn (s) | Zn 2 + (aq) || Cu 2 + (aq) | Cu (s)
Существует несколько других соглашений, касающихся обозначения ячеек и номенклатуры, которые вы должны знать:
- На аноде происходит окисление, а на катоде происходит восстановление.В реальной ячейке идентичность электродов зависит от направления, в котором происходит чистая реакция ячейки.
- Если электроны текут от левого электрода к правому электроду (как изображено в приведенном выше обозначении ячейки), когда ячейка работает в своем спонтанном направлении, потенциал правого электрода будет выше, чем у левого, и потенциал ячейки будет будь позитивным.
- «Обычный ток» от положительного к отрицательному, который противоположен направлению потока электронов.Это означает, что если электроны текут от левого электрода вправо, гальванометр, помещенный во внешнюю цепь, будет показывать ток, протекающий справа налево.
Электроды и электродные реакции
Реакция электрода относится к чистому процессу окисления или восстановления, который происходит на электроде. Эта реакция может происходить на одной стадии переноса электрона или в виде последовательности двух или более стадий. Вещества, которые получают и теряют электроны, называются электроактивными веществами.
Рис. 4: Перенос электрона на анодеЭтот процесс происходит в очень тонкой межфазной области на поверхности электрода и включает в себя квантово-механическое туннелирование электронов между электродом и электроактивными веществами. Работа, необходимая для смещения молекул H 2 O в сферах гидратации ионов, составляет часть энергии активации процесса.
В примере ячейки Zn / Cu, которую мы использовали, электродная реакция включает металл и его гидратированный катион; мы называем такие электроды металл-металлические ионные электроды.{3} + \). Если ни один из электроактивных частиц не является металлом, какой-то другой металл должен служить в качестве канала для подачи или удаления электронов из системы. Чтобы избежать осложнений, которые могут возникнуть в результате электродных реакций с участием этого металла, обычно используется относительно инертное вещество, такое как платина. Такая половина ячейки будет представлена как
Pt (s) | Fe 3 + (aq) , Fe 2 + (aq) || …
и полуклеточная реакция будет
\ [Fe ^ {2 +} (aq) \ rightarrow Fe ^ {3+} (aq) + e ^ — \]
Реакция происходит на поверхности электрода (рис. 4 выше).Электроактивный ион диффундирует к поверхности электрода и адсорбируется (присоединяется) к нему под действием ван-дер-ваальсовых и кулоновских сил. При этом воды гидратации, которые обычно присоединяются к любому ионному виду, должны быть вытеснены. Этот процесс всегда является эндотермическим, иногда до такой степени, что только небольшая часть ионов может достаточно близко контактировать с поверхностью, чтобы подвергнуться переносу электрона, и реакция будет медленной. Фактический перенос электрона происходит путем квантово-механического туннелирования.- (aq) | AgCl (s) | Ag (s) \]
Хотя полезность такого электрода может быть не сразу очевидна, этот тип электрода находит очень широкое применение в электрохимических измерениях, как мы увидим позже.
электродов сравнения
В большинстве электрохимических экспериментов наш интерес сосредоточен только на одной из электродных реакций. Поскольку все измерения должны проводиться на полной ячейке с участием двух электродных систем, обычной практикой является использование электрода сравнения в качестве другой половины ячейки.Основные требования к электроду сравнения: его легко готовить и обслуживать, а его потенциал должен быть стабильным. Последнее требование по существу означает, что концентрация любых ионных частиц, участвующих в электродной реакции, должна поддерживаться на фиксированном уровне. Наиболее распространенным способом достижения этого является использование электродной реакции с участием насыщенного раствора нерастворимой соли иона. Одна такая система, серебряно-серебряный хлоридный электрод, уже упоминалась:
\ [Ag | AgCl (s) | Cl ^ — (aq) || ,- \]
Этот электрод обычно принимает форму куска серебряной проволоки, покрытой AgCl. Покрытие делается путем превращения серебра в анод в электролизере, содержащем HCl; ионы Ag + соединяются с ионами Cl — так же быстро, как они образуются на поверхности серебра.
Другим распространенным электродом сравнения является каломельный электрод ; каломель — это общее название хлорида ртути (I). Такая половина ячейки будет представлена как
\ [Hg | Hg ^ {2 +} (aq) | KCl || ,- \]
Потенциалы обоих электродов были очень точно определены относительно водородного электрода. Последний редко используется в рутинных электрохимических измерениях, потому что его сложнее приготовить; поверхность платины должна быть специально обработана предварительным электролизом. Кроме того, существует потребность в подаче газообразного водорода, что делает его несколько громоздким и опасным.
Резюме и дополнительные примечания
Убедитесь, что вы хорошо понимаете следующие основные идеи, которые были представлены выше.Особенно важно, чтобы вы знали точные значения всех выделенных терминов в контексте этой темы.
- Гальваническая ячейка (иногда более уместно называемая — ячейка ) состоит из двух полуклеток , соединенных солевым мостиком или каким-либо другим путем, который позволяет ионам проходить между двумя сторонами для поддержания . электронейтральность .
- Традиционный способ представления электрохимической ячейки любого вида состоит в том, чтобы записать половинную реакцию окисления слева и восстановление справа.Таким образом, для реакции
Zn (s) + Cu 2 + → Zn 2 + + Cu (s)
пишем
Zn (s) | Zn 2 + (aq) || Cu 2 + (aq) | Cu (s)
, в которой одиночные вертикальные полосы представляют фазовых границ . Двойная черта обозначает границу жидкость-жидкость , которая в лабораторных ячейках состоит из солевого мостика или ионопроницаемого барьера.Если бы чистая клеточная реакция была написана в обратном порядке, клеточная нотация стала бы
Cu (s) | Cu 2 + (aq) || Zn 2+ (aq) | Zn (s)
Помните: процесс R всегда отображается на R ight .
- на поверхности электрода. Энергия, необходимая для вытеснения молекул воды из гидратной оболочки иона при его приближении к поверхности электрода, составляет энергии активации , которая может замедлить процесс.Еще большие энергии активации (и более медленные реакции) происходят, когда молекула, такая как O 2, образуется или потребляется.
Поскольку гальванические элементы могут быть автономными и портативными, их можно использовать в качестве батарей и топливных элементов. Аккумулятор (аккумулятор) представляет собой гальванический элемент (или ряд гальванических элементов), который содержит все реагенты, необходимые для производства электроэнергии. Напротив, топливный элемент представляет собой гальванический элемент, для которого требуется постоянное внешнее питание одного или нескольких реагентов для выработки электроэнергии. В этом разделе мы опишем химию, стоящую за некоторыми из наиболее распространенных типов батарей и топливных элементов.
Аккумуляторы
Существует два основных типа батарей: одноразовые или первичные батареи, в которых электродные реакции эффективно необратимы и которые невозможно перезарядить; и перезаряжаемые или вторичные батареи, которые образуют нерастворимый продукт, который прилипает к электродам. Эти батареи можно заряжать, применяя электрический потенциал в обратном направлении. Процесс перезарядки временно преобразует аккумуляторную батарею из гальванического элемента в электролизер.
Батареи— это продуманные устройства, основанные на тех же фундаментальных законах, что и гальванические элементы. Основное различие между батареями и гальваническими элементами, которые мы описали ранее, состоит в том, что коммерческие батареи используют твердые вещества или пасты, а не растворы в качестве реагентов для максимизации электрической мощности на единицу массы. Использование высококонцентрированных или твердых реагентов имеет другой полезный эффект: концентрации реагентов и продуктов не сильно изменяются при разрядке батареи; следовательно, выходное напряжение остается удивительно постоянным во время процесса разряда.Это поведение отличается от поведения ячейки Zn / Cu, выход которой логарифмически уменьшается по мере протекания реакции (рис. \ (\ PageIndex {1} \)). Когда батарея состоит из более чем одного гальванического элемента, элементы обычно соединяются последовательно, то есть с положительным (+) выводом одного элемента, соединенным с отрицательным (-) выводом следующего, и так далее. Таким образом, общее напряжение батареи является суммой напряжений отдельных элементов.
Рисунок \ (\ PageIndex {1} \): три вида первичных (не перезаряжаемых) батарей.(a) Сухой элемент Лекланше на самом деле представляет собой «влажный элемент», в котором электролит представляет собой кислую пасту на водной основе, содержащую MnO 2 , NH 4 Cl, ZnCl 2 , графит и крахмал. Хотя элемент недорогой в изготовлении, он не очень эффективен в производстве электрической энергии и имеет ограниченный срок хранения. (b) В кнопочной батарее анодом является цинк-ртутная амальгама, а катодом может быть либо HgO (показан здесь), либо Ag 2 O в качестве окислителя. Батареи для кнопок надежны и имеют высокое отношение массы к массе, что позволяет использовать их в таких приложениях, как калькуляторы и часы, где их небольшой размер имеет решающее значение.(c) Литий-йодная батарея состоит из двух элементов, разделенных металлической никелевой сеткой, которая собирает заряд от анодов. Анод — металлический литий, а катод — твердый комплекс I 2 . Электролит представляет собой слой твердого LiI, который позволяет ионам Li + диффундировать от катода к аноду. Хотя этот тип батареи вырабатывает только относительно небольшой ток, он очень надежен и долговечен.Основное различие между батареями и гальваническими элементами состоит в том, что коммерческие батареи обычно используют твердые вещества или пасты, а не растворы в качестве реагентов для максимизации электрической мощности на единицу массы.Очевидным исключением является стандартная автомобильная аккумуляторная батарея, в которой используется химия фаз раствора.
Leclanché Dry Cell
Сухой элемент, безусловно, самый распространенный тип батареи, используется в фонарях, электронных устройствах, таких как Walkman и Game Boy, и многих других устройствах. Хотя сухой элемент был запатентован в 1866 году французским химиком Жоржем Лекланше, и каждый год продается более 5 миллиардов таких элементов, детали химии электродов до сих пор не до конца понятны.- \) ионы присутствуют в растворе, поэтому общая клеточная реакция выглядит следующим образом:
\ [2MnO_ {2 (s)} + 2NH_4Cl _ {(aq)} + Zn _ {(s)} \ rightarrow Mn_2O_ {3 (s)} + Zn (NH_3) _2Cl_ {2 (s)} + H_2O _ {(l )} \ label {Eq3} \]
Сухой элемент вырабатывает около 1,55 В и недорог в изготовлении. Это, однако, не очень эффективно при производстве электрической энергии, потому что только относительно небольшая доля \ (MnO_2 \), находящаяся рядом с катодом, фактически уменьшается, и только небольшая доля цинкового катода фактически расходуется при разрядке элемента.Кроме того, сухие элементы имеют ограниченный срок годности, поскольку анод \ (Zn \) самопроизвольно реагирует с \ (NH_4Cl \) в электролите, вызывая коррозию корпуса и позволяя содержимому вытекать.
Источник: Фото любезно предоставлено Mitchclanky2008, www.flickr.com/photos/25597837@N05/2422765479/.Щелочная батарея — это, по сути, элемент Leclanché, приспособленный для работы в щелочных или основных условиях. Половинные реакции, которые происходят в щелочной батарее, следующие:
\ [2MnO_ {2 (s)} + H_2O _ {(l)} + 2e ^ — \ rightarrow Mn_2O_ {3 (s)} + 2OH ^ −_ {(aq)} \ label {Eq4} \]
\ [Zn _ {(s)} + 2OH ^ −_ {(aq)} \ rightarrow ZnO _ {(s)} + H_2O _ {(l)} + 2e ^ — \ label {Eq5} \]
\ [Zn _ {(s)} + 2MnO_ {2 (s)} \ rightarrow ZnO _ {(s)} + Mn_2O_ {3 (s)} \ label {Eq6} \]
Эта батарея также производит около 1.5 В, но он имеет более длительный срок хранения и более постоянное выходное напряжение, поскольку элемент разряжается, чем сухой элемент Leclanché. Хотя щелочная батарея более дорогая в производстве, чем сухая батарея Leclanché, улучшенная производительность делает эту батарею более рентабельной.Батареи для пуговиц
Хотя некоторые маленькие батарейки, используемые для питания часов, калькуляторов и камер, представляют собой миниатюрные щелочные элементы, большинство из них основаны на совершенно другом химическом составе. В этих «кнопочных» батареях анод представляет собой цинк-ртутную амальгаму, а не чистый цинк, и катод использует либо \ (HgO \), либо \ (Ag_2O \) в качестве окислителя, а не \ (MnO_2 \) (часть (b) ) на рисунке \ (\ PageIndex {1} \)).−_ {(aq)} \ label {Eq9} \]
\ [Zn _ {(s)} + 2Ag_2O _ {(s)} \ rightarrow 2Ag _ {(s)} + ZnO _ {(s)} \ label {Eq10} \]
с \ (E_ {cell} = 1.6 \, V \)
Основными преимуществами ртутных и серебряных ячеек являются их надежность и их высокое отношение массы к массе. Эти факторы делают их идеальными для приложений, где малый размер имеет решающее значение, таких как камеры и слуховые аппараты. Недостатками являются стоимость и экологические проблемы, вызванные утилизацией тяжелых металлов, таких как \ (Hg \) и \ (Ag \).
Литий-йодная батарея
Ни одна из батарей, описанных выше, не является «сухой». Все они содержат небольшое количество жидкой воды, которая добавляет значительную массу и вызывает потенциальные проблемы коррозии. Следовательно, значительные усилия были потрачены на разработку безводных батарей. Одной из немногих успешных безводных батарей является литий-йодная батарея . Анод — металлический литий, а катод — твердый комплекс из \ (I_2 \). Их разделяет слой твердого вещества \ (LiI \), который действует как электролит, позволяя диффузии ионов Li + .- \ label {Eq12} \]
\ [2Li _ {(s)} + I_ {2 (s)} \ rightarrow 2LiI _ {(s)} \ label {Eq12a} \]
с \ (E_ {ячейка} = 3,5 \, V \)
Кардиостимулятор: рентгеновское изображение пациента, показывающее расположение и размеры кардиостимулятора, работающего от литий-йодной батареи.Как показано в части (c) на рисунке \ (\ PageIndex {1} \), типичная литий-йодная батарея состоит из двух элементов, разделенных сеткой из никелевого металла, которая собирает заряд от анода. Из-за высокого внутреннего сопротивления, вызванного твердым электролитом, может потребляться только низкий ток.Тем не менее, такие батареи оказались долговечными (до 10 лет) и надежными. Поэтому они используются в приложениях, где частая замена затруднена или нежелательна, например, в кардиостимуляторах и других медицинских имплантатах, а также в компьютерах для защиты памяти. Эти батареи также используются в охранных передатчиках и дымовой сигнализации. Другие батареи на основе литиевых анодов и твердых электролитов находятся в стадии разработки, используя \ (TiS_2 \), например, для катода.
Сухие элементы, кнопочные батареи и литиево-йодные батареи являются одноразовыми и не могут заряжаться после их разрядки.Аккумуляторы, напротив, обладают значительными экономическими и экологическими преимуществами, поскольку их можно заряжать и разряжать много раз. В результате затраты на производство и утилизацию резко снижаются при заданном количестве часов использования батареи. Две распространенные аккумуляторные батареи — никель-кадмиевая и свинцово-кислотная, о которых мы расскажем далее.
никель-кадмиевая (NiCad) батарея
Никель-кадмиевая батарея или NiCad используется в небольших электрических приборах и устройствах, таких как дрели, портативные пылесосы и цифровые тюнеры AM / FM.Это элемент на водной основе с кадмиевым анодом и сильно окисленным никелевым катодом, который обычно называют оксогидроксидом никеля (III), NiO (OH). Как показано на рисунке \ (\ PageIndex {2} \), конструкция максимизирует площадь поверхности электродов и минимизирует расстояние между ними, что уменьшает внутреннее сопротивление и делает возможным довольно высокий ток разряда.
Рисунок \ (\ PageIndex {2} \): Никель-кадмиевая (NiCad) батарея, аккумуляторная батарея. NiCad батареи содержат кадмиевый анод и сильно окисленный никелевый катод.- \ label {Eq14} \]\ [Cd _ {(s)} + 2NiO (OH) _ {(s)} + 2H_2O _ {(l)} \ правая стрелка Cd (OH) _ {2 (s)} + 2Ni (OH) _ {2 (с) )} \ label {Eq15} \]
\ (E_ {cell} = 1,4 В \)
Поскольку продукты полуреакций разряда являются твердыми веществами, которые прилипают к электродам [Cd (OH) 2 и 2Ni (OH) 2 ], общая реакция легко переворачивается, когда элемент перезаряжается. Несмотря на то, что никель-кадмиевые батареи имеют малый вес, заряжаются и имеют большую емкость, они имеют определенные недостатки.Например, они имеют тенденцию быстро терять емкость, если им не дают полностью разрядиться перед зарядкой, они плохо хранятся в течение длительных периодов времени при полной зарядке и представляют значительные проблемы для окружающей среды и утилизации из-за токсичности кадмия.
Разновидностью никель-кадмиевой батареи является никель-металлогидридная батарея (NiMH), используемая в гибридных автомобилях, устройствах беспроводной связи и мобильных вычислениях. Общее химическое уравнение для этого типа батареи выглядит следующим образом:
\ [NiO (OH) _ {(s)} + MH \ rightarrow Ni (OH) _ {2 (s)} + M _ {(s)} \ label {Eq16} \]
Емкость никель-металлогидридной батареи увеличена на 30–40% по сравнению с никель-кадмиевой батареей; он более экологичен, поэтому хранение, транспортировка и утилизация не подлежат контролю окружающей среды; и он не так чувствителен к перезарядке памяти.Тем не менее, он подвержен на 50% большей скорости саморазряда, ограниченному сроку службы и более высокому обслуживанию, и он дороже, чем никель-кадмиевая батарея.
Директива Европейского Союза 2006/66 / EC запрещает размещение на рынке портативных батарей, содержащих более 0,002% кадмия по весу. Целью этой директивы было улучшение «экологических характеристик аккумуляторов и аккумуляторов»
Свинцово-кислотный аккумулятор (свинцовый аккумулятор)
Свинцово-кислотный аккумулятор используется для обеспечения пусковой мощности практически каждого автомобильного и морского двигателя на рынке.Морские и автомобильные аккумуляторы обычно состоят из нескольких элементов, соединенных последовательно. Общее напряжение, генерируемое аккумулятором, представляет собой потенциал на элемент (E ° , элемент ), умноженный на количество элементов.
Рисунок \ (\ PageIndex {3} \): одна ячейка свинцово-кислотной батареи. Аноды в каждой ячейке перезаряжаемой батареи представляют собой пластины или сетки из свинца, содержащие губчатый металлический свинец, тогда как катоды представляют собой аналогичные сетки, содержащие порошкообразный диоксид свинца (PbO 2 ). Электролит представляет собой водный раствор серной кислоты.Значение E ° для такого элемента составляет около 2 В. При последовательном соединении трех таких элементов получается батарея 6 В, тогда как типовая автомобильная батарея 12 В содержит шесть элементов последовательно. При правильном обращении этот тип аккумулятора большой емкости можно разряжать и заряжать много раз.Как показано на рисунке \ (\ PageIndex {3} \), анод каждой ячейки в свинцовой аккумуляторной батарее представляет собой пластину или решетку из губчатого металлического свинца, а катод представляет собой аналогичную решетку, содержащую порошкообразный диоксид свинца (\ (PbO_2 \)). Электролит обычно представляет собой приблизительно 37% раствор (по массе) серной кислоты в воде с плотностью 1.° _ {cath
.Гальваническая коррозия — NACE
Гальваническая Коррозия
Гальваническая коррозия (также называемая «коррозия разнородного металла» или ошибочно «электролиз») относится к коррозионному повреждению, вызванному соединением двух разнородных материалов в коррозийный электролит. Это происходит, когда два (или более) разнородных металла приводятся в электрический контакт под водой. Когда образуется гальваническая пара, один из металлов в паре становится анодом и корродирует быстрее, чем сам по себе, а другой становится катодом и корродирует медленнее, чем один.

Любой (или оба) металла в паре могут или не могут разъедать сами по себе. Однако при контакте с разнородным металлом скорость самокоррозии изменится:
Коррозия анода ускорится Коррозия катода замедлится или даже остановится. Гальваническая муфта является основой многих методов контроля коррозии
Движущей силой коррозии является разность потенциалов между различными материалами. Биметаллическая движущая сила была открыта в конце восемнадцатого века Луиджи Гальвани в серии экспериментов с открытыми мышцами и нервами лягушки, которая сокращалась при подключении к биметаллическому проводнику.Позднее этот принцип был применен на практике Алессандро Вольта, который в 1800 году построил первый электрический элемент или батарею: серию металлических дисков двух видов, разделенных картонными дисками, пропитанными растворами кислот или солей. Это основа всех современных аккумуляторных батарей с мокрыми элементами, и это было чрезвычайно важное научное открытие, потому что это был первый метод, который был найден для генерации постоянного электрического тока.
Сэр Хэмфри Дэви и Майкл Фарадей в начале девятнадцатого века также применили этот принцип для полезной защиты металлических конструкций.Жертвенная коррозия одного металла, такого как цинк, магний или алюминий, является широко распространенным методом катодной защиты металлических конструкций.
В биметаллической паре менее благородный материал станет анодом этой коррозионной ячейки и имеет тенденцию к коррозии с ускоренной скоростью по сравнению с несвязанным состоянием. Более благородный материал будет действовать как катод в коррозионной ячейке. Гальваническая коррозия может быть одной из самых распространенных форм коррозии, а также одной из самых разрушительных.
Следующие примеры иллюстрируют этот тип атаки.
Гальваническая коррозия: нержавеющий винт v шайба из кадмированной стали Гальваническая коррозия внутри горизонтального стабилизатора Гальваническая коррозия Статуи Свободы Контргайка с кадмиевым покрытием.
Относительное благородство материала можно предсказать, измерив его коррозионный потенциал. Хорошо известная гальваническая серия перечисляет относительное благородство определенных материалов в морской воде. Небольшое отношение площади анода к катоду крайне нежелательно.В этом случае гальванический ток концентрируется на небольшой анодной области. Быстрая потеря толщины растворяющего анода имеет тенденцию происходить в этих условиях. Проблемы гальванической коррозии должны быть решены путем проектирования, чтобы избежать этих проблем в первую очередь. Ячейки гальванической коррозии могут быть установлены на макроскопическом уровне или на микроскопическом уровне. На микроструктурном уровне различные фазы или другие микроструктурные особенности могут быть подвержены гальваническим токам

